1
Tuberkulosis (TB) masih merupakan masalah kesehatan utama di dunia. Dari populasi di berbagai negara Asia dan Afrika yang melakukan tes tuberkulin sekitar 80% dinyatakan positif, namun pada populasi di Amerika Serikat menunjukkan hanya 5-10% saja yang dinyatakan positif. Masyrakat di negara berkembang banyak yang terserang TB disebabkan oleh lemahnya kekebalan tubuh, biasanya akibat terinfeksi virus HIV dan berkembang menjadi AIDS (Kumar dkk., 2010; Lawn, 2011).
Indonesia berada pada peringkat keempat di dunia dengan kasus TB terbanyak setelah India, Cina, dan Afrika Selatan. Diperkirakan jumlah pasien TB di Indonesia sekitar 10% dari total jumlah pasien TB di dunia. Kasus baru TB di Indonesia dilaporkan bertambah sekitar seperempat juta per tahun. Dengan angka kematian mencapai 91.000 orang setiap tahunnya (Depkes, 2007; WHO, 2013).
World Health Organization (WHO) dan International Union Against Tuberculosis and Lung Disease (IUATLD) telah merekomendasikan pengobatan
TB menggunakan rifampisin, isoniazid, pirazinamid, dan etambutol dengan dosis tunggal maupun secara kombinasi (WHO, 2006).
Dalam upaya untuk memantau efektifitas pengobatan TB diperlukan pemeriksaan kadar obat dalam darah yang biasanya disebut dengan Therapeutic
antituberkulosis. Studi farmakokinetik sangat berguna tertutama untuk penentuan aturan dosis dan melihat nasib obat dalam tubuh. Oleh karena itu, diperlukan uji farmakokinetik sebagai salah satu sumber indikasi untuk mendapatkan terapi dengan obat-obat antituberkulosis yang tepat indikasi, tepat penderita dan tepat regimen dosis (Depkes, 2005; Santoso, 1985).
Studi farmakokinetika dapat dilakukan dengan metode konvensional dan dapat pula menggunakan pendekatan modeling berbasis populasi yang telah lazim digunakan di berbagai negara maju. Pendekatan modeling kompartemen dengan analisis berbasis populasi menawarkan suatu sistem yang relatif lebih murah, mudah, dan memberikan informasi komprehensif karena dapat memberikan informasi terkait parameter populasi yang lebih mewakili data sebenarnya. Kepraktisan pendekatan modeling berbasis populasi adalah difokuskannya analisis terhadap populasi subyek secara keseluruhan dan bukan lagi pada subyek per individu. Konsekuensi hal ini adalah kelengkapan pengambilan informasi terkait kinetika absorpsi, eliminasi dan atau distribusi tidak harus diperoleh dari setiap individual subyek, namun dikontribusikan oleh keseluruhan subyek yang terlibat sebagai populasi (Mould dan Upton, 2012; Sheiner dkk, 1972).
Dengan berbagai kepraktisan yang diberikan menggunakan analisis berbasis populasi maka perlu dilakukan penelitian farmakokinetika pada obat-obat antituberkulosis menggunakan analisis berbasis populasi. Rifampisin menjadi salah satu obat lini pertama pada penanganan tuberkulosis. Untuk melihat keunggulan perhitungan menggunakan analisis berbasis populasi profil kadar rifampisin dalam plasma dan parameter farmakokinetika rifampisin dengan bahan
pengisi maka diperlukan penelitian farmakokinetika rifampisin menggunakan beberapa model analisis pada subjek uji tikus putih galur Wistar setelah pemberian suspensi tablet secara oral dengan bahan pengisi yang umum digunakan dalam formulasi, salah satunya ialah laktosa. Laktosa dipilih pada penelitian ini karena memberikan sifat alir yang cukup baik, mudah di dapatkan, dan murah. Dalam penelitian ini, digunakan tiga model analisis yaitu PK Solver, WinSAAM, dan Monolix.
B. Perumusan Masalah
Berdasarkan latar belakang yang telah diuraikan di atas, maka dapat dirumuskan permasalahan sebagai berikut:
1. Bagaimanakah profil kadar rifampisin dalam plasma terhadap waktu pada tikus Wistar setelah pemberian tablet dengan bahan pengisi laktosa menggunakan
PK Solver, WinSAAM, dan Monolix?
2. Berapakah nilai parameter farmakokinetika rifampisin pada tikus Wistar setelah pemberian tablet dengan bahan pengisi laktosa jika dihitung menggunakan
PK Solver, WinSAAM, dan Monolix?
C. Tujuan Penelitian Penelitian ini bertujuan untuk:
1. Untuk mengetahui profil kadar rifampisin dalam plasma terhadap waktu pada tikus Wistar setelah pemberian oral dengan bahan pengisi laktosa menggunakan PK Solver, WinSAAM, dan Monolix.
2. Untuk mengetahui nilai parameter farmakokinetika rifampisin pada tikus Wistar setelah pemberian oral dengan bahan pengisi laktosa jika dihitung menggunakan PK Solver, WinSAAM, dan Monolix.
D. Manfaat Penelitian
1. Untuk pengembangan ilmu pengetahuan khususnya di bidang farmakokinetika.
2. Untuk diterapkan dalam bidang kesehatan khususnya pada penanggulangan lebih lanjut penyakit tuberkulosis.
3. Untuk pembelajaran dan pengalaman peneliti dalam bidang ilmu yang digeluti.
E. TINJAUAN PUSTAKA I. Tuberkulosis
Tuberkulosis merupakan penyakit menular yang disebabkan oleh kuman tuberculosis (Mycobacterium tuberculosis) yang ditularkan melalui udara saat seorang pasien tuberkulosis batuk dan percikan ludah yang mengandung bakteri tersebut terhirup oleh orang lain saat bernapas (Widoyono, 2008).
Pengobatan TB diberikan dalam 2 tahap yaitu, tahap awal (intensif) selama 2-3 bulan. Pada tahap intensif pasien mendapat obat setiap hari dan perlu diawasi secara langsung untuk mencegah terjadinya resistensi obat. Bila pengobatan tahap intensif tersebut diberikan secara tepat, biasanya pasien menular menjadi tidak menular dalam kurun waktu 2 minggu.
Tahap lanjutan selama 4-7 bulan. Pada tahap lanjutan, pasien mendapat jenis obat yang lebih sedikit dan diminum 3 kali seminggu namun dalam jangka waktu yang lama. Tahap lanjutan ini penting untuk mencegah kekambuhan. Banyak kombinasi obat anti TB (OAT) yang bisa dipakai dimana masa pengobatannya minimal 6 bulan. Kemasan OAT antara lain:
a) Obat tunggal yaitu obat disajikan secara terpisah, masing-masing INH,rifampisin, pirazinamid, dan etambutol.
b) Obat kombinasi dosis tetap (fixed dose combination) yaitu dalam satu tablet terdiri dari 3 atau 4 obat (Depkes RI, 2004).
II. Model analisis
Dalam penelitian ini, digunakan tiga model analisis yaitu PK Solver, WinSAAM, dan Monolix.
a. PK Solver
PK Solver merupakan menu add-in tambahan pada piranti lunak
Microsoft Excel. Program ini dikembangkan untuk aplikasi analisis data farmakokinetik maupun farmakodinamik, termasuk analisis non kompartemental data plasma setelah pemberian ekstravaskular, injeksi bolus intravena, dan infus intravena, pemodelan data kompartemental, serta pemodelan data farmakodinamik (Zhang dkk, 2010).
Program ini dapat melakukan fitting profil farmakokinetika menggunakan model yang telah disediakan dengan cara yang cepat dan mudah. Untuk memilih model yang sesuai dengan
presisi yang baik dari estimasi parameter, PK Solver menyediakan beberapa model diagnostik seperti koefisien korelasi, jumlah kuadrat residual (SS), standard error dari residual tertimbang (SE), Akaike’s Information
criterion (AIC) dan Schwarz criterion (SC) (Zhang dkk, 2010).
Nilai-nilai parameter farmakokinetika dihitung sesuai model yang dipilih. Sebagai contoh untuk perhitungan nilai parameter menggunakan model non kompartemental, program PK Solver menghitung area dibawah kurva (AUC) menggunakan metode trapezoid (Zhang dkk, 2010).
b. WinSAAM
Software WinSAAM merupakan software yang memungkinkan
untuk melakukan analisis berbasis kompartemen dengan membentuk model matematis dengan data yang diperoleh. Selain kemampuan tersebut WinSAAM memiliki kemampuan lain yaitu 1) kemampuan mensimulasikan sistem 2) fitting model kedalam suatu data 3) dapat mengukur perkiraan parameter yang belum diketahui sebenarnya. (Sulaiman, 2012).
Aplikasi WinSAAM dilakukan dengan tiga langkah, 1) kompilasi model, 2) solusi model dan 3) fitting model. Model kinetika dapat ditentukan dengan pendekatan goodness of fit antara metode visual dan numerik berdasarkan plot Q pengamatan dengan plot P prediksi. Evaluasi hasil fitting dilakukan secara visual dengan overlay scaterred plot. Model memiliki keseuaian apabila Qobs(data penelitian) berhimpit dengan Qpred (berdasarkan model) (Stefanovski dkk., 2003).
c. Monolix
Monolix merupakan salah satu software berbasis populasi. Analisis berbasis populasi adalah suatu metode untuk memodelkan, mengidentifikasi dan menjelaskan hubungan antara karakter fisiologi subyek terhadap pemejanan obat dan atau respon farmakologi yang diamati. Metode ini awalnya dimaksudkan untuk mengatasi permasalahan kesulitan analisis ketika jumlah sample terbatas pada kasus TDM. Pendekatan ini kemudian dikembangkan lebih lanjut dengan menghubungkannya dengan respon farmakodimanika obat yang membuat metode ini menjadi salah satu piranti krusial dalam pengembangan sediaan obat baru (Mould dan Upton, 2012).
Pendekatan analisis berbasis populasi dapat menganalisis data dari berbagai desain penelitian yang tidak seimbang sehingga dapat memberikan informasi mengenai variabilitas interindividual subjek yang mempengaruhi efikasi dan efektifitas penggunaan obat (FDA, 1999).
Implementasi modeling farmakokinetika berbasis populasi dewasa ini sangat terbantu dengan kemajuan teknologi informasi khususnya dalam ketersediaan fasilitas dan dukungan komputasi baik dari sisi hardware maupun
software.
Dengan menggunakan software berbasis populasi bisa didapatkan profil kadar obat dalam darah, serum, ataupun plasma serta parameter-parameter farmakokinetika dengan mudah dan cepat serta hanya memerlukan jumlah sampel yang lebih sedikit, seperti yang umunya dijumpai pada kasus TDM.
III. Farmakokinetika
Farmakokinetika dapat didefinisikan sebagai setiap proses yang dilakukan tubuh terhadap obat, yaitu absorpsi, distribusi, metabolisme dan ekskresi. Dalam arti sempit farmakokinetika khususnya mempelajari perubahan-perubahan konsentrasi dari obat dan metabolitnya didalam darah dan jaringan sebagai fungsi dari waktu (Tjay dan Rahardja, 2002).
1. Absorpsi
Yang dimaksud dengan absorpsi suatu obat ialah pengambilan obat dari permukaan tubuh ke dalam aliran darah atau ke dalam sistem pembuluh limfe. Absorpsi, distribusi dan ekskresi tidak mungkin terjadi tanpa suatu transport melalui membran. Absorpsi kebanyakan obat terjadi secara pasif melalui difusi.
2. Distribusi
Apabila obat mencapai pembuluh darah, obat akan ditransfer lebih lanjut bersama aliran darah dalam sistem sirkulasi. Akibat perubahan konsentrasi darah terhadap jaringan, bahan obat meninggalkan pembuluh darah dan terdistribusi ke dalam jaringan (Mutscler, 1985).
Pada tahap distribusi ini penyebarannya sangat peka terhadap berbagai pengaruh yang terkait dengan tahap penyerapan dan tahap yang terjadi sesudahnya yaitu peniadaan, serta terkait pula dengan komposisi biokimia serta keadaan fisiopatologi subyeknya, disamping itu perlu diingat kemungkinan adanya interaksi dengan molekul lainnya.
3. Metabolisme
Obat yang telah diserap usus ke dalam sirkulasi lalu diangkut melalui sistem pembuluh porta (vena portae), yang merupakan suplai darah utama dari daerah lambung usus ke hati. Dalam hati, seluruh atau sebagian obat mengalami perubahan kimiawi secara enzimatis dan hasil perubahannya (metabolit) menjadi tidak atau kurang aktif, dimana proses ini disebut proses diaktivasi atau bio-inaktivasi (pada obat dinamakan first
pass effect). Tapi adapula obat yang khasiat farmakologinya justru
diperkuat (bio-aktivasi), oleh karenanya reaksi-reaksi metabolisme dalam hati dan beberapa organ lain lebih tepat disebut biotransformasi (Tjay & Rahardja, 2002).
Tipe metabolisme dibedakan menjadi dua bagian yaitu Nonsynthetic
Reactions (Reaksi Fase I) dan Synthetic Reaction (Reaksi Fase II). Reaksi
fase I terdiri dari oksidasi, reduksi, hidrolisa, alkali, dan dealkilasi. Metabolitnya bisa lebih aktif dari senyawa asalnya. Umumnya tidak dieliminasi dari tubuh kecuali dengan adanya metabolisme lebih lanjut. Reaksi faseII berupa konjugasi yaitu penggabungan suatu obat dengan suatu molekul lain. Metabolitnya umumnya lebih larut dalam air dan mudah diekskresikan (Hinz, 2005).
4. Ekskresi
Pengeluaran obat atau metabolitnya dari tubuh terutama dilakukan oleh ginjal melalui air seni disebut ekskresi. Lazimnya tiap obat diekskresi berupa metabolitnya dan hanya sebagian kecil dalam keadaan asli yang
utuh. Tapi adapula beberapa cara lain yaitu melalui kulit bersama keringat, paru-paru melalui pernafasan dan melalui hati dengan empedu (Tjay & Rahardja, 2002).
Turunnya kadar plasma obat dan lama efeknya tergantung pada kecepatan metabolisme dan ekskresi. Kedua faktor ini menentukan kecepatan eliminasi obat yang dinyatakan dengan pengertian plasma half-life eliminasi (waktu paruh) yaitu rentang waktu dimana kadar obat dalam plasma pada fase eliminasi menurun sampai separuhnya. Kecepatan eliminasi obat dan plasma t1/2-nya tergantung dari kecepatan biotransformasi dan ekskresi (Waldon, 2008).
3.1 Parameter Farmakokinetika
Bioavailabilitas dari suatu sediaan obat adalah persentase obat yang secara utuh mencapai sirkulasi umum untuk melakukan kerjanya. Selama proses absorpsi dapat terjadi kehilangan zat aktif akibat tidak dibebaskannya dari sediaan pemberiannya. Atau pula karena penguraian didalam usus atau dindingnya dalam hati salama peredaran pertama disistem porta sebelum tiba diperedaran darah. Karena Firs Pass Effect (FPE) ini, maka bioavailabilitas obat menjadi rendah dari pada persentase yang sebenarnya diabsorpsi (Tjay dan Rahardja, 2002).
Parameter primer meliputi konstanta kecepatan absorpsi (Ka), fraksi obat terabsorbsi (Fa), volume distribusi (Vd), kliren tubuh total (Cl), kliren hepatic (Clh), dan kliren renal (Clr) (Rowland & Tozer, 1989). Parameter sekunder adalah parameter yang nilainya dipengaruhi
oleh parameter primer. Meliputi tetapan kecepatan ekskresi (Kel), waktu paro eliminasi (t1/2), dan fraksi obat utuh yang dieksresi lewat urin (fe). Selain itu, juga terdapat parameter turunan lainnya yaitu luas di bawah kurva kadar obat utuh terhadap waktu pengambilan darah atau
Area Under Curve (AUC), kadar obat keadaan tunak, dan availabilitas
oral atau fraksi obat yang diabsorbsi (F). (Shargel dan Yu, 2005; Rowland & Tozer, 1989). Nilai parameter farmakokinetika yang akan dihitung pada penelitian ini berdasarkan model satu kompartemen ekstravaskuler. Adapun parameter-parameter farmakokinetika dijelaskan lebih lanjut sebagai berikut:
a. T maksimum (tmaks)
Yaitu waktu konsentrasi plasma mencapai puncak dapat disamakan dengan waktu yang diperlukan untuk mencapai konsentrasi obat maksimum setelah pemberian obat. Pada tmaks absorpsi obat adalah terbesar, dan laju absorpsi obat sama dengan laju eliminasi obat. Absorpsi masih berjalan setelah tmakstercapai, tetapi pada laju yang lebih lambat. Harga tmaksmenjadi lebih kecil (berarti sedikit waktu yang diperlukan untuk mencapai konsentrasi plasma puncak) bila laju absorpsi obat menjadi lebih cepat (Shargel dan Yu, 2005).
tmax =
………(1)
b. Konsentrasi plasma puncak (Cmaks)
Menunjukkan konsentrasi obat maksimum dalam plasma setelah pemberian secara oral. Untuk beberapa obat diperoleh suatu hubungan
antara efek farmakologi suatu obat dan konsentrasi obat dalam plasma (Shargel, 2005).
Cmaks = Be-k.tmaks – Ae-ka.tmaks...(2) c. Volume Distribusi(Vd)
Volume Distribusi (Vd) adalah volume yang didapatkan pada saat obat didistribusikan. Menghubungkan jumlah obat dalam tubuh dengan konsentrasi obat (C) dalam darah atau plasma (Holford, 1998).
Vd =
………...(3) d. AUC (Area Under Curve)
AUC adalah permukaan di bawah kurva yang menggambarkan naik turunnya kadar plasma sebagai fungsi dari waktu. AUC dapat dihitung secara matematis dan merupakan ukuran untuk bioavailabilitas suatu obat. AUC dapat digunakan untuk membandingkan kadar masing-masing plasma obat bila penentuan kecepatan eliminasinya tidak bioavailabilitas terdapat hubungan langsung (Waldon, 2008).
AUC0-∞ = ………..……….………(4) e. Tetapan laju absorpsi (Ka) dan waktu paruh absorpsi (t1/2 abs)
Tetapan laju absorpsi (Ka) menggambarkan kecepatan absorpsi, yakni masuknya obat ke dalam sirkulasi sitemik. Nilai ini dapat diperoleh dari nilai slope pada persamaan regresi linier antara waktu absorpsi dengan lnCpr.
Sedangkan waktu paruh absorpsi adalah waktu dimana konsentrasi obat dalam plasma mencapai separuhnya dari nilai absorpsi seharusnya. Nilainya diperoleh dari rumus berikut:
t1/2 abs =
……….…….(5)
f. Tetapan laju eliminasi (Kel) dan waktu paruh eliminasi (t1/2 el)
Tetapan laju eliminasi (Kel) menggambarkan kecepatan eliminasi obat. Nilai ini diperoleh dari slope persamaan regresi linier antara waktu eliminasi dengan lnCp.
Waktu paruh eliminasi adalah waktu dimana konsentrasi obat dalam plasma menurun hingga separuhnya. Pengukuran t1/2el didapatkan dari nilai tetapan laju eliminasi, sebagai berikut:
t1/2 el =
……….………..(7)
g. Klirens
Klirens suatu obat adalah faktor yang memprediksi laju eliminasi yang berhubungan dengan konsentrasi obat :
CL =
……….………(8)
Klirens dapat dirumuskan berkenaan dengan darah (CLb), plasma (CLp) atau bebas dalam urin (CLu), bergantung pada konsentrasi yang diukur. Eliminasi obat dari tubuh dapat meliputi proses-proses yang terjadi dalam ginjal, paru, hati dan organ lainnya. Dengan membagi laju terjadi pada setiap organ dengan konsentrasi obat yang menuju pada organ menghasilkan klirens pada masing-masing obat tersebut. Kalau digabungkan klirens-klirens yang terpisah sama dengan klirens sistemik
total (Katzung, 2002).
Klirens obat adalah suatu ukuran eliminasi obat dari tubuh tanpa mempermasalahkan mekanisme prosesnya. Umumnya, jaringan tubuh atau organ dianggap sebagai suatu kompartemen cairan dengan volume terbatas (volume distribusi) dimana obat terlarut didalamnya (Shargel dan Yu, 2005).
Untuk beberapa obat rute pemakaian mempengaruhi kecepatan metabolismenya. Obat- obat yang diberikan secara oral diabsorbsi secara normal dalam duodenal dari usus halus dan ditransport melalui pembuluh mesenterika menuju vena porta hepatik dan ke hati sebelum ke sirkulasi sistemik. Obat-obat yang dimetabolisme dalam jumlah besar oleh hati atau sel-sel mukosa usus halus menunjukkan avaibilitas sistemik yang jelek jika diberikan secara oral. Metabolisme secara oral sebelum mencapai sirkulasi umum disebut first pass effect atau eliminasi presistemik (Shargel dan Yu, 2005).
IV. Rifampisn
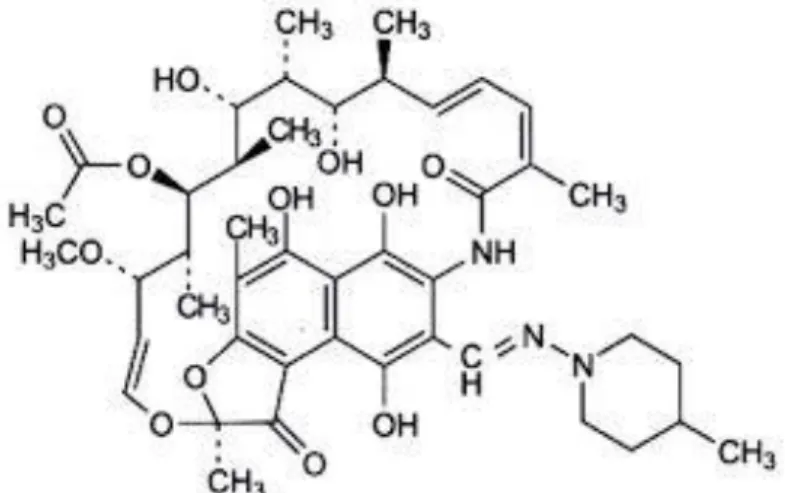
Rifampisin dengan rumus kimia 5, 6, 9, 17, 19, 21-Heksahidroksi-23-metoksi-2, 4, 12, 16, 18, 20, 22-heptametil-8 [N-(4-metil-1-piperazinil) formimidoil]-2, 7-(epoksipentadeka [1, 11, 13] trienimino) nafto [2, 1-b] furan- 1, 11-(2H)-dion-21 asetat dan rumus molekul C43H58N4O12 memiliki nama lain seperti rifampicinum, rifampin, rivalzadin, 3-[{(4-Metil-1-piperazinil)imino} metil] rifamisin. Bobot molekul rifampisin ialah 822,95 g/mol, berupa serbuk hablur dengan warna coklat merah. Sangat sukar larut
dalam air, sukar larut dalam etanol, eter dan aseton, mudah larut dalam kloroform, larut dalam etil asetat dan dalam metanol (Depkes RI, 1995).
Rifampisin merupakan obat yang sering digunakan untuk penyakit tuberkulosis, lepra, serta beberapa jenis virus. Rifampisin bekerja sebagai bakterisid, melawan kuman pada fase aktif maupun laten. Aktivitas bakterisid terjadi beberapa saat setelah terapi ketika kuman berkembang secara cepat, meskipun aktivitasnya lebih rendah dibandingkan dengan INH dalam 2 hari pertama terapi. Aktivitas membunuh Mycobacterium tuberculosis akan tetap berlangsung untuk beberapa bulan kemudian. Aksi Rifampisin dimulai secara cepat namun 6-24 jam kemudian Mycobacterium tuberculosis yang selamat akan mulai tumbuh kembali selama 2-3 hari sehingga diperlukan dosis yang lebih besar pada pemberian intermiten. Rifampisin sendiri merupakan inducer enzim mikrosomal hati serta bersifat auto-induktif (Weinstein, 1990).
Rumus struktur rifampisin ditunjukkan pada gambar 1 dibawah ini:
4.1 Farmakokinetika rifampisin
Rifampisin segera diabsorbsi dari saluran pencernaan. Konsentrasi maksimum obat dalam plasma adalah 7 µg/mL sampai 24 µg/mL setelah 2 jam sampai 4 jam pemberian dosis 600 mg. Selain dalam dosis 600 mg, terdapat pula dosis rifampisin sebesar 150 mg dan 300 mg. Hal ini dapat berbeda antara individu yang satu dengan individu yang lainnya. Rifampisin berada 80% dalam protein plasma. Waktu paruh rifampisin berkisar antara 3 jam sampai 5 jam, dengan waktu paruh yang lebih pendek (1 jam sampai 3 jam) pada penggunaan 2 minggu pertama karena rifampisin menginduksi metabolisme terhadap rifampisin itu sendiri. Rifampisin secara cepat dimetabolisme di hati menjadi 25-O-deasetilrifampisin. Deasetilrifampisin diserap kembali ke saluran cerna dan meningkatkan ekskresi melalui feses, tetapi siklus enterohepatik tetap berjalan. Sekitar 60% obat diekskresikan melalui feses sedangkan 30% obat diekskresikan melalui urin, setengah bagian tersebut diekskresikan dalam waktu 24 jam. Metabolit formilrifampisin juga diekskresikan melalui urin. Pada pasien gangguan ginjal waktu paruh rifampisin menjadi lebih panjang dari normalnya (Sweetman, 1999; Peloquin, 2002).
V. Laktosa
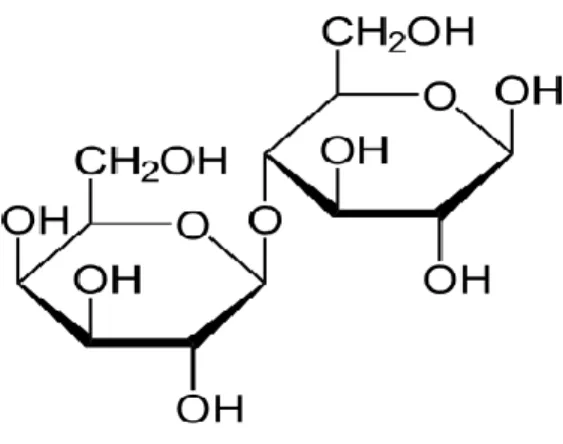
Laktosa adalah gula yang diperoleh dari susu. Laktosa merupakan disakarida yang dapat dipecah menjadi glukosa dan galaktosa. Memiliki rumus kimia C12H22O11 dan nama IUPAC β-D-galactopyranosil-(1→4)-D-glukosa. Massa molar dari laktosa ialah 342.30 g/mol. Terdapat dalam bentuk
anhidrat atau mengandung satu molekul air hidrat. Pemerian serbuk atau masa hablur, keras, putih, atau putih krem. Mudah larut dalam air secara perlahan dan lebih mudah larut dalam air mendidih, sangat sukar larut dalam etanol, tidak larut dalam kloroform dan dalam eter (Depkes RI, 1995).
Rumus struktur laktosa anhidrat ditunjukkan pada gambar 2 berikut:
Gambar 2. Rumus struktur laktosa
Laktosa secara umum sering digunakan sebagai bahan pengisi. Keuntungan bahan pengisi laktosa dibanding bahan pengisi lainnya ialah menunjukkan kecepatan pelepasan zat aktif dengan baik, mudah dikeringkan dan tidak peka terhadap variasi moderat dalam kekerasan tablet pada pengempaan. Laktosa dapat memadatkan massa granul dalam granulasi basah atau metode kempa langsung. Laktosa merupakan eksipien yang baik sekali digunakan dalam tablet yang mengandung zat aktif berkonsentrasi kecil karena mudah melakukan pencampuran yang homogen. Harga laktosa juga relatif lebih murah daripada banyak pengisi lainnya dan sangat mudah di dapat. Laktosa berfungsi sebagai bahan pengisi dalam formulasi tablet rifampisin yang telah teruji memberikan stabilitas dan disolusi tablet yang cukup baik (Khrisna dkk, 2013).
VI. Metode Kromatografi Cair Kinerja Tinggi (High Performance
Liquid Chromatography)
Kromatografi cair kinerja tinggi merupakan sistem pemisahan dengan kecepatan dan efisiensi yang tinggi karena didukung oleh kemajuan dalam teknologi kolom, sistem pompa tekanan tinggi dan detektor yang sangat sensitif dan beragam sehingga mampu menganalisis berbagai cuplikan secara kualitatif maupun kuantitatif, baik dalam komponen tunggal maupun campuran (USP XXX, 2007).
Kromatografi cair kinerja tinggi merupakan metode yang sering digunakan untuk menganalisis senyawa obat. Kromatografi cair kinerja tinggi dapat digunakan untuk pemeriksaan kemurnian bahan obat, pengawasan proses sintesis dan pengawasan mutu (Ahuja dan Dong, 2005).
Tablet kombinasi rifampisin, isoniazid dan pirazinamid dapat ditentukan kadarnya secara kromatografi cair kinerja tinggi. Untuk rifampisin, isoniazid dan pirazinamid dapat ditentukan kadarnya secara kromatografi cair kinerja tinggi menggunakan kolom L1 (oktadesil silana yang terikat secara kimiawi pada partikel mikro keramik) diameter kolom 4,6 mm, panjang kolom 25 cm, diameter ukuran partikel 5 µm dengan fase gerak campuran larutan dapar fosfat pH 6,8 dan asetonitril (96:4) (fase gerak A) dan campuran larutan dapar fosfat pH 6,8 dan asetonitril (55:45) (fase gerak B) dengan perbandingan kedua campuran yang berubah-ubah, laju alir (flow rate) 1,5 mL/menit dan deteksi dilakukan pada panjang gelombang 238 nm. Ekstraksi
sampel dilakukan dengan menggunakan dapar fosfat pH 6,8. (USP XXX, 2007).
F. KETERANGAN EMPIRIK
Data empirik yang ingin diketahui adalah profil kadar dan nilai parameter farmakokinetika rifampisin pada tikus Wistar setelah pemberian oral dengan bahan pengisi laktosa yang dihitung menggunakan PK Solver, WinSAAM, Monolix.