BAB 1 PENDAHULUAN
A. LATAR BELAKANG
Angka kejadian persalinan dengan bedah sesar menurut World Health
Organization (WHO), diperkirakan 10% sampai 15% dari semua proses persalinan di Negara-negara berkembang1. Proporsi persalinan dengan bedah sesar di 64 Rumah Sakit di Jakarta pada tahun 1993 adalah 45% dari 17.665 persalinan2. Data dari RSUP Cipto Mangunkusumo Jakarta tahun 1999-2000, menyebutkan bahwa proporsi persalinan dengan bedah sesar 30% dari 404 persalinan setiap bulan3.
Nyeri yang terjadi setelah bedah sesar akan membuat proses pemulihan menjadi sulit dan kontak antara ibu dan bayi tertunda, selain itu juga akan menjadi hambatan untuk posisi menyusui yang baik, perawatan diri, perawatan bayi baru lahir, dan untuk melakukan kegiatan sehari hari, jangka waktu rawatan di rumah sakit bertambah dan pada akhirnya akan meningkatkan biaya pengobatan. Nyeri paska bedah sesar sering diabaikan, sehingga dapat mempengaruhi kepuasan pasien dan mengurangi kualitas hidupnya4,5,6.
Anestesi regional merupakan pilihan utama dalam penatalaksanaan pasien selama bedah sesar. Penggunaan kembali anestesi intratekal sebagai teknik yang popular mungkin karena teknik yang sederhana dan perkembangan jarum bore kecil. Keuntungan lain, seperti: mula kerja yang cepat dan kemampuan dalam menghasilkan blok motorik dan sensorik yang sama jika dibandingkan dengan epidural anestesi. Kerugian utamanya berhubungan dengan masa kerjanya yang terbatas. Anestesi dan analgesia intratekal dapat diperpanjang dengan menggunakan adjuvan terhadap anestesi lokal seperti adrenalin, midazolam, opioid, neostigmin, klonidin, dan lain-lain.4,6.
Banyak faktor yang mempengaruhi ketepatan blok saraf sensorik untuk pembedahan, dosis lokal anestesi adalah penentu utama untuk
keberhasilannya. Beberapa buku ajar anestesi menganjurkan bupivakain pada dosis antara 12 sampai 15 mg. Bupivakain mempunyai mula kerja 5-10 menit dan lama kerja 75-150 menit. Namun, penggunaan rentang dosis ini berhubungan dengan kejadian hipotensi pada ibu dari 69% sampai lebih dari 80%, menyebabkan morbiditas pada ibu dan bayi. Penggunaan dosis rendah bertujuan untuk mengurangi efek samping terhadap ibu (hipotensi, mual/muntah intra operasi), mengurangi waktu perawatan di unit perawatan paska bedah, dan meningkatkan kenyamanan ibu. Namun, strategi tersebut dapat melemahkan kecukupan anestesi, dan memerlukan obat analgesia tambahan, dengan kemungkinan resiko terhadap bayi, dan mungkin membutuhkan konversi ke anestesi umum7.
Lubis B (Medan, 2013) melakukan penelitian tentang efek analgesia dan efek samping hipotensi pada dosis 10 mg dan 15 mg hiperbarik bupivakain 0,5% pada bedah sesar dan didapati bahwa anestesi intratekal menggunakan 10 mg bupivakain hiperbarik 0,5% lebih efektif dibandingkan 15 mg bupivakain hiperbarik 0,5% karena menghasilkan analgesia intraoperatif yang adekuat dan hemodinamik yang lebih stabil (25% Versus 76,6% kejadian hipotensi)8.
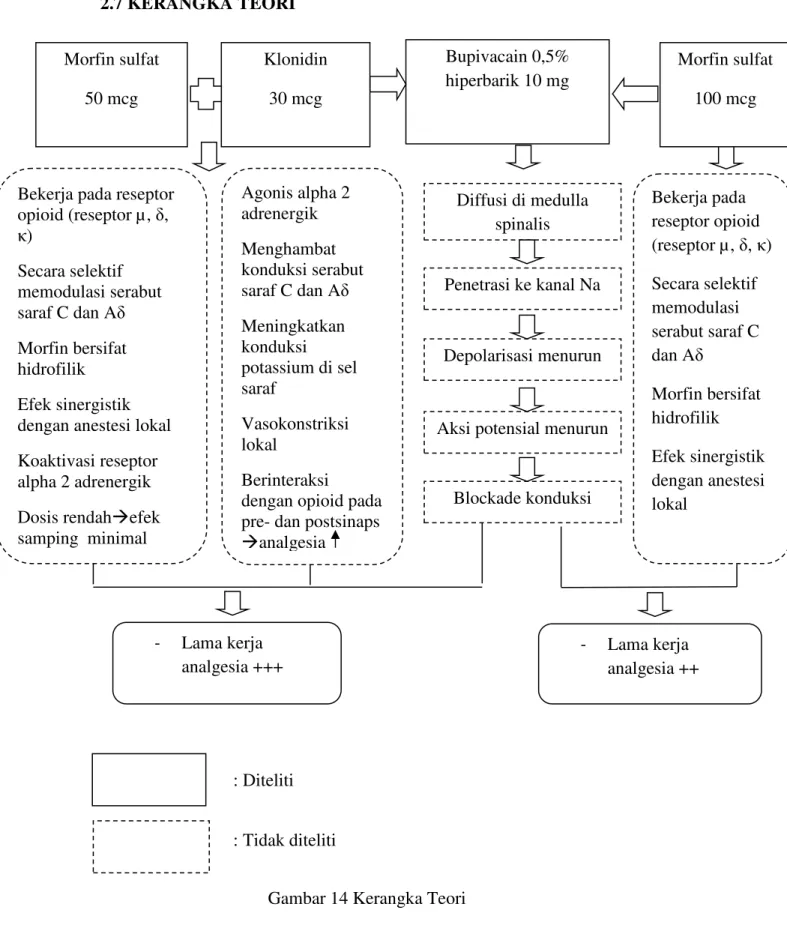
Opioid intratekal dan anestesi lokal juga telah terbukti bekerja secara sinergis pada tingkat spinal. Keuntungan kombinasi dua jenis obat dengan cara ini dijelaskan dengan perbedaaan sifat analgetik dan kemampuannya untuk menghambat rasa nyeri di dua cara yang berbeda. Opioid menghasilkan efek analgesia dengan mengikat dan mengaktifkan reseptor opiat spesifik dalam substansia gelatinosa, sedangkan anestesi lokal menghasilkan efek analgesia dengan menghambat transmisi inpuls pada akar saraf dan ganglia akar dorsal9.
Morfin intratekal memperlihatkan efek anti nyeri yang efektif paska bedah sesar, jika dikombinasi dengan anestesi lokal, dengan dosis sekurang-kurangnya 50-100 mcg, tetapi efek samping terhadap ibu sering dijumpai seperti mual, muntah, retensi urin dan pruritus. Efek samping yang jarang terjadi namun sangat berbahaya adalah depresi pernafasan
lambat, yang mungkin terjadi 6 sampai 12 jam setelah pemberian intratekal morfin, dan direkomendasikan secara klinis tidak lebih dari 300 mcg untuk mencegah depresi pernapasan tertunda10,11.
Yang T dkk (Canada, 1999), melakukan penelitian pada morfin 250 mcg dan 100 mcg intratekal sebagai analgesia pada pasien bedah sesar, tidak dijumpai perbedaan skor nyeri VAS atau jumlah ibu yang meminta opioid diantara kedua kelompok. Skor pruritus pada kelompok 100 mcg lebih rendah selama 24 jam pertama (p = 0.001). Beberapa ibu dengan dosis 100 mcg membutuhkan nalbupin untuk mengobati pruritus (p = 0.018). Skor mual lebih rendah pada kelompok 100 mcg (p < 0.001)12.
Slappendel R dkk (Belanda, 1999), melakukan penelitian tentang dosis optimal intratekal morfin pada operasi tulang panggul dengan membandingkan dosis 25 mcg, 50 mcg, 100 mcg dan 200 mcg, dan didapati bahwa dosis optimal intratekal morfin setelah operasi tulang panggul adalah 100 mcg. Pada dosis ini menghasilkan penanggulangan nyeri yang baik dan kebutuhan morfin sistemik yang minimal pada 24 jam paska bedah. Sedangkan pada dosis 200 mcg morfin intratekal tidak menghasilkan efek analgesia yang lebih baik, dengan angka kejadian gatal lebih tinggi dan hipotensi lebih sering dan berlangsung lama. Dosis morfin intratekal di bawah 100 mcg kurang efektif. Dari penelitian ini didapatkan nilai VAS tertinggi berturut – turut 3,4, 3,4, 3, 2,5, dan total VAS 24 jam paska bedah adalah: 11,1, 9,5, 8,4, 6,3, dan penggunaan morfin PCA adalah ( mg ): 23,7, 17,8, 10,9, 9,913.
Dahl JB dkk (Denmark, 1999), melakukan review sistematik untuk menilai efektifitas analgesia intraoperatif dan postoperatif serta efek samping opioid intratekal pada pasien-pasien bedah sesar yang dilakukan spinal anestesi. Didapati waktu pemberian analgesia tambahan paska bedah pada morfin dosis 100 mcg dan 200 mcg lebih lama. Dimana dosis 50 mcg tidak dijumpai efek yang bermakna terhadap plasebo. Waktu
permintaan analgetik tambahan pertama paska bedah pada beberapa penelitian adalah antara 11-29 jam14.
Palashevska dkk (Yugoslavia, 2011), membandingkan morfin 0,05 mg dengan morfin 0,1 mg sebagai adjuvan bupivakain hidroklorida isobarik 17,5 mg secara intratekal pada operasi histerektomi pervaginam, paska operasi didapati bahwa masa kerja analgesia pada kelompok morfin 0,05 mg adalah 14,3 ± 1,1 jam dan secara bermakna lebih singkat dibandingkan 19,7 ± 1,7 jam pada kelompok morfin 0,1 mg (p<0.05), kejadian mual muntah tidak berbeda bermakna antara kedua kelompok, kejadian pruritus lebih sering pada morfin dosis 0,1 mg (p<0,05). Tidak dijumpai depresi pernapasan pada kedua kelompok15.
Carvalho FAE dkk (Brazil, 2012), meneliti tentang efek analgesia dan efek samping morfin dosis 50 mcg dan 100 mcg pada bedah sesar, dan didapati tidak berbeda bermakna secara statistik intensitas nyeri pada kedua kelompok, dimana nyeri sering terjadi pada jam ke 12 setelah dilakukan anestesi (p < 0.001). Konsumsi tramadol hidroklorida dan waktu untuk analgetik pertama sama pada kedua kelompok. Pruritus adalah efek samping yang paling sering terjadi, dengan angka kejadian secara statistik lebih tinggi pada kelompok morfin 100 mcg dibandingkan kelompok morfin 50 mcg yaitu 32% dan 12% (p = 0,026)16.
Sharma NR dkk (Nepal, 2013), melakukan penelitian pada morfin 100 mcg dan 200 mcg sebagai adjuvan bupivakain intratekal pada operasi bedah sesar didapati bahwa masa kerja analgesia lebih panjang pada morfin 200 mcg tetapi tidak bermakna secara statistik (p= 0.09). Kejadian pruritus, mual dan muntah lebih sering pada 200 mcg namun tidak bermakna secara statistik (p = 0.09 dan 0.373)17.
Trivedi DA dkk (India, 2013), melakukan penilaian morfin intratekal untuk analgesia paska bedah hysterectomy pervaginam dengan dosis morfin 100 mcg dibandingkan dengan plasebo sebagai adjuvan bupivakain 17,5 mg, dijumpai masa kerja analgesia rata-rata adalah 13,825 ± 4,206 jam pada kelompok morfin dan 4,762 ± 0,679 jam pada kelompok
plasebo (p<0,001). Frekuensi pernapasan dan saturasi oksigen adalah normal pada kedua kelompok pada setiap interval waktu selama operasi dan untuk 24 jam paska bedah18.
Ishak M dkk (Libanon, 2013), membandingkan intratekal morfin 50 mcg dengan intratekal morfin 100 mcg dalam bupivakain 0,5% 10 mg pada 48 pasien yang menjalani operasi bedah sesar dan didapati bahwa permintaan dosis analgetik pertama setelah 7 jam pada rata-rata ibu yang mendapat dosis morfin 50 mcg dan 9 jam pada ibu yang mendapat dosis morfin 100 mcg. Ibu yang mendapat morfin 50 mcg tidak dijumpai efek samping yang bermakna. Empat pasien pada grup 100 mcg mengalami mual19.
Weber EWG dkk (Belanda, 1999), membuktikan bahwa kejadian mual muntah adalah sama pada semua pasien ortopedi yang mendapat morfin intratekal. Lebih dari 60% pengalaman pasien dengan mual muntah terjadi pada 24 jam paska bedah tulang panggul. Dan kejadian mual muntah paska bedah tidak berhubungan dengan perbedaan dosis morfin intratekal, kejadian mual muntah juga sama pada pasien yang tidak mendapatkan morfin intratekal20.
Slappendel R dkk (Belanda, 1999), mendapati bahwa kejadian pruritus meningkat sesuai dengan dosis pada rentang dosis 25 – 200 mcg morfin intratekal. Dimana kejadian tertinggi pruritus dijumpai pada 6 sampai 9 jam setelah pembedahan. Dengan angka kejadian dan lama (jam) rata – rata pada dosis intratekal morfin 25 mcg, 50 mcg, 100 mcg, 200 mcg, berturut – turut: angka kejadian pruritus ringan: 11%, 14%, 38%, 50%, pruritus sedang: 3%, 8%, 11%, 9%, dan pruritus berat: terjadi pada 3% pasien yang mendapat dosis 0,2 mg. Sedangkan lama waktu pruritus ( jam ) berturut-turut adalah 3,6, 3,4, 7,5, dan 6,7. Dengan perbandingan antara keempat kelompok terlihat bahwa lama pruritus hanya berbeda antara kelompok 25 mcg dan 50 mcg dibandingkan kelompok 100 mcg dan 200 mcg (p= 0,0000)21.
Gehling M dan Tryba M (Germany, 2008), melakukan meta-analisis tentang resiko dan efek samping morfin intratekal dikombinasikan dengan anestesi spinal. Dibandingkan plasebo dosis morfin intratekal < 0,3 mg menghasilkan peningkatan mual (RR 1,4 CI 1,1-1,7) atau muntah (RR 3,1 CI 1,5-6,4) dan pruritus (RR 1,8 CI 1,4-2,2). Dosis morfin ≥ 0,3 mg menghasilkan rasio resiko pruritus (RR 5,0 CI 2,9-8,6), tetapi tidak berbeda pada mual (RR 1,2 CI 0,9-1,6) atau muntah (RR 1,3 CI 0,9-1,9). Secara keseluruhan intratekal morfin tidak meningkatkan depresi pernapasan22.
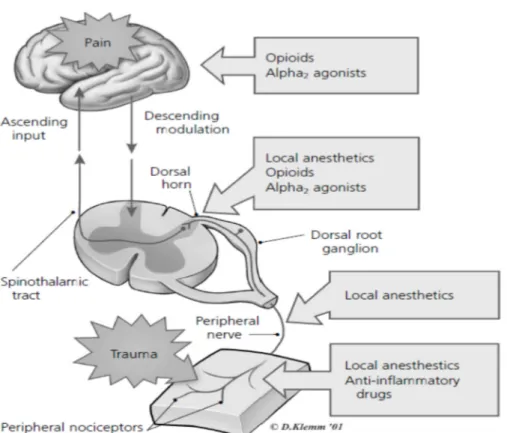
Klonidin intratekal telah digunakan pada rentang dosis 15 sampai 150 mcg, secara sendiri atau dicampur dengan anestesi lokal yang beragam dan opioid. Peningkatan aktivitas anestesi lokal terjadi karena blok hantaran saraf pada serabut A delta dan C, hiperpolarisasi saraf terisolasi karena peningkatan konduktansi kalium, dan vasokontriksi yang dimediasi oleh reseptor α2 adrenergik paska sinap sehingga absorbsi obat anestesi berkurang, meningkatkan waktu kontak jaringan saraf dengan obat tersebut4,9,10,23,24,25.
Reseptor α2 adrenergic dan reseptor opioid, dua reseptor ini memediasi fungsi fisiologis yang beragam, termasuk efek analgesia. Beberapa laporan telah menggambarkan peningkatan anti nyeri di spinal yang dimediasi opioid pada pemberian bersama agonis reseptor α2 adrenergic dosis rendah. Selain itu, telah dibuktikan secara luas perilaku dan elektrofisiologi co-aktivasi reseptor α2 adrenergik dan reseptor opioid akan menghasilkan interaksi sinergis di sumsum tulang belakang9,10,23.
Santiveri X dkk (India, 2002), melakukan penelitian tentang efek anestesi dan analgesia paska bedah klonidin intratekal sebagai obat tambahan pada prilocain pada operasi transuretra reseksi tumor kandung kemih dan didapatkan bahwa penambahan klonidin 75 mcg pada intratekal prilokain 75 mg meningkatkan masa kerja blok sensorik dan motorik dan mengurangi kebutuhan analgetik paska bedah26.
Kunakeri S (India, 2011), melakukan penelitian pada klonidin intratekal 30 mcg sebagai adjuvan terhadap bupivakain pada operasi abdomen bagian bawah didapati peningkatan masa kerja analgesia pada kelompok klonidin yaitu 7.46 ± 2.18 jam sedang pada bupivakain saja 4.91 ± 1.41 jam27,28.
Bhushan SB dkk (India, 2012), melakukan penelitian pada 60 pasien yang menjalani operasi bedah sesar dengan klonidin 60 mcg, 30 mcg, atau 15 mcg sebagai adjuvan terhadap bupivakain 0,5% hiperbarik secara intratekal dan diamati bahwa masa kerja analgesia secara bermakna lebih lama pada kelompok klonidin 60 mcg dibandingkan dengan kelompok lain (598,7±140,47 vs. 436,65±149,84 dan 387,1±97,05 menit) namun sedasi juga lebih sering terjadi. Peneliti juga mendapatkan analgesia cukup baik dengan lebih sedikit sedasi pada dosis 15 mcg dan 30 mcg klonidin dan merupakan pilihan lebih baik ketika sedasi tidak dibutuhkan29.
Neves JFNP dkk (Brazil, 2006), melakukan penelitian pada 60 pasien bedah sesar dengan spinal anestesi dan dibagi menjadi 3 kelompok pasien yaitu pasien dengan intratekal bupivakain 0,5% hiperbarik (12,5 mg), morfin 100 mcg dan klonidin 15 atau 30 mcg. Pada jam ke 12 nilai VAS secara bermakna lebih rendah pada pasien kelompok klonidin 15 mcg dan 30 mcg jika dibandingkan dengan kelompok morfin saja (p < 0,05). Lama kerja analgesia paska bedah juga meningkat pada kelompok yang mendapat klonidin. Tidak ada perbedaan efek samping antara kelompok30.
E. Engelman dan C. Marsala (Belgia, 2012), melakukan suatu meta-analisis tentang efektifitas penambahan klonidin terhadap morfin intratekal pada nyeri akut paska bedah dan didapati bahwa klonidin meningkatkan masa kerja analgesia sampai 1,63 jam (CI: 0,93-2,33). Klonidin mengurangi jumlah penggunaan morfin paska bedah dengan rata-rata 4,45 mg. Hanya kejadian hipotensi yang dijumpai meningkat pada klonidin31.
Braga AFA dkk (Brazil, 2013), melakukan penelitian tentang efektifitas dan efek samping terhadap janin dan ibu pada dua dosis bupivakain dengan campuran morfin dan klonidin secara intratekal, pada penelitian ini juga dilakukan penilaian tentang karakteristik larutan anestesi dan didapati bahwa pencampuran bupivakain hiperbarik 0,5% 10 mg (2 ml) + klonidin 75 mcg (0,5 ml) + morfin 100 mcg (1 ml) + salin 0,9% (0,5 ml) dengan total volume sampai 4 ml menghasilkan densitas larutan pada suhu 37 ºC yaitu 1.0125 dan masih hiperbarik dibandingkan CSF.
B. RUMUSAN MASALAH
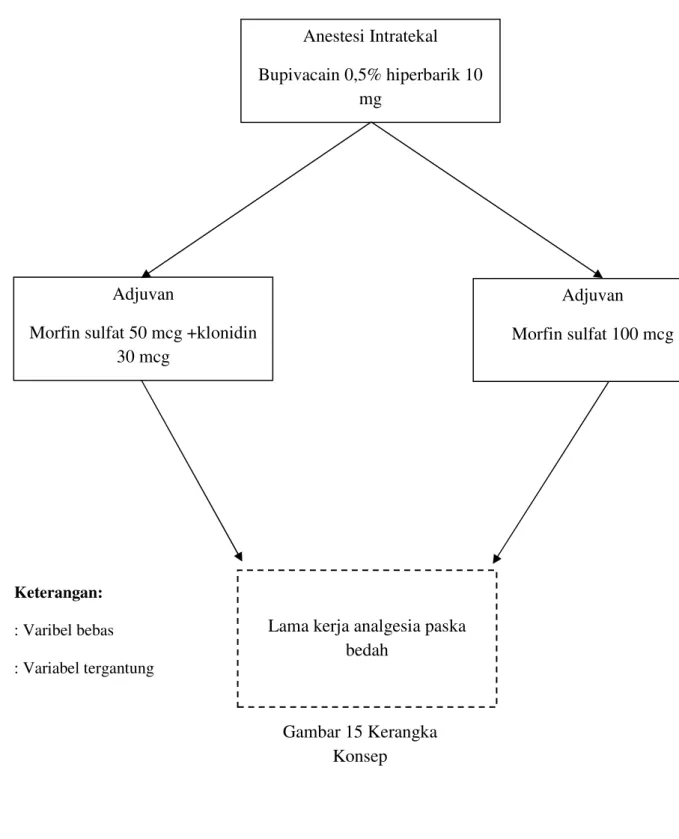
Apakah masa kerja analgesia klonidin 30 mcg – morfin 50 mcg lebih lama dibandingkan dengan morfin 100 mcg sebagai adjuvan bupivakain hiperbarik 0,5% 10 mg intratekal pada bedah sesar.
C. HIPOTESIS
Masa kerja analgesia klonidin 30 mcg – morfin 50 mcg lebih lama dibandingkan dengan morfin 100 mcg sebagai adjuvan bupivakain hiperbarik 0,5% 10 mg intratekal pada bedah sesar.
D. TUJUAN UMUM
Untuk mendapatkan obat adjuvan pada anestesi intratekal bupivakain hiperbarik 0,5% 10 mg yang memiliki masa kerja analgesia yang lama dengan efek samping yang rendah.
E. TUJUAN KHUSUS
1. Untuk mengetahui masa kerja analgesia klonidin 30 mcg – morfin 50 mcg sebagai adjuvan bupivacain hiperbarik 0,5% 10 mg pada bedah sesar.
2. Untuk mengetahui masa kerja analgesia morfin 100 mcg sebagai adjuvan bupivakain hiperbarik 0,5% 10 mg pada bedah sesar.
3. Untuk mengetahui perbandingan masa kerja analgesia klonidin 30 mcg – morfin 50 mcg dengan morfin 100 mcg sebagai adjuvan bupivakain hiperbarik 0,5% 10 mg pada bedah sesar.
4. Untuk mengetahui perbandingan angka kejadian efek samping klonidin 30 mcg – morfin 50 mcg dengan morfin 100 mcg sebagai adjuvan bupivakain hiperbarik 0,5% 10 mg intratekal pada bedah sesar.
F. MANFAAT PENELITIAN 1. Manfaat Akademis
Hasil dari penelitian ini diharapkan dapat digunakan sebagai landasan dalam pemilihan adjuvan pada anestesi intratekal yang memiliki masa kerja analgesia yang lama dan efek samping yang minimal terutama pada bedah sesar
2. Manfaat Pelayanan Pasien
1. Untuk mendapatkan pasien dengan kualitas analgesia yang lebih baik pada bedah sesar.
2. Untuk mendapatkan obat adjuvan anestesi dengan masa kerja analgesia yang lama dan efek samping yang minimal pada bedah sesar.
3. Untuk mengurangi efek samping morfin intratekal yang merugikan pasien.
4. Mempercepat mobilisasi pasien sehingga menurunkan angka lamanya perawatan di rumah sakit dan biaya pengobatan.
5. Mempercepat mobilisasi ibu, sehingga mempercepat dan meningkatkan kualitas perawatan bayi oleh ibu.
BAB 2
TINJAUAN PUSTAKA
2.1 Anestesi Intratekal dan Bedah Sesar
Pada tahun 1885, J. Leonard Corning, seorang ahli neurologi menyuntikkan cocain kedalam ruang subarachnoid secara tidak sengaja menembus dura ketika melakukan percobaan terhadap anjing. Kemudian secara berulang dan sengaja menyuntikkan intradural cocain 3% dan menyarankan dapat digunakan pada pembedahan4,6.
Istilah Seksio Sesarea berasal dari bahasa latin “caedere” yang artinya ‘memotong’. Pengertian ini dapat dijumpai dalam hukum roma yaitu lex regia atau lex sesarea yang merupakan hukum yang menjelaskan bahwa prosedur tersebut dilakukan diakhir kehamilan pada seorang wanita yang dalam keadaan sekarat demi menyelamatkan calon bayinya. Secara definisi seksio sesarea adalah suatu tindakan untuk melahirkan bayi melalui insisi abdominal (laparatomi) dan dinding uterus (histereotomi). Definisi ini tidak mencakup pengeluaran janin pada kasus rupture uteri atau pada kasus kehamilan abdominal. Berdasarkan kamus kedokteran Dorland, 2002, bedah sesar merupakan suatu proses insisi dinding abdomen dan uterus untuk mengeluarkan janin32,33,34.
Pemilihan teknik anestesi pada ibu hamil yang akan menjalani bedah sesar adalah anestesi yang aman dan nyaman bagi ibu tanpa menyebabkan menurunnya kondisi janin dan bayi yang akan dilahirkan, oleh karena pemilihan teknik anestesi memiliki peranan sekitar 3-12% dari angka kematian ibu melahirkan. Pada saat ini, teknik regional anestesi yang paling sering digunakan oleh ahli anestesi selama bedah sesar adalah dengan menggunakan teknik anestesi regional subarakhnoid (anestesi intratekal). Hal ini di latar belakangi oleh karena tingginya angka mortalitas ibu yang menjalani bedah sesar dengan anestesi umum, yaitu hampir 17 kali lebih tinggi dibandingkan setelah penggunaan anestesi
regional dengan resiko komplikasi jalan napas pada anestesi umum, gagal intubasi, gagal ventilas-oksigenasi dan atau terjadinya aspirasi32,33,35.
Pada 16 agustus 1898, Keil August Bier melakukan anestesi intratekal terencana pertama kali pada manusia. Dia menyuntikkan 3 ml cocain 0,5% kedalam ruang subarachnoid kepada buruh umur 34 tahun yang sedang melakukan operasi ekstremitas bawah. Setelah menggunakannya pada 6 orang pasien, dia dan asistennya menyuntikkan cocain ke tekal masing – masing6,36,37.
Heinrich Braun, ahli bedah dari Jerman pada tahun 1905 melaporkan penggunaan procain untuk anestesi intratekal. Dia juga melaporkan penggunaan epinephrine intratekal untuk memperpanjang lama kerja anestesi intratekal tetapi ini tidak diterima karena adanya ketakutan akan komplikasi neurologis. Barulah pada tahun 1945 Prickett dkk, menerbitkan laporan tentang keamanan neurologis penambahan intratekal epinephrine untuk memperpanjang lama kerja anestesi intratekal.
Teknik anestesi intratekal baru diterima secara baik diseluruh dunia dan banyak yang melaporkan penggunaannya. Pada tahun berikutnya, popularitas anestesi intratekal menjadi meningkat dengan memperkenalkan obat-obat dan teknik terbaru36,37.
Anestesi intratekal adalah injeksi obat anestesi lokal kedalam ruang intratekal yang menghasilkan analgesia. Pemberian obat lokal anestesi kedalam ruang intratekal atau ruang subaraknoid di regio lumbal antara vertebra L2-3, L3-4, L4-5, untuk menghasilkan onset anestesi yang cepat dengan derajat kesuksesan yang tinggi. Walaupun teknik ini sederhana, dengan adanya pengetahuan anatomi, efek fisiologi dari anestesi spinal dan faktor – faktor yang mempengaruhi distribusi anestesi lokal di ruang intratekal serta komplikasi anestesi spinal akan mengoptimalkan keberhasilan terjadinya blok anestesi intratekal6,38,39.
Kontraindikasi absolut anastesi intratekal meliputi pasien menolak, infeksi di daerah penusukan, koagulopati, hipovolemi berat, peningkatan
tekanan intrakranial, stenosis aorta berat dan stenosis mitral berat. Sedangkan kontraindikasi relatif meliputi pasien tidak kooperatif, sepsis, kelainan neuropati seperti penyakit demielinisasi sistem saraf pusat, lesi pada katup jantung serta kelainan bentuk anatomi tulang belakang yang berat. Ada juga menyebutkan kontraindikasi kontroversi yang meliputi operasi tulang belakang pada tempat penusukan, ketidakmampuan komunikasi dengan pasien serta komplikasi operasi yang meliputi operasi lama dan kehilangan darah yang banyak6,38,39.
Anestesi intratekal dihasilkan oleh injeksi larutan anestesi lokal kedalam ruang subarakhnoid lumbal. Larutan anestesi lokal dimasukkan kedalam cairan serebrospinal lumbal, bekerja pada lapisan superfisial dari korda spinalis, tetapi tempat kerja yang utama adalah serabut preganglionik karena mereka meninggalkan korda spinal pada rami anterior. Karena serabut sistem saraf simpatis preganglionik terblokade dengan konsentrasi anestesi lokal yang lebih rendah untuk mempengaruhi serabut sensoris dan motoris, tingkat denervasi sistem saraf simpatis selama anestesi intratekal meluas kira – kira sekitar dua segmen spinal sefalad dari tingkat anestesi sensoris6,38,39.
Anestesi intratekal mempunyai beberapa keuntungan antara lain, perubahan metabolik dan respon endokrin akibat stress dapat dihambat, komplikasi terhadap jantung, otak, paru minimal, relaksasi otot maksimal pada daerah yang terblok sementara pasien dalam keadaan sadar. Selain keuntungan ada juga kerugian dari cara ini yaitu berupa komplikasi yang meliputi hipotensi, mual dan muntah, PDPH, nyeri pinggang dan lainnya 32-34,40-44.
Anestesi intratekal pada ibu hamil yang menjalani bedah sesar memerlukan dosis obat anestesi lokal yang lebih sedikit untuk mendapatkan ketinggian blok yang cukup bila dibandingkan dengan pasien yang tidak hamil. Hal ini disebabkan oleh adanya peningkatan sensitifitas sel saraf terhadap anestesi lokal, penurunan jumlah cairan
serebrospinal, dan efek dari uterus gravid terhadap penyebaran obat intratekal kearah sefalad39,43.
Pada bedah sesar, ketinggian blok analgesia untuk menghasilkan bebas nyeri selama tindakan bedah sesar yang diperlukan adalah setinggi Th6 (batas bawah sternum). Hal ini dapat dicapai dengan 2-2,5 ml (10-12,5 mg) larutan bupivakain 0,5% hiperbarik ataupun isobarik39,43,45.
2.2 Anatomi Kolumna Vertebra
Pengetahuan yang baik tentang anatomi kolumna vertebralis merupakan salah satu faktor keberhasilan tindakan anestesi intratekal. Disamping itu, pengetahuan tentang penyebaran anestesi lokal dalam cairan serebrospinal dan level analgesia diperlukan untuk menjaga keamanan tindakan anestesi intratekal.
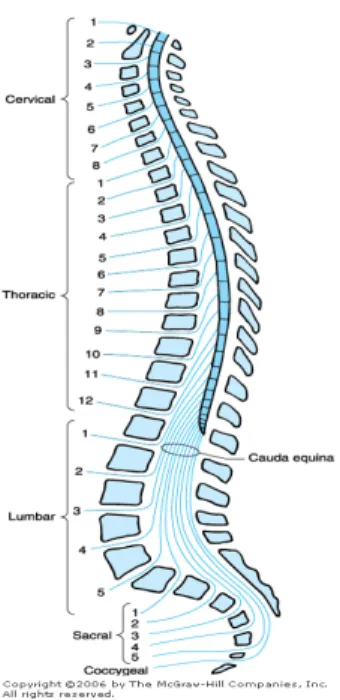
Vertebra lumbalis merupakan vertebra yang paling penting dalam anestesi intratekal, karena sebagian besar penusukan pada anestesi intratekal dilakukan pada daerah ini. Kolumna vertebralis terdiri dari 33 korpus vertebralis yang dibagi menjadi 5 bagian yaitu 7 servikal, 12 thorakal, 5 lumbal, 5 sakral dan 4 koksigeus. Kolumna vertebralis mempunyai empat lengkungan yaitu daerah servikal dan lumbal melengkung ke depan, daerah thorakal dan sakral melengkung ke belakang sehingga pada waktu berbaring daerah tertinggi adalah L3, sedang daerah terendah adalah L5,38,39,46.
Lapisan yang harus ditembus untuk mencapai ruang subarakhnoid dari luar yaitu kulit, subkutis, ligamentum supraspinosum, ligamentum flavum dan duramater. Arakhnoid terletak antara duramater dan piamater serta mengikuti otak sampai medulla spinalis dan melekat pada duramater. Antara arakhnoid dan piamater terdapat ruang yang disebut ruang sub arakhnoid38,39,46.
Duramater dan arakhnoid berakhir sebagai tabung pada vertebra sakral 2, sehingga dibawah batas tersebut tidak terdapat cairan serebrospinal. Ruang subarakhnoid merupakan sebuah rongga yang
terletak sepanjang tulang belakang berisi cairan otak, jaringan lemak, pembuluh darah dan serabut saraf spinal yang berasal dari medulla spinalis. Pada orang dewasa medulla spinalis berakhir pada sisi bawah vertebra lumbal38,39,46.
Gambar 1. Kolumna Vertebralis.
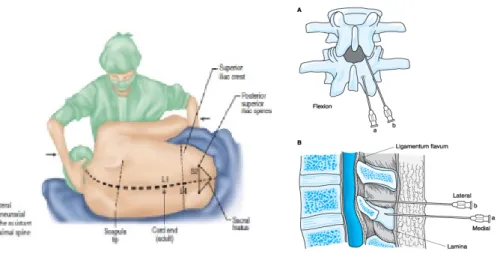
Gambar 3. Ligamentum Vertebralis.
2.3 Anestesi Lokal
Obat anestesi lokal adalah suatu senyawa amino organik. Pada pemakaian sehari-hari, obat ini dapat dibagi menjadi golongan amino ester dan golongan amino amida. Ikatan ester mempunyai sifat mudah dihidrolisis dalam hepar dan oleh plasma esterase, mula kerja lambat, lama kerja pendek dan hanya sedikit menembus jaringan. Sedangkan ikatan amida mudah menjadi tidak aktif oleh hepatic amidase, mula kerja cepat, lama kerja lebih lama dan lebih banyak menembus jaringan. Kelompok ester antara lain procaine, chloroprocaine dan tetracaine. Kelompok amida antara lain lidocaine, mepivacaine, bupivakaine dan etidocaine47,48,49.
Semua obat anestesi lokal bersifat stabilisasi membran yang menghambat transmisi nyeri. Mempunyai kemampuan yang reversibel untuk membuka dan menutup volgated gated sodium channel dari dalam, dengan demikian mencegah depolarisasi membran saraf dan perbedaan potensial aksi pada tempat suntikan obat (pertama kali dilaporkan pada tahun 1950), sehingga membran akson tidak akan dapat bereaksi dengan asetil kholin dan membran akan tetap dalam keadaan semipermiabel dan tidak tejadi perubahan potensial. Keadaan ini menyebabkan aliran implus yang melewati saraf tersebut terhenti, sehingga segala macam rangsang ataupun sensasi tidak akan sampai ke susunan saraf pusat, keadaan ini
menyebabkan timbulnya parastesia sampai analgesia, paresis sampai paralisis dan vasodilatasi pembuluh darah pada daerah yang terblok47,48,49.
Dengan menghentikan transmisi stimuli nyeri dan menghilangkan tonus otot rangka, blokade neuroaksial dapat memberikan kondisi pembedahan yang baik. Blokade sensoris menghambat nyeri somatik dan visceral, sedangkan blokade motoris menyebabkan relaksasi otot rangka. Efek obat anestesi lokal pada serabut saraf bervariasi bergantung pada ukuran serabut saraf, bermielin, konsentrasi obat anetesi lokal serta lamanya kontak. Akar serabut saraf spinalis terdiri dari gabungan bermacam serabut saraf. Serabut yang lebih kecil dan bermielin umumnya lebih mudah diblok daripada serabut saraf yang lebih besar dan tidak bermielin. Pada kenyataannya bahwa konsentrasi obat anestesi lokal akan menurun dengan semakin meningkatnya jarak dari level penyuntikan, hal ini menerangkan fenomena perbedaan blokade. Perbedaan blokade berakibat blok simpatis (yang ditentukan oleh sensitivitas temperatur) menjadi 2 segmen lebih tinggi daripada blok sensoris (nyeri, raba halus) yang 2 segmen lebih tinggi daripada blok motoris47,48,49.
Mula kerja obat bergantung pada beberapa faktor antara lain: 1. pKa mendekati PH fisiologis sehingga konsentrasi bagian yang
tidak terionisasi (bermuatan) meningkat dan dapat menembus membran sel saraf sehingga menghasilkan mula kerja yang cepat. 2. Alkalinisasi anestesi lokal membuat mula kerja cepat.
3. Konsentrasi obat anestesi lokal. Masa kerja obat dipengaruhi oleh :
1. Ikatan dengan protein plasma, karena reseptor anestesi lokal adalah protein.
2. Dipengaruhi oleh kecepatan absorbsi.
3. Dipengaruhi oleh banyaknya pembuluh darah perifer di daerah pemberian47,48,49.
2.3.1. Seleksi Barisitas Larutan Anestesi Lokal
Faktor-faktor yang mempengaruhi penyebaran larutan anestesi lokal pada Anestesi intratekal :47,48,49
1. Gravitasi :
Cairan serebrospinal pada suhu 37°C mempunyai BJ 1,0003 (0.00004). Jika larutan hiperbarik yang diberikan kedalam cairan serebrospinal akan bergerak oleh gaya gravitasi ketempat yang lebih rendah, sedangkan larutan hipobarik akan bergerak berlawanan arah dengan gravitasi seperti menggantung dan jika larutan isobarik akan tetap dan sesuai dengan tempat injeksi.
2. Postur tubuh :
Makin tinggi tubuh seseorang, makin panjang medulla spinalisnya dan volume dari cairan serebrospinal di bawah L2 makin banyak sehingga penderita yang lebih tinggi memerlukan dosis yang lebih banyak dari pada yang pendek.
3. Tekanan intra abdomen :
Peningkatan tekanan intra abdomen menyebabkan bendungan saluran pembuluh darah vena abdomen dan juga pelebaran saluran-saluran vena di ruang epidural bawah, sehingga ruang epidural akan menyempit dan akhirnya akan menyebabkan penekanan ke ruang subarakhnoid sehingga cepat terjadi penyebaran obat anestesi lokal ke kranial. Perlu pengurangan dosis pada keadaan seperti ini.
4. Anatomi kolumna vertebralis :
Anatomi kolumna vertebralis akan mempengaruhi lekukan – lekukan saluran serebrospinal, yang akhirnya akan mempengaruhi tinggi anestesi spinal pada
penggunaan anestesi lokal jenis hiperbarik. 5. Tempat penyuntikan :
Makin tinggi tempat penyuntikan, maka analgesia yang dihasilkan makin tinggi. Penyuntikan pada daerah L2-3 lebih memudahkan penyebaran obat ke kranial dari pada penyuntikan pada L4-5.
6. Manuver valsava :
Setelah obat disuntikkan penyebaran obat akan lebih besar jika tekanan dalam cairan serebrospinal meningkat yaitu dengan cara mengedan.
7. Volume obat :
Efek volume larutan bupivakain hiperbarik pada suatu percobaan yang dilakukan oleh Anellson, 1984, dikatakan bahwa penyebaran maksimal obat kearah sefalad dibutuhkan waktu kurang lebih 20 menit pada semua jenis volume obat( 1,5 cc, 2 cc, 3 cc dan 4 cc). Mula kerja untuk tercapainya blok motorik akan bertambah pendek waktunya dengan bertambahnya volume. Makin besar volume obat makin tinggi level blok sensoriknya.
8. Konsentrasi obat :
Dengan volume obat yang sama ternyata bupivakain 0,75% hiperbarik akan menghasilkan penyebaran obat kearah sefalad lebih tinggi beberapa segmen dibandingkan dengan bupivakain 0,5% hiperbarik (WA Chamber, 1981). Lama kerja obat akan lebih panjang secara bermakna pada penambahan volume obat bupivakain 0,75%. Demikian pula perubahan kardiovaskuler akan berbeda bermakna pada bupivakain 0,75% hiperbarik.
Dalam suatu percobaan oleh J.A.W. Wildsmith dikatakan tidak ada pengaruh penyebaran obat jenis obat larutan isobarik pada perubahan posisi tubuh, sedangkan pada jenis larutan hiperbarik akan dipengaruhi posisi tubuh. Pada larutan hiperbarik posisi terlentang bisa mencapai level blok T4 sedangkan pada posisi duduk hanya mencapai T8. 10. Lateralisasi :
Lateralisasi pada larutan anestetika lokal jenis hiperbarik dapat dilakukan dengan posisi berbaring miring (lateral dekubitus). Pada percobaan oleh J.A.W. Wildsmith disimpulkan bahwa 5 menit setelah penyuntikan obat penyebaran obat pada sisi tubuh sebelah bawah mencapai T10, sedangkan sisi atas mencapai S1. 20 menit setelah obat disuntikkan, penyebaran obat pada sisi bawah mencapai T6, sedangkan pada sisi atas mencapai T7.
.
2.3.2 Dampak Fisiologis
a. Pengaruh terhadap sistem kardiovaskuler :
Pada anestesi intratekal tinggi terjadi penurunan aliran darah jantung dan penghantaran (supply) oksigen miokardium yang sejalan dengan penurunan tekanan arteri rata – rata. Penurunan tekanan darah yang terjadi sesuai dengan tinggi blok simpatis, makin banyak segmen simpatis yang terblok makin besar penurunan tekanan darah. Untuk menghindarkan terjadinya penurunan tekanan darah yang hebat, sebelum dilakukan anestesi spinal diberikan cairan elektrolit NaCl fisiologis atau ringer laktat 10-20 ml/kgbb. Pada Anestesi spinal yang mencapai T4 dapat terjadi penurunan frekuensi nadi dan penurunan tekanan darah dikarenakan terjadinya blok saraf simpatis yang bersifat akselerator jantung47-50.
b. Terhadap Sistem Saraf Pusat (SSP).
Sistem saraf pusat (SSP) paling rentan mengalami toksisitas obat anestesi lokal. Overdosis obat anestesi lokal jelas terlihat pada pasien yang sadar. Gejala awal seperti bibir kebas, lidah terasa seperti logam, parastesia lidah, bingung serta gangguan pada mulut dan penglihatan. Kejadian tersebut diikuti dengan tanda - tanda eksitatori (contoh: rasa lelah, agitasi, cemas, dan paranoid) yang dengan sangat cepat menjadi depresi pada SSP (contoh: bicara pelo, tidak sadar, kejang, henti nafas, kolaps kardiovaskuler). Neurotoksisitas seperti sindroma cauda
equina pernah dilaporkan terjadi setelah penyuntikan lignokain 5% dan tetrakain 0,5% intratekal yang berulang-ulang47-50.
c. Terhadap sistem pernafasan :
Pada anestesi intratekal blok motorik yang terjadi 2-3 segmen di bawah blok sensorik, sehingga umumnya pada keadaan istirahat pernafasan tidak banyak dipengaruhi. Tetapi apabila blok yang terjadi mencapai saraf frenikus yang mempersarafi diafragma, dapat terjadi apnoe47-50.
d. Terhadap sistem pencernaan :
Oleh karena terjadi blok serabut simpatis preganglionik yang kerjanya menghambat aktifitas saluran pencernaan (T4-5), maka aktifitas serabut saraf parasimpatis menjadi lebih dominan, tetapi walapun demikian pada umumnya peristaltik usus dan relaksasi spingter masih normal.
Pada anestesi spinal bisa terjadi mual dan muntah yang disebabkan karena hipoksia serebri akibat dari hipotensi mendadak, atau tarikan pada pleksus terutama yang melalui saraf vagus47-50.
Gambar 4. Mekanisme Kerja Anestesi Lokal
2.4 Morfin
Pemisahan morfin dari opium oleh Seturner pada tahun 1803 dan pengenalan jarum suntik dan jarum berongga untuk praktek klinis oleh Wood, pada tahun 1853 akhirnya penggunaan opioid diizinkan dengan pengukuran dosis secara hati – hati (Foldes 1963). Morfin sering digunakan secara intramuskular pada medikasi preoperative sebagai suplementasi analgesia selama penggunaan ether dan chloroform. Pada akhir abad ke 19 sejumlah besar opioid (1 sampai 2 mg/Kg) digunakan pada intravena dengan dosis yang berbeda – beda, secara intramuskular atau keduanya, sebagai anestesi yang menyeluruh9,51,53.
Reseptor opioid dijumpai di otak dan korda spinalis tempat mereka menghasilkan efek analgesia. Pada tahun 1973 tiga peneliti independen menjelaskan keberadaan reseptor opioid pada jaringan saraf dan hipotesis bahwa substansi endogen menstimulasi strukturnya (Hughes, Kosterlitz, Terenius 1973). Pada momentum ini beberapa tipe reseptor
opioid di ketahui. Terutama, mu (µ), kappa (κ), delta (δ), sigma (σ)52,53. Pada tahun 1979, dua laporan menjadi katalisator untuk mendorong beberapa penelitian tentang pemberian opioid secara intratekal. Wang dkk (1979). Melaporkan efektifitas morfin intratekal untuk menghilangkan nyeri malignan yang tak tertahankan pada 8 pasien. Behar dkk (1979), melaporkan efektifitas morfin dengan epidural pada pasien nyeri kronis. Kedua peneliti tersebut menunjukkan bahwa penyuntikan opioid intratekal sebenarnya lebih dekat kepada tempat kerja reseptor opiat9,51,53.
2.4.1. Farmakokinetik Intratekal Morfin
Farmakokinetik opioid intratekal adalah complex mengikuti model multi-kompartemen, dan ditentukan oleh sifat fisikokimia opioid dan dinamika CSF. Pada sirkulasi sistemik, perhitungan data farmakokinetik seperti volume distribusi mengasumsikan pencampuran yang memadai dan keseimbangan obat diseluruh kompartemen. Namun CSF adalah kompartemen campuran yang buruk yang dibentuk oleh gradient cephalo - caudal untuk opioid setelah diberikan ke dalam CSF lumbal9,51,53,55.
Disposisi obat setelah pemberian secara intratekal bervariasi tergantung pada kelarutan masing-masing obat dalam lemak, terutama opioid. Setelah pemberian secara intratekal, khususnya pada cairan serebrospinalis (CSF) pada cisterna lumbar, obat didistribusikan di dalam CSF. Ummenhofer dkk, melaporkan dalam sebuah percobaan mengukur konsentrasi morfin, fentanyl, sufentanyl, dan alfentanyl didalam CSF, korda spinalis, lemak epidural dan plasma pada babi yang dianestesi secara intratekal pada lumbal. Dari data mereka, mereka mengembangkan sebuah model farmakokinetik multi-compartment yang menstimulasikan farmakologi dan menjelaskan banyak karakteristik klinis opioid yang digunakan sebagai analgesia intratekal. Nasib opioid setelah
pemberian obat secara intratekal sangat kompleks. Opioid intratekal menembus korda spinalis dan duramater untuk memasuki ruang epidural. Didalam korda spinalis, mereka berikatan dengan reseptor nonspesifik didalam lapisan putih serta reseptor spesifik pada tanduk dorsal. Obat pada korda spinalis akhirnya mencapai kopartmen plasma melalui pengambilan oleh vena. Pada ruang epidural, opioid memasuki jaringan lemak dan memasuki kompartmen plasma melalui pengambilan vena. Penjumlahan dari banyak jalan untuk disposisi obat menghasilkan karakteristik klinis dari obat ini. Sejumlah obat yang diberikan secara intratekal dengan cepat beredistribusi didalam CSF; opioid di jumpai pada cisterna magna setelah pemberian secara intratekal dalam 30 menit, termasuk obat yang bersifat lipofilik seperti sufentanyl. Memang, semua opioid bergerak didalam CSF dan distribusi cepat dalam CSF sepertinya terhitung dalam jumlah yang kecil, tetapi bermakna, kejadian depresi nafas teramati secara langsung setelah penyuntikkan intratekal9,52,53.
Morfin adalah opioid hidrofilik yang sering digunakan dan diteliti secara luas pada pemberian untuk penggunaan secara intratekal. Obat ini 129-1737 kali lebih hidrofilik dibandingkan fentanyl dengan koeficien oktanol: air yang rendah (1,4), menghasilkan difusi yang lambat kedalam ruang epidural. Morfin mengikat reseptor dengan afinitas tinggi pada tempat reseptor di tanduk dorsal, tetapi memperlihatkan kapasitas yang lebih rendah terhadap sisi non-reseptor pada myelin dan lapisan putih dari korda dibandingkan dengan fentanyl. Ini menghasilkan volume distribusi yang kecil didalam korda spinalis dan bertahan dalam konsentrasi yang tinggi didalam CSF. Terbukti pada pengamatan klinis memiliki area analgesi yang luas dan kecendrungan menyebar ke
cephalad yang dapat menimbulkan depresi pernapasan lambat. Setelah pemberian morfin intratekal, konsentrasi CSF
dipertahankan dengan waktu kontak terhadap korda yang lama, diikuti oleh penurunan secara bertahap setelah 12 jam; adanya difusi lambat kedalam ruang epidural dengan konsekuensi peningkatan konsentrasi plasma yang lambat; penyebaran ke
cephalad dengan konsentrasi obat terdeteksi secepat – cepatnya 30 menit pada sistern CSF; penyebaran yang jelek dalam CSF sekitar korda dari titik penyuntikkan; dan metabolisme minimal untuk metabolit larut air dalam CSF dan sumsum tulang belakang. Radiolabelled (14C) morfin bertahan untuk 2 jam dengan hanya 4,5% dari dosis yang disuntikkan yang tersisa pada 3 jam paska penyuntikkan. Penarikan obat dari CSF difasilitasi melalui suatu sistem transport pembawa glycoprotein yang terletak pada plexus coroidalis53,54,55,57,58.
Morfin memiliki derajat ionisasi yang tinggi dan bersifat hidrofilik dan tidak menembus jaringan kaya lemak seperti yang terjadi pada fentanyl; morfin akan bertahan di CSF dalam jangka waktu yang lama. Morfin akan menyebar rostral di dalam cairan CSF melalui aliran bulk dan akan mencapai nervus trigeminalis secepat – cepatnya 3 jam setelah penyuntikkan intratekal pada relawan sehat. Penyebaran ke rostral menghasilkan depresi pernapasan tertunda. Lama kerja analgesia juga sangat dipengaruhi oleh kelarutan dalam lemak, pada obat yang bersifat hidrofilik seperti morfin relatif memiliki lama kerja yang panjang pembersihannya dari cairan serebrospinal dan jaringan spinal terjadi dalam waktu yang lama53,55,57,58.
Pergerakan cephalad opioid yang disuntikkan ke dalam CSF di timbulkan oleh:53,55,58
1. Aliran massal obat dalam arah caudal-cephalad.
2. Fluktuasi perubahan tekanan di dalam thorax sebagai hasil proses bernafas, memfasilitasi aliran cephalad dari CSF.
3. Ekspansi dan relaksasi otak, yang terjadi sebagai akibat dari siklus jantung. Hal ini membantu untuk menciptakan gerakan maju dan mundur dari CSF dengan perpindahan bersih opioid dalam arah cephalad
Gambar 5. Opioid Intratekal setelah Injeksi Lumbal CSF
2.4.2. Mekanisme Kerja Morfin dan Jenis Reseptor
Stimulus nyeri aferen berkumpul di tanduk dorsal corda spinalis, dimana neuron nociceptif utama bersinap dengan interneuron dinamis yang lebar dan neuron nociceptif urutan kedua ditraktus spinotalamikus. Agonis dari reseptor opioid membantu untuk menekan stimulus nociceptif aferen dari lokasi nyeri dengan pelepasan peptida yang berhubungan dengan jalur nyeri9,51,52,53,55,56,,57,58.
Opiod menghasilkan analgesia dengan meniru kerja pada reseptor spesifik dari peptide opioid endogen, termasuk
metenkephalin, beta-endorphin, dan dynorphin. Tiga tipe utama reseptor opioid, masing-masing dengan subtipenya, mu (µ), delta (δ), dan kappa (κ). Target opioid terpenting adalah reseptor µ (endorphin), dan opioid intratekal terlihat secara selektif memodulasi serabut C dan A dengan dampak minimal pada akson
di akar dorsal. Enkephalin adalah ligan endogen primer dari reseptor δ dan termasuk analgesia spinal. Dynorphin adalah prototype ligan untuk reseptor κ. Aktivasi reseptor κ menghasilkan analgesia spinal yang segmental dan sedasi. Beberapa campuran opioid agonis-antagonis (seperti, butorphanol) berikatan dengan κ reseptor9,51,52,53,58.
Tabel 1. Komponen Reseptor Opioid
Sifat fisikokimia opioid intratekal menentukan mula kerja, lama kerja dan potensi opioid tersebut. Kelarutan dalam lemak yang tinggi dan pKa yang rendah menghasilkan potensi opioid yang tinggi dengan mula kerja yang cepat, tetapi dengan lama kerja yang singkat. Sebaliknya dengan penurunan lipofilisitas obat akan meningkatkan lama kerja. Opioid larut lemak juga menyerupai anestesi lokal dalam hal pKa, berat molekul, dan partisi koefisien – koefisien yang dapat menjelaskan beberapa efek analgesic opioid di CSF52,53,58.
Pada PH fisiologis (7,4), kelompok opioid amin tersier terionisasi membuat mereka larut dalam air. Namun, kelompok hydroxyl pada molekul morfin yang bertanggungjawab terhadap kelarutannya yang lebih tinggi di dalam air dibandingkan dengan
opioid lain. Peningkatan kelarutan dalam air bertanggungjawab terhadap mula kerja yang lambat dan lama kerja yang panjang9,51.
Potensi opioid intratekal meningkat dengan meningkatnya hidropobisitas. Sebagai contoh, fentanyl hanya empat kali lebih kuat dibandingkan morfin ketika diberikan secara intratekal tetapi 100 kali lebih kuat setelah pemberian sistemik. Rasio potensi dosis sistemik dari opioid tidak dapat diaplikasikan terhadap obat yang sama setelah pemberian intratekal9,51,58.
Terdapat jumlah receptor opioid yang lebih besar di presinap dibandingkan dengan postsinap. Pengikatan opioid pada reseptor postsinap di tanduk dorsal menghasilkan pembukaan saluran potassium dan secara tidak langsung mengaktifkan jalur desending dari brainstem. Target lain yang mungkin pada opioid intratekal yang sedang diusulkan:53.
a. Opioid phenylpiperidine, termasuk fentanyl dan meperidine (phetidine), memperlihatkan kemiripan struktural dengan anestesi lokal. Fentanyl memperlihatkan efek anestesi lokal pada serabut saraf aferen primer sensorik C yang mungkin memfasilitasi efek analgesia.
b. Peningkatan konsentrasi adenosin di lumbosakral pada cairan serebrospinal (CSF) setelah pemberian morfin intratekal pada hewan dan manusia. Adenosin diketahui dapat membuka saluran potassium yang akan menghasilkan hiperpolarisasi serabut saraf dan menurunkan aktivitas neuronal.
c. Opioid intratekal meningkatkan pelepasan gamma amino
butyric acid (GABA) dan glycine melalui proses
calcium-independent pada saraf-saraf di tanduk dorsal. Ini akan muncul sebagai penghambat apa yang kita katakan secara intuitif sebagai damping down dari aktivitas neuronal dalam konteks efek analgesia. Sehingga dapat digambarkan bahwa opioid mungkin suatu disinhibit inhibitory phatway, sehingga
mengurangi transmisi nosiseptif. Ini memberi kita wawasan baru tentang kompleksitas mekanisme kerja opioid di tanduk dorsal.
2.4.3. Dosis Morfin Intratekal dan Penelitian Klinis
Morfin intratekal menurunkan intensitas nyeri pada saat istirahat dan saat bergerak sampai 24 jam setelah operasi ortopedi mayor dan operasi abdomen jika dikombinasi dengan lokal anestesi, dengan dosis sekurang-kurangnya 50-100 mcg, dan rekomendasi klinis tidak lebih dari 300 mcg untuk mencegah depresi pernapasan tertunda53,55,57,58.
R. Slappendel dkk (1999), melakukan penelitian tentang dosis optimal intratekal morfin pada operasi tulang panggul dengan membandingkan dosis 25 mcg, 50 mcg, 100 mcg dan 200 mcg, dan didapati bahwa dosis optimal morfin intratekal setelah operasi tulang panggul adalah 100 mcg. Pada dosis ini menghasilkan penanggulangan nyeri yang baik dan kebutuhan morfin sistemik yang minimal pada 24 jam paska bedah. Sedangkan pada dosis 200 mcg morfin intratekal tidak menghasilkan efek analgesia yang lebih baik, dengan angka kejadian gatal lebih tinggi dan hipotensi lebih sering dan berlangsung lama. Dosis morfin intratekal di bawah 100 mcg kurang efektif.
2.4.4. Efek Samping Morfin Intratekal
Efek samping dimediasi oleh reseptor opioid setelah penyuntikkan opioid intratekal lebih ringan dibandingkan pemberian opioid secara sistemik. Survey terbaru secara prospektif pada 6000 pasien melaporkan kejadian efek samping yang rendah dan kenyamanan pasien yang baik setelah pemberian opioid intratekal dosis tunggal. Efek samping opioid intratekal seperti sedasi, berkeringat,
perlambatan pengosongan lambung, retensi urin, pruritus, mual muntah, dan depresi napas53,54,55,57,58.
Mual dan Muntah
Morfin intratekal menyebabkan peningkatan muntah tergantung dosis pada sukarelawan. Namun, ketika menghadapi pasien dengan operasi yang sangat nyeri maka gambarannya menjadi kurang jelas. Beberapa penelitian temuan dosis menyelidiki efektivitas dan efek samping morfin intratekal. Kalso dkk, menemukan lebih dari 48 jam, sedikit tetapi tidak berbeda bermakna secara statistik dalam hal mual dan muntah setelah penambahan 0, 0.2, atau 0.4 mg morfin kedalam bupivakain untuk pembedahan orthopedic (40 vs 50 vs 55% masing-masing). Jacobson dkk, melaporkan tingkat PONV 60 vs 50 vs 100% setelah 0, 0.3, dan 1 mg morfin, masing-masing, digunakan pada operasi penggantian sendi. Sebuah penelitian pada 181 pasien yang terjadwal untuk transabdominal hysterectomy dengan anestesi spinal tetracain, pasien mendapatkan 0,1 mg morfin yang secara bermakna lebih memperlihatkan gejala muntah dibandingkan dosis antara 0,03 dan 0,08 mg. Weber dkk, melakukan pengamatan yang lebih luas termasuk 300 pasien yang menjalani pembedahan orthopedic mayor pada ekstremitas bawah, membandingkan bupivakain dengan bupivakain dan 0,2 mg morfin. Tidak ada perbedaan bermakna secara statistik antara kelompok berkaitan dengan perasaan atau konsumsi antiemetic (60 vs 56,6%) subyektif. Data ini menunjukkan bahwa, setidaknya dalam operasi yang lebih luas dimana efektif untuk menghilangkan rasa nyeri pada paska bedah yang masih diperbolehkan, morfin intratekal tidak berhubungan dengan tingkat yang lebih tinggi dari PONV dibanding analgesia sistemik yang berbasis opioid, terutama jika dosis yang dipilih kurang dari 0.1 mg. Penggunaan pada prosedur bedah minor belum dipelajari lebih lanjut, tetapi laporan tentang peningkatan insiden PONV setelah 0.2-1.0 mg morfin intratekal pada TURP dibandingkan larutan bebas morfin harus lebih hati-hati.
Ketika morfin ditambahkan kepada anestesi lokal untuk menghasilkan anestesi spinal pada bedah sesar, peningkatan mual muntah terlihat pada paska bedah tetapi tidak intraoperatif. Hal ini terjadi pada pengamatan menunjukkan kejadian puncak mual dan muntah antara 4 dan 6 jam setelah selesai operasi ketika morfin intratekal diberikan. Selain itu, kejadian PONV lebih tinggi setelah pemberian dosis besar morfin (0,2 atau 0,25 mg) dibandingkan dengan 0,1 mg. Cordoso dkk, menunjukkan kecendrungan kearah gejala mual dan muntah lebih rendah dengan dosis yang lebih kecil dari 0,05 dan 0,025 mg dibandingkan 0,1 mg morfin dalam sebuah penelitian pada 120 wanita hamil cukup bulan. Sebuah metaanalisis menjelaskan tentang peningkatan kejadian PONV pada penggunaan morfin53,56.
Depresi Pernapasan
Insidensi yang sesungguhnya dari depresi pernapasan tidak diketahui, suatu penelitian retrospektif besar mengutip insidensinya 0,03-7%. Sayangnya, masih kurangnya definisi yang tepat dari istilah ‘depresi napas’ pada literature. Ulasan artikel baru-baru ini pada 96 artikel yang dipublikasi dalam 40 tahun. Ko dkk, menemukan bahwa hanya 46% yang didefinisikan sebagai depresi napas dan 24% dimasukkan dalam definisi frekwensi nafas saja. Frekwensi napas dan pulse oximetri merupakan penilaian yang buruk untuk menentukan depresi napas pada periode paska operasi. Level sedasi, dan analisa gas darah yang terbaru, lebih dapat dipercaya53,54,57.
Opioid intratekal dosis tinggi yang diberikan secara keliru dapat menyebabkan episode apnoe akut dan membutuhkan naloxon dan bantuan ventilasi. namun, dosis rendah opioid lipofilik intratekal menyebabkan secepat-cepatnya (0-1 jam) depresi napas, sementara opioid yang lipofilik dapat menyebabkan early atau late (sampai 24 jam) depresi napas. Morfin menyebabkan depresi pernapasan lambat terjadi antara 3,5 dan 12 jam setelah penyuntikkan dengan puncak pada jam ke 6. Laporan pertama tahun 1979 ketika dua pasien, yang diberikan 2 dan 5 mg morfin, dirawat
di ruang perawatan intensif. Namun, pada beberapa penelitian, 20 mg morfin hiperbarik intratekal tidak berhubungan dengan depresi napas. Ini mempelihatkan tidak dapat diprediksinya komplikasi yang serius ini53,54,57.
Faktor resiko untuk munculnya depresi napas termasuk penambahan usia, penggunaan bersama dengan obat sedatif kerja panjang, ventilasi tekanan positif, dan penyakit pernapasan sebagai penyerta. Pemberian bersama analgetik opioid selama 12-24 jam setelah pemberian intratekal telah lama dikhawatirkan dapat berkembang menjadi depresi pernapasan dengan mula kerja cepat dan lambat, tetapi survey dalam skala besar telah membantah klaim ini53,54,57.
Gambar 6. Onset Depresi Pernafasan Fentanil dan Morfin
Pruritus
Pada beberapa literatur dikatakan bahwa insidensi pruritus tidak berhubungan dengan dosis dan bervariasi antara 0 sampai 100%. Pruritus lebih sering terjadi pada wanita hamil dimana hormon – hormon kehamilan dapat menyebabkan perubahan dalam populasi reseptor opioid. Pruritus mempengaruhi leher wajah dan thorax bagian atas lebih sering dengan tanpa korelasi antara intensitas gatal dan dosis opioid53,54,57.
Mekanisme yang mendasari pruritus belum sepenuhnya diketahui. Studi neurophisiologik mendefinisikan kelas baru dari serabut C yang memediasi respon pruritus yang terhubung dengan jaringan reseptor yang terletak di sentral. Jaringan ini secara alamiah tidak diketahui dengan pasti, tetapi ada banyak reseptor opioid mu dan 5-HT3 pada lokasi yang sama pada dan disekitar nukleus trigeminal53,54,57. Pemberian obat antihistamin bukan merupakan terapi kausal untuk pruritus yang disebabkan rangsangan di sentral. Namun obat ini telah memperlihatkan keberhasilan yang tinggi pada banyak pasien. Pada penelitian yang dilakukan oleh Slappendel dkk hanya satu pasien saja yang tidak efektif dengan promethazine dan membutuhkan naloxon13.
Antagonis reseptor opioid seperti Naloxon (<2 mcg/kg/jam/IV) dan Naltrexon (6-9 mg/IV) telah dihubungkan dengan keberhasilan yang besar tanpa membalikkan efek analgesia.53,58.
2.5 Klonidin
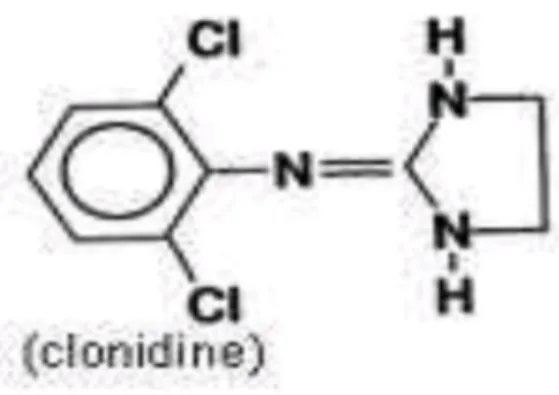
Gambar 7. Molekul Klonidin
Klonidin adalah gabungan agonis adrenoseptor alfa-1 dan alfa-2 dengan kerja lebih dominan pada alfa-2. Secara tradisional, obat ini digunakan sebagai antihipertensi semenjak akhir tahun enam puluhan. Efek utamanya adalah simpatolisis dan menurunkan pelepasan norepinefrin dengan merangsang inhibisi prejunctional adrenoseptor alfa-2. Selanjutnya digunakan sebagai sedasi, anti cemas dan sebagai analgetik yang sedang dikembangkan9,55,59.
2.5.1. Farmakokinetik dan Farmakodinamik
Klonidin memiliki nama N-(2,6-dichlorophenyl)-4,5-dihydro-1H-imidazol-2-amine dengan rumus kimia C9H9Cl2N3. Larut dalam lemak dan dapat dengan mudah menembus sawar darah otak untuk mencapai hipotalamus dan medulla ketika disuntikkan secara epidural. Obat ini merangsan alfa 2 adrenoreseptor untuk mengurangi transmisi saraf pusat pada sel saraf spinal. Menghambat substansi-P dipercaya dapat meningkatkan efek analgesia59.
Klonidin cepat diserap setelah pemberian secara oral. Dan mencapai kadar puncak di plasma dalam 60-90 menit. Ketersediaan hayati obat ini adalah 75-95%. Sekitar 20-40% obat berikatan dengan protein. 50% obat dimetabolisme di hati menjadi bentuk yang tidak aktif kemudian diekskresikan didalam urin dan waktu paruh sekitar 12-33 jam. Obat ini tidak berubah bentuk menjadi zat lain sebelum bekerja59.
2.5.2. Mekanisme Kerja
Agonis alfa-2 adrenergik menghasilkan efek klinis dengan mengikat reseptor alfa-2 yang memiliki 3 subtipe: alfa-2a, alfa-2b dan alfa-2c. reseptor alfa-2a memediasi sedasi, analgesia, dan simpatolisis9,10,28,29,59.
Reseptor alfa-2b memediasi vasokonstriksi dan mungkin mekanisme anti-shivering. Respon kejut mencerminkan aktivasi reseptor alfa-2c dan respon ini adalah respon otak dan tubuh terhadap rangsangan yang tak terduga, seperti kilatan cahaya, suara yang bising (reflek kejut akustik), atau suatu gerakan cepat disekitar wajah. Pada manusia, reaksinya termasuk berupa gerakan tubuh menghindar dari stimulus, kontraksi otot lengan dan kaki, mengedip dan juga termasuk tekanan darah, pernafasan, dan perubahan pola nafas9,10,59.
Klonidin adalah agonis adrenergik parsial selektif sentral (alfa-2; alfa-1=220; 1). Reseptor alfa-2 ditemukan banyak terdapat di pons lokus ceruleus suatu sumber persarafan yang penting pada sistem saraf simpatis pada otak tengah dan suatu modulator penting untuk kewaspadaan. Efek sedasi ditimbulkan oleh agonis alfa-2 lebih sering disebabkan inhibisi pada nukleus ini9,10,59.
Klonidin juga menstimulasi alfa-2 adrenergik saraf inhibitor pada pusat vasomotor di medulla. Sebagai hasil, terjadi penurunan aliran keluar sistem saraf simpatis dari sistem saraf pusat (CNS) ke jaringan perifer. Menyebabkan redaman aliran keluar simpatis di sentral dan perifer serta aktivasi imidazol nonadrenergik reseptor. Penurunan aktivitas sistem saraf simpatis terlihat sebagai vasodilatasi perifer dan penurunan tekanan darah sistolik, denyut jantung dan curah jantung. Kemampuan klonidin memodifikasi kanal potassium di CNS dan dengan demikian membuat membran sel hiperpolarisasi mungkin suatu mekanisme pengurangan jumlah kebutuhan obat anestesi yang dihasilkan oleh klonidin9,10,59,60.
Pemberian klonidin secara neuroaksial menghambat pelepasan substansi P di spinal dan aliran rangsangan di saraf nosiseptik yang dihasilkan oleh stimulus nyeri. Alfa-2 aferen terminal terletak di pusat dan perifer. Di lamina superfisial dari korda spinalis dan sebagian besar nukleus di batang otak. Hal ini menunjukkan bahwa efek analgetik lebih nyata setelah pemberian secara neuroaksial9,10,59.
2.5.3. Efek Samping
Pemberian klonidin mungkin berhubungan dengan mengantuk, mulut kering, bradikardi, hipotensi ortostatik dan impotensi. Pemutusan obat dapat menimbulkan rebund hipertensi dan menghasilkan krisis hipertensi. Oleh karena itu klonidin harus
dilanjutkan selama periode perioperatif. Klonidin dapat meningkatkan kadar gula darah dengan menghambat pelepasan insulin9,10,59.
2.5.4. Klonidin Sebagai Adjuvan Regional Anestesi
Klonidin sebagai agonis α2 adrenergik sentral juga menghambat rangsangan nosiseptif dengan mengaktifkan α2 adrenoseptor pada tanduk dorsal dikorda spinalis. Jenis reseptor ini terletak pada terminal afferent primer ( pada perifer dan ujung spinal ), pada sel saraf di lamina superficial korda spinalis dan didalam beberapa nukleus batang otak yang menimbulkan analgesia. Klonidin meningkatkan dan memperpanjang blok sensorik dan motorik dari lokal anestesi pada epidural atau blok saraf perifer. Postulat untuk mekanisme ini bahwa klonidin menghambat konduksi serabut C dan A delta dan meningkatkan konduksi kalium pada sel saraf yang diisolasi secara in vitro, dengan demikian mengintensifkan blok konduksi. Kedua, klonidin menyebabkan vasokonstiksi lokal pada penggunaan klinis, sehingga mengurangi penyerapan oleh pembuluh darah zat anestesi lokal dari sekitar struktur saraf. Agonis α2 adrenergik juga meningkatkan analgesia dari opioid intratekal dengan berinteraksi pada pre dan paska sinap di korda spinalis. Pemberian klonidin secara neuroaksial juga memiliki efek lokal pada saraf simpatis di korda spinalis. Penggunaan klinis klonidin intratekal terhambat oleh efek samping sedasi, bradikardi, dan hipotensi; dimana klonidin dosis sampai 150 mcg ditambahkan sebagai blok pleksus dapat memperpanjang analgesia tanpa meningkatkan efek samping9,10,28,29,60.
Suatu uji coba oleh Wolf dengan rancangan untuk menilai efek analgesia seperti zat anestesi lokal pada klonidin di sel saraf tanduk dorsal superficial. Lamina superficial terdiri dari struktur penting untuk transmisi nyeri, menerima banyak masukan sensorik
primer nyeri dari serabut A delta dan C. Telah terbukti bahwa klonidin menekan lanjutan rangsangan potensial aksi pada sel saraf di tanduk dorsal spinal, dan bahwa klonidin juga memberi kontribusi pada analgesia selama anestesi lokal9,10.
Dobrydnjov melakukan penelitian RCT double-blinded tentang analgesia pada pasien yang mendapatkan anestesi lokal dengan penambahan klonidin dengan anestesi kombinasi spinal-epidural pada operasi arthroplasti sendi panggul. Klonidin intratekal dosis rendah menghasilkan kualitas anestesi yang lebih baik dan analgesia paska bedah yang lebih lama. Penambahan intratekal klonidin 15 mcg ke bupivakain pada anestesi kombinasi spinal epidural menghasilkan kualitas anestesi yang lebih tinggi dan lama analgesia yang lebih panjang dibandingkan bupivakain tunggal. Perlu dilakukan penelitian lebih lanjut untuk mencari dosis yang efektif dengan efek samping yang minimal9,10,28,29.
Pada suatu tinjauan sistematik dengan uji secara acak oleh Elia, mempelajari tentang klonidin sebagai adjuvan anestesi lokal secara intratekal pada pembedahan. Disimpulkan, bahwa penambahan intratekal klonidin untuk operasi meningkatkan lama blok motorik, meningkatkan analgesia intra operatif dan menunda penurunan blok sensorik serta waktu membutuhkan analgetik pertama. Beberapa penelitian melaporkan efek obat ini tergantung pada dosis, beberapa penelitian lain menyatakan tidak ada hubungan efek dengan dosis obat. Efek samping yang sering dijumpai intra operatif adalah hipotensi9,10.
2.6 Nyeri
2.6.1 Fisiologi Nyeri
Definisi nyeri berdasarkan International Association for the Study
of Pain (IASP, 1979) adalah pengalaman sensori dan emosi yang tidak menyenangkan dimana berhubungan dengan kerusakan
jaringan atau potensial terjadi kerusakan jaringan. Sebagai mana diketahui bahwa nyeri tidaklah selalu berhubungan dengan derajat kerusakan jaringan yang dijumpai. Namun nyeri bersifat individual yang dipengaruhi oleh genetik, latar belakang kultural, umur dan jenis kelamin. Kegagalan dalam menilai faktor kompleks nyeri dan hanya bergantung pada pemeriksaan fisik sepenuhnya serta tes laboratorium mengarahkan kita pada kesalahpahaman dan terapi yang tidak adekuat terhadap nyeri, terutama pada pasien-pasien dengan resiko tinggi seperti orang tua, anak-anak dan pasien dengan gangguan komunikasi5,6,61,62,63.
2.6.2 MEKANISME NYERI
Nyeri merupakan suatu bentuk peringatan akan adanya bahaya kerusakan jaringan. Pengalaman sensoris pada nyeri akut disebabkan oleh stimulus noksius yang diperantarai oleh sistem sensorik nosiseptif. Sistem ini berjalan mulai dari perifer melalui medulla spinalis, batang otak, thalamus dan korteks serebri. Apabila telah terjadi kerusakan jaringan, maka sistem nosiseptif akan bergeser fungsinya dari fungsi protektif menjadi fungsi yang membantu perbaikan jaringan yang rusak63,67,.
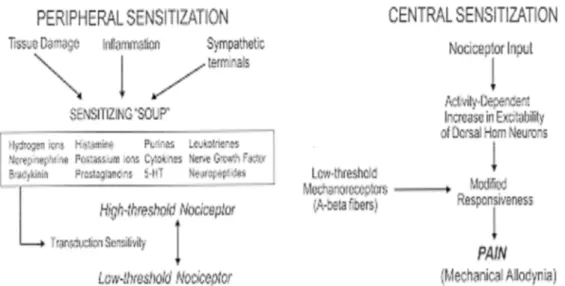
Sensitisasi Perifer
Cedera atau inflamasi jaringan akan menyebabkan munculnya perubahan lingkungan kimiawi pada akhir nosiseptor. Sel yang rusak akan melepaskan komponen intraselulernya seperti adenosine trifosfat, ion K+, pH menurun, sel inflamasi akan menghasilkan sitokin, chemokine dan
growth factor. Beberapa komponen diatas akan langsung merangsang nosiseptor (nociceptor activators) dan komponen lainnya akan menyebabkan nosiseptor menjadi lebih hipersensitif terhadap rangsangan berikutnya (nociceptor sensitizers)67,68.
Komponen sensitisasi, misalnya prostaglandin E2 akan mereduksi ambang aktivasi nosiseptor dan meningkatkan kepekaan ujung saraf
dengan cara berikatan pada reseptor spesifik di nosiseptor. Berbagai komponen yang menyebabkan sensitisasi akan muncul secara bersamaan, penghambatan hanya pada salah satu substansi kimia tersebut tidak akan menghilangkan sensitisasi perifer. Sensitisasi perifer akan menurunkan ambang rangsang dan berperan dalam meningkatkan sensitifitas nyeri di tempat cedera atau inflamasi67,68.
Gambar 8. Mekanisme sensitisasi perifer dan sensitisasi sentral68.
Sensitisasi Sentral
Sama halnya dengan sistem nosiseptor perifer, maka transmisi nosiseptor di sentral juga dapat mengalami sensitisasi. Sensitisasi sentral dan perifer bertanggung jawab terhadap munculnya hipersensitivitas nyeri setelah cidera. Sensitisasi sentral memfasilitasi dan memperkuat transfer sinaptik dari nosiseptor ke neuron kornu dorsalis. Pada awalnya proses ini dipacu oleh input nosiseptor ke medulla spinalis (activity dependent), kemudian terjadi perubahan molekuler neuron (transcription dependent)67.
2.6.3 NOSISEPTOR (RESEPTOR NYERI)
Nosiseptor adalah reseptor ujung saraf bebas yang ada di kulit, otot, persendian, viseral dan vaskular. Nosiseptor-nosiseptor ini
bertanggung jawab terhadap kehadiran stimulus noksius yang berasal dari kimia, suhu (panas, dingin), atau perubahan mekanikal. Pada jaringan normal, nosiseptor tidak aktif sampai adanya stimulus yang memiliki energi yang cukup untuk melampaui ambang batas stimulus (resting). Nosiseptor mencegah perambatan sinyal acak (skrining fungsi) ke SSP untuk interpretasi nyeri6,63,69,70.
Nosiseptor viseral, tidak seperti nosiseptor kutaneus, tidak didesain hanya sebagai reseptor nyeri karena organ dalam jarang terpapar pada keadaan yang potensial merusak. Banyak stimulus yang sifatnya merusak (memotong, membakar, kepitan) tidak menghasilkan nyeri bila dilakukan pada struktur viseralis. Selain itu inflamasi, iskemia, regangan mesenterik, dilatasi, atau spasme viseralis bisa menyebabkan spasme berat. Stimulus ini biasanya dihubungkan dengan proses patologis, dan nyeri yang dicetuskan untuk mempertahankan fungsi6,63,70.
2.6.4 PERJALANAN NYERI (NOCICEPTIVE PATHWAY)
Perjalanan nyeri termasuk suatu rangkaian proses neurofisiologis kompleks yang disebut sebagai nosiseptif (nociception) yang merefleksikan empat proses komponen yang nyata yaitu transduksi, transmisi, modulasi dan persepsi, dimana terjadinya stimuli yang kuat diperifer sampai dirasakannya nyeri disusunan saraf pusat (cortex cerebri)4,65,71.
Proses Transduksi
Proses dimana stimulus noksius diubah ke impuls elektrikal pada ujung saraf. Suatu stimuli kuat (noxion stimuli) seperti tekanan fisik kimia, suhu dirubah menjadi suatu aktifitas listrik yang akan diterima ujung – ujung saraf perifer (nerve ending) atau organ-organ tubuh (reseptor meisneri, merkel, corpusculum paccini, golgi mazoni). Kerusakan jaringan karena trauma baik trauma
pembedahan atau trauma lainnya menyebabkan sintesa prostaglandin, dimana prostaglandin inilah yang akan menyebabkan sensitisasi dari reseptor-reseptor nosiseptif dan dikeluarkannya zat-zat mediator nyeri seperti histamin, serotonin yang akan menimbulkan sensasi nyeri. Keadaan ini dikenal sebagai sensitisasi perifer4,65,69,71.
Proses Transmisi
Proses penyaluran impuls melalui saraf sensori sebagai lanjutan proses transduksi melalui serabut A-delta dan serabut C dari perifer ke medulla spinalis, dimana impuls tersebut mengalami modulasi sebelum diteruskan ke thalamus oleh tractus spinothalamikus dan sebagian ke traktus spinoretikularis. Traktus spinoretikularis terutama membawa rangsangan dari organ-organ yang lebih dalam dan viseral serta berhubungan dengan nyeri yang lebih difus dan melibatkan emosi. Selain itu juga serabut-serabut saraf disini mempunyai sinaps interneuron dengan saraf-saraf berdiameter besar dan bermielin. Selanjutnya impuls disalurkan ke thalamus dan somatosensoris di cortek cerebri dan dirasakan sebagai persepsi nyeri4,65,69,71.
Proses Modulasi
Proses perubahan transmisi nyeri yang terjadi disusunan saraf pusat (medulla spinalis dan otak). Proses terjadinya interaksi antara sistem analgesik endogen yang dihasilkan oleh tubuh kita dengan input nyeri yang masuk ke kornu posterior medulla spinalis merupakan proses assenden yang dikontrol oleh otak. Analgesik endogen (enkefalin, endorphin, serotonin, noradrenalin) dapat menekan impuls nyeri pada kornu posterior medulla spinalis. Dimana kornu posterior sebagai pintu dapat terbuka dan tertutup untuk menyalurkan impuls nyeri untuk analgesik endogen tersebut. Inilah yang menyebabkan persepsi nyeri sangat subjektif pada setiap orang4,65,69,71.
Persepsi
Hasil akhir dari proses interaksi yang kompleks dari proses tranduksi, transmisi dan modulasi yang pada akhirnya akan menghasilkan suatu proses subjektif yang dikenal sebagai persepsi nyeri, yang diperkirakan terjadi pada thalamus dengan korteks sebagai diskriminasi dari sensorik4,65,69,71.
Gambar 9. Pain Pathway40.
2.6.5 PENILAIAN NYERI
Ada beberapa skala penilaian nyeri pada pasien sekarang ini:4,5,72-75 1. Wong-Baker Faces Pain Rating Scale
Skala dengan enam gambar wajah dengan ekspresi yang berbeda, dimulai dari senyuman sampai menangis
karena kesakitan. Skala ini berguna pada pasien dengan gangguan komunikasi, seperti anak-anak, orang tua, pasien yang kebingungan atau pada pasien yang tidak mengerti dengan bahasa lokal setempat.
Gambar 10. Wong Baker Faces Pain Rating Scale
2. Verbal Rating Scale (VRS)
Pasien ditanyakan tentang derajat nyeri yang dirasakan berdasarkan skala lima poin ; tidak nyeri, ringan, sedang, berat dan sangat berat.
Gambar 11. Verbal Rating Scale
3. Numerical Rating Scale (NRS)
Pertama sekali dikemukakan oleh Downie dkk pada tahun 1978, dimana pasien ditanyakan tentang derajat nyeri yang dirasakan dengan menunjukkan angka 0 – 5 atau 0 – 10, dimana angka 0 menunjukkan tidak ada