45
SINTESIS TiO
2/Ti TERDOPING LOGAM Fe
3+MENGGUNAKAN
METODE ANODISASI DENGAN BANTUAN SINAR TAMPAK
Aldrianti1*, Anthoni B. Aritonang1, Intan Syahbanu1
1Program Studi Kimia, Fakultas MIPA, Universitas Tanjungpura, Jl. Prof. Dr. H. Hadari Nawawi, Pontianak
*e-mail: [email protected]
ABSTRAK
Aktifitas fotokatalisis TiO2 dapat ditingkatkan dengan menggeser daerah serapan sinar UV ke daerah sinar tampak. Salah satu upaya untuk meningkatkan aktifitas fotokatalis TiO2 dengan penambahan dopan Fe3+. Penelitian ini bertujuan untuk mengetahui pengaruh penambahan dopan Fe3+ terhadap gugus fungsi, ukuran kristal, dan energi band gap. Metode yang digunakan adalah metode anodisasi menggunakan tegangan 40 V selama 1 jam dan dilakukan proses kalsinasi pada suhu 450oC selama 3 jam. Konsentrasi dopan Fe3+ yang digunakan sebesar 0,3%; 0,4%; dan 0,5% (b/v). Fotokatalis Fe-TiO2/Ti yang dihasilkan dilakukan uji aktivitas terhadap degradasi zat warna metilen biru dengan bantuan sinar tampak. Metilen biru divariasikan pada pH 9, 10, 11, 12 dan 13. Hasil karakterisasi FTIR menunjukkan Fe-TiO2/Ti 0,3% (b/v) memiliki vibrasi ulur gugus fungsi -OH 3399,68 cm-1 dan vibrasi ulur gugus fungsi Ti-O-Ti atau Ti-O 685,72 cm-1 dan 453,29 cm-1. Difraktogram XRD menunjukkan struktur fasa anatase dengan ukuran kristalit sebesar 124,58 nm. Hasil karakterisasi UV-Vis/DRS menunjukkan energi band gap TiO2 Degussa P25, TiO2/Ti, dan Fe-TiO2/Ti sebesar 3,22 eV; 3,16 eV; dan 2,91 eV. Hal ini menunjukkan bahwa dopan Fe3+ pada TiO
2/Ti mempengaruhi nilai energi band gap.
Kata Kunci: anodisasi, fotokatalis Fe-TiO2/Ti, metilen biru, titanium dioksida
PENDAHULUAN
Titanium dioksida (TiO2) adalah salah satu material semikonduktor yang dapat diaplikasikan sebagai fotokatalis. Fotokatalis TiO2 secara alami memiliki keunggulan diantaranya tidak beracun, harganya yang relatif murah, dan kemampuan menyerap cahaya sangat tinggi (Habib
et al., 2013). Secara alami TiO2 memiliki tiga tipe struktur kristal yaitu rutile, anatase, dan brookite.
Anatase memiliki sifat yang lebih stabil dibandingkan brookite. Struktur kristal TiO2 yang sering digunakan ialah anatase 3,0-3,2 eV (Linsebigler et al., 1995). Akan tetapi TiO2 masih memiliki kekurangan seperti energi band gap yang masih cukup besar yaitu 3,0-3,2 eV. Hal ini menyebabkan TiO2 hanya mampu bekerja dibawah sinar UV. Sinar UV memiliki panjang gelombang sebesar 190-400 nm, sedangkan sinar tampak memiliki panjang gelombang sebesar 400-700 nm (Sastrohamidjojo, 1991).
Sinar UV yang dihasilkan matahari dan sampai ke bumi hanya sebesar 5%, sedangkan sinar tampak sebesar 45% (Karim, et al., 2016). Oleh karena itu, perlu dilakukan modifikasi struktur TiO2 agar dapat meningkatkan aktivitasnya hingga ke daerah sinar tampak. Salah satu cara yang dapat dilakukan ialah dengan melakukan dopan kation logam (Dastan et al., 2014). Dopan kation logam yang berpotensi seperti Fe3+. Kation Fe3+ memiliki kemiripan jari-jari dengan Ti4+sebesar 0,55 Å, sedangkan kation Ti4+ memiliki jari-jari sebesar 0,61 Å. Sehingga kation Fe3+ dapat mengganti Ti4+ dalam struktur kristalnya dan mampu memperkecil energi band gap, serta aktivitasnya dapat bergeser ke daerah sinar tampak (Atkins et al., 2010). Menurut Ghorbanpour dan Feizi (2019) bahwa TiO2 terdoping Fe3+ menunjukkan serapan terpanjang sebesar 424,35 nm dengan celah pita sebesar 2,92 eV.
Fotokatalisis adalah proses reaksi kimia yang dibantu oleh adanya cahaya dan katalis, dimana reaksinya melibatkan pasangan photoelectron (e-) dan photohole (h+) (Arutanti et al., 2009). Spesi
photohole (h+) yang terbentuk akan mengoksidasi air atau ion OH- menghasilkan radikal hidroksil, sedangkan photoelectron (e-) akan mereduksi molekul O
2 yang teradsorpsi di permukaan yang membentuk radikal peroksida (O2-). Radikal hidroksil merupakan oksidator kuat yang dapat
46
et al., 1995). Berbagai metode dapat dilakukan untuk menumbuhkan kristal TiO2 salah satunya dengan metode anodisasi.
Pada penelitian ini dilakukan sintesis TiO2/Ti terdoping Fe3+ berupa lapisan oksida pada permukaan plat Ti menggunakan metode anodisasi, karena memiliki beberapa kelebihan diantaranya alat yang digunakan relatif sederhana, membutuhkan biaya yang relatif murah, dan menghasilkan morfologi berupa nanotube (Aritonang et al., 2018; Rahman et al., 2016). Dopan yang digunakan pada penelitian ini berupa kation Fe3+ dari Fe(NO
3)3.9H2O dengan variasi konsentrasi 0,3%; 0,4%; dan 0,5% (b/v). Fotokatalis Fe-TiO2/Ti yang dihasilkan kemudian dilakukan uji aktivitas fotokatalisis terhadap degradasi metilen biru dengan bantuan sinar tampak dan hasil sintesis dilakukan analisis menggunakan Fourier Transform Infrared (FTIR), Ultraviolet-Visible Diffuse Reflectance Spectrophotometry (UV-Vis/DRS), X-Ray Diffraction (XRD).
METODOLOGI PENELITIAN Alat dan Bahan
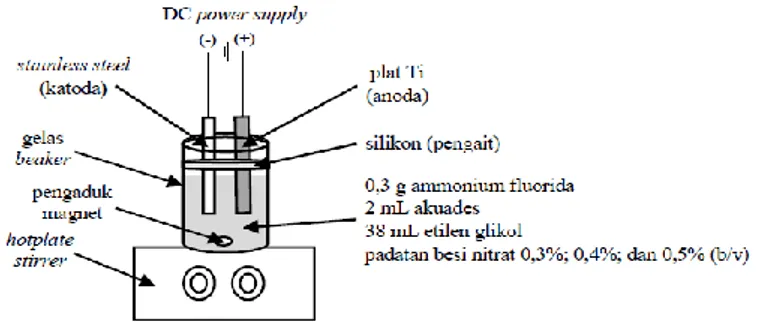
Alat yang digunakan pada penelitian ini adalah abrasive paper batang pengaduk, botol semprot, cawan porselen, DC power supply (KXN-6010D), gelas beaker, gunting, hotplate stirrer, kaca arloji, labu ukur, lampu Light Emitting Diode (LED flood light 20W Watt BE-6205, warm white), neraca analitik, pengaduk magnet, pinset, pipet tetes, pipet ukur, stopwatch, spatula, sonikasi (Branson 3510 DTH ultrasonic cleaner), tabung kuarsa, tanur, solar power meter, spektrofotometer Fourier Transformed Infrared (FTIR) shimadzu IR Prestige-21, spektrofotometer
Ultraviolet-Visible (UV-Vis) Shimadzu UV-1280, Ultraviolet-Visible Diffuse Reflectance Spectrophotometry (UV-Vis/DRS) Agilent Cary 60, dan X-Ray Diffraction (XRD) Shimadzu 7000.
Bahan yang digunakan pada penelitian ini adalah akuades, ammonium fluorida (NH4F) (merk), aseton (C3H6O) (merk), besi (III) nitrat [Fe(NO3)3.9H2O] (merk), etanol (C2H5) (merk), etilen glikol (C2H6O2) (merk), indikator universal, abrasive paper, metilen biru (C16H18ClN3S), natrium hidroksida (NaOH) (merk), stainless steel (504), dan plat Ti (Beijing steel, ketebalan 0,2 μm). Prosedur Kerja
TiO2/Ti terdoping Fe3+ dengan metode anodisasi
Preparasi plat Ti (99,6% dan ketebalan 0,3 µm) yang telah dimodifikasi. Plat dipotong dengan ukuran 4,5 x 1,5 cm dan diamplas menggunakan abrasive paper hingga permukaannya bersih dan mengkilap. Setelah proses pengamplasan dilakukan plat Ti dicuci menggunakan air dan deterjen. Kemudian plat Ti dibersihkan lagi dengan proses sonikasi berturut-turut dalam 10 mL larutan terdiri dari aseton, etanol, dan akuades masing-masing larutan dilakukan selama 10 menit, dikeringanginkan pada suhu ruang (Aritonang et al., 2018).
SintesisTiO2/Ti terdoping Fe3+dimasukkan ke dalam gelas beaker yang berisi larutan elektrolit terdiri dari etilen glikol dan akuades. Kemudian ditambahkan 0,3 g NH4F dan serbuk besi nitrat atau Fe(NO3)3 dengan variasi konsentrasi dopan Fe3+ 0,3%; 0,4%; dan 0,5% (b/v) terhadap larutan elektrolit. Proses anodisasi dilakukan dengan menempatkan plat Ti sebagai anoda dan
stainless steel sebagai katoda menggunakan pengaduk magnet dan potensial sebesar 40 V. Selanjutnya dihubungkan dengan DC power supply. Proses anodisasi dengan waktu maksimum selama 1 jam, dicuci dengan akuades dan dikalsinasi pada suhu 450oC selama 3 jam (Aritonang
et al., 2018). Skema reaktor proses anodisasi sintesis TiO2/Ti terdoping Fe3+ dapat dilihat pada Gambar 1.
47
HASIL DAN PEMBAHASAN
TiO2/Ti Terdoping Fe3+ dengan Metode Anodisasi
Sintesis TiO2 dilakukan dengan metode anodisasi untuk menghasilkan lapisan TiO2 yang tumbuh di atas plat logam Ti. Plat logam Ti digunakan dengan kemurnian 99,6% dan ketebalan 0,3 μm yang berfungsi sebagai perkusor dan matriks pendukung (Mohamed dan Rohani, 2011). Plat Tidipotong dengan ukuran 4,5 x 1,5 cm dan diamplas menggunakan abrasive paper
bertujuan untuk menghaluskan permukaannya supaya bersih dan mengkilat. Plat yang sudah diamplas kemudian dicuci menggunakan akuades dan deterjen bertujuan untuk plat TiO2 bebas dari kontaminasi dan menghilangkan zat pengotor.
Plat Ti yang sudah bersih,dilakukan proses sonikasi dalam pelarut aseton, etanol, dan akuades masing-masing selama 10 menit untuk membersihkan pengotor yang terdapat dipermukaan dan di dalam pori-pori plat Ti berdasarkan sifat kepolarannya dari yang bersifat polar, nonpolar, dan semipolar seperti lemak, debu, dan sebagainya. Permukaan plat Ti yang mengkilat dan halus menandakan bahwa plat tersebut telah bersih dan homogen, sehingga dapat digunakan dalam proses anodisasi untuk menghasilkan TiO2 yang merata pada permukaan plat Ti.
Sintesis TiO2/Ti terdoping besi nitrat dengan metode anodisasi. Proses anodisasi pada plat logam Ti menggunakan dua elektroda yang dimasukkan ke dalam larutan elektrolit yang terdiri dari NH4F dalam pelarut etilen glikol dan variasi serbuk besi nitrat sebanyak 0,12 g; 0,16 g dan 0,2 g. Peralatan DC power supply arus yang digunakan untuk menyediakan potensial yang konstan pada 40 V (Aritonang et al., 2018). Besar potensial berpengaruh terhadap ukuran diameter dan panjang tube yang dihasilkan. Potensial anodisasi yang besar akan mempercepat proses oksidasi plat Ti dan disolusi kimia, sehingga dapat memperbesar ukuran nanotube
sebelum tercapai kesetimbangan (Hassan et al., 2009). Potensial anodisasi pada 40V digunakan karena pembentukan nanotube menggunakan larutan etilen glikol optimal pada potensial listrik 20-65 V (Ratnawati dan Slamet, 2012).
Elektroda yang digunakan yaitu plat logam Ti dan plat logam stainless steel, plat logam Ti berfungsi sebagai anoda sedangkan plat logam stailess steel sebagai katoda (Misriyani et al., 2017). Lapisan oksida TiO2 akan terbentuk ketika Ti teroksidasi saat potensial listrik dihidupkan, sedangkan pada plat logam stainless steel terbentuk gelembung gas H2. Larutan elektrolit yang digunakan mengandung ion flourida dalam pelarut etilen glikol (Aritonang et al., 2018). Pemilihan etilen glikol sebagai pelarut karena memiliki viskositas sebesar (1,61 x 10-2 Ns/m) sehingga memudahkan ion-ion berdifusi dalam larutan (Dumitru et al., 2015).
Larutan elektrolit yang viskositasnya tidak terlalu tinggi dapat menghambat mobilitas ion flourida untuk mengurangi disolusi kimia dalam proses pembentukan lapisan TiO2, sehingga dapat menghasilkan tube TiO2 yang panjang dengan diameter yang kecil (Ratnawati dan Slamet, 2012). Penggunaan larutan etilen glikolmemerlukan pengadukan untuk mempercepat proses anodisasi. Proses pengadukan dibantu menggunakan magnetic stirrer untuk meningkatkan mobilitas ion dalam larutan elektrolit sehingga mempercepat pembentukan lapisan oksida Ti(OH)n (Mohapatra et al., 2007).
Pelarutan lapisan oksida dalam proses anodisasi dipengaruhi oleh banyaknya kandungan air dan ion flourida yang terdapat dalam larutan elektrolit. Penggunaan NH4F sebagai penyedia ion flourida sebanyak 0,3 g dan akuades sebanyak 2 mL agar terjadi kompetisi pembentukan lapisan oksida dan disolusi kimia sehingga pembentukan nanotube dapat diamati. Selama proses anodisasi, ion flourida akan terus merusak lapisan oksida pada permukaan Ti yang mengakibatkan terbentuknya pori pada lapisan oksida. Lapisan oksida yang mengalami disolusi akan berikatan dengan ion flourida berlebih dalam larutan elektrolit membentuk senyawa [TiF6]-2 yang mudah larut dalam air, sehingga kandungan air dalam larutan elektrolit rendah maka dapat menurunkan disolusi lapisan oksida oleh ion flor (Roy et al., 2011). Dalam larutan elektrolit, NH4F berperan sebagai sumber ion F- yang berperan dalam mendesolusi permukaan TiO
2 dan pembentukan tube. Adapun reaksi yang terjadi sebagai berikut (Misriyani et al., 2015):
48
permukaan plat Ti. Tahap awal pembentukan lapisan tipis oksida TiO2 terjadi pada titanium mnginduksi reaksi oksidasi pada anoda Ti dan reduksi pada katoda stainless steel. Reaksi yang terjadi pada katoda dan anoda sebagai berikut (Yoriya, 2007).
Reaksi katoda: 2H2O (l) + 2e- → H2(g) + 2OH-(aq) Reaksi anoda: Ti (s) + 2H2O (l) → TiO2(s) + 4H+(g) + 4e-
Reaksi oksidasi Ti terjadi pada anoda sehingga membentuk lapisan oksida TiO2, sedangkan pada katoda terjadi reduksi air melepas gas H2, dibuktikan dengan munculnya gelembung gas disekitar
stainless steel selama proses sintesis. Hasil Plat Fe-Ti(OH)n dicuci dengan akuades bertujuan untuk membersihkannya dari sisa-sisa larutan elektrolit sebelum dilakukan proses kalsinasi. Fe-Ti(OH)n amorf yang dihasilkan secara visual berwarna abu-abu muda dengan permukaannya yang homogen.sintesis Ti(OH)n dan Fe-Ti(OH)namorf ditunjukkan pada Gambar 2 berikut ini.
(a)
(b)
(c)
(d)
Gambar 2. Plat Ti setelah proses anodisasi Ti(OH)n (a), dan Fe-Ti(OH)n 0,3% (b/v) (b), 0,4% (b/v) (c), dan 0,5% (b/v) (d)
Lapisan oksida yang terbentuk pada Ti(OH)n dan Fe-Ti(OH)n amorf, kemudian dilakukan proses kalsinasi pada suhu 450oC selama 3 jam yang bertujuan untuk memperoleh kristal
anatase serta menguapkan sisa-sisa pelarut yang teradsorpsi pada permukaan lapisan oksida. Ketika suhu tanur diturunkan dari 450oC-30oC, maka akan terjadi kompetisi antara kation Ti4+ dan kation Fe3+ saling berikatan dengan atom O, sehingga terjadi pertumbuhan kristal secara TiO2/Ti (Aritonang, et al., 2018). Proses kondensasi terjadi ketika penurunan suhu tanur, dapat terjadi penyisipan atau berikatan antara kation Fe3+ pada struktur TiO
2. Selama proses kondensasi berlangsung, dopan Fe3+ ini diharapkan berikatan pada kisi TiO
2 sehingga terbentuk kristal Fe-TiO2/Ti. Dopan Fe3+ yang berikatan pada kisi TiO2 mampu memperkecil energi band
gap. Hasil plat Fe-TiO2/Tikalsinasi mengalami perubahan warna dari bentuk amorf, yaitu dari berwarna abu-abu muda menjadi abu-abu gelap. Kemudian dilakukan uji aktivitas fotokatalisis terhadap degradasi dengan bantuan sinar tampak menggunakan lampu LED 20W Watt. Hasil kalsinasi Ti(OH)n dan Fe-Ti(OH)n amorf dapat dilihat pada Gambar 3 sebagai berikut.
Gambar 3. Plat Ti setelah di kalsinasi Ti(OH)n (a), dan Fe-Ti(OH)n 0,3% (b/v) (b), 0,4% (b/v) (c), dan 0,5% (b/v) (d)
(a)
(b)
(c)
(d)
Plat Ti Lapisan oksida padapermukaan Ti dalam bentuk amorf Plat Ti Lapisan oksida pada permukaan Ti setelah kalsinasi49
Penentuan Gugus Fungsi pada TiO2/Ti dan Fe-TiO2/Ti
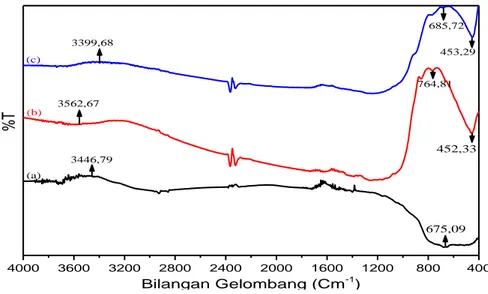
Karakterisasi menggunakan FTIR dilakukan untuk mengetahui ikatan kimia Ti-O yang terdapat dalam material hasil sintesis. Karakterisasi FTIR menggunakan spektroskopi inframerah pada rentang bilangan gelombang 4000-400 cm-1. Hasil karakterisasi menggunakan FTIR pada (a) TiO2 Degussa P25, (b) TiO2/Ti, dan (c) Fe-TiO2/Ti diperoleh spektrum pada Gambar 4.
Gambar 4. Perbandingan spektra FTIR TiO2 Degussa P25 (a), TiO2/Ti (b), dan Fe-TiO2/Ti (c)
Berdasarkan Gambar 3 dapat diketahui adanya serapan pada bilangan gelombang 685,72 cm -1 dan 453,29 cm-1 merupakan vibrasi Ti-O-Ti atau Ti-O. Hasil sesuai dengan penelitian yang telah dilakukan Pratibha, et al. (2018) yaitu vibrasi Ti-O teridentifikasi pada bilangan gelombang 400-850 cm-1. Serapan pada bilangan gelombang 400-700 cm-1 mengalami pergeseran ketika ditambahkan dopan Fe3+. Hal ini menunjukkan bahwa ikatan senyawa Ti-O atau Ti-O-Ti akan melemah pada saat penambahan dopan Fe3+ pada struktur kristal TiO
2. Spektrum FTIR pada bilangan gelombang 2317,47 cm-1 (b) dan (c) terdapat puncak kecil yang menunjukkan adanya molekul H2O yang teradsorpsi pada permukaan TiO2. Selain itu, munculnya serapan bilangan gelombang pada 3399,68 cm-1 terbentuknya ikatan -OH (vibrasi ulur) dengan signal kuat. Pada penelitian ini tidak muncul serapan baru pada bilangan gelombang 2200 cm-1, karena menurut Luu, et al. (2010) menyatakan bahwa Ti-O-Fe mucul pada bilangan gelombang 2200 cm-1, sehingga dapat disimpulkan bahwa secara fisik Fe hanya bisa menyisip pada struktur TiO2.
Penentuan Nilai Energi Celah Pita
Karakterisasi menggunakan spektrofotometer UV-Vis/DRS dilakukan untuk mengetahui besar energi band gap TiO2 Degussa P25, TiO2/Ti, dan Fe-TiO2/Ti pada panjang gelombang 200-800 nm. Perhitungan energi band gap dilakukan dengan menggunakan persamaan Tauc dan fungsi reflektansi disubstitusikan dalam koefisien Kubelka-Munk, sehingga diperoleh grafik hubungan antara F(R) vs hv seperti pada Gambar 5.
4000 3600 3200 2800 2400 2000 1600 1200 800 400 (b) 453,29 685,72 452,33 764,81 3446,79 3562,67
%T
Bilangan Gelombang (Cm-1 ) 3399,68 (c) (a) 675,0950
(a) TiO
2Degussa P25
(b) TiO
2/Ti
(c) Fe-TiO
2/Ti
Gambar 5.Perbandingan spektra UV-Vis DRS fotokatalis TiO2 Degussa P25 (kontrol) (a),TiO2/Ti (b), dan Fe-TiO2/Ti (c)
Berdasarkan Gambar 4.8 persamaan garis linier (a) TiO2 Degussa P25 y = 7,5379x – 24,271 (b) TiO2/Ti y = 2,3153x – 7,3106 (c) Fe-TiO2/Ti y = 1,1844x – 3,4522. Perpotongan garis lurus yang ditarik memotong sumbu x pada kurva saat F(R) sama dengan nol memberikan nilai band gap TiO2 Degussa P25, TiO2/Ti, dan Fe-TiO2/Ti sebesar 3,22 eV; 3,16 eV; dan 2,91 eV yang tergolong fasa anatase. Hasil ini sesuai dengan rentang nilai band gap TiO2/Ti yaitu 3,0-4,0 eV (Ma et al., 2015). Material anatase memiliki energi band gap sebesar 3,2-3,3 eV (Linsebigler et al., 1995), sedangkan fasa rutile sebesar 3,0 eV (Yao et al., 2009)
Penentuan Karakteristik Struktur Kristal TiO2
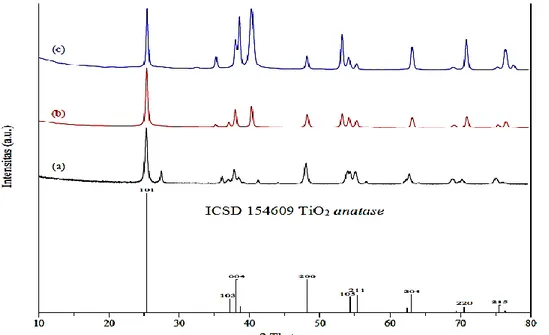
Analisis menggunakan XRD bertujuan untuk melihat derajat kristalinitas dan menentukan bentuk kristal yang dihasilkan. Analisis XRD dilakukan terhadap TiO2 Degussa P25 (sebagai kontrol), TiO2/Ti, dan Fe-TiO2/Ti hasil sintesis. Karakterisasi TiO2/Ti diobservasi dengan sinar X dari logam tembaga (Cu) dengan panjang gelombang (λ) sebesar 0,15406 nm. Hasil analisis menunjukkan munculnya puncak-puncak kristalin yang ditampilkan pada Gambar 5.
2,8 2,9 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 0,0 0,3 0,6 0,9 1,2 1,5 1,8 2,1 F(R) E 2,8 2,9 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 0,6 1,2 1,8 2,4 3,0 F(R) E 2,8 2,9 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 0,0 0,3 0,6 0,9 1,2 1,5 1,8 2,1 E F(R)
51
Gambar 5. Perbandingan difraktogram fotokatalis TiO2 Degussa P25 (a),TiO2/Ti (b), dan Fe-TiO2/Ti (c)
Hasil analisis XRD pada Gambar 5menunjukkan puncak TiO2/Ti dengan Fe-TiO2/Ti. Data TiO2/Ti yang diperoleh berupa jarak bidang intensitas sudut 2θ sebesar 25,33o; 37,89o; 40,21o; 48,07o; 53,03o; 53,99o, 62,95o; 70,70o; dan 76,25o dengan puncak-puncak spesifik dari (ICSD 154609 TiO2 anatase) (101), (103), (004), (200), (105), (211), (204), (220), dan (215). Data Fe-TiO2/Ti 0,3% yang diperoleh berupa jarak bidang intensitas sudut 2θ sebesar 25,64o; 38,74o; 40,47o; 48,33o; 53,51o; 55,35o; 63,25o; 70,96o; dan 76,25o. Difraktogram TiO
2 terdoping Fe3+ memperlihatkan terjadinya peningkatan intensitas anatase (101), (103), (004), (200), dan (105) pada puncak difraksi 2θ sebesar 25,64o; 38,74o; 40,47o; 53,31o; dan 70,96o.
Menurut Wen, et al. (2012) dan Solano, et al. (2019) bahwa puncak difraksi 2θ terjadi karena
adanya pengaruh pendopingan pada Fe3+maka jarak bidang difraksi (101), (103), (004), (200), dan (220). Dopan Fe3+ dengan mudah diintegrasikan kedalam matriks TiO
2 karena jari-jari kation Fe3+ sebesar 0,55 Å yang hampir sama dengan jari-jari kation Ti4+ sebesar 0,61 Å.
SIMPULAN
Berdasarkan hasil Sintesis fotokatalis TiO2/Ti terdoping Fe3+ dengan metode anodisasi menghasilkan lapisan oksida pada permukaan plat Ti dan berwarna abu-abu gelap. Fotokatalis Fe-TiO2/Ti 0,3% (b/v) memberikan serapan pada bilangan gelombang 3399,68 cm-1 (vibrasi ulur gugus fungsi -OH) 685,72 dan 453,29 cm-1 (vibrasi ulur gugus fungsi Ti-O-Ti). Difraktogram XRD menunjukkan struktur berupa fasa anatase dan ukuran kristalit sebesar 124,58 nm dan UV-Vis/DRS Fe-TiO2/Ti 0,3% (b/v) memiliki nilai energi band gap sebesar 2,91 eV.
DAFTAR PUSTAKA
Aritonang, B. A., Krisnandi, K. Y., and Gunlazuardi., 2018, Modification of TiO2 Nanotube Arrays with N Doping and Ag Decorating for Enhanced Visible Light Photoelectrocatalytic Degradation of Methylene Blue. International Journal on Advanced Science Engineering Indormation Technology. 8(1) ISSN: 2088-5334.
Atkins, P. W., Overton, T. L., Rourke , J. P., Weller, M.T., and Armstrong, F. A., 2010, Shriver and
Atkins' Inorganic Chemistry, Fifth Edition: Published in Great Britain by Oxford University Press.
Arutanti., Mikrajuddin., Khairurrijal., dan Mahfudz., 2009, Penjernihan Air dari Pencemar Organik dengan Proses Fotokatalis pada Permukaan Titanium Dioksida (TiO2), Jurnal Nanosains & Nanoteknologi: 53-55.
52
Gel Technique: a article, International Journal of Materials, Mechanics and Manufacturing. 2(1), 21-24.
Dumitru, C., Popescu, M., Ungureanu, C, and Pirvu, C., 2015, Antibacterial Efficiencies of TiO2 Nanostructured Layers Prepared in Organic Electrolytes Viscous Electrolytes, J. Applied Surface Science, 341: 157-165.
Ghorbanpour, M. and Feizi, A., 2019, Iron-Doped TiO2 Catatlyst with Photocatalytic Activity,
Journal of Water and Environmental Nanotechnology, 4: 6-66.
Habib., Md Ahsan., Md Tusan. S, Newaz, M. B., and Iqbal, M. I. I., Abu, J, M. 2013, Synthesis and Characterization of ZnO-TiO2 Nanocomposites an Their Application as Photocatalysts:a article, Chemical Science Transactions, 2(1): 239-245.
Hassan, F. M. B.; narjo, H.; Kanakubo, M.; Ishikawa, I. and Nishioka, M., 2009, Effect of Ultrasonic Waves on The Formation of TiO2 Nanotube by Electrochemical Anodization of Titanium in Glycerol and NH4F, J. Surf. Sci. Tech., 8(2):351-362.
Karim, S., Pradoyo., dan Subagiyo, A. 2016. Sintesis dan Karakterisasi TiO2 Terdoping Nitrogen (N-Doped TiO2) dengan Metode Sol-Gel. Jurnal Kimia Sains dan Aplikasi. 19(2): 63-67. Linsebigler., Amy, L. Guangquan, Lu, and John, T. 1995, Photocatalysis on TiO2 Surfaces:
Prinsiples, Mechanisms, and Selected Results, Chem. Rev 95: 735-758.
Luu, L. C., Nguyen, T. Q, and Ho, T. S, 2010, Synthesis and Characterization of Fe-doped TiO2 Photocatalyst by the Sol-gel Method. J. Nanosci. Nanotechnol. 10: 2034-6254.
Ma, S., Zhan, S., Jia, Y, and Zhou, Q., 2015, Superior Antibacterial Activity of Fe3O4/TiO2 Nanosheets under Solar Light, ACS Appl. Mater. Interface, 7(39): 21875-21883.
Misriyani, Wahab, w.A., Taba, P., Gunlazuardi, J., 2015, Application of TiO2 Nanotube as Photoelectrode for Corrosion Prevention of Stainless Steel in pH Variation of NaCl. Ind. J. Chem. Res, 3. 242-248.
Misriyani, Wahab, A. W., Taba, P. and Gunlazuardi, 2017, Effect of Anodizing Time and Annealing Temperature on Photoelectrochemical Propeties of Anodized TiO2 Nanotube for Corrosion Prenetion Application, Indones. J. Chem., 17(2): 219-277.
Mohapatra, S. K., Misra, M., Mahajam, V. K, and Raja, K. S., 2007, A Novel Methode fot the Synthesis of Titania Nanotube using Sonoelectrochemical Metode and its application for Photoelectrochemical Splitting of Water, J. Catal, 246:362-369.
Pratibha, V.; Bakre, dan Tilve, S. G., 2018, Direct Access to Highly Crystlline Mesoporous Nano TiO2 Using Sterically Bulky Organic Acid Templates, J. of physics and Chemistry of Solids, 116:234-240.
Rahman, M. A., Hossain, M. A., & Das, B., 2016, Synthesis of TiO2 Nanotube by Electrochemical Anodization of Ti Foil in Room Temperature. Mechanical Enggineering Research Journal, 10, 90-93.
Ratnawati., dan Slamet., 2012, Potensi Titania Nanotube Array dan Aplikasi dalam Produksi Hidrogen dan Pengolahan Limbah. J. Kimia Kemasan. 34(2): 248-261.
Roy, P., Berger, S. and Schuki, P., 2011, TiO2 Nanotube: Synthesis and Aplications, Angew, Chem. Int. Ed, 50(13): 2904-2939.
Sastrohamidjojo, H., 1991, Spektroskopi, Liberty, Yogyakarta.
Solona, A. R., Herrera, P. A., Maestre, D., and Cremades, A., 2019, Fe-TiO2 Nanoparticles Synthesized by Green Chemistry for Potential Application in Waste Water Photocatalytic Treatment. Journal of Nanotechnology. 1-11.
Wen, L., Liu, B., Zhao, X., Nakata, K., Murakami, T., and Fujishima, A., 2012, Synthesis, Caracterization, and Photocatalysis of Fe-Doped TiO2: acombined Experimental and Theoretical Study, International Journal of Photoenergy. 1-11.
Yao, K., Peng, Z., Liao, Z. H. and Chen , J. J., 2009, Preparation and Photocatalytic Property of TiO2-Fe3O4 Core-Shell Nanoparticel, J. Nano. Sci. Nanotechnol, 9(2): 1458-61.
Yoriya, S., Paulose, M., Varghese, O. K., Mor, G. K., Grimes, C. A, 2007. Fabrication of Vertically Oriented TiO2 Nanotube Arrays using Dimethyl Sulfoxide Electrolytes, J. Phys. Chem. C 111: 13770-13776.