ISOLASI DAN IDENTIFIKASI SENYAWA FENOLIK DARI
KULIT BATANG
Aquilaria microcarpa
DAN UJI
AKTIVITASNYA SEBAGAI ANTIKANKER
SKRIPSI
OKKY PUTRI RAHAYU
PROGRAM STUDI S-1 KIMIA DEPARTEMEN KIMIA
FAKULTAS SAINS DAN TEKNOLOGI UNIVERSITAS AIRLANGGA
Skripsi ini tidak dipublikasikan, namun tersedia di perpustakaan dalam lingkungan Universitas Airlangga, diperkenankan untuk dipakai sebagai referensi kepustakaan, tetapi pengutipan harus seizin penyusun dan harus menyebutkan sumbernya sesuai kebiasaan ilmiah.
Puji syukur kepada Allah SWT, atas segala rahmat, karunia dan hidayah-Nya penulis dapat menyelesaikan skripsi yang berjudul “Isolasi dan Identifikasi Senyawa Fenolik dari Kulit Batang Aquilaria microcarpa dan Uji Aktivitasnya sebagai Antikanker”. Naskah skripsi ini dibuat untuk memenuhi salah satu syarat kelulusan di Fakultas Sains dan Teknologi, Universitas Airlangga.
Pada kesempatan ini, penulis menyampaikan ucapan terimakasih kepada semua pihak yang telah membantu menyelesaikan penulisan skripsi ini terutama kepada yang terhormat:
1. Dr. Mulyadi Tanjung, M,S sebagai Pembimbing I yang telah banyak meluangkan waktu dalam memberikan dorongan berupa kritik dan saran untuk perbaikan naskah skripsi juga semua bantuannya selama penelitian.
2. Dr. Alfinda Novi Kristanti, DEA sebagai Pembimbing II, sekaligus dosen wali, yang telah memberikan kritik dan saran untuk perbaikan naskah skripsi, dan juga motivasinya selama penelitian.
3. Dr. Purkan, M.Si sebagai Ketua Departemen Kimia Fakultas Sains dan Teknologi Universitas Airlangga, atas dorongan dan motivasinya. 4. Bapak Tamso dan Ibu Sri Mundari, kedua orang tua tercinta yang senantiasa memberikan doa dan motivasi demi kelancaran penulisan skripsi ini.
5. Ira Esti Rahayu, Ibnu Basuki, Friska Dwi Rahayu, Warsito, Zidane Satria Danuarta, Nayaka Sandya Kesuma, Keane Nixon Athallah, Amelia Meika Putri, selaku keluarga terkasih yang selalu memberikan dukungan dan semangatnya kepada penulis.
6. Tjitjik Srie Tjahjandarie, Ph.D, selaku dosen favorit sekaligus dosen penguji I, yang telah memberikan inspirasi, arahan dan masukan pada penulis.
10. Dini Oktavia, Dian Ningsih, Murobbiyatul Wathoniyyah dan Wahyu Sara Novita yang selalu menemani dan memberikan semangat pada penulis.
Teknologi Universitas Airlangga yang telah memberikan ilmunya. 13. Teman-teman Kimia Universitas Airlangga yang telah memberikan
banyak inspirasi dan semangat dalam mencari segala informasi dan pengetahuan dalam menyelesaikan penulisan skripsi ini.
14. Teman-teman rekan satu kelompok dalam KKN-BBM Unair ke-52 yang tidak bisa disebutkan satu persatu atas dukungannya selama ini pada penulis.
Penulisan skripsi ini masih banyak kekurangan, oleh karena itu kritik dan saran dari penguji serta pembaca akan sangat membantu dalam menyempurnakan skripsi ini.
Surabaya, 25 Juli 2016 Penulis,
Rahayu, O.P., 2016, Isolasi dan Identifikasi Senyawa Fenolik dari Kulit Batang Aquilaria microcarpa dan Uji Aktivitasnya sebagai Antikanker. Skripsi ini di bawah bimbingan Dr.Mulyadi Tanjung, M.S dan Dr.Alfinda Novi Kristanti, DEA. Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya.
ABSTRAK
Aquilaria microcarpa merupakan salah satu spesies dari famili
Thymelaeaceae. Tujuan dari penelitian ini adalah untuk menentukan struktur senyawa fenolik dari kulit batang Aquilaria microcarpa serta menentukan
aktivitas antikankernya. Ekstrasi kulit batang A. microcarpa dilakukan
menggunakan pelarut n-heksana yang dilanjutkan dengan pelarut metanol.
Kemudian fraksinasi dan pemurnian dilakukan menggunakan berbagai teknik kromatografi, meliputi kromatografi kolom tekan dan kromatografi radial hingga menghasilkan dua senyawa fenolik, yang diidentifikasi sebagai 6-hidroksi-2-(2-feniletil)kromon dan 7-hidroksi-5,3’,4’-trimetoksiflavon. Struktur kedua senyawa fenolik ditetapkan berdasarkan metode spektroskopi, meliputi UV,HR-ESI-MS,1D NMR (1H-NMR dan 13C-NMR), serta 2D NMR (HMQC dan HMBC). Uji aktivitas antikanker senyawa fenolik hasil isolasi ditentukan menggunakan metode microculture tetrazolium technique (MTT) terhadap sel kanker payudara
Rahayu, O.P., 2016, Isolation and Identification of Phenolic Compounds from The Stem Bark of Aquilaria microcarpa and Their Anticancer Activity. This thesis is supervised by Dr.Mulyadi Tanjung, M.S and Dr.Alfinda Novi Kristanti, DEA. Department of Chemistry, Faculty of Science and Technology, Universitas Airlangga, Surabaya.
ABSTRACT
Aquilaria microcarpa is a species from Thymelaeaceae family. The
objectives of this research are to determine the structure of phenolic compounds isolated from the stem bark of Aquilaria microcarpa and to determine anticancer
activity of these isolated phenolic compounds against T47D breast cancer cells. Extraction of A. microcarpa’s stem bark was done using n-hexane and followed
by methanol. Fractination and purification were carried out using various chromatographic techniques, including flash chromatography and radial chromatography, yielded two phenolic compounds, which were identified as 6-hidroxy-2-(2-phenylethyl)chromones and 7-hidroxy-5,3’,4’-trimethoxyflavones. The structure of both compounds was determined by spectroscopic methods, including UV, HR-ESI-MS, 1D NMR (1H-NMR and 13C-NMR), and 2D NMR (HMQC and HMBC). The anticancer activity test of both isolated compounds against T47D breast cancer cells by microculture tetrazolium technique (MTT)
showed IC50 values were 2884,03 and 2494,59 ppm respectively. This result showed that these two compounds were categorized inactive as anticancer.
Yang bertandatangan di bawah ini, saya :
Nama : Okky Putri Rahayu
NIM : 081211532003
Program studi : S-1 Kimia
Fakultas : Sains dan Teknologi Jenjang : Sarjana (S1)
Menyatakan bahwa saya tidak melakukan tindakan plagiat dalam penulisan skripsi saya yang berjudul : Isolasi dan Identifikasi Senyawa Fenolik dari Kulit Batang Aquilaria microcarpa dan Uji Aktivitasnya sebagai Antikanker. Apabila suatu saat nanti terbukti melakukan tindakan plagiat, maka saya akan menerima sanksi yang telah diterapkan.
Demikian pernyataan ini saya buat dengan sebenar-benarnya.
Surabaya, 25 Juli 2016
DAFTAR ISI
Halaman
LEMBAR JUDUL... ... i
LEMBAR PERNYATAAN ... ii
LEMBAR PENGESAHAN ... iii
LEMBAR PEDOMAN PENGGUNAAN SKRIPSI ... iv
KATA PENGANTAR... ... v
BAB II TINJAUAN PUSTAKA ... 4
2.1 Aquilaria microcarpa ... 5
2.2 Profil Fitokimia Aquilaria ... 5
2.2.1 Senyawa kromon Aquilaria ... 7
2.2.2 Senyawa flavonoid Aquilaria ... 10
2.3 Analisis Spektroskopi ... 12
2.4 Tinjauan Tentang Antikanker ... 14
2.4.1 Penentuan aktivitas antikanker dengan metode MTT ... 16
BAB III METODE PENELITIAN ... 19
3.1 Waktu dan Lokasi Penelitian ... 19
3.2 Sampel dan Bahan Penelitian ... 19
3.2.1 Sampel penelitian ... 19
3.2.2 Bahan penelitian ... 19
3.3 Peralatan Penelitian ... 20
3.4 Prosedur Kerja ... 21
3.4.1 Ekstraksi dan pemurnian senyawa fenolik ... 21
3.4.2 Penentuan struktur molekul senyawa fenolik hasil isolasi ... 22
3.4.3 Penentuan aktivitas antikanker senyawa fenolik... ... 24
3.5 Diagram Alir Penelitian ... 25
BAB III HASIL DAN PEMBAHASAN ... 26
4.1 Ekstraksi dan Pemurnian Senyawa Fenolik ... 26
4.2 Penentuan Struktur Molekul Senyawa Fenolik Hasil Isolasi ... 29
4.2.1 Senyawa 1 ... 29
BAB V KESIMPULAN DAN SARAN ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 47
DAFTAR TABEL
Nomor Judul Tabel Halaman
2.1 Distribusi senyawa metabolit sekunder Aquilaria 6
2.2 Distribusi senyawa 2-(2-feniletil)kromon tumbuhan Aquilaria 37
2.3 Senyawa flavonoid Aquilaria 11
4.1 Hasil analisis spektrum HMQC senyawa 1 hasil isolasi 32 4.2 Data spektrum NMR senyawa 6-hidroksi-2-(2-feniletilkromon) hasil
Isolasi dalam aseton 34
Nomor Judul Gambar Halaman
2.1 Tumbuhan Aquilaria microcarpa 5
2.2 Kerangka struktur senyawa 2-(2-feniletil)kromon pada Aquilaria 9
2.3 Struktur senyawa tetrahidrokromon dan epoksikromon Aquilaria 10
2.4 Struktur senyawa flavon Aquilaria 11
2.5 Struktur senyawa glikosida flavon Aquilaria 12
2.6 Struktur 5,7-dihidroksi-3’-metoksi flavon 13
2.7 Persamaan reaksi reduksi garam MTT menjadi kristal formazan oleh
enzim suksinat dehidrogenase 17
3.1 Diagram alir penelitian 25
4.1 Analisis KLT dari hasil kromatografi kolom tekan 27 4.2 Hasil uji kemurnian senyawa 1 menggunakan KLT 29 4.3 Hasil uji kemurnian senyawa 2 menggunakan KLT 29 4.4 Kemungkinan struktur senyawa 1 hasil isolasi 31 4.5 Korelasi sinyal proton H-3 dengan sinyal karbon C-2, C-4a dan C-8’ 33 4.6 Korelasi sinyal proton H-5 dan H-8 dengan sinyal karbon C-4a, C-6,
C-7 dan C-8a 34
4.7 Struktur flavon tersubtitusi C-5/C-7/C-3’/C-4’ 37 4.8 Korelasi H-3 dengan sinyal karbon C-2, C-4, C-4a dan C-1’ 39 4.9 Korelasi sunyal proton H-2’, H-5’, H-6’, 3’-OCH3 dan 4’-OCH3 dengan
sinyal-sinyal atom karbon di cincin B 40
4.10 Korelasi sunyal proton H-6, H-8, 5-OCH3 dan 5-OCH3 dengan
No Judul Lampiran
1 Hasil pengukuran spektrum UV senyawa 1 dalam metanol 2 Hasil pengukuran HR-ESI-MS senyawa 1
3 Hasil pengukuran spektrum 1H-NMR senyawa 1 4 Hasil pengukuran spektrum 13C-NMR senyawa 1 5 Hasil pengukuran HMQC senyawa 1
6 Hasil pengukuran HMBC senyawa 1
7 Hasil pengukuran spektrum UV senyawa 2 dalam metanol 8 Hasil pengukuran HR-ESI-MS senyawa senyawa 2
9 Hasil pengukuran spektrum 1H-NMR senyawa 2 10 Hasil pengukuran spektrum 13C-NMR senyawa 2 11 Hasil pengukuran HMQC senyawa 2
12 Hasil pengukuran HMBC senyawa 2
BAB I
PENDAHULUAN
1.1 Latar Belakang Permasalahan
Aquilaria microcarpa merupakan salah satu spesies dari famili
Thymelaeaceae dan dikenal dengan nama gaharu. Tumbuhan ini hanya terdapat di Asia Tenggara dan Asia Selatan (Gao, et al., 2014). Aquilaria merupakan salah
satu komoditas ekspor, karena Aquilaria menghasilkan bau harum sehingga
digunakan sebagai bahan pembuat parfum dalam industri kosmetika. Di Indonesia
Aquilaria ditemukan beberapa spesies, antara lain A. agallocha, A. crassna, A. sinensis, A. beccariana, A. malaccensis, A. cumingiana, A. hirta, A. microcarpa,
dan A. filaria (Wiriadinata, 2009). Selain menghasilkan minyak atsiri, tumbuhan
ini digunakan dalam pengobatan tradisional seperti analgesik, antidiabetes, antiinflamasi dan antikanker (Dong, et al.,2012; Feng, et al., 2011; Ibrahim, et al.,
2011; Li, et al., 2014; Zhou, et al., 2008). Kegunaan tumbuhan Aquilaria tentunya
berkaitan dengan senyawa metabolit sekunder yang dihasilkan.
Berdasarkan studi literatur, senyawa metabolit sekunder Aquilaria
golongan fenolik antara lain senyawa golongan flavonoid, kromon, benzofenon, dan kumarin (Dai, et al., 2010; Feng, et al, 2011; Ishihara, et al., 1993; Yang, et
al., 2012; Qi, et al., 2009). Senyawa kromon dan seskuiterpen ditemukan dalam A. agallocha, A. crassna, A. hirta, A. malaccensis dan A. sinensis, sedangkan
Aquilaria microcarpa merupakan salah satu spesies yang belum pernah
diteliti kandungan senyawa metabolit sekundernya. Berdasarkan uji skrining fitokimia, tumbuhan ini mengandung senyawa fenolik.
Berdasarkan studi literatur, Aquilaria juga diketahui memperlihatkan
aktivitas sebagai antikanker. Ekstrak Aquilaria malaccensis memperlihatkan
aktivitas antikanker terhadap sel usus HCT116 dengan IC50 4µg/mL (Ibrahim, et
al., 2011), dan terhadap sel lymphocytic leukimia P-388 dengan hasil ED50 yaitu 0,35 µg/mL (Gunasekera, et al., 1981). Senyawa 2-(2-feniletil)kromon yang
diisolasi dari Aquilaria sinensis menunjukkan aktivitas antikanker sebesar IC50 14,6 µg/mL terhadap sel kanker lambung manusia SGC-7901 (Liu, et al., 2008).
Dari penelitian tersebut, dapat ditunjukkan bahwa senyawa metabolit sekunder dalam Aquilaria memiliki potensi sebagai antikanker.
Penelitian ini bertujuan mengisolasi dan mengidentifikasi senyawa fenolik dalam kulit batang tumbuhan Aquilaria microcarpa dan menguji aktivitas
antikanker terhadap sel sel kanker payudara T47D. Metode yang digunakan dalam penelitian ini meliputi ekstraksi dengan pelarut n-heksana, yang dilanjutkan
dengan ektraksi dengan metanol. Fraksinasi dan pemurnian dilakukan dengan menggunakan berbagai teknik kromatografi. Penentuan struktur molekul ditetapkan berdasarkan cara-cara spektroskopi, meliputi spektroskopi ultraviolet (UV), spektroskopi massa (MS) dan resonansi magnet inti (NMR). Senyawa fenolik hasil isolasi yang sudah diketahui struktur molekulnya selanjutnya dilakukan uji antikankernya menggunakan metode microculture tetrazolium
1.2 Rumusan Permasalahan
Berdasarkan latar belakang permasalahan, maka rumusan permasalahan dalam penelitian ini adalah sebagai berikut :
1. Bagaimana struktur senyawa fenolik hasil isolasi dari kulit batang
Aquilaria microcarpa ?
2. Bagaimana aktivitas antikanker dari senyawa fenolik hasil isolasi dari kulit batang Aquilaria microcarpa?
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Melakukan isolasi dan menentukan struktur senyawa fenolik hasil isolasi dari kulit batang Aquilaria microcarpa.
2. Menentukan aktivitas antikanker dari senyawa fenolik hasil isolasi dari kulit batang Aquilaria microcarpa
1.4 Manfaat Penelitian
Manfaat hasil penelitian ini diharapkan dapat memberikan kontribusi terhadap keragaman senyawa fenolik tumbuhan Aquilaria microcarpa dari aspek
fitokimia serta memberikan informasi bahwa senyawa fenolik tumbuhan
BAB II
TINJAUAN PUSTAKA
2.1 Aquilaria microcarpa
Aquilaria merupakan salah satu genus dari famili Thymelaeaceae yang
tersebar di Asia Tenggara dan Asia Selatan. Aquilaria menghasilkan senyawa
minyak atsiri dengan nilai ekonomi tinggi. Kualitas minyak atsiri dengan aroma yang khas dan menghasilkan warna hitam pada batang dan kambiun. Bentuk pertahanan diri terhadap serangan mikroba pada tumbuhan tersebut dikenal dengan nama agarwood. Jenis kerangka senyawa minyak atsiri seperti eudesman,
guaiadien, dan spirovetiven merupakan ciri khas senyawa turunan seskuiterpen dari Aquilaria (Gao, et al., 2014; Li, et al., 2015; Zhang, et al., 2012).
Aquilaria microcarpa merupakan salah satu spesies yang dapat ditemui di
Sumatera, Kalimantan dan Malaysia yang sampai saat ini belum ada kajian fitokimianya. Tumbuhan ini termasuk dalam kategori dilindungi dengan status kelangkaan yang rawan, mengingat eksploitasi yang berlebihan sehingga masuk daftar terancam punah (Wiriadinata, 2009).
Aquilaria microcapa merupakan pohon dengan tinggi 40 m dengan
hijau licin dan berukuran sekitar 1-1,5 cm. Bijinya berjumlah 2 buah (Wiriadinata, 2009).
Berdasarkan taksonomi, tumbuhan Aquilaria microcarpa (Tarigan, 2004)
diklasifikasikan sebagai berikut: Kingdom : Plantae
Divisi : Tracheophyta
Kelas : Magnoliopsida
Ordo : Malvales
Famili : Thymelaceae
Genus : Aquilaria
Spesies : Aquilaria microcarpa
Gambar-2.1. Tumbuhan Aquilaria microcarpa
2.2 Profil Fitokimia Aqularia
spirovetiven yakni senyawa-senyawa yang merupakan komponen penyusun minyak atsiri yang memberikan aroma pada resin gaharu (Gao, et al., 2014; Li, et
al., 2015; Ueda, et al., 2006; Zhang, et al., 2012). Selain seskuiterpen, tumbuhan Aquilaria menghasilkan senyawa fenolik antara lain benzofenon, flavonoid,
kumarin, santon dan kromon (Dai, et al., 2010; Dong, et al., 2012; Peng, et al.,
2011; Sun, et al., 2014; Wu, et al., 2014; Yagura, et al., 2003; Yang, et al.,
2014). Senyawa kromon merupakan senyawa fenolik utama yang terdapat dalam tumbuhan Aquilaria. Senyawa kromon Aquilaria mempunyai kerangka jenis
2-(2-feniletil)kromon yang jarang ditemukan pada tumbuhan lain. Senyawa flavonoid Aquilaria merupakan jenis flavon dan isoflavon dengan pola oksigenasi
C-5/7/4’ dan C-5/7/3’/4’ (Dong, et al., 2012). Distribusi senyawa metabolit
sekunder tumbuhan Aquilaria dapat dilihat pada data Tabel-2.1.
Tabel-2.1. Distribusi senyawa metabolit sekunder Aquilaria.
Spesies Bagian
tumbuhan Asal kerangka Jenis Pustaka
A. agallocha Batang, kulit
batang India, Jepang Kromon, kumarin, seskuiterpen
A. hirta Batang Malaysia Seskuiterpen Hassan, et al., 2011
A. malaccensis Batang, kulit
batang Indonesia, Thailand Fenilpropanoid, kromon, seskuiterpen
Gunasakera, et al., 1982; Konishi, et al., 2002; Nakanishi, et al., 1984;
A. sinensis Daun, batang,
et al., 2003; Yang, et al., 2014, 2013, 2012a; 2012b, 2012c
2.2.1 Senyawa kromon Aquilaria
Kromon merupakan senyawa dalam kelompok senyawa poliketida dan biosintesisnya berasal dari jalur asetat malonat melalui pembentukan rantai karbon linier yakni poli-β-karboksilat atau yang disebut rantai poliasetil. Berbagai variasi senyawa-senyawa turunan 2-(2-feniletil)kromon pada Aquilaria dapat
dilihat dalam Tabel-2.2.
Tabel-2.2. Distribusi senyawa 2-(2-feniletil) kromon tumbuhan Aquilaria
Senyawa Spesies Pustaka
6-Metoksi-2-(2-3'-hidroksi-4'-metoksifeniletil)kromon (1) A. sinensis Li, et al., 2014
5-Hidroksi-6-metoksi-2-(2-3'-hidroksi-4'-metoksifeniletil)kromon
(2) A. sinensis Li, et al., 2014
5-Hidroksi-6-metoksi-2-[2-(4-metoksifenil)etil]kromon (3) A. sinensis Li, et al., 2014
6-Metoksi-2-[2-(4-metoksifenil)etil]kromon (4) A. sinensis Li, et al., 2014
6-Metoksi-2-[2-(3-metoksi-4-hidroksifenil)etil]kromon (5) A. sinensis Li, et al., 2014
6-Metoksi-2-[2-(3-metoksifenil)etil]kromon (6) A. sinensis Li, et al., 2014 2-(2-Feniletil)kromon (7) A. malaccensis Konishi, et al., 2002 7-Hidroksi-2-(2-feniletil)kromon (8) A. malaccensis Konishi, et al., 2002
6,8-Dihidroksi-2-(2-feniletil)kromon (9) A. malaccensis Konishi, et al., 2002
6-Hidroksi-2-(2-4'-hidroksifeniletil)kromon (10) A. malaccensis Konishi, et al., 2002
6-Hidroksi-2-(2-2'-hidroksifeniletil)kromon (11) A. malaccensis Konishi, et al., 2002
6-Hidroksi-7-metoksi-2-(2-feniletil)kromon (12) A. malaccensis Konishi, et al., 2002
hidroksi-4'-metoksifeniletil)kromon (14)
6,7-Dimetoksi-2-(2-3'-hidroksi-4'-metoksifeniletil)kromon (15) A. sinensis Yang, et al., 2012
7-Hidroksi-6-metoksi-2-(2-3'-hidroksi-4'-metoksifeniletil)kromon
(16) A. sinensis Yang, et al., 2012
6,7-Dimetoksi-2-(2-4'-hidroksi-3'-metoksifeniletil)kromon (17) A. sinensis Yang, et al., 2012
6,8-Dihidroksi-2-(2-3'-hidroksi-4'-metoksifeniletil)kromon (18) A. sinensis Yang, et al., 2012
6,7-Dihidroksi-2-(2-4'-metoksifeniletil)kromon (19) A. sinensis Yang, et al., 2012
6-Hidroksi-2-(2-4'-hidroksi-3'-metoksifeniletil)kromon (20) A. sinensis Yang, et al., 2012
5-Hidroksi-6-metoksi-2-(2-feniletil)kromon (21) A. sinensis Yagura, et al., 2003
8-Kloro-2-(2-feniletil)-5,6,7-trihidroksi-5,6,7,8-tetrahidrokromon
(22) A. sinensis Yagura, et al., 2003
6,7-Dihirdoksi-2-(2-feniletil)-5,6,7,8-tetrahidrokromon (23) A. sinensis Yagura, et al., 2003
7,8-Dimetoksi-2-(2-3'-asetoksifeniletil)kromon (24) A. sinensis Alkhathlan,2005 et al., 6-Metoksi-2-(2-feniletil)kromon
(25) A. sinensis Alkhathlan,2005 et al.,
(5S*,6R*,7S* )-5,6,7-Trihidroksi-2- (3-hidroksi-4-metoksifeniletil)-5,6,7,8-tetrahidro-4H-kromen-4-on (26)
A. sinensis Dai, et al., 2010
(5S*,6R*,7R* )-5,6,7-Trihidroksi-2- (3-hidroksi-4-metoksifeniletil)-5,6,7,8-tetrahidro-4H-kromen-4-on (27)
A. sinensis Dai, et al., 2010
6,7-Dimetoksi-2-[2-4-hidroksifenil)etil]kromon (28) A. sinensis Yang, et al., 2014
2-[2-Hidroksi-2-(4-metoksifenil)etil]kromon (29) A. Sinensis Yang, et al., 2014
2-(2-Hidroksi-2-4'-hidroksifeniletil)kromon (30) A. Sinensis Yang, et al., 2014
AH3 (31) A. Crassna Okudera, et al., 2009
(37)
6-Metoksi-2-[2-(4’-metoksifenil)-etil]-kromon (38) A. agallocha Nakanishi, et al., 1986
8-Kloro-5,6,7-trihidroksi-2-(3- hidroksi-4-metoksifenetil)-5,6,7,8-tetrahidrokromen-4-on (39)
A. sinensis Liu, et al., 2008
Oksidoagarokromon A (40) A. crassna Yagura, et al., 2005 Oksidoagarokromon B (41) A. crassna Yagura, et al., 2005 Oksidoagarokromon C (42) A. crassna Yagura, et al., 2005
Struktur kimia senyawa turunan 2-(2-feniletil) kromon Aquilaria
umumnya mempunyai substituen hidroksi dan metoksi di kedua inti aromatik seperti terlihat pada Gambar-2.2.
Gambar-2.2. Kerangka struktur senyawa 2-(2-feniletil)kromon pada Aquilaria
Modifikasi kimiawi melalui reaksi reduksi dan oksidasi senyawa turunan 2-(2-feniletil) kromon Aquilaria menghasilkan senyawa tetrahidrokromon dan
Gambar-2.3. Struktur senyawa tetrahidrokromon dan epoksikromon Aquilaria
2.2.2 Senyawa flavonoid Aquilaria
Senyawa flavonoid mempunyai kerangka dasar karbon yang terdiri dari 15 atom karbon, dimana dua cincin benzen (C6) terikat pada suatu rantai propan (C3) sehingga membentuk suatu susunan C6-C3-C6 (Manitto, 1992). Susunan ini dapat menghasilkan tiga jenis kerangka, yakni 1,3-diarilpropan (flavonoid), 1,2-diarilpropan (isoflavonoid), dan 1,1 1,2-diarilpropan (neoflavanoid). Biosintesis senyawa flavonoid, merupakan penggabungan jalur skhimat dan asetat malonat dengan prekursor asam amino tirosin. Senyawa flavonoid yang ditemukan pada tumbuhan Aquilaria umumnya merupakan jenis flavonoid dan isoflavonoid.
Senyawa jenis flavonoid Aquilaria umumnya merupakan jenis flavon dalam
bentuk turunan apigenin (5,7,4’-trihidroksi flavon) dan turunan luteolin (5,7,3’,4’-tetrahidroksi flavon). Senyawa jenis flavon Aquilaria ditemukan baik dalam
bentuk aglikon maupun dalam bentuk glikon seperti terlihat pada Tabel 2.3.
Senyawa aglikon flavon Aquilaria mempunyai ciri yaitu adanya substituen
aglikon flavon Aquilaria umumnya menggunakan pelarut semipolar seperti
diklorometana, kloroform atau etilasetat. Beberapa senyawa aglikon flavon
Aquilaria dapat dilihat pada Gambar-2.4.
Gambar-2.4. Struktur senyawa flavon Aquilaria
Tabel-2.3. Senyawa flavonoid Aquilaria
Senyawa Spesies Pustaka
5,7-Dihidroksi-4’-metoksiflavon (43) A. sinensis Dong et.al., 2012
5-Hidroksi-7,4’-dimetoksiflavon (44) A. sinensis Dong et.al., 2012
5,3’,4’-Trihidroksi-7-metoksiflavon (45) A. sinensis Dong et.al., 2012
5-Hidroksi-7,3’,4’-trimetoksiflavon (46) A. sinensis Dong et.al., 2012
Formonetin (47) A. sinensis Dong et.al., 2012
Akuilarinosida A1 (48) A. sinensis Dong et.al., 2012
Letediosida A (49) A. sinensis Dong et.al., 2012
7, 4’-Dimetil-5-O-silosilglukosida
apigenin (50) A. sinensis Dong et.al., 2012
Letedosida A (51) A. sinensis Dong et.al., 2012
7, 3’-Dimetil-4’-hidroksi-5-O-glukosida
flavon (52) A. sinensis Dong et.al., 2012
7, 4’-Dimetil-5-O-glukosida flavon (53) A. sinensis Dong et.al., 2012
Senyawa glikon flavon Aquilaria selain substituen hidroksi dan metoksi
glukosa, silosa dalam bentuk mono maupun diglikosida. Beberapa senyawa glikon flavon Aquilaria dapat dilihat pada Gambar-2.5.
Gambar-2.5. Struktur senyawa glikosida flavon Aquilaria
2.3 Analisis Spektroskopi
Penentuan struktur molekul senyawa flavonoid dan 2-(2-feniletil)kromon tumbuhan Aquilaria diinterpretasi dengan metode spektroskopi. Alat
spektrofotometer yang digunakan meliputi spektrometer ultraviolet (UV), spektroskopi inframerah (IR), spektroskopi massa (MS), dan spektroskopi resonansi magnet inti (NMR).
Pada sub bab ini akan dibahas mengenai analisis spektroskopi salah satu senyawa flavonoid dalam Aquilaria, yakni 5,7-dihidroksi-4’-metoksi flavon.
Gambar-2.6. Struktur 5,7-dihidroksi-4’-metoksiflavon
Spektrum UV senyawa 5,7-dihidroksi-4’-metoksi flavon dalam metanol memberikan serapan maksimum pada λmaks (log ɛ) : 260 nm dan 330 nm yang merupakan ciri khas serapan benzoil dan sinamoil. Spektrum IR senyawa 5,7-dihidroksi-4’-metoksi flavon dalam KBr memperlihatkan pita serapan pada bilangan gelombang maksimum ʋmaks : 3383 cm-1 (vibrasi ulur hidroksi OH), 1652 cm-1 (vibrasi ulur C=O terkonyugasi), dan 1604, 1504, 1466 cm-1 (vibrasi ulur C=C aromatik). Spektrum massa senyawa 5,7-dihidroksi-4’-metoksi flavon terdiri dari unsur C, H dan O memperlihatkan ion molekul Mr pada m/z genap (Dong,
et.al., 2012).
Spektrum 1H NMR senyawa 5,7-dihidroksi-4’-metoksi flavon dalam aseton d6 memperlihatkan sepasang sinyal proton aromatik meta (J = 2,4 Hz)
pada pergeseran kimia δH 6,15 dan 6,01 ppm di cincin A yakni pada H-6 dan H-8. Sepasang proton aromatik berposisi ortho (J = 8,4 Hz) yang masing-masingnya
mewakili dua proton pada pergeseran kimia δH 7,15 dan 7,88 ppm di cincin B yakni pada H-2’/6’ dan H-3’/5’. Satu sinyal singlet pada δH 6.34 ppm merupakan sinyal proton di H-3 yang merupakan ciri khas flavon. Sinyal singlet broad pada
hidrogen dengan karbonil C=O di C-4. Sinyal singlet metoksi terlihat pada δH 3,87 ppm genap (Dong, et.al., 2012).
2.4 Tinjauan Tentang Antikanker
Kanker merupakan suatu penyakit yang ditandai dengan hilangnya fungsi kontrol sel terhadap regulasi siklus hidup sehingga sel tidak dapat berpoliferasi secara normal. Pertumbuhan sel yang tidak normal ini akan menyerang jaringan biologis sekitarnya serta mampu bermigrasi ke jaringan tubuh yang lain melalui sirkulasi darah atau sistem limfatik sehingga menyebabkan kematian (Farida, et al., 2010).
Secara teoritis, timbulnya sel kanker umumnya terjadi oleh senyawa-senyawa karsinogenik yang berinteraksi dengan DNA sehingga terjadi mutasi. Senyawa-senyawa tersebut membentuk senyawa intermediet menghasilkan alkilasi DNA yang menyebabkan kesalahan pasangan basa DNA. Hal tersebut menyebabkan terjadinya perubahan urutan basa atau terjadi kesalahan pembacaan informasi genetik dan mengakibatkan terjadinya mutasi. Mutasi DNA dapat memicu perkembangan neoplastik yang menghasilkan sel tumor atau kanker (Jagetia, et al., 2006).
ketiga yaitu tahap progresi. Tahapan terakhir ialah metatasis, yaitu tahapan sel kanker melakukan ekspansi ke jaringan pembuluh darah lain. Sel ekspansif akan membentuk kanker sekunder di jaringan yang ditulari (Ren, et al., 2003).
Pengobatan kanker umumnya menggabungkan pembedahan dan radiasi dengan pengobatan kemoterapi. Kemoterapi merupakan pengobatan kanker menggunakan suatu obat sitostatika yang merusak sel kanker. Beberapa obat sitostatika yang sudah digunakan sebagai agen kemoterapi ialah taksol, bleomisin, 5-flurourasil, klorambusil, tiotepa, serta alkaloid indol seperti vinblastin dan vinkristin. Obat sitostatika bekerja dengan mempengaruhi metabolisme asam nukleat terutama DNA atau biosintesis protein. Hal inilah yang menyebabkan obat sitostatika bekerja tidak selektif karena bersifat toksik baik pada sel kanker maupun sel normal, terutama sel normal yang kecepatan proliferasinya tinggi seperti pada sum-sum tulang belakang. Obat-obatan tersebut memberikan efek samping berupa mual, muntah, rambut rontok, iritasi kandung kemih disertai terdapatnya darah dalam air kemih (Sukmarianti, et al., 2013). Hal ini mendorong
para peneliti untuk mengeksplorasis enyawa-senyawa bioaktif antikanker dari bahan alam untuk mengurangi efek samping. Sampai saat ini pencarian obat untuk antikanker dari senyawa bahan alam masih terus dikembangkan.
Pada dasarnya strategi pengembangan senyawa bahan alam untuk mendapatkan obat kanker yang aman dan efektif meliputi uji senyawa aktif pada kultur sel kanker secara in vitro, uji senyawa aktif pada tingkat molekuler (DNA
break), dan uji senyawa aktif secara in vivo dengan menggunakan hewan
kanker antara lain melalui DNA alkilasi, inhibisi DNA, inhibisi sintesis protein, DNA topoisomerase, inhibisi lipoksigenase, dan mekanisme sistem imun (Ancuceanu, et al., 2004).
2.4.1 Penentuan aktivitas antikanker dengan metode MTT
Salah satu metode yang digunakan dalam penentuan aktivitas antikanker ialah metode microculture tetrazolium technique (MTT) secara in vitro. Sel
kanker yang digunakan pada uji aktivitas antikanker ini adalah sel kanker payudara T47D.
Metode MTT berperan untuk mendeteksi adanya proliferasi sel. Sel yang mengalami proliferasi ditandai dengan berubahnya garam MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida] yang berwarna kuning menjadi kristal formazan yang berwarna biru gelap. Perubahan warna ini disebabkan adanya reaksi reduksi garam MTT menjadi kristal formazan oleh enzim suksinat
dehidrogenase yang berada pada mitokondria sel kanker payudara T47D. Dalam
N N
Gambar-2.7. Persamaan reaksi reduksi garam MTT menjadi kristal formazan oleh enzim suksinat dehidrogenase (Jaswir, et al., 2011)
Kristal formazan yang dihasilkan tersebut tidak dapat larut dalam air. Penambahan reagen dimetil sulfoksida dapat melarutkan kristal formazan yang kemudian diukur absorbansinya pada panjang gelombang 540 nm menggunakan
microplate reader. Intensitas warna biru gelap yang terbentuk sebanding dengan
jumlah sel yang hidup (Zulfiana, 2012).
BAB III
METODE PENELITIAN
3.1 Waktu dan Lokasi Penelitian
Penelitian ini dilakukan pada bulan Desember 2015-Juni 2016 di Laboratorium Kimia Organik, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya. Analisis spektroskopi UV dilakukan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Sains dan Teknologi, Universitas Airlangga, Surabaya. Analisis spektroskopi massa dilakukan di FMIPA, ITB, Bandung. Analisis spektroskopi NMR dilakukan di Institute of
Tropical Disease, Universitas Airlangga, Surabaya. Uji aktivitas antikanker
dilakukan di Fakultas Farmasi, Universitas Airlangga, Surabaya. 3.2 Sampel dan Bahan Penelitian
3.2.1 Sampel penelitian
Sampel yang digunakan dalam penelitian ini adalah kulit batang Aquilaria
microcarpa yang belum terinfeksi mikroba, yang diperoleh dari hutan konservasi
Bukit Bangkirai, Samboja, Kota Samarinda, Kalimantan Timur. 3.2.2 Bahan penelitian
Pelarut yang digunakan untuk keperluan ekstraksi ialah pelarut dengan kualitas teknis yang telah didestilasi. Pelarut yang digunakan untuk pemisahan, pemurnian dan analisis adalah pelarut dengan kualitas pro analisis. Pelarut organik yang digunakan antara lain metanol, n-heksana, etilasetat, diisopropileter,
pemurnian adalah silika gel 60 GF254 0.25 mm (Merck) untuk keperluan kromatografi lapis tipis (KLT), silika gel 60 GF254 untuk keperluan kromatografi kolom gravitasi, serta silika gel 60 PF254 untuk keperluan kromatografi radial. Pereaksi yang digunakan untuk penampak noda ialah pereaksi serium sulfat dan lampu UV. Sel kanker yang digunakan untuk uji aktivitas antikanker adalah sel kanker payudara T47D. Bahan yang digunakan untuk pembuatan kultur sel adalah medium RPMI-1640. Pereaksi yang digunakan untuk uji aktivitas antikanker adalah reagen MTT [3-(4,5-dimetil thiazol-2-il)-2,5-difenil tetrazolium bromida]. 3.3 Peralatan Penelitian
Peralatan yang digunakan dalam penelitian ini adalah alat destilasi, rotary
vacuum evaporator, kromatografi kolom tekan, kromatografi radial, pipet mikro,
kuvet mikro, lampu UV serta alat gelas yang umum. Peralatan spektrofotometer antara lain spektrometer UV-Vis Shimadzu 1800, spektrometer HR-ESI-MS merck Waters LCT XE ESI-TOF (electro spray ionization-time of flight), serta
3.4 Prosedur Kerja
3.4.1 Ekstraksi dan pemurnian senyawa fenolik
Bahan penelitian berupa kulit batang Aquilaria microcarpa yang terlebih
dahulu dibersihkan lalu dipotong kecil-kecil dan digiling sampai berbentuk serbuk. Serbuk kulit batang sebanyak 1,69 kg diekstraksi padat cair dengan metode maserasi menggunakan pelarut n-heksana sebanyak tiga kali pada suhu
kamar. Ekstraksi dengan n-heksana bertujuan untuk menghilangkan senyawa non
polar yang terdapat dalam kulit batang Aquilaria microcarpa. Selanjutnya, serbuk
kulit batang diektraksi dengan maserasi menggunakan metanol sebanyak tiga kali. Ekstrak metanol yang diperoleh dari hasil maserasi dipekatkan dengan alat penguap bertekanan rendah untuk memperoleh ekstrak kental metanol
Pemisahan ekstrak etilasetat dengan kromatografi kolom tekan dilakukan menggunakan pelarut n-heksana-etil asetat yang ditingkatkan kepolarannya secara gradien, yaitu dengan perbandingan menggunakan pelarut n-heksana dan etilasetat, yaitu dengan perbandingan 9:1, 8:2, 7:3, dan 6:4. Hasil elusi ini menghasilkan beberapa fraksi, yang dimonitoring dengan pereaksi serium sulfat dan analisis KLT. Pemurnian senyawa fenolik dilakukan menggunakan kromatografi radial dan dilakukan analisis kemurnian dengan KLT, minimal menggunakan tiga sistem eluen yang berbeda. Senyawa dianggap murni jika memperlihatkan satu noda dalam berbagai eluen. Uji kemurnian senyawa fenolik hasil isolasi juga ditentukan dengan pengukuran titik leleh menggunakan Fisher
Johns melting point apparatus.
Senyawa fenolik hasil isolasi dianalisis secara spektroskopi untuk menentukan struktur kimianya. Senyawa fenolik yang sudah diketahui struktur kimianya kemudian dilakukan uji aktivitas antikankernya terhadap sel kanker payudara T47D untuk mengetahui keaktifan senyawa fenolik hasil isolasi terhadap sel kanker payudara T47D.
3.4.2 Penentuan struktur molekul senyawa fenolik
Struktur senyawa fenolik hasil isolasi ditentukan dengan menggunakan pengukuran spektroskopi UV, HR-ESI-MS dan NMR.
Penentuan massa molekul dan rumus molekul ditentukan dengan spektrometer massa resolusi tinggi HR-ESI-MS. Pengukuran spektroskopi massa senyawa fenolik hasil isolasi dilakukan dengan cara melarutkan sampel dalam campuran air:asam formiat (1:1). Melalui percobaan ionisasi kuasi molekul positif menghasilkan ion pada m/z [M+H]+ atau percobaan ionisasi kuasi molekul
negatif menghasilkan ion pada m/z [M-H]-.
Analisis NMR merupakan analisis spektroskopi yang paling penting dalam penentuan struktur senyawa fenolik. Pengukuran NMR dapat dilakukan dengan cara satu dimensi 1D NMR dan dua dimensi 2D NMR. Analisis 1D NMR meliputi pengukuran 1H-NMR dan 13C-NMR. Daerah pengukuran pergeseran kimia 1H-NMR ialah pada δH 0-14 ppm, sedangkan daerah pengukuran pergeseran kimia 13C-NMR ialah pada δC 0-220 ppm. Referensi standar internal untuk pelarut CDCl3 muncul sinyal pada pergeseran kimia δH7,26 ppm untuk proton dan pergeseran kimia δC 77,0 ppm untuk karbon.
Pengukuran 2D NMR dalam penentuan struktur molekul senyawa flavonoid hasil isolasi menggunakan analisis pengukuran HMQC dan HMBC. Analisis spektrum HMQC berguna untuk mengetahui korelasi antara proton dan karbon dalam satu ikatan, sedangkan analisis spektrum HMBC berguna untuk mengetahui korelasi antara proton dan karbon dalam dua atau tiga ikatan.
3.4.3 Penentuan aktivitas antikanker senyawa fenolik
[3-(4,5-dimetiltiazol-2-il)2,5-difenil-tetrazoliumbromida] assay (Alley, 1988). Uji aktivitas dilakukan dengan cara
Kromatografi Kolom Tekan Serbuk kulit batang Aquilaria microcarpa(1,69 kg)
Maserasi dengan n-heksana
Fraksi B Fraksi C Fraksi D Fraksi E
BAB IV
HASIL DAN PEMBAHASAN
4.1 Ekstraksi dan Pemurnian Senyawa Fenolik
Ektraksi senyawa fenolik yang terdapat dalam kulit batang Aquilaria
microcarpa (1,69 kg) dilakukan dengan metode ektraksi padat-cair secara
maserasi. Proses ekstraksi dengan n-heksana dilakukan pada suhu kamar sebanyak
tiga kali yang bertujuan untuk menghilangkan senyawa non polar agar tidak mengganggu dalam isolasi senyawa fenolik. Selanjutnya proses ekstraksi dengan metanol pada suhu kamar dilakukan sebanyak tiga kali. Proses ekstraksi dilakukan sebanyak tiga kali bertujuan supaya senyawa fenolik yang terdapat dalam kulit batang Aquilaria microcarpa terekstrak secara sempurna.
Ekstrak metanol hasil maserasi dipekatkan dengan alat penguap bertekanan rendah sehingga diperoleh ekstrak kental metanol sebanyak 120 g. Selanjutnya ekstrak metanol ditambahkan air sebanyak 10% dan dilakukan pemisahan dengan ekstraksi cair-cair secara partisi menggunakan pelarut etilasetat. Partisi tersebut menghasilkan dua lapisan, yakni lapisan atas berupa ekstrak etilasetat dan lapisan bawah berupa ekstrak metanol-air. Ekstrak etilasetat selanjutnya dipekatkan dengan alat penguap bertekanan rendah sehingga diperoleh ekstrak kental etilasetat sebanyak 10,8 g yang mengandung senyawa fenolik.
digunakan dalam pemisahan ditetapkan melalui analisis dengan kromatografi lapis tipis (KLT) menggunakan eluen campuran n-heksana:etilasetat (8:2), n-heksana :
aseton (8:2),, dan kloroform : etilasetat (9:1). Hasil KLT menunjukkan bahwa . campuran n-heksana : etilasetat merupakan eluen yang terbaik dalam pemisahan.
Pemisahan ekstrak etilasetat sebanyak 10 g dilakukan dengan kromatografi kolom tekan menggunakan campuran n-heksana : etilasetat yang kepolarannya
ditingkatkan secara gradien dengan perbandingan 9:1, 8:2, 7:3, dan 3:2 menghasilkan lima fraksi utama, yaitu fraksi A-E. Hasil KLT dapat dilihat pada Gambar-4.1.
Gambar-4.1. Analisis KLT dari hasil kromatografi kolom tekan (eluen kloroform 100%)
Fraksi C menunjukkan spot warna ungu yang sangat kuat di bawah sinar UV pada uji KLT. Spot yang berpendar dengan sinar UV merupakan ciri dari senyawa fenolik. Pemisahan fraksi C (1,81 g) dilakukan dengan kromatografi kolom tekan dengan campuran n-heksana : etilasetat yang ditingkatkan secara
gradien kepolarannya dengan perbandingan 9:1, 8:2, 7:3, dan 6:4 menghasilkan empat subfraksi, yaitu fraksi C1-C4. Pemurnian subfraksi C4 (0,04 g) dengan kromatografi radial menggunakan campuran n-heksana : etilasetat (8,5 : 1,5
sampai 7:3) menghasilkan senyawa 1berwujud padatan kuning muda sebanyak 3 mg.
Pemisahan fraksi E (0,25 g) dengan eluen n-heksana : etilasetat yang
ditingkatkan kepolarannya secara gradien dengan perbandingan 9:1, 8:2, 7:3, dan 6:4 menghasilkan empat subfraksi, yaitu fraksi E1-E4. Pemurnian subfraksi E2 (605mg) dengan kromatografi radial menggunakan campuran eluen n-heksana :
kloroform (9:1 sampai 7:3) menghasilkan senyawa 2 berwujud padatan kuning muda sebanyak 20 mg.
Uji kemurnian kedua senyawa hasil isolasi dilakukan menggunakan KLT dengan tiga eluen yang berbeda. Senyawa 1 memperlihatkan satu noda dengan eluen kloroform 100%, n-heksana : etilasetat (9:1) dan n-heksana : aseton (8:2).
Senyawa 2 memperlihatkan satu noda dengan eluen kloroform(100%), n-heksana:
etilasetat (8:2), dan n-heksana:aseton (8,5:1,5). Hasil uji KLT kedua senyawa
Gambar-4.2. Hasil uji kemurnian senyawa 1 menggunakan KLT
Gambar-4.3. Hasil uji kemurnian senyawa 2 menggunakan KLT
4.2 Penentuan Struktur Molekul Senyawa Fenolik Hasil Isolasi 4.2.1 Senyawa 1
batokromik yakni bertambahnya serapan maksimum senyawa. Hasil pengukuran UV terlampir pada Lampiran 1.
Pengukuran senyawa 1 hasil isolasi dengan spektroskopi massa ionisasi elektrosprey resolusi tinggi (HR-ESI-MS) memperlihatkan ion kuasi molekul negatif [M-H]- pada pada m/z 265,0805 (perhitungan [M-H]- 265,0865) yang sesuai dengan rumus molekul C17H14O3 Hasil pengukuran spektum HR-ESI-MS senyawa kromon dapat dilihat pada Lampiran 2.
Spektrum 1H-NMR (400 MHz) senyawa 1 hasil isolasi dalam aseton d6 memperlihatkan dua unit sinyal proton aromatik yakni tiga buah sinyal proton sistem ABX aromatik dan lima buah sinyal proton aromatik monosubstitusi. Tiga buah sinyal proton sistem ABX aromatik memperlihatkan sinyal proton pada pergeseran kimia δH 6,88 (d, J = 8,3 Hz), 7,24 (dd, J = 8,3 dan 2,1 Hz), dan 7,48
(d, J = 2,1 Hz). Sinyal proton dari unit aromatik lainnya memperlihatkan
Gambar-4.4. Kemungkinan struktur senyawa 1 hasil isolasi
yang disarankan pada Gambar 4.4. Hasil pengkuran 13C-NMR terlampir pada Lampiran 4.
Spektrum HMQC (Heteronuclear Multiple Quantum Coherence)
menunjukkan korelasi antara sinyal proton 1H-NMR dan satu sinyal karbon 13 C-NMR dalam satu ikatan. Sebagai contoh, sinyal singlet proton δH 6,04 berkorelasi dengan sinyal karbon pada δC 109,7 ppm. Sinyal proton sistem ABX pada pergeseran kimia δH 6,88 (d, J =8,3 Hz) berkorelasi dengan sinyal karbon δC 115,8, sinyal proton pada pergeseran kimia δH 7,24 (dd, J = 8,3 dan 2,1)
berkorelasi dengan sinyal karbon pada δC 120,2 ppm, dan satu sinyal proton δH 7,48 (d, J = 2,1 Hz) berkorelasi dengan sinyal karbon pada pergeseran kimia δC 108,9 ppm. Dua sinyal proton multiplet metilen CH2 pada pergeseran kimia δH 3,08 dan 2,96 ppm, masing-masingnya berkorelasi dengan sinyal karbon metilen CH2 pada pergeseran kimia δC 33,4 dan 36,4 ppm. Data analisis HMQC senyawa 1 hasil isolasi dapat dilihat pada Tabel-4.1 dan Lampiran 5.
δH 6,04 (H-3) memperlihatkan korelasi dengan dua sinyal karbon kuarterner (δC 169,1 dan 124,6) dan satu sinyal karbon metilen pada δC 36,4. Berdasarkan analisis HMQC diketahui sinyal karbon pada δC 169,1 adalah milik C-2, δC 124,6 merupakan sinyal di C-4a dan δC 36,4 adalah sinyal C-8’. Korelasi tersebut dapat dilihat pada Gambar-4.5.
Gambar-4.5. Korelasi sinyal proton H-3 dengan sinyal karbon C-2, C-4a dan C-8’
Proton-proton aromatik sistem ABX pada pergeseran kimia δH 7,48 (d, J =
2,1 Hz) memperlihatkan korelasi dengan dua karbon oksiaril (δC 156,6 dan 151,2) dan satu sinyal karbon δC 124,6 (C-4a). Hasil korelasi tersebut mengindikasikan bahwa subtituen hidroksi terikat di C-6. Dengan demikian sinyal proton pada δH 7,48 (d, J = 2,1 Hz) terletak pada H-5. Sinyal proton pada δH 6,88 (d, J = 8,3 Hz)
Gambar-4.6. Korelasi sinyal proton H-5 dan H-8 dengan sinyal karbon C-4a, C-6, C-7 dan C-8a
Dari keseluruhan hasil analisis disimpulkan bahwa senyawa 1 hasil isolasi adalah 6-hidroksi-2-(2-feniletil)kromon. Data hasil analisis HMBC yang mendukung struktur senyawa 6-hidroksi-2-(2-feniletil)kromon hasil isolasi dapat dilihat pada Tabel-4.2.
Analisis spektrum NMR senyawa 1 hasil isolasi memperlihatkan kesesuaian data dengan senyawa 6-hidroksi-2-(2-feniletil)kromon pada tumbuhan
A. sinensis (Ibrahim, et al., 2014). Data hasil perbandingan
6-hidroksi-2-(2-feniletil)kromon hasil isolasi dan 6-hidroksi-2-(2-6-hidroksi-2-(2-feniletil)kromon pada literatur dapat dilihat pada Tabel-4.3.
benzoil dan sinamoil (Dong, et al., 2012). Penambahan NaOH memberikan efek
batokromik yang menunjukkan senyawa hasil isolasi merupakan senyawa fenolik. Hasil pengukuran spektrum UV senyawa fenolik hasil isolasi dapat dilihat pada Lampiran 7.
Spektrum massa senyawa 2 memperlihatkan ion kuasi molekul positif pada m/z 329,1024 yang sesuai dengan rumus molekul C18H17O6 (perhitungan [M+H]+ 329,1025) berdasarkan hasil pengukuran spektrum massa ionisasi elektrosprey resolusi tinggi (HR-ESI-MS). Hasil pengukuran spektrum massa senyawa 2 hasil isolasi dapat dilihat pada Lampiran 8.
Spektrum 1H-NMR (400 MHz) senyawa 2 hasil isolasi dalam CDCl3 memperlihatkan dua unit sinyal proton aromatik yakni tiga buah sinyal proton aromatik untuk sistem ABX dan dua buah sinyal proton aromatik yang berposisi
meta satu sama lainnya.
Tiga buah proton aromatik dari sistem ABX memperlihatkan sinyal proton pada pergeseran kimia δH 7,53 ppm (dd, J = 8,6 dan 2,1 Hz); 7,34 ppm (d, J = 2,1
Hz); dan 6,98 ppm (d, J = 8,6 Hz). Sepasang sinyal proton dari unit aromatik
lainnya memperlihatkan multiplisitas doublet dengan konstanta kopling meta (J =
2,2 Hz) pada pergeseran kimia δH 6,50 dan 6,38 ppm. Sinyal proton 1H-NMR dari kedua unit aromatik menunjukkan senyawa flavonoid hasil isolasi tersubstitusi pada C-5/C-7/C-3’/C-4’. Sinyal singlet pada δH 6,60 ppm menunjukkan bahwa senyawa 2 hasil isolasi merupakan turunan flavon (Dong, et al., 2012). Senyawa 2
merupakan senyawa flavon tersubstitusi pada C-5/C-7/C-3’/C-4’ seperti terlihat pada Gambar-4.7. Hasil pengukuran spektrum 1H-NMR senyawa 2 hasil isolasi dapat dilihat pada Lampiran 9.
Gambar-4.7. Struktur flavon tersubstitusi C-5/C-7/C-3’/C-4’
Spektrum HMQC (Lampiran 11) senyawa 2 hasil isolasi memperlihatkan korelasi satu ikatan antara sinyal proton 1H-NMR dengan sinyal karbon 13C-NMR. Sebagai contoh, sinyal proton aromatik dari sistem ABX pada pergeseran kimia δH 7,34 ppm (d, J = 2,1 Hz) berkorelasi dengan sinyal karbon δC 108,8 ppm; sinyal proton pada δH 7,53 ppm (dd, J = 8,6 dan 2,1 Hz) mempunyai korelasi
dengan sinyal karbon δC 120,2 ppm; dan sinyal proton pada δH 6,98 ppm (d, J =
8,6 Hz) berkorelasi dengan sinyal karbon pada δC 111,2 ppm. Data analisis HMQC dapat dilihat pada Tabel-4.4.
Tabel-4.4. Hasil analisis spektrum HMQC senyawa 2 hasil isolasi
δH (multiplisitas, J Hz) δH
Gambar-4.8. Korelasi H-3 dengan sinyal karbon C-2, C-4, C-4a dan C-1’
Berdasarkan struktur kimia pada Gambar 4.8 maka sinyal proton aromatik sistem ABX pada pergeseran kimia δH 7,53 ppm (dd, J = 8,6 dan 2,1 Hz)
berkedudukan di H-6’; 7,34 ppm (d, J = 2,1 Hz) di H-2’; dan 6,98 ppm (d, J = 8,6
Gambar-4.9. Korelasi sinyal proton H-2’, H-5’, H-6’, 3’-OCH3 dan 4’-OCH3 dengan sinyal-sinyal atom karbon di cincin B
Gambar-4.10. Korelasi sinyal proton H-6, H-8, 5-OCH3 dan 5-OCH3 dengan sinyal-sinyal atom karbon di cincin A
Berdasarkan data analisis spektrum UV, HR-ESI-MS, 1D dan 2D NMR maka diketahui senyawa 2 hasil isolasi adalah 7-hidroksi-5,3’,4’-trimetoksiflavon, yang strukturnya tertera pada Gambar-4.11.
Gambar-4.11. Strukur kimia 7-hidroksi-5,3’,4’-trimetoksiflavon hasil isolasi
Tabel-4.5. Data spektrum NMR 7-hidroksi-5,3’,4’-trimetoksiflavon dalam CDCl3.
4.3 Penentuan Aktivitas Antikanker Senyawa Hasil Isolasi
Kedua senyawa hasil isolasi, yaitu senyawa 6-hidroksi-2-(2-feniletil)kromon dan 7-hidroksi-5,3’,4’-trimetoksiflavon ditentukan aktivitas antikankernya terhadap sel kanker payudara T47D secara in vitro menggunakan
metode MTT [3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium bromida].
dehidrogenase yang berada pada mitokondria sel kanker payudara T47D. Kristal
formazan yang dihasilkan tersebut tidak dapat larut dalam air. Penambahan reagen dimetil sulfoksida dapat melarutkan kristal formazan yang kemudian diukur absorbansinya pada panjang gelombang 540 nm menggunakan microplate reader.
Intensitas warna biru gelap yang terbentuk sebanding dengan jumlah sel yang hidup. Dalam uji aktivitas antikanker ini, penambahan senyawa 6-hidroksi-2-(2-feniletil)kromon dan 7-hidroksi-5,3’,4’-trimetoksiflavon hasil isolasi dalam berbagai konsentrasi bertujuan untuk menghambat reaksi reduksi garam MTT menjadi kristal formazan oleh enzim suksinat dehidrogenase yang berada di
dalam mitokondria sel kanker payudara T47D hidup.
Daya hambat konsentrasi senyawa uji terhadap sel kanker payudara T47D dinyatakan dalam nilai IC50 yang dihitung melalui ektrapolasi garis 50% serapan senyawa uji terhadap berbagai konsentrasi menggunakan analisis regresi. Sifat sitotoksik suatu senyawa uji dikategorikan kuat jika nilai IC50< 2 ppm (< 10 µM), sedang jika IC50 2-4 ppm (10-20 µM), lemah jika IC50 4-8 ppm (20-40 µM), dan tidak aktif jika IC50> 8 ppm (> 40 µM) (Ito, et al., 2003).
dari kedua senyawa hasil isolasi, yaitu 26,92 ppm meskipun masih dalam kategori tidak aktif.
Data uji aktivitas antikanker dengan sistem triplo pada senyawa
6-hidroksi-2-(2-feniletil)kromon dan 7-hidroksi-5,3’,4’-trimetoksiflavon, juga sistem duplo pada ekstrak etilasetat terhadap sel kanker payudara T47D
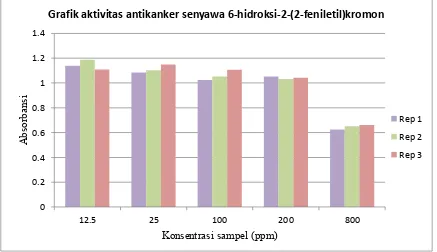
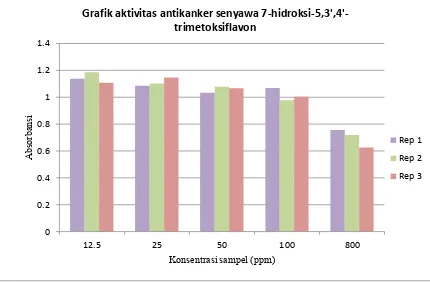
masing-masing terlampir pada Lampiran 13, Lampiran 14 dan Lampiran 15. Grafik aktivitas antikanker dari senyawa 6-hidroksi-2-(2-feniletil)kromon, 7-hidroksi-5,3’,4’-trimetoksiflavon dan ekstrak etilasetat terhadap sel kanker payudara T47D dapat dilihat pada Gambar-4.12, Gambar-4.13 dan Gambar-4.14.
6-hidroksi-2-(2-\
Gambar-4.13 Grafik aktivitas antikanker senyawa 7-hidroksi-5,3’,4’-trimetoksiflavon
Gambar-4.14 Grafik aktivitas antikanker ekstrak etilasetat
BAB V
KESIMPULAN
Berdasarkan hasil penelitian, maka kesimpulan penelitian ini adalah sebagai berikut:
1. Dua senyawa fenolik berhasil diisolasi dari kulit batang Aquilaria microcarpa
yakni senyawa 6-hidroksi-2-(2-feniletil)kromon dan 7-hidroksi-5,3’,4’-trimetoksiflavon. Struktur kedua senyawa fenolik hasil isolasi ditetapkan berdasarkan data pengukuran spektroskopi UV, HR-ESI-MS, 1D NMR (1 H-NMR dan 13C-NMR), dan 2D NMR (HMQC dan HBMC).
(1)
(2)
2. Uji aktivitas 6-hidroksi-2-(2-feniletil)kromon dan 7-hidroksi-5,3’,4’-trimetoksiflavon terhadap sel kanker payudara T47D mempunyai nilai IC50
masing-masing sebesar 2884,03dan 2494,59 ppm. Sedangkan ekstrak etilasetat
mempunyai nilai IC50 sebesar 26,92 Hasil uji aktivitas antikanker kedua senyawa fenolik tersebut dikategorikan tidak aktif, begitu pula dengan ekstrak etilasetat.
5.1 Saran
Alkhathlan, H. Z., Al-Hazimi, H. M., Al-Dhalaan, F. S., and Mousa, A. A., 2005, Three 2-(2-phenylethyl)chromones and two terpenes from agarwood,
Nat. Prod. Res., 19(4), 367-372.
Alley, M.C., Czerwinski, M.J., Scudiro, D.A., Monks, A., and Hursey, M.L., 1988, Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay, Cancer. Res., 48, 589-601.
Ancuceanu, R.V., Pharm, Candidate, and Istudor, V., 2004, Pharmacologically active natural compounds for lung cancer,Altern. Med. Rev., 9 (4),
402-419.
Bhandari, P., Pant, P., and Rastogi, R.P., 1982, Aquillochin a coumarinolignan from Aquilaria agallocha, Phytochem., 21(8), 2147-2149.
Dai, H., Liu, J., Han, Z., Zeng, Y., Wang, H., and Mei, L., 2010, Two new 2-(2-phenylethyl)chromones from Chinese eaglewood, J. Asian. Nat. Prod.,
12(2), 134-137.
Dong, C., Dan, B., Yue-Lin, S., and Peng-Fei, T., 2012, Flavanoids from the stems of Aquilaria sinensis, J Nat. Med., 10, 0287-0291.
Farida, Y., Martati, T., Musir, A., and Edward, B., 2010, Cytotoxic activity and antioxidants from Typhonium divaricatum leaf extract (L) Decne, Indonesian J. Pharm. Sci., 8 (2), 69-140.
Feng, J., Yang, X. W., and Wang, R. F., 2011, Bio-assay guided isolation and identification of α-glucosidase inhibitors from the leaves of Aquilaria sinensis, Phytochem., 72, 242-247.
Gao, X., Xie, M., Liu, S., Guo, X., Chen, X., Zhong, Z., Wang, L., and Zhang, W., 2014, Chromatographic fingerprint analysis of metabolites in natural and artificial agarwood using gas chromatography-mass spectrometry combined with chemometric methods, J. Chrom., 967,
264-273.
Gunasekera, S. P., Kinghorn, A.D., Cordell, G.A., and Farnsworth, S.S., 1981, Plan Anti Cancer Agent. XIX. Constittuent of Aquilaria maaccensis, J Nat. Prod.,44(5), 569-572.
Salah, K.M, and Ab-Kadir, M.O., 2011, Separation and fractionation of
Aquilaria malaccennsis oil using supercritical fluid extraction and the
cytotoxic properties of the extraxted oil, Pro. Food.Sci., 1, 1953-1959.
Ibrahim, Sabrin R.M and Gamal A.Mohamed.,2014. Natural Occuring 2-(2-phenylethyl)chromones, structure elucidation and biological activities,
Nat.Prod.Res
Ishihara, M., Tsuneya, T., and Uneyama, K., 1993, Fragrant sesquiterpenes from agarwood, Phytochem., 33(5), 1147-1155.
Ishihara, M., Masatsugu, Y., and Uneyama, K., 1992, Preparation of(-)-Guaia-1(10),11-dien-15,2-olide and (-)-2α-hydroxyguaia-1(10),11-dien-15-oic acid, fragrant sesquiterpenes in agarwood (Aquilaria agallocha Roxb.), Tetrahedron., 48(47), 10265-10276.
Ishihara, M., Tsuneya, T., Shiga, M., and Uneyama, K., 1991, Three sesquiterpenes from agarwood, Phytochem., 30(2), 563-566.
Ishihara, M., Tsuneya, T., and Uneyama, K., 1991, Guaiane sesquiterpenes from agarwood, Phytochem., 30(10), 3343-3347.
Ito, C., Itoigawa, M., Takakura, T., Ruangrungsi, N., Enjo, F., Tokuda, H., Nishino, H., and Furukawa, H., 2003, Chemical constituents of
Garcinia fusca: Structure elucidation of eight new xanthones and their
cancer hemopreventive activity, J. Nat. Prod., 66 (2), 200-205.
Jagetia, G. C., and Rao, S. K., 2006, Evaluation of the antineoplastic activity of guduchi (Tinospora cordifolia) in ehrlich ascites carcinoma bearing mice, Biol. Pharm. Bull.,29(3), 460-466.
Jaswir, I., Noviendri, D., Salleh, H. M., Taher, M., and Miyashita, K., 2011, Isolation of Fucoxanthin and Fatty Acids Analysis of Padina australis and Cytotoxic Effect of Fucoxanthin on Human Lung Cancer (H1299) Cell Lines, African J. Biotech., 10 (81), 18855-18862.
Konishi, T., Konoshima, T., Shimada, Y., and Kiyosawa, S., 2002, Six New 2-(2-Phenylethyl)chromones from Agarwood, Chem. Pharm. Bull., 50(3),
419-422.
Kristanti, A., Aminah, N. S., Tanjung, M., dan Kurniadi B., 2008, Buku Ajar Fitokimia, Surabaya; Airlangga University press.
Dai, H. F., 2015, Five new eudesmane-type sesquiterpenoids from Chinese agarwood induced by artificial holing, Fitote., 100, 44-49.
Liu, J., Wu, J., Zhao, Y. X., Deng, Y. Y., Mei, W. L., and Dai., 2008, H. F., A new cytotoxic 2-(2-phenylethyl)chromone from Chinese eaglewood,
Chinese. Chem. Letters., 19, 934-936.
Manitto, P. 1992. Biosintesis Produk Alami. Cetakan Pertama. Terjemahan Koensoemardiyah dan Sudarto. New York: Ellis Horwood Limited. Nakanishi, T., Yamagata, E., Yoneda, K., and Miura, I., 1981, Jinkohol, a
prezizane sesquiterpene alcohol from agarwood, Phytochem., 20(7),
1597-1599.
Nakanishi, T., Yamagata, E., Yoneda, K., Nagashima, T., Kawasaki, I., Yoshida, T., Mori, H., and Miura, I., 1984, Three fragrant sesquiterpenes of agarwood, Phytochem., 23(9), 2066-2067.
Nakanishi, T., and Nishi, A. I. M., 1986, A new and a known derivates of 2-(2-phenylethyl) chromone from a kind of agarwood (“Kanankoh” in japanese) originating from Aquilaria agallocha, J Nat. Prod., 49(6),
1106-1108.
Okudera, Y., and Ito, M., 2009, Production of agarwood fragrant constituents in
Aquilaria calli and cell suspension cultures, Plant. Biotech., 26,
307-315.
Peng, K., Mei, W., Zhao, Y., Tan, L., Wang, Q., and Dai, H., 2011, A novel degraded sesquiterpene from the fresh stem of Aquilaria sinensis, J. Asian. Nat. Prod. Res., 13(10), 951-955.
Qi, J., Lu, J.J., Liu, J.H., Yu, B.Y., 2009, Flavonoid and a rare benzophenone glycoside from the leaves of Aquilaria sinensis, Chem. Pharm. Bull.,
57, 134-137.
Ren,W., Qiao,Z.,Wang, H.,Zhu,L., and Zhang, L., 2003, Flavonoids: Promising
anticancer agents, Med. Res. Rev., 23(4), 519-534.
Sukmarianti, N. W. S., Suaniti, N. M., and Swantara, I. M. D., 2013, Identifikasi dan uji aktivitas antikanker ekstrak spons Ianthella basta terhadap larva Artemia salina L., Ind. E-J. App. Chem., 1 (1), 14-19.
Sun, J., Wang, S, Xia, F., Wang, K. Y., Chen, J. M., and Tu, P. F., 2014, Five new benophenone glycosides from the leaves of Aquilaria sinensis (Lour.)
Kehutanan. Departemen Kehutanan. Jakarta.
Ueda, J., Imamura, L., Tezuka, Y., Tran, Q.L., Tsuda, M., and Kadoota, S., 2006, New sesquiterpene from Vietnamese agarwood and its induction effect on brain-derived neurotrophic factor mRNA expression in vitro, J Bioorg. Med. Chem., 14, 3571-3574.
Wiriadinata, 2009. Para pemilik keharuman, (http://www.lipi.go.id/bio_indonesia/ diakses 27 Oktober 2015 pukul 20.17)
Wu, Y., Liu, C., Li, H., Sun, J., Li, Y., Gu, W., Wang, D., Liu, J., and Hu, Y., 2014, A novel neolignan glycoside from Aquilaria sinensis. Bio. Sys and eco., 55, 41-45
Yagura, T., Ito, M., Kiuci, F., Honda, G., and Shimada, Shimada, Y., 2003, For new 2-(2-phenylethyl)chromones derivates from withered wood of
Aquilaria sinensis,Chem. Pharm. Bull., 51(5), 560-564.
Yagura, T., Shibiyama, N., Ito, M., Kiuci, F., and Honda, G., 2005, Three novel diepoxy tetrahydrochromones from agarwood artificially produced by intentional wounding, Tetrahedron Lett., 46, 4395–4398.
Yang, D. L., Wang, H., Guo, Z. K., Dong, W. H., Mei, W. L., and Dai, H. F., 2014, A new 2-(2-phenylethyl)chromone derivative in Chinese agarwood‘Qi-Nan’ from Aquilaria sinensis, J Asian. Nat. Prod. Res.,
16(7), 770-776.
Yang, L., Qiao, L., Ji C.,Xie, D., Gong, N.B., Lu, Y., Zhang, J., Dai, J., and Guo, S., 2013, Antidepressant abietane diterpenoids from Chinese eaglewood, J Nat, Prod., 76, 216−222.
Yang, L., Qiao, L., Ji C.,Xie, D., Yuan, Y., Chen, N., Dai, J., and Guo, S., 2012, 2-(2-Phenylethyl)chromones from Chinese eaglewood, Phytochem., 76,
92-97.
Yang, X. B., Feng, J., Yang, X. W., Zhao, B., and Liu, J. X., 2012, Aquisiflavoside, a new nitric oxide production inhibitor from the leaves of Aquilaria sinensis, J Asian. Nat. Prod. Res., 14(9), 867-872.
Yang, L., Qiao, L., Zhang, J., Dai, J., and Guo, S., 2012, Two new sesquiterpenes derivatives from Chinese eaglewood, J. Asian. Nat. Prod., 14(11),
1054-1058
2012, Production of high-quality agarwood in Aquilaria sinensis trees
via whole-tree agarwood-induction technology, China. Chem. Lett., 23,
727-730.
Zhang, Y., Wang, W., and Zhang, J., 2004, Effects of novel anxiolytic 4-butyl-alpha-agarofuran on levels of monoamine neurotransmitters in rats,
Europ. J Pharm., 504, 39-44.
Zhou, M., Wang, H., Suolangjiba.,Kou, J., and Yu, B., 2008, Antinociceptive and anti-inflammatory activities of Aquilaria sinensis (Lour.) Gilg. Leaves extract, Ethnopharm., 117, 345–350.
LAMPIRAN
Lampiran 1. Hasil pengukuran spektrum UV senyawa 1 dalam metanol
Lampiran 3. Hasil pengukuran spektrum 1H-NMR senyawa 1
Lampiran 5. Hasil pengukuran HMQC senyawa 1
Lampiran 7. Hasil pengukuran spektrum UV senyawa 2 dalam metanol
Lampiran 9. Hasil pengukuran spektrum 1H-NMR senyawa 2
Lampiran 11. Hasil pengukuran HMQC senyawa 2
Lampiran 13. Data dan tabel hasil uji aktivitas antikanker 6-hidroksi-2-(2-feniletil)kromon
Konsentrasi sampel (ppm)
Absorbansi
Replikasi 1 Replikasi 2 Replikasi 3
12,5 1,139 1,187 1,108
25 1,085 1,102 1,148
100 1,026 1,052 1,106
200 1,052 1,033 1,043
800 0,625 0,651 0,662
Lampiran 14. Data dan tabel hasil uji antikanker 7-hidroksi-5,3’,4’-trimetoksiflavon
Konsentrasi
sampel (ppm) Replikasi 1 Absorbansi Replikasi 2 Replikasi 3
12,5 1,114 1,111 1,102
25 1,106 1,089 1,047
50 1,033 1,078 1,066
100 1,068 0,978 1,005
800 0,756 0,719 0,625
Lampiran 15. Data dan tabel hasil uji aktivitas antikanker ekstrak etilasetat Konsentrasi
sampel (ppm) Replikasi 1 Absorbansi Replikasi 2
12,5 0,882 0,961
25 0,790 0,663
50 0,157 0,191