BAB I
PENDAHULUAN
A. Latar Belakang
Sukrosa adalah senyawa disakarida dengan rumus molekul C12H22O11.
Sukrosa terbentuk melalui proses fotosintesis yang ada pada tumbuh-tumbuhan. Pada proses tersebut terjadi interaksi antara karbon dioksida dengan air didalam sel yang mengandung klorofil. Bentuk sederhana dari persamaan tersebut adalah :
6 CO2 + 6 H2O —–> C6H12O6 + 6 O2
Gula tebu adalah disakarida, gula tersebut dapat dibuat dari gabungan dua gula yang sederhana yaitu glukosa dan fruktosa (monosakarida). Penggabungan dari dobel unit karbon monosakarida menjadi : C12H22O11 yang selanjutnya dinamakan sukrosa
atau saccharose.
Sukrosa pada kondisi larutan dengan brix rendah dapat mengalami dekomposisi yang salah satunya dapat disebabkan karena hidrolisis. Dalam larutan yang mengandung asam, sukrosa mengalami hidrolisis menghasilkan D – Glukosa dan D – Fruktosa. Sukrosa murni memutar bidang polarisasi ke kanan (+), sedangkan hasil hidrolisis berupa campuran senyawa yang memutar bidang polarisasi ke kiri (-), sehingga proses ini disebut inversi. Kehilangan gula akibat hidrolisi harus diperhatikan terutama pada pH rendah dan suhu yang tinggi. Kehilangan gula dapat menimbulkan kerugian bagi pabrik. Oleh karena itu pada percobaan ini akan ditentukan orde reaksi dari reaksi inversi gula menggunakan polarimeter.
B. Rumusan Masalah
Berapa orde reaksi dari reaksi inversi gula menggunakan polarimeter?
C. Tujuan
BAB II
TINJAUAN PUSTAKA
Istilah laju atau kecepatan sering dibicarakan dalam pelajaran fisika. Pengertian laju dalam reaksi sebenarnya sama dengan laju pada kendaraan yang bergerak. Reaksi kimia menyangkut perubahan dari suatu pereaksi (reaktan) menjadi hasil reaksi (produk), yang dinyatakan dalam persamaan reaksi.
Pereaksi (reaktan) Hasil reaksi (produk)
Persamaan laju reaksi pertama kali dikemukakan oleh Gulberg dan Wooge dalam hukum Aksi Massa. Mereka menyebutkan laju reaksi pada suatu sistem pada temperatur tertentu berbanding lurus dengan konsentrasi zat yang bereaksi setelah tiap – tiap konsentrasi dipangkatkan dengan koefisien dalam persamaan
yang bersangkutan. Dengan cara fisis penentuan konsentrasi dilakukan secara langsung, yaitu berdasar sifat–sifat fisis campuran yang dipengaruhi oleh konsentrasi campuran, misalnya daya hantar listrik, tekanan, adsorbsi cahaya, dan sebagainya. Penentuan secara kimia dilakukan dengan menghentikan reakis secara tiba – tiba (reaksi dibekukan) setelah selang waktu tertentu, kemudian konsentrasinya dihitung dengan analisis kimia. Laju reaksi akan menurun dengan bertambahnya waktu. Hal ini menunjukkan adanya hubungan antara konsentrasi zat yang tersisa saat itu dengan laju reaksi sehingga dapat dikatakan umumnya laju reaksi tergantung pada konsentrasi awal dari zat – zat pereaksi, pernyataan ini dikenal sebagai Hukum Laju Reaksi atau Persamaan Laju Reaksi
m A + n B o C + p D Dalam persamaan laju reaksi dapat dituliskan
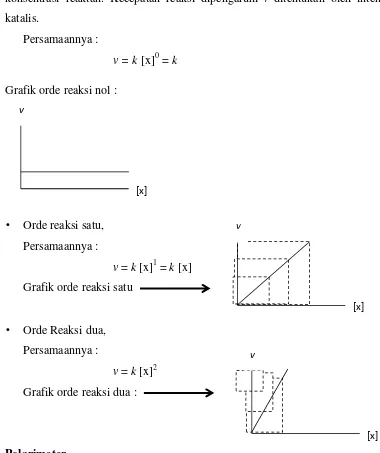
harga k tergantung pada suhu, jika suhunya tetap harga k juga tetap. Untuk mengetahui hubungan pereaksi dengan reaktan, digunakan orde reaksi yang diperoleh dari perhitungan konsentrasi sehingga grafik yang diperoleh berbentuk grafik perpangkatan. Harga k tergantung pada tingkat (orde) reaksi totalnya. Apabila ditunjukkan dengan grafik antara laju reaksi terhadap konsentrasi, maka diperoleh grafik sebagai berikut :
● Orde reaksi nol,
Reaksi yang memiliki kecepatan reaksi tetap dan tidak dipengaruhi konsentrasi reaktan. Kecepatan reaksi dipengaruhi / ditentukan oleh intensitas katalis.
Persamaannya :
v = k [x]0 = k
Grafik orde reaksi nol :
• Orde reaksi satu, Persamaannya :
v = k [x]1 = k [x] Grafik orde reaksi satu
• Orde Reaksi dua, Persamaannya :
v = k [x]2 Grafik orde reaksi dua :
Polarimeter
Polarimetri adalah suatu cara analisa yang didasarkan pada pengukuran sudut putaran (optical rotation) cahaya terpolarisir oleh senyawa yang transparan dan
optis aktif apabila senyawa tersebut dilewati sinar monokromatis yang terpolarisir tersebut.
Senyawa optis aktif adalah senyawa yang dapat memutar bidang getar sinar terpolarisir. Zat yang optis ditandai dengan adanya atom karbon asimetris atau atom C kiral dalam senyawa organik, contoh : kuarsa ( SiO2 ), fruktosa.
Cahaya monokromatik pada dasarnya mempunyai bidang getar yang banyak sekali. Bila dikhayalkan maka bidang getar tersebut akan tegak lurus pada bidang datar. Bidang getar yang banyak sekali ini secara mekanik dapat dipisahkan menjadi dua bidang getar yang saling tegak lurus. Yang dimaksud dengan cahaya terpolarisasi adalah senyawa yang mempunyai satu arah getar dan arah getar tersebut tegak lurus terhadap arah rambatnya.
Prinsip dasar polarimetris ini adalah pengukuran daya putar optis suatu zat yang
menimbulkan terjadinya putaran bidang getar sinar terpolarisir. Pemutaran bidang getar sinar terpolarisir oleh senyawa optis aktif ada 2 macam, yaitu :
1. Dexro rotary (+), jika arah putarnya ke kanan atau sesuai putaran jarum jam.
2. Levo rotary (-), jika arah putarnya ke kiri atau berlawanan dengan putaran jarum jam.
Inversi Gula
Karbohidrat merupakan senyawa karbon, hidrogen dan oksigen yang terdapat dalam alam. Karbohidrat sangat beranekaragam sifatnya. Misalnya, sukrosa (gula pasir) dan kapas, keduanya adalah karbohidrat. Salah satu perbedaan utama antara pelbagai tipe karbohidrat ialah ukuran molekulnya.
Gula merupakan zat optis aktif. Bila cahaya terpolarisasi linier jatuh pada bahan optis aktif, maka cahaya yang keluar bahan akan tetap terpolarisasi linier dengan arah bidang getar terputar terhadap arah bidang getar semula
Sifat optis aktif zat dispesifikasikan dengan sudut putar jenis.Sudut putar bidang polarisasi sebanding dengan sudut putar jenis dan konsentrasi bila sudut putar jenis diketahui dan sudut putar bidang polarisasi dapat diukur, maka
Gula inversi adalah campuran D-glukosa dan D- fruktosa yang diperoleh dengan hidrolisis asam atau enzimatik dari sukrosa. Enzim yang mengkatalis hidrolisis sukrosa disebut invertase,bersifat spesifik untuk ikatan β -D-fruktofuranosida dan terdapat dalam ragi dan lebah (madu terutama terdiri dari gula inversi). Berdasarkan teori bahwa mayoritas gula adalah fruktosa dan fruktosa membelokkan cahaya ke kiri. Gula yang terdiri dari Sukrosa maupun Glukosa memutar cahaya ke kanan. Sukrosa memiliki rotasi +66,5° (positif) produk yang dihasilkan glukosa[α]= +52,7° dan fruktosa [α] = -92,4o mempunyai rotasi netto negatif.Dengan mengetahui pembelokan cahaya yang dihasilkan oleh larutan gula, dapat di analisa jenis/komposisi gula yang ada dalam larutan tersebut
Sudut putar jenis jenis dapat dihitung :
[ ]
Kinetika reaksi inversi gula merupakan reaksi orde satu terhadap sukrosa. Dalam larutan gula yang netral (pH=5) reaksi hidrolisa gula mempunyai waktu paruh 10 minggu. Sedangkan didalam larutan asam, dengan adanya katalis ion H+, waktu paruh tersebut lebih pendek. Hukum laju reaksi inversi gula tersebut dapat diungkapkan sebagai berikut:
R = - d (gula) / dt = k (H+)(H2O)(gula)
Dengan metode grafik, dapat dikemukakan sebagai berikut. Reaksi hidrolisis dari percobaan:
Cara Penggunaan Polarimeter
Cara penggunaan berikut adalah cara pada Zeiss Polarimeter, tetapi secara umum cara penggunaan polarimeter manapun adalah sama. Untuk memulai penggunaan polarimeter pastikan tombol power pada posisi on dan biarkan selama 5-10 menit agar lampu natriumnya siap digunakan. Selalu mulai dengan menentukan keadaan nol (zero point) dengan mengisi tabung sampel dengan pelarut saja. Keadaan nol ini perlu untuk mengkoreksi pembacaan atau pengamatan rotasi optik. Tabung sampel harus dibersihkan sebelum digunakan agar larutan yang diisikan tidak terkontaminasi zat lain. Pembacaan/pengamatan bergantung kepada tabung sampel yang berisi larutan/pelarut dengan penuh. Perhatikan saat menutup tabung sampel, harus dilakukan hati-hati agar di dalam
tabung tidak terdapat gelembung udara.
Bila sebelum tabung diisi larutan didapat keadaan terang, maka setelah tabung
BAB III PEMBAHASAN
Pada percobaan penentuan orde reaksi dari reaksi inversi gula menggunakan polarimeter diperoleh data sebagai berikut :
No Waktu Sudut Polarisasi
1 0 46.15o
2 5 44.35°
3 10 31.85°
4 15 25.73°
5 20 16.49°
6 25 10.29°
Dari data diatas maka dapat ditentukan orde reaksi dari reaksi inversi gula dengan menggunakan metode grafik dan non grafik.
• Metode Integral Non Grafik untuk Orde satu
Waktu ln Sudut Polarisasi
0 3.831
5 3.792
10 3.461
15 3.247
20 2.802
25 2.331
∶ = − −
Pada t = 5 menit kt = ln a – ln (a-x) k.5 = 3.831 – 3,792 k.5 = 0,039
Pada t = 10 menit
• Metode Integral Grafik untuk Orde satu
Waktu ln Sudut Polarisasi
k.10 = 0,010
• Metode Integral Grafik untuk Orde dua
k.20 = 0.003159
• Metode Integral Grafik untuk Orde tiga
Waktu 1/(Sudut Polarisasi)2
Sehingga, menggunakan metode integral secara non grafik tidak dapat dibuktikan bahwa orde reaksi dari reaksi inversi gula adalah orde satu menurut teori.
BAB IV KESIMPULAN
DAFTAR PUSTAKA
Anonim A.2009.inversi gula.www.wikipedia.com.Diakses tanggal :5 Desember 2011
Anonim B.2010.Polarimeter.www.scribd,co.Diakses Tanggal : 5 Desember 2011
Anonim C.2009.orde reaksi.www.chemistry.org.Diakses Tanggal : 5 Desember 2011
Atkins..P.W. 1990. Kimia Fisika jilid 2 edisi ke empat. Jakarta. : Erlangga
Fessenden , Fessenden.1982. Kimia Organik edisi ketiga jilid 2.Jakarta Erlangga.
Reski Wahyudi, Udin.2011.Polarimeter.http://www. blogspot.com (Diakses pada
tanggal 18 Desember 2011)