i
APLIKASI SERABUT KELAPA
SEBAGAI ADSORBSI UNSUR Pb DALAM SAMPEL CAIR
DENGAN METODE LASER INDUCED BREAKDOWN SPECTROSCOPY (LIBS)
SKRIPSI
BIDANG MINAT FISIKA TERAPAN
Ida Ayu Gede Kusuma Dewi
JURUSAN FISIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS UDAYANA
vii
APLIKASI SERABUT KELAPA SEBAGAI ADSORBSI UNSUR Pb DALAM SAMPEL CAIR DENGAN METODE LASER INDUCED BREAKDOWN
SPECTROSCOPY (LIBS)
[Skripsi]
Karya Tulis ini tidak dipublikasikan tetapi tersedia diperpustakaan di lingkungan Universitas Udayana, diperkenankan dipakai sebagai referensi kepustakaan tetapi
pengutipan harus menyebutkan sumbernya sesuai dengan kebiasaan ilmiah
viii
KATA PENGANTAR
Puji syukur penyusun panjatkan kehadirat Tuhan Yang Maha Esa, karena atas rahmat dan berkat-Nya penyusun dapat menyelesaikan skripsi yang berjudul “Aplikasi Serabut Kelapa sebagai Adsorbsi Unsur Pb dalam Sampel Cair dengan Metode Laser
Induced Breakdown Spectroscopy (LIBS)”.
Penyusun mengucapkan terimakasih kepada seluruh pihak yang telah membantu dan mendukung terselesaikannya skripsi ini. Ucapan terimakasih tersebut penyusun sampaikan kepada:
1. Bapak Dr. Hery Suyanto, M.T, selaku dosen pembimbing I yang telah memberikan bimbingan, dukungan dan pengetahuan tentang konsep yang sangat banyak, serta tema pokok yang telah diberikan demi terselesaikannya skripsi ini.
2. Bapak Drs. Ida Bagus Alit Paramata, M.Si, selaku dosen pembimbing II yang telah memberikan bimbingan dan koreksi yang sangat bermanfaat demi terselesaikannya skripsi ini.
3. Bapak Ir. S. Poniman, M.Si selaku Ketua Jurusan Fisika FMIPA Universitas Udayana yang telah mengesahkan skripsi ini.
4. Bapak dan Ibu dosen Fisika FMIPA Universitas Udayana yang telah memberikan masukan dan pengetahuan.
5. Bapak I.B Putra Yadnya, S.Sos, dan Ibu I.A Putu Tantri selaku orang tua kandung yang selalu mendoakan dan memberikan bekal.
6. Universitas Udayana melalui hibah penelitian unggulan perguruan tinggi tahun anggaran 2015 PNBP dengan surat perjanjian penugasan nomor : 246-308/UN14.2/PNL.01.03.00/2015 yang telah membantu untuk membiayai selama penelitian berlangsung.
Penyusun menyadari bahwa pemaparan materi dalam skripsi ini kurang sempurna dan masih terdapat keterbatasan dalam penyampainnya. Oleh karena itu penyusun mengharapkan kritik dan saran dari pembaca agar skripsi ini menjadi lebih baik lagi.
Bukit Jimbaran, Januari 2016
ix ABSTRAK
Telah dilakukan penelitian tentang aplikasi serabut kelapa sebagai adsorbsi unsur Pb dalam sampel cair dengan metode Laser Induced Breakdown Spectroscopy (LIBS). Penelitian ini bertujuan untuk mengetahui optimasi waktu tunggu pengeringan dan suhu pemanasan sampel, serta menentukan konsentrasi minimum larutan unsur logam berat Pb yang mampu diadsorbsi oleh serabut kelapa. Penelitian dilakukan dalam tiga tahap. Tahap pertama dilakukan penentuan optimasi waktu tunggu pengeringan sampel (10 menit, 20 menit, 30 menit). Tahap kedua penentuan optimasi suhu pemanasan sampel (50°C, 60°C, 70°C, dan 80°C). Terakhir penentuan konsentrasi larutan Pb yang mampu diadsorbsi oleh serabut kelapa dengan konsentrasi 25 ppm, 20 ppm, 15 ppm, dan 10 ppm. Pengambilan data dilakukan oleh LIBS dengan energi laser 120mJ, akumulasi 2, dan waktu tunggu deteksi 1 µs. Emisi atom netral Pb I 405,78 nm ditangkap oleh spektrometer HR 2500⁺ dan ditampilkan spektrum intensitas fungsi panjang gelombang. Data menunjukan bahwa waktu tunggu pengeringan optimum dan suhu optimum pemanasan sampel masing-masing adalah 20 menit dan 70°C. Data juga menunjukan bahwa metode ini dapat menganalisis konsentrasi Pb dengan deteksi limit sebesar 2,91 ppm.
Kata Kunci : Unsur Pb, Serabut kelapa, Adsorbsi, LIBS, Deteksi limit.
ABSTRACT
Research on the application of coconut fibers as Pb adsorption element in the liquid sample by method of Laser Induced Breakdown Spectroscopy (LIBS) has been done. This study aims to determine the waiting time optimization of drying, heating temperature of the sample, and determine the minimum concentration of heavy metals Pb adsorbed by coconut fibers. The study was conducted in three stages. The first stage is the determination of the waiting time optimization of drying samples (10 min, 20 min, 30 min). The second stage is the optimization determination of sample heating temperature (50°C, 60°C, 70°C and 80°C). Final is the determination of the minimum concentration of Pb adsorbed by coconut fibers with a concentration of 25 ppm, 20 ppm, 15 ppm and 10 ppm. Data were collected by LIBS with laser energy of 120 mJ, accumulation of 2, and the delay time detection 1 µs. Neutral atom emission Pb I 405.78 nm captured by the spectrometer HR 2500⁺ and displayed in intensity as a function of wavelength. Data shows that the optimum waiting time of drying and the temperature of heating were 20 minutes and 70°C respectively. The data also show that this method can analyze the concentration of Pb with a limit detection of 2.91 ppm.
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
FAKTA INTEGRITAS ... ii
LEMBAR PRASYARAT GELAR ... iii
LEMBAR PENGESAHAN TUGAS AKHIR ... iv
LEMBAR PERSETUJUAN ... v
PEDOMAN PENGGUNAAN ... vi
KATA PENGANTAR ... vii
ABSTRAK ... viii
DAFTAR ISI ... ix
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 2
1.3 Batasan Masalah ... ... 2
1.4 Tujuan Penelitian ... ... 3
1.5 Sistematika Penulisan ... 3
1.6 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Polimer Organik ... 5
2.1.1 Serabut kelapa ... 6
2.2 Immobilisasi Ion ... 7
2.2.1 Adsorbsi ... 7
2.2.2 Kompleksasi ... 9
2.2.3 Pertukaran Ion ... 9
2.3 Interaksi Laser dengan Bahan ... 10
2.3.1 Laser ... 10
xi
2.3.3 Metode deteksi plasma menggunakan LIBS ... 12
2.4 Karakteristik Unsur Pb ... 14
2.4.1 Unsur timbal/plumbum (Pb) ... 14
2.4.2 Karakteristik unsur Pb ... 15
2.5 Konsentrasi Larutan ... 16
BAB III METODE PENELITIAN ... 17
3.1 Tempat dan Waktu Penelitian ... 17
3.1.1 Tempat dan waktu penelitian ... 17
3.2 Alat dan Bahan ... 17
3.2.1 Alat ... 17
3.2.2 Bahan ... 17
3.3 Sistematika Penelitian ... 18
3.3.1 Penentuan waktu pengeringan dan suhu penguatan sampel (serabut kelapa) ... 18
3.3.2 Penentuan konsentrasi unsur logam berat Pb yang mampu diadsorbsi sampel ... 18
3.4 Pengambilan Data ... 18
3.5 Bagan Alir Penelitian ... 20
3.5.1 Analisis bahan serabut kelapa ... 20
3.5.2 Optimasi waktu tunggu dan suhu pemanasan sampel ... 22
3.5.3 Optimasi analisis kuanlitatif larutan Pb dengan metode LIBS ... 22
3.6 Tabel Data Penelitian ... 23
3.6.1 Data optimasi waktu tunggu pengeringan sampel ... 23
3.6.2 Data optimasi suhu pemanasan sampel ... 23
3.6.3 Data konsentrasi yang mampu diadsorbsi oleh sampel ... 23
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian ... 24
4.1.1 Penentuan optimum waktu tunggu pengeringan sampel ... 24
4.1.2 Penentuan suhu optimum penguatan ikatan unsur Pb teradsorbsi ... 25
4.1.3 Penentuan konsentrasi larutan logam berat Pb ... 25
xii BAB V PENUTUP
5.1 Kesimpulan ... 32 5.2 Saran ... 32 DAFTAR PUSTAKA
xiii
DAFTAR TABEL
Halaman Tabel 2.1 Karakteristik unsur Pb ... 15 Tabel 3.1 Data hasil optimasi waktu tunggu penembakan sampel
dengan energi laser tetap ... 23 Tabel 3.2 Data hasil optimasi suhu pemanasan sampel dengan
energi laser dan waktu tunggu penembakan sampel tetap ... 23 Tabel 3.3 Data konsentrasi larutan yang mampu difiltrasi oleh sampel ... 23 Tabel 4.1 Nilai intensitas maksimal unsur Pb terhadap waktu pengeringan .... 24 Tabel 4.2 Nilai intensitas maksimal unsur Pb terhadap perubahan suhu
penguatan sampel ... 25 Tabel 4.3 Nilai intensitas maksimal unsur Pb terhadap perubahan konsentrasi
larutan Pb ... 26 tabel 4.4 Nilai standar deviasi untuk masing-masing penurunan konsentrasi
xiv
DAFTAR GAMBAR
Halaman
Gambar 2.1 Mekanisme reaksi polimer adisi ... 5
Gambar 2.2 Mekanisme reaksi polimer kondensasi ... 6
Gambar 2.3 Bagian-bagian buah kelapa ... 7
Gambar 2.4 Ilustrasi sederhana sebuah atom ... 10
Gambar 2.5 Eksitasi elekron ke tingkat energi yang lebih tinggi ... 11
Gambar 2.6 Kembalinya elektron ke tingkat energi semula disertai emisi cahaya ... 11
Gambar 2.7 Skema sederhana komponen utama LIBS ... 12
Gambar 2.8 Metode deteksi plasma pada LIBS ... 13
Gambar 3.1 Skema rangkaian alat Laser Induced Breakdown Spectroscopy (LIBS) ... 19
Gambar 3.2 Bagan alir analisis bahan serabut kelapa ... 20
Gambar 3.3 Skema alur penentuan waktu tunggu pengeringan dan suhu penguatan sampel ... 21
Gambar 3.4 Bagan alir analisis kuanlitatif sampel cair ... 22
Gambar 4.1 Grafik intensitas emisi atom netral Pb 405,78 nm fungsi waktu tunggu pengeringan sampel ... 27
Gambar 4.2 Grafik intensitas emisi atom netral Pb 405,78 nm fungsi optimasi suhu penguatan sampel ... 28
Gambar 4.3 Grafik intensitas emisi atom netral Pb 405,78 nm fungsi konsentrasi untuk penurunan konsentrasi larutan Pb 1000 ppm, 500 ppm, 50 ppm, 30 ppm, 25 ppm, 20 ppm, 15 ppm, dan 10 ppm ... 29
1
BAB I PENDAHULUAN
1.1Latar Belakang
Logam berat seperti Pb merupakan salah satu jenis polutan yang paling banyak ditemukan pada perairan. Polutan jenis ini kebanyakan dihasilkan oleh limbah industri yang dibuang ke lingkungan tanpa melalui suatu proses tertentu dan tidak dapat hilang begitu saja secara alami. Hal ini dapat membahayakan kehidupan manusia dan makhluk hidup lain yang mengkonsumsinya. Untuk itu perlu dilakukan pencegahan limbah tersebut sebelum dilakukan pembuangan ke lingkungan. Para peneliti telah banyak melakukan pencegahan prefentif melalui beberapa metode, diantaranya metode immobilisasi ion yang mana meliputi pertukaran ion, kompleksasi dan adsorpsi.
Metode adsorpsi merupakan salah satu metode yang paling potensial untuk menganalisis limbah logam di air, karena prosesnya yang relatif sederhana, dapat di daur ulang, biaya yang dibutuhkan relatif murah dan dapat bekerja pada konsentrasi rendah (Ratnaningsih, 2007). Akan tetapi masalah yang muncul adalah jenis bahan apa saja yang mampu mengadsorpsi berbagai jenis logam berat yang terkandung dalam zat cair tersebut. Beberapa peneliti telah melakukan metode ini dengan berbagai jenis bahan alam diantaranya menggunakan adsorben jerami padi (Zahrah, dkk, 2013), menggunakan batu paras (Agustiningrum, 2012) dan (Diantariani, 2010), menggunakan batu zeolit (Priyo, 2014). Kebanyakan penelitian-penelitian tersebut di atas hanya memperhatikan unjuk kerja dari bahan tersebut yaitu tentang analisis kualitatif untuk mengetahui unsur yang teradsorpsi dengan cara menganalisis sampel cair sebelum dan sesudah perlakuan adsorbsi. Tetapi tidak pernah menganalisis bahan adsorbennya. Selain itu penelitian yang dilakukan memerlukan banyak perlakuan baik pada sampel yang akan diteliti maupun pada adsorbennya yaitu melalui proses aktivasi, sehingga jauh lebih sulit dan memerlukan waktu yang cukup lama pula.
Berdasarkan kelemahan penelitian-penelitian sebelumnya, maka pada penelitian ini menggunakan polimer organik seperti serabut kelapa yang banyak ditemukan di alam bebas dan dimanfaatkan sebagai adsorben unsur logam berat Pb dalam sampel cair yang kemudian dianalisis melalui Laser Induced Breakdown Spectroscopy (LIBS). Laser Induced Breakdown Spectroscopy (LIBS) merupakan metode spektroskopi untuk
2
analisis kualitatif dan kuantitatif unsur yang terkandung dalam sebuah bahan. Metode ini sangat baik digunakan untuk analisis sampel padat dan gas. Sedangkan untuk sampel cair harus ditransformasikan kebentuk padat dengan cara adsorbansi. Sampel diiradiasi dengan laser kemudian emisi unsur dalam sampel tersebut ditangkap oleh detektor yang kemudian ditampilkan sebagai intensitas fungsi panjang gelombang. Sehingga pendeteksian unsur yang terkandung dalam sampel berlangsung sangat cepat.
Proses transformasi sampel cair ke padat, dalam penelitian ini menggunakan metode adsorbsi. Adsorben yang digunakan adalah polimer organik serabut kelapa. Polimer ini mempunyai gugus aktif yang mampu mengadsorbsi ion-ion dan sampel cair dalam jumlah tertentu dan proses pengadsorbsian membutuhkan waktu serta membutuhkan perlakuan penguatan ikatan diantaranya dengan cara meningkatkan suhu bahan adsorben tersebut.
Berdasarkan uraian di atas, pada penelitian ini akan melakukan pengadsorbsian unsur logam berat Pb yang ada dalam larutan dengan menggunakan serabut kelapa yang dianalisis menggunakan Laser Induced Breakdown Spectroscopy (LIBS).
1.2Rumusan Masalah
Berdasarkan latar belakang yang sudah dipaparkan, maka diperoleh rumusan masalah sebagai berikut:
1. Berapa waktu tunggu pengeringan yang optimum?
2. Berapa suhu penguatan unsur Pb dengan polimer organik?
3. Berapakah besar konsentrasi unsur logam berat Pb yang mampu diadsorbsi oleh serabut kelapa?
1.3Batasan Masalah
Batasan masalah dari penelitian ini adalah sebagai berikut :
1. Penelitian ini menggunakan 1 jenis unsur logam berat yaitu Pb dalam sampel cair.
2. Penelitian ini menggunakan serabut kelapa gading yang tumbuh diwilayah pedesaan bertempat di Desa Cempaga, Kec. Bangli, Kab. Bangli, Provinsi Bali. 3. Penelitian ini menggunakan peralatan LIBS yang ada di Laboratorium Bersama
FMIPA Universitas Udayana.
3
1.4Tujuan Penelitian
Tujuan dari penelitian ini adalah sebagai berikut :
1. Untuk mengetahui besarnya waktu tunggu pengeringan yang optimum.
2. Untuk mengetahui besarnya suhu penguatan unsur Pb dengan polimer organik. 3. Untuk mengetahui besarnya konsentrasi unsur logam berat Pb yang mampu
diadsorbsi.
1.5Sistematika Penulisan
Sistematika penulisan pada makalah penelitian ini adalah sebagai berikut : BAB I PENDAHULUAN
1.1Latar Belakang 1.2Rumusan Masalah 1.3Batasan Masalah 1.4Tujuan Penelitian 1.5Sistematika Penulisan 1.6Manfaat Penelitian BAB II TINJAUAN PUSTAKA BAB III METODE PENELITIAN BAB IV PEMBAHASAN
4
1.6Manfaat Penelitian
Manfaat penelitian ini adalah sebagai berikut : 1. Bagi Pembaca
Dapat digunakan sebagai referensi tentang aplikasi laser. Selain itu juga dapat digunakan sebagai acuan untuk masyarakat di pedesaan yang susah untuk mendapatkan suatu bahan sebagai alat untuk memfiltrasi air yang tercemar limbah Pb sehingga dapat menggunakan serabut kelapa yang banyak dijumpai dialam.
2. Bagi Penulis
5
BAB II
TINJAUAN PUSTAKA
2.1 Polimer Organik
Polimer atau kadang-kadang disebut sebagai makromolekul. Polimer adalah molekul besar yang dibangun dari pengulangan kesatuan-kesatuan kimia yang kecil dan sederhana (monomer) (Firman, 1991). Berdasarkan asal polimer, dikenal polimer alami dan polimer sintetik. Polimer alami (organik) adalah polimer yang tersedia bebas di alam dan diderivasi dari hewan dan tumbuhan. Contoh dari polimer alami yang sudah digunakan sejak dulu adalah tumbuhan hijau, kayu, karet, kapas, wool, kulit dan sutera. Adapun jenis polimer alami lainnya seperti protein, enzim, tepung, dan selulosa sangat penting dalam proses biologi dan fisiologi tumbuhan dan hewan.
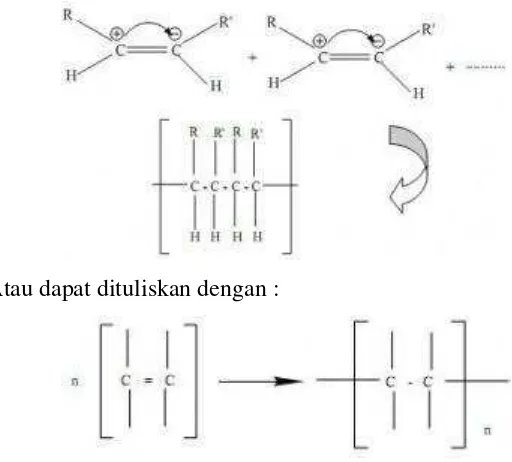
Reaksi Polimerisasi adalah reaksi penggabungan molekul-molekul kecil (monomer) yang membentuk molekul yang besar. Ada dua jenis reaksi polimerisasi, yaitu : polimerisasi adisi dan polimerisasi kondensasi.
Polimerisasi Adisi terjadi pada monomer yang mempunyai ikatan tak jenuh yaitu ikatan rangkap dengan melakukan reaksi dengan cara membuka ikatan rangkap dan menghasilkan senyawa polimer dengan ikatan jenuh, seperti Gambar 2.1.
Atau dapat dituliskan dengan :
Gambar 2.1 Mekanisme reaksi polimer adisi. [Sumber :
http://www.academia.edu/7401894/7._Polymer. Diakses pada tanggal 8 mei 2015]
6
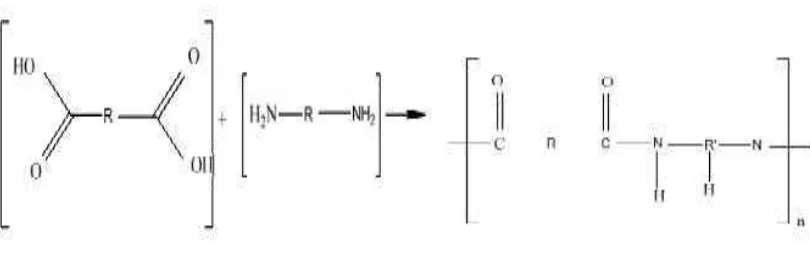
Polimerisasi kondensasi adalah reaksi yang terjadi antara dua molekul bergugus fungsi banyak yang menghasilkan molekul besar dengan disertai pelepasan molekul kecil seperti air melalui reaksi kondensasi (Cowd, 1991). Contoh reaksi polimer kondensasi seperti Gambar 2.2 :
Gambar 2.2 Mekanisme reaksi polimer kondensasi. [Sumber :
http://www.digilib.unail.ac.id./1969/2/pdf.Polymer. Diakses pada tanggal 7 Januari 2016]
2.1.1 Serabut kelapa
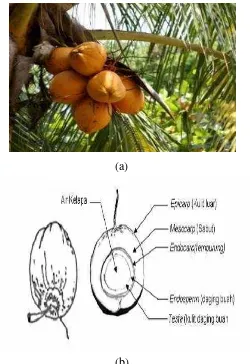
Kelapa adalah salah satu jenis polimer alami. Di dalam kelapa (Cocos nucefera L) dikenal dua varietas utama yaitu varietas dalam (tall variety) dan varietas genjah (drawf variety). Kelapa varietas genjah adalah jenis kelapa yang mempunyai ciri-ciri sebagai berikut :
1. Bentuk batang ramping dari pangkal sampai ke ujung 2. Tinggi batang mencapai 5 meter atau lebih
3. Mulai berbuah cepat (3-4 tahun setelah tanam) dan dapat mencapai umur lebih dari 50 tahun.
7
(a)
(b)
Gambar 2.3 (a) Pohon kelapa gading, (b) Bagian dari buah kelapa gading.
Serabut kelapa merupakan bagian tengah buah kelapa. Ketebalan sabut kelapa berkisar 5-6 cm yang terdiri atas lapisan terluar (exocarpium) dan lapisan dalam (endocarpium). Endocarpium mengandung serat halus sebagai bahan pembuat tali, karpet, sikat, keset, filter dan lainnya (Zainal M dan Yulius, 2005).
2.2 Immobilisasi Ion
Immobilisasai ion dibagi menjadi tiga yaitu : 1. Adsorbsi
2. Kompleksasi 3. Pertukaran ion
2.2.1 Adsorbsi
8
padatan tersebut. Materi atau partikel-partikel yang diadsorbsi disebut adsorbat dan bahan yang mengadsorbsi disebut adsorben. Pada umumnya, adsorben bersifat spesifik yaitu hanya menyerap zat tertentu. Dalam memilih jenis adsorben pada proses adsorpsi, disesuaikan dengan sifat dan keadaan zat yang akan diadsorbsi. Adsorbsi berbeda dengan absorbsi karena pengikatan molekul dilakukan pada permukaan adsorben. Adsorbsi dibedakan menjadi dua yaitu adsorbsi fisika yang disebabkan oleh gaya Van Der Waals dan adsorbsi kimia yang terjadi reaksi antara zat yang diserap (adsorbat)
dengan adsorben.
Adsorbsi fisika berhubungan dengan gaya Van Der Waals. Apabila daya tarik-menarik antara zat terlarut dengan adsorben lebih besar dari daya tarik-tarik-menarik antara zat terlarut dengan pelarutnya, maka zat yang terlarut akan diadsorbsi pada permukaan adsorben. Adsorbsi ini mirip dengan proses kondensasi (perubahan wujud benda ke wujud yang lebih padat, misalnya gas (uap) menjadi cairan) dan biasanya terjadi pada temperatur rendah (Agustiningrum, 2012). Pada proses ini gaya yang menahan molekul fluida pada permukaan padat relatif lemah, dan besarnya sama dengan gaya kohesi (gaya tarik-menarik antar molekul yang sejenis) molekul pada fase cair (gaya Van Der Waals) sehingga hanya padatan saja yang mampu di adsorbsi oleh adsorben.
Adsorbsi kimia merupakan reaksi yang terjadi antara zat padat dengan zat terlarut yang teradsorbsi. Adsorbsi ini bersifat spesifik dan melibatkan gaya yang jauh lebih besar daripada adsorbsi fisika. Menurut Langmuir, molekul teradsorbsi ditahan pada permukaan oleh gaya valensi yang tipenya sama dengan yang terjadi antara atom-atom dalam molekul. Karena adanya ikatan kimia, maka pada permukaan adsorben akan terbentuk suatu lapisan dan akan menghambat proses penyerapan selanjutnya oleh batuan adsorben yang menyebabkan efektifitasnya menurun (Agustiningrum, 2012).
Pada proses adsorbsi, terdapat juga laju penyerapan suatu fluida oleh adsorben dalam jangka waktu tertentu yang disebut kinetika adsorbsi. Kinetika adsorbsi suatu zat dapat diketahui dengan cara mengukur perubahan konsentrasi zat teradsorbsi dan menganalisis nilai k (berupa slope/kemiringan) serta memplotnya pada grafik. Besar kecilnya adsorbsi dipengaruhi oleh beberapa hal, diantaranya:
a. Macam adsorben
9
d. Konsentrasi zat yang diadsorben e. Temperatur
Pada dasarnya adsorben merupakan komponen yang paling penting dalam proses adsorbsi. Umumnya adsorben bersifat spesifik, yaitu hanya menyerap zat tertentu. Dalam memilih jenis adsorben, harus disesuaikan dengan sifat dan keadaan zat yang akan diadsorbsi.
2.2.2 Kompleksasi
Kompleksasi atau senyawa koordinasi menurut definisi klasik diakibatkan dari mekanisme donor-akseptor atau reaksi asam-basa lewis antara dua atau lebih konstituen kimia yang berbeda. Setiap atom atau ion nonlogam, apakah bebas atau berada dalam molekul netral atau dalam senyawa ionik yang dapat menyumbangkan satu pasang elektron, dapat bertindak sebagai donor. Akseptor atau konstituen yang ambil bagian dalam pasangan elektron, seringkali berupa ion logam, walaupun dapat juga atom netral.
2.2.3 Pertukaran ion
Pertukaran ion merupakan suatu metode yang digunakan untuk memisahkan ion-ion yang tidak dikehendaki berada dalam larutan untuk dipindahkan ke dalam media padat yang disebut dengan media penukaran ion, dimana media penukaran ion ini melepaskan ion lain kedalam larutan.
Mekanisme pertukaran ion yaitu jika suatu larutan yang mengandung anion atau kation dikontakkan dengan media penukaran ion, maka akan terjadi pertukaran anion dengan mekanisme reaksi sebagai berikut :
Mekanisme pertukaran anion : A+ + R+ B- = => B- + R+ A- Mekanisme pertukaran kation :
A+ + R- B+ = => B+ + R- A+ Keterangan :
A = ion yang akan dipisahkan (pada larutan)
10
2.3 Interaksi Laser dengan Bahan 2.3.1 Laser
LASER adalah singkatan dari Light Amplification by Stimulation Emission of Radiation, yang artinya penguatan intensitas cahaya oleh emisi terangsang. Kata kuncinya adalah “penguatan” dan “emisi terangsang”. Laser merupakan cahaya yang monokromatik, koheren dan menuju satu arah yang sama sehingga cahayanya menjadi sangat kuat dan terkordinasi.
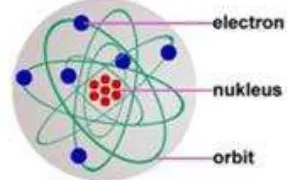
Prinsip pembangkit laser menggunakan teori tentang atom. Sebuah atom terdiri dari inti atom yang disebut nukleus (berisi proton dan netron) dan elektron. Ilustrasi sederhana sebuah atom ditunjukkan pada Gambar 2.4.
Gambar 2.4 Ilustrasi sederhana sebuah atom. [Sumber : http://www.yohanessurya.com/
download/penulis/Teknologi_18.pdf. Diakses pada tanggal 24 Maret 2015]
Elektron-elektron dalam atom selalu berputar mengelilingi inti atom pada orbit tertentu sesuai dengan tingkat energinya. Keadaan energi yang paling rendah disebut dengan keadaan dasar (ground state). Orbit elektron yang memiliki tingkat energi paling rendah adalah yang paling dekat dengan inti. Dengan persamaan energi menurut model atom Bohr yaitu (Krane, 1992) :
Dengan : E = energi orbit (eV)
n = tingkat energi atau kulit orbit ke (1, 2, 3....)
11
Gambar 2.5 Eksitasi elektron ke tingkat energi yang lebi tinggi. [Sumber : http://www.yohanes
surya.com/ download/penulis/Teknologi_18.pdf. Diakses pada tanggal 24 Maret 2015]
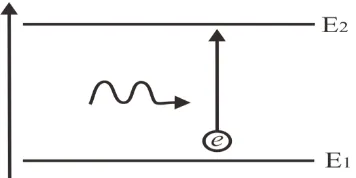
Elektron yang teriksitasi ke tingkat energi yang lebih tinggi berada dalam keadaan tidak stabil dan akan selalu berusaha untuk kembali ke keadaan awalnya (ground state) atau keadaan metastabil dengan cara melepaskan kelebihan energi tersebut, dalam bentuk foton atau energi cahaya yang mempunyai panjang gelombang tertentu seperti ditunjukkan pada Gambar 2.6.
Gambar 2.6 Kembalinya elektron ke tingkat energi semula disertai emisi cahaya. [Sumber :
http://www.yohanessurya.com/download/penulis/Teknologi_18.pdf. Diakses pada tanggal 24 Maret 2014]
Foton ini akan menstimulasi atau merangsang elektron lain yang berada pada keadan metastabil sehingga akan mengemisikan foton yang identik dalam hal energi, panjang gelombang dan frekuensi serta merambat ke arah yang sama sehingga mempunyai phase yang sama pula. Kejadian ini disebut stimulated emission of radiation, yang mendasari terjadinya laser.
2.3.2 Laser Induced Breakdown Spectroscopy (LIBS)
Laser Induced Breakdown Spectroscopy (LIBS) adalah metode spektroskopi untuk
12
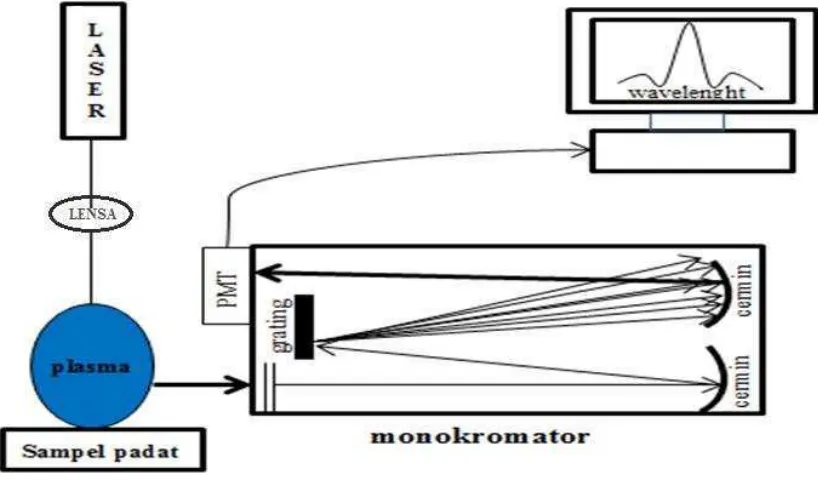
Skema komponen utama secara sederhana untuk LIBS seperti ditunjukkan pada Gambar 2.7, laser difokuskan ke permukaan sampel melalui lensa bikonvek. Sebagian kecil sampel (~ 0,01 mg) dengan kecepatan tinggi dan terjadi kompresi adiabatis dengan gas udara dilingkungan dan terbentuk gelombang kejut (shockwave). Energi gelombang kejut ini diserap oleh partikel-partikel yang terablasi dan digunakan untuk mengeksitasikan elektron-elektron dalam atom ke energi yang lebih tinggi. Elektron-elektron dalam atom-atom yang tereksitasi kembali ke keadaan dasar (ground state) sambil memancarkan atau mengemisikan foton dengan panjang gelombang sesuai jenis unsurnya. Emisi ini selanjutnya diolah oleh spektrometer dan selanjutnya ditampilkan dikomputer sebagai grafik intensitas fungsi panjang gelombang.
Gambar 2.7 Skema sederhana komponen utama LIBS.
2.3.3 Metode deteksi plasma menggunakan LIBS
13
(a)
(b)
(c)
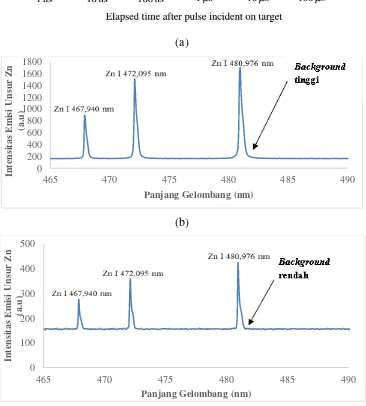
Gambar 2.8 (a) Metode deteksi plasma pada LIBS, (b) spektrum dengan sinyal latar (sinyal latar
tinggi), (c) spektrum tanpa sinyal latar (sinyal latar rendah).
Gambar 2.8(a) menunjukkan perjalanan umur plasma. Pada saat laser difokuskan pada sampel, terbentuk plasma primer dengan kerapatan partikel yang sangat tinggi
0 200 400 600 800 1000 1200 1400 1600 1800
465 470 475 480 485 490
Inte ns it a s E m is i Uns ur Z n (a .u)
Panjang Gelombang (nm)
0 100 200 300 400 500
465 470 475 480 485 490
Inte ns it a s E m is i Uns ur Z n (a .u)
14
(~10 ns). Kondisi ini menyebabkan ion-ion berekombinasi dengan elektron-elektron dan elektron melepaskan energi dalam bentuk foton dengan panjang gelombang kontinyu. Selain itu, pada plasma primer juga terjadi tumbukan bebas antara elektron dengan elektron (Bremsstrahlung). Hal ini juga mengakibatkan elektron mengemisikan foton dengan panjang gelombang lebar/kontinyu. Emisi kontinyu inilah yang menyebabkan spektrum terangkat atau sinyal latar (background) tinggi seperti ditunjukkan pada gambar 2.8(b). Proses Bremsstrahlung dan rekombinasi ion berlangsung sangat cepat (~10 ns atau selebar pulsa laser). Oleh sebab itu pendeteksian emisi sebaiknya dilakukan setelah 1 s dari ablasi laser dan waktu inilah yang disebut dengan waktu tunggu (delay time). Nilai waktu tunggu ini bervariasi tergantung jenis unsurnya, tetapi hampir semua unsur memiliki waktu emisi lebih dari 1 s. Spektrum yang dihasilkan dengan delay time setelah 1s ditunjukkan oleh gambar 2.8(c) yang mana backgroundnya sangat rendah.
2.4 Karakteristik Unsur Pb
Unsur kimia atau sering disebut unsur merupakan zat kimia yang tidak dapat dibagi lagi menjadi zat yang lebih kecil. Partikel terkecil dari unsur yaitu atom. Perbedaan paling mencolok dari suatu unsur dengan lainnya adalah jumlah proton. Jumlah proton pada sebuah atom dikenal dengan istilah nomor atom (Z). Selain itu, terdapat berat atom (A) sebuah unsur yang merupakan massa rata-rata atom suatu unsur pada alam.
2.4.1 Unsur timbal/plumbum (Pb)
Unsur timbal (Pb) lebih dikenal dengan sebutan timah hitam. Timbal dan persenyawaannya dapat berada di perairan secara alamiah dan sebagai dampak dari aktivitas manusia. Timbal dapat masuk ke perairan melalui pengkristalan di udara dengan bantuan air hujan. Aktivitas manusia yang menyebabkan pencemaran timbal diantaranya air limbah dari industri yang berkaitan dengan timbal, air pembuangan dari penambangan bijih timah hitam, buangan sisa industri baterai, dll.
15
bentuk ion (Pb2+) mampu menggantikan keberadaan ion Ca2+ yang terdapat dalam jaringan tulang.
2.4.2 Karakteristik unsur Pb
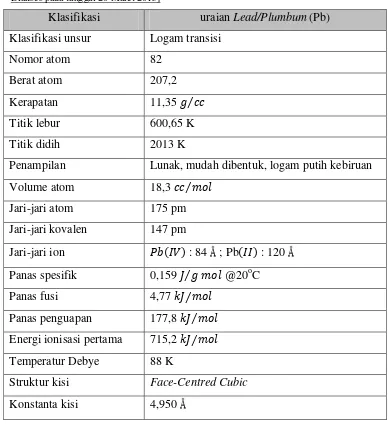
Logam ini berada pada golongan IVA pada tabel periodik unsur kimia. Timbal mempunyai nomor atom (Z) 82 dengan berat atom (A) 207,2. Uraian mengenai unsur timbal seperti ditunjukkan pada Tabel 2.1.
Tabel 2.1 Karakteristik unsur Pb. [Sumber: http://chemistry.about.com/od/elementfacts/a/ lead.htm.
Diakses pada tanggal 20 Maret 2015]
Klasifikasi uraian Lead/Plumbum (Pb)
Klasifikasi unsur Logam transisi
Nomor atom 82
Berat atom 207,2
Kerapatan 11,35
Titik lebur 600,65 K
Titik didih 2013 K
Penampilan Lunak, mudah dibentuk, logam putih kebiruan
Volume atom 18,3
Jari-jari atom 175 pm
Jari-jari kovalen 147 pm
Jari-jari ion : 84 Å ; Pb : 120 Å Panas spesifik 0,159 @20oC
Panas fusi 4,77
Panas penguapan 177,8 Energi ionisasi pertama 715,2
Temperatur Debye 88 K
Struktur kisi Face-Centred Cubic
Konstanta kisi 4,950 Å
Penentuan panjang gelombang unsur berdasarkan perumusan dari (NIST, 2005) :
16
Dengan: E2 = Tingkat energi awal (cm-1) E1 = Tingkat energi akhir (cm-1)
= Panjang gelombang (nm)
Probabilitas elektron berpindah dari konfigurasi j=2 atau tingkat 10650,3 cm-1 ke konfigurasi j=1 atau pada tingkat 35287,2 cm-1 dengan mengemisikan foton yang mempunyai panjang gelombang 4057,81 Ǻ (NIST, 2005).
2.5 Konsentrasi Larutan
Konsentrasi larutan menyatakan banyaknya zat terlarut dalam sejumlah tertentu larutan. Secara fisika, konsentrasi dapat dinyatakan dalam % (persen) atau ppm (part per million)/bagian per juta. Penentuan konsentrasi larutan jika dihitung dalam satuan
volume disebut molaritas (M). Molaritas menyatakan jumlah mol zat terlarut dalam setiap liter larutan sesuai dengan Persamaan 2.3.
Perhitungan pengenceran konsentrasi suatu larutan menggunakan Persamaan 2.4. M1.V1 = M2.V2 Dengan : M1= Molaritas larutan ke-1 (mol/Liter)