1.Mahasiswa memahami sifat dan konsep dasar kimia analitik serta mampu menyelesaikan berbagai persoalan dasar kimia analitik
2. Menilai silang hasil simulasi penyusunan dari Penerapan Analisa Pendahuluan, analisis kation, dan analisis anion.
Indikator Pembelajaran: Mahasiswa sebelum , sedang dan sesudah perkuliahan awal/mukadimah makin takut, taat, dekat, cinta akan kekuasaan dan keagungan Allah serta dapat menghadirkan Allah swt dalam setiap saat dan keadaan melalui penelaahan 1. Wujud. 2. Warna 3. Kelarutan 4 Tes nyala. 5. Aroma, 6. Raba, 7. Teknik Pengambilan sampel, 8. Ukuran
Analisis Pendahuluan 1. Wujud analit
2. Warna analit (ada orbital d) 3. Kelarutan analit
4. Tes nyala analit 5. Aroma analit 6. Raba analit
7. Teknik pengambilan sampel. 8. Ukuran cuplikan
Analisis secara konvensional • Analisis Anion • Analisis Kation
1. Wujud : Padat, Cair, atau Gas
HCl 100% berwujud gas pada STP
Larutan HCl pekat ± 37% (% berat) berwujud cair pada STP Larutan HNO3 pekat ...% berwujud cair pada STP
Larutan Amonia NH4OH pekat...% berwujud cair pada STP
NaOH padat ± 100% bewujud padat pada STP, sangat hidroskopis/mudah menyerap uap air di udara.
H2S berwujud gas pada STP Amoniak (NH3) berwujud gas
2. Tabel 1. Zat Kimia yang berwarna
No Warna Zat Kimia
1 Kuning CrO4=
2 Merah jingga Cr2O7=
3 Ungu MnO4
-4 Hijau Ni2+ dan Cr3+
5 Merah coklat Fe3+ 6 Hijau Abu-abu Fe2+
7 Biru-hijau Cu2+
8 Merah anggur biru Co2+
9 Merah muda Mn2+
3.Kaedah Kelarutan
1. Semua garam Asetat dan/atau Nitrat melarut dalam air; Perak Asetat hanya melarut sedikit.
2. Semua garam Natrium, Kalium, dan Amonium melarut dalam air.
3. Semua garam Klorida, Bromida, dan Iodida melarut dalam air kecuali PbX2; AgX; Hg2X2 (X = Cl; Br; I). HgI2 tak melarut dalam air; PbX2 melarut dalam air panas. Garam-garam Klorida, Bromida dan Iodida yang tak melarut dalam air juga tidak melarut dalam asam encer.
4. Semua garam Sulfat melarut dalam air, kecuali dengan Pb, Hg(I), Ba, dan Ca. Garam Sulfat yang tak melarut dalam air juga tak melarut dalam asam encer. 5. Semua garam Karbonat, Fosfat, Borat, Sulfit, Kromat, dan Arsenat tak melarut
dalam air (kecuali dengan Natrium, Kalium, dan Amonium) tapi melarut dalam asam encer. MgCrO4 melarut dalam air dan MgSO3 melarut sedikit dalam air. 6. Semua garam Sulfida (kecuali dengan Ion Barium, Kalsium, Magnesium,
Natrium, Kalium, dan Amonium) tak melarut dalam air. BaS, CaS, dan MgS melarut sedikit dalam air.
7. Hidroksida-hidroksida dari Natrium, Kalium, dan Amonium sangat mudah melarut dalam air. Kalsium di-Hidroksida dan Barium di-Hidroksida agak melarut dalam air. Semua Hidroksida dengan kation lainnya tidak melarut dalam air.
Bagaimana zat anorganik ini dapat melarut dalam air?
1. Mahasiswa secara sembarang menentukan satu garam.
2. Dengan menggunakan “Kaedah Kelarutan” itu menjawab sendiri tentang kelarutan satu garam tersebut.
3. Secara bergiliran dan silang satu mahasiswa masing-masing menilai hasil jawab mahasiswa tersebut (sambil diskusi antar mereka).
4. Mengapa garam itu melarut atau tidak melarut? 5. Apa warna garam itu saat tes nyala?
6. Apa wujud garam itu? 7. Apa warna dari garam itu? 8. Apa bau garam itu?
9. Apa rasa/raba dari garam itu? Ag+ AgCl tidak melarut dalam air krn
Disamping ke-7 Kaedah Kelarutan itu juga ada uji kelarutan secara umum yaitu: cuplikan zat kimia dilarutkan berturut mulai dari air dingin, air panas, larutan Asam Klorida encer, Asam Klorida pekat, Asam Nitrat encer, Asam Nitrat pekat, dan Air Raja (yaitu campuran HCl pekat : HNO3 pekat = 3 : 1).
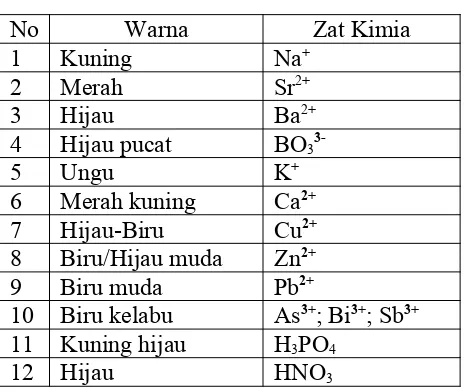
Tes nyala sebagai Analisi Pendahuluan dilaksanakan dengan cara membakar dengan api cuplikan zat kimia yang diletakkan di kawat Platina. Tes nyala atau reaksi nyala dapat dilihat pada Tabel 2 berkut ini.
Tabel 2. Tes Nyala
No Warna Zat Kimia
1 Kuning Na+
2 Merah Sr2+
3 Hijau Ba2+
4 Hijau pucat BO3
3-5 Ungu K+
6 Merah kuning Ca2+
7 Hijau-Biru Cu2+
8 Biru/Hijau muda Zn2+
9 Biru muda Pb2+
10 Biru kelabu As3+; Bi3+; Sb3+ 11 Kuning hijau H3PO4
12 Hijau HNO3
HgS; Bi2S3; CuS; CdS; As2S3; SnS; Sb2S3
Tes nyala ini sangat bermanfaat bagi mahasiswa untuk menduga awal pada analisis kation.
Jika hal ini tidak dipraktikumkan maka kecenderungan mahasiswa menghafal yang tentunya tidak banyak manfaatnya menghafal fakta tersebut.
Ukuran cuplikan juga merupakan bagian dari Analisis Pendahuluan. Isi materi ukuran cuplikan bahwa ukuran cuplikan terbagi 2. Pertama, cuplikan total (dominan)
semi mikro dengan ukuran 0,01 gram sampai dengan 0,1 gram; dan 3) mikro dengan ukuran sama dengan dan atau lebih kecil dari 0,001 gram. Kemudian Kedua (tidak dominan) untuk cuplikan dengan konsentrasi kecil digolongkan ke dalam 1) utama, untuk konsentrasi zat kimia-nya lebih besar 1%; 2) tambahan, untuk konsentrasi zat kimia-nya antara 0,01% sampai dengan 1%; dan 3) renik atau runut untuk konsentrasi zat kimia-nya lebih kecil dari 0,01%.
Pengambilan cuplikan:
1. Padat: digerus halus, dibuat kerucut/pyramid, dibagi 4 bagian, ambil 2 bagian yang berseberangan, jika masih terlalu besar ukuran cuplikan itu, maka 2 bagian itu diaduk rata lagi, dibuat kerucut/pyramid lagi, dibagi 4 bagian lagi dst… sampai didapatkan ukuran cuplikan yang dikehendaki.
2. Cair: Air sungai musi, diambil di bagian hulu, tengan dan hilir, dipermukaan, tengah, dan bagian dasar, 2 sisi pinggir dan tengah. (yang homogen)
3. Cairan minyak, dan air maka diambil pada bagian minyak dan juga bagian air sesuai dengan ukuran yang dikehendaki. (yang heterogen)
4. Cairan dan padatan maka diambil pada bagian cairan dan juga bagian padatan sesuai dengan ukuran yang dikehendaki. (yang heterogen)
5. Gas: (homogen) ambil sesuai dengan ukuran yang dikehendaki. Untuk kasus khusus misalnya ada terbau gas LPG bocor, maka diambil di bagian atas dan bawah.
Cara tes kation try and error (tes secara langsung)
Tes/identifikasi apakah dalam suatu cuplikan terdapat kation Ag+? Maka ambil ± 1mL larutan cuplikan lalu direaksikan Cl- . Kalau terjadi endapat putih, positif mengandung Kation Ag+, kalau tidak terjadi endapan putih, negatif cuplikan itu mengandung kation Ag+. Cara ini tidak efektif, karena tidak semua kation dapat dites secara langsung.
Cara kedua
jumlah/konsentrasi kecil/renik (ppm; 20 ppm = 20 dalam 1.000.000) digunakan analisa dengan instrumen.
Tujuan Pembelajaran:
1.Mahasiswa memahami sifat dan konsep dasar kimia analitik serta mampu menyelesaikan berbagai persoalan dasar kimia analitik
2. Menilai silang hasil simulasi penyusunan dari Skema pemisahan, reaksi pengenalan kation dan anion.
Indikator Pembelajaran: Mahasiswa sebelum , sedang dan sesudah perkuliahan awal/mukadimah makin takut, taat, dekat, cinta akan kekuasaan dan keagungan Allah serta dapat menghadirkan Allah SWT setiap saat dan keadaan
melalui penelaahan 1. Skema Pemisahan Kation Metode H2S 2. Reaksi dan Identifikasi Pengenalan Kation
3. Reaksi dan Identifikasi Pengenalan Anion
Analisis Kualitatif Kation secara Konvensional dengan Metoda H2S melalui Skema sebagai berikut.
Pengujian Kation Golongan I Pendahuluan, analisis kation, dan analisis anion agar makin percaya akan kekuasaan Allah swt dan dapt menghadirkan kata Allah swt dalam setiap saat dan keadaan.
Latihan:
1. tulis satu contoh garam (kation + anion) secara sembarang! (misal KCl)
2. Bagaimana kelarutan garam itu berdasarkan 7 kaidah kelarutan? (melarut dalam air, sesuai dengan kaedah nomor 2 ”semua garam Kalium, Narium, dan
Filtrat Pb2+ (larutan panas) PbCl
2 (s) lar dingin + Larutan NH4OH
Endapan Hg(NH3)Cl + Hg Filtrat Ag(NH
-4. Jika anda mengetahui apa wujud garam itu? (padat) 5. Apa warna tes nyala garam itu? (ungu)
6. Bagaimana garam itu jika direaksikan dengan:
a. asam klorida? (tak bereaksi, tidak ada perubahan warna, tidak ada perubahan suhu, tidak ada perubahan wujud/gas/padat)
b. Filtratnya dengan Asam sulfida? (tak bereaksi) c. Filtratnya dengan NH4OH dan NH4Cl? (tak bereaksi) d. Filtratnya dengan (NH4)2S dan NH4Cl? (tak bereaksi) e. Filtratnya dengan (NH4)2CO3? (tak bereaksi)
7. ES direaksikan dengan HNO3(aq) berlebih + ion perak? (Bereaksi, endapan putih) 8. ES direaksikan dengan HCl(aq) berlebih + ion Barium? (tak bereaksi)
9. ES direaksikan dengan H2SO4 + FeSO4 + H2SO4(pekat)? (tidak terjadi endapan cincin coklat)
10.ES direaksikan dengan Amoniummolibdat ?(tidak terjadi endapan kuning)
11.ES direaksikan dengan H2SO4 4N + Difenilamin dlm H2SO4(pekat)? (tidak terjadi biru tua)
Susunlah pernyataan yang diakhiri dengan pertanyaan” kation dan anion apakah yang terdapat dalam sampel itu?”
Susunan itu lengkap dengan kunci interpretasi dan skornya (skor 1 tiap poin) 1 kelompok 2 orang.
Contoh Pernyataan yang diakhiri pertanyaan:
Suatu sampel padat, (berwarna) putih melarut dalam air, memberikan warna ungu ketika tes nyala. Ketika direaksikan dengan asam kolorida, tidak bereaksi, dengan asam sulfida, tidak bereaksi, dengan Amonium hidroksida dan Amonium klorida, bereaksi, dengan Amonium sulfida dan Amonium klorida tidak bereaksi, dengan Amonium karbonat tidak bereaksi. Setelah dibuat Ekstrak sodanya: dengan Asam nitrat berlebih dan dengan ion perak membentiuk endapan putih; ES dengan asam klorida berlebih dan ion timbal tidak bereaksi...
Kation dan anion apakah yang terdapat dalam sampel itu?
hijau; Co2+ merah anggur-biru; Mn 2+
merah muda. 2
4 Tes nyala, berwarna ungu Diduga kuat K + positif 2
5 Tidak bereaksi dengan HCl Ag + ; Pb 2+ ; dan Hg + negatif 4
6 Tidak bereaksi dengan H2S Hg 2+ ; Bi ; Cu3+ ; Cd2+ 2+ ;As 3+ ; Sn 2+ ; Sb 3+ negatif
8
7 Tidak bereaksi dengan NH4OH dan NH4Cl Al3+; Fe3+; Mn4+; Cr3+ negatif 5
8 Tidak bereaksi dengan (NH4)2S dan NH4Cl Ni2+; Co2+; Mn2+; Zn2+ negatif 5
9 Tidak bereaksi dengan (NH4)2CO3 Ba2+; Ca2+ ; Sr2+ negatif 4
10 Kesimpulan berdasarkan interprretasi di atas
maka kation yang ada dalam sampel diduga kuat adalah K +
1
11 Telah dibuat larutan ES. ES itu direaksikan dengan HNO3(aq) berlebih + ion perak, terjadi
endapan putih
Cl- positif 1
12 ES direaksikan dengan HCl(aq) berlebih +
ion Barium, tidak bereaksi
SO4= dan CrO4= negatif 3
13 ES direaksikan dengan H2SO4 + FeSO4 +
H2SO4(pekat)... (tidak terjadi endapan cincin coklat)
NO3-; NO2-; negatif 3
14 ES direaksikan dengan Amoniummolibdat ...
( tidak terjadi endapan kuning)
PO43- dan AsO43- negatif 3
15 ES direaksikan dengan H2SO4 4N + Difenilamin
dlm H2SO4(pekat)...( tidak terjadi biru tua)
NO3-; NO2-; ClO3-; ClO- ; CrO4=; MnO4- negatif 6
1
16 Kesimpulan berdasarkan interprretasi di atas
maka anion yang ada dalam sampel diduga kuat adalah Cl -
1
Skor maksimal 33
Nilai maksimal = (betul/33) x 100 = ...
1. Suatu sampel padat, (berwarna) putih melarut dalam air, memberikan warna kehijauan ketika tes nyala. Ketika direaksikan dengan asam kolorida, tidak bereaksi, dengan asam sulfida, tidak bereaksi, dengan Amonium hidroksida dan Amonium klorida, tidak bereaksi, dengan Amonium sulfida dan Amonium klorida tidak bereaksi, dengan Amonium karbonat bereaksi mengendap berwarna putih. Setelah dibuat Ekstrak sodanya (ES) dengan Asam nitrat berlebih dan dengan ion perak membentuk endapan putih kekuningan; ES dengan asam klorida berlebih dan ion timbal tidak bereaksi; ES dengan H2SO4 + FeSO4 + H2SO4(pekat); dengan
Amoniummolibdat ...( tidak terjadi reaksi; ES direaksikan dengan H2SO4 4N +
Difenilamin dalamH2SO4(pekat)( tidak terjadi reaksi). ES direaksikan dengan HCl(aq) berlebih
+ ion Barium, tidak bereaksi. Kation dan anion apakah yang terdapat dalam sampel itu?
2. Suatu sampel 0,950g mengandung Timbal Nitrat. Kemudian Timbal itu direaksikan dengan Kalium Kromat, sehingga terjadi endapan Timbal Kromat. Setelah disaring, dicuci dan dipanaskan berat Timbal Kromat itu 0,425 gram. Hitung % Timbal itu dalam cuplikan! Ar O = 16; K = 39; Ca = 40; Cr = 52; Pb = 207,2.
1. Suatu sampel padat, (berwarna) putih melarut dalam air, memberikan warna kehijauan ketika tes nyala. Ketika direaksikan dengan asam kolorida, tidak bereaksi, dengan asam sulfida, tidak bereaksi, dengan Amonium hidroksida dan Amonium klorida, tidak bereaksi, dengan Amonium sulfida dan Amonium klorida tidak bereaksi, dengan Amonium karbonat bereaksi mengendap berwarna putih. Setelah dibuat Ekstrak sodanya (ES) dengan Asam nitrat berlebih dan dengan ion perak membentuk endapan putih kekuningan; ES dengan asam klorida berlebih dan ion timbal tidak bereaksi; ES dengan H2SO4 + FeSO4 + H2SO4(pekat); dengan Amonium
molibdat ...( tidak terjadi reaksi); ES direaksikan dengan H2SO4 4N + Difenilamin
dalam H2SO4(pekat) ( tidak terjadi reaksi). ES direaksikan dengan HCl(aq) berlebih + ion
2. Suatu sampel 0,950g mengandung Timbal Nitrat. Kemudian Timbal itu direaksikan dengan Kalium Kromat, sehingga terjadi endapan Timbal Kromat. Setelah disaring, dicuci dan dipanaskan berat Timbal Kromat itu 0,425 gram. Hitung % Timbal itu dalam cuplikan! Ar O = 16; K = 39; Ca = 40; Cr = 52; Pb = 207,2; N = 14.
10 Kesimpulan berdasarkan interpretasi di atas maka
kation yang ada dalam sampel diduga kuat adalah Ba
2+ karena tes nyala hijau dan bereaksi dengan
ammonium karbonat.
1
11 Telah dibuat larutan ES. ES itu direaksikan dengan HNO3(aq)
berlebih + ion perak, terjadi endapan putih kekuningan.
Br
- kemungkinan positif 2
12 ES dengan asam klorida berlebih
dan ion timbal tidak bereaksi 12 ES direaksikan dengan HCl(aq)
berlebih + ion Barium, tidak bereaksi
SO4= dan CrO4= negatif 3
13 ES direaksikan dengan H2SO4 + FeSO4 +
H2SO4(pekat)... (tidak terjadi endapan
cincin coklat)
NO3-; NO2-; negatif 3
14 ES direaksikan dengan
Amoniummolibdat ...( tidak terjadi endapan kuning)
PO43- dan AsO43- negatif 3
15 ES direaksikan dengan H2SO4 4N +
Difenilamin dlm H2SO4(pekat)...( tidak
terjadi biru tua)
NO3-; NO2-; ClO3-; ClO- ; CrO4=; MnO4- negatif 7
16 Kesimpulan berdasarkan interpretasi di atas maka
anion yang ada dalam sampel diduga kuat adalah
Br- 1
No. 2
No Pernyataan Skor
1 Diketahui: Berat sampel. = 0,950g 1
2 Berat Timbal Kromat = 0,425 gram 1
3 Ditanya : % Timbal dalam cuplikan 1
4 Jawab: (Ar Pb/Mr PbCrO4) x (berat ditimbang/berat sampel) x 100% = .... 1
5 Ar Pb = 207,2; PbCrO4 = 323,2; 2
6 (207,2/323,2) x (0,425/0,950) x 100% = 28,68 % 1
Jumlah 7
Nilai total = (betul/68) x 100 =...
orbital dxz dxy dyz dx2-y2 dan dz2
No L 1s 2s 2p 3s 3p 3d 4s
1 21Sc 2 2 6 2 6 1 2
2 22Ti 2 2 6 2 6 2 2
3 23V 2 2 6 2 6 3 2
4 24Cr 2 2 6 2 6 4 2
5 25Mn 2 2 6 2 6 5 2
6 26Fe 2 2 6 2 6 6 2
7 27Co 2 2 6 2 6 7 2
8 28Ni 2 2 6 2 6 8 2
9 29Cu 2 2 6 2 6 9 2
dx2 - y2 dz2
dxz dxy dyz tingkat energi
Beberapa zat rasa/diraba
NaOH, licin; KOH Licin NH4OH licin
CH3COOH kesat; Larutan HCl kesat, sabun licin
Aroma khas beberapa zat
No Aroma Zat Kimia
1 Cuka Asam asetat CH3COOH
2 Alcohol CnH2n+1OH
3 Khas menyengat, pedas, menyesakkan nafas NO2, HNO3
4 Sda Br2, HBr, HJ
5 Sda, gatal Cl2
6 Bawang putih As
7 Telur busuk S, H2S
8 Buah badam/ amandel racun HCN
9 Asetilin/karbit C2H2
10 pesing NH3, NH4OH