BAB II
TINJAUAN PUSTAKA
2.1 Biologi Kelapa dan Peran Kelapa bagi Manusia (Cocos nucifera L.)
2.1.1 Deskripsi Kelapa
Kelapa (Cocos nucifera L.) merupakan tanaman anggota keluarga Arecaceae dan satu-satunya anggota genus Cocos yang diyakini memiliki asal-usul dari daerah pesisir (zona littoral) Asia tenggara (Indonesia, Malaysia, Filipina) dan Melanesia (Chan & Elevitch, 2006). Pada zaman prasejarah diyakini kelapa liar (Niu kafa) menyebar ke arah timur melalui arus laut ke pulau tropis pasifik (Melanesia, Polynesia, dan Mikronesia) dan ke barat pesisir India, Sri lanka, Afrika Timur, dan pulau-pulau tropis (misalnya Seychelles, Andaman dan Mauritius) di Samudera Hindia. Selain melalui arus laut, penyebaran kelapa diyakini melalui perpindahan manusia dalam rangka perdagangan seperti dilakukan oleh bangsa Melayu dan Arab sekitar 3000 tahun yang lalu menyebarkan kelapa ke barat India, Sri Lanka, dan Afrika Timur. Kelapa diperkenalkan ke Afrika Barat dan Karibia (termasuk pantai Atlantik, Amerika Tengah) pada abad 16 oleh penjelajah Eropa (Chan & Elevitch, 2006). Saat ini kelapa telah tumbuh di lebih 200 negara dan ditemukan didaerah antara 230 lintang utara dan 230 lintang selatan (Gomes-Copeland et al., 2015).
Selain itu, kelapa yang pada awalnya merupakan tanaman yang dekat dengan pantai mulai menyebar ke pedalaman dan sekarang tumbuh di berbagai macam jenis tanah sampai dengan ketinggian 600 m di khatulistiwa (Chan & Elevitch, 2006). Tanaman kelapa dapat tumbuh optimal pada suhu 28 0C, dengan
kelembapan relatif yang lebih besar dari 60 % serta tidak ada defisit air pada tanah ataupun kelebihan air salinitas pada tanah. Kelapa tumbuh optimal dengan curah hujan mencapai total 2000 mm pertahun (Foale & Harries, 2011).
Gambar 2.1 Morfologi reproduksi dari kultivar Kelapa Dalam Borneo (Borneo tall / BONT) (A) tanaman kelapa umur kurang lebih 10 tahun, (B)
tandan buah, (C) bunga dewasa kelapa karena sudah membuka, (D) bunga betina, menghasilkan nektar untuk menarik penyerbukan, (E) bunga jantan, menghasilkan benang sari yang mulai perkembang dari atas ke pangkal, (F) Buah kelapa, sekitar 11-12 bulan setelah penyerbukan (COGENT network, 2013; Ratnambal et al., 2010; Anonim, 2016).
A B C
F
Kelapa (Gambar 2.1) merupakan tanaman monokotil yang memiliki sistem perakaran serabut (Chan & Elevitch, 2006; Ohler & Magat, 2016). Setiap pohon kelapa memiliki akar serabut sekitar 2000–4000 buah dengan diameter sekitar 1 cm. Pada umumnya akar kelapa ditemukan sampai kedalaman 5 m pada tanah yang berpasir atau berdrainase baik. Sebagian besar akar ditemukan pada kedalaman 1,5 m (Ohler & Magat, 2016).
Tanaman kelapa memiliki batang berbentuk silinder, tegak atau sering melengkung atau miring, dengan diameter 20-40 cm (van Steenis, 1987). Batang kelapa umumnya berwarna abu-abu terang tidak bercabang dan mempunyai bekas daun berbentuk cincin serta tidak memiliki duri pada batangnya (van Steenis, 1987; Ohler & Magat, 2016).
Pada ujung batang terdapat daun kelapa yang membentuk roset batang (mahkota). Daun kelapa tersusun pada batang dengan pola spiral pada filotaksis 2/5, yaitu daun keenam selalu berada di atas daun pertama (Foale, 2003). Jumlah daun kelapa pada setiap mahkota sebanyak antara 20 - 30 helaian yang terbuka, sedangkan sekitar 40 daun masih terlipat berbentuk tombak. Panjang helaian daun antara 4,5-7 m dengan tangkai daun memiliki panjang antara 0,50-1,50 m. Kelapa memiliki warna tangkai daun bervariasi yang mengindikasikan warna buah. Warna tangkai daun tergantung kultivar kelapa (van Steenis, 1987; Chan & Elevitch, 2006; Ohler & Magat, 2016). Daun kelapa merupakan daun majemuk menyirip dengan jumlah anak daun mencapai sekitar 120 buah dengan ukuran lebar 1,5-5 cm dan panjang 50-150 cm (van Steenis, 1987; Ohler & Magat, 2016).
Pada tanaman kelapa yang sudah dewasa, di setiap ketiak daun muncul satu buah sistem perbungaan (karangan bunga atau tongkol bunga) (van Steenis, 1987). Tanaman kelapa memiliki bunga tongkol majemuk dengan bunga betina dan jantan terletak pada kuntum bunga yang terpisah namun berada pada sistem perbungaan yang sama (Tjitrosoepomo, 2000; Ohler & Magat, 2016). Setiap sistem perbungaan tersusun atas 40-60 buah spikelet (cabang karangan) yang dilindungi oleh seludang bunga (mancung/spata) (Chan & Elevitch, 2006). Setiap spikelet (cabang karang) memiliki sekitar 200-300 bunga jantan dan beberapa bunga betina pada bagian pangkal tergantung kultivar (Ohler & Magat, 2016). Setiap tahun, kelapa dapat menghasilkan sistem perbungaan antara 12-15 buah (Chan & Elevitch, 2006).
Bunga jantan memiliki panjang sekitar 9 mm, dengan 3 buah sepal kecil dan 3 buah kelopak besar serta 6 benang sari. Bunga betina berbentuk bulat dengan diameter 2,5-3 cm. Bunga betina memiliki perhiasan bunga berdaging yang menempel pada bakal buah, dengan bakal buah beruang 3, tidak memiliki tangkai putik, dengan kepala putik seperti celah yang tenggelam (van Steenis, 1987).
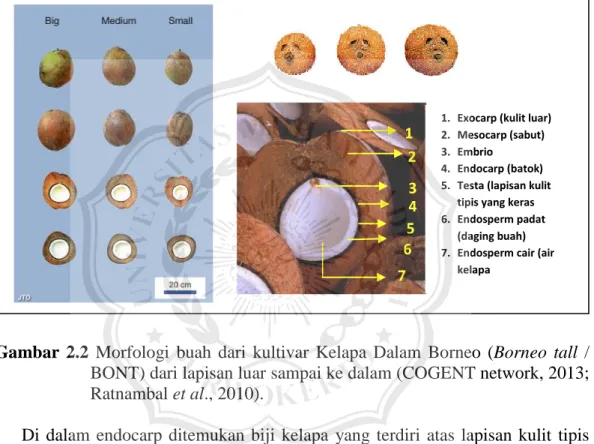
Setelah terjadi penyerbukan, bunga betina selanjutnya berkembang membentuk buah kelapa. Buah kelapa akan matang 11–12 bulan kemudian sesudah terjadinya penyerbukan (Ohler & Magat, 2016). Buah kelapa berbentuk bulat telur (Round) sampai memanjang (Angeled), tergantung kultivar (International Plant Genetic Resources Institute (IPGRI), 1995; Ohler & Magat, 2016). Buah kelapa (Gambar 2.2) memiliki panjang 20-30 cm dan berat antar 850 – 3700 grm (Chan & Elevitch, 2006; Ohler & Magat, 2016). Buah kelapa
memiliki kulit luar (exocarp) yang tipis (0,1 mm), keras, dan halus serta warna yang bervariasi tergantung kultivar. Lapisan dibawah kulit luar merupakan lapisan tebal yang berserat (mesocarp) dengan ketebalan antara 4-8 cm. Lapisan terdalam dari kulit buah (endocarp), berupa batok yang keras dan berwarna coklat (Ohler & Magat, 2016).
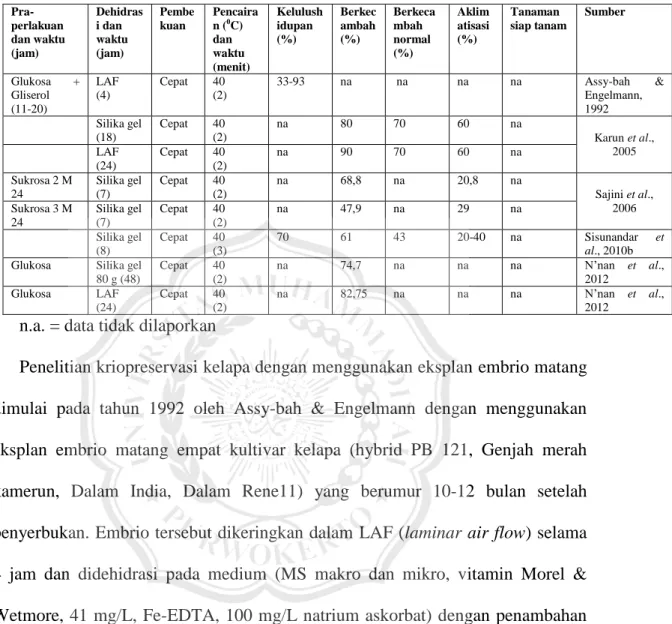
Gambar 2.2 Morfologi buah dari kultivar Kelapa Dalam Borneo (Borneo tall /
BONT) dari lapisan luar sampai ke dalam (COGENT network, 2013; Ratnambal et al., 2010).
Di dalam endocarp ditemukan biji kelapa yang terdiri atas lapisan kulit tipis yang keras (testa), endosperm yang padat (daging buah) serta endosperm cair (air kelapa). Pada daging buah terdapat embrio yang berukuran bervariasi dengan panjang sekitar 0,5 - 1 cm dan diameter sekitar 0,5 cm serta berat yang sekitar 0,1 g tergantung kulivar dan umur embrio (Foale, 2003; Sisunandar et al., 2014; Ohler & Magat, 2016). Embrio terletak pada sisi pangkal buah yang terdapat tiga mata lembaga. Di antara ketiga mata lembaga tersebut terdapat satu buah mata
1 2 3 4 5 6
1. Exocarp (kulit luar) 2. Mesocarp (sabut) 3. Embrio
4. Endocarp (batok) 5. Testa (lapisan kulit
tipis yang keras 6. Endosperm padat
(daging buah) 7. Endosperm cair (air
kelapa
lembaga yang lunak tempat keluarnya tunas sewaktu embrio berkecambah (Gambar 2.3) (Ohler & Magat, 2016).
Gambar 2.3 Embrio kelapa dan perkecambahannya, (A) 3 mata lembaga, (B)
embrio pada endosperm (dilihat secara membujur / atas), (C) embrio pada endosperm (dilihat secara melintang / samping), (D) embrio kelapa yang sudah tumbuh ditandai munculnya tunas dan akar dari salah satu mata lembaga, (E) houstorium membesar, (F) penampang utuh embrio yang tumbuh terlepas dari batok (Newton’saplle, 2016).
Buah kelapa yang telah matang mulai berkecambah segera setelah panen tanpa diikuti masa dormansi (rekalsitrant). 2 – 4 minggu setelah panen, embrio bagian apikal tumbuh dan muncul dari batok melalui mata lembaga yang lunak sedangkan pada bagian dorsal akan berkembang menjadi haustorium yang lembut dan berasa manis (Ohler & Magat, 2016). Tunas dan akar primer muncul dari massa apikal sekitar 8 minggu setelah panen. Daun pertama muncul 5 minggu kemudian serta menjadi bibit siap tanam setelah sekitar 1 tahun setelah panen (Ohler & Magat, 2016).
A B C
2.1.2 Kultivar
Berdasarkan morfologinya (Gambar 2.4), tanaman kelapa dibedakan menjadi dua tipe yaitu kelapa tipe dalam (tall) dan kelapa tipe genjah (dwarf; Foale & Harries, 2011). Kelapa dalam dapat dibedakan dengan kelapa genjah secara cepat karena kelapa dalam memiliki batang yang besar dengan pangkal yang membesar membentuk bole, sedangkan kelapa genjah memiliki batang yang lebih kecil dan pangkal tanpa membentuk bole. Pada umur yang sama, kelapa dalam memiliki batang yang lebih tinggi dibandingkan dengan kelapa genjah (Foale, 2003; Chan & Elevitch, 2006). Kelapa dalam juga memiliki umur yang lebih panjang (bisa mencapai lebih dari 100 tahun) dibandingkan dengan kelapa genjah (sekitar 60 tahun)(Ohler & Magat, 2016). Daun kelapa dalam juga lebih besar dan panjang dibandingkan dengan kelapa genjah (Foale, 2003).
Gambar 2.4 Kultivar (A) Kelapa dalam Tenga (Tenga Tall/ TGT) dan (B) kelapa
genjah Raja coklat (Raja Brown Dwarf / RBD01), (C) pangkal batang kelapa dalam yang memebentuk bole, (D) pangkal batang kelapa genjah yang tidak membentuk bole (Foale, 2003; Balai penelitian dan pengembangan perkebunan, 2007; Bourdeix R et al., 2010; Novarianto & Bourdeix, 2010).
A B C
Perbedaan kelapa dalam dengan kelapa genjah juga dapat diamati dari buahnya. Kelapa dalam mulai menghasilkan buah pada umur sekitar 6 - 8 tahun, dengan buah yang memiliki ukuran relatif besar dan jumlah per tandan relatif sedikit. Pada kelapa genjah, buah umumnya mulai dihasilkan setelah kelapa berumur 4 -5 tahun dengan ukuran buah yang relatif kecil dibadingkan dengan buah kelapa dalam, serta memiliki jumlah buah per tandan relatif besar (Foale & Harries, 2011; Ohler & Magat, 2016).
Pada umumnya kelapa dalam memiliki bunga bersifat protrandris (proterandri), yaitu bunga jantan lebih dahulu matang dibadingkan dengan bunga betina (Tjitrosoepomo, 2000). Akibatnya, kelapa dalam pada umumnya melakukan penyerbukan silang dan bersifat heterozigot. Hal tersebut tidak terjadi pada kelapa genjah, dimana bunga jantan matang hampir bersamaan dengan bunga betina sehingga mayoritas kelapa genjah melakukan penyerbukan sendiri dan bersifat homozigot (Foale & Harries, 2011).
Kultivar kelapa dinamai dengan dua kata (Bourdeix, 2012). Kata pertama dapat menunjukkan tempat (pulau atau negara) mereka ditemukan, nama tradisional yang sudah dikenal, ciri-ciri yang menonjol atau kombinasi dari nama di atas. Pada kelapa genjah ditambahkan warna buah jika warna tersebut telah diketahui bersifat homozigot. Kata kedua menunjukkan kelapa tersebut tergolong kelapa dalam atau kelapa genjah. Sebagai contoh kelapa dalam bali (Bali tall) merupakan kultivar kelapa dalam yang berasal dari pulau Bali. Kelapa dalam tebu (Tebu sweet husk tall) merupakan kelapa dalam yang memiliki sabut yang manis seperti tebu. Contoh lain seperti genjah hijau Jombang (Jombang Green Dwarf)
merupakan kultivar kelapa genjah yang memiliki warna buah hijau dan berasal dari Jombang, Jawa Timur (Chan & Elevitch, 2006; Ohler & Magat, 2016). Demikian pula dengan genjah hijau kopyor (Kopyor green dwarf) merupakan kelapa genjah yang memiliki buah berwarna hijau dan endosperm yang hancur (kopyor).
Pada tahun 2012, Indonesia memiliki 105 kultivar yang terdiri dari 82 kelapa dalam dan 23 kelapa genjah (Bourdeix, 2012). Angka tersebut hampir seperempat dari keseluruhan kultivar kelapa yang ditemukan di dunia. Pada saat ini ditemukan sebanyak 419 kultivar kelapa diseluruh dunia yang terdiri atas 319 kelapa dalam dan 100 kultivar kelapa genjah (Bourdeix, 2012). Meskipun demikian, di Indonesia diperkirakan masih banyak kultivar kelapa yang belum terpublikasi secara resmi.
Salah satu daerah di Indonesia yang mempunyai jenis kelapa (kultivar) yang belum terpublikasi secara resmi adalah Kabupaten Banyumas. Luas area perkebunan kelapa di kabupaten Banyumas sekitar 18 ribu Hektar dengan jumlah pohon kelapa sekitar 1,7 juta pohon (Husein, 2014). Di Kabupaten Bayumas paling tidak dikenal dua jenis kelapa yang belum dilepas secara resmi oleh pemerintah, yakni Kelapa Dalam Banyumas (KDB) dan Kelapa Genjah Entog (KGE). KDB tersebar di kebun-kebun rakyat di desa Karang Gedang, Kemiri, kecamatan Sumpiuh, sedangkan KGE tersebar di dua kecamatan, yakni Cilongok dan Ajibarang (SK Direktur Jenderal Perkebunan, Nomor:53/KB.820/SK/DJ.BUN/05-1996). Kedua wilayah tesebut telah ditetapkan sebagai kebun blok penghasil tinggi penghasil benih guna memenuhi kebutuhan
benih kelapa. Namun demikian, upaya pelestarian kedua plasma nutfah terbetu belum dilakukan, oleh karena itu langkah-langkah penelitian guna pelestariannya perlu segera dilakukan.
2.1.3 Nilai Sosial-Ekonomi Kelapa
Kelapa merupakan tree of life (pohon kehidupan) karena hampir semua bagian tanaman tersebut bermanfaat bagi kehidupan manusia (Foale, 2003). Akar kelapa digunakan sebagai bahan baku kerajinan pada masyarakat Bali (Pratiwi & Sutara, 2013). Akar kelapa juga banyak digunakan untuk menurunkan suhu tubuh pada penderita demam (antipiretik) maupun sebagai obat untuk meningkatkan produksi urin (diuretik; Ohler & Magat, 2016).
Batang kelapa yang lurus secara umum dapat kita temui digunakan oleh masyarakat sebagai bahan baku bangunan (Pannetier & Buffard-Morel, 1986; Ohler & Magat, 2016). Selain itu, batang kelapa juga banyak digunakan sebagai furniture, alat rumah tangga, maupun hiasan rumah (Foale, 2003; Ohler & Magat, 2016).
Daun kelapa digunakan oleh masyarakat sebagai atap, daun yang dianyam menjadi tikar, keranjang, tas, topi, wadah untuk makanan, dan tulang jari daun (lidi) dapat digunakan sebagai sapu (Foale, 2003; Ohler & Magat, 2016). Selain itu, tangkai daun dan daun yang kering dapat digunakan sebagai bahan bakar untuk tungku tradisional (Foale, 2003). Di samping nilai ekonominya yang tinggi, daun kelapa juga mempunyai nilai sosial yang tinggi. Bagi masyarakat di Indonesia, daun kelapa digunakan sebagai perlengkapan dalam upacara adat maupun kegiatan keagamaan lainnya (Pratiwi & Sutara, 2013).
Bunga kelapa yang masih muda juga dapat disadap untuk menghasilkan nira. Nira mengandung sekitar 15 % sukrosa sehingga dapat digunakan untuk menghasilkan gula kelapa maupun gula semut (gula kristal; Ohler & Magat, 2016). Nira juga dapat diminum secara langsung atau diolah lebih lanjut untuk menghasilkan alkohol. Dalam satu satu hari, dapat dihasilkan nira dalam sekitar 1 liter untuk setiap pohon kelapa (Foale, 2003).
Buah kelapa merupakan bagian terpenting dari tanaman kelapa yang memiliki nilai guna yang tinggi bagi masyarakat. Sabut kelapa banyak digunakan untuk membuat tali, karpet, tikar dan geo-tekstil, bahan pembuatan sikat, kasur, maupun jok (Foale, 2003). Selain itu, sabut kelapa yang dihancurkan/ tepung (cocopeat) dapat digunakan untuk campuran kompos, bahan bangunan ringan dan isolasi termal (Foale, 2003; Ohler & Magat, 2016). Bagian buah yang paling keras (batok) dapat dibuat menjadi peralatan rumah tangga, pot hias, dan digunakan sebagai bahan bakar (Ohler & Magat, 2016). Batok kelapa juga merupakan bahan baku karbon aktif yang memiliki nilai jual tinggi karena banyak dibutuhkan dunia industri (Foale, 2003).
Daging buah atau endosperm padat merupakan bagian terpenting dari buah kelapa disamping air kelapa yang banyak digunakan sebagai bahan baku pembuatan nata de coco ataupun diminum secara langung. Daging buah kelapa yang masih muda dapat dimakan langsung atau sebagai bahan utama dalam pembuatan es kelapa muda. Daging buah kelapa yang sudah tua (matang) diparut dan dicampur dengan air untuk selanjutnya diperas untuk menghasilkan santan (coconut milk) yang banyak digunakan sebagai bahan tambahan dalam masakan
makanan atau minuman (Foale, 2003; Ohler & Magat, 2016). Selain itu daging buah banyak dikeringkan (kadar air <50 %) menjadi kopra untuk ekstraksi minyak dan bahan makanan. Minyak kelapa banyak digunakan dalam industri sabun, deterjen, kosmetik, shampoo, cat, pernis dan produk farmasi (Widiyanti, 2015; Ohler & Magat, 2016). Saat ini, daging buah juga banyak diproses untuk menghasilkan minyak goreng berkualitas tinggi dan menyehatkan, yaitu virgin
coconut oil. Sisa pengolahan minyak kelapa (bungkil kelapa) juga banyak
digunakan sebagai pakan ternak yang mengandung protein 20 % dan 10 % minyak sisa (Foale, 2003; Ohler & Magat, 2016).
2.1.4 Budidaya Kelapa dan Permasalahannya
Kelapa (Cocos nucifera L.) merupakan salah satu komoditi perkebunan yang sangat penting dalam perekonomian Indonesia. Pada tahun 2014, Indonesia merupakan produsen kelapa terbesar di dunia dengan total produksi mencapai 19,1 juta ton (FAO, 2014) yang dihasilkan dari area perkebunan kelapa seluas sekitar 3,6 juta hektar (Nasir, 2014).
Salah satu kendala yang dihadapi pada budidaya kelapa di Indonesia adalah berkurangnya area perkebunan kelapa. Setiap tahun, luas area perkebunan kelapa di Indonesia menurun sekitar 0,38 % (Nasir, 2014). Beberapa faktor diduga menjadi penyebab berkurangnya luas area perkebuan kelapa seperti serangan hama dan penyakit, alihfungsi lahan, dan bencana alam.
Hama utama yang telah terbukti berbahaya dan menimbulkan kerugian pada tanaman kelapa adalah kumbang badak (Oryctes rhinoceros) dan belalang pedang (Sexava nubila; Siahaya, 2014). Kumbang badak (O.rhinoceros) merusak
daun muda kelapa yang belum terbuka. Hama tersebut telah mengakibatkan kerugian sekitar 10 miliar rupiah di Jawa Tengah pada tahun 2005 (Mulyono, 2007). Selain itu pada tahun 2014, serangan hama tersebut juga telah menyebabkan kematian lebih dari 5 ribu batang pohon kelapa di Kabupaten Blitar, Jawa Timur (Kustantini, 2014). Hama belalang pedang (Sexava nubila) merusak kelapa pada bagian daun kelapa yang sudah dewasa (tua) meskipun terkadang dapat menyerang daun muda, kulit buah dan bunga. Pada serangan belalang pedang yang cukup berat dapat mengakibatkan daun kelapa meranggas dan hanya menyisakan lidi. Akibatnya, buah kelapa akan rontok dan tanaman tidak dapat menghasilkan buah selama kurang lebih 2 tahun atau pada serangan hama tersebut yang sangat parah dapat mengakibatkan kematian (Lobalohin et al., 2014). Pada tahun 2012, di Kabupaten Kepulauan Talaud, Provinsi Sulawesi Utara serangan hama tersebut menyebabkan kerugian ekonomi sekitar Rp. 26,3 milyar dengan total luas serangan mencapai 16 ribu hektar (Wagiman et al., 2012).
Beberapa penyakit kelapa juga dapat menyebabkan berkurangnya luas lahan perkebunan kelapa seperti penyakik busuk pucuk (PBP) maupun penyakit layu Kalimantan (PLK). PBP disebakan oleh cendawan Phytophthora palmivora yang mengakibatkan daun-daun muda mengering di tengah-tengah tajuk, daun berwarna coklat dan patah pada pangkalnya, pangkal membusuk, yang kemudian dapat mencapai titik tumbuh sehingga pertumbuhan tanaman terhenti dan mati (Lolong, 2005). PBP pernah menyerang area perkebunan kelapa di daerah Kabupaten Minahasa Selatan, Sulawesi Utara dengan total lahan mencapai 3 ribu hektar (Lolong, 2010).
PLK disebabkan oleh Phytoplasma yang ditandai dengan daun menguning serta diikuti dengan pelepah bagian bawah kering layu dan menggantung di pohon. Pada serangan penyakit tersebut yang berat dapat mengakibatkan buah tidak normal dan banyak buah yang jatuh, maupun tangkai buah menjadi kering (Lolong, 2014). Berdasarkan hasil survei pada Desember 1997, PLK sudah menyerang lebih dari 100 ribu pohon, di antaranya lebih dari 47 ribu pohon mati (Lolong, 2014).
Faktor lain yang menjadi berkurangnya luas area perkebunan kelapa adalah adanya alihfungsi lahan. Alihfungsi dapat terjadi karena meningkatnya jumlah populasi masyarakat di Indonesia. Alihfungsi yang selama ini telah terjadi adalah alihfungsi menjadi perumahan (tempat tinggal), jalan, dan penggantian tanaman menjadi tanaman yang dianggap memiliki nilai ekonomi lebih tinggi. Sebagai contoh pada tahun 2011, antar 5-10 % dari luas area perkebunan kelapa di Sulawesi Utara (dengan total area perkebunan kelapa sekitar 270 ribu hektar) mengalami alihfungsi lahan menjadi perumahan dan area industri (Republika.co.id, 2014). Selain itu, kebun plasma nutfah kelapa di Paniki, Manado, Sulawesi Utara telah dialihfungsikan menjadi tempat pacuan kuda karena dianggap mempunyai nilai ekonomi yang lebih tinggi (Novarianto, 2008).
Faktor terakhir yang menjadi penyebab berkurangnya luas area perkebunan kelapa adalah bencana alam. Seperti yang terjadi di Propinsi Aceh pada tahun 2004, tsunami telah dilaporkan mengakibatkan hilangnya 10 ribu hektar (9,28 %) perkebunan kelapa (Antaraaceh, 2014).
2.2 Konservasi Kelapa
Salah satu akibat yang muncul dari berkurangnya luas area perkebunan kelapa di Indonesia adalah hilangnya plasma nutfah kelapa baik yang telah dikenal maupun yang belum teridentifikasi. Pada saat ini diketahui terdapat 419 kultivar kelapa di dunia dan lebih dari seperempatnya ditemukan di Indonesia. Pada tahun 2012, jumlah kultivar yang dimiliki Indonesia mencapai 105 kultivar yang terdiri dari 82 kelapa dalam dan 23 kelapa genjah (Bourdeix, 2012). Dan diperkirakan saat ini Indonesia masih memiliki sekitar 400 kultivar yang belum diidentifikasi (Novarianto, 2008). Untuk itu diperlukan upaya konservasi untuk mencegah terjadi pengikisan plasma nutfah kelapa tersebut.
2.2.1 Konservasi Kelapa secara In situ
Konservasi kelapa secara in situ merupakan upaya mempertahankan plasma nutfah pada habitat aslinya seperti dilahan-lahan perkebunan milik petani, di pinggir pantai ataupun pulau terpencil (Foale, 2003). Salah satu contoh keberhasilan konservasi kelapa secara in situ adalah konservasi kelapa kopyor yang dilakukan oleh para petani di Kabupaten Pati yang dimulai sekitar tahun 1960-an (Maskromo et al., 2007). Pada saat ini program tersebut berhasil mengkonservasikan hampir 2000 pohon kelapa kopyor genjah (Kompas.com, 2012). Selain itu, upaya konservasi in situ juga dilakukan oleh pemerintah kabupaten Banyumas dengan membagikan 85 ribu bibit kelapa genjah entog kepada 85 kelompok tani di 13 kecamatan di kabupaten Banyumas (Bupatibanyumas, 2014). Upaya tersebut selain bertujuan untuk meremajakan tanaman kelapa khususnya tanaman kelapa deres, meningkatkan produktivitas
tanaman kelapa dan mengurangi resiko kecelakaan bagi penderes juga berperan penting dalam upaya pelestarian kelapa genjah entog di Kabupaten Banyumas.
Konservasi kelapa secara in situ memiliki keuntungan tidak hanya mudah dilakukan dan membutuhkan biaya yang murah, namun dapat juga digunakan untuk penanggulangan kemiskinan dengan meningkatkan pendapatan serta pengetahuan petani kelapa. Di sisi lain, teknik tersebut juga memiliki kelemahan seperti rentan terhadap bencana alam, pengalihan fungsi lahan, membutuhkan pengawasan yang aktif dan sulitnya pengumpulan data jika diperlukan (Dullo et
al., 2005). Oleh karena itu alternatif lain konservasi kelapa yang lebih aman
dilakukan sangat dibutuhkan guna melestarikan plasma nutfah kelapa di Indonesia.
2.2.2 Konservasi Kelapa secara Ex Situ
Konservasi kelapa secara ex situ merupakan upaya mempertahankan plasma nutfah di luar habitat aslinya seperti pembangunan kebun plasma nutfah, penyimpanan pollen, maupun penyimpanan embrio zigotik (Dullo et al., 2005). Konservasi kelapa secara ex situ memiliki banyak keunggulan dibandingkan dengan konservasi secara in situ, seperti lebih aman terhadap upaya alih fungsi lahan serta memiliki data yang lebih lengkap dan lebih mudah diakses (Engelman, 2011).
2.2.2.1 Kebun Plasma Nutfah Kelapa
Salah satu teknik konservasi kelapa yang paling banyak dilakukan karena lebih aman terhadap alih fungsi lahan maupun data yang lengkap adalah melalui pembangunan kebun plasma nutfah. Upaya pembangunan kebun plasma nutfah
kelapa di Indonesia telah dilakukan sejak tahun 1911 dengan dimulainya membuat koleksi kelapa dari berbagai wilayah di Indonesia. Pada tahun 1930, kebun koleksi kelapa pertama di Indonesia dibangun di kebun percobaan Mapanget, Manado oleh Dr. P.L.M. Thammes yang berhasil mengkoleksi lebih dari 40 kultivar yang berasal dari berbagai daerah di Indonesia (Balai Penelitian tanaman Palma (Indonesia Palmae Resarch Institute), 2015). Pada saat ini, Indonesia memiliki kebun plasma nutfah kelapa sebanyak tujuh lokasi (Tabel 2.1), yaitu kebun plasma nutfah (KP) Mapanget (Manado, Sulawesi Utara), Pakuwon (Jawa Barat), Sikijang Mati (Riau), Paniki (Sulawesi Utara), Pandu (Sulawesi Utara) dan Kima Atas serta Bone-bone (Sulawesi Selatan) (Novarianto et al., 2005) dan berhasil mengkoleksi kelapa sebanyak 97 aksesi kelapa dalam dan 40 aksesi kelapa genjah (Novarianto et al., 2005; Novarianto, 2008).
Tabel 2.1 Lokasi kebun plasma nutfah kelapa di Indonesia beserta jumlah aksesi
(Novarianto et al., 2005; Novarianto, 2008).
NO Kebun Plasma Nutfah Aksesi Sumber
Dalam (tall) Genjah (dwarf)
1 Mapengat (Manado) 40 13 Novarianto
et al., 2005
2 Pakuwon (Jawa Barat) 12 8 Novarianto
et al., 2005
3 Sikijang Mati (Riau) 24 9 Novarianto
et al., 2005
4 Paniki (Sulut) 21 10 Novarianto,
2008
5 Bone-Bone (Sulsel) na na
6 Pandu (Sulut) na na
7 Kima Atas (Sulsel) na na
Jumlah Total 97 40
Bahkan, mulai tahun 1993 Indonesia ditetapkan oleh International Coconut
Genetics Network (COGENT) sebagai salah satu negara dari 5 negara lokasi
pelestarian kelapa internasional (International Coconut Genebank/ ICG). Indonesia ditetapkan sebagai lokasi kebun plasma nutfah kelapa untuk wilayah Asia Tenggara dan Asia Timur yang meliputi Cina, Malaysia, Myanmar, Philipina, Thaliand, Vietman, dan Indonesia (Novarianto, 2008). Lokasi konservasi kelapa tersebut ditempatkan di Sikijang Mati, Riau. Namun karena adanya okupasi tanah oleh masyarakat akibat selama era reformasi, maka lokasi tersebut kemudian dipindahkan ke kebun Pandu dan Paniki, Sulawesi Utara pada tahun 2002 (Tulalo et al., 2007).
Kebun plasma nutfah yang telah dibangun tersebut memberikan banyak kemudahan seperti pengaksesan dan pengamatan data yang lebih rinci karena terkumpul dalam satu wilayah, dimiliki oleh pemerintah sehingga relatif aman terhadap alihfungsi lahan ataupun tanaman perkebunan lainnya serta perawatan yang lebih baik sehingga relatif aman terhadap serangan hama dan penyakit (Engelman, 2011). Namun demikian, pembangunan kebun plasma nutfah masih rawan terhadap bencana alam termasuk kekeringan, disamping biaya untuk pembangunan dan perawatan yang cukup besar (Engelman, 2011). Oleh karena itu, ketersediaan plasma nutfah kelapa yang disimpan dalam bentuk lain sangat dibutuhkan sebagai cadangan simpanan plasma nutfah (back up).
2.2.3 Konservasi Pollen Kelapa
Salah satu upaya konservasi ex situ kelapa yang aman, tidak mengalami serangan hama dan penyakit serta terlindung dari bencana alam adalah konservasi
pollen. Konservasi pollen adalah upaya pelestarian plasma nutfah kelapa melalui penyimpanan pollen (serbuk sari). Penyimpanan tersebut dimaksudkan untuk memfasilitasi program pemuliaan tanaman melalui penyerbukan silang, pendistribusian dan pertukaran plasma nutfah antar lokasi dan melestarikan gen plasma nutfah, serta untuk studi fisiologi, biokimia, pembuahan dan bioteknologi, yang melibatkan ekspresi gen, serta transformasi dan pembuahan in vitro (Panis & Lambardi, 2005). Pollen dapat dikeringkan dan disimpan di bawah vakum untuk jangka waktu yang singkat (2-6 bulan) dalam freezer domestik (Dullo et al., 2005) atau disimpan di suhu beku (-196 0C) untuk penyimpanan yang lebih lama (Karun et al., 2014). Keunggulan teknik tersebut adalah pollen dapat dengan mudah dikumpulkan dan dalam jumlah besar, membutuhkan ruang penyimpanan yang sedikit, serta mudah dalam pertukaran plasma nutfah (COGENT, 2008). Oleh karena itu teknik penyimpanan pollen dapat digunakan sebagai back up konservasi kelapa yang lain seperti kebun plasma ataupun teknik konservasi in
situ. Namun demikian, penerapan teknik ini masih terbatas pada proses pemuliaan
materi genetik tanaman jantan yang hanya menyimpan setengah dari informasi genetik yang terdapat pada kelapa (haploid; Engelmann et al., 2007).
2.2.4 Konservasi Embrio Zigotik Kelapa
Alternatif konservasi ex situ yang banyak digunakan adalah penyimpanan biji. Namun demikian biji kelapa tidak dapat disimpan karena biji kelapa merupakan biji rekalsitaran yakni biji dengan kadar air yang tinggi tidak toleran terhadap proses pengeringan (Engelman, 1999). Selain itu, ukuran buah kelapa yang besar (sekitar 850 – 3000 grm; Chan & Elevitch, 2006) akan sulit untuk disimpan dalam
jumlah yang banyak (Engelman, 1999). Oleh karena itu, satu-satunya alternatif yang tersedia untuk digunakan dalam konservasi kelapa secara ex situ adalah dengan cara konservasi embrio zigotik. Teknik konservasi embrio kelapa memiliki banyak keunggulan dibandingkan dengan teknik konservasi pollen karena menyimpan informasi genetik kelapa secara utuh. Beberapa teknik telah dikembangkan untuk konservasi embrio zigotik kelapa, baik untuk konservasi jangka pendek sampai menengah (short to medium term conservation), maupun untuk konservasi jangka panjang (long term conservation).
Teknik konservasi embrio kelapa untuk jangka pendek sampai menengah bertujuan untuk menyimpan plasma nutfah embrio kelapa untuk jangka waktu 2 hingga 12 bulan (<1 tahun; Engelmann, 1990). Teknik penyimpanan yang dapat digunakan untuk menyimpan kelapa dalam jangka pendek-menengah meliputi teknik penyimpanan secara in vitro maupun embrio dikeringkan dan disimpan pada suhu rendah.
Teknik penyimpanan embrio secara in vitro dapat dilakukan dengan cara mengubah menurunkan periode subkultur melalui modifikasi lingkungan kultur seperti penurunan temperatur ruang kultur (Karunaratne, 1988), intensitas cahaya maupun kuat penyinaran sehingga menurunkan tingkat metabolisme tanaman (Muhammed et al., 2013). Penurunan periode subkultur juga dapat dilakukan dengan cara menurunkan konsentrasi medium tanam (Karunaratne, 1988), penambahan zat penghambat pertumbuhan ataupun penambahan senyawa yang mampu menurunkan penyerapan nutrisi seperti penambahan mannitol (Sukendah & Cedo, 2005; Ledo et al, 2014).
Teknik penyimpanan in vitro tersebut mudah dilakukan dan cepat untuk mendapatkan tanaman baru jika dibutuhkan serta memiliki persentase keberhasilan yang tinggi (Sukendah & Cedo, 2005). Namun demikian, lama penyimpanan yang terbatas, tingginya resiko kontaminasi, membutuhkan pemeliharaan yang intensif dengan skill yang tinggi sehingga membutuhkan biaya yang mahal guna mengaplikasikan teknik tersebut (Tambunan & Mariska, 2003; Sukendah & Cedo, 2005).
Teknik lain yang lebih mudah dan aman untuk digunakan dalam konservasi embrio kelapa dalam jangka pendek sampai menengah adalah dengan cara embrio dikeringkan sampai kadar air sekitar 29 %, kemudian embrio dapat disimpan sampai 3 minggu pada -20 0C atau selama 26 minggu pada -80 0C (Sisunandar et
al., 2012). Teknik tersebut tidak membutuhkan tenaga kerja yang banyak serta
murah untuk dilakukan, namun teknik penyimpanan tersebut masih terbatas untuk jangka waktu yang menengah (maksimal 26 minggu) dengan tingkat keberhasilan yang relatif rendah untuk menumbuhkan kembali tanaman dari embrio yang disimpan (12 %; Sisunandar et al., 2012). Oleh karena itu diperlukan alternatif lain teknik yang dapat digunakan untuk menyimpan embrio kelapa dalam jangka waktu yang panjang (>1 tahun; long term conservation).
Penyimpanan embrio kelapa sebagai konservasi jangka panjang (long term
conservation) dapat dicapai dengan menyimpanan embrio pada suhu ultra rendah
(-196 0C) dengan menggunakan nitrogen cair (kriopreservasi; Engelmann, 2004). Pada suhu tersebut proses aktifitas metabolisme sel akan berjalan lambat atau
bahkan terhenti, sehingga memungkinkan embrio disimpan dalam jangka waktu yang lama bahkan tidak terbatas (Engelman, 1990).
2.3.Teknik Kriopreservasi untuk Penyimpanan Plasma Nutfah
Teknik kriopreservasi telah banyak diaplikasikan untuk menyimpan plasma nutfah berbagai tanaman untuk jangka waktu yang panjang, seperti rambutan (Nephelium lappaceum L; Zebua, 1998); damar (Agathis damare Salisb.; Djam’an
et al., 2006) ataupun purwoceng (Pimpinella pruatjan Molk; Roostika et al.,
2013). Teknik tersebut juga banyak direkomendasikan sebagai teknik penyimpanan plasma nutfah paling aman di berbagai laboratorium ternama seperti
United States Departement of Agriculture- Agricultural Research Service
(USDA-ARS) National Clonal Germplasm Repository (NCGR) di Corvalis, Amerika Serikat (Reed et al., 2001) dan Centro Internacional de Agricultura Tropical (CIAT di Columbia; Gonzalez-Benito et al., 2004).
Secara umum, untuk melakukan penyimpanan plasma nutfah pada suhu ultra rendah tersebut dilakukan dengan 4 tahap, yaitu tahapan pengeringan (dehidrasi), pembekuan (freezing), pencairan (thawing), dan pemulihan kembali (recovery).
2.3.1 Pengeringan (Dehidrasi)
Pengeringan (dehidrasi) adalah usaha penurunan kadar air pada sampel yang akan disimpan. Air di dalam sel yang tinggi dapat menyebabkan terbentukanya kristal es dalam sel sewaktu dilakukan pembekuan. Akibatnya sel akan rusak dan menyebabkan kematian dari sampel yang akan disimpan (Panis & Lambardi, 2005). Oleh karena itu, semakin rendah kadar air di dalam sel akan diperoleh sampel yang mampu bertahan pada suhu beku semakin banyak. Banyak sampel
tumbuhan yang digolongkan di dalam kelompok ortodoks yang mampu dikeringkan sampai kadar air yang sangat rendah (sekitar 5 %) seperti tumbuhan gandum (Triticum aestivum L; Fabian et al., 2008), ceri liar (Prunus avium L; Chmielarz, 2008) dan jagung (Zea mays L; Usman & Abdulmalik, 2010). Namun demikian, banyak sampel tanaman yang digolongkan di dalam kelompok rekalsitran, yaitu tanaman yang hanya mampu dikeringkan sampai kadar air relatif tinggi (sekitar 20 – 30 %), seperti tanaman araucaria (Araucaria husteinii K. Schum; Pritchard & Prendergast, 1986), karet (Hevea brasiliensis; Yen yen, 1999), melur (Podocarpus neriifolius; Syamsuwida & Aminah, 2008) maupun kelapa (Cocos nucifera L.; Engelmann, 2011).
Sampai saat ini berbagai metode dehidrasi telah banyak dikembangkan, secara umum metode tersebut dapat dikelompokan menjadi dua, yakni dehidrasi secara fisik dan dehidrasi secara kimia atau gabungan dari kedua teknik tersebut. Dehidrasi secara fisik merupakan pengeringan menggunakan aliran udara, seperti
laminar air flow (LAF) maupun silica gel, (Panis & Lambardi, 2005). Teknik
dehidrasi dengan menggunakan LAF selama hampir 5 jam digunakan pada embrio zigotik labu siam (Sechium edule Jacq.Sw) dengan dengan keberhasilan 30 % (Abdelnour-Esquivel & Engelmann, 2002). Teknik yang sama dilakukan selama 0,5 jam juga berhasil digunakan pada embrio zigotik kopi robusta (Coffea
canephora) dengan tingkat keberhasilan 41 % maupun kopi arabika (C. Arabica
L) dengan tingkat keberhasilan mencapai 95,8 % (Abdelnour-Esquivel et al., 1992).
Teknik dehidrasi dengan cara mengeringkan sampel di dalam wadah tertutup berisi silika gel selama 9 jam juga berhasil dilakukan pada biji tanaman palem kipas cina (Livistona chinensis) dengan tingkat keberhasilan mencapai 80 % (Wen, 2009). Selain itu, Benmahioul et al., (2015) juga menggunakan silica gel selama 2 jam untuk mengeringkan bakal tunas kacang piscatio (Pistacia vera) sebelum disimpan di dalam nitrogen cair dengan tingkat keberhasilan mencapai 100 %.
Dehidrasi secara kimia pada umumnya dilakukan dengan menggunakan senyawa kimia konsentrasi tinggi seperti sukrosa, glukosa, maupun polietilen glikol (PEG) yang mampu menyebabkan air di dalam sel keluar sehingga menurunkan kadar air di dalam sel (Panis & Lambardi, 2005). Sebagai contoh, dehidrasi dengan menggunakan larutan 0,75 M sukrosa selama 3 hari berhasil digunakan untuk mengeringkan embrio zigotik tanaman hantap (Sterculia
cordata) dengan tingkat keberhasilan mencapai 80 % (Nadarajan et al., 2007).
Teknik dehidrasi dengan cara eksplan direndam dalam larutan 0,5 M sukrosa selama 3 hari juga berhasil digunakan untuk mendehidrasi ujung pucuk tanaman jeruk ponsil (Poncirus trifoliata) dengan tingkat keberhasilan mencapai 50 % (Gonzalez-Arnao et al., 1998). Selain itu, dehidrasi menggunakan larutan 1 M glukosa selama 1 jam berhasil digunakan untuk mendehidrasi embrio tanaman kelapa sawit (Elaeis guineensis Jacq.) dengan tingkat keberhasilan sekitar 28 % (Chabrillange et al., 2000).
Beberapa penelitian menggunakan senyawa yang mampu melindungi sel selama suhu ultra rendah dengan cara menjaga stabilitas keutuhan membran
plasma (Kaviani, 2011), senyawa tersebut digolongkan ke dalam krioprotektan seperti dimetilsulfoksida (DMSO) gliserol, dan metanol (Day & McLellan, 1995). Sebagai contoh, dehidrasi menggunakan larutan 1,5 M gliserol yang dikombinasikan dengan 0,3 M sukrosa selama 30 menit berhasil digunakan untuk mendehidrasi embrio somatik tanaman tebu (Sacharrum sp) dengan tingkat kelulushidupan mencapai 55 % (Martinez-Montero et al, 2008). Contoh lain, penggunaan larutan 10 % DMSO dengan dikombinasi larutan 1 M sukrosa selama 30 menit berhasil mendehidrasi tanaman karet (Hevea brasiliensis) dengan tingkat kelulushidupan 49 % (Engelmann et al., 1997).
2.3.2 Pembekuan (Freezing)
Suhu penyimpanan sampel merupakan salah satu faktor penentu keberhasilan penyimpanan plasma nutfah. Semakin rendah suhu penyimpanan akan mengakibatkan sampel yang disimpan semakin tahan lama. Sebagai contoh biji
Lactuca sativa yang telah dikeringkan hanya disimpan selama 13 tahun pada suhu
5 0C, sedangkan pada suhu yang lebih rendah (-18 0C) dapat disimpan sampai 150 tahun, bahkan pada suhu ultra rendah (-196 0C), biji dapat disimpan lebih dari 3000 tahun (Walter et al., 2004).
Pada umumnya, sel akan mengalami kerusakan apabila dimasukkan ke dalam suhu rendah karena adanya pembentukan kristal es di dalam sel (Cruz-cruz et al., 2013), namun apabila pembekuan dilakukan secara benar maka pembentukan kristal es dapat dihindari. Berdasarkan kecepatan proses pembekuan, kriopreservasi dapat dikelompokkan menjadi dua macam, yaitu teknik pembekuan lambat dan pembekuan cepat. Pembekuan lambat merupakan proses penurunan
suhu secara perlahan-lahan dan terkontrol dengan kecepatan rendah (0,5-2,0 0C per menit) sampai suhu sekitar -40 0C atau -80 0C dan dilanjutkan dengan perendaman ke dalam nitrogen cair (-196 0C; Engelmann, 2004). Pada proses pembukan lambat ini, pada awalnya kristal es terbentuk di cairan ekstraseluler, kristalisasi es ini mendorong air dari sitoplasma dan vakuola ke luar dari sel, sehingga pembentukan kristal es pada bagian dalam sel dapat dihindari (Engelmann, 2004; Cruz-cruz et al., 2013). Teknik tersebut berhasil digunakan pada tanaman singkong (Manihot esculenta Crantz) dengan tingkat kelulushidupan 55 % (Danso & Ford-Lioyr, 2011). Namun demikian, pembekuan secara lambat membutuhkan alat pendingin yang dapat diprogram kecepatan penurunan suhunya. Oleh karena itu teknik tersebut kurang banyak digunakan (Engelmann, 2004). Teknik pembekuan paling umum dilakukan secara cepat dengan memasukkan sampel secara langsung ke dalam nitrogen cair (-196 0C), sehingga faktor pembentukan kristal es dapat dihindari (Engelmann, 2004). Teknik tersebut berhasil diaplikasikan pada embrio tanaman hantap (Sterculia
cordata) dengan tingkat keberhasilan 80 % berkecambah (Nadarajan et al.,
2007), dan tunas apel (Malus domestica) dengan tingkat keberhasilan 68 % untuk kultivar Romus4 dan 62 % untuk kultivar rootstock M16 (Halmagyi et al., 2010).
2.3.3 Pencairan (Thawing)
Pencairan (thawing) adalah proses pengeluaran sampel dari fase pendinginan (dalam nitrogen; -196 0C) ke suhu kamar atau suhu awal (sekitar 25 0C). Thawing bertujuan untuk menghindari kerusakan sel embrio akibat terbentuknya kembali kristal es (Engelmaan, 2004; Panis & Lambardi, 2005). Thawing dapat dibagi
menjadi dua macam, yakni slow thawing (pencairan lambat) dan rapid thawing (pencairan cepat). Slow thawing adalah dengan cara membiarkan cryotube dalam suhu ruang (sekitar 25 0C) selama beberapa saat (Engelmann, 1990). Teknik slow
thawing berhasil dilakukan pada quina (Strychnos pseudoquina) dengan cara
sampel dibiarkan di temperatur ruangan selama 2 jam dan memiliki tingkat keberhasilan mencapai 80 % (Silva et al., 2012). Namun demikian, teknik slow
thawing berpotensi menimbulkan kerusakan jaringan. Oleh karena itu teknik rapid thawing merupakan teknik yang sering digunakan. Teknik tersebut dilakukan
dengan cara mencelupkan cryotube (tabung kriopreservasi) yang berisi embrio ke dalam air yang bersuhu sekitar 40 0C selama kurang lebih 3 menit (Engelmann, 1990). Teknik rapid thawing tersebut berhasil digunakan pada kotiledon embrio tanaman teh (Camellia sinensis L) dengan tingkat kebehasilan antara 75-80 % bibit (Kim et al., 2002) maupun pada sumbu embrio nangka (Artocarpus
heterophyllus L) dengan tingkat kelangsunghidupan 30 % (Chandel et al., 1995). 2.3.4 Pemulihan (Recovery)
Penamaman kembali (recovery) sampel yang telah disimpan pada medium tanam merupakan tahapan terakhir dalam proses kriopreservasi. Pada tahapan ini sampel yang sudah melewati tahap thawing selanjutnya ditanam pada medium pemulihan secara in vitro. Pemilihan medium recovery tersebut sangat mempengaruhi keberhasilan sampel untuk berkecambah. Beberapa media yang dasar yang sering digunakan diantaranya medium MS (Murashige dan Skoog, 1962; Assy-bah & Engelman, 1992, 1993; N’Nan et al., 2012), Eeuwens Y3
(Euwen, 1976; Gomes-Copeland et al., 2015), dan HEC (Hibrid Embrio Culture
medium; Rillo, 2004).
Penambahan zat pengatur tumbuh ke dalam medium tanam juga sering digunakan selama proses penanaman kembali tersebut. Proses penanaman kembali tumbuhan hantap (Sterculia cordata; Nadarajan et al., 2007) dilakukan dengan menggunakan medium MS dengan penambahan benzyadenosine (BA) 0,5 mg/L. Selain itu, pada tumbuhan krisan (Chysanthemum sp) juga telah dilakukan dengan menanam pada medium pemulihan MS dengan penambahan 0,25 mg dm-3 kinetin. Perlakuan tersebut memiliki tingkat keberhasilan pemulihan 40 % (Zalewska & Kulus, 2014).
2.4 Perkembangan Penelitian Kriopreservasi Kelapa dan Permasalahannya
Penelitian tentang kriopreservasi kelapa telah banyak dilakukan. Sampai saat ini terdapat tiga buah jenis eksplan yang telah digunakan dalam kriopreservasi kelapa, yaitu plumular (Bandupriya et al., 2010; N’Nan, 2014), embrio muda (Bajaj, 1984) dan embrio matang (Tabel 2.2). Namun demikian, teknik kriopreservasi kelapa dengan menggunakan eksplan embrio yang matang merupakan teknik yang paling banyak digunakan dan memiliki tingkat keberhasilan yang lebih baik dibandingkan dengan eksplan yang lain (Sisunandar
Tabel 2.2 Perkembangan penelitian kriopreservasi embrio matang kelapa Pra-perlakuan dan waktu (jam) Dehidras i dan waktu (jam) Pembe kuan Pencaira n (0C) dan waktu (menit) Kelulush idupan (%) Berkec ambah (%) Berkeca mbah normal (%) Aklim atisasi (%) Tanaman siap tanam Sumber Glukosa + Gliserol (11-20) LAF (4) Cepat 40 (2) 33-93 na na na na Assy-bah & Engelmann, 1992 Silika gel (18) Cepat 40 (2) na 80 70 60 na Karun et al., 2005 LAF (24) Cepat 40 (2) na 90 70 60 na Sukrosa 2 M 24 Silika gel (7) Cepat 40 (2) na 68,8 na 20,8 na Sajini et al., 2006 Sukrosa 3 M 24 Silika gel (7) Cepat 40 (2) na 47,9 na 29 na Silika gel (8) Cepat 40 (3) 70 61 43 20-40 na Sisunandar et al., 2010b
Glukosa Silika gel 80 g (48) Cepat 40 (2) na 74,7 na na na N’nan et al., 2012 Glukosa LAF (24) Cepat 40 (2) na 82,75 na na na N’nan et al., 2012 n.a. = data tidak dilaporkan
Penelitian kriopreservasi kelapa dengan menggunakan eksplan embrio matang dimulai pada tahun 1992 oleh Assy-bah & Engelmann dengan menggunakan eksplan embrio matang empat kultivar kelapa (hybrid PB 121, Genjah merah kamerun, Dalam India, Dalam Rene11) yang berumur 10-12 bulan setelah penyerbukan. Embrio tersebut dikeringkan dalam LAF (laminar air flow) selama 4 jam dan didehidrasi pada medium (MS makro dan mikro, vitamin Morel & Wetmore, 41 mg/L, Fe-EDTA, 100 mg/L natrium askorbat) dengan penambahan 600 g/Lsukrosa dan 15 % gliserol, dengan pH 5,5 selama 20 jam sebelum disimpan pada suhu -196 0C. Setelah dilakukan rapid thawing dan recovery, jumlah embrio yang masih bertahan hidup masih sangat tinggi (93 %), namun demikian, persentase kecambah yang berhasil tumbuh setelah disimpan serta jumlah bibit yang dihasilkan dari embrio yang telah disimpan belum dilaporkan.
untuk selanjutnya disimpan pada temperatur -196 0C (Tabel 2.2). Setelah dilakukan rapid thawing dan penanaman kembali pada medium tanam, perlakuan tersebut menghasilkan persentase embrio yang berkecambah mencapai sekitar 80 % dan perssentase perkecambahan normal mencapai 70 % serta 60 % bibit hasil aklimatisasi. Namun demikian persentase bibit siap tanam yang dihasilkan dari embrio yang telah disimpan di dalam nitrogen cair juga belum dilaporkan.
Perlakuan 2 M sukrosa selama 24 jam dengan pengeringan menggunakan silika gel selama 7 jam juga berhasil digunakan untuk dehidrasi embrio kelapa
West Coast Tall sebelum disimpan di dalam nitrogen cair (Tabel 2.2). Perlakuan
tersebut menghasilkan persentase embrio yang mampu berkecambah sebesar 68,8 % dan bibit aklimatisasi sebesar 20,8 %. Namun teknik tersebut belum menghasilkan bibit siap tanam (Sajini et al., 2006).
Pendekatan dehidrasi yang lebih sederhana dengan cara embrio kelapa dikeringkan dengan menggunakan silika gel (680 g) selama 8 jam sebelum disimpan di dalam nitrogen cair berhasil digunakan untuk menyimpan embrio kelapa dengan tingkat keberhasilan menghasilkan bibit yang berhasil diaklimatisasi mencapai sekitar 20-40 % bergantung kultivar yang digunakan (Sisunandar et al., 2010b). Pada penelitian tersebut digunakan 10 kultivar kelapa dalam dan 10 kultivar kelapa genjah asli Indonesia. Berdasarkan penelitian tersebut, kultivar kelapa digolongkan menjadi 3 kelompok, yaitu mudah, sedang dan sukar berdasarkan tingkat keberhasilan perkecambahan sesudah kriopreservasi dan aklimatisasi (Sisunandar et al., 2010b).
Teknik dehidrasi dengan menggunakan larutan 3,2 M glukosa dan ditempatkan dalam laminar air flow (LAF) selama 24 jam juga telah digunakan untuk mengeringkan embrio kelapa sebelum disimpan dalam nitrogen cair. Teknik tersebut mampu menghasilkan embrio yang berhasil berkecambah setelah penyimpanan di dalam nitrogen cair dengan tingkat keberhasilan mencapai 82,75 % (N’Nan, 2012). Namun demikian persentase bibit hasil aklimatisasi dan bibit siap tanam yang dihasilkan dari embrio yang telah disimpan di dalam nitrogen cair juga belum dilaporkan.
Dari hasil penelitian yang telah dilaporkan tersebut menunjukkan bahwa meskipun tingkat keberhasilan kriopreservasi pada embrio kelapa masih relatif rendah, namun teknik tersebut memberikan harapan untuk digunakan sebagai
back-up konservasi plasma nutfah kelapa. Salah satu daerah dengan potensi
plasma nutfah kelapa yang cukup tinggi, namun belum diteliti dengan baik adalah Kabupaten Banyumas. Kultivar-kultivar kelapa yang ditemukan di Kabupaten Banyumas belum dikenal dan dilestarikan dengan baik. Oleh karena itu pada penelitian ini dilaporkan upaya penyimpanan plasma nutfah kelapa yang ditemukan di Kabupaten Banyumas melalui teknik kriopreservasi.