GAMBARAN RESPON KEBAL TERHADAP INFECTIOUS BURSAL DISEASE (IBD) PADA AYAM PEDAGING YANG DIVAKSIN IBD KILLED SETENGAH DOSIS DAN DITANTANG DENGAN VIRUS IBD
CHARLES JONSON SIREGAR
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2009
ABSTRACT
CHARLES JONSON SIREGAR. The Immune Response of Broiler Against Infectious Bursal Disease (IBD) after Giving a Half Dose of IBD Killed Vaccine and Challenging with infective IBD Virus. Under the supervision of SRI MURTINI dan RETNO D. SOEJOEDONO.
The objective of the research was to study immune respons of broiler which was vaccinated using a half dose of IBD killed vaccine and challenged with IBD virus. Two hundred of day old chicks (DOC) strain Cobb are divided into two groups, each group consist of 100 chicken. Group 1 was vaccinated using IBD killed vaccine and group 2 unvaccinated. Vaccination was done on day 4th. Group 1 are divided into two group, each group consist of 50 chicken. Group K1 was challenged with IBD virus on day 14th, group K3 non challenged. Group 2 are divided into two group, each group consist of 50 chicken. Group K2 was challenged with IBD virus, group K4 non challenged. Blood sample were taken On day 14th, 21th, 28th and 42th. The antibody titer were measured by enzyme linked immunosorbent assay (ELISA). The result showed that the vaccined groups not be able to produced protective antibody against IBD viral infection.
RINGKASAN
CHARLES JONSON SIREGAR. Gambaran Respon Kebal Terhadap Infectious Bursal Disease (IBD) Pada Ayam Pedaging Yang Divaksin IBD Killed Setengah Dosis Dan Ditantang Dengan Virus IBD. Dibimbing oleh SRI MURTINI dan RETNO D. SOEJOEDONO.
Telah dilakukan penelitian yang bertujuan untuk mengetahui respon tanggap kebal ayam pedaging terhadap vaksinasi IBD killed setengah dosis yang ditantang dengan virus IBD pada umur 14 hari. Sebanyak 200 ekor ayam strain Cobb umur sehari dibagi menjadi 2 kelompok, masing-masing kelompok berjumlah 100 ekor yaitu kelompok ayam yang divaksin IBD killed dan kelompok yang tidak divaksinasi. Kelompok ayam yang divaksin dibagi menjadi 2 kelompok, masing-masing 50 ekor yaitu kelompok ayam yang diuji tantang (K1) dan kelompok yang tidak diuji tantang (K3). Kelompok ayam yang tidak divaksinasi juga dibagi menjadi 2 kelompok, masing-masing 50 ekor yaitu kelompok yang diuji tantang (K2) dan yang tidak diuji tantang (K4). Vaksinasi IBD killed dilakukan pada saat ayam berumur 4 hari , sebelum vaksinasi dilakukan pengambilan darah untuk mengukur titer antibodi asal induk terhadap IBD. Sampel darah berikutnya diambil pada hari ke- 14, 21, 28, 42 untuk diukur titer antibodi terhadap IBD dengan menggunakan uji enzyme linked immunosorbent assay (ELISA). Hasil penelitian menunjukkan bahwa vaksinasi dengan vaksin IBD killed setengah dosis tidak mampu melindungi ayam dari virus tantang yang ditandai dengan turunnya titer antibodi sampai pada titer tidak protektif pada seminggu setelah infeksi virus IBD.
GAMBARAN RESPON KEBAL TERHADAP INFECTIOUS BURSAL DISEASE (IBD) PADA AYAM PEDAGING YANG DIVAKSIN IBD KILLED SETENGAH DOSIS DAN DITANTANG DENGAN VIRUS IBD
CHARLES JONSON SIREGAR
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Kedokteran Hewan Pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN INSTITUT PERTANIAN BOGOR
BOGOR 2009
Judul Skripsi : Gambaran Respon Kebal Terhadap Infectious Bursal Disease (IBD) Pada Ayam Pedaging Yang Divaksin IBD Killed Setengah Dosis Dan Ditantang Dengan Virus IBD
Nama : Charles Jonson Siregar NRP : B04051652
Disetujui
Dr. drh. Sri Murtini, Msi Prof. Dr. drh. Retno D. Soejoedono, MS Pembimbing I Pembimbing II
Diketahui
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
Dr. Nastiti Kusumorini NIP. 19621205 1987 032 001
PRAKATA Bismillahirrohmannirrohim
Alhamdulillah, segala puji dan syukur penulis panjatkan kehadirat Allah SWT yang telah melimpahkan rahmat, nikmat dan karunia-Nya, sehingga penulis dapat menyelasikan penelitian dan penulisan skripsi ini. Shalawat dan salam selalu tercurah kepada Nabi Muhammad SAW beserta keluarga, sahabat dan ummatnya hingga akhir zaman.
Skripsi berjudul “Gambaran Respon Kebal Terhadap Infectious Bursal Disease (IBD) pada Ayam Pedaging yang Divaksin IBD Killed Setengah Dosis dan Ditantang Dengan Virus IBD” merupakan salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penulis menyadari skripsi ini tidak akan terselesaikan tanpa bantuan dan dukungan dari berbagai pihak. Pada kesempatan ini penulis menyampaikan penghargaan dan ucapan terima kasih yang sebesar-besarnya kepada :
1. Dr. drh. Sri Murtini, MSi dan Prof. Dr. drh. Retno D. Soejoedono, MS sebagai pembimbing skripsi yang telah banyak memberikan bimbingan, saran dan nasehat serta segala kemudahan yang diperoleh selama penelitian hingga penyelesaian skripsi. Selain itu, ucapan terima kasih juga untuk Dr. Drh. Nurhidayat, MS sebagai pembimbing akademik serta seluruh dosen dan staf yang telah memberikan ilmunya selama ini.
2. Keluarga tercinta, Bapak, Ibu serta Adikku yang terus mendoakan dan mendukung selama ini.
3. Rekan-rekan seperjuangan penelitian (Deva, Acil, Shinta, Lia, Faradilla, Atun Jegek), Andi Yekti Tua, Mizwar, Muning Cirebon, Ikhsan, A. Syifa, Rezi, Jayanti, Cude, Nidji, Hage, seluruh Goblet’42 dan Citra Rafika S.pd atas segala doa, motivasi, suka duka dan kekeluargaan selama ini.
4. Rekan-rekan seperjuangan di Pondok Assalam yang telah bersama-sama tinggal satu atap dan berbagi selama ini.
5. Semua pihak yang telah banyak membantu dalam pelaksanaan penelitian dan penyusunan skripsi yang tidak dapat penulis sebutkan satu per satu semoga amal ibadahnya diterima Allah SWT, Amin.
Penulis menyadari masih banyak kekurangan dalam penulisan skripsi ini. Saran dan kritik membangun sangat penulis harapkan. Semoga skripsi ini dapat bermanfaat bagi kita semua. Amin.
Bogor, September 2009 Penulis
RIWAYAT HIDUP
Penulis dilahirkan di Bengkulu, pada tanggal 16 April 1987 dari ayah Ali Hidir Siregar dan Ibu Irmawati. Penulis merupakan anak pertama dari dua bersaudara.
Penulis melewati pendidikan sekolah dasar (SD) di SDN 60 Kotapadang dan lulus tahun 1999. Tahun yang sama penulis melanjutkan ke sekolah lanjutan tingkat pertama (SLTP) di SLTP Negeri 1 Kotapadang, lulus tahun 2002 dan melanjutkan ke sekolah menengah umum (SMU) di SMU Negeri 4 Curup dan lulus tahun 2005 dan pada tahun yang sama penulis kemudian terdaftar sebagai mahasiswa Institut Pertanian Bogor (IPB) melalui jalur undangan seleksi masuk IPB (USMI). Penulis kemudian memilih program studi Kedokteran Hewan di Fakultas Kedoteran Hewan IPB.
Selama menjalankan perkuliahan, penulis aktif mengikuti organisasi intra kampus antara lain sebagai ketua ikatan mahasiswa kedokteran hewan Indonesia (IMAKAHI) Cabang FKH IPB periode 2008/2009, pengurus dewan keluarga musholla (DKM) An-Nahl dan himpunan minat profesi (Himpro) hewan kesayangan dan satwa aquatik (HKSA) periode 2006/2007. Organisasi ekstra kampus antara lain sebagai ketua Pokja FKH IPB dalam forum mahasiswa Indonesia tanggap flu burung (FMITFB) wilayah Jawa Bagian Barat periode 2008/2009.
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMSI
Dengan ini saya menyatakan bahwa skripsi Gambaran Respon Kebal Terhadap Infectious Bursal Disease (IBD) pada Ayam Pedaging yang Divaksin IBD Killed Setengah Dosis dan Ditantang Dengan Virus IBD adalah karya saya dengan arahan dari dosen pembimbing serta belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2009
Charles Jonson Siregar NIM. B04051652
DAFTAR ISI DAFTAR TABEL……….. i DAFTAR GAMBAR………. ii LAMPIRAN……….. iii PENDAHULUAN………. 1 Tujuan……….... 3 TINJAUAN PUSTAKA……… 4
Ayam Pedaging Dan Sistem Kekebalannya……….. 4
Infectious Bursal Disease (IBD)……… 8
Vaksin dan vaksinasi IBD... 12
BAHAN DAN METODE………. 16
Tempat dan Waktu Penelitian………... 16
Hewan Percobaan………. 16
Vaksin IBD………... 16
Virus Untuk Uji Tantang………... 16
Rancangan Percobaan……… 16
Uji ELISA………. 17
Pembacaan Hasil……… 18
Analisis Statistik……… 19
HASIL DAN PEMBAHASAN……… 20
KESIMPULAN……… 25
DAFTAR PUSTAKA………... 26
LAMPIRAN………. 29
DAFTAR TABEL
1 Rancangan Percobaan... 17 2 Interpretasi Hasil Uji ELISA... 19 3 Rataan titer antibodi terhadap IBD pada masing-masing
DAFTAR GAMBAR
1 Bursa Fabricius pada ayam... 7 2 Bursa Fabricius membengkak akibat infeksi akut virus IBD…... 12 3 Bursa Fabricius mengalami atrofi akibat infeksi kronis virus IBD... 12 4 Rataan titer antibodi per kelompok perlakuan... 21
LAMPIRAN
I Hasil analisis data dengan menggunakan uji ANOVA dan
dilanjutkan dengan uji Duncan... 29
PENDAHULUAN Latar Belakang
Usaha dan pengembangan peternakan saat ini menunjukkan prospek yang sangat cerah dan mempunyai peranan penting dalam pertumbuhan ekonomi pertanian. Sebagian besar masyarakat dunia mengakui bahwa produk-produk peternakan memegang peranan sangat penting dimasa yang akan datang. Beberapa faktor pendukung dunia peternakan sehingga berkelanjutan dan menjanjikan peluang bisnis adalah kebutuhan pangan yang meningkat sejalan dengan percepatan pertumbuhan populasi manusia. Kebutuhan akan bahan pangan khususnya yang berasal dari daging , telur, dan susu dari tahun ke tahun selalu meningkat, sejalan dengan meningkatnya tingkat pendidikan dan kesadaran masyarakat akan peranan zat-zat makanan khususnya protein bagi kehidupan (Dirjen Bina Produksi Peternakan 2005).
Salah satu bidang peternakan di Indonesia yang terus menunjukkan peningkatan setiap tahunnya adalah peternakan ayam pedaging (broiler). Faktor penyebab peningkatan ini adalah kemampuan tumbuh ayam pedaging (broiler) yang cepat sehingga dapat dipanen dalam waktu sekitar 30-40 hari, nilai ekonomis bibit, mempunyai nilai gizi yang berkualitas, sumber protein dan energi serta produknya disukai dan dapat diterima oleh konsumen (Susilorini et al. 2008, Amrullah 2003).
Kemajuan bidang peternakan ayam pedaging ini tentu disertai dengan berbagai kendala diantaranya adalah penyakit. Berbagai penyakit yang sering timbul antara lain adalah infectious bronchitis (IB), infectious bursal disease (IBD), Newcastle disease (ND), infectious coryza dan lain-lain. Diantara penyakit tersebut salah satu penyakit yang cukup ditakuti oleh para peternak ayam broiler adalah infectious bursal disease (IBD) atau yang lebih kita kenal dengan penyakit Gumboro (Gumboro disease).
Infectious bursal disease (IBD) merupakan penyakit virus akut yang sangat menular. Penyakit ini ditemukan hampir di setiap daerah peternakan ayam intensif di seluruh pelosok dunia. Penyakit IBD sangat penting dalam industri ayam pedaging karena dapat menyebabkan imunosupresi sehingga mengakibatkan
kerugian ekonomi yang cukup tinggi. Angka morbiditas penyakit IBD mencapai 100% sedangkan angka mortalitas mencapai 20 – 30 %. Penyakit IBD dapat menyebabkan banyak ayam yang diafkir pada saat pemotongan, rasio konversi pakan besar dan berat badan tidak mencapai target (McIlroy 1989 ; Mahanan 1992).
Virus IBD menginfeksi organ limfoid seperti bursa Fabricius, timus, serta limpa (Cheville 1967). Organ-organ tersebut merupakan organ penting dalam proses kekebalan. Kerusakan bursa Fabricius menyebabkan menurunnya kemampuan tubuh membentuk kekebalan sehingga ayam yang terserang virus IBD menjadi rentan terhadap penyakit lain, seperti Newcastle disease (ND), chronic respiratory disease (CRD), Colibacilosis dan sebagainya. Meskipun demikian, tubuh ayam masih mampu membentuk kekebalan terhadap IBD (Wiryawan 2002). Di samping itu, IBD juga akan menyebabkan respon yang suboptimal terhadap berbagai program vaksinasi, misalnya vaksinasi terhadap ND, IB dan penyakit Marek’s. Virus IBD tidak menular pada manusia dan tidak mempunyai arti penting pada kesehatan masyarakat.
Pencegahan dan pengendalian penyakit IBD yang paling efektif adalah dengan melaksanakan program vaksinasi secara teratur dan diperkuat oleh sistem manajemen yang benar baik sanitasi kandang, pemberian pakan maupun penggunaan desinfektan (Listyawati 2002). Saat ini berbagai jenis vaksin IBD komersial telah banyak beredar, baik vaksin live maupun killed. Vaksin live mempunyai patogenitas dan efek imunosupresi tergantung serotipe virus yang digunakan. Adapun vaksin killed biasanya dipakai untuk vaksinasi ulangan atau lanjutan untuk mendapatkan antibodi yang mempunyai titer tinggi dan bertahan lama. Vaksinasi IBD dapat dilakukan dengan pemberian beberapa kali vaksin live atau gabungan beberapa kali vaksin live dan vaksin killed (Tabbu 2000). Oleh karena itu, jenis vaksin, dosis, patogenitas dan keamanan virus vaksin yang digunakan dalam vaksinasi perlu diperhatikan.
Tujuan
Penelitian ini dilakukan dengan tujuan untuk melihat gambaran respon tanggap kebal ayam pedaging yang divaksinasi dengan vaksin IBD killed setengah dosis dan ditantang dengan virus IBD.
TINJAUAN PUSTAKA Ayam Pedaging dan Sistem Kekebalannya
Ayam pedaging adalah ayam yang sangat efektif untuk menghasilkan daging. Karakteristik ayam pedaging bersifat tenang, bentuk tubuh besar, pertumbuhan tubuh cepat, bulu merapat ke tubuh, kulit putih, dan produksi telur rendah. Beberapa bangsa ayam ras pedaging yang termasuk kedalam kelas yaitu ayam Sussex, Cornish, Orpington, Australop dan Dorking. Bangsa ayam Cornish, terutama White Cornish biasanya digunakan sebagai pejantan untuk pembentukan ayam ras pedaging. Sementara contoh strain dari ayam pedaging adalah Arbor Arces, Hubbard, Cobb, Lohman dan Hybro (Susilorini et al. 2008).
Di Indoneasia, terdapat lima galur broiler modern, yaitu Cobb, Lohman, Ross, Hubbard dan Hybro. Strain ayam pedaging modern terutama berasal dari jenis White Plymouth Rock dan White Cornish. Semua strain tersebut terus mengalami perbaikan mutu genetik dan semakin efisien. Diantaranya ada yang diformulasikan agar pertumbuhannya cenderung lebih cepat di awal pemeliharaan, tetapi ada juga yang dibuat tumbuh lambat di awal yang kemudian berakselerasi cepat, sehingga mencapai berat ideal di akhir masa pemeliharaan (Mulyantono dan Isman 2008). Berdasarkan cara pembuatan galur, material genetik setiap individu ayam indukan (parent stock / PS) dengan ayam komersial (final stock / FS) dan setiap galur adalah sama. Dengan demikian bila ayam peka terhadap infeksi virus tertentu maka ayam lainnya dalam galur yang sama juga berpeluang tinggi terinfeksi. Hal ini menyebabkan banyak ditemukannya kejadian kematian serempak dalam jumlah besar pada suatu peternakan ayam yang memelihara galur sama (Anonimus 2008).
Ayam pedaging strain Cobb merupakan salah satu strain broiler yang ada di Indonesia yang memiliki titik tekan pada perbaikan feed consumption rate (FCR), pengembangan genetik diarahkan pada pembentukan daging dada, mudah beradaptasi dengan lingkungan tropis (heat stress) serta produksinya yang efisien (bobot badan 1,8 – 2 kg; FCR 1,65). Saat ini bibit Cobb digunakan untuk produksi broiler di lebih dari 60 negara. Strain Hybro memilki fokus terhadap kekuatan dan daya hidup, menjaga keseimbangan antara sifat broiler dan breeder, performa
bagus pada iklim tropis, tahan terhadap kasus ascites dan fokus pengembangan genetik pada hasil maupun produk karkas. Strain Ross memilki keunggulan berupa FCR lebih efisien, laju pertumbuhan lebih cepat, daya hidup lebih bagus, fokus pengembangan genetik pada kekuatan kaki sebagai penyeimbang berat badan (Anonimus 2006).
Berbeda dengan ayam pedaging (broiler) beberapa tahun lalu, broiler modern telah mengalami perubahan genetik yang luar biasa. Umur panen dengan berat yang sama menjadi semakin pendek. Berat panen 1,6-1,7 kg, sekitar 5-10 tahun lalu baru diperoleh pada umur 35 hari, sekarang hanya 30-31 hari. Ayam broiler ini merupakan hasil persilangan galur murni unggul dan rekayasa genetik dengan karakter pertumbuhan cepat dan selektif, yakni daging dada yang lebih banyak, serta FCR rendah, sehingga sangat efisien dalam mengubah pakan menjadi daging. Namun, broiler modern lebih peka terhadap perubahan iklim, mudah stres, pertumbuhan bulu lambat dan memerlukan pemenuhan nutrisi yang benar-benar tepat, sehingga kualitas pakan yang benar-benar baik sangat dibutuhkan (Mulyantono dan Isman 2008).
Sistem kebal ayam seperti halnya ternak lain merupakan sistem yang sangat komplek. Sistem kekebalan dapatan tubuh unggas terdiri atas kekebalan humoral dan selular. Kekebalan humoral melibatkan antibodi spesifik terhadap antigen yang masuk. Pada ayam, ada dua organ tubuh yang berhubungan dengan sistem kebal, yakni bursa Fabricius dan timus. Bursa Fabricius sebagian besar berisi sel B yang berperan dalam memproduksi antibodi humoral atau yang bersirkulasi. Timus sebagian besar berisi sel T dengan fungsi mengenal dan menghancurkan sel yang terinfeksi bakteri atau virus, mengaktifkan makrofag dalam fagositosis dan membantu sel B dalam memproduksi antibodi. Pada masa embrio, kedua sistem ini diprogramkan untuk menghasilkan kekebalan aktif terhadap penyakit, artinya kekebalan yang didapat sebagai akibat pernah terinfeksi atau karena inokulasi dengan bahan-bahan penyebab penyakit yang telah diubah bentuknya (Junaidi 2007). Sel B yang dihasilkan oleh bursa Fabricius akan menghasilkan antibodi dan sel pengingat (sel memori). Dalam menanggapi adanya antigen, sel-sel plasma menghasilkan antibodi. Antibodi adalah suatu protein yang besar molekulnya dapat membantu menghancurkan dan
melumpuhkan patogen dengan jalan mengikat patogen tersebut dengan protein yang bersifat antigenik. Sel-sel plasma yang menghasilkan antibodi berasal dari sel B. Sel-sel memori akan mengingat dan mengenal antigen yang pernah masuk kedalam tubuh, sehingga sistem kekebalan unggas dapat bertindak cepat (Cheville 1967).
Permukaan dalam bursa Fabricius ayam terdiri dari lipatan longitudinal (plika) besar dan kecil. Lipatan yang besar mencapai keseluruhan dari panjang lumen bursa sedangkan lipatan yang kecil lebih pendek. Lipatan-lipatan ini terdiri dari folikel bursa dan dibawahnya terdapat matriks jaringan ikat. Lipatan epitel longitudinal dibentuk pada permukaan dalam kantung dan epitel kolumnar menutupi plika berproliferasi dan membentuk pertumbuhan ke arah luar dari pucuk epitel ke dalam lamina propria yang ada dibawahnya (Riddel 1996). Jumlah total lipatan mukosa pada bursa yang matang atau dewasa sekitar 10 – 15 (Cross 1987).
Unit dasar bursa Fabricius adalah folikel bursa. Folikel berkembang dari interaksi pertumbuhan epitel dan sel mesenkim. Setiap folikel matang terdiri dari medulla dan korteks. Pada pewarnaan Hematoksilin Eosin (HE) bagian korteks mengambil warna lebih kuat dibandingkan dengan medulla sama seperti kandungannya yang relative lebih banyak mengandung limfosit kecil. Pucuk epitel dipenuhi oleh sel-sel limfosit yang akhirnya membentuk bagian medulla dari folikel bursa. Tiap folikel dipenuhi oleh satu atau dua sel dan koloni tersebut melakukan proliferasi di dalam folikel. Jumlah total folikel pada bursa yang matang atau dewasa sekitar antara 8000-1200 buah. Korteks dan medulla dipisahkan oleh membran basal yang berhubungan dengan permukaan epitel. Permukaan medulla dari membran basal folikularis terdiri dari lapisan sel epitel squasmos atau kubus. Stroma jaringan epitel secara ekstensif terdapat dalam medulla. (Riddel 1996 dan Eerola et al.1987).
Menurut Tizard (1987), bursa Fabricius mempunyai fungsi sebagai tempat pendewasaan dan diferensiasi sel limfosit B, kemudian sel limfosit akan masuk ke sirkulasi dan berperan untuk menerima atau memberi reaksi terhadap benda asing yang masuk ke dalam tubuh. Sel T tidak memproduksi antibodi tetapi berfungsi dalam kekebalan berperantaraan sel. Limfosit T yang peka terhadap
antigen spesifik mampu menghilangkan sel-sel yang telah terinfeksi oleh virus. Sel T mempunyai fungsi mengatur aktifitas sel B dan sel T (Partadiredja 1991). Selain itu bursa Fabricius juga berfungsi sebagai organ limfoid sekunder yang bekerja menangkap antigen yang masuk ke dalam tubuh dan informasi akan dikirimkan ke sistem pembentuk antibodi yang akan menghasilkan antibodi khusus untuk menyingkirkan antigen tersebut.
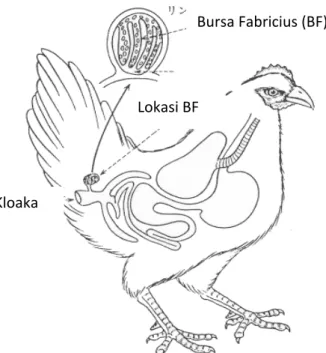
Bursa Fabricius pada Ayam
Bursa berkembang secara cepat pada ayam muda dan mencapai ukuran maksimum antara umur 4 dan 12 minggu. Pada kebanyakan ayam, regresi bursa dengan cepat setelah 20-24 minggu. Perkembangan cepat sering ditemukan pada awal 3-5 minggu dalam kehidupan ayam. Umumnya regresi dihubungkan dengan kematangan seksual. Mengecilnya bursa, karena jaringan ikat berperan lebih dominan, epitel melipat kedalam dan folikel limfoid digantikan oleh kista (Riddel 1987).
Bursa Fabricius (BF)
Kloaka
Gambar 1. Bursa Fabricius sebagai tempat perkembangan sel limfosit B (Sumber : http://teaching.path.cam.ac.uk/part IB pract/P05)
Lokasi BF
Infectious Bursal Disease (IBD)
Penyakit IBD pertama kali dilaporkan di Gumboro, Delaware, Amerika Serikat pada tahun 1962 oleh Cosgrove, oleh karena itu penyakit ini dikenal juga dengan nama Gumboro disease (Lukert dan Saif 1997). Kasus penyakit IBD di Indonesia pertama kali ditemukan pada tahun 1980 di sebuah peternakan ayam jantan di daerah Sawangan, Bogor (Partadireja dan Juniman 1985). Penyebaran penyakit ini telah meluas hampir di seluruh daerah di Indonesia dan bersifat endemik (Santhia 1996). Penyakit Gumboro sangat mudah menular. Suatu peternakan yang terkena wabah IBD akan sangat mudah menyebar ke peternakan lain, bahkan penularan berlanjut sampai generasi berikutnya pada peternakan yang sama. Terjadinya penularan ini dapat ditimbulkan karena kontak langsung antara ayam penderita dengan ayam sehat, litter yang tercemar virus Gumboro atau lewat makanan yang terkontaminasi. Serangga dapat juga berperan dalam penyebaran penyakit ini (Murtidjo 1992).
Penyakit IBD merupakan satu diantara penyakit unggas terpenting di USA, Eropa, dan di Asia khususnya di Indonesia. Penyakit ini menimbulkan kerugian berupa angka mortalitas tinggi, penurunan produksi daging, telur, peningkatan biaya manajemen serta bersifat imonusupresi, akibatnya ayam menjadi lebih peka terhadap berbagai jenis infeksi (Jackwood and Sommers 1999). Virus yang masuk kedalam bursa Fabricius akan bereplikasi secara besar-besaran, kemudian virion yang dihasilkan akan dilepaskan ke peredaran darah dan menyebabkan terjadinya viremia sekunder yang berakibat terdisposisinya virus pada berbagai organ lain seperti: timus, limpa dan paru-paru (Weiss dan Weiss l994). Terdisposisinya virus pada berbagai organ menyebabkan perubahan pada organ tersebut dan perubahan biasanya mulai terlihat setelah virus melisis sel sasarannya. Virus IBD bersifat sitolitik membuat perubahan yang teramati secara makroskopik adalah mengecilnya organ sasaran akibat lisisnya sel parenkim organ tersebut. Namun hal tersebut tidak bersifat permanen karena proses persembuhan yang disertai dengan regenerasi organ segera terjadi (Adi dan Berata 1998). Menurut Subekti (2000) infeksi IBD juga dapat diperparah oleh infeksi Escherichia coli, Aspergillus flavus dan Avian nephritis.
Infectious bursal disease (IBD) adalah penyakit yang disebabkan oleh virus golongan Birnaviridae, menyerang ayam muda , bersifat akut dan mudah menular. Virus tersebut tidak mempunyai envelope, berbentuk icosahedral dan mempunyai diameter 55-65 nm. Virus IBD sangat stabil pada berbagai kondisi fisik dan agen kimiawi. Virus IBD resisten terhadap eter dan kloroform, dapat tahan terhadap pelarut organik tetapi peka terhadap formalin dan kelompok iodofor. Virus tersebut dapat diinaktifasi dengan larutan 0,5 % kloramin selama 10 menit. Sehubungan dengan ketahanan virus IBD terhadap pengaruh lingkungan dan bahan kimiawi, maka virus tersebut dapat bertahan dalam kandang ayam maupun di lingkungan dalam periode yang lama walaupun telah dilakukan sanitasi maupun desinfeksi. Virus dapat diinaktifasi pada pH 12, tetapi tidak dipengaruhi oleh pH 2, masih tetap aktif pada temperatur 56 0 C selama lebih dari 5 jam. Virus ini akan tetap hidup pada suhu 600C selama 30 menit, tetapi akan mati pada suhu 700C selama 30 menit (Tabbu 2000).
Virus IBD merupakan virus RNA utas ganda, genomnya terbagi menjadi dua segmen. Genom A memiliki panjang 3129-3260 bp dan genom B dengan panjang 2795-2827 bp. Virion mengandung 5 macam protein yang dikenal VP2, VP3, VP4 dan VP5 (segmen A) dan VP1 (Segmen B). Protein VP2 merupakan antigen spesifik dan mengandung epitop yang dapat memicu pembentukan antibodi netralisasi dan tingkat virulensi. Gen VP2 ini dapat diekspresikan dalam berbagai sistem ekspresi yang berbeda (Lejal et al. 2000 ; Ming 2000). Virus penyebab Gumboro ini mempunyai kecenderungan untuk mengalami modifikasi genetik secara cepat sehingga muncul virus yang bersifat antigenik ataupun patogenik varian. Kasus Gumboro di Indonesia menurut pengamatan Balai Besar Penelitian Veteriner Bogor, dapat dihubungkan dengan virus Gumboro bentuk klasik yang mengalami modifikasi dalam patogenisitasnya, yang lazim disebut patogenik varian. Efek dari virus ini sangat mirip dengan virus Gumboro dari negara lain yang digolongkan sebagai very virulent IBDV (vvIBDV) (Listyawati 2002). Kasus infeksi virus Gumboro ganas (vvIBDV) asal lapangan yang menyerang ayam umur diatas 3 (tiga) minggu cenderung menampakkan gejala klinis yang sangat jelas, mulai dari adanya kelesuan dan ayam nampak menggigil, bulu berdiri dan cenderung bergerombol disertai adanya diare warna keputihan.
Akibat diare, ayam menjadi dehidrasi, nampak tremor dan sangat lemah sehingga berakhir dengan kematian (Wiryawan 2007). Adanya varian baru dari virus IBD menunjukkan perbedaan sekuen nukleotida pada genom penyandi protein VP2. Beberapa isolat bahkan ditemukan dalam keadaan baru sama sekali berbeda dengan isolat yang ada sebelumnya (Soejoedono et al. 1995 ; Ernawati dan Nidom 2001).
Jaringan limfoid merupakan target utama virus IBD dengan bursa Fabricius sebagai organ targetnya (Adi dan Huminto 2001). Virus IBD juga menyerang organ limpa, tonsil-sekum dan timus (Abdu et al. 1986). Lesio pada bursa Fabricius yang disebabkan oleh virus IBD merupakan diagnosa patognomonis atau spesifik (Lukert dan Saif 1997). Virus IBD juga menginfeksi makrofag, namun hal tersebut tidak berperan dalam terciptanya imunosupresi, tetapi cenderung merugikan tubuh (Van den Berg 2000).
Ayam yang terserang Gumboro akan memberikan reaksi yang suboptimal terhadap pengobatan dengan antibakterial ataupun antiparasit sehingga dosis harus ditingkatkan, demikian juga lama pengobatan perlu diperpanjang untuk mendapatkan hasil yang optimal. Keadaan tersebut mungkin dapat dihubungkan dengan penurunan populasi limfosit ataupun jumlah imunoglobulin yang diperlukan untuk membunuh bakteri atau parasit (Tabbu 2000).
Virus IBD hanya menimbulkan penyakit dan lesi tertentu pada ayam. Virus IBD asal lapangan dapat menimbulkan derajat patogenesitas yang berbeda pada berbagai jenis ayam dan semua ayam dapat terinfeksi oleh virus tersebut. Umur yang sangat sensitif terhadap virus tersebut adalah 3-6 minggu. Kejadian Gumboro dapat dibagi 2 bentuk yaitu : infeksi dini pada anak ayam umur 1-21 hari dan infeksi yang tertunda pada ayam yang berumur lebih dari 3 minggu. Jika virus Gumboro menyerang ayam yang berumur 1-21 hari biasanya akan timbul Gumboro bentuk subklinis yang mempunyai efek sangat imunosupresi (menekan kekebalan) dan menyebabkan kegagalan berbagai program vaksinasi. Efek immunosupresi yang ditimbulkan, diawali dengan adanya infeksi virus vvIBD yang secara langsung menginfeksi dan melakukan perbanyakan diri (replikasi) pada bursa Fabrisius dan timus sebagai organ target utamanya. Mekanisme terjadinya immunosupresi oleh karena infeksi virus Gumboro, kemungkinan besar
terkait dengan adanya kematian sel-sel penghasil limfosit B, terutama yang terdapat pada bursa Fabricius. Sel limfosit B merupakan salah satu calon pembentuk zat kebal tubuh. Adanya kerusakan sel-sel limfoid dari bursa Fabricius sebagai akibat infeksi virus penyebab Gumboro, mengakibatkan adanya penurunan jumlah produksi sel B oleh bursa Fabricius, yang selanjutnya akan berakibat pada terjadinya penurunan reaksi pembentukan zat kebal tubuh dari perlakuan vaksinasi yang diberikan pada tahap selanjutnya. Adanya kerusakan folikel bursa Fabricius, menyebabkan kemampuan organ tersebut dalam menghasilkan zat kebal tubuh untuk melawan infeksi yang disebabkan oleh mikroorganisme patogen lainnya menjadi kurang optimal, sehingga ayam menjadi peka dan mudah terserang berbagai macam penyakit (Wiryawan 2007).
Okeye dan Uzoukwu (1991) menyatakan bahwa infeksi oleh virus IBD akan meningkatkan kepekaan ayam terhadap infeksi E. coli. Infeksi campuran antara IBD dan E.coli makin merangsang penurunan jumlah sel limfosit dalam bursa Fabricius maupun kelenjar timus. Pada kondisi lapangan, penyakit IBD subklinis ini lebih sulit dideteksi. Penyakit Gumboro yang bersifat klinis menyebabkan kematian yang lebih tinggi, sulit dikontrol dan menyebabkan kerugian ekonomi yang besar. Penyakit IBD bentuk klinis juga dapat dicirikan dengan adanya perdarahan berupa titik-titik atau garis-garis pada otot paha bagian tengah lateral abdomen. Suatu kenyataan di lapangan yang menyimpang dari teori di atas adalah sejumlah kasus IBD bentuk klinis yang ditemukan pada umur sekitar 14-18 hari, bahkan kurang dari 2 minggu dengan kerusakan bursa Fabricius yang parah dan sejumlah gejala tertentu. Hal ini sulit diterangkan, namun beberapa ahli berpendapat bahwa infeksi dini tersebut mungkin berhubungan dengan tingkat keganasan virus IBD yang sangat tinggi (Tabbu 2000).
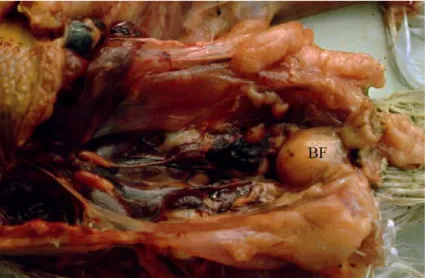
Gambar 2. Bursa Fabricius membengkak akibat infeksi akut virus IBD
BF: bursa Fabricius
Gambar 3. Bursa Fabricius mengalami atrofi akibat infeksi kronis virus IBD (Sumber : http://www.fmv.utl.pt/atlas/orglinfo/orglinfo_001.htm)
Vaksin dan Vaksinasi IBD
Vaksin merupakan mikroorganisme bibit penyakit yang telah dilemahkan virulensinya atau dimatikan dan bila diberikan pada ternak tidak menimbulkan penyakit melainkan dapat merangsang pembentukan zat kebal yang sesuai dengan jenis vaksinnya. Vaksinasi merupakan tindakan memasukkan vaksin ke dalam tubuh ternak dan merupakan suatu usaha dengan tujuan melindungi ternak terhadap serangan penyakit tertentu (Junaidi 2007). Lebih lanjut dipaparkannya bahwa vaksinasi yang dilakukan peternak dengan cara tetes mata, tetes hidung, air minum dan spray akan merangsang tubuh ayam untuk membentuk kekebalan lokal, sedangkan pelaksanaan vaksinasi dengan injeksi atau suntikan akan
Bursa atrofi Bursa normal
merangsang pembentukan kekebalan humoral atau menyeluruh. Pada anak ayam, aplikasi vaksinasi biasanya dengan cara tetes mata atau tetes hidung, dan kadang-kadang pemberiannya melalui suntikan bila jenis vaksinnya killed. Vaksinasi melalui air minum tidak bisa dilakukan, karena anak ayam umur 1-4 hari minumnya masih sedikit dan tidak teratur. Pada ayam dewasa, aplikasi vaksinasi biasanya dengan tetes mata, tetes hidung, air minum dan suntikan (Junaidi 2007).
Pemberian vaksin pada anak ayam merupakan cara yang efektif untuk pengendalian IBD. Pendapat lain menjelaskan bahwa pemberian vaksinansi pada induk ayam dapat memberi kekebalan pada keturunannya, antibodi tersebut dapat melindungi anak ayam dari efek imunosupresi lebih awal. Terdapat dua tipe vaksin untuk unggas, yaitu vaksin live (antigen dalam vaksin masih hidup tetapi dilemahkan) dan vaksin killed (antigen dalam vaksin mati). Vaksin IBD live merupakan vaksin yang banyak dipergunakan karena dapat diberikan pada ayam dengan cara praktis. Aplikasi biasanya melalui air minum atau dengan cara spray, meskipun cara tetes mata dan injeksi masih dilakukan. Adapun vaksin killed diaplikasikan menggunakan adjuvan, baik minyak mineral dan aluminium hidroksida yang ditujukan untuk mengoptimalkan respon imun terhadap antigen (Nurvidia 2008). Penggunaan vaksin IBD live pada induk ayam akan melindungi anak ayam selama 1-3 minggu. Masalah utama vaksinasi IBD pada anak ayam yang memiliki antibodi asal induk adalah waktu vaksinasi harus tepat karena titer antibodi asal induk bervariasi, rute vaksinasi dan virulensi virus vaksin. Sebaliknya, pemberian vaksin Gumboro killed pada induk akan memberikan kekebalan yang lebih lama yaitu selama 4-5 minggu (Lukert dan Saif 1997).
Vaksinasi awal pada parent stock dan calon ayam petelur dengan vaksin IBD live perlu dilakukan sebelum pemberian vaksin killed. Vaksinasi ini diharapkan dapat meningkatkan sejumlah antibodi pada DOC yang dapat melindungi anak ayam dari infeksi awal virus IBD yang bersifat imunosupresi (Listyawati 2002).
Pada bagian lain, Listyawati (2002) menyatakan, pengendalian Gumboro pada ayam dapat dilakukan dengan pengamanan biologis ketat dan pelaksanaan berbagai aspek manajemen secara optimal untuk menghilangkan sumber infeksi, termasuk vaksinasi pada tingkat breeder maupun komersial. Seiring dengan
berkembangnya vvIBDV (very virulent Infectious Bursal Disease Virus) beberapa perubahan pada vaksinasi IBD secara konvensional sangat diperlukan. Perlu diingat bahwa kualitas vaksin ditentukan oleh cara pembuatan vaksin, distribusi dan penyimpanan vaksin, kemampuan vaksin menggertak kekebalan ayam dan masa kadaluarsa vaksin. Selain dari masalah kualitas vaksin, yang harus diperhatikan peternak adalah cara pemberian vaksin atau metode vaksinasi akan sangat mempengaruhi hasil vaksinasi. Selain itu faktor lain yang memegang andil keberhasilan vaksinasi adalah keterampilan vaksinator yang terlatih, peralatan vaksinasi beserta sarana maupun prasarana peternakan ayam yang mendukung, dan status kesehatan ayam sewaktu pelaksanaan vaksinasi. Semua parameter tersebut di atas memegang kunci penting dalam penanggulangan penyakit Gumboro ( Nurvidia 2009).
Vaksinasi dapat dilakukan dengan pemberian beberapa kali vaksin IBD live dan vaksin killed. Berdasarkan virulensi dan struktur antigenik virus dikenal beberapa jenis vaksin IBD live yang beredar di pasaran yaitu tergolong tidak virulen (mild), virulen (intermediate) dan sangat virulen (hot) (Listyawati 2002).
Pada kondisi lingkungan yang terkontaminasi, virus IBD yang sangat sulit diinaktifasi dapat dikontrol dengan melakukan program vaksinasi. Namun demikian beberapa vaksin live dilaporkan memiliki efek samping berupa pembengkakan bursa Fabricius yang diikuti kematian ayam akibat mengalami imunosupresi (Alan et al. 2002). Penggunaan vaksin live juga memiliki kelemahan lain, yaitu adanya reaksi pasca vaksinasi dan dapat menimbulkan varian baru. Perkembangan teknologi rekombinan DNA , memungkinkan pemecahan masalah tersebut dengan penyediaan protein rekombinan yang bersifat imunogenik dan spesifik dalam jumlah yang besar untuk pembuatan vaksin (Alan et al. 2002).
Program vaksinasi yang bersifat universal tidak dapat dianjurkan oleh karena adanya variasi titer antibodi asal induk, praktek manajemen dan kondisi operasional. Jika titer antibodi asal induk sangat tinggi dan tantangan virus IBD lapangan sudah menurun, maka vaksinasi pada ayam pedaging tidak diperlukan lagi. Vaksinasi dengan virus live yang dilemahkan dapat dilakukan pada hari ke-7 sampai minggu ke-2 atau ke-3. Jika antibodi asal induk rendah dan atau virulensi
virus lapangan sangat tinggi misalnya vvIBD, maka vaksinasi IBD sebaiknya dilakukan seawal mungkin. Jika kondisi DOC memungkinkan, dapat dilakukan pada umur sehari. Hal ini bertujuan untuk menjaga agar bursa Fabricius tidak dirusak oleh virus lapangan sehingga virus vaksin dapat berfungsi dengan baik. Vaksinasi IBD pada anak ayam umur sehari hendaklah menggunakan virus IBD galur tidak virulen (mild) dan dapat dilakukan secara suntikan, bersama dengan vaksin lain (Tabbu 2000).
Penyakit IBD menyebabkan kerugian ekonomi yang cukup besar pada industri perunggasan, terutama jika penyakitnya berbentuk subklinis (McIlroy 1989). Vaksinasi dapat meningkatkan pendapatan dan rata-rata berat badan, serta menurunkan mortilitas (McIlroy 1992). Vaksinasi harus dilakukan secara teratur agar dapat menurunkan jumlah virus di lapangan (Mahanan 1992). Kontak dengan virus IBD asal lapangan atau vaksinasi dengan vaksin IBD killed atau vaksin live dapat merangsang respon antibodi yang bersifat aktif. Pembentukan antibodi asal induk yang tinggi, dapat dirangsang dengan menggunakan vaksin IBD killed dalam emulsi minyak pada induknya. Penggunaan ini dapat merangsang pembentukan antibodi asal induk yang dapat memberi perlindungan pada anak ayam selama 4-5 minggu. Sebaliknya ayam yang berasal dari induk dan divaksinasi vaksin live maka hanya mendapat perlindungan selama 1-3 minggu. Meskipun demikian, jika virus IBD mempunyai patogenesitas yang sangat tinggi maka antibodi asal induk hanya memberikan perlindungan dalam waktu yang singkat.
Vaksin killed dalam pelarut minyak biasanya dipakai vaksinasi ulang ataupun lanjutan untuk mendapatkan antibodi yang mempunyai titer tinggi dan bertahan lama. Vaksin killed ini banyak digunakan pada parent stock dan ayam petelur komersial. Vaksin killed tidak praktis jika digunakan untuk merangsang respon yang bersifat primer pada ayam muda. Jenis vaksin tersebut paling efektif jika diberikan pada ayam yang telah digertak dengan virus IBD live yang berasal dari vaksin atau telah kontak dengan virus lapangan (Tabbu 2000). Penggunaan vaksin IBD yang tidak tepat pada anak ayam dapat merusak sel limfoid bursa Fabricius meskipun ayam kebal terhadap virus IBD, ayam tidak mempunyai kekebalan terhadap infeksi penyakit lain (Parede et al. 1994).
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di kandang hewan percobaan FKH IPB dan di unit pelayanan terpadu, bagian Mikrobiologi Medis, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, FKH IPB. Penelitian ini berlangsung mulai bulan April 2008 sampai Mei 2009.
Hewan Percobaan
Ayam pedaging strain Cobb umur satu hari (DOC) sebanyak 200 ekor digunakan untuk penelitian ini. Semua ayam dipelihara dalam kandang dan diberi pakan komersial dan air minum ad libitum.
Alat dan Bahan
Alat yang digunakan yaitu spoit volume 1 ml dan 3 ml, tray, mikropipet 10-100 µl, microplate U, inkubator, refrigerator, dan mesin ELISA (ELISA reader). Adapun bahan yang digunakan dalam penelitian ini adalah vaksin IBD killed setengah dosis, Virus IBD, serum darah ayam, kontrol negatif dan positif IBD, washing solution, konjugat, subsrat solution, stopping solution dan ELISA kit CIVTEST AVI IBD.
Vaksin IBD
Vaksin IBD yang digunakan dalam penelitian ini adalah vaksin IBD inaktif setengah dosis (0,25 ml) rute subcutan.
Virus untuk Uji Tantang
Virus IBD yang digunakan sebagai antigen untuk uji tantang adalah virus IBD isolat lokal strain hot dengan dosis 106 TCID50 per ekor ayam melalui tetes mulut.
Rancangan Percobaan
Sebanyak 200 ekor ayam strain Cobb umur sehari dibagi menjadi 2 kelompok, masing-masing kelompok berjumlah 100 ekor yaitu kelompok ayam yang divaksin IBD killed setengah dosis dan kelompok yang tidak divaksinasi. Kelompok ayam yang divaksin dibagi menjadi 2 kelompok, masing-masing 50
ekor yaitu kelompok ayam yang diuji tantang pada umur 14 hari (K1) dan kelompok yang tidak diuji tantang (K3). Kelompok ayam yang tidak divaksinasi juga dibagi menjadi 2 kelompok, masing-masing 50 ekor yaitu kelompok yang diuji tantang (K2) dan yang tidak diuji tantang (K4). Vaksinasi IBD killed dilakukan pada saat ayam berumur 4 hari , sebelum vaksinasi dilakukan pengambilan darah untuk mengukur titer antibodi asal induk terhadap IBD. Sampel darah berikutnya diambil pada hari ke- 14, 21, 28, 42 untuk diukur titer antibodi terhadap IBD dengan menggunakan uji ELISA. Rancangan percobaan ini dapat dilihat pada Tabel berikut :
Tabel 1 Rancangan Percobaan
Kelompok Perlakuan (hari ke-)
4 14 21 28 42 K1 Vaksinasi IBD Uji tantang Pengambilan serum darah Pengambilan serum darah Pengambilan serum darah K2 Tidak divaksinasi IBD Uji tantang Pengambilan serum darah Pengambilan serum darah Pengambilan serum darah K3 Vaksinasi IBD Tidak uji tantang Pengambilan serum darah Pengambilan serum darah Pengambilan serum darah K4 Tidak divaksinasi IBD Tidak uji tantang Pengambilan serum darah Pengambilan serum darah Pengambilan serum darah
Uji ELISA (Enzyme - Linked Immunoassay)
Uji ELISA dilakukan untuk mengukur titer antibodi terhadap IBD. Tahap-tahap prosedur uji ELISA adalah sebagai berikut :
a. Microplate diisi dengan 50 µl kontrol positif dan negatif serta larutan sampel sesuai dengan pola yang telah dirancang.
b. Microplate yang telah berisi sampel diinkubasi selama 30 menit pada suhu 37 0C
c. Setelah inkubasi, plate dicuci dengan menggunakan washing solution 300 µl/sumur, diulang sebanyak 3 kali lalu dikeringkan.
d. Ditambah 50 µl conjugate solution pada masing-masing sumur dan diinkubasi selama 30 menit pada suhu 37 0C
e. Dilakukan pencucian seperti pada tahapan c.
f. Ditambahkan 50 µl substrate solution pada masing-masing sumur dan diinkubasi selama 30 menit pada suhu 37 0C dengan kondisi gelap, biarkan terjadi perubahan warna dari kromogennya.
g. Setelah inkubasi, tutup plate kembali dibuka dan ditambah 50 µl stop solution, larutan dicampur dengan menggoyangkan plate pelan-pelan. h. Terakhir, permukaan plate dibersihkan dengan menggunakan tissue dan
selanjutnya hasil dibaca secepatnya pada ELISA reader dengan panjang gelombang 405 nm.
Pembacaan Hasil • Kesahihan Uji
Uji dapat dikatakan sahih jika rataan dari optical density (OD) positif kontrol lebih dari 0.6 dan ratio (rataan OD405 positif kontrol / rataan OD405 negatif kontrol) adalah lebih dari 4.
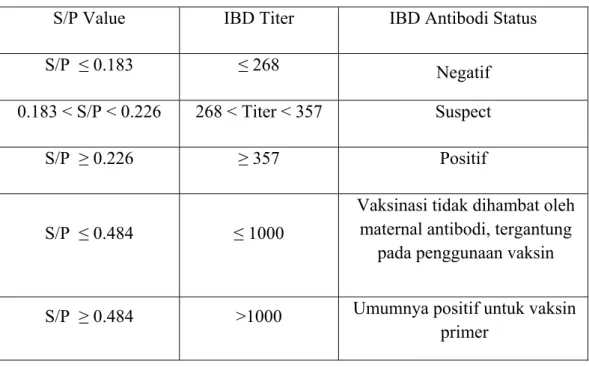
• Interpretasi Hasil
Perhitungan sample value related to positiv value (S/P) menurut Laboratoire Service International (LSI) dapat dihitung dengan formula sebagai berikut :
S/P = Sampel OD405 – Rataan OD405 Negatif Kontrol Rataan OD405 Kontrol Positif – Rataan OD405 Negatif Kontrol Kalkulasi titer : Log10 titer = 1.35 x Log 10 S/P + 3.425
Titer = antilog (Log 10 titer)
Tabel 2 Interpretasi Hasil Uji ELISA
S/P Value IBD Titer IBD Antibodi Status
S/P ≤ 0.183 ≤ 268 Negatif
0.183 < S/P < 0.226 268 < Titer < 357 Suspect
S/P ≥ 0.226 ≥ 357 Positif
S/P ≤ 0.484 ≤ 1000
Vaksinasi tidak dihambat oleh maternal antibodi, tergantung
pada penggunaan vaksin
S/P ≥ 0.484 >1000 Umumnya positif untuk vaksin primer
Analisis Statistik
Data yang diperoleh dari penelitian ini dianalisis dengan menggunakan uji ANOVA dan dilanjutkan dengan uji Duncan.
HASIL DAN PEMBAHASAN
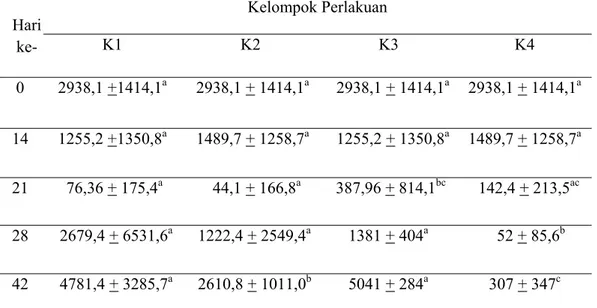
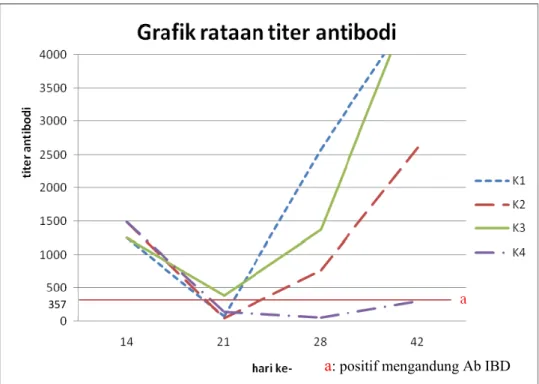
Hasil pemeriksaan terhadap titer antibodi pada perlakuan masing-masing kelompok serta perbandingannya dapat dilihat pada Tabel 3 dan Gambar 4. Berdasarkan data tersebut menunjukkan bahwa rataan titer antibodi asal induk terhadap IBD pada ayam umur 1 hari (hari ke 0 vaksin) adalah 2938,16 +1414,11. Anak ayam memperoleh antibodi IgG dari kuning telur. Imunoglobulin ini dapat diturunkan dari serum induk ayam ke dalam kuning telur ketika telur masih berada dalam ovarium. Di dalam fase cair kuning telur, IgG ditemukan memiliki titer yang sama dengan yang ada dalam serum induk. Selain itu, sementara telur melewati saluran telur, IgM dan IgA yang disekresi oleh saluran telur bergabung ke dalam albumin. Selama embrio ayam berkembang, IgG dari kuning telur diserap yang kemudian ditemukan dalam sirkulasi. Waktu paruh (half life) antibodi asal induk terhadap IBD yaitu 3-6 hari, sehingga titer antibodi asal induk kemudian akan mengalami penurunan hingga mencapai titik rendah (sifatnya non protektif). Oleh karena itu perlu dilakukan vaksinasi untuk meningkatkan titer antibodi melalui induksi kekebalan aktif tubuh (Lukert dan Saif 1997).
Tabel 3 Rataan titer antibodi terhadap IBD pada masing-masing kelompok perlakuan Hari ke- Kelompok Perlakuan K1 K2 K3 K4 0 2938,1 +1414,1a 2938,1 + 1414,1a 2938,1 + 1414,1a 2938,1 + 1414,1a 14 1255,2 +1350,8a 1489,7 + 1258,7a 1255,2 + 1350,8a 1489,7 + 1258,7a 21 76,36 + 175,4a 44,1 + 166,8a 387,96 + 814,1bc 142,4 + 213,5ac 28 2679,4 + 6531,6a 1222,4 + 2549,4a 1381 + 404a 52 + 85,6b 42 4781,4 + 3285,7a 2610,8 + 1011,0b 5041 + 284a 307 + 347c Keterangan : Huruf yang sama pada baris yang sama menunjukkan perbedaan yang tidak nyata (P > 0,05).
Gambar 4 Rataan titer antibodi per kelompok perlakuan
Berdasarkan penelitian ini tampak rataan titer antibodi terhadap IBD pada hari ke 14 setelah vaksinasi pada kelompok K1 tidak berbeda nyata (P > 0,05) dibandingkan kelompok K2, dan K4 serta nilai titernya sama dengan K3. Hal ini menunjukkan bahwa belum ada peningkatan titer antibodi setelah vaksinasi dan antibodi asal induk masih cukup tinggi. Ayam yang mempunyai titer antibodi asal induk yang tinggi akan mampu mencegah infeksi dini virus IBD, tetapi tidak akan memberi respon terhadap vaksinasi karena antibodi asal induk menetralisir virus vaksin. Hal ini berarti bahwa vaksin killed tidak praktis jika digunakan untuk merangsang respon kebal yang bersifat primer.
Pada hari ke 21 setelah vaksinasi (1 minggu setelah ditantang dengan virus IBD) yang merupakan titik rawan terjadinya kasus Gumboro pada ayam broiler, rataan titer antibodi kelompok K1 tidak berbeda nyata (P > 0,05) dibandingkan kelompok K2. Kemungkinan hal ini disebabkan adanya proses netralisasi virus tantang oleh antibodi yang dihasilkan dari vaksinasi. Hasil ini dibuktikan dari kelompok 3 (K3) yang divaksin tapi tidak ditantang memiliki titer antibodi yang berbeda nyata (P < 0,05) dibandingkan K1 pada hari ke 21 setelah vaksinasi. Netralisasi virus akan terjadi jika ada pengikatan antara antibodi dan virus, sehingga mencegah virus mencapai sel target dengan cara mencegah interaksi dari
a: positif mengandung Ab IBD 357
ikatan permukaan virus dengan sel reseptor atau menghalangi internalisasi atau pelepasan secara intraseluler. Antibodi yang menetralisasi dapat membatasi infeksi virus awal serta dapat juga menjadi penting untuk eliminasi dari infeksi yang sudah ada (Monath 1999). Dengan menetralisasi virus yang masuk ke dalam tubuh maka jumlah antibodi yang bersirkulasi dalam darah menurun. Hal ini yang terjadi pada kelompok 1 (K1), yang memiliki titer antibodi lebih rendah dibandingkan K3 yang tidak mendapat uji tantang. Pada kelompok K3 terjadi penurunan rataan titer antibodi yang merupakan penurunan dari antibodi asal induk. Hal ini menunjukkan bahwa antibodi asal induk hanya bisa memberikan perlindungan terhadap infeksi virus IBD selama 1-3 minggu. Lamanya perlindungan oleh antibodi asal induk erat hubungannya dengan virulensi virus IBD asal lapangan, waktu kontak dengan virus IBD dan kondisi DOC (Tabbu 2000).
Gambaran patologi anatomi dan gejala klinis dari masing-masing kelompok pada hari ke 21 (1 minggu setelah uji tantang) menunjukkan bahwa pada kelompok 2 (K2) memperlihatkan perubahan klinik akibat infeksi IBD berupa lesu, tremor dan bulu kusam serta hasil pemeriksaan bedah bangkai yang memperlihatkan bursa Fabricius mengalami nekrose dan perdarahan. Data ini membuktikan bahwa virus yang digunakan untuk uji tantang memiliki virulensi yang tinggi. Pada kelompok K1 hasil pemeriksaan bursa memperlihatkan adanya ptechi dan kebengkakan. Hal ini menunjukkan bahwa vaksinasi yang dilakukan tidak mampu menahan virulensi virus uji tantang. Selain itu, titer antibodi terhadap IBD juga tidak memperlihatkan adanya peningkatan kekebalan (antibodi yang dihasilkan tidak protektif) dan menyebabkan terjadi penekanan respon kebal terhadap penyakit lain seperti ND, IB dan lain sebagainya. Hal ini sesuai dengan penelitian Puspitasari (2009) yang menunjukkan bahwa pada hari ke 21 setelah vaksinasi IBD killed setengah dosis, terjadi penurunan titer antibodi terhadap ND akibat ketidakmampuan vaksin dalam menahan efek imunosupresi dari infeksi dini virus IBD yang ditantang pada hari ke 14.
Titer antibodi pada hari ke 28 setelah vaksinasi (2 minggu setelah ditantang dengan virus IBD) pada kelompok K1 tidak berbeda nyata (P > 0,05) dibandingkan kelompok K2 maupun dengan kelompok K3, namun berbeda nyata
(P < 0,05) terhadap K4. Penelitian ini sesuai dengan pernyataan Tabbu (2000) bahwa kontak dengan virus IBD atau dengan vaksin IBD killed dapat merangsang respon antibodi yang tinggi.
Rataan titer antibodi pada hari 42 setelah vaksinasi (4 minggu setelah ditantang dengan virus IBD) pada kelompok K1 berbeda nyata (P < 0,05) dibandingkan kelompok K2 dan K4 namun tidak berbeda nyata (P > 0,05) dibandingkan kelompok K3. Hal ini menunjukkan bahwa ayam yang divaksinasi dengan vaksin IBD killed setengah dosis mampu menginduksi titer antibodi berbeda nyata terhadap IBD meskipun ditantang dengan virus tersebut. Namun peningkatan titer antibodi hasil vaksinasi pada hari ke 28 dan 42 ini dinilai kurang efektif mengingat ayam pedaging telah dipanen pada umur 30-40 hari (Amrullah 2003). Selain itu, penggunaan vaksin IBD killed dalam emulsi minyak ternyata merangsang pembentukan antibodi asal induk yang lebih tinggi dan dalam jangka waktu yang lebih lama. Penggunaan adjuvan dalam vaksin killed berfungsi untuk memperlambat pengeluaran antigen. Hal ini berarti bahwa jika antigen dalam vaksin dicampur dengan adjuvan maka akan terbentuk granuloma yang kaya akan makrofag di dalam jaringan. Antigen yang berada dalam granuloma ini pelahan-lahan dilepas ke dalam pembuluh darah, dengan demikian akan menyediakan rangsangan antigenik dan peningkatan antibodi dalam jangka waktu yang lama. Pembentukan antibodi yang lebih tinggi ini juga dikarenakan terbentuknya tanggap kebal sekunder, yaitu tubuh akan memberi respon yang lebih cepat dengan adanya mekanisme sel memori (Tizard 1987). Dinyatakan pula bahwa infeksi gumboro pada ayam siap panen (42 hari), biasanya efek penyakit berlangsung lebih ringan namun masih mungkin terjadi imunosupresi dan ayam dapat bertindak sebagai reservoir virus IBD.
Rataan titer antibodi pada kelompok K2 dan K4 pada Tabel 3 dan Gambar 4 menunjukkan bahwa pada hari ke 21, rataan titer antibodi pada kelompok K4 tidak berbeda nyata (P > 0,05) dibandingkan kelompok K2. Hal ini dikarenakan pada K4 masih memiliki antibodi asal induk yang tinggi dan tidak mendapat uji tantang sehingga tidak terjadi proses netralisasi, sedangkan pada K2 yang mendapat uji tantang memiliki titer antibodi yang lebih rendah akibat infeksi virus tantang. Hal ini menunjukkan bahwa respon kekebalan yang terjadi akibat infeksi
virus IBD pada uji tantang dapat menyebabkan stimulasi antibodi yang lebih tinggi, sedangkan pada kelompok yang tidak divaksinasi infeksi tersebut merupakan paparan pertama sehingga antibodi yang dihasilkan lebih rendah. Pada hari ke 28 dan 42, rataan titer antibodi pada K2 berbeda nyata (P < 0,05) dibandingkan K4. Hal ini disebabkan karena terjadi peningkatan titer antibodi dari kelompok ayam K2 akibat adanya uji tantang pada hari ke-14. Pada umumnya, tanggap kebal meningkat dipicu oleh adanya antigen. Segera setelah antigen dilenyapkan, maka rangsangan untuk proliferasi sel hilang dan tanggap kebal akan berhenti. Namun bila antigen tetap ada, maka rangsangan akan tetap ada dan sebagai akibatnya tanggap kebal cenderung berlangsung lebih lama. Sel peka antigen akan menanggapi antigen dengan memproduksi antibodi atau sel efektor khusus hanya jika antigen disajikan kepada sel dalam dosis dan dengan cara yang tepat. Jika jumlah antigen yang ditantang berlebihan atau tidak cukup maka sel akan memberi respon tidak menentu dan bahkan dapat menyebabkan sel menjadi tidak reaktif. Jadi dapat dikatakan bahwa selama perjalanan tanggap kebal, kekuatan dari ikatan antibodi terhadap antigen akan meningkat.
KESIMPULAN DAN SARAN
Kesimpulan
Vaksinasi dengan vaksin IBD killed setengah dosis tidak mampu menahan virulensi virus uji tantang dan efek imunosupresi dari infeksi dini virus IBD. Hal ini dibuktikan dengan tidak protektifnya titer antibodi terhadap IBD satu minggu setelah diuji tantang. Peningkatan respon kebal terhadap IBD dan infeksi virus tantang pada ayam pedaging pada hari ke 28 dan 42 setelah vaksinasi dinilai tidak efektif karena ayam pedaging telah dipanen pada umur 30-40 hari.
Saran
Perlu dilakukan penelitian lebih lanjut mengenai dosis efektif vaksinasi dengan vaksin IBD killed yang mampu melindungi ayam dari infeksi dini virus IBD. Dengan demikian program vaksinasi dalam upaya pengendalian penyakit IBD dapat berjalan dengan baik.
DAFTAR PUSTAKA
Abdu PA, Abdullah SU, Adesiyun AA, Ezoekoli CD. 1986. Infectious bursal disease. World’s Poultry Science Journal, 42(3):219-226
Adi AAM dan K Berata. 1998. Gambaran patologik bursa Fabricius ayam pasca inokulasi dengan IBDV isolat lapang. Bull Sains Vet, XIV;16: 6-13
Adi AAM dan Huminto H. 2001. Melacak antigen virus Gumboro pada bursa Fabricius dan limpa menggunakan metode ELISA. J. Vet, 2(4):107-110 Alan et al. 2002. Effect Of maternally derived antibody on vaccination againts
infectious bursal disease (Gumboro) with light vaccine in brunei. Int. J. Poult. Sci, 1: 98-101
Anonimus. 2006. Karakteristik serta keunggulan strain broiler yang ada di Indonesia http://cjfeed.co.id/index.php?option=com_content&task
Anonimus. 2006. Imunosupresi pada ayam broiler dan cara penanganannya. http://www.fmv.utl.pt/atlas/orglinfo/orglinfo_001.htm
Anonimus. 2007. Kerusakan bursa akibat infeksi infectious bursal disease http://teaching.path.cam.ac.uk/partIB_pract/P05/
Anonimus. 2008. Menelusuri jejak strain ayam terpilih. Trobos edisi Mei:7-8 Amrullah IK. 2003. Nutrisi ayam broiler. Bogor : Lembaga Satu Gunungbudi Cheville NF. 1967. Studies on pathogenesis of Gumboro disease in the bursa of
Fabricius, spleen and thymus of the chicken. Am. J. Pathol, 51 : 527-551 Cross GM. 1987. Proceedings of workshop on avian histopathology. Aus. Vet.
Poultry Association. Hlm : 123
Direktorat Jenderal Bina Produksi Ternak. 2005. Statistik peternakan. Jakarta: Departemen Pertanian Republik Indonesia
Eerola et al. 1987. Special features in the stuructural organization of avian lymphoid system. Avian Imunology : Basic and Practice. Boca Raton : CRC Pr. Hlm 9-21
Ernawati R dan CA Nidom. 2001. Identifikasi karakterisasi dan ekspresi protein imunogen virus infeksi bursal isolat Indonesia sebagai bahan vaksin subunit. Laporan Penelitian. Lemlit Unair
Jackwood DJ and SE Sommers. 1999. Restriction fragment length polymorphism in the VP2 gen of IBDV. From Outside United States. Avian Dis.41 : 627-637
Lejal et al. 2000. Role Of 506-652 and 145-692 in the protease activity of infectious bursal disease virus VP4 and identification of its substrate cleavage sites. J. Gen Virol, 81 : 983-992
Lukert PD, Saif YM. 1997. Infectious bursal disease. Di dalam : Calnek BW, editor. Disease of Poultry Ed. Ke-10. USA : Iowa Univ Pr. Hlm 721-738 Listyawati D. 2002. Diagnosis dan Kontrol gumboro. Poultry Indonesia, 272 :
90-91
Mahanan AK. 1992. Divaksin kena, tidak divaksin kena. Poultry Indonesia, 147 : 43-46
Mcllroy SG. 1989. Economic effect of subklinic infectious bursal disease on Broiler production. Avian Pathol, 18: 465-480
. 1992. The cost of vaccinating broiler flocks againts subklinical infectious bursal disease. Avian Pathol, 21: 65-76
Ming Y. 2000. Emerging immunosupresive disease of poultry. Idexx’s Tehnical Update. Surabaya: Seminar, Oct 3
Mulyantono B dan Isman. 2008. Bertahan di tengah krisis. Jakarta: Agro Media Pustaka
Murtidjo AB. 1992. Pengendalian Hama dan Penyakit Ayam. Yogyakarta: Kanisius
Monath W. 1999. Kejadian imunosupresi pada ayam akibat IBD. Wartazoa,16: 13-16
Nurvidia M. 2008. Metode pemberian vaksin pada ayam. Infovet, 162. 2008: 54-56
. 2009.Gumboro pada ayam broiler modern. Infovet, 174. 2009: 17-19 Okeye JOA dan Uzoukwu. 1991. Pathogenesis of infectious bursal disease in
embrionally bursectomized chicken. Av. Pathol, 19 : 48-50
Parede L et al. 1994. Isolasi dan karakterisasi virus IBD dari kejadian akut wabah penyakit Gumboro. Penyakit Hewan 16 (41): 20-24
Partadireja M, Juniman M. 1985. Isolasi dan identifikasi virus Gumboro di Indonesia. Hemera Zoa, 72 (1): 7-14
Partadiredja M. 1991. Inilah Gumboro. Majalah Ayam dan Telur. Edisi 70: 8-9 Puspitasari S. 2009. Gambaran repon kebal terhadap Newcastle disease (ND) pada
ayam pedaging yang divaksin IBD killed setengah dosis. Makalah seminar: 12
Riddel C. 1987. Avian histopathology. Inc. Pennsylvania: American Association of Avian Pathologist
Santhia K. 1996. Penyakit Gumboro. Buletin Veteriner. BPPH 9 (50) :1-37
Soejoedono et al. 1995. Sifat serologik sejumlah isolat virus Gumboro yang berasal dari wilayah padat ternak di Indonesia. Hemera Zoa. 77:109-113 Subekti TS. 2000. Bibit, vaksin dan vaksinasi. Infovet, 074: 12-15
Susilorini T E et al. 2008. Budidaya 22 Ternak Potensial. Jakarta: Penebar Swadaya
Tizard I. 1987. Pengantar imunologi veteriner. Surabaya : Airlangga Univ Pr. Partadiredja M, Penerjemah
Tabbu CR. 2000. Penyakit ayam dan penanggulangannya. Yogyakarta: Kanisius Weiss, E , and I. K. Weiss. 1994. Pathology and pathogenesis of infectious bursal
disease. In. Proc. International Symposium on Infectious Bursal Disease and Chicken Infectious Anemia, Ravischholzhausen, Germany. 21-24 Juni 1994
Wiryawan W. 2002. Gumboro dan Marek penyebab utama imunosupresi dan konsep pencegahannya. Infovet, 096 : 40-42
Wiryawan W. 2007. Pengebalan terhadap Gumboro dengan vaksin vang tidak menimbulkan dampak imunosupresi.
http://Infovet.blogspot.com/2007/09/16
Van den Berg. 2000. Acute infectious bursal disease in poultry : a review. Avian Pathol, 29: 125-194
Lampiran
Hasil analisis data dengan menggunakan uji ANOVA dan dilanjutkan dengan uji Duncan
The GLM Procedure
Class Level Information Class Levels Values
COMB 16 K1H14 K1H21 K1H28 K1H42 K2H14 K2H21
K2H28 K2H42 K3H14 K3H21 K3H28 K3H42 K4H14 K4H21 K4H28 K4H42
Number of Observations Read 400
Number of Observations Used 397
Dependent Variable: RESP
Source DF Sum of Squares Mean Square F Value Pr > F Model 15 953643212 63576214 14.66 <.0001 Error 381 1652043476 4336072 Corrected Total 396 2605686688
R-Square Coeff Var Root MSE RESP Mean
0.365985 147.5166 2082.324 1411.586
Source DF Type I SS Mean Square F Value Pr > F COMB 15 953643212.0 63576214.1 14.66 <.0001
Source DF Type III SS Mean Square F Value Pr > F COMB 15 953643212.0 63576214.1 14.66 <.0001
The GLM Procedure
Levene's Test for Homogeneity of RESP Variance ANOVA of Squared Deviations from Group Means
Source DF Sum of Squares Mean Square F Value Pr > F
COMB 15 3.528E16 2.352E15 1.44 0.1243
Error 381 6.211E17 1.63E15
Duncan's Multiple Range Test for RESP
Alpha 0.05
Error Degrees of Freedom 381
Error Mean Square 4336072
Harmonic Mean of Cell Sizes 24.8062
Means with the same letter are not significantly different.
Duncan Grouping Mean N COMB
A 5041.0 25 K3H42 A 4781.5 25 K1H42 B 2610.9 24 K2H42 B 2582.5 24 K1H28 C B 1489.7 25 K2H14 C B 1489.7 25 K4H14 C D 1255.3 25 K1H14 C D 1255.3 25 K3H14
Alpha 0.05
Error Degrees of Freedom 381
Error Mean Square 4336072
Critical Value of Studentized Range 4.87801
Minimum Significant Difference 2039.4
Harmonic Mean of Cell Sizes 24.8062
Means with the same letter are not significantly different.
Tukey Grouping Mean N COMB
A 5041.0 25 K3H42 A 4781.5 25 K1H42 B 2610.9 24 K2H42 B 2582.5 24 K1H28 C B 1489.7 25 K2H14 C B 1489.7 25 K4H14 C D 1222.4 24 K2H28 C D 387.4 25 K3H21 C D 1381.4 25 K3H28 C D 306.8 25 K4H42 C D 142.4 25 K4H21 D 76.4 25 K1H21 D 52.0 25 K4H28 D 43.7 25 K2H21
Means with the same letter are not significantly different.
Tukey Grouping Mean N COMB
C B 1255.3 25 K1H14 C B 1255.3 25 K3H14 C B 1222.4 24 K2H28 C 387.4 25 K3H21 C 1381.4 25 K3H28 C 306.8 25 K4H42 C 142.4 25 K4H21 C 76.4 25 K1H21 C 52.0 25 K4H28 C 43.7 25 K2H21