METODE PENELITIAN
Waktu dan Tempat Penelitian
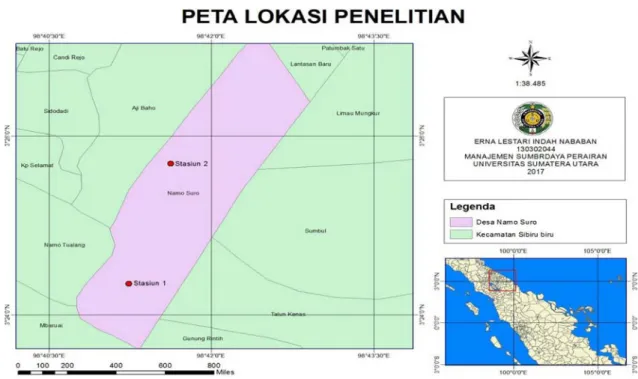
Penelitian ini dilaksanakan pada bulan Juni sampai dengan September 2017. Pengambilan sampel akan dilakukan di kolam budidaya ikan Bawal air tawar Desa Namu Suro Baru Kecamatan Sibiru-biru Kabupaten Deli Serdang Provinsi Sumatera Utara yang terletak pada titik koordinat 98o 41’ 19’’ LU dan 3o26’15’’ BT dan Penelitian identifikasi bakteri potensial probiotik di laksanakan di Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan I, Kualanamu.
Gambar 3. Peta Lokasi Penelitian
Alat dan Bahan Penelitian
Alat yang digunakan untuk isolasi dan identifikasi antara lain, inkubator, autoclave, laminar air flow, pipet tetes, Erlenmeyer, alumunium foil, Bunsen,
cawan petri, mikroskop, objeck glass, jarum ose, tabung reaksi, rak tabung, mortal porselen, cover glass, paper disk, timbangan digital, gelas beaker, pisau, gunting, kamera digital.
Bahan yang digunakan dalam penelitian ini adalah Ikan Bawal air tawar, isolat bakteri patogen Aeromonas hydrophila, media Tryptone Soya Agar (TSA), media de Mann Rose Broth (MRSB), de Mann Rose Agar (MRSA), media Triple Sugar Iron Agar (TSIA), media Skim Milk Agar (SMA), media Strach Agar (SA), media Methly Red (MR), media Voges Proskaurt (VP), media gula-gula (glukosa, laktosa, rafinosa, fruktosa, maltosa, arabinosa, manitol, dan sukrosa), kertas Oxidase Test Strip, reagen Kovac, kristal violet, iodine, safranin, alkohol 95%, akuades, yodium, HCl 0,1 N, hidrogen peroksida (H2O2) 3%, alkohol, kapas, kertas label, alat tulis, sarung tangan, larutan fisiologis (NaCl 0,9 %) dan larutan Mc Farland.
Prosedur Penelitian Deskripsi Area Penelitian
Sampel Ikan diambil dari kolam yang berada di Desa Namu Suro Baru Kecamatan Sibiru-biru Kabupaten Deli Serdang dengan panjang 20 meter dan lebar kolam 10 meter dengan kedalaman 1,5 meter, dapat dilihat pada gambar 4.
Pengambilan Sampel
Ikan yang dijadikan sampel adalah Ikan Bawal air tawar yang ada di kolam pembesaran dengan kriteria ukuran panjang 15-20 cm. Sampel yang telah diambil dimasukkan kedalam kantong plastik yang telah diisi air untuk selanjutnya dibawa dan diperiksa di Balai Karantina Ikan, Pengendalian Mutu, dan Keamanan Hasil Perikanan Kelas I Medan I, Kualanamu.
Persiapan Pengambilan Sampel
Sterilisasi alat dan bahan. Semua alat dan bahan yang akan digunakan disterilkan dengan autoklaf pada temperatur 121ºC pada tekanan uap 15 lb/in2 selama 15 menit (Marlina, 2008). Pengambilan sampel. Bakteri diisolasi pada organ pencernaan berupa lambung dan usus ikan bawal air tawar segar. Ikan dibedah untuk diambil bagian lambung dan usus, lalu dimasukkan ke dalam larutan fisiologis NaCl 0,9% (Feliatra dan Suryadi, 2004). Selanjutnya, lambung dan usus dihancurkan atau dihaluskan dengan menggunakan mortar porselen.
Isolasi bakteri
Sampel yang telah dihaluskan dicampur dengan 1 ml larutan fisiologis, kemudian dilakukan seri pengenceran. Metode seri pengenceran yang dilakukan dengan mengambil sebanyak 1 ml sampel, dimasukkan ke dalam tabung reaksi yang berisi 9 ml akuades sehingga didapat pengenceran 10-1, untuk mendapatkan pengenceran 10-2 dilakukan dengan mengambil 1 ml dari pengenceran 10-1 dimasukkan ke dalam tabung reaksi yang berisi 9 ml akuades, demikian seterusnya dilakukan seri pengenceran hingga 10-5. Pengenceran 10-4 dan 10-5. .
Pengenceran 10-5 diambil 1 ml kemudian dimasukkan ke dalam cawan Petri yang telah berisi medium MRSA dengan menggunakan metode cawan sebar (spread plate), kemudian diinkubasi pada suhu 35°C selama 24 jam.
Setelah inkubasi selama 24 jam, koloni dengan penampakan morfologi yang berbeda dari warna, bentuk, tepian, dan elevasi pada medium MRSA kemudian diambil dan dimurnikan (diisolasi) pada media baru MRSA dengan menggunakan metode cawan gores dengan beberapa tahap sampai didapatkan koloni bakteri tunggal sebagai isolat murni, kultur diinkubasi pada suhu 35°C selama 24 jam. Selanjutnya, dilakukan seleksi sebagai kandidat probiotik berdasarkan kemampuan mendegradasi protein dan karbohidrat dengan melakukan serangkaian uji hidrolisis kasein (protein), uji hidrolisis pati, dan melakukan uji penghambatan bakteri potensial probiotik terhadap bakteri patogen untuk mengetahui bakteri potensial probiotik yang berhasil didapatkan mampu menghambat bakteri patogen yang sering menyerang ikan budidaya.
Uji Probiotik
a. Uji Hidrolisis Kasein (Protein)
Suspensi bakteri hasil biakan murni diambil satu ose dan digoreskan pada cawan yang berisi media Skim Milk Agar (SMA), dan diinkubasi pada suhu 35°C selama 24 jam. Uji hidrolisis protein positif ditandai dengan adanya zona bening di sekeliling koloni yang menunjukkan bahwa bakteri tersebut mempunyai aktivitas proteolitik (Fardiaz, 1992).
b. Uji Hidrolisis Pati (Amilum) Suspensi bakteri hasil biakan murni diambil satu ose dan digoreskan pada
cawan yang berisi media Strach Agar, Bakteri yang akan diuji digoreskan pada setengah bagian cawan yang berisi medium starch agar. Inkubasi dilakukan pada suhu 30 o C selama 48 jam. Setelah inkubasi, koloni yang tumbuh ditetesi larutan gram yodium sehingga semua bagian agar terendam. Uji hidrolisis pati positif ditandai dengan terbentuknya bagian yang transparan (bening) di sekeliling koloni yang tumbuh (Fardiaz 1989).
c. Uji Aktivitas Antagonistik Terhadap Bakteri Patogen
Seleksi bakteri berpotensi probiotik berdasarkan aktivitas antagonistik terhadap bakteri patogen dilakukan dengan teknik difusi agar dengan menggunakan paper disk. Bakteri patogen yang digunakan untuk uji aktivitas antagonistik ini adalah bakteri Aeromonas hydrophila. Tryptone Soya Agar (TSA) yang telah dicampur dengan bakteri patogen pada pengenceran 10-5 dituangkan ke dalam cawan petri steril, kemudian paper disk steril yang telah dicelupkan ke dalam kultur cair isolat bakteri berpotensi probiotik diletakkan dengan cara ditekan ke atas media TSA. Masing-masing isolat bakteri berpotensi probiotik diuji daya hambatnya dengan bakteri patogen dengan tiga kali ulangan. Selanjutnya, diinkubasi pada suhu 35oC selama 24 jam. Aktivitas antagonistik ditunjukkan dengan terbentuknya zona bening pada media. Isolat yang menghasilkan zona bening berarti menunjukkan kemampuan menghambat bakteri patogen (Yulvizar dkk., 2014).
Identifikasi Spesies Bakteri Potensial Probiotik
a. Karakterisasi Morfologi Isolat Isolat bakteri murni diidentifikasi morfologi selnya dengan menggunakan
uji pewarnaan gram dan pengamatan bentuk bakteri secara mikroskopik. Pewarnaan gram dilakukan dengan membersihkan kaca objek dengan alkohol dan disterilkan pada nyala api bunsen, kemudian diambil isolat bakteri dengan jarum ose dan dioleskan pada object glass. Isolat bakteri kemudian ditetesi kristal violet dan dibiarkan selama 1 menit, selanjutnya dicuci dengan air mengalir dan dianginkan hingga kering. Isolat bakteri kemudian ditetesi kembali dengan larutan iodine dan dibiarkan selama 1 menit, kemudian dicuci dengan air mengalir dan dianginkan hingga kering. Selanjutnya isolat bakteri ditetesi alkohol 95% selama 30 detik, kemudian dialiri air dan dianginkan hingga kering. Isolat bakteri kemudian ditetesi safranin selama 30 detik dan dicuci dengan air mengalir dan dikering anginkan, kemudian dilakukan pengamatan dengan menggunakan mikroskop.
Bakteri gram positif ditandai dengan warna ungu yang menunjukkan bahwa bakteri tersebut mampu mengikat warna kristal violet, sedangkan bakteri gram negatif ditandai dengan warna merah muda yang menunjukkan bahwa bakteri tersebut tidak mampu mengikat warna kristal violet dan hanya terwarnai oleh safranin (pewarna tandingan) (Hadioetomo, 1993).
b. Uji Motilitas
Isolat bakteri ditusukkan ke dalam media SIM semi padat pada tabung reaksi menggunakan jarum ose tusuk steril. Kemudian diinkubasi selama 24 jam pada suhu 37ºC. Uji positif ditandai dengan pertumbuhan bakteri yang menyebar, maka bakteri tersebut bergerak (motil) dan bila pertumbuhan bakteri tidak menyebar hanya berupa satu garis, maka bakteri tersebut tidak bergerak (non motil) (Sudarsono, 2008).
c. Uji indol
Dalam uji indol digunakan medium tryptone broth. Bakteri yang akan diuji diinokulasikan ke dalam tabung reaksi yang berisi tryptone broth dan diinkubasi pada suhu 37 oC selama 1-2 hari. Setelah diinkubasi, masing-masing tabung ditambahkan 0,5 ml pereaksi Kovacs. Terbentuknya warna merah menunjukkan uji indol positif (Hadioetomo 1985)
d. Uji Katalase
Sebanyak 2 tetes H2O2 3% diletakkan pada object glass steril. Isolat bakteri diambil menggunakan jarum ose steril, kemudian dipindahkan ke atas kaca objek dan dicampurkan. Uji positif ditandai dengan terbentuknya gelembung-gelembung oksigen yang menunjukkan bahwa organisme yang bersangkutan menghasilkan enzim katalase yang mengubah hidrogen peroksida menjadi air dan oksigen dan uji negatif ditandai dengan tidak adanya perubahan atau gelembung-gelembung oksigen pada isolat bakteri (Hadioetomo, 1993). e. Uji Oksidase
Tujuan uji oksidase adalah untuk mengetahui ada tidaknya enzim oksidase pada bakteri dengan menggunakan paper oksidase yang dapat dilihat perubahan warna yang terjadi pada paper oksidase, Sebanyak satu ose isolat bakteri digoreskan pada kertas Oxidase Test Strip. Tunggu selama 1 menit, lalu amati hasilnya. Uji positif ditandai dengan perubahan warna menjadi biru violet dan uji negatif ditandai dengan tidak adanya perubah warna pada kertas oxidase test strip .
f. Uji MR-VP
Sebanyak satu ose isolat bakteri diinokulasi ke dalam media MR-VP dan diinkubasi selama 24 jam pada suhu 29ºC. Setelah inkubasi selama 24 jam, media ditambahkan 3-4 tetes indikator metil red. Uji positif ditandai dengan perubahan warna medium menjadi merah, artinya terbentuk asam dan uji negatif ditandai dengan tidak adanya perubahan warna pada media (Hadioetomo, 1993).
g. Uji Gelatin
Sebanyak satu ose isolat bakteri diinokulasikan pada media cair Gelatin dan diinkubasi selama 24 jam pada suhu 29ºC. Uji positif ditandai dengan media cair tetap mencair apabila telah diletakkan di dalam lemari es selama beberapa menit dan uji negatif ditandai dengan membekunya media gelatin jika diletakkan di dalam lemari es.
h. Uji Oksidatif-Fermentatif Baird Parker
Dalam uji oksidatif-fermentatif digunakan medium Baird Parker agar (BPA) dan indikator pH bromthymol blue. Bakteri yang akan diuji, secara aseptis dengan menggunakan loop ditusukkan ke dalam medium tegak Baird Parker agar (BPA) yang sudah disiapkan terlebih dahulu. Setiap bakteri yang akan diuji ditusukkan ke dalam dua tabung, dimana tabung pertama ditutupi dengan parafin 3-5 ml, sedangkan tabung kedua tanpa parafin. Inkubasi dilakukan pada suhu 30 oC selama 48 jam. Bila terjadi perubahan warna (terbentuk warna kuning) pada kedua tabung, maka bakteri tersebut bersifat fermentatif dan bila hanya tabung tanpa parafin yang berubah warna (terbentuk warna kuning), maka bakteri bersifat oksidatif, sedangkan bila tidak terjadi perubahan warna pada kedua tabung tersebut berarti uji oksidatif-fermentatif bersifat negatif (Cowan dan Steel 1974)
i. Uji TSIA
Sebanyak satu ose isolat bakteri diinokulasi ke dalam media TSIA dengan cara menusuk tegak lurus pada bagian butt (tusuk) dan cara zig zag pada bagian slant (miring) dan diinkubasi selama 24 jam pada suhu 29ºC. Perubahan warna kemudian diamati, apabila bagian slant berwarna merah dan butt berwarna kuning maka bakteri mampu memfermentasi glukosa, sedangkan apabila bagian slant dan butt keduanya berwarna kuning maka bakteri mampu memfermentasi sukrosa dan laktosa.
j. Uji LIA
Sebanyak satu ose isolat bakteri diinokulasi secara tusuk lalu zig-zag pada permukaan agar miring media LIA dan diinkubasi selama 24 jam pada suhu 29ºC. Uji positif ditandai dengan berubahnya warna medium menjadi ungu dan uji negatif ditandai dengan tidak terjadinya perubahan warna pada media (Sudarsono, 2008).
k. Uji Gula-Gula
Sebanyak satu ose isolat bakteri diinokulasikan ke dalam tabung-tabung reaksi yang berisi medium fermentasi glukosa, laktosa, rafinosa, fruktosa, maltosa, arabinosa, manitol, dan sukrosa diinkubasi selama 24 jam pada suhu 29ºC. Uji positif ditandai dengan berubahnya warna medium menjadi kuning dan apabila dalam tabung terdapat gelembung, berarti fermentasi tersebut menghasilkan gas (CO2).
Analisis Data
Setelah uji morfologi dan uji biokimia selesai maka dibuat tabel hasilnya sehingga mudah dalam pembacaan dimana data yang telah diperoleh dianalisis secara deskriptif dengan mendeskripsikan secara sistematis dan akurat secara ilmiah. Hasil uji terhadap isolat-isolat yang diperoleh, dilakukan upaya identifikasi bakteri berdasarkan karakter biokimia sesuai dengan tabel biokimia dengan berpedoman pada buku “Cowan amd Steels’s Manual for The Identification of Medical Bacteria”
HASIL DAN PEMBAHASAN
Hasil
Bakteri Potensial Probiotik Pada Lambung dan Usus Ikan Bawal Air Tawar Tahapan awal penelitian dilakukan penggerusan usus dan lambung, pengenceran, penanaman bakteri pada media agar dan dilakukan pemurnian bakteri hingga memperoleh koloni tunggal.Tingkaat pengenceran tertinggi yang dilakukan dalam penelitian ini adalah sampai 10-5. Akan tetapi, koloni terpilih berasal dari kultur bakteri dengan tingkat pengenceran 10-3 dan 10-5 (Lampiran 2). Bakteri yang berasal dari saluran pencernaan Ikan Bawal air tawar ditumbuhkan ke dalam media MRSA. Media tersebut merupakan medium selektif bagi pertumbuhan bakteri asam laktat.
Setelah dilakukan penanaman pada media MRSA terlebih dahulu koloni yang terdiri dari campuran mikroba dipisahkan dengan dari satu dengan yang lain Dari penelitian yang telah dilakukan, diperoleh hasil bahwa jumlah isolat bakteri potensial probiotik dari isolasi lambung dan usus ikan Bawal air tawar (Colossoma macropomum) ditemukan sebanyak 4 isolat bakteri, yaitu terdapat 2 isolat bakteri dari hasil isolasi pada usus dan 2 isolat bakteri dari hasil isolasi pada lambung. Hasil tersebut diperoleh setelah dilakukan uji probiotik untuk menyeleksi seluruh isolat yang ditemukan dari usus dan lambung ikan Bawal air tawar (Colossoma macropomum) sehingga diperoleh isolat bakteri yang memang merupakan potensial probiotik yaitu sebanyak 4 isolat murni.
Morfologi Koloni dan Sel Bakteri Potensial Probiotik pada Ikan Bawal Air Tawar
Dari kultur bakteri tersebut, koloni yang tumbuh dominan dan mempunyai morfologi berbeda, baik dari segi warna, bentuk dari atas, bentuk dari samping dan bentuk penonjolannya diambil untuk diinokulasi ke dalam media MRSA. Dari hasil pengamatan, dipilih 4 koloni bakteri yang tumbuh dominan serta mempunyai morfologi berbeda satu sama lainnya. Untuk memudahkan dalam pembahasan, maka empat koloni bakteri diberi kode UIB-01, UIB-02, LIB-01, dan LIB-02.
Isolat-isolat bakteri potensial probiotik yang ditemukan dari hasil isolasi usus dan lambung ikan Bawal air tawar (Colossoma macropomum) dapat dilihat dari morfologi koloni meliputi tepian, elevasi dan warna koloni. Adapun ciri-ciri morfologi dari keempat koloni yang berhasil diperoleh dapat dilihat pada Tabel 1. Berdasarkan Tabel 1. dapat dijelaskan bahwa ke-4 jenis. bakteri memiliki kemiripan pada tepian dan elevasi, yaitu bertepi licin dan berelevasi cembung, sedangkan pada warna dan bentuk memiliki perbedaan yaitu ke-2 isolat bakteri memiliki warna putih dan putih susu dan 2 isolat lainnya memiliki warna kuning dan putih.
Tabel 1. Morfologi Koloni Isolat Bakteri Potensial Probiotik Pada Ikan Bawal
Kode Isolat Koloni Morfologi Sel
Tepian Elevasi Warna Gram Bentuk
UIB-01 Licin Cembung Putih Positif Bulat
UIB-02 Licin Cembung Putih susu Positif Bulat LIB-01 Licin Cembung Kuning Positif Bulat LIB-02 Licin Cembung Putih Positif Batang Note: UIB-01 = Usus Ikan Bawal 01 LIB-01 = Lambung Ikan Bawal 01
UIB-02 = Usus Ikan Bawal 02 LIB-02 = Lambung Ikan Bawal 02 Pengamatan secara mikroskopik terhadap bentuk dan struktur sel merupakan tahap yang paling penting dalam karakterisasi bakteri. Pengamatan
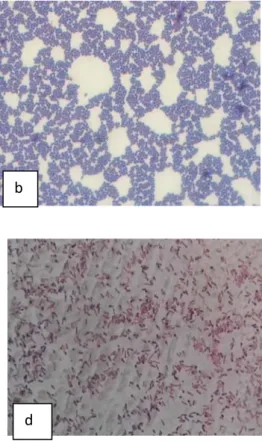
morfologi pada sel isolat bakteri potensial probiotik yang dilakukan secara mikroskopik dengan pembesaran 100x didapat hasil pewarnaan Gram dari ke-4 isolat bakteri yaitu berwarna ungu yang merupakan Gram positif karena mampu mengikat kristal violet.
Dari 4 isolat tersebut isolat bakteri tersebut berbentuk basil atau batang, sedangkan yang lainnya berbentuk kokus atau bulat. Hasil pewarnaan gram dari isolat bakteri potensial probiotik dapat dilihat pada Gambar 5.
Gambar 2. Bentuk Sel dari Isolat (a) UIB-01 (b) UIB-02 (c) LIB-01 (d) LIB-02
Karakterisasi dan Identifikasi Bakteri Potensial Probiotik Pada Ikan Bawal Air Tawar
Hasil pengamatan morfologi sel baik pewarnaan Gram dan uji biokimia dari ke-4 isolat bakteri dapat dilihat pada Tabel 2. Hasil uji Biokimia dari ke-4
b a
d c
bakteri yang diperoleh diidentifikasi menurut buku Characterization Test Method. Di dalam: Manual for the Identification of Medical Bacteria oleh Cowan ST, Steel KJ (1974).
Tabel 2. Karakterisasi Isolat Bakteri Probiotik Potensial Pada Ikan Bawal Air Tawar
Karakterisasi Bakteri
Isolat Bakteri
UIB-01 UIB-02 LIB-01 LIB-02
Motilitas - - - + Ornitin - - - - Indol - - - - Katalase + + + + Oksidase + - + - TSIA K/K K/K K/K K/K Gelatin - - - - MR - + - + VP + + - + O/F F F F F LIA + + - - Glukosa + - + + Laktosa + + + - Sukrosa + + + - Manitol + + + - Sorbitol + + + - Arabinosa + + + - Rafinosa + - + - Fruktosa + + + - Maltosa + + + - Spesies Bakteri Enterococcus faecalis Staphylococcus saprophyticus Micrococcus luteus Bacillus cereus Keterangan: (+) positif, (-) negatif, (A) Acid, (K) Alkali, F: fermentatif
Hasil karakterisasi dan identifikasi ke-4 isolat bakteri dengan kode isolat UIB-01 merupakan Enterococcus faecalis dan UIB-02 merupakan Staphylococcus saprophyticus, isolat dengan kode isolat LIB-01 merupakan dan isolat dengan kode Micrococcus luteus isolat LIB-02 merupakan Bacillus cereus
Identifikasi bakteri dilakukan dengan teknik konvensional yaitu dengan membandingkan bakteri yang sedang diidentifikasi dengan bakteri yang telah
teridentifikasi sebelumnya. Bila tidak terdapat bakteri yang ciri-cirinya 100% mempunyai kemiripan ciri-ciri, maka dilakukan pendekatan terhadap bakteri yang memiliki ciri-ciri yang paling menyerupai. Oleh karena itu teknik identifikasi dengan metode konvensional akan selalu menghasilkan suatu bakteri tertentu yang sudah teridentifikasi sebelumnya dan tidak akan dapat menemukan spesies baru (Holt et al,. 1994)
Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Uji probiotik dilakukan dengan pengamatan uji hidrolisis pati (amilum) dan kasein (protein) terhadap isolat bakteri dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan enzim amilase dan protease yang merupakan tahap awal dalam seleksi seluruh isolat bakteri untuk mendapatkan bakteri yang berpotensi probiotik pada Ikan Bawal air tawar. Uji hidrolisis pati dilakukan dengan menggoreskan masing-masing koloni bakteri murni pada media Strach Agar (SA) dan uji kasein (protein) dilakukan dengan menggoreskan masing-masing bakteri murni pada media Skim Milk Agar (SMA) yang diinkubasi selama 1x 24 jam pada suhu 35 OC kemudian ditandai dengan terbentuknya zona bening. Kemampuan isolat-isolat bakteri dalam menghidrolisis pati (amilum) dan kasein (protein) dapat dilihat pada Tabel 3.
Tabel 3. Kemampuan Isolat Kandidat Probiotik Menghidrolisis Pati dan Kasein
Kode Isolat Hidrolisis
Kasein Pati/Amilum
UIB-01 + +
UIB-02 + +
LIB-01 + +
Gambar 6. Hidrolisis Pati (a) UI B-01 (b) UIB-02 (c) LIB-02 (d) LIB-02
Gambar 8. Hidrolisis Kasein (a) UIB-01 (b) UIB-02 (c) LIB-02 (d) LIB-02 a d b d a c b c Zona Bening Zona Bening
Indikasi Penghambatan Bakteri Aeromonas hydrophila
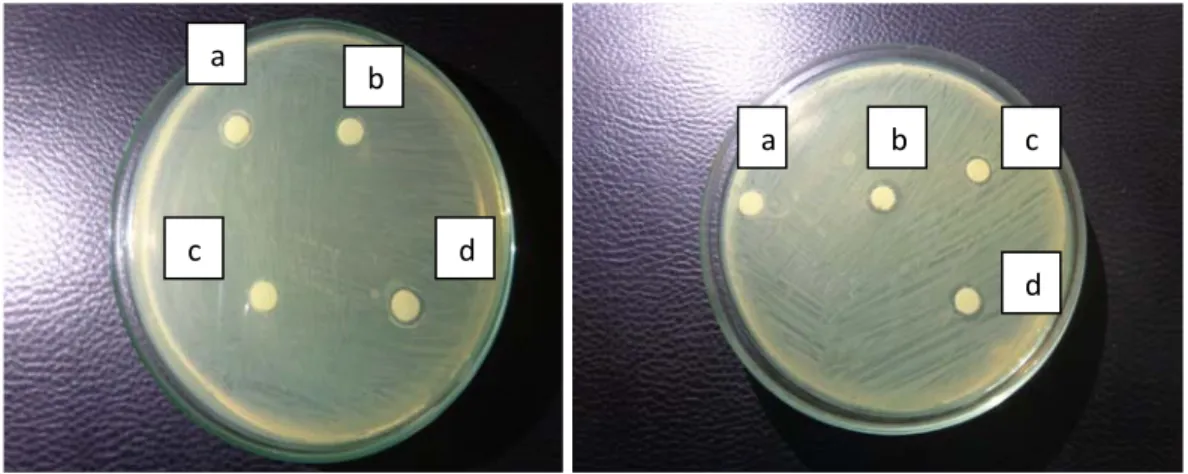
Isolat-isolat bakteri yang mampu menghidrolisis pati (amilum) dan kasein (protein) selanjutnya diuji tantang dengan bakteri Aeromonas hydrophila untuk mengetahui adanya indikasi penghambatan terhadap bakteri A. hydrophila. Uji tersebut bertujuan untuk memastikan bahwa ke-4 isolat bakteri tersebut merupakan isolat bakteri yang berpotensi probiotik pada Ikan Bawal air tawar dengan menunjukkan adanya indikasi penghambatan terhadap bakteri patogen A. hydrophila. Indikasi penghambatan isolat bakteri potensial probiotik yaitu dengan terbentuknya zona bening di sekitar blank disk yang menandakan adanya penghambat pertumbuhan terhadap bakteri patogen A. hydrophila dapat dilihat pada Gambar 5.
Gambar 8. Indikasi Penghambatan bakteri A.hydrophila (a) Enterococcus faecalis
(b) Stapylococcus saprophyticus (c) Micrococcus luteus (d) bacillus cereus
Dari hasil penelitian didapatkan adanya indikasi penghambatan pada bakteri patogen A. hydrophilla menunjukkan bahwa empat isolat dari hasil isolasi saluran pencernaan Ikan Bawal air tawar menghasilkan zona bening di sekitar paper disk yang menunjukkan bahwa isolat bakteri yang berpotensi sebagai
a a b c d d c b
probiotik tersebut mampu menghambat pertumbuhan bakteri uji patogen A. hydropilla.
Kemampuan setiap isolat menghasilkan zona bening di sekitar paper disk berbeda-beda berdasarkan tingkat daya hambat dari bakteri terhadap bakteri uji. Berdasarkan Gambar 4, nilai indikasi hambatan untuk bakteri Enterococcus faecalis sebesar 2 mm, bakteri Stapylococcus saprophyticus sebesar 2 mm, bakteri Micrococcus luteus sebesar 2 mm, dan bakteri Bacillus cereus sebesar 3 mm.
Pembahasan
Bakteri Potensial Probiotik Pada Usus dan Lambung Ikan Bawal Air Tawar Secara alamiah bakteri probiotik terdapat pada saluran pencernaan makhluk hidup terutama pada ikan yang dapat dimanfaatkan sebagai penghambat pertumbuhan bakteri patogen guna memperbaiki kualitas air dan pengendalian penyakit bakterial yang terjadi pada budidaya ikan yang bernilai ekonomis tinggi. Selain itu sistem penanganan pengendalian penyakit harus bersifat ramah lingkungan, maka probiotik merupakan salah satu langkah alternatif yang berperan sebagai kontrol biologis yang digunakan sebagai penghambat bakteri patogen. Hal ini sesuai dengan Irianto (2003) menyatakan bahwa probiotik dapat mengatur lingkungan mikrobia pada usus, menghalangi mikroorganisme patogen dalam usus dengan melepas enzim-enzim yang membantu proses pencernaan makanan. Penggunaan probiotik menjadi solusi internal untuk menghasilkan pertumbuhan dan efisiensi pakan yang optimal, mengurangi biaya produksi dan
pada akhirnya dapat mengurangi beban lingkungan karena akumulasi limbah diperairan Iribarren dkk., (2012).
Berdasarkan penelitian yang telah dilakukan terhadap bakteri yang terdapat pada saluran pencernaan (usus dan lambung) Ikan Bawal air tawar, maka diperoleh sebanyak 4 isolat yang berpotensi sebagai bakteri probiotik yang diisolasi pada medium MRSA yang merupakan media selektif terhadap pertumbuhan bakteri probiotik. Pada tabel 1 memperlihatkan jumlah isolat yang diperoleh yaitu sebanyak 4 isolat, masing-masing isolat bakteri probiotik diberi kode UIB-01,UIB-02, LIB-01, dan LIB-02. Data penelitian menunjukkan setiap isolat yang berpotensi sebagai probiotik memiliki karakteristik morfologi yang berbeda-beda.
Morfologi Koloni dan Sel Bakteri Potensial Probiotik Pada Ikan Bawal Air Tawar
Untuk mengetahui ciri-ciri isolat bakteri perlu dilakukan pengamatan morfologi sel dari ke-4 isolat bakteri melalui pewarnaan Gram menunjukkan bahwa 3 isolat bakteri tersebut memiliki bentuk sel kokus dan 1 isolat bakteri berbentuk basil. Hal ini sesuai dengan Lay dan Hastowo (1992) yang menyatakan bahwa ciri-ciri utama suatu mikroorganisme yang perlu diketahui dalam mengkarakterisasi mikroba, meliputi: ciri morfologi, susunan kimiawi dari sel, sifat biakan, metabolisme, sifat antigenik, sifat genetik dan patogenisitas. Untuk menentukan ciri tersebut, maka diperlukan beberapa uji morfologi dan sifat fisiologis.
Hasil uji pewarnaan gram masing-masing bakteri merupakan gram positif yang mampu mempertahankan kristal violet pada pewarnaan Gram (Gambar 3). Hal tersebut disebabkan karena bakteri ini mempunyai kandungan lipid yang lebih rendah, sehingga dinding sel bakteri akan lebih mudah terdehidrasi akibat perlakuan dengan alkohol. Dinding sel yang terdehidrasi menyebabkan ukuran pori-pori sel menjadi kecil dan daya permeabilitasnya berkurang sehingga zat warna ungu kristal yang merupakan zat warna utama tidak dapat keluar dari sel dan sel akan tetap berwarna ungu. Hal ini sesuai dengan Campbell, dkk., (2003) yang menyatakan struktur dinding sel akan menentukan respon pewarnaan. Bakteri diwarnai dengan suatu zat warna violet dan yodium, dibilas dengan alkohol dan kemudian diwarnai sekali lagi dengan zat warna merah. Bakteri Gram Positif yang sebagian besar dinding selnya mengandung peptidoglikan akan menjerat warna violet.
Hasil pengamatan morfologi sel dari ke-4 isolat bakteri melalui pewarnaan Gram menunjukkan bahwa 3 isolat bakteri tersebut memiliki bentuk sel kokus dan 1 isolat bakteri berbentuk basil merupakan bakteri kandidat potensial probiotik yang mengandung asam laktat. Hal ini sesuai dengan Salminem (1998) yang menyatakan bahwa bakteri asam laktat merupakan bakteri yang bersifat gram positif, tidak membentuk spora, dan dapat berbentuk coccus atau batang, tidak menghasilkan enzim katalase, non-motil atau sedikit motil, mikroaerofilik sampai anaerob, toleran terhadap asam, kemoorganotrofik, dan membutuhkan suhu mesofilik.
Karakterisasi dan Identifikasi Bakteri Potensial Probiotik Pada Ikan Bawal Air Tawar
Berdasarkan hasil penelitian yang dilakukan, isolat bakteri yang berpotensi probiotik yang berhasil ditemukan berjumlah empat isolat (Tabel 1), yang memiliki ciri morfologi yang sama yaitu tepian licin dan elevasi datar tetapi memiliki sedikit perbedaan pada warna yaitu isolat UIB-01 dan UIB-02 berwarna putih dan isolat LIB-01 dan LIB-02 bewarna kuning dan putih susu. Setelah melakukan pengamatan morfologi koloni, selanjutnya dilakukan tahap uji biokimia untuk menentukan spesies bakteri potensial probiotik dan ditemukan hasil uji biokimia pada ke-4 isolat bakteri tersebut.
Hasil uji biokimia pada kode UIB-01 menunjukan hasil yang sama yaitu positif untuk Katalase, Oksidase, VP, LIA, Laktosa, Glukosa, Sukrosa, Manitol, Inositol, Sorbitol, Rafinosa, Fruktosa, Maltosa dan negatif untuk uji Motil, Indol, Ornitin, Arabinosa serta TSIA bernilai alkali. Dari hasil tersebut selanjutnya dilakukan penentuan spesies berdasarkan buku menurut buku Cowan ST, Steel KJ. 1974. Characterization Test Method. Di dalam: Manual for the Identification of Medical Bacteria Edition yang menyimpulkan bahwa isolat yang didapat sesuai dengan uji biokimia tersebut adalah Enterococcus faecalis. Hal ini sesuai dengan Evan dkk,. (2002) yang menyatakan bahwa Enterococcus faecalis merupakan kokus gram positif berbentuk ovoid dengan diameter 0,5–1 μm yang dapat berkoloni secara rantai, berpasangan atau bahkan soliter. Bakteri ini bersifat Fakultatif anaerob, mempunyai kemampuan untuk hidup dan berkembang biak dengan oksigen maupun tanpa oksigen.
Hasil uji biokimia pada kode UIB-02 menunjukan hasil yang sama yaitu positif untuk Katalase, MR/VP, LIA, Laktosa, Sukrosa, Manitol, Sorbitol, Arabinosa, Fruktosa, Maltosa dan hasil negatif pada uji Oksidase, MIO, Glukosa, Rafinosa serta TSIA bernilai alkali. Dari hasil tersebut selanjutnya dilakukan penentuan spesies berdasarkan buku menurut buku Cowan ST, Steel KJ. 1974. Characterization Test Method. Di dalam: Manual for the Identification of Medical Bacteria. Edition yang menyimpulkan bahwa isolat yang didapat sesuai dengan uji biokimia yang diamati adalah Staphylococcus saprophyticus. Hal ini sesuai dengan Hal ini sesuai dengan Holt, dkk., (1994) yang menyatakan bahwa bakteri Staphylococcus sp. gram positif, motilitas berubah-ubah, kebanyakan motil, warna koloni putih susu atau krem. Bakteri ini memiliki katalase positif dan oksidase negatif, sering mengubah nitrit menjadi nitrat, mampu memfermentasi laktosa dan sukrosa, tumbuh optimum pada temperatur 37ºC. Beberapa spesies ada yang patogen pada manusia dan hewan dan Fardiaz (1983) menyatakan bakteri Staphylococcus bersifat fakultatif anaerobik, tetapi pertumbuhan pada keadaan anaerobik sangat lambat. Sel bakteri ini bersifat Gram positif, berbentuk bulat dan kecil dengan diameter 0,5-1,5 mikron, tidak membentuk spora dan tidak bergerak Hasil uji biokimia pada kode LIB-01 menunjukan hasil yang sama yaitu positif untuk Katalase, Oksidase, Glukosa, Laktosa, Sukrosa, Manitol, Sorbitol, Manitol, Sorbitol, Arabinosa, Rafinosa dan hasil negatif pada MR/VP, Motility serta TSIA bernila Alkali. Dari hasil tersebut selanjutnya dilakukan penentuan spesies berdasarkan buku menurut buku Cowan ST, Steel KJ. 1974. Characterization Test Method. Di dalam: Manual for the Identification of Medical Bacteria. Edition yang menyimpulkan bahwa isolat yang didapat sesuai dengan
uji biokimia yang diamati adalah Micrococcus luteus. Hal ini sesuai dengan Holt et al. (1994) yang menyatakan bahwa bakteri Micrococcus sp. memiliki morfologi Gram positif, jarang motil dan kebanyakan non motil, koloni berwarna kekuningan, tumbuh pada media yang sederhana, katalase positif, indol negatif, ada yang mampu memfermentasi glukosa dan ada yang mampu memfermentasi laktosa dan sukrosa, tumbuh optimum pada suhu 25ºC-37ºC.
Hasil uji biokimia pada kode LIB-02 menunjukan hasil yang sama yaitu positif Katalase, Motility, Glukosa, Fruktosa, Sucrosa, Manitol dan hasil negatif pada uji Oksidase, Laktosa, Sorbitol, Arbinosa, Maltosa dan TSIA bernilai alkali. Dari hasil tersebut selanjutnya dilakukan penentuan spesies berdasarkan buku menurut buku Cowan ST, Steel KJ. 1974. Characterization Test Method. Di dalam: Manual for the Identification of Medical Bacteria Edition yang menyimpulkan bahwa isolat yang didapat sesuai dengan uji biokimia tersebut adalah Bacillus cereus. Hal ini sesuai dengan Holt et al. (1994) yang menyatakan bahwa bakteri Bacillus sp. memiliki ciri-ciri morofologi yaitu gram positif, motil dengan flagel peritrik, endospora oval, kadang-kadang bundar atau silinder, warna koloni putih susu sampai kekuningan dengan tepian berombak, katalase positif, indol negatif dan mampu memfermentasi glukosa dan sukrosa.
B. cereus yang ditemukan memiliki batamg besar berwarna putih dan tumbuh pada suhu 370 . Hal ini sesuai dengan Villaen dkk., (2006) yang menyatakan bahwa Bacillus cereus merupakan bakteri gram positif bersifat aerob fakultatif mesophilik, yaitu tumbuh optimal pada suhu antara 20 0 C dan 400 C dan mampu beradaptasi terhadap kondisi lingkungan pada kisaran yang luas. B. cereus memiliki koloni besar, kasar, datar, tidak teratur dengan tepian
seperti cambuk, putih dengan penampilan berbintik-bintik. Variasi lain yaitu tipis dan menyebar, kasar, halus dan padat. Holt dkk., (1994).
Hidrolisis Pati (Amilum) dan Kasein (Protein) Pada Isolat Bakteri
Hasil uji menunjukkan bahwa semua isolat bakteri yang diisolasi dari usus dan lambung, dapat menguraikan zat pati menjadi maltosa atau glukosa oleh aktivitas enzim amilase yang dihasilkan bakteri itu sendiri. Hal tersebut ditandai dengan tidak terbentuknya warna biru di sekeliling koloni bakteri sewaktu penambahan larutan yodium ke dalam media dan terbentuknya zona bening di sekitar isolat bakteri. Hasil uji hidrolisis pati oleh enzim amilase bakteri dapat dilihat pada Gambar 5.
Hal ini sesuai dengan Lay (1994) yang menyatakan bahwa uji hidrolisis pati dilakukan untuk mengetahui adanya enzim amilase yang berfungsi untuk memecah pati menjadi komponen yang lebih sederhana. Zat pati adalah polisakarida yang terdiri dari beberapa sakarida glukosa. Bila zat pati dihidrolisis oleh eksoenzim amilase, maka senyawa tersebut akan diuraikan menjadi maltosa dan glukosa. Zat pati bereaksi secara kimia dengan yodium, reaksi ini ditandai dengan terbentuknya warna biru kehitaman. Warna biru kehitaman ini terjadi bila molekul yodium masuk ke dalam bagian yang kosong pada molekul zat pati (amilosa) yang berbentuk spiral. Proses yodinisasi zat pati menghasilkan molekul yang dapat mengabsorpsi semua cahaya, terkecuali warna biru. Bila zat pati ini telah diuraikan menjadi maltosa atau glukosa, warna biru ini tidak terbentuk karena tidak adanya bentuk spiral. Tidak terbentuknya warna biru sewaktu
penambahan larutan yodium ke dalam media merupakan petunjuk adanya hidrolisis zat pati.
Uji hidrolisis protein dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan enzim protease. Pengujian aktivitas proteolitik bertujuan untuk mengukur besarnya aktivitas proteolitik masing-masing isolat dengan uji hidrolisis kasein. Hal ini sesuai dengan Fardiaz (1992) yang menyatakan bahwa Uji aktivitas proteolitik bertujuan untuk mengetahui adanya enzim proteinase ekstraseluler pada bakteri. Enzim ini merupakan enzim pemecah protein yang diproduksi di dalam sel dan kemudian dikeluarkan dari sel, oleh sebab itu dinamakan enzim ekstraseluler. Semua bakteri mempunyai enzim proteinase di dalam sel, tetapi tidak semua bakteri mempunyai enzim proteinase ekstraseluler.
Dari hasil penelitian uji hidrolisis protein dilakukan untuk mengetahui kemampuan bakteri dalam menguraikan enzim protease. Uji ini ditandai dengan terbentuknya zona bening disekeliling bakteri yang ditanam pada media Skim Milk Agar yang mengandung kasein yang dapat dipecah oleh mikroorganisme proteolitik untuk mengetahui kandidat bakteri potensial probiotik yang dapat menghidrolisis protein.
Hal ini sesuai dengan Lay (1994) yang menyatakan bahwa media yang digunakan untuk uji ini adalah skim milk agar (SMA). Pada media ini terdapat kasein yang merupakan protein pada susu. Kasein dapat digunakan oleh mikroorganisme tertentu sebagai sumber energi. Bila susu dicampur dengan media biakan bakteri, kasein dalam susu akan menyebabkan media tersebut keruh. Kekeruhan ini disebabkan karena kasein dalam susu bereaksi dengan ion Ca2+ membentuk Ca- kasein. Kompleks ini tidak larut dalam media, namun membentuk
larutan koloidal, sehingga media terlihat keruh. Bila mikroorganisme mempunyai enzim proteinase ekstraseluler yang menghidrolisis kasein, maka wilayah sekeliling koloni bakteri terlihat jernih. Kejernihan ini disebabkan molekul kasein diuraikan. Asam amino yang dihasilkan dari proses penguraian ini larut dalam media, sehingga kekeruhan di sekeliling koloni bakteri akan hilang.
Indikasi Penghambatan Bakteri Aeromonas hydrophila
Uji antagonistik bertujuan untuk mengetahui apakah bakteri yang didapat berpotensi sebagai daya hambat terhadap pertumbuhan bakteri uji patogen. Pengujian dilakukan terhadap 4 isolat murni yang bernilai positif terhadap uji probiotik kasein dan amilum yang akan di uji tantang terhadap bakteri uji Aeromonas hydrophila, Berdasarkan hasil penelitian dengan uji penghambatan Aeromonas hydrophila, diperoleh hasil bahwa ke-4 isolat menunjukkan indikasi penghambatan bakteri A. hydrophila dengan daya hambat masing-masing isolat Entercoccus faecalis 2 mm, Staphylococcus saprophyticus 2 mm, isolat Micrococcus cereus 2 mm isolat dan Bacillus cereus 3 mm.
Uji penghambatan bakteri patogen terhadap kandidat bakteri probiotik yang ditemukan di dalam lambung dan usus ikan menggunakan bakteri patogen Aeromonas hydrophila. Bakteri ini merupakan bakteri yang paling sering menyerang ikan karena bakteri ini merupakan bakteri oportunistik yang hampir selalu terdapat di dalam air dan sering menyerang ikan pada saat sistem pertahanan tubuh ikan sedang menurun akibat stress yang menimbulkan terjadinya bercak merah pada ikan, kerusakan pada kulit, insang dan organ dalam.
Uji penghambatan bakteri patogen biasanya dilakukan secara in vitro. Uji tersebut dapat dilakukan dengan beberapa metoda. Berdasarkan penelitian yang dilakukan, uji penghambatan bakteri patogen A.hydrophila menggunakan metoda paper disk, dimana paper disk yang telah ditanam isolat bakteri kandidat probiotik selanjutnya di letakkan di atas media yang telah disebar isolat bakteri patogen A.hydrophila, zona bening yang terbentuk disekeliling paper disk berisi kultur probiotik menunjukkan terjadinya penghambatan. Hal ini sesuai dengan Irianto (2003) yang menyatakan bahwa metode kertas cakram merupakan metoda yang cukup baik dan cukup kuat manakala daya penghambatannya terlihat baik dibandingkan metoda goresan pararel atau silang yang memiliki banyak kelemahan karena pembentukan isolat probiotik dan pertumbuan bakteri patogen tidak signifikan.
Berdasarkan hasil uji morfologi dan biokimia bahwa salah satu isolat bakteri yang berpotensi sebagai kandidat probiotik yang diperoleh dari usus Ikan Bawal air tawar adalah jenis Enterococcus faecalis yang juga memiliki indikasi penghambatan A. hydrophila. Hal ini sesuai dengan Batrinon (2010) yang menyatakan bahwa Enterococcus memiliki spesies yang berbeda-beda tetapi hanya dua dari mereka yang penting sebagai probiotik yaitu Enterococcus faecim diaplikasikan pada manusia dan hewan sementara Enterococcus faecalis terutama digunakan sebagai probiotik pada manusia.
Enterococcus faecalis merupakan bakteri potensial probiotik pada ikan Bawal air tawar (Colossoma macropomum) karena mampu menghambat pertumbuhan A. hydrophila yang merupakan bakteri patogen yang sering menyerang ikan dengan nilai indikasi penghambatan yaitu 2mm. Sebagaimana
penelitian yang dilakukan oleh Mutmainnah dkk., 2013 yang menemukan 11 isolat berdasarkan uji fisiologi dan biokimia kesebelas isolat menunjukkan karakteristik probiotik. Keseluruhan isolat tersebut tergolong bakteri gram positif dimana isolat A, B, G, J, dan K selnya berbentuk bulat (coccus) diduga tergolong Lactococcus, Streptococcus, Leuconostoc, Enterococcus dan Pediococcus. Isolat C, D, E, F, H, dan I berbentuk batang (basil) diduga Lactobacillus.Keseluruhan isolat mampu tumbuh pada pH rendah maupun pada konsentrasi ox bile 1% dan 5% serta pada suhu rendah dan suhu tinggi. Mampu menghambat pertumbuhan bakteri uji Escherichia coli dan Staphylococcus aureus. Namun semua isolat yang didapat perlu penanganan khusus dalam pengaplikasian terhadap pemberian probiotik pada ikan sebagaimana menurut Trisna (2012), tidak semua bakteri baik dapat dijadikan sebagai probiotik, salah satu bakteri yang berperan sebagai probiotik adalah bakteri asam laktat (BAL).
Staphylococcus saprophyticus merupakan bakteri potensial probiotik yang berhasil di isolasi pada usus ikan Bawal air tawar (Colossoma macropomum). Pada uji indikasi penghambatan terhadap bakteri patogen A. hydrophilla, bakteri ini mampu menghambat pertumbuhan bakteri patogen dengan terbentuknya zona bening disekitar paper disk sebesar 2 mm. Menurut Cowan dan Steel, (1974). jenis Staphylococcus yang berperan dalam proses fermentasi bekasam, seperti S. saprophyticus dan S. Albus. Bakteri Staphylococcus sp. dapat dijadikan sebagai probiotik sebagaimana yang dilakukan pada penelitian Syabani, dkk., (2015) tentang frekuensi penambahan bakteri Staphylococcus sp. pada media pemeliharaan benih Ikan Lele Dumbo untuk meningkatkan ketahanan tubuh ikan lele Dumbo terlihat dari kelangsungan hidup 93,33 % lebih baik dibandingkan
dengan media pemeliharaan yang tidak diberikan bakteri Staphylococcus sp. Bakteri Staphylococcus sp tidak semua bersifat probiotik ada juga yang patogen terutama pada manusia dan hewan lain untuk itu perlu dipertimbangkan bila dijadikan probiotik baik skala labortaorium dan lapangan. Hal ini sesuai dengan Irianto (2005) yang menyatakan salah satu spesies probiotik pada akuakultur yang bakterinya dikenal sebagai patogen bagi manusia dan hewan tentu perlu dipertimbangkan, karena dari sisi usaha akuakultur menjadi tidak sepenuhnya aman.
Dari hasil uji Micrococcus sp merupakan salah satu isolat murni yang ditemukan di saluran pencernaan yang juga memiliki indikasi penghambatan terhadap bakteri patogen. Hal ini sesuai dengan Vine dkk., (2004) menjelaskan bahwa bakteri Micrococcus bersifat non patogen dan memberikan efek yang menguntungkan bagi ikan. Chiu dkk,. (2004) melaporkan bahwa sifat yang menguntungkan dari bakteri Micrococcus dapat digunakan untuk probiotik dalam mencegah penyakit pada ikan. Sebagaimana bakteri ini dapat menghambat pertumbuhan bakteri patogen hal ini sesuai dengan Osman, dkk. (2010), menyatakan bahwa Micrococcus sp. merupakan bakteri yang bermanfaat karena memiliki peran dalam pengendalian penyakit, promotor pertumbuhan dan juga meningkatkan parameter fisiologis seperti aliran darah di antara ikan nila. Selain itu, memiliki efek antagonis terhadap patogen A. hydrophila secara in vitro serta mendukung pertumbuhan dan tingkat kelangsungan ikan nila pada uji secara in vivo.
Berdasarkan hasil uji morfologi dan biokimia bahwa salah satu isolat bakteri yang berpotensi sebagai kandidat probiotik yang diperoleh dari usus Ikan
Bawal air tawar adalah jenis Micrococcus luteus yang juga memiliki indikasi penghambatan A. hydrophila. Dengan demikian Micrococcus luteus merupakan bakteri yang potensial probiotik pada Ikan Bawal air tawar karena menghambat pertumbuhan A. hydrophila. Hal ini sesuai dengan Abd El-Rhman dkk., (2009) yang menyatakan micrococcus luteus yang diisolasi dari gonad dan saluran pencernaan ikan nila menunjukkan aktivitas antimikroba terhadap A. hydrophila dan ditemukan memiliki kemampuan probiotik yang baik untuk meningkatkan pertumbuhan ikan nila dengan penambahan pada pakan, serta memiliki kemampuan untuk mengurangi flora mikroba patogen dan meningkatkan adsorpsi makanan dalam usus.
Uji antagonis pada saluran pencernaan Ikan Bawal air tawar menghasilkan bakteri yang memiliki kemampuan untuk menghasilkan enzim protease dan bakteri potensial probiotik yang dapat menghambat pertumbuhan bakteri patogen yaitu bakteri Bacillus sp dan Stapylococcus sp merupakan kandidat bakteri potensial probiotik yang dapat dipertimbangkan sebagai antibiotik yang berguna bagi budidaya ikan. Hal ini sesuai dengan Kurniasih dkk., (2013) yang menyatakan Bacillus sp merupakan bakteri probiotik yang mampu menghambat pertumbuhan bakteri Vibrio sp dan Aeromonas sp, tetapi tidak dapat menghambat Pseudomonas sp dan ditemukan juga bakteri Stapylococcus sp. Bakteri yang terdapat dalam saluran pencernaan diketahui dapat memberi manfaat untuk meningkatkan aktivitas pencernaan ikan karena kemampuannya mensekresikan berbagai jenis enzim. Pemberian enzim Stapylococcus sp dan Bacillus sp dapat meningkatkan efisiensi pemanfaatan protein pakan dan pembentuk jaringan tubuh.
Dari hasil uji spesies yang didapat adalah bakteri Bacillus cereus merupakan salah satu bakteri yang didapat yang bersifat proteolitik yang dapat menghambat bakteri uji patogen. Pada uji indikasi penghambatan terhadap bakteri patogen A. hydrophilla, bakteri ini mampu menghambat pertumbuhan bakteri patogen dengan terbentuknya zona bening disekitar paper disk sebesar 3 mm. Bakteri B. cereus. Hal ini sesuai dengan Feliatra dkk., (2012), yang menyatakan menemukan efektifitas bakteri probiotik melalui antagonis bakteri probiotik terhadap bakteri patogen pada ikan. Bakteri B. cereus memberikan respon positif yaitu terbentuknya hambatan pada pertumbuhan bakteri Aeromonas sp dan vibrio sp, respon terlihat dengan terbentuknya zona yang terputus oleh adanya pertumbuhan bakteri B. cereus.
Dari ke-4 isolat yang didapat pada penelitian ini menunujukkan bahwa daya hambat yang terbentuk zona bening tidak luas dan hanya menunjukkan indikasi penghambatan, tetapi itu sudah memberikan indikasi bahwa bakteri-bakteri tersebut mempunyai kemampuan menghambat pertumbuhan patogen yang nantinya dapat diteliti lebih mendalam tentang uji penggunaan bakteri tersebut secaran langsung pada ikan (in vivo) dan penggunaannya lebih dipertimbangkan lagi agar tidak terjadi hal yang merugikan bagi ikan budidaya.
KESIMPULAN DAN SARAN
Kesimpulan
1. Isolat bakteri yang diperoleh dari usus Ikan Bawal air tawar (Colossoma macropomum) yang berpotensi sebagai probiotik yaitu Enterococcus faecalis Staphylococcus saprophyticus, Micrococcus luteus, dan Bacillus cereus.
2. Isolat bakteri potensial yang berhasil diidentifikasi menunjukkan indikasi penghambatan terhadap bakteri patogen A. hydrophila dengan nilai hambatan yaitu 2 mm dan 3 mm.
Saran
Identifikasi isolat bakteri potensial probiotik dalam penelitian ini dilakukan berdasarkan karakterisasi secara manual, sehingga perlu dilakukan identifikasi secara molekuler atau Polimeration Chain Reaction (PCR) dan penelitian lebih lanjut terhadap ikan uji secara in vivo dengan pemberian isolat bakteri potensial probiotik pada media air ikan.