BAB II
TINJAUAN PUSTAKA
II.I Tinjauan Secara Umum II.1.1 Tapak Dara
Gambar 2.1 Bunga tapak dara
Tapak dara adalah tanaman tahunan yang berasal dari Madagaskar, namun telah menyebar ke berbagai daerah tropika lainnya. Nama ilmiahnya
Catharanthus roseus (L.) Don. Di Indonesia tumbuhan hias pekarangan ini
dikenal dengan bermacam-macam nama, seperti sindapor (Sulawesi),
kembang tembaga (bahasa Sunda), dan kembang tapak dårå (bahasa Jawa).
Orang Malaysia mengenalnya pula sebagai kemunting cina, pokok rumput
jalang, pokok kembang sari cina, atau pokok ros pantai. Di Filipina ia dikenal
sebagai tsitsirika, di Vietnam sebagai hoa hai dang, di Cina dikenal sebagai
chang chun hua, di Inggris sebagai rose periwinkle, dan di Belanda sebagai
Tabel 2.1 Klasifikasi bunga tapak dara
Kerajaan Plantae (tumbuhan)
Divisi Magnoliophyta (berbunga)
Kelas Magnoliopsida (berkeping dua/dikotil)
Ordo Gentianales
Famili Apocynaceae
Genus Catharanthus
Spesies C. roseus
Kandungan Kimia
Herba tapak dara mengandung alkaloid diantaranya vinkaleukoblastin
(vinblastin), leurokristin (vinkristin), leurosin, vinkadiolin, leurosidin, dan
katarantin (Dalimartha, 1999). Sedangkan pada akar tapak dara mengandung
alkaloid, saponin, flavonoid, dan tanin (Dalimartha, 1999). Kulit akarnya
mengandung 2 % resin fenolik dan 3 % d-kamfor. Selain alkaloid daunnya
menghasilkan resin (oleoresin), sejumlah kecil minyak atsiri. Kandungan
terbesar yang biasa ditemukan adalah senyawa alkaloid pada daun yaitu
vinkristin (C46H56N4O10) dan vinblastin (C46H58N4O9) (Sutarno dan Radjiman
1999).
Habitat
Tapak dara tumbuh di tempat yang berpasir tapi juga dapat tumbuh di
pinggir sungai, vegetasi savanna dan tempat kering, di hutan. Tapak dara
sebagian besar ditemukan di dekat laut tapi seringkali ditemukan hingga 1500
m di atas permukaan laut. Tapak dara dapat hidup di lingkungan yang tidak
terlalu panas.
Morfologi Tanaman
Tapak dara berupa terna atau semak, menahun, tumbuh tegak, tinggi
mencapai 120 cm, banyak bercabang. Batang bulat, bagian pangkal berkayu,
berambut halus, warnanya merah tengguli (Dalimartha, 1999). Bunga
tunggal, keluar dari ujung tangkai dan ketiak daun dengan lima helai mahkota
bunga, entuknya seperti terompet, berwarna putih, ungu, merah muda atau
putih dengan warna merah ditengahnya, tabung mahkota bunga sepanjang
22-30 mm (Wijayakusuma, 2000). Buahnya buah bumbung berbulu,
menggantung, berisi banyak biji berwarna hitam. Perbanyakan dengan biji,
stek batang, atau akar (Dalimartha, 1999).
Cantik dan bermanfaat
Tanaman yang termasuk dalam famili Apocynaceae ini merupakan jenis
tumbuhan dengan berbagai kandungan kimia. Menurut Winarto, ahli tanaman
obat dari Kebun Obat Karyasari, terdapat lebih dari 70 macam alkaloid pada
seluruh bagian tanaman tapak dara. Bahkan di dalam tanaman tapak dara pun
terdapat alkaloid antikanker, yaitu komponen aktif vinblastine dan
leurocristine (vincristine).
Hanya saja, dijelaskan oleh Endah Lasmadiwati, ahli tanaman obat dari
tanaman tapak dara bisa digunakan untuk membuat ramuan obat. Jenis bunga
yang biasa digunakan adalah bunga putih karena sifatnya yang lebih dingin
atau yin.
Tapak dara yang berbunga merah jarang dimanfaatkan. Namun, bunga
merahnya biasa digunakan untuk menghentikan perdarahan. Inilah beberapa
ramuan tapak dara menurut Winarto dan Endah Lasmadiwati, yang berkhasiat
mengatasi beberapa penyakit seperti :
Obat Diabetes
Lima lembar daun tapak dara diseduh dengan satu gelas air
mendidih. Diamkan hingga dingin, kemudian diminum.
Obat Hipertensi
Daun tapak dara kering sebanyak 6-15 gram direbus. Setelah
dingin, diminum.
Obat Bisul atau Bengkak
Tumbuk hingga halus satu genggam daun tapak dara. Tempelkan
pada bagian yang bengkak atau bisul. ( Winarto dan Endah
II.1.2 Senyawa Alkaloid
Dalam dunia medis dan kimia organik, istilah alkaloid telah lama
menjadi bagian penting dan tak terpisahkan dalam penelitian yang telah
dilakukan selama ini, baik untuk mencari senyawa alkaloid baru ataupun
untuk penelusuran bioaktifitas. Senyawa alkaloid merupakan senyawa
organik terbanyak ditemukan di alam. Hampir seluruh alkaloid berasal dari
tumbuhan dan tersebar luas dalam berbagai jenis tumbuhan. Secara
organoleptik, daun-daunan yang berasa sepat dan pahit, biasanya
teridentifikasi mengandung alkaloid. Selain daun-daunan, senyawa alkaloid
dapat ditemukan pada akar, biji, ranting, dan kulit kayu. Bahwa hampir
semua alkaloid di alam mempunyai keaktifan biologis dan memberikan efek
fisiologis tertentu pada mahluk hidup. Sehingga tidaklah mengherankan jika
manusia dari dulu sampai sekarang selalu mencari obat-obatan dari berbagai
ekstrak tumbuhan. Fungsi alkaloid sendiri dalam tumbuhan sejauh ini belum
diketahui secara pasti, beberapa ahli pernah mengungkapkan bahwa alkaloid
diperkirakan sebagai pelindung tumbuhan dari serangan hama dan penyakit,
pengatur tumbuh, atau sebagai basa mineral untuk mempertahankan
keseimbangan ion. Alkaloid secara umum mengandung paling sedikit satu
buah atom nitrogen yang bersifat basa dan merupakan bagian dari cincin
heterosiklik. Kebanyakan alkaloid berbentuk padatan kristal dengan titik
lebur tertentu atau mempunyai kisaran dekomposisi. Alkaloid dapat juga
ditemukan dan dengan berbagai variasi struktur yang unik, mulai dari yang
paling sederhana sampai yang paling sulit ( Sinly Evan Putra, 1999 ).
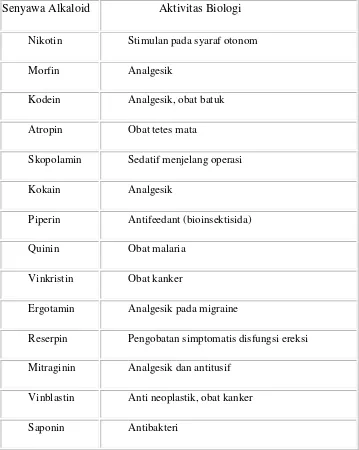
Tabel 2.2 Beberapa contoh senyawa alkaloid
Senyawa Alkaloid Aktivitas Biologi
Nikotin Stimulan pada syaraf otonom
Morfin Analgesik
Kodein Analgesik, obat batuk
Atropin Obat tetes mata
Skopolamin Sedatif menjelang operasi
Kokain Analgesik
Piperin Antifeedant (bioinsektisida)
Quinin Obat malaria
Vinkristin Obat kanker
Ergotamin Analgesik pada migraine
Reserpin Pengobatan simptomatis disfungsi ereksi
Mitraginin Analgesik dan antitusif
Vinblastin Anti neoplastik, obat kanker
II.1.3 Heksane (CH3(CH2)4CH3)
Heksana adalah sebuah senyawa hidrokarbon alkana dengan rumus kimia
C6H14 (isomer utama n-heksana memiliki rumus CH3(CH2)4CH3). Awalan
heks- merujuk pada enam karbon atom yang terdapat pada heksana dan
akhiran -ana berasal dari alkana, yang merujuk pada ikatan tunggal yang
menghubungkan atom-atom karbon tersebut. Seluruh isomer heksana amat
tidak reaktif, dan sering digunakan sebagai pelarut organik yang inert.
Heksana juga terdapat pada bensin dan lem sepatu, kulit dan tekstil. Dalam
keadaan standar senyawa ini merupakan cairan tak berwarna yang tidak larut
dalam air (http://id.wikipedia.org/wiki/Heksana).
Tabel 2.3 Sifat-sifat heksane :
Rumus kimia C6H14
Massa molar 86.18 g mol−1
Penampilan Cairan tidak berwarna
Densitas 0.6548 g/mL
Titik didih 69 °C (342 K)
Kelarutan dalam air 13 mg/L at 20°C[
Viskositas 0.294 cP
Tujuan Menggunakan Heksana
Heksana merupakan pelarut yang dapat membebasankan lemak dari
daun tapak dara karena adanya lemak - lemak akan mengganggu proses
pencarian alkaloid. Heksana sangat cocok untuk mengekstraksi senyawa yang
memiliki kepolaran rendah seperti minyak yang terdapat dalam tapak dara
karena bunga tapak dara mengandung minyak atsiri (Dalimartha, 2001).
II.1.4 Etanol (C2H5OH)
Etanol disebut juga etil alkohol, alkohol murni, alkohol absolut,
atau alkohol saja, adalah sejenis cairan yang mudah menguap, mudah
terbakar, tak berwarna, dan merupakan alkohol yang paling sering digunakan
dalam kehidupan sehari-hari.
Etanol banyak digunakan sebagai pelarut berbagai bahan-bahan kimia
yang ditujukan untuk konsumsi dan kegunaan manusia. Contohnya adalah
pada parfum, perasa, pewarna makanan, dan obat-obatan. Dalam kimia,
etanol adalah pelarut yang penting sekaligus sebagai stok umpan untuk
sintesis senyawa kimia lainnya. Dalam sejarahnya etanol telah lama
Kegunaan Etanol
Etanol dan alkohol membentuk larutan azeotrop. Karena itu pemurnian
etanol yang mengandung air dengan cara penyulingan biasa hanya mampu
menghasilkan etanol dengan kemurnian 96%. Etanol murni (absolut)
dihasilkan pertama kali pada tahun 1796 oleh Johan Tobias Lowitz yaitu
dengan cara menyaring alkohol hasil distilasi melalui arang.
Lavoisier menggambarkan bahwa etanol adalah senyawa yang terbentuk
dari karbon, hidrogen dan oksigen. Pada tahun 1808 Saussure berhasil
menentukan rumus kimia etanol. Lima puluh tahun kemudian
(1858), Coupermempublikasikan rumus kimia etanol. Dengan demikian
etanol adalah salah satu senyawa kimia yang pertama kali ditemukan rumus
kimianya.
Etanol pertama kali dibuat secara sintetik pada tahun 1826 secara
terpisah oleh Henry Hennel dari Britania Raya dan S.G. Sérullas dari
Perancis. Pada tahun 1828, Michael Faraday berhasil membuat etanol dari
hidrasi etilenayang dikatalisis oleh asam. Proses ini mirip dengan proses
sintesis etanol industri modern. Etanol telah digunakan sebagai bahan bakar
lampu di Amerika Serikat sejak tahun 1840, namun pajak yang dikenakan
pada alkohol industri semasa Perang Saudara Amerika membuat
penggunaannya tidak ekonomis. Pajak ini dihapuskan pada tahun 1906, dan
sejak tahun 1908 otomobil Ford Model T telah dapat dijalankan
Tabel 2.4 Sifat-sifat etanol
Rumus molekul C2H5OH
Massa molar 46,07 g/mol
Penampilan Cairan tak berwarna
Densitas 0,789 g/cm3
Titik lebur −114,3 C
Titik didih 78,4 C
Kelarutan dalam air Tercampur penuh
Keasaman (pKa) 15,9
Viskositas 1,200 cP (20 °C)
Momen dipol 1,69 D (gas)
Tujuan Menggunakan Etanol
Etanol merupakan pelarut organik yang biasa digunakan dalam
mengekstraksi senyawa alkaloid dari berbagai tumbuhan. Selain itu,
etanol lebih ramah lingkungan daripada metanol. Penggunaan etanol
96% lebih baik digunakan agar kapang dan kuman sulit tumbuh.
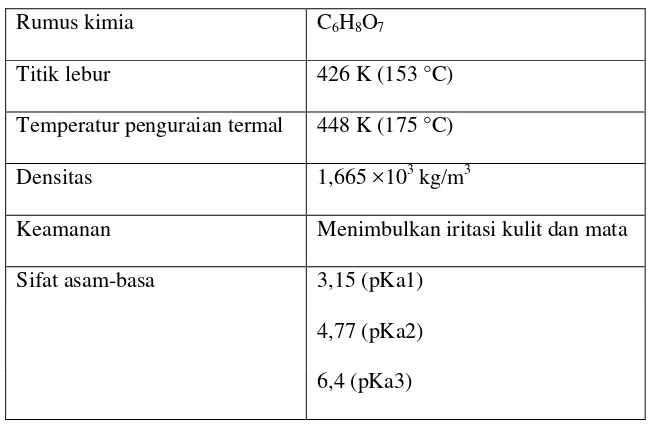
II.1.5 Asam sitrat (C6H8O7)
Asam sitrat merupakan asam organik lemah yang ditemukan pada daun
dan buah tumbuhan genus Citrus (jeruk-jerukan). Senyawa ini merupakan
bahan pengawet yang baik dan alami, selain digunakan sebagai penambah
rasa masam pada makanan dan minuman ringan. Rumus kimia asam sitrat
adalah C6H8O7. Struktur asam ini tercermin pada nama IUPAC-nya, asam
2-hidroksi-1,2,3-propanatrikarboksilat.
Sifat Fisika dan Kimia
Keasaman asam sitrat didapatkan dari tiga gugus karboksil COOH yang
dapat melepas proton dalam larutan. Jika hal ini terjadi, ion yang dihasilkan
adalah ion sitrat. Sitrat sangat baik digunakan dalam larutan penyangga untuk
mengendalikan pH larutan. Ion sitrat dapat bereaksi dengan banyak ion logam
membentuk garam sitrat. Selain itu, sitrat dapat mengikat ion-ion logam
dengan pengkelatan, sehingga digunakan sebagai pengawet dan penghilang
kesadahan air.
Pada temperatur kamar, asam sitrat berbentuk serbuk kristal berwarna
putih. Serbuk kristal tersebut dapat berupa bentuk anhydrous (bebas air), atau
bentuk monohidrat yang mengandung satu molekul air untuk setiap molekul
asam sitrat. Bentuk anhydrous asam sitrat mengkristal dalam air panas,
sedangkan bentuk monohidrat didapatkan dari kristalisasi asam sitrat dalam
air dingin. Bentuk monohidrat tersebut dapat diubah menjadi bentuk
seperti asam karboksilat lainnya. Jika dipanaskan di atas 175 °C, asam sitrat
terurai dengan melepaskan karbon dioksida dan air.
Tabel 2.5 Sifat-sifat asam sitrat :
Rumus kimia C6H8O7
Titik lebur 426 K (153 °C)
Temperatur penguraian termal 448 K (175 °C)
Densitas 1,665 ×103 kg/m3
Keamanan Menimbulkan iritasi kulit dan mata
Sifat asam-basa 3,15 (pKa1)
4,77 (pKa2)
6,4 (pKa3)
II.1.6 Amonium Hidroksida (NH4OH)
Amonium Hidroksida adalah larutan gas amoniak (NH3) dalam air,
berbau khas menusuk hidung H3. Biasanya senyawa ini didapati berupa gas
dengan bau tajam yang khas (disebut bau amonia). Walaupun amonia
memiliki sumbangan penting bagi keberadaan nutrisi di bumi, amonia sendiri
adalah senyawa kaustik dan dapat merusak kesehatan. Administrasi
Keselamatan dan Kesehatan Pekerjaan Amerika Serikat memberikan batas 15
menit bagi kontak dengan amonia dalam gas berkonsentrasi 35 ppm volum,
atau 8 jam untuk 25 ppm volum. Kontak dengan gas amonia berkonsentrasi
tinggi dapat menyebabkan kerusakan paru-paru dan bahkan kematian.
digolongkan sebagai bahan beracun jika terhirup, dan pengangkutan amonia
berjumlah lebih besar dari 3.500 galon (13,248 L) harus disertai surat izin.
Amonia yang digunakan secara komersial dinamakan amonia anhidrat.
Istilah ini menunjukkan tidak adanya air pada bahan tersebut. Karena amonia
mendidih di suhu -33 °C, cairan amonia harus disimpan dalam tekanan tinggi
atau temperatur amat rendah. Walaupun begitu, kalor penguapannya amat
tinggi sehingga dapat ditangani dengan tabung reaksi biasa di dalam sungkup
asap. "Amonia rumah" atau amonium hidroksida adalah larutan NH3 dalam
air. Konsentrasi larutan tersebut diukur dalam satuan baumé. Produk larutan
komersial amonia berkonsentrasi tinggi biasanya memiliki konsentrasi 26
derajat baumé (sekitar 30 persen berat amonia pada 15.5 °C). Amonia yang
berada di rumah biasanya memiliki konsentrasi 5 hingga 10 persen berat
amonia. Amonia umumnya bersifat basa (pKb=4.75), namun dapat juga
bertindak sebagai asam yang amat lemah (pKa=9.25).
http://id.wikipedia.org/wiki/Amonia
Tabel 2.6 Sifat-sifat Amonium Hidroksida :
Rumus molekul NH4OH
Massa molar 17.0306 g/mol
Penampilan Gas tak berwarna berbau tajam
Massa jenis and fase 0.6942 g/L, gas.
Kelarutan dalam air 89.9 g/100 ml pada 0 °C
Titik lebur -77.73 °C (195.42 K)
Titik didih -33.34 °C (239.81 K)
Keasaman (pKa) 9.25
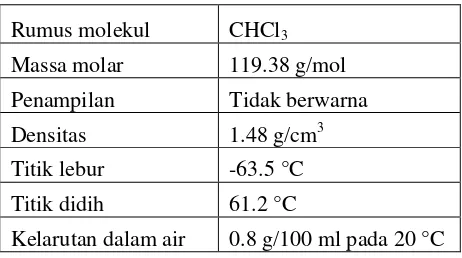
II.1.7 Kloroform (CHCl3)
Kloroform adalah nama umum untuk triklorometana (CHCl3). Kloroform
disebut juga haloform disebabkan karena brom dan klor juga bereaksi dengan
metal keton, yang menghasilkan masing-masing bromoform (CHBr3) dan
kloroform (CHCl3). Hal ini disebut CHX3 atau haloform, maka reaksi ini
sering disebut reaksi haloform. Pembuatan kloroform :
1. Pengfoto kloran metana
2. Menurut reaksi haloform :
Zat + halogen + basa (halogen+basa=atau hipoklorit) CHCl3
Syarat untuk zat ini yaitu yang mempunyai atau pada oksidasi
menghasilkan gugus CH3COO (asetil) yang terikat pada atom H atau C.
Reaksi haloform ini berlangsung dalam tiga tingkat :
1. Oksidasi (bila perlu)
2. Substitusi
3. Penguraian oleh basa
Kegunaan Kloroform
1. Sebagai pelarut
Kloroform adalah pelarut yang umum di laboratorium karena relatif tidak
reaktif, miscible dengan cairan organik yang paling, dan nyaman volatile.
Kloroform digunakan sebagai pelarut dalam farmasi industri dan untuk
efektif untuk alkaloid dalam bentuk basis mereka dan dengan demikian
bahan tanaman biasanya diekstraksi dengan kloroform untuk diproses
farmasi.
2. Sebagai reagen dalam sintesis organik
Sebagai reagen , kloroform berfungsi sebagai sumber CCL
diklorokarbena 2 kelompok. Ia bereaksi dengan air natrium hidroksida
biasanya dalam kehadiran katalis transfer fase untuk menghasilkan
diklorokarbena , CCL 2. Reagen ini efek orto-Formilasi dari diaktifkan
cincin aromatik seperti fenol , memproduksi aril aldehida dalam reaksi
yang dikenal sebagai Tiemann-reaksi Reimer . Atau yang karbena bisa
terperangkap oleh alkena membentuk siklopropana derivatif. Di samping
Kharasch kloroform membentuk radikal bebas CHCl 2 selain alkena.
3. Sebagai obat bius
Kloroform yang pernah menjadi populer anestesi ; uap yang menekan
pada sistem saraf pusat dari pasien, yang memungkinkan dokter
melakukan berbagai prosedur lain yang menyakitkan. Pada 1847, di
Edinburgh dokter kandungan James Young Simpson kloroform
digunakan pertama untuk anestesi umum selama persalinan . Penggunaan
kloroform selama operasi berkembang pesat setelahnya di Eropa. Di
Amerika Serikat, kloroform mulai menggantikan eter sebagai obat bius
pada awal abad ke-20, namun ia dengan cepat ditinggalkan untuk eter
atas penemuan toksisitasnya, terutama kecenderungan untuk
disebut " 's sniffer kematian mendadak ". Neraswara,2009 “Kloroform”
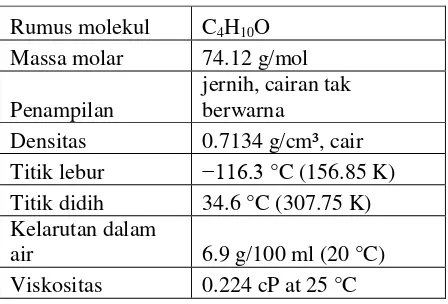
Dietil eter, yang juga dikenal sebagai eter dan etoksi etana, adalah cairan
mudah terbakar yang jernih, tak berwarna, dan bertitik didih rendah serta
berbau khas. Anggota paling umum dari kelompok campuran kimiawi yang
secara umum dikenal sebagai eter ini merupakan sebuah isomernya butanol.
Berformula CH3-CH2-O-CH2-CH3, dietil eter digunakan sebagai pelarut biasa
dan telah digunakan sebagai anestesi umum. Eter dapat dilarutkan dengan
menghemat di dalam air (6.9 g/100 mL).
Penggunaan
Dietil eter merupakan sebuah pelarut laboratorium yang umum dan
memiliki kelarutan terbatas di dalam air, sehingga sering digunakan untuk
ekstrasi cair-cair. Karena kurang rapat bila dibandingkan dengan air, lapisan
eter biasanya berada paling atas. Sebagai salah satu pelarut umum untuk
reaksi Grignard, dan untuk sebagian besar reaksi yang lain melibatkan
berbagai reagen organologam. Dietil eter sangat penting sebagai salah satu
pelarut dalam produksi plastik selulosa sebagai selulosa asetat. Dietil eter
Tabel 2.8 Sifat-sifat dietil eter :
II.1.9 Tinjaun Berdasarkan Pengendapan
Beberapa pengendapan digunakan untuk memisah-misahkan jenis
alkaloid. Reagen sering didasarkan pada kesanggupan alkaloid untuk
bergabung dengan logam yang memiliki berat atom tinggi seperti
merkuri, bismut, tungsten, atau jood. Reagen yang sering digunakan
untuk mengidentifikasi senyawa alkaloid yaitu reagen Dragendorff,
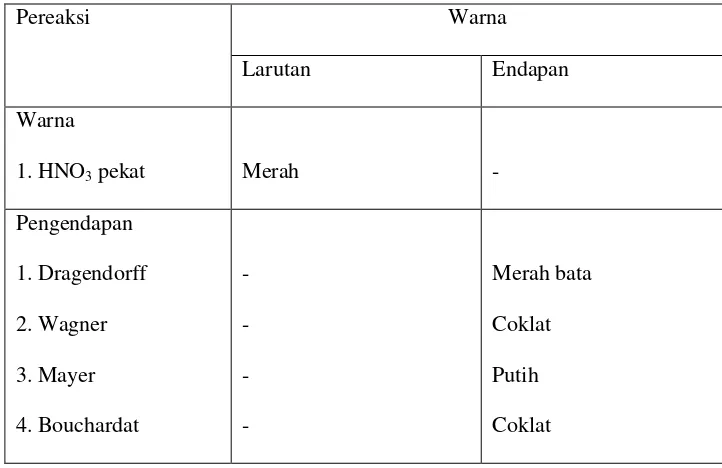
reagen Mayer, reagen Wagner, reagen Bouchardat, dan reagen HNO3.
Reagen Dragendorff mengandung kalium iodida dan bismut nitrat
dalam asam klorida pekat yang akan memberikan endapan warna
merah bata.
Reagen Mayer mengandung merkuri klorida dan kalium Iodida
yang akan memberikan endapan warna putih.
Reagen Bouchardat mirip dengan reagen Wagner dan mengandung
kalium Iodida dan jood. Kedua reagen ini akan memberikan
endapan warna coklat untuk senyawa alkaloid.
Adanya senyawa alkaloid pada tumbuhan dapat juga diuji dengan
HNO3 pekat. Reagen ini akan memberikan warna larutan menjadi
merah.
(http://www.scribd.com/doc/49575733/23/Pembuatan-Larutan-Pereaksi)
Tabel 2.8 Reagen warna dan pengendapan untuk senyawa alkaloid
Pereaksi Warna
Ekstraksi adalah untuk pengambilan semua komponen kimia yang
terdapat dalam simplisia. Ekstraksi ini didasarkan pada perpindahan massa
komponen zat padat ke dalam pelarut dimana perpindahan mulai terjadi pada
lapisan antar muka, kemudian berdifusi masuk ke dalam pelarut. Secara
umum, terdapat empat situasi dalam menentukan tujuan ekstraksi:
1. Senyawa kimia telah diketahui identitasnya untuk diekstraksi dari
ikuti dan dibuat modifikasi yang sesuai untuk mengembangkan proses atau
menyesuaikan dengan kebutuhan pemakai.
2. Bahan diperiksa untuk menemukan kelompok senyawa kimia tertentu,
misalnya alkaloid, flavanoid atau saponin, meskipun struktur kimia
sebetulnya dari senyawa ini bahkan keberadaannya belum diketahui.
Dalam situasi seperti ini, metode umum yang dapat digunakan untuk
senyawa kimia yang diminati dapat diperoleh dari pustaka. Hal ini diikuti
dengan uji kimia atau kromatografik yang sesuai untuk kelompok senyawa
kimia tertentu
Proses pengekstraksian komponen kimia dalam sel tanaman yaitu pelarut
organik akan menembus dinding sel dan masuk ke dalam rongga sel yang
mengandung zat aktif, zat aktif akan larut dalam pelarut organik di luar sel,
maka larutan terpekat akan berdifusi keluar sel dan proses ini akan berulang
terus sampai terjadi keseimbangan antara konsentrasi cairan zat aktif di dalam
dan di luar sel. Ada empat faktor penting yang harus diperhatikan dalam
operasi ekstraksi :
1. Ukuran partikel
Ukuran partikel mempengaruhi kecepatan ekstraksi. Semakin kecil ukuran
partikel maka semakin besar luas permukaan dan akan terjadi kontak
antara padatan dan cairan. Semakin besar partikel, maka cairan yang akan
mendifusi akan memerlukan waktu yang relative lama. Dari penjelasan
ukuran + 0,5 s/d 1 cm lalu di oven dan di gerus hingga menjadi serbuk
agar terjadi kontak secara tepat.
2. Faktor pengaduk
Semakin cepat laju putaran pengaduk partikel akan semakin terdistribusi
dalam permukaan kontak akan lebih luas terhadap pelarut. Semakin lama
waktu pengadukan berarti difusi dapat berlangsung terus dan lama
pengadukan harus dibatasi pada harga optimum agar dapat optimum agar
konsumsi energi tak terlalu besar.
3. Temperatur
Pada banyak kasus, kelarutan material akan diekstraksi akan meningkat
dengan temperatur dan akan menambah kecepatan ekstraksi. Untuk
mendapatkan hasil yang optimal suhu pada proses pengadukan di jaga.
4. Pelarut
Pemilihan pelarut yang baik adalah pelarut yang sesuai dengan viskositas
yang cukup rendah agar sirkulasinya bebas. Umumnya pelarut murni akan
digunakan meskipun dalam operasi ekstraksi konsentrasi dari solute akan
meningkat dan kecepatan reaksi akan melambat, karena gradien konsentrasi
akan hilang dan cairan akan semakin viskos pada umumnya (Coulson, 1955:
721). Di dalam penelitian ini digunakan dua macam pelaut yaitu heksana
dan etanol. Heksana merupakan pelarut non polar sehingga pembebasan
lemak dari daun tapak dara menggunakan pelarut heksana sangat penting
karena adanya lemak - lemak akan mengganggu proses pencarian alkaloid.
kepolaran rendah seperti minyak yang terdapat dalam tapak dara karena
bunga tapak dara mengandung minyak atsiri (Dalimartha, 2001). Etanol
merupakan pelarut organik yang biasa digunakan dalam mengekstraksi
senyawa alkaloid dari berbagai tumbuhan.
(http://irwanfarmasi.blogspot.com/2010/04/ekstraksi-menggunakan-proses-infudasi.html)
II.2.1 Proses Ekstraksi
Proses pengambilan alkaloid dari daun tapak dara ada dua tahap :
1. Serbuk kering daun tapak dara + CH3(CH2)4CH3 larutan minyak daun
tapak dara + heksane
2. Serbuk tahap pertama + C2H5OH larutan alkaloid daun tapak dara +
etanol
Proses ekstraksinya adalah serbuk kering daun tapak dara dilarutkan
pada pelarut CH3(CH2)4CH3. Kemudian pelarut menembus pori – pori dari
padatan dengan bantuan pengadukan untuk mengambil zat terlarut kemudian
dipisahkan dengan cara filtrat dibuang dan residu di oven hingga kering.
Residu yang sudah dikeringkan diekstraksi lagi dengan etanol untuk
mendapatkan alkaloid yang terdapat di dalam daun tapak dara.
II.2.2 Uji Alkaloid Dengan Pengendapan
Uji alkaloid dengan pengendapan melalui beberapa tahap :
1. Ekstrak etanol + C6H8O7 larutan asam sitrat (mencapai pH 3-4)
2. Larutan asam sitrat + Bi (NO3)3.5H2O +3KI endapan coklat
3. Larutan asam + C4H10O larutan asam + eter
4. Larutan asam tahap ketiga + NH4OH larutan basa (mencapai pH 8-9)
5. Larutan basa + CHCl3 larutan basa + kloroform
6. Larutan basa tahap kelima + Bi (NO3)3.5H2O +3KI endapan coklat
kemerahan + larutan basa
Proses pemeriksaan alkaloid dengan reaksi pengendapan adalah ekstrak
etanol ditambahkan asam sitrat 5% hingga pH larutan mencapai pH 3-4.
Penambahan larutan asam diulangi beberapa kali sampai larutan tersebut
memberikan hasil negatif terhadap reagen penguji alkaloid. Disaring lalu
residu dibuang dan larutan asam yang diperoleh dikocok dengan eter
beberapa kali hingga fraksi eter yang terakhir tidak berwarna. Selanjutnya
larutan asam dibasakan dengan amonium hidroksida pekat hingga pH larutan
mencapai pH 8-9. Larutan basa yang diperoleh dikocok dengan kloroform
sampai tidak berwarna. Kemudian ditambah reagen dragendorff 5 ml sampai
menghasilkan endapan coklat kemerahan.
II.3Hipotesis
Pengambilan alkaloid dari daun tapak dara dapat dilakukan melalui
proses ekstraksi dengan memperhatikan faktor-faktor yang mempengaruhinya
BAB III
METODOLOGI PENELITIAN
III.1 Bahan yang Digunakan
Penelitian ini menggunakan bahan baku daun tapak dara yang di ambil
di Magetan, Jawa Timur. Etanol, heksana, kalium iodida, bismut subnitrat,
aquades, kertas saring, asam sitrat, eter, amonium hidroksida, kloroform
dibeli dari PT. BRATACO Surabaya.
III.2 Alat yang Digunakan
Peralatan yang digunakan terdiri atas alat utama dan alat penunjang alat
utama yaitu seperangkat alat ekstraksi (pengaduk, motor pengaduk , statif,
tangki ekstraksi). Sedangkan penunjang oven waterbath, neraca digital, ayakan, erlenmeyer, pipet tetes, spatula, gelas ukur, labu ukur, kertas saring, thermometer, beaker glass.
III.3 Variabel Yang Digunakan
Variabel Tetap :
1. Volume pelarut : 150 ml
2. Ukuran ayakan : 100 mesh
3. Berat bahan : 25 gram
4. Suhu ekstraksi : 60 - 78 0C
Variabel Peubah :
1. * Waktu ekstraksi heksane (jam) : 1 ; 1,5 ; 2 ; 2,5 ; 3
* Waktu ekstraksi etanol (jam) : 1 ; 1,5 ; 2 ; 2,5 ; 3
2. Kecepatan pengadukan (rpm) : 100 ; 125 ; 150 ; 175 ; 200
III.4 Prosedur Penelitian
Proses penelitian yang dijalankan adalah sebagai berikut :
1. Persiapan Bahan
Daun tapak dara dibersihkan dari kotoran – kotoran dan di cuci
himgga bersih. Dikeringkan dengan menggunakan oven hingga suhu 100
0
C untuk menghilangkan kadar airnya. Lalu di tumbuk hingga halus.
2. Jalannya Proses Ekstraksi
Daun Tapak dara yang sudah halus di timbang sesuai dengan berat
pada variabel yang di tetapkan, kemudian masukkan ke dalam beaker
glass dan di tambahkan pelarut heksana. Di ekstraksi untuk
menghilangkan lemak pada daun, di lakukan beberapa kali hingga lemak
di perkirakan habis. Ekstrak heksana yang di dapat di sisihkan,
kemudian serbuknya di keringkan sampai bebas heksana lalu di ekstraksi
dengan etanol 96 %. Tahap ini di lakukan beberapa kali hingga semua
senyawa yang terkandung dalam daun tapak dara telah tertarik semua.
3. Pemeriksaan Alkaloid Dengan Reaksi Pengendapan
Ekstrak etanol dimasukkan kedalam beaker glass, sambil diaduk
ditambahkan asam sitrat 5% hingga pH larutan mencapai pH 3-4. Larutan
asam ditambahkan reagen dragendroff penguji alkaloid. Larutan asam
yang diperoleh dikocok dengan eter hingga tidak berwarna.
Selanjutnya larutan asam dibasakan dengan amonium hidroksida
pekat hingga pH larutan mencapai pH 8-9. Larutan basa yang diperoleh
ditambahkan kloroform kemudian ditambahkan reagen dragendroff
penguji alkaloid sebanyak 5 ml.
4. Pembuatan Pereaksi Dragendorff
Larutan pereaksi dragendorff di buat terlebih dahulu. Sebanyak 8
gram KI dilarutkan dalam 20 ml aquades. 0,85 gram bismut subnitrat
dilarutkan dalam 40 ml aquades, kemudian kedua larutan ini
Pemeriksaan Alkaloid Dengan Pengendapan
+ Asam sitrat 5% (pH 3-4)
Larutan asam ditambah reagen dragendorff sampai coklat kemerahan
Saring
Dikocok dengan eter hingga larutan tidak berwarna
+ Amonium hidroksida (pH 8-9)
Ditambahkan kloroform sampai tidak berwarna
Kemudian ditambah reagen dragendorff 5 ml sampai menghasilkan endapan coklat kemerahan
Gambar 3.1 Blok diagram proses identifikasi alkaloid dalam daun tapak dara Residu
Larutan Asam
Ekstrak etanol
Residu dibuang
BAB IV
HASIL DAN PEMBAHASAN PENELITIAN
IV.1 Hasil Analisis Bahan Baku
Berdasarkan uji Balai Penelitian dan Konsultasi Industri (BPKI)
Surabaya - Jawa Timur, pada analisa bahan baku yaitu daun tapak dara
yang sudah ditumbuk hingga halus dengan berat 25 gram diperoleh
komposisi untuk masing-masing zat reduktor dengan acuan metode
Spektrofotometer sebagai berikut:
Tabel 4.1 Analisis bahan baku
No Parameter Hasil Satuan
1 Minyak Atsiri 0,46 %
IV.2 Hasil Penelitian
Data hasil penelitian yang diperoleh dari penelitian ekstraksi dari daun
tapak dara dengan menggunakan perbandingan waktu ekstraksi etanol 1 ;
1,5 ; 2 ; 2,5 ; 3 (jam) dengan kecepatan pengadukan 100; 125; 150; 175;
200 (rpm) adalah sebagai berikut:
Tabel 4.2 Pengaruh perbandingan waktu ekstraksi dan kecepatan
pengadukan terhadap kadar alkaloid dalam daun tapak dara
IV.3 Pembahasan
Grafik 4.1 Hubungan antara kadar alkaloid dengan waktu ekstraksi
Berdasarkan tabel diatas terlihat bahwa waktu ekstraksi sangat
menentukan kadar alkaloid. Dari grafik dapat dilihat bahwa ekstraksi
semakin lama dan semakin cepat pengadukannya semakin bertambah kadar
alkaloidnya dapat dilihat pada waktu ekstraksi selama 1 sampai 2,5 jam.
Hal ini terjadi karena semakin lama waktu ekstraksi maka kontak antara
pelarut dengan bahan yang diekstraksi semakin baik, maka kontak antara
solute dan solven akan semakin lama sehingga proses akan dapat berjalan
baik. Semakin cepat laju putaran pengaduk partikel akan semakin
terdistribusi dalam permukaan kontak akan lebih luas terhadap pelarut.
Meskipun kenaikan grafik diatas tidak terlalu curam tetapi kadar yang
diperoleh semakin lama semakin besar. Kondisi terbaik terjadi pada waktu
ekstraksi selama 2,5 jam dengan kecepatan pengadukan 200 rpm diperoleh
3 jam terjadi penurunan, hal ini disebabkan karena terlalu lama solute di
ekstraksi maka kandungan alkaloid yang didapat semakin berkurang.
Berdasarkan dari tabel diatas juga terlihat bahwa reagen Dragendroff
memberikan hasil yang positif pada alkaloid dengan memberikan endapan
warna cokelat kemerahan dan hasil yang di peroleh dari penelitian terdahulu
menggunakan reagen Mayer memberikan endapan warna putih (Topan
Waskito, 1999) dan Ita Mustikawati, 2005 menggunakan reagen Wagner
BAB V
KESIMPULAN DAN SARAN
V.1 Kesimpulan
Berdasarkan uraian dari hasil penelitian dan pembahasan dapat ditarik
kesimpulan bahwa kadar alkaloid tertinggi diperoleh pada waktu ekstraksi
selama 2,5 jam dengan kecepatan pengadukan 200 rpm sebesar 19,73 %.
V.2 Saran
Bagi peneliti yang akan mengembangkan penelitian ini dapat mencoba
menggunakan pelarut lain untuk mengekstraksi alkaloid dari daun tapak dara
DAFTAR PUSTAKA
Bhattacharyya, S.S., Mandal, S.K., 2008, In Vitro Studies Demonstrate Anti-
cancer Activity of an Alkaloid of a Plant (Gelsemiun sempervirens),
Experimental Biology and Medicine, 233(12):1591-601.
Coulson, 1955: 721, http://himapet.multiply.com/journa, di akses 27 Desember
2011
Dalimartha, 1999. etd.eprints.ums.ac.id/1542/, di akses 27 Desember 2011
Dalimartha, 2001. http://etd.eprints.ums.ac.id/10900/3/BAB_I.pdf, di akses 27
Desember 2011
Hariana, 2006. http://etd.eprints.ums.ac.id32811K100040026.pdf, di akses 27
Desember 2011
Leonindita, P. D., 2009, Formulasi Tablet Ekstrak Herba Tapak Dara (Catharantus
roseus (L) G. Don) Dengan Bahan Pengikat Gelatin Dan Gom Arab Pada
Berbagai Konsentrasi.
http://www.scribd.com/doc/49575733/23/Pembuatan-Larutan-Pereaksi, di akses 27 Desember 2011
Lenny, 2006, Senyawa Flavanoida, Fenilpropanida dan Alkaloida, Karya Ilmiah
Departemen Kimia Fakultas MIPA Universitas Sumatera Utara.
repository.usu.ac.id/bitstream/123456789/1842/1/06003489.pdf, di akses 24
Februari 2012
Mustikawati, Ita., 2006. Isolasi dan Identifikasi Senyawa Golongan Alkaloid dari
Daun Gendarussa Vulgaris Nees, Skripsi, Fakultas Farmasi Universitas
Airlangga, Surabaya
Padmanabha, B. V., Chandrashekar, M., 2006, Pattern of Accumulation
of Camphotechin, an Anti – cancer Alkaloid in Nothapodytes
nimmoniana Graham., Current Science, 90(1):95-100.
eprints.undip.ac.id/25181/1/indah.pdf, di akses 27 Desember 2011
Perry, R.H., 1999,” Chemical Engineering Handbook”, 7th Edition,Mc-Graw-
Putra, Sinly Evan.” Alkaloid : Senyawa Organik Terbanyak di Alam”,
http://www.chem-is-try.org/artikel_kimia/biokimia/alkaloid_
senyawa_organik_ terbanyak_di_alam/,di akses 28 Desember 2011
Srivastava, S.K., Khan, M., Khanuja, S.P.S., 2005, Process for Isolation of
Anticancer Agent Camptothecin from Nothapodytes foetida, US patent no
6893668.
Sutarno dan Radjiman, 1999.
http://mamaraihand.blogspot.com/2009/07/kanker-payudara-dapat-disembuhkan.html, di akses 28 Desember 2011
Waskito, Topan, 1999. Isolasi dan Uji Aktivitas Alkaloid dari Daun Tapak Dara
(Catharantous Roseus) Var Albus, Skripsi, Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Diponegoro, Semarang
Wijayakusuma, 2000. etd.eprints.ums.ac.id/1542/, di akses 27 Desember 2011
Winarto dan Endah Lasmadiwati.”Khasiat Tanaman Obat Tapak Dara, Tapak
KudadanTapakLiman”.http://www.ubb.ac.id/menulengkap.php?judul=Khasi
at%20Tanaman%20Obat%20Tapak%20Dara,%20Tapak%20Kuda%20dan
%20Tapak%20Liman&&nomorurut_artikel=175, di akses 28 Desember
2011
Saputera, Yoky Edy.” Spektrofotometri.
http://www.chem-is-try.org/artikel_kimia/kimia_analisis/spektrofotometri/, di akses 28
Desember 2011
Zhou, D., Zhao, K., Ping, W., Jun, L., 2005, Study on Mutagensis of Protoplast
from Taxol-Producing Fungus Nodulisporium sylviforme, The Journal of
APPENDIKS
Pembuatan Asam Sitrat 5 % dengan volume 100 ml
% W = W
1x 100 %
Sebanyak 8 gram KI dilarutkan dalam 20 mL aquades. 0,85 gram bismut
subnitrat dilarutkan dalam 40 mL aquades, kemudian kedua larutan ini
dicampurkan dan diencerkan sampai volumenya 100 mL, kemudian disimpan
dalam botol berwarna gelap. Reaksi yang terjadi :
LAMPIRAN
Proses kegiatan selama penelitian
1. Persiapan Bahan
* Daun tapak dara yang * Kemudian dioven * Setelah di oven
telah dibersihkan ditumbuk hingga halus
2. Jalannya Proses Ekstraksi
* Di ekstraksi dengan * Disaring, residu di oven * Ketika selesai di oven n-heksana
3. Pemeriksaan Alkaloid Dengan Reaksi Pengendapan
* Ekstak etanol * Lalu ditambahkan * Disaring, filtrat ditambahkan asam sitrat reagen Dragendroff disimpan
* Dikocok dengan eter * Larutan basa dikocok Dengan reagen dragendroff
Pembuatan Pereaksi Dragendorff