BAHAN dan METODE PE NELITIAN
Tempat dan waktu percobaan
Isolat kapang L. giganteum dicari pada larva nyamuk Anopheles, Culex dan Aedes. yang ada di desa lingkar Kampus IPB di sekitar Cikarawang, Kabupaten Bogor. Isolasi dan identifikasi serta penentuan dosis efektif dilakukan di Laboratorium Mikologi Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner , Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Proses pembuatan pewarnaan untuk pengamatan mekanisme infeksi dilakukan di Laboratorium Histologi Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Rearing nyamuk dilakukan di Laboratorium Pengendalian Hayati, Pusat Antar Universitas (PAU), Institut Pertanian Bogor. Penelitian dilaksanakan mulai tahun 2001 sampai tahun 2005.
Bahan dan Alat
Bahan dan alat utama yang digunakan dalam penelitian ini adalah larva nyamuk dari berbagai genus yang diperoleh di sekitar Bogor, larva nyamuk hasil peliharaan. Media agar yang terdiri dari Sabouraud Dextrose Agar (SDA), Medium PYG, Medium Z, Medium Telur Air (EWM), Cotton seed oil, Cotton seed flour, Tepung gandum, Minyak jagung, Larutan Hipochlorid, MgCl2, CaCl2,
Air bebas ion, Aquades, Pewarna Lugol, Lactophenol Cotton Blue (LPCB), Toluidin Blue. Alat utama yang digunakan Mikroskop, Shaker waterbath, Haemocytometer, cawan petri, Inkubator dan lain-lain. Bahan dan alat secara detail akan dijelaskan pada metode masing-masing tahap perc obaan.
Percobaan 1.
Isolasi dan Identifikasi Kapang Entomopatogen Lagenedium giganteum dari larva Nyamuk asal Daerah Sekitar Desa Cikarawang Bogor Sebagai
Kandidat Agen Pengendali Hayati
METODE PENELITIAN
1. Pengambilan Sampel Larva Nyamuk
Larva nyamuk diambil dari persawahan yang sudah ditinggalkan didaerah sekitar Cikarawang, Kabupaten Bogor. Pengambilan sampel dilakukan dengan menggunakan ciduk dan diambil secara acak. Waktu pengambilan dilaksanakan sampai 7 kali. Larva yang sudah diambil dimasukkan dalam tempat yang terbuat dari plastik polietilen yang diisi air. Selanjutnya sampel larva dibawa ke Laboratorium untuk dilakukan isolasi dan identifikasi terhadap kapang.
2. Isolasi Kapang dari Larva Nyamuk
Larva asal lapangan dicuci bersih dengan menggunakan larutan NaCl fisiologis dan kemudian dicuci ulang menggunakan larutan Hipoklorit 0,5% . Pencucian ini bertujuan untuk menghilangkan kontaminan-kontaminan yang tidak diinginkan. Larva kemudian dihancurkan menggunakan penggerus kaca steril dan kemudian dibiakkan ke dalam lempengan agar Sabaurauds Dextrose Agar (SDA) yang sudah ditambah Antibiotika 0,2%. Biakan kemudian diinkubasi pada suhu 250C dalam ruangan gelap selama 7-14 hari. Setelah koloni kapang tumbuh dilakukan pengamatan makroskopis koloni dengan cara melihat gambaran bentuk dari koloni, sifat pertumbuhan, warna koloni, ukuran , topografi dan tekstur koloni. Selanjutnya dilakukan pemeriksaan mikroskopis untuk melihat gambaran morfologi dengan menggunakan bantuan mikroskop. Metode yang
digunakan untuk pemeriksaan morfologi ini adalah dengan metode secara natif, dan untuk melihat morfologi secara jelas, koloni kapang yang terbentuk dibiakkan kembali dengan metode Slide culture Riddel pada suhu 25oC selama 10 hari. Dalam pengamatan secara mikroskopis menggunakan Lactophenol Cotton Blue sebagai bahan pewarnaan.
3. Pemurnian Isolat Kapang
Isolat kapang yang tumbuh di media SDA, masing-masing dikelompokkan berdasarkan morfologi baik secara makroskopik dan mikroskopik. Selanjutnya masing-masing isolat dimurnikan dengan menginokulasikan kembali pada media agar lempeng SDA yang ditambah antibiotik dan diinkubasi pada suhu kamar selama 3-10 hari.
4. Identifikasi Kapang
Identifikasi kapang dila kukan secara makroskopik dan mikroskopik. Secara makroskopik diamati bentuk, warna, sifat pertumbuhan, ukuran, topografi dan tekstur koloni. Pengamatan secara mikroskopik dilakukan setelah kapang dibiakkan pada media agar dengan menggunakan metode slide culture. Dalam pembuatan slide culture, sebelumnya disiapkan terlebih dahulu cawan petri yang didalamnya terdapat gelas obyek, gelas penutup, pipa U, dan kertas saring yang semuanya dalam keadaan steril. Pada kaca obyek yang ditopang dengan pipa U diletakkan potongan agar berukuran 1x1 cm2 dan dari keempat sisi agar tersebut dengan menggunakan os ë, kapang yang akan diidentifikasi diambil dan ditempelkan dalam jumlah secukupnya. Tahap selanjutnya adalah potongan agar ditutup dengan gelas penutup. Kertas saring dibasahi dengan aquades steril yang
berfungsi untuk menjaga kelembaban. Semua isolat diinkubasikan pada suhu kamar selama satu minggu. Kapang diidentifikasi dengan cara memindahkan gelas penutup dari potongan agar menggunakan pinset dan menempatkannya diatas gelas obyek yang telah ditetesi pewarna lactophenol cotton b lue, kemudian diamati dibawah mikroskop dan diidentifikasi (Fisher dan Cook 1998; Humber 1998; Butt et al. 2001).
5. Pemeliharaan isolat L. giganteum
Pemeliharaan isolat hasil identifikasi dilakukan pada media yang mengandung SDA, sedangkan kapang L. giganteum dilakukan pemeliharaan ke dalam media khusus. Salah satu media yang digunakan untuk pemeliharaan L. giganteum adalah seperti apa yang dilakukan oleh Kerwin dan Wasino (1983) yaitu media agar 2% (w/v) yang mengandung kuning telur segar, Whole milk, glukosa dan peptone dengan per bandingan 70:20:20:10 g/liter. Miselium yang berasal dari biakan murni diambil dengan menggunakan os ë steril dan dipindahkan kedalam media yang berisi kuning telur dan di inkubasi pada suhu 260C selama 1 minggu dalam ruang gelap.
HASIL dan PEMBAHASAN
Isolasi dan identifikasi
Larva nyamuk yang diambil dari persawahan yang telah ditinggalkan di daerah sekitar Cikarawang Kabupaten Bogor diidentifikasi terlebih dahulu dan diidentifikasi sebagai larva nyamuk Culex, Anopheles dan Aedes. Larva diambil (dengan menggunakan ciduk) kemudian dibersihkan dengan cara mencuci
menggunakan aquades steril dan dibilas menggunakan Larutan Hipokhlorit 0,5% yang berfungsi sebagai disinfektan. Setelah dicuci, dilakukan penggerusan, kemudian dilakukan isolasi pada media SDA yang ditambah dengan antibiotik. Setelah diinkubasi selama satu minggu dari beberapa kali percobaan dihasilkan 10 macam koloni kapang yaitu kapang, Aspergillus niger, Aspergillus fumigatus, Penicillium sp., Verticillium sp., Mucor sp., Syncephalastrum sp., Gliocladium sp., Beauveria sp. dan kapang L. giganteum.
Menurut Beneke dan Rogers (1970) kapang Aspergillus, Mucor, Penicillium, Syncephalastrum dan Gliocladium merupakan kapang-kapang saprofit yang umum ditemukan pada material klinis, sebagai kontaminan laboratorium dan pada kondisi te rtentu kapang ini akan menjadi bersifat patogen. Kapang Aspergillus dan Penicillium merupakan kapang kontaminan yang umum ditemukan pada bangkai serangga (Humber 1998). Menurut Butt (2001) bahwa L. giganteum, Verticillium sp., dan kapang Beauveria sp., telah dikenal berpotensi sebagai kapang pengendali hayati. Kapang Aspergillus kelompok A yang berasal dari Daerah Curug, Bogor mempunyai patogenisitas paling tinggi terhadap larva nyamuk Ae. aegypti, yaitu mampu membunuh 90% populasi larva instar II, 85% larva instar III serta 82.50% pada larva instar IV dalam waktu 12 jam pada konsentrasi 201.0/mm3 sedang untuk Penicillium sp mampu membunuh 67.50% larva instar II, 55% pada instar III dan 55% instar IV (Natalia 2000).
Aspergillus fumigatus secara makroskopis gambaran koloni mempunyai warna hijau kebiruan yang dikelilingi warna putih pada bagian pinggirnya, topografi flat dan menyebar dengan tekstur seperti serbuk halus dan sifat pertumbuhannya cepat yaitu 2-5 hari. Secara mikroskopik mempunyai hifa yang
bersepta, konidiofor tidak bercabang, pada bagian ujung konidiofor membesar membentuk vesikel yang bulat seperti buah pear. Permukaan dari vesikel dipenuhi oleh fialid yang berbentuk seperti botol. Konidia sedikit ramping dan kasar memenuhi ujung dari fialid (Campbell et al. 1996).
Aspergillus niger secara makroskopik berwarna hitam, topografi flat dan kadang ditemukan bentukkan topografi yang melipat dengan tekstur bergranula. Pada permukaan bagian belakang berwarna krem. Secara mikroskopis mempunyai hifa bersepta dengan konidiofor berdinding tebal, halus dan tidak berwarna. Vesikel berbentuk bulat dan di bagian permukaan dipenuhi oleh fialid dan metulae. Konidia berbentuk bulat, kasar dan me nempel diatas metulae (Larone 1976; Campbell et al. 1996; Fischer dan Cook 1998).
Penicillium sp. secara makroskopik berwarna hijau kebiruan dengan bagian tepi berwarna putih, koloni seperti beludru dan topografi flat sampai keriput dengan tekstur granuler dan sifat pertumbuhannya cepat. Secara mikroskopis hifa bersepta, konidiofor bercabang dan mempunyai metulae. Pada metulae terdapat fialid yang berbentuk botol dengan ditempeli konidia yang bulat dan tersusun berantai dan susunanya sangat karakteristik (Campbell et al. 1996; Fischer dan Cook 1998).
Menurut Larone (1976), kapang M ucor secara makroskopik koloni pada permulaan pertumbuhan berwarna putih dan makin lama berwarna abu-abu. Pada permukaan koloni berwarna hitam. Topografi seperti kapas dengan pertumbuhan miselium ke arah permukaan dan mempunyai tekstur flocose dengan tipe pertumbuhan sangat cepat yaitu 2-4 hari. Secara mikroskopis hifa tidak bersepta dan berdinding tebal, mempunyai rizoid. Sporangia berbentuk sperik dengan
kolumela yang besar dan spora berwarna hijau keabuan. Menurut Fisher dan Cook (1998) bahwa kapang ini merupakan kapang kontaminan dan bersifat oportunis patogen.
Menurut Vuillemin (1912) kapang Beauveria bassiana memiliki laju pertumbuhan sedang dengan diameter koloni mencapai 1 sampai 3 cm. Topografi dari kapang ini seperti flat dan tekstur seperti kapas dan bergranula. Secara mikroskopik sel konidiogen memanjang, hifa bersepta dengan konidiofor halus dan tidak berwarna. Konidia berbentuk globosa, ovoid subglobosa. Didalam pengendalian hayati kapang ini sudah menjadi produk komersil dan banyak diterapkan sebagai musuh hayati belalang (Butt et al. 2001).
Kapang L. giganteum merupakan kapang yang bersifat patogen fakultatif pada larva nyamuk (Lord dan Robert 1986). Kapang L. giganteum diketahui dapat menyebabkan terjadinya mortalitas yang tinggi pada populasi nyamuk dibeberapa laboratorium khususnya dari genus Culex (Merriem dan Axtell 1982; Jaronski dan Axtell 1983), Mansonia (Cuda et al. 1997) dan Anopheles (Kerwin dan Was hino 1987). Kerwin (2004) mengatakan bahwa kapang L. giganteum tidak dapat menginfeksi larva kumbang air, capung dan tanaman air.
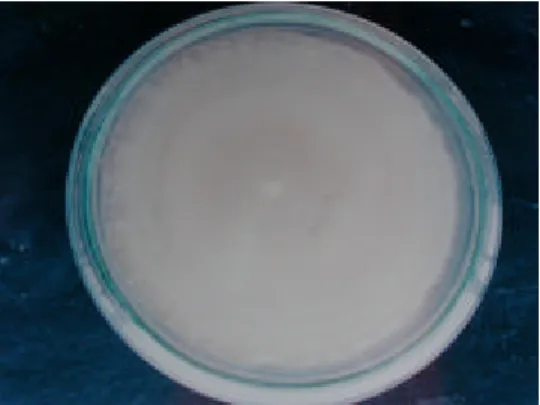
Dari hasil isolasi dan identifikasi (William 1961; Fisher dan Cook 1998) yaitu dengan cara melihat secara makroskopik dan mikroskopik dalam penelitian ini, salah satu isolat yang ditemukan adalah L. giganteum. Secara makroskopik dengan melihat koloni yang terbentuk maka diperoleh hasil bahwa bentuk koloni bulat, tekstur globrous dengan topografi flat dan warna putih keabuan. Waktu yang digunakan untuk pertumbuhannya adalah 7 hari (Gambar 1).
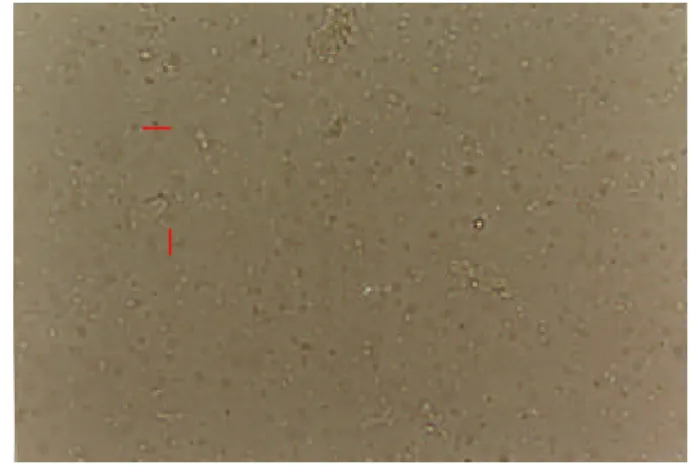
Menurut Kerwin (2000) gambaran makroskopik kapang Lagenidium pada tahap infektif pada larva yang terinfeksi menunjukkan koloni yang sangat karakteristik dan berwarna putih keabuan. Dari hasil pengamatan secara mikroskopik kapang hasil identifikasi mempunyai miselium soenositik dan hifa bersepta, mempunyai vesikel, dan sporangium (Gambar 2). Menurut Dwidjoseputro (1978) pada Lagenidium hifanya terbagi atas beberapa sel dan diantara sel-selnya akan berubah menjadi gametangium dan sporangium dan bentuk spora bulat sampai oval. Gambaran morfologi secara mikroskopik kapang L. giganteum yang berhasil diidentifikasi menunjukkan morfologi yang terlihat secara jelas setelah dilakukan subkultur dengan metode slide culture Riddel (Campbell dan Stewart 1990) (Gambar 3).
Gambar 1. : Koloni kapang L .giganteum dalam media PYG
Gambar 2:Mikroskopik L . giganteum dengan metode natif 10x (a.sporangium)
Gambar 3 : Mikroskopik dengan Slide culture Riddel perbesaran 10x (a. Hifa; b.sporangium)
Lagenidium merupakan kapang yang tumbuh di air tawar dan bersifat parasit fakultatif. Kapang ini hidup secara vegetatif sebagai saprofit pada tanaman busuk atau serangga yang sudah mati dan bersifat parasit pada fitoplankton dan hewan lain di air (Stoskopf 1993). Morfologi dari L. giganteum adalah mempunyai hifa bersepta yang membagi hifa menjadi beberapa segmen yang kadang menyempit pada bagian septanya (Couch,1935 dalam Misman 1990), tiap-tiap segmen kemudian berubah menjadi suatu sporangium atau gametangium. Protoplast dari sporangium membagi diri menjadi zoospora (Dwidjoseputro 1978). Dalam siklus hidupnya Lagenidium mempunyai 2 cara yaitu secara aseksual (zoospora) dan seksual (oospora). Menurut Brady (1981), zoospora merupakan tahapan infektif terhadap larva nyamuk dan dapat mengakibatkan kematian. Untuk mendapatkan stadium infektif ini maka diperlukan pembiakan kembali pada media biakan yang mampu memicu terjadinya zoosporogenesis.
KESIMPULAN Dari penelitian ini dapat disimpulkan sebagai berikut:
1. Berdasarkan hasil isolasi dan identifikasi diperoleh 9 isolat kapang meliputi kapang Aspergillus niger, Aspergillus fumigatus, Penicillium sp., Verticillium sp., Mucor sp., Syncephalastrum sp., Gliocladium sp., Beauveria sp. dan kapang L. g iganteum, yang berasal dari larva nyamuk Culex, Anopheles dan Aedes .
2. Karena kemampuannya di dalam membunuh larva nyamuk maka isolat L. giganteum dijadikan kandidat kapang pengendali hayati.
Percobaan 2
Pengaruh Media Biakan terhadap Proses Zoosporogenesis dan Oosporogenesis dari Lagenidium .giganteum
METODE PENELITIAN
1. Pemeliharaan Isolat K apang L. giganteum
Di laboratorium setiap bulan dilakukan subkultur isolat kapang L. giganteum seperti yang dilakukan oleh Kerwin and Wasino (1986), yaitu
menumbuhkan kembali pada media agar 2% (w/v) yang mengandung kuning telur segar, whole milk, glukosa dan pepton dengan perbandingan 70:20:20:10 g/lt. Setelah dilakukan subkultur kemudian diinkubasi pada suhu ruangan selama 7-14 hari dalam ruangan gelap. Dalam pembuatan media selalu ditambah dengan antibiotik 0.2%.
2. Isolasi dan Produksi Zoospora
Untuk isolasi zoospora digunakan kombinasi 2 media biakan yaitu media PYG dan media Z. Media PYG berisi 1,25 gr pepton, 1,25 gr yeast ekstrak dan 3,0 gr glukosa ditambah suplemen 1,5 g/lt minyak jagung. Media Z (Domnas et al, 1983) berisi 1,25 gr yeast ekstrak, 1,2 gr glukosa, 3,2 gr tepung gandum dan 1.2 gr hemp seed extract . Untuk menginduksi proses zoosporogenesis digunakan juga air bebas ion.
Miselium hasil subkultur dipindahkan kedalam tabung erle nmeyer yang berisi 250 ml medium PYG. Pemindahan dilakukan secara aseptis dan kemudian diinkubasi pada suhu 250C didalam shaker watebath (120 rpm) selama 4 hari. Pada hari keempat semua miselium dipindahkan ke tabung erlenmeyer yang berisi
250 ml medium Z, dan diinkubasi kembali seperti perlakuan pada saat menggunakan medium PYG.
Empat hari kemudian miselium dipanen dengan cara menyaring menggunakan kertas saring. Miselium hasil panenan ditimbang dan diambil 0,2 gr berat basah. Hasil timbangan kemudian dilarutkan kedalam 1000 ml air bebas ion. Untuk menghitung jumlah zoospora yang dihasilkan dari hasil miselium yang telah dilarutkan diambil 5 ml dan dimasukkan ke dalam cawan petri dan diinkubasikan pada suhu kamar selama 2 hari dalam ruang yang gelap. Dua hari kemudian akan tampak adanya suatu lapisan tipis/germline pada permukaan bawah cawan petri. Germline ini merupakan kelompok-kelompok zoospora yang terbentuk.
3. Isolasi dan Produksi Oospora
Menurut Kerwin et al. (1985) metode yang digunakan untuk menginduksi terbentuknya oospora adalah sebagai berikut : Media biakan yang digunakan tiap 1000 ml air bebas ion mengandung 1,25 gr pepton, 1,25 gr Ardamin, 3 gr glukosa, 0,05 gr lesitin, 0,025 mg kolesterol, 0,075 CaCl2.2H2O dan 0,15 gr
Mg.Cl2.6H2O. Selain itu juga menggunakan media biakan yang mengandung 2.8
g/lt yeast ekstrak, 2,4 gr glukosa, 3,2 gr/lt tepung gandum 300mg/lt cottonseed oil, 100 ml ekstrak cotton seed flour 0,15 gr CaCl2.2H2O dan 0,15 gr Mg.Cl2.6H2O
(Brey, 1985).
Zoospora dimasukkan ke dalam aquadestilata selama 12-18 jam sebelum diinokulasikan kemedia yang mengandung ardamin di atas. Setelah diinkubasi zoospora diambil 8 ml dan dimasukkan ke dala m tabung erlenmeyer yang berisi
waterbath 120 rpm. Miselium yang dihasilkan dipanen dan dimasukkan kembali ke media yang berisi cotton seed oil dan kemudian diinkubasi selama 7-10 hari pada suhu kamar. Oospora akan bergerombol di dasar tabung dan siap dipanen.
4. Penghitungan dan pengamatan zoospora dan oospora
Penghitungan zoospora dan oospora yang dihasilkan dengan menggunakan malazzes hemocytometer dan pengamatan dilakukan dengan menggunakan bantuan mikroskop dengan perbesaran 10x dan 40x. Zat warna yang digunakan Lacto phenol cotton blue (LPCB).
HASIL dan PEMBAHASAN
Pemeliharaan isolat Lagenidum giganteum, salah satu tujuannya supaya isolat tersebut tidak mati dan dalam pemeliharaan ini membutuhkan waktu yang lama karena selama pemeliharaan seringkali ditemukan banyak terjadi kendala. Dalam pemeliharaan ini dari isolat murni dibiakkan ke dalam media biakan agar seperti yang dilakukan oleh Kerwin dan Wasino (1986). Kuning te lur yang ada dalam media biakan ini digunakan sebagai sumber utama untuk pertumbuhan kapang L. giganteum yang meliputi lemak, karbohidrat, protein dan elemen organik yang meliputi sulfur, potassium, sodium, fosfor, kalsium, magnesium dan besi (Stadelman dan Cotterill(1977) dalam Misman, 1990). Sedangkan sumber karbon untuk pertumbuhan kapang ini selain berasal dari glukosa yang ada pada kuning telur juga berasal dari glukosa yang ditambahkan pada media diatas. Menurut Bilgrami dan Verma (1981) dalam Misman (1990) bahwa unsur karbon diperlukan oleh kapang tersebut untuk menyusun komponen miselium kapang.
Dari penelitian ini setelah kapang L. giganteum ditumbuhkan pada media khusus (Domnas et al. 1983) yaitu kombinasi antara media PYG (pepton, yeast ekstrak dan glukosa) dengan pH 6,5 dan Medium Z pH 6,0 dan didiamkan pada air bebas ion selama 2 hari maka dihasilkan zoospora yang merupakan stadium infektif , bersifat motil dan merupakan alat reproduksi aseksualnya (Gambar 4). Jumlah zoospora yang dihasilkan sete lah dihitung dengan Malassez hemocytometer sebesar 15 x 107 zoospora/ml.
Dalam siklus hidupnya Lagenidium mempunyai siklus hidup yang relatif sederhana, terdiri dua siklus yang terpisah yaitu aseksual sebagai zoospora dan siklus seksual dengan oospora (Dwidjoseputro 1978). Dalam lingkungan perairan kapang L. giganteum mempunyai dua fase yaitu bersifat saprofit ik dan parasitik. Fase parasitik bersifat motil, berbentuk bulat dan mempunyai 2 flagella pada bagian lateralnya.
Gambar 4. Zoospora 40x
Tahap infektif dari kapang ini adalah tahap spora (zoospora). bersifat motil dan memiliki kemampuan untuk mencari sekaligus merusak inangnya dengan cara
luar) nyamuk. Zoospora dapat ditemukan menempel pada batang padi, kumbang air ataupun larva capung. Apabila zoospora belum menemukan inang yang cocok, zoospora akan berenang kembali dan mencari inang yang sesuai (Melvin et al. 1987; Kerwin 1990 ; Kerwin 2000). Secara in vitro produksi zoospora akan dapat tercapai apabila ditumbuhkan pada media biakan yang mengandung cukup nutrisi dan pH yang sesuai.
Gugus trehalosa merupakan sumber karbon terbaik selain glukosa, mannosa, fruktosa, maltosa dan gliserol selain itu kapang ini juga membutuhkan aspartat, glutamat dan glutamin sebagai sumber nitrogen (McInnis (1971) dalam Misman (1990). Kapang akan mempunyai enzim ekstrasel protease apabila ditumbuhkan pada media PYG dan dalam memproduksi enzim ini juga dibutuhkan suatu perangsang protein. Pada penelitian ini miselium kapang ditumbuhkan dalam media biakan cair yang mengandung PYG dan ditambah suplemen minyak jagung. Minyak jagung digunakan sebagai sumber sterol yang digunakan sebagai bahan tambahan yang akan digunakan untuk menginduksi terjadinya proses zoosporogenesis. Menurut Domnas et al. (1977) media biakan yang mengandung PYG perlu ditambahkan unsur protein baik berupa kolesterol ataupun protein nabati untuk memicu terjadinya zoosporogenesis. Selain itu dengan penambahan protein tersebut akan memicu juga produksi enzim protease menjadi dua sampai tiga kali lipat dan waktu pertumbuhan akan menjadi dua kali lebih cepat apabila dibandingkan dengan tanpa penambahan suplemen. Enzim protease membantu proses zoospora dalam melakukan penetrasi ke dalam lapisan kutikula dari nyamuk disamping enzim lipase (Domnas et al. 1974). Menurut Jaronski et al. (1983) bahwa apabila kapang L. giganteum ditumbuhkan pada
media yang bebas sterol proses zoosporogenesis akan terhambat dan kemampuan pembentukkan zoospora akan tertahan apabila kapang ditumbuhkan pada media PYG setelah beberapa bulan (Lord dan Robert 1986).
Kisaran pH yang dibutuhkan dalam produksi zoospora secara in vitro adalah 4,5-8,4 (Lord dan Robert 1985) sedang menurut Domnas et al. (1982) bahwa produksi zoospora kisaran pH yang digunakan adalah 5,4-7,5 dan pH optimal apabila menggunakan media PYG adalah 6,5-7,5). L. giganteum akan mampu memproduksi zoospora secara optimal apabila setelah ditumbuhkan ke media PYG, harus ditumbuhkan pada media Z dengan pH 5,5-6,0 (Balaraman dan Hoti (1986) dalam Misman, 1990) .
Dalam penelitian ini untuk memperoleh proses zoosporogenesis secara sempurna, suspensi zoospora dimasukkan kedalam cawan-cawan petri yang berisi air bebas ion steril yang diinkubasikan pada suhu 250C selama 3 hari dan diperoleh hasil adanya germline pada dasar petri. Menurut Kerwin et al. (1986) bahwa untuk memacu terjadinya zoosporogenesis nutrisi yang terkandung di media biakan, digunakan juga aquades steril, sedangkan Domnas et al. (1977) menggunakan air bebas ion sebagai pemacu zoosporogenesis.
Dalam penelitian ini untuk menghasilkan oospora, zoospora yang telah dihasilkan kemudian dibiakkan kembali kemedia yang mengandung yeast ekstrak 2,8g/lt, glukosa 2,4 g/lt, wheat germ 3,2g/lt, cotton seed oil dan cotton seed flour serta ditambah beberapa milimolar unsur kalsium dan magnesium. Inkubasi dilakukan selama 7-10 hari. Setelah 7 hari miselium dipanen dan dilarutkan dalam aquades steril dan diinkubasi kembali selama 7 hari. Pada hari kesepuluh oospora dipanen dan diperoleh hasil 2,1x103 oospora/ml setelah dihitung dengan
menggunakan Malassez hemocytometer. Oospora berbentuk bulat mempunyai dinding yang jelas dan lapisan halus (Gambar 5). Secara normal dalam pertumbuhannya L. giganteum membutuhkan unsur karbon, nitrogen dan mineral serta vitamin. Untuk dapat aktif memproduksi oospora dalam media cair yang digunakan untuk pertumbuhan dibutuhkan sterol, kalsium dan asam lemak tak jenuh. Sterol akan merubah pertumbuhan vegetatif menjadi pertumbuhan reproduktif. Sumber sterol dapat berasal dari minyak sayur, minyak jagung ataupun minyak ga ndum dan ketiga sumber sterol ini yang sangat optimum dalam memproduksi oospora (Kerwin et al. 1986). Oospora dapat dihasilkan dan dapat bertahan lama dengan memberikan asam lemak dalam media pertumbuhannya khususnya unsur trigliserida. Jumlah oospora yang diproduksi dipengaruhi suhu, pH, nutrisi, salinitas, cahaya ataupun komponen organik. Dalam penelitian ini oospora yang dihasilkan sedikit, hal ini kemungkinan disebabkan oleh faktor sterol yang digunakan ataupun asam lemaknya kurang optimal sehingga berpengaruh dalam proses oosporogenesis. Menurut Kerwin et al. (1986) bahwa dalam produksi oospora hasil akan optimum apabila jumlah sterol yang ditambahkan cukup besar yaitu 60 mg/lt dan diproduksi menggunakan fermentor. Tipe dan konsentrasi asam lemak yang digunakan juga berpengaruh dalam proses oosporogenesis. Asam lemak kemungkinan mempengaruhi proses fisiologi yang berkaitan dengan terjadinya oosporogenesis. Asam lemak tergabung dalam golongan fospolipid yang mungkin berpengaruh dalam aktivitas pengikatan antara membran sel dengan enzim adenil siklase yang diketahui terlibat dalam merangsang terjadinya proses oosporogenesis. Kandungan fospolipid juga berpengaruh dalam fusi antara anteridia dan oogonia , menghambat terjadinya
gametangia sehingga menyebabkan terjadinya kegagalan dalam pembentukkan oospora.
Vegetables oil kaya akan asam oleic, linoleic dan linolenic, ketika ditambahkan kholesterol, yang mana keduanya cocok sebagai sumber asam lemak untuk produksi oospora yang aktif dalam media cair. Menurut Kerwin e t al. (1986) bahwa asam linolenic yang terkandung dalam ekstrak hemp seed mendekati 60%, sehingga apabila minyak ini ditambahkan pada media dasar yang telah ditambah kolesterol akan sangat berpengaruh dalam memproduksi oospora. Selain itu dalam proses oosporogenesis juga dibutuhkan adanya unsur kalsium dan magnesium. Menurut Brey (1985) dengan menggunakan media biakan yang sama oospora yang dihasilkan 5,0 x 103 dan Kerwin et al. (1983) menggunakan medium padat yang berisi PYG dan ditambah suplemen kolesterol dan lesitin mampu menghasilkan oospora sejumlah 4,1x105/10 cm diameter petri.
Gambar 5. Oospora perbesaran 10x
Oospora mampu bertahan hidup dan bersifat dorman (spora istirahat) serta stabil, dapat bertahan terhadap kondisi lingkungan yang kurang baik, tahan terhadap kekeringan dan mampu bertahan sampai 7 tahun (Kerwin 2000). Pada
kondisi lingkungan yang tepat, oospora akan ber kecambah dan menghasilkan zoospora.
KESIMPULAN Dari penelitian ini dapat disimpulkan bahwa :
1. Media biakan yang terdiri dari Media PYG yaitu media yang berisi pepton, yeast ekstrak dan glukosa yang kemudian dipindahkan kemedia yang mengandung sumplemen vegetable oil serta dipindahkan ke media air bebas ion mampu menghasilakn zoospora sebanyak 15 x 107 zoospora/ml.
2. Media cair yang berisi 1,25 gr pepton, 1,25 gr ardamin, 3 gr glukosa, 0,05 gr lesitin, 0,025 mg kholesterol, 0,075 CaCl2.2H2O dan 0,15 gr Mg. Cl2.6H2O dan
media yang mengandung 2,8g/lt yeast ekstrak, 2,4 gr glukosa, 3,2 gr/lt tepung gandum, 300 mg/lt cottonseed oil, 100 ml ekstrak cotton seed flour, 0,15 gr. CaCl2.2H2O dan 0,15 gr Mg.Cl2.6H2O menghasilkan oospora sebanyak 2,1x103
Percobaan 3
Uji Patogenisitas Zoospora dan Oospora Kapang Lagenidium
giganteum terhadap Larva Instar 2 Nyamuk
Ae. aegypti Skala Laboratorium
METODE PENELITIAN
1. Pemeliharaan Nyamuk Ae. aegypti
Ae. aegypti dipupuk (rearing) dalam insektari yang berukuran 76x76x76 cm. Selama pemeliharaan didalam insektari dimasukkan sukrosa 10% sebagai sumber makanan. Sumber makanan darah diberikan dengan cara memasukkan tikus yang telah difiksasi dalam kawat berjaring, sedangkan untuk tempat bertelur disiapkan kertas saring berbentuk kerucut diatas cawan petri yang berisi air untuk menjaga kelembaban.. Selama pemeliharaan diharapkan nyamuk akan bertelur di atas kertas saring. Apabila diperkirakan sudah tidak ada nyamuk yang bertelur kemudian kertas saring diangkat dan dikeringkan dalam suhu kamar. Selanjutnya kertas saring yang berisi telur tersebut sebagian dimasukkan dalam kantong polietilen untuk disimpan dan sebagian ditetaskan. Proses penetasan dilakukan di laboratorium. Kertas saring yang berisi telur direndam dalam air sumur yang telah diendapkan semalam. Kurang lebih selama 3-5 hari telur akan menetas. Pemeliharaan pada stadium larva, kebutuhan makanan diperoleh dengan memberikan tepung hati yang dikeringkan.
2. Uji Efektifitas zoospora
Uji patogenesitas dilakukan di laboratorium Mikologi, Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner, Fakultas Kedokteran
Hewan Institut Pertanian Bogor. Dalam uji efektifitas ini dibutuhkan zoospora, larva instar 2 nyamuk Ae. aegypti. Tepung hati, air sumur yang diendapkan, gelas plastik, penutup kasa dan lain-lain.
Zoospora hasil panenan dihitung dibawah mikroskop dengan menggunakan malazzes hemocytometer. Setelah didapatkan hasil perhitungan zoospora selanjutnya dibuat sua tu pengenceran. Suspensi zoospora dari masing-masing pengenceran kemudian dimasukkan kedalam gelas-gelas plastik yang didalamnya sudah berisi media tumbuhnya larva nyamuk serta makanannya. Larva instar 2 dimasukkan dalam gelas-gelas yang sudah berisi zoospora sesuai pengenceran sebanyak 25 ekor. Dalam percobaan ini media cair yang digunakan adalah 50 ml air sumur yang sudah diendapkan Sebagai kontrol dalam percobaan ini hanya berisi air sumur dan larva nyamuk. Masing-masing perlakuan diulang 4 kali. Pengama tan dilakukan setiap hari sampai hari kelima. Penghitungan LD50
dengan menggunakan metode Reed dan Muench (1938). Larva yang mati diambil dan disimpan untuk dilihat secara mikroskopis dengan menggunakan pewarnaan.
3. Uji Efektivitas Oospora
Uji efektivitas dilakukan di laboratorium Mikologi, Departemen Ilmu Penyakit Hewan dan Kesmavet, Fakultas Kedokteran Hewan Institut Pertanian Bogor. Dalam uji efektivitas ini dibutuhkan oospora, larva instar 2 nyamuk Ae. aegypti, tepung hati, air sumur yang diendapkan, gelas plastik polietilen, penutup kasa dll.
Oospora hasil panenan dihitung dibawah mikroskop dengan menggunakan malazzes hemocytometer. Setelah didapatkan hasil perhitungan oospora selanjutnya dibuat suatu pengenceran. Suspensi oospora dari masing – masing
pengenceran kemudian dimasukkan ke dalam gelas-gelas plastik yang didalamnya sudah berisi media tumbuhnya larva nyamuk serta makanannya. Larva instar 2 dimasukkan dalam gelas – gelas yang sudah berisi oospora sesuai pengenceran sebanyak 25 ekor. Dalam percobaan ini media cair yang digunakan adalah 50 ml air sumur yang sudah diendapkan Sebagai kontrol dalam percobaan ini hanya berisi air sumur dan larva nyamuk.. Masing – masing perlakuan diulang 4 kali dan pengamatan dilakukan mulai hari kelima sampai hari keempat belas. Penghitungan LD5 0 dengan menggunakan metode Reed dan Muench (1938).
Larva yang mati diambil, dihitung dan dilihat secara mikroskopis dengan menggunakan pewarnaan .
4. Mekanisme infeksi zoospora terhadap Larva
Mulai dari awal pemerik saan patogenisitas, setiap larva yang mati mulai hari pertama dikumpulkan dari tiap-tiap perlakuan. Larva yang mati kemudian diamati secara mikroskopis yang sebelumnya diwarnai terlebih dahulu dengan Lacto Phenol Cotton Blue (LPCB) dan Toluidin Blue 2,5%.