OPTIMASI METODE PENETAPAN KADAR ETANOL DAN PROFIL
SENYAWA YANG TERDAPAT DALAM HASIL PRODUKSI “CIU”
RUMAHAN DESA SENTUL KABUPATEN SUKOHARJO DENGAN METODE KROMATOGRAFI GAS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Alexius Ario Panduwaskito NIM: 088114085
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
OPTIMASI METODE PENETAPAN KADAR ETANOL DAN PROFIL SENYAWA YANG TERDAPATDALAM HASIL PRODUKSI “CIU”
RUMAHAN DESA SENTUL KABUPATEN SUKOHARJO DENGAN METODE KROMATOGRAFI GAS
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Ilmu Farmasi
Oleh:
Alexius Ario Panduwaskito NIM: 088114085
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
Ucapan rasa syukur dan terimakasih untuk Dia yang Maha Esa
Karena berkat-Nya lah saya dapat menyelesaikan skripsi ini
Penantian yang panjang pun telah berlalu
Saatnya menatap masa depan yang telah menanti di luar sana
Karya ini saya persembahkan untuk kedua orangtuaku yang kusayangi Mas Agung, Rista, dan Andika yang selalu mendukungku
INTISARI
Desa Bekonang merupakan salah satu daerah perkampungan yang terdapat di kabupaten Sukoharjo di Provinsi Jawa Tengah. Desa ini merupakan sentra produksi alkohol yang dikenal hasil produksinya oleh masyarakat sebagai “Ciu Bekonang”. Hasil produksi “Ciu Bekonang” digunakan sebagai bahan baku etanol medis oleh pabrik-pabrik pembuat alat kesehatan.
Sebelum dilakukan penetapan kadar etanol dan senyawa lain yang terkandung di dalam “Ciu Bekonang”, perlu dilakukan optimasi pada metode yang digunakan dalam penetapan kadar. Pentingnya dilakukan optimasi pada metode penetapan kadar ini untuk memperoleh pengaturan alat kromatografi yang dapat memperoleh hasil pemisahan peak yang bagus dan bila digunakan pada proses validasi, dapat memenuhi standar parameter-parameter validasi. Untuk memperoleh pemisahan peak senyawa yang optimum, dalam penelitian ini dilakukan optimasi suhu kolom awal, initial time, dan tekanan kolom. Optimasi dari ketiga faktor tersebut dilakukan untuk memperoleh peak yang memenuhi parameter-parameter optimasi, yakni waktu retensi, efisiensi kolom, resolusi, dan faktor asimetri.
Hasil optimasi pada metode penetapan kadar senyawa dalam “Ciu Bekonang” menggunakan Kromatografi Gas suhu terprogram antara lain suhu awal: 70oC; initial time: 2 menit; rate: 30oC/menit; suhu akhir: 220oC; waktu akhir: 2 menit; suhu injektor B: 200oC; suhu detektor A: 250oC; range: 3. Hasil perhitungan asymetri factor yaitu 1 untuk peak etanol dan n-butanol. Waktu retensi etanol yaitu 252 detik, resolusi 15,78 dan nilai efisiensi kolomnya sebesar 0,0009.
Kata kunci: Etanol, butanol, ciu Bekonang, kromatografi gas
ABSTRACT
Bekonang village is one of the villages located in Sukoharjo district in Central Java province. This village is a center for the production of alcohol that known of their products by the public as “Ciu Bekonang”. The production of “Ciu Bekonang” was used as a raw material by the medical ethanol manufacturers of medical devices.
Prior to the determination of ethanol and other compounds contained in the “Ciu Bekonang”, optimization needs to be done on methods used in the assay. The importance of optimization performed on the assay method was to obtain the settings tool of gas chromatography that generate good peak separation which meet the standard of validation parameters in validation process. To obtain optimum separation of peak compounds, the researcher has to optimize value of initial column temperature, initial time, and column pressure. Optimization of these three factors was done to obtain the peak that meets optimization parameters, specifically the retention time, column efficiency, resolution, and asymetri factor.
The optimization results of assay methods of the compounds in “ciu” Bekonang using programmed temperature gas chromatography include the initial temperature: 70°C; initial time: 2 minutes; rate: 30oC/menit; end temperature: 220°C; end time: 2 minutes; injector B temperature: 200oC; detector A temperature: 250oC; range: 3. The calculation results of asymetri factor were 1 for both of ethanol and n-buthanol peaks. The retention time of ethanol was 252 seconds, 15.78 for resolution and value of column efficiency was 0.0009.
Key Words: Ethanol, buthanol, ciu Bekonang, gas chromatography
Segala rasa puji dan syukur penulis sampaikan kepada Tuhan Yang Maha
Esa atas segala berkat dan kasih karunia-Nya sehingga penelitian dan penyusunan
skripsi yang berjudul “Optimasi Metode Penetapan kadar etanol dan profil senyawa yang terdapat dalam hasil produksi “ciu” rumahan Desa Sentul Kabupaten Sukoharjo dengan metode kromatografi gas” dapat diselesaikan dengan baik. Skripsi ini disusun sebagai salah satu syarat untuk meraih gelar
Sarjana Farmasi (S.Farm.) di Fakultas Farmasi, Universitas Sanata Dharma,
Yogyakarta.
Dalam pelaksanaan penelitian hingga selesainya penyusunan skripsi ini,
penulis mendapat banyak dukungan dan bantuan dari berbagai pihak. Oleh karena
itu, penulis mengucapkan terima kasih kepada:
1. Ibu Aris Widayati, M.Si., Ph.D., Apt. selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Bapak Jeffry Julianus, M.Si. selaku dosen pembimbing yang dengan sabar
memberikan pengarahan, masukan, kritik dan saran baik selama penelitian
maupun penyusunan skripsi ini.
3. Bapak Enade Perdana Istyastono, Ph.D., Apt. selaku dosen penguji yang telah
memberikan saran dan kritik yang membangun dalam penyusunan skripsi.
4. Bapak Florentinus Dika Octa Riswanto, M.Sc. selaku dosen penguji yang
telah memberikan saran dan kritik yang membangun dalam penyusunan
skripsi.
KATA PENGANTAR
5. Ibu Christofori Maria Ratna Rini Nastiti, M.Pharm., Apt., selaku Kaprodi
Farmasi dan dosen pembimbing akademik atas bimbingan dan semangat yang
telah diberikan selama ini.
6. Ibu Rini Dwi Astuti, M.Sc, Apt. selaku Kepala Laboratorium Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta.
7. Seluruh Dosen Fakultas Farmasi Universitas Sanata Dharma yang telah
memberikan ilmu yang bermanfaat demi kemajuan mahasiswa dalam bidang
farmasi.
8. Seluruh staf laboratorium kimia Fakultas Farmasi Universitas Sanata
Dharma: Mas Bimo, Mas Bimo anpus, yang telah banyak membantu selama
penelitian di laboratorium.
9. Semua pihak yang tidak dapat disebutkan satu per satu yang telah membantu
penulis dalam mewujudkan skripsi ini.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan
skripsi ini, sehingga penulis mengharapkan segala kritik dan saran yang
membangun. Semoga skripsi ini membantu dan bermanfaat bagi pembaca pada
khususnya dan ilmu pengetahuan pada umumnya.
Penulis
Halaman
HALAMAN JUDUL……… i
HALAMAN PERSETUJUAN PEMBIMBING ………. ii
HALAMAN PENGESAHAN ………. iii
HALAMAN PERSEMBAHAN ……….. iv
PERNYATAAN KEASLIAN KARYA ………. v
BAB I.PENDAHULUAN ……….. 1
A. Latar BelakangPenelitian ……….. 1
1. Permasalahan ……….... 3 2. Keaslian penelitian ………... 3 3. Manfaat penelitian ………... 4 a. Manfaat metodologis ... 4 b. Manfaat praktis ... 4 B. Tujuan Penelitian ……….. 4 DAFTAR ISI xi DAFTAR LAMPIRAN ………... xvii DAFTAR ISI ……… xi DAFTAR TABEL ……… xv DAFTAR GAMBAR ………... xvi INTISARI ……… vii ABSTRACT ………. viii KATA PENGANTAR ...………... ix HALAMAN PERSETUJUAN PUBLIKASI ... vi
BAB II. PENELAAHAN PUSTAKA……… 5
A. Tetes Tebu (Molase)………. 5
B. Alkohol“Ciu Bekonang” ………. 6
C. Etanol ... 8
D. Kromatografi Gas ………... 8
1. Gas Pembawa ……….. 10
2. Sistem Injeksi Sampel ………. 12
3. Kolom ……….. 13
a. Kolom kemas ... 14
b. Kolom kapiler ... 14
4. Fase Diam ……… 15
5. Detektor ………... 16
6. Pengaturan Suhu ……….. 19
a. Operasi isotermal ... 19
b. Suhu terprogram ... 20
7. Analisis Kuatitatif ……….... 21
E. Parameter Optimasi Metode………... 21
F. Landasan Teori ...……….. 24
G. Hipotesis ... 25
BAB III. METODE PENELITIAN………. 26
A. Jenis dan Rancangan Penelitian ………. 26
B. Variabel ………. 26
1. Variabel bebas ………. 26
2. Variabeltergantung ………. 26
3. Variabel pengacau terkendali ……….. 26
C. Definisi Operasional………. 27
D. Bahan Penelitian ……… 27
E. Alat Penelitian ……… 27
F. ProsedurKerja ……….. 28
1. Pemilihan sampel ………. 28
2. Preparasi sampel ……….. 28
3. Optimasi metode kromatografi gas……….. 28
a. Pembuatan larutan seri baku etanol kadar sedang ... 28
b. Pembuatan larutan sampel ... 29
c. Pembuatan larutan etanol murni, sampel murni dan n-butanol murni ... 29
d. Pengaturan instrumen kromatografi gas ... 29
e. Optimasi suhu kolom ... 30
f. Optimasi initial time ... 30
g. Optimasi tekanan kolom ... 31
G. Analisis Hasil ………. 31
BAB IV. HASIL DAN PEMBAHASAN ……… 33
A. Hasil Pemilihan Sampel ……… 33
B. Hasil Preparasi Sampel ...………. 33
C. Hasil Pemilihan Kolom .………. 34
D. Orientasi Metode Kromatografi Gas ... 35
1. Pemilihan sistem pengaturan suhu ...…… 35
2. Pengaturan alat dengan sistem suhu terprogram………. 37
E. Penggunaan Flame Ionization Detector (FID)……….. 39
F. Optimasi Metode Kromatografi Gas .……… 41
1. Hasil pembuatan larutan seri baku etanol kadar sedang……. 41
2. Pembuatan larutan sampel dengan standar internal n-butanol 42 3. Pembuatan larutan etanol murni, sampel murni, dan n-butanol murni ... 43
4. Hasil optimasi suhu kolom ... 46
5. Hasil optimasi initial time ... 50
6. Hasil optimasi tekanan kolom ... 53
BAB V KESIMPULAN DAN SARAN ………. 56
A. Kesimpulan ……… 56 B. Saran ……….. 57 DAFTAR PUSTAKA ……….. 58 LAMPIRAN ………. 60 BIOGRAFI PENULIS………. 90 xiv
DAFTAR TABEL
Tabel I Kandungan Kimia Molase……….……. 6 Tabel II Contoh Gas Pembawadan Pemakaian Detektor ………... 11 Tabel III Kecepatan Linier Gas Pembawa untuk Kolom 30 m…… 12 Tabel IV Jenis Fase Diam dan Penggunaannya………... 15 Tabel V Jenis detektor, sampel, batas deteksi dan
kecepatan alir fase gerak……... 16 Tabel VI Pengaturan Awal Alat Kromatografi Gas…...…... 39 Tabel VII Hasil Perhitungan Nilai Resolusi (RS) ...…. 79
Tabel VIII Hasil Perhitungan Nilai Faktor Asimetri (AS)
Kromatogram Etanol ...…….... 83 Tabel IX Hasil Perhitungan Nilai Faktor Asimetri (AS)
Kromatogram n-Butanol ...…... 83 Tabel X Hasil Perhitungan Nilai Efisiensi Kolom(HETP)……….. 87
DAFTAR GAMBAR
Gambar 1 Lintasan Embden-Meyerhof-Parnas ... 7
Gambar 2 Skema Kerja Alat Kromatografi Gas……….. 9
Gambar 3 Karakteristik Gas Pembawa (N2, He, dan H2)………... 10
Gambar 4 Sistem Injeksi Kromatografi Gas……….... 13
Gambar 5 Kolom Kemas dan Kolom Kapiler……….. 15
Gambar 6 Skema FID………... 18
Gambar 7 Kromatogram Baku Etanol dengan Suhu Isothermal…. 35 Gambar 8 Kromatogram Baku Etanol dengan Suhu Terprogram… 36 Gambar 9 Kromatogram Baku Etanol Kadar Sedang ... 42
Gambar 10 Kromatogram Larutan Sampel ... 43
Gambar 11 Kromatogram Larutan Etanol p.a ... 44
Gambar 12 Kromatogram Larutan n-Butanol p.a……... 44
Gambar 13 Kromatogram Sampel………... 45
Gambar 14 Kromatogram Sampel Range 0………... 46
Gambar 15 Kromatogram Optimasi Suhu 50oC ... 47
Gambar 16 Kromatogram Optimasi Suhu 70oC……… 48
Gambar 17 Kromatogram Optimasi Suhu 90oC……… 49
Gambar 18 Kromatogram Optimasi Initial time 2 menit…………... 51
Gambar 19 Kromatogram Optimasi Initial time 3 menit…………... 51
Gambar 20 Kromatogram Optimasi Tekanan 10 psi…..…………... 53
Gambar 21 Kromatogram Optimasi Tekanan 7,5 psi…..………….. 53
Gambar 22 Kromatogram Optimasi Tekanan 5 psi…..…... 54
DAFTAR LAMPIRAN
Lampiran 1. Sertifikat analisis etanol ………. 61
Lampiran 2 Sertifikat analisis n-butanol ……….. 63
Lampiran 3 Kromatogram hasil optimasi suhu……….. 65
Lampiran 4 Kromatogram hasil optimasi initial time……… 67
Lampiran 5 Kromatogram hasil optimasi tekanan………. 70
Lampiran 6 Data perhitungan resolusi ... 79
Lampiran 7 Data perhitungan nilai faktor asimetri (AS)……….... 82
Lampiran 8 Data perhitungan nilai efisiensi kolom (HETP) ……. 86
1
BAB I PENDAHULUAN
A. Latar Belakang
Desa Bekonang merupakan salah satu daerah perkampungan yang
terdapat di wilayah kabupaten Sukoharjo di Provinsi Jawa Tengah. Desa ini
merupakan sentra produksi alkohol yang dikenal hasil produksinya oleh
masyarakat sebagai “ciu Bekonang”. Pekerjaan sebagai produsen industri rumah tangga pembuatan alkohol telah dilakukan sejak jaman dahulu.
Alkohol produksi Bekonang dibuat dari bahan dasar tetes tebu yang
difermentasikan dan mengalami proses destilasi sehingga diperoleh etanol
(Widodo, 2004). Tetes tebu yang digunakan merupakan sisa hasil produksi pabrik
gula yang kemudian difermentasikan. Proses fermentasi menggunakan ragi yang
mengandung spesies mikroba seperti saccharomyces cerevisiae yang berlangsung
kurang lebih selama 5-6 hari. Dari hasil fermentasi ini kemudian dilakukan proses
destilasi dengan pemanasan menggunakan kompor tungku dan alat destilasi yang
terbuat dari pipa-pipa yang terdapat pendinginnya (Sebayang, 2006).
Produsen di Bekonang memproduksi etanol dengan kadar 30-40% yang
disebut dengan “ciu” Bekonang. Hasil produksi tersebut digunakan sebagai bahan baku etanol medis oleh pabrik-pabrik pembuat alat-alat kesehatan.
Etanol atau alkohol merupakan senyawa kimia yang berbentuk cair dan
bersifat volatil (mudah menguap). Etanol mudah terbakar dan titik didihnya 78oC (Pharmaceutical Press, 2009). Karena bersifat volatil, senyawa ini sangat cocok
ditetapkan kadarnya menggunakan metode kromatografi gas. Kromatografi gas
merupakan metode yang dinamis untuk pemisahan dan deteksi senyawa-senyawa
yang mudah menguap dalam suatu campuran (Gandjar dan Rohman, 2007).
Prinsip pemisahan dalam kromatografi gas yaitu dengan cara partisi dari
komponen-komponen senyawanya berdasarkan titik didih dan kepolaran
komponen-komponen senyawanya dengan menggunakan fase gas sebagai fase
gerak, dan fase cair sebagai fase diam. Prinsip penetapan kadar dengan
kromatografi gas adalah sampel diinjeksikan pada instrumen dan oleh gas yang
mempunyai tekanan tertentu sampel dibawa menuju kolom kapiler untuk
dipisahkan berdasarkan komponen penyusun dan diteruskan menuju detektor.
Dari detektor dihasilkan sinyal pembacaan untuk dicatat oleh rekorder sehingga
menghasilkan kromatogram. Kadar senyawa diketahui dengan menghitung luas
area kromatogram.
Untuk dapat menetapkan kadar etanol dengan hasil yang dipercaya dan
profil senyawa lain yang terdapat di dalam hasil produksi “ciu” perlu dilakukan serangkaian penelitian terdahulu yaitu optimasi dan validasi. Dalam hal ini,
peneliti mengambil bagian tahap optimasi metode kromatografi gas yang akan
digunakan pada penetapan kadar “ciu Bekonang” ini. Oleh karena sampel yang digunakan mengandung komponen-komponen senyawa yang mempunyai titik
didih dan polaritas yang hampir sama, maka peneliti menggunakan metode
kromatografi gas dengan suhu terprogram untuk menghasilkan pemisahan
Pada sistem kromatografi gas dengan suhu terprogram, suhu kolom
ditingkatkan secara bertahap dari suhu awal kolom pada rentang waktu tertentu
sampai batas suhu maksimal kolom. Oleh karena itu, untuk menetapkan suhu awal
kolom dan rentang waktu peningkatan suhu pada sistem kromatografi gas ini
perlu dilakukan optimasi parameter-parameter yang dapat mempengaruhi proses
pemisahan komponen-komponen senyawa di dalam hasil produksi “ciu”. Parameter-parameter yang akan dioptimasi yaitu suhu kolom, tekanan kolom, dan
initial time. Untuk menghasilkan pemisahan kromatogram komponen–komponen senyawa dalam sampel yang optimal maka peak senyawa yang dihasilkan harus
memiliki waktu retensi yang cepat, nilai resolusi lebih dari 1,5, nilai faktor
asimetri sama dengan 1, dan nilai efisiensi kolom kurang dari 1.
1. Permasalahan
Bagaimana kondisi optimal sistem kromatografi gas untuk dapat
menetapkan kadar etanol dalam sampel “ciu” Bekonang?
2. Keaslian Penelitian
Peneliti menemukan penelitian serupa yang pernah dilakukan yaitu
penelitian yang berjudul “Perbandingan Metode Kromatografi Gas dan Berat Jenis Pada Penetapan Kadar Etanol Dalam Minuman Anggur” (Mardoni, 2006). Namun sejauh yang diketahui penulis dan studi pustaka yang telah dilakukan
penulis, penelitian mengenai optimasi metode penetapan kadar dan profil
kandungan alkohol hasil produksi industri “ciu” rumahan di daerah Sukoharjo secara kromatografi gas belum pernah dilakukan.
3. Manfaat penelitian
a. Manfaat metodologis. Dengan penelitian ini diharapkan dapat
memberikan sumbangan ilmiah mengenai metode kromatografi yang dipilih untuk
menetapkan kadar etanol dalam hasil produksi “ciu” di desa Sentul kabupaten Sukoharjo.
b. Manfaat praktis. Dengan penelitian ini diharapkan dapat memberikan
informasi mengenai hasil optimasi metode dalam penetapan kadar etanol dan
profil senyawa yang terdapat dalam hasil produksi “ciu” rumahan desa Sentul kabupaten Sukoharjo dengan metode kromatografi gas.
B. Tujuan Penelitian
Tujuan dilakukan penelitian ini untuk mengetahui kondisi optimal sistem
kromatografi gas untuk dapat menetapkan kadar etanol dalam sampel “ciu” Bekonang.
5
BAB II
PENELAAHAN PUSTAKA
A. Tetes Tebu (Molase)
Tetes tebu (molase) adalah salah satu hasil samping pabrik gula tebu yang
masih memiliki kandungan gula yang tinggi sekitar 52 persen, sehingga
memungkinkan dijadikan bahan baku berbagai industri. Industri yang
memanfaatkan tetes tebu adalah industri yang menghasilkan produk distilasi,
alkohol salah satunya. Molase mengandung gula yang tidak mengkristal, sehingga
gula tersebut dapat dimanfaatkan untuk memproduksi etanol melalui proses
fermentasi (Juwita, 2012).
Molase masih mengandung kadar gula yang cukup untuk dapat
menghasilkan etanol dengan proses fermentasi, biasanya pH molase berkisar
antara 5,5-6,5. Molase yang masih mengandung kadar gula sekitar 10-18% telah
memberikan hasil yang memuaskan dalam pembuatan etanol (Simanjuntak,
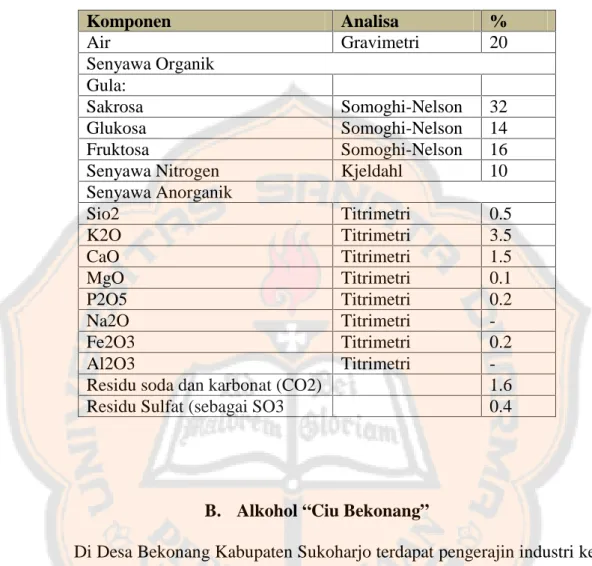
Tabel I. Kandungan Kimia Molase (Widyanti, 2010) Komponen Analisa % Air Gravimetri 20 Senyawa Organik Gula: Sakrosa Somoghi-Nelson 32 Glukosa Somoghi-Nelson 14 Fruktosa Somoghi-Nelson 16 Senyawa Nitrogen Kjeldahl 10 Senyawa Anorganik Sio2 Titrimetri 0.5 K2O Titrimetri 3.5 CaO Titrimetri 1.5 MgO Titrimetri 0.1 P2O5 Titrimetri 0.2 Na2O Titrimetri -Fe2O3 Titrimetri 0.2 Al2O3 Titrimetri
-Residu soda dan karbonat (CO2) 1.6 Residu Sulfat (sebagai SO3 0.4
B. Alkohol“Ciu Bekonang”
Di Desa Bekonang Kabupaten Sukoharjo terdapat pengerajin industri kecil
skala rumah tangga yang menghasilkan alkohol untuk keperluan bahan baku
kimia industri dan juga keperluan pengobatan. Alkohol yang dihasilkan berasal
dari fermentasi tetes tebu. Tetes tebu tersebut diberikan enzim yang berasal dari
jamur lalu didiamkan beberapa hari, hasil fermentasi di destilasi dengan alat
buatan sendiri yang berasal dari drum, lalu hasil destilasi tersebut disaring
sehingga menghasilkan cairan yang jernih (Widodo, 2004).
Fermentasi merupakan proses kegiatan mikrobia pada bahan pangan
cerevisiae merupakan mikroorganisme yang terlibat dalam mengubah gula pada
substrat menjadi alkohol pada kondisi aerob (Hidayat, 2008).
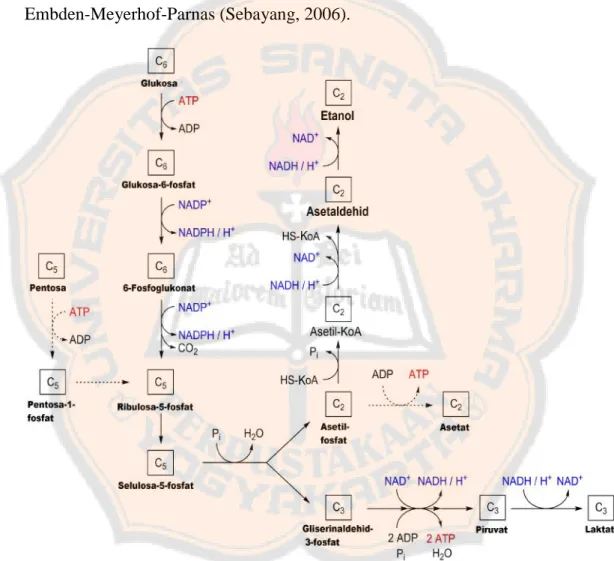
Dalam fermentasi ini glukosa didegradasi menjadi etanol dan CO2 melalui
suatu jalur metabolisme yang disebut glikolisis yang biasa jalurnya disebut jalur
Embden-Meyerhof-Parnas (Sebayang, 2006).
C. Etanol
Etanol merupakan cairan bening, tidak berwarna, mudah mengalir,
mudah menguap dengan bau spritus dan rasa membakar. Etanol mudah terbakar,
titik didihnya sekitar 78oC (Pharmaceutical Press, 2009).
Senyawa ini merupakan jenis obat psikoaktif. Etanol termasuk ke dalam
alkohol rantai tunggal, dengan rumus kimia C2H5OH dan rumus empiris C2H6O,
dan merupakan isomer konstitusional dari dimetil eter. Etanol sering disingkat
menjadi EtOH, dengan "Et" merupakan singkatan dari gugus etil (C2H5) (Myers
and Myers, 2007).
Etanol yang dihasilkan diperoleh dari peragian karbohidrat yang
berkataliskan enzim. Enzim tersebut mengubah karbohidrat ke glukosa kemudian
ke etanol. Reaksi ini terjadi tanpa adanya oksigen dan menghasilkan CO2
(Fessenden dan Fessenden, 1986).
C6H12O6 enzim CH3CH2OH+ CO2 (1)
D. Kromatografi Gas
Kromatografi gas merupakan metode yang dinamis untuk pemisahan dan
deteksi senyawa-senyawa yang mudah menguap dalam suatu campuran.
Kegunaan umum Kromatografi Gas (KG) adalah untuk melakukan pemisahan
dinamis dan identifikasi semua jenis semua senyawa organik yang mudah
menguap dan juga melakukan analisis kualitatif dan kuantitatif senyawa dalam
KG terdapat dua tipe yang sering digunakan, tipe pertama yaitu gas-solid
(adsorption) chromatography dan gas-liquid (partition) chromatography
(Christian, 2004). Pemakaian zat cair sebagai fase diam ternyata lebih meluas
dibandingkan zat padat, sehingga teknik ini kadangkala dikenal sebagai
kromatografi gas-cair (Khopkar, 1990).
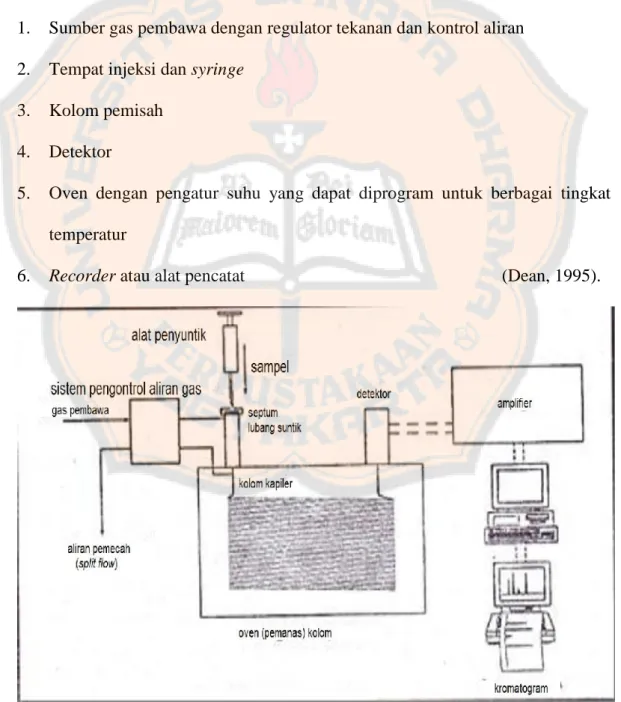
Komponen dasar dari KG adalah sebagai berikut:
1. Sumber gas pembawa dengan regulator tekanan dan kontrol aliran
2. Tempat injeksi dan syringe
3. Kolom pemisah
4. Detektor
5. Oven dengan pengatur suhu yang dapat diprogram untuk berbagai tingkat
temperatur
6. Recorder atau alat pencatat (Dean, 1995).
1. Gas Pembawa
Gas pembawa merupakan fase gerak yang berfungsi untuk membawa
cuplikan melewati kolom. Gas yang biasa digunakan adalah helium, nitrogen,
hidrogen, dan argon. Gas-gas ini relatif tidak mahal, bisa didapatkan dengan
mudah, tidak begitu berbahaya serta bersifat tidak reaktif sehingga tidak bereaksi
dengan molekul-molekul cuplikan pada tekanan dan suhu kromatograf (Christian,
2004).
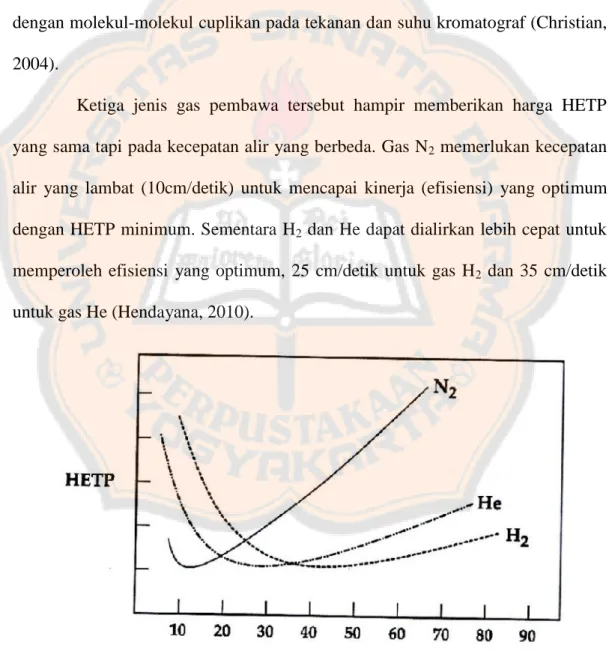
Ketiga jenis gas pembawa tersebut hampir memberikan harga HETP
yang sama tapi pada kecepatan alir yang berbeda. Gas N2 memerlukan kecepatan
alir yang lambat (10cm/detik) untuk mencapai kinerja (efisiensi) yang optimum
dengan HETP minimum. Sementara H2dan He dapat dialirkan lebih cepat untuk
memperoleh efisiensi yang optimum, 25 cm/detik untuk gas H2 dan 35 cm/detik
untuk gas He (Hendayana, 2010).
Syarat gas pembawa yaitu murni dan tidak reaktif, gas pembawa keadaan
murni agar tidak berpengaruh pada detektor dan disimpan dalam tangki
bertekanan tinggi (Gandjar dan Rohman, 2007).
Gas pembawa dipilih berdasarkan sifat inert-nya. Fungsi utamanya
adalah membawa uap analit melalui system kromatografi tanpa berinteraksi
dengan komponen-komponen sampel. Terkadang pemilihan gas pembawa
ditentukan oleh detektor yang digunakan (Dean, 1995).
Tabel II. Contoh Gas Pembawa dan Pemakaian Detektor (Gandjar dan Rohman, 2007)
Gas pembawa Detektor
Hidrogen Hantar panas Helium Hantar panas Ionisasi nyala Fotometri nyala Termoionik Nitrogen Ionisasi nyala
Tangkap elektron Fotometri nyala Termoionik Argon Ionisasi nyala Argon + metana 5% Tangkap elektron Karbon dioksida Hantar panas
Untuk kolom kapiler, aliran gas pembawa paling baik diungkapkan
dengan kecepatan rata-rata linear (µ, cm/detik), bukan dengan laju alir volumetrik
(F, mL/menit). Kecepatan rata linear dapat diartikan sebagai kecepatan
Tabel III. Kecepatan Linear Gas Pembawa untuk Kolom 30 m (MSP KOFEL, 2005)
Diameter Kolom (mm)
Kecepatan Linear (cm/detik) Laju Alir (mL/menit)
He H2 He H2 0.18 30-45 45-60 0,5-0,7 0,7-0,9 0.25 30-45 45-60 0,9-1,3 1,3-1,8 0.32 30-45 45-60 1,4-2,2 2,2-2,9 0.45 30-45 45-60 2,9-4,3 4,3-5,7 0.53 30-45 45-60 4,0-6,0 6,0-7,9
2. Sistem Injeksi Sampel
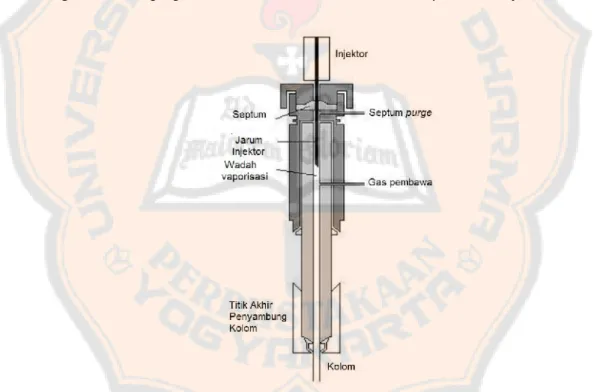
Fungsi tempat penginjeksian adalah untuk menyediakan jalan masuk bagi
syringe dan juga sampel ke dalam aliran gas pembawa dan untuk menyediakan
panas yang cukup untuk menguapkan sampel (Dean, 1995).
Pada dasarnya, ada 4 sistem penginjeksian sampel pada KG, yaitu:
a. Injeksi langsung (direct injection), yang mana sampel yang diinjeksikan akan
diuapkan dalam injektor yang panas dan dan 100% sampel masuk menuju
kolom.
b. Injeksi terpecah (split injection), yang mana sampel yang diinjeksikan
diuapkan dalam injektor yang panas dan selanjutnya dilakukan pemecahan.
c. Injeksi tanpa pemecahan (splitness injection), yang mana hampir semua
sampel diuapkan dalam injektor yang panas dan dibawa ke dalam kolom
karena katup pemecah ditutup.
d. Injeksi langsung ke kolom (on column injection), yang mana ujung septum
Cuplikan yang dapat dianalisis dengan teknik KG dapat berupa zat cair
dan gas. Dengan syarat cuplikan tersebut mudah menguap dan stabil (tidak rusak
pada kondisi operasional). Di tempat pemasukan cuplikan terdapat pemanas yang
suhunya dapat diatur untuk menguapkan cuplikan. Suhu tempat penyuntikan
cuplikan biasanya sekitar 50 derajat di atas titik didih cuplikan. Bila cuplikan
rusak pada suhu tersebut maka cuplikan tersebut tidak dapat dianalisis dengan
teknik KG. Untuk kolom analitik memerlukan antara 0,1-10 µL cuplikan cair
sedangkan kolom preparatif memerlukan antara 20-1000 µL (Hendayana, 2010).
Gambar 4. Sistem injeksi kromatografi gas (Gandjar dan Rohman, 2007)
3. Kolom
Kolom merupakan tempat terjadinya proses pemisahan karena di
dalamnya terdapat fase diam, sehingga merupakan komponen yang sentral
mengandung fase diam yang bias berupa adsorben (kromatografi gas, padat) atau
cairan. Kolom tersebut terbuat dari logam, gelas, atau silika (Dean, 1995).
Ada 2 tipe kolom yang digunakan dalam KG yaitu kolom kemas dan
kolom kapiler. Kolom kemas adalah kolom tipe pertama dan telah digunakan
selama beberapa tahun. Kolom kapiler merupakan kolom yang paling banyak
digunakan sekarang, tetapi kolom kemas tetap digunakan untuk penelitian yang
tidak membutuhkan resolusi tinggi atau ketika dibutuhkan peningkatan kapasitas
kolom (Christian, 2004).
a. Kolom kemas
Kolom yang biasanya dibuat dari gelas atau kaca yang disilanisasi untuk
menghilangkan senyawa silanol polar Si-OH dari permukaannya yang
menyebabkan tailing pada peak dari analit polar. Internal diameternya 2-5 mm,
kolomnya dikemas dengan partikel solid pendukung yang disalut dengan cairan
fase diam (Watson, 1999).
Dibandingkan dengan kolom kapiler, kolom kemas memiliki variasi
panjang jalur aliran fase gerak dan lapisan film diskontinyu dari fase diamnya
yang tidak seragam (Dean, 1995).
b. Kolom kapiler
Kolom kapiler terbuat dari lelehan silika yang disalut bagian luarnya
dengan poliamida untuk memberikan sifat fleksibel kolom. Penyalutan dengan
aluminium juga telah dilakukan untuk pengerjaan pada suhu yang tinggi
(>400oC). Internal diameternya 0,15-0,5 mm. Dinding kolom disalut dengan cairan fase diam yang memberi lapisan tipis antara 0,1-5µm (Watson,1999).
Memiliki beberapa kelebihan dibandingkan dengan kolom kemas yaitu
fleksibel, awet/tahan lama, dan memiliki silika kapiler yang bersifat inert terhadap
bahan kimia (Dean, 1995).
Gambar 5. Kolom kemas dan kolom kapiler (Rohman, 2009)
4. Fase Diam
Fase diam yang dipilih berdasarkan polaritas dari sampel yang akan
diujikan, dengan prinsip “like dissolve like”, oleh karena itu fase diam yang polar akan lebih berinteraksi dengan senyawa yang lebih polar, dan begitulah
sebaliknya fase diam yang non polar akan lebih berinteraksi dengan senyawa yang
lebih non polar (Christian, 2004).
Komponen-komponen sampel harus teretensi di fase diam untuk
memperoleh resolusi. Retensi yang semakin lama dan selektif akan menghasilkan
resolusi yang semakin baik. Selektivitas bisa divariasi hanya dengan mengubah
Tabel IV. Jenis Fase Diam dan Penggunannya (Gandjar dan Rohman, 2007)
Fase diam Polaritas Golongan sampel Suhu maksimumoC Squalen Non polar Hidrokarbon 125oC Apiezon L Non polar Hidrokarbon, ester, eter 300oC Metil silikon Non polar Steroid, pestisida,
alkaloida, ester
300oC Dionil ptalat Semi polar Semua jenis 170oC Dietilenglikosuksinat Polar Ester 200oC
Carbowax 20M Polar Alkohol, amina aromatik, keton
250oC
5. Detektor
Detektor merupakan perangkat yang berada di ujung kolom tempat
keluarnya fase gerak (gas pembawa) yang membawa komponen hasil pemisahan.
Pada garis besarnya detektor pada KG termasuk detektor diferensial, dalam arti
respons yang keluar dari detektor memberikan relasi yang linier dengan kadar atau
laju aliran massa komponen yang teresolusi (Rohman, 2009).
Detektor harus mempunyai karakteristik sebagai berikut:
a. Sensitivitas yang tinggi
b. Tingkat noise yang rendah
c. Respon yang linier pada rentang dinamis yang lebar
d. Respon yang baik pada semua komponen organik
e. Tidak sensitive pada variasi alirah dah perubahan suhu
f. Stabil dan ruggedness
g. Kemudahan penggunaan
Tabel V. Jenis Detektor, Sampel, Batas Deteksi dan Kecepatan Alir Fase gerak (Rohman, 2009)
Jenis detektor Jenis sampel Batas deteksi
Kecepatan alir (ml/ menit) Gas
pembawa H2 Udara Hantar panas Senyawa umum 5-100 ng 15-30 - -Ionisasi nyala Hidrokarbon 10-100 pg 20-60 30-40
200-500 Penangkap elektron Halogen organik, pestisida 0,05-1 pg 30-60 - 70-100 Nitrogen-fosfor Senyawa nitrogen organik dan fosfat
organic 0,1-10 g 20-40 1-5 60-80 Fotometri nyala (393nm) Senyawa-senyawa sulful 10-100 pg 20-40 50-70 100-150 Fotometri nyala (393nm) Senyawa-senyawa fosfor 1-10 pg 20-40 120-170 -Fotoionisasi Senyawa-senyawa yang terionisasi dengan UV 2 pg 30-40 - -Konduktifitas elektronik Halogen, N, S 0,5 pg Cl 2 pg S 4 pg N 20-40 80 Forier transform -infra red Senyawa-senyawa organik 1000 pg 3-10 -
-Selektif massa Sesuai untuk senyawa apapun
10 pg- 10
ng 0,5-30 -
-Emisi atom Sesuai untuk elemen apapun
0,1–20
pg 60-70 -
-FID (Flame Ionization Detector) adalah detektor KG yang paling banyak
rentang dinamis yang lebar, sensitivitas tinggi, dan akan mendeteksi semua
senyawa yang mengandung karbon (Scott, 2003).
Gambar 6. Skema FID (Scott, 2003)
Pada pemakaian FID, ada beberapa hal yang perlu diperhatikan: pertama,
kecepatan alir O2(udara) dan H2. Untuk memperoleh tanggapan FID yang optimal
sebaiknya kecepatan aliran H2 + 30 mL/menit dan O2 sepuluh kalinya. Kedua
adalah suhu FID harus diatas 100oC. Hal ini bertujuan untuk mencegah kondensasi uap air yang mengakibatkan FID berkarat atau kehilangan (menurun)
sensitivitasnya (Gandjar dan Rohman, 2007).
Solut yang keluar dari kolom dicampur H2 dan udara kemudian dibakar
pada nyala di bagian dalam detektor. Atom karbon senyawa organik dapat
menghasilkan radikal CH yang selanjutnya menghasilkan ion CHO+dalam nyala hidrogen–udara.
CHO+yang dihasilkan dalam nyala bergerak ke katoda yang berada di atas nyala. Arus yang mengalir di antara anoda dan katoda diukur dan diterjemahkan sebagai
sinyal pada rekorder. Detektor ini jauh lebih peka daripada detektor daya hantar
panas. Kepekaan detektor ionisasi nyala akan lebih meningkat kalau N2digunakan
sebagai gas pembawa (Hendayana, 2010).
6. Pengaturan Suhu
Secara keseluruhan, pemilihan suhu dalam kromatografi gas
berhubungan dengan beberapa faktor. Suhu injektor harus relatif tinggi, konsisten
dengan stabilitas thermal sampel, untuk memberikan kecepatan penguapan yang
paling tinggi agar sampel masuk ke kolom dalam volum kecil, menurunkan
penyebaran dan meningkatkan resolusi. Suhu kolom berhubungan dengan
kecepatan, sensitifitas dan resolusi. Pada suhu tinggi, sampel berada pada fase gas
terlama dan terelusi dengan cepat, tetapi resolusinya jelek. Pada suhu rendah,
sampel berada di fase diam paling lama dan terelusi dengan lamban; resolusi
meningkat tetapi sensitifitas menurun. Suhu detektor harus cukup tinggi untuk
mencegah sampel terkondensasi (Christian, 2004).
KG didasarkan pada dua sifat senyawa yang dipisahkannya yakni
kelarutan senyawa dan titik didih senyawa. Karena titik didih senyawa
berhubungan dengan suhu makan suhu merupakan faktor utama dalam
kromatografi gas (Gandjar dan Rohman, 2007).
a. Operasi isotermal
Pemilihan suhu kolom untuk operasi isotermal merupakan permasalahan
komponen-komponennya memiliki titik didih dengan rentang yang luas
menghasilkan hasil kromatograf yang tidak memuaskan hanya dengan single
isotermal run. Pemisahan pada suhu kolom yang sedang mungkin menghasilkan
resolusi yang bagus untuk komponen dengan titik didih rendah tetapi
membutuhkan waktu yang panjang untuk mengelusi komponen dengan titik didih
tinggi. Salah satu solusinya adalah dengan meningkatkan suhu kolom beberapa
poin lebih tinggi selama pemisahan sehingga komponen dengan titik didih tinggi
akan terelusi lebih cepat dan dengan peak yang lebih berdekatan (Dean,1995).
b. Suhu terprogram
Pemisahan konstituen-konstituen dalam sampel yang mempunyai daerah
titik didih luas dapat diperbaiki dan dipercepat dengan menaikan temperatur
kolom pada suatu laju yang seragam. Cairan yang mempunyai titik didih rendah
akan terelusi terlebih dahulu, sedangkan pada temperatur lebih tinggi zat yang
mempunyai titik didih lebih tinggi baru akan terelusi (Khopkar, 1990).
Sampel diinjeksikan ke dalam sistem kromatografi ketika suhu kolom di
bawah suhu komponen sampel pada titik didih terendah, diutamakan di bawah
suhu 90oC. Suhu kolom kemudian dinaikkan dengan kecepatan yang telah ditentukan. Pada aturan umumnya, waktu retensi dibagi pada peningkatan suhu
20-30oC. Suhu akhir seharusnya mendekati titik didih komponen yang terelusi terakhir tetapi tidak boleh melebihi batas maksimal suhu pada fase diam yang
digunakan. Kecepatan pemanasan 3-5oC/menit harus dicoba pada awal operasi kemudian diatur sedemikian rupa sehingga diperoleh pemisahan yang optimum
7. Analisis kuantitatif
Analisis kuantitatif secara KG menggunakan metode standar internal.
Metode standar internal digunakan karena terdapat ketidakpastian yang
disebabkan injeksi sampel, kecepatan aliran gas, dan variasi keadaan kolom dapat
diminimalisasi. Dalam prosedur ini, standar internal yang telah diukur dengan
seksama dimasukkan ke dalam setiap larutan baku dan sampel, dan rasio luas
puncak analit terhadap luas puncak standar internal adalah parameter analisisnya.
Puncak standar internal dan puncak lainnya harus terpisah dengan baik sebagai
syarat keberhasilan metode ini (Skoog, West, dan Holler, 1994).
Untuk menjamin kondisi yang digunakan dalam analisis kuantitatif
bersifat stabil dan reprodusibel, baik pada penyiapan sampel atau proses
kromatografi, berikut beberapa syarat yang harus dipenuhi dalam analisis
kuantitatif:
a. Analit (solut) harus telah diketahui dan terpisah sempurna dari
komponen-komponen lain dalam kromatogram
b. Baku dengan kemurnian yang tinggi dan telah diketahui harus tersedia
c. Prosedur kalibrasi yang sudah diketahui harus digunakan (Rohman, 2009).
E. Parameter Optimasi Metode
Dalam kromatografi modern terdapat beberapa parameter yang
berhubungan satu dengan yang lain dan perlu dimengerti untuk memahami konsep
kromatografi. Parameter tersebut adalah waktu retensi, faktor kapasitas,
1. Waktu retensi
Waktu retensi (tR) adalah waktu mulai injeksi cuplikan hingga suatu
komponen campuran keluar kolom, dengan kata lain waktu yang diperlukan suatu
komponen campuran (solute) untuk keluar dari kolom. Waktu retensi diukur
melalui kromatogram dari menit ke-0 hingga muncul puncak peak (Hendayana,
2010).
2. Faktor Kapasitas
Faktor kapasitas (k’) merupakan suatu ukuran kekuatan interaksi suatu komponen dengan fasa diam yang diformulasikan sebagai berikut:
(3)
K’= faktor kapasitas
tR = waktu retensi yaitu waktu yang diperlukan oleh suatu komponen
yang berinteraksi dengan fasa diam untuk meninggalkan kolom
t0 = waktu yang diperlukan oleh suatu komponen yang tidak berinteraksi
dengan fasa diam untuk meninggalkan kolom
ns= jumlah mol suatu senyawa di dalam fasa diam
nm= jumlah mol suatu senyawa di dalam fasa gerak
VS= volume fasa diam
Vm= volume fasa gerak
Senyawa yang mempunyai harga faktor kapasitas tinggi menunjukkan
senyawa yang mempunyai faktor kapasitas yang rendah menunjukkan komponen
tersebut berinteraksi dengan fase diam secara lemah (Hendayana, 2010).
3. Selektivitas
Selektivitas (α) diartikan sebagai ukuran keterpilihan dua komponen campuran yang dipisahkan, difromulasikan sebagai berikut:
α = (4)
K’1 dan k’2 masing-masing adalah faktor kapasitas komponen pertama dan komponen kedua. Harga selektivitas dapat sama dengan satu atau lebih besar dari
satu. Bila harga α = 1 berarti senyawa 1 dan senyawa 2 keluar dari kolom bersama-sama, dengan kata lain senyawa 1 dan senyawa 2 tidak dapat dipisahkan.
Sebaliknya bila α > 1 maka senyawa 1 keluar lebih cepat dari senyawa2. Semakin besar nilai α maka semakin baik pemisahan(Hendayana, 2010).
4. Efisiensi
Tingkat pemisahan dengan kromatografi tercermin pada peak-peak
kromatogram yang dihasilkan. Semakin lebar suatu peak kromatogram maka
dapat dikatakan pemisahan semakin kurang efisien. Secara kuantitatik, efisiensi
dapat dijelaskan dengan teori plat (N). Pemahaman teori plat sebagai berikut:
dalam proses kromatografi terjadi kesetimbangan distribusi di antara fase gerak
dan fase diam ketika solute bergerak melalui kolom (Hendayana, 2010).
Dengan kata lain, kromatografi merupakan proses ekstraksi
berkesinambungan. Semakin banyak proses ekstraksi dilakukan maka semakin
ekstraksi sebanyak N kali. Semakin besar nilai N maka semakin baik pemisahan
(Hendayana, 2010).
5. Resolusi
Tujuan utama dari kromatografi adalah memisahkan
komponen-komponen campuran secara sempurna. Derajat pemisahan dua komponen-komponen
campuran dalam proses kromatografi dinyatakan dengan istilah resolusi (RS)
(Hendayana, 2010).
Rumus perhitungan resolusi:
RS=
B A A R B RW
W
t
t
2
(5)(Skoog, West, dan Holler, 1994).
Nilai resolusi 0,6 digunakan untuk melihat terbentuk “lembah” dari 2 puncak dengan tinggi yang sama. Nilai 1,0 menghasilkan 2,3% overlap pada 2
puncak dengan tinggi yang sama dan diyakini sebagai pemisahan yang minimum
untuk menghasilkan hasil kuantitatif yang bagus. Hasil 1,5 hanya menyebabkan
0,1% overlap pada puncak yang sama tinggi dan menjadi dasar suatu nilai resolusi
yang cocok dan bagus untuk puncak yang sama tinggi (Christian, 2004).
F. Landasan Teori
Metode kromatografi gas digunakan dalam penetapan kadar etanol dan
profil senyawa yang terdapat dalam hasil produksi “ciu” berdasarkan perbedaan titik didih senyawa–senyawa golongan alkohol yang terkandung di dalam hasil produksi “ciu” dan interaksinya dengan fase gerak dan fase diam di dalam kolom
KG yang digunakan. Sistem KG menggunakan sistem pengaturan suhu
terprogram karena senyawa–senyawa alkohol di dalam “ciu” memiliki titik didih yang berdekatan sehingga perlu dilakukan pengaturan suhu yang tepat untuk
memperoleh kromatogram hasil pemisahan senyawa yang memenuhi
parameter-parameter optimasi. Alat KG perlu diketahui kondisi optimalnya agar memperoleh
hasil yang memenuhi parameter validasi pada proses selanjutnya.
G. Hipotesis
Metode kromatografi gas pada penetapan kadar dan profil alkohol hasil
produksi “ciu” rumahan daerah kabupaten Sukoharjo memenuhi parameter optimasi yang meliputi waktu retensi, efisiensi kolom, resolusi dan asymetri
26
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental dengan
rancangan penelitian deskriptif dikarenakan mendeskripsikan keadaan yang ada
dan dilakukan manipulasi terhadap subjek uji.
1. Variabel bebas
Variabel bebas dalam penelitian ini adalah alkohol hasil produksi industri
rumahan daerah Sukoharjo
2. Variabel tergantung
Variabel tergantung dalam penelitian ini adalah waktu retensi, resolusi,
asimetri faktor, dan efisiensi kolom yang dihasilkan.
3. Variabel pengacau terkendali
Variabel pengacau terkendali yang terdapat dalam penelitian ini adalah:
a. Pelarut, untuk mengatasinya digunakan pelarut pro analisis dengan kemurnian
tinggi.
b. Kondisi lingkungan, dikarenakan etanol mudah menguap, oleh karena itu
wadah sampel selalu dalam posisi tertutup.
C. Definisi Operasional
1. Sampel yang digunakan adalah alkohol hasil produksi industri rumahan
daerah Sukoharjo.
2. Optimasi metode kromatografi gas menggunakan sistem kromatografi gas
dengan pengaturan awal yaitu kolom kapiler CP-Wax CB 25 (i.d. 0,32 mm),
Flame Ionization Detector (FID), serta suhu terprogramkan.
3. Optimasi yang dilakukan meliputi optimasi temperatur awal kolom, optimasi
initial time, dan optimasi tekanan kolom.
4. Parameter optimasi yang digunakan meliputi waktu retensi, resolusi, asimetri
faktor, dan efisiensi kolom.
D. Bahan-bahan Penelitian
Bahan yang digunakan dalam penelitian adalah “ciu” Bekonang dari fermentasi tetes tebu, baku etanol p.a.(E. Merck), , n-butanol p.a. (E. Merck),
akuabides (Fakultas Farmasi Universitas Sanata Dharma), gas hydrogen HP
99,995% (CV. Perkasa), udara (Laboratorium Analisis Pusat Universitas Sanata
Dharma), gas nitrogen HP 99,9995% (CV. Perkasa).
E. Alat-alat Penelitian
Alat yang digunakan dalam penelitian ini meliputi seperangkat alat
Kromatografi Gas (HP 5890) dengan Flame Ionization Detector (FID), kolom
kapiler CP-Wax (25 m, i.d. 0,32 mm), alat-alat gelas yang lazim digunakan untuk
F. Prosedur Kerja 1. Pemilihan sampel
Penelitian ini menggunakan sampel yang berasal dari desa Bekonang
yang merupakan hasil industri rumahan produksi alkohol. Sampel diambil
sebanyak 600 mL setiap produksi dan diambil sebanyak tiga kali produksi yang
dilakukan di 15 rumah produksi dari 70 rumah produksi, pemilihan tempat
produksi dengan cara random yaitu dengan mengambil undian dan dipilih
sebanyak 15 rumah produksi dari total rumah produksi.
2. Preparasi sampel
Sampel yang didapat dihomogenkan terlebih dahulu dengan cara digojog
pada setiap botol, lalu sejumlah 100 mL sampel kemudian disaring dengan kertas
Whatman no 1 agar lebih jernih. Kemudian disimpan dalam botol tertutup untuk
menghindari penguapan sampel.
3. Optimasi metode kromatografi gas
A. Pembuatan larutan seri baku etanol kadar sedang
Larutan etanol p.a. sejumlah 600 µL diambil dan dimasukkan ke dalam
labu ukur 10 mL, kemudian ditambahkan standar internal sejumlah 600 µL
n-butanol ke dalam labu ukur. Encerkan dengan aquabidest hingga batas tanda dan
gojog homogen sehingga diperoleh konsentrasi larutan baku etanol 6%v/v.
Larutan ini dibuat masing-masing satu kali untuk pengerjaan 18 parameter
B. Pembuatan larutan sampel
Larutan sampel hasil preparasi diambil sejumlah 2000 µL menggunakan
mikropipet dan dimasukkan ke dalam labu ukur 10 mL, kemudian ditambahkan
standar internal 600 µL n-butanol ke dalam labu ukur. Encerkan dengan aquabides
hingga batas tanda.
C. Pembuatan larutan etanol murni, sampel murni dan n-butanol murni
Siapkan masing-masing 10 mL larutan etanol p.a., n-butanol p.a., dan
larutan sampel ke dalam labu uku 10 mL untuk diinjeksikan ke dalam
kromatografi gas dengan pengaturan awal.
Atur instrumen kromatografi gas dengan pengaturan awal sebagai berikut:
Gas : Nitrogen, Hidrogen, Udara
Kolom : Cp-Wax 52 CB, 25 m x 0.32 mm
Fase Diam : Polietilen glikol
Jenis Detektor : FID (Flame Ionization Detector)
Tekanan : 10 psi
Tekanan Udara : 4 bar
Tekanan Hidrogen : 2,2 bar
Tekanan Nitrogen : 1,5 bar
Split Vent : 99,2 mL/min
Purge Vent : 3,22 mL/min
Temperatur Awal : 70oC
Initial time : 2 menit
Rate : 30oC /min Temperatur Final : 220oC Waktu Final : 2 menit
Injektor B : 200oC Detektor A : 250oC
Range : 3
Injeksikan masing-masing 1 µ L larutan baku etanol dan larutan sampel
ke dalam instrumen kromatografi gas dengan pengaturan yang dipilih.
Bandingkan waktu retensi dan pemisahan antara kromatogram baku etanol dan
sampel.
E. Optimasi suhu kolom
Mengatur kromatografi gas dengan temperatur awal 50oC, 70oC dan 90oC bergantian, kemudian masing-masing injeksikan sejumlah 1 µL larutan baku.
Selanjutnya mencatat waktu retensi dan pemisahan yang dihasilkan pada
masing-masing kromatogram.
F. Optimasi initial time
Mengatur kromatografi gas dengan initial time 2 menit dan 3 menit
secara bergantian, kemudian masing-masing injeksikan sejumlah 1 µL larutan
baku etanol pada temperatur awal 50oC, 70oC, dan 90oC. Selanjutnya mencatat waktu retensi dan pemisahan yang dihasilkan pada masing-masing kromatogram.
G. Optimasi tekanan kolom
Mengatur kromatografi gas dengan tekanan kolom 5 psi, 7.5 psi dan 10
psi, atur masing-masing initial time pada 2 menit dan 3 menit secara berurutan.
Kemudian masing-masing injeksikan sejumlah 1 µL larutan baku etanol pada
temperatur awal 50oC, 70oC, dan 90oC. Selanjutnya mencatat waktu retensi dan pemisahan yang dihasilkan pada kromatogram.
G. Analisis Hasil
Kondisi optimal diperoleh dengan cara membandingkan kromatogram
yang dihasilkan pada masing-masing kondisi pengaturan instrumen yang telah
ditetapkan.
1. Waktu retensi (tR)
Waktu retensi (tR) adalah waktu mulai injeksi cuplikan hingga suatu
komponen campuran keluar kolom. Waktu retensi diukur melalui kromatogram
dari menit ke-0 hingga muncul puncak peak (Hendayana, 2010).
2. Resolusi
Resolusi didefinisikan sebagai perbedaan antara waktu retensi 2 puncak
yang saling berdekatan (∆tR = tR2-tR1) dibagi dengan rata-rata lebar puncak
(W1+W2/2). Nilai resolusi > 1,5 untuk memberikan pemisahan puncak yang baik
(Gandjar dan Rohman, 2007).
3. Faktor asimetri
Faktor asimetri (tailing factor) digunakan untuk melihat ada tidaknya
TF = puncak tinggi 10% simetri garis dari diukur puncak kedua bagian lebar puncak tinggi 10% simetri garis dari diukur puncak pertama bagian lebar
(Gandjar dan Rohman, 2007).
4. Efisiensi kolom
Ukuran efisiensi kolom dapat ditunjukkan dengan nilai HETP (Height
Equivalent to a Theoretical Plate, H). HETP diperoleh dari pembagian panjang
kolom (L) dengan jumlah lempeng (N), H= L / N. Jumlah lempeng (N) dihitung
dengan: N = 2 puncak dasar lebar retensi waktu 16
33
BAB IV
A. Hasil Pemilihan Sampel
Penelitian ini menggunakan sampel alkohol hasil produksi rumahan yang
berasal dari dusun Sentul desa Bekonang, Kabupaten Sukoharjo, Jawa Tengah.
Terdapat sekitar 70 rumah produksi yang memproduksi “ciu” Bekonang, sehingga untuk menghasilkan data dengan kadar sampel yang representatif, maka sampel
yang diambil minimal 15% dari populasi rumah produksi yang ada.
Pemilihan sampel dilakukan secara acak dengan cara mengambil undi,
sehingga terpilihlah 15 rumah produksi yang dijadikan sampel penelitian. Hasil
pemilihan sampel adalah ciu Bekonang yang diambil sebanyak 600,0 mL dari
masing-masing rumah produksi.
B. Hasil Preparasi Sampel
Preparasi sampel dilakukan dengan menggojog sampel hingga homogen
kemudian disaring dengan kertas Whatman no.1 dan disimpan dalam botol
tertutup untuk menghindari penguapan alkohol bila sampel disimpan lebih dari
satu hari. Tujuan dari homogenisasi ini untuk mendapatkan sampel yang
diasumsikan telah seragam dalam hal kadar komponen-komponen senyawanya.
Hasil preparasi sampel ini adalah sampel yang memiliki homogenitas yang tinggi,
dalam arti memiliki kadar komponen-komponen senyawa yang seragam. Tidak
seperti validasi dan penetapan kadar, pada optimasi sampel hanya digunakan
untuk melihat pemisahan yang terjadi pada sampel dalam kondisi optimasi dan
tidak dihitung nilai AUCnya.
C. Hasil Pemilihan Kolom
Pemilihan kolom merupakan hal yang sangat penting dalam penelitian
yang menggunakan metode kromatografi. Hal ini disebabkan karena kolom
merupakan tempat terjadinya pemisahan komponen-komponen sampel dan di
dalamnya terdapat fase diam sebagai pemeran penting dalam pemisahan
komponen-komponen sampel tersebut. Sampel yang digunakan diketahui
mengandung etanol yang merupakan senyawa organik cair yang bersifat mudah
menguap, polar, dan memiliki titik didih 78oC.
Berdasarkan sifat etanol tersebut, maka peneliti memilih kolom Cp-Wax
yang mengandung fase diam polietilen glikol yang memiliki sifat polar. Menurut
Sastrohamidjojo (2005), fase-fase cair (fase diam) polar, seperti polietilen glikol,
mempunyai sifat baik penerima maupun pemberi ikatan hidrogen sehingga fase
cair tersebut dapat memisahkan campuran senyawa-senyawa polar dan non polar
dalam suatu cuplikan / analit yaitu dengan menahan komponen-komponen polar.
Kolom Cp-Wax yang digunakan merupakan jenis kolom kapiler yang memiliki
kemampuan pemisahan yang lebih baik dibandingkan dengan jenis kolom kemas.
Selain memiliki keunggulan dalam menghasilkan pemisahan komponen
senyawa yang baik, kolom Cp-Wax ini memiliki keterbatasan dalam suhu. Suhu
senyawa yang titik leburnya sangat tinggi atau belum melebur di atas suhu 250oC tidak bisa dianalisis menggunakan kolom Cp-Wax.
D. Orientasi Metode Kromatografi Gas
Sebelum dilakukan optimasi, peneliti melakukan orientasi untuk
menentukan pengaturan awal kromatografi gas yang tepat. Pada awalnya peneliti
hanya mencoba-coba berbagai suhu kolom, suhu injektor, dan suhu detektor untuk
melihat seberapa bagus pemisahan yang terjadi.
1. Pemilihan Sistem Pengaturan Suhu
Awalnya peneliti menggunakan operasi suhu isothermal di mana dalam
satu running alat hanya menggunakan satu suhu. Pengaturan suhu isothermal ini
sangat bagus untuk senyawa dengan titik didih rendah, tetapi sangat lama jika
mendeteksi senyawa dengan titik didih tinggi. Selain itu suhu isothermal ini tidak
dapat memisahkan dengan jelas komponen-komponen senyawa dengan titik didih
yang berdekatan.
Gambar 7. Kromatogram Baku Etanol dengan Suhu Isothermal
A
Ket: A= etanol
Gambar 7 adalah gambar salah satu kromatogram hasil orientasi
menggunakan sistem suhu isothermal. Senyawa yang digunakan adalah baku
etanol kadar sedang, dengan pengaturan suhu kolom 120oC, suhu detektor dan injektor sama 250oC. Pengaturan itu adalah pengaturan terbaik pada saat itu, yang menghasilkan kromatogram yang cukup ramping dan runcing. Masalah yang
terjadi adalah dengan suhu yang cukup tinggi tetapi menghasilkan waktu retensi
etanol yang masih cukup lama, selain itu kromatogram ini juga memiliki nilai
faktor asimetri sama dengan 2, yang menunjukkan kromatogram tidak simetris.
Hal yang berbeda ditunjukkan pada kromatogram dengan metode
kromatografi gas suhu terprogram berikut ini:
Gambar 8. Kromatogram Baku Etanol dengan Suhu Terprogram
Gambar di atas adalah salah satu kromatogram baku etanol (A) dengan
standar internal n-butanol (B) yang dideteksi dengan kromatografi gas suhu
terprogram. Jika dibandingkan dengan kromatogram suhu isothermal sebelumnya,
kromatogram ini lebih runcing, simetris, dan ramping. Pengaturan suhu
terprogram yang dipakai yaitu suhu kolom awal 70oC, initial time 2 menit, suhu
A B
Ket: A= etanol B= n-butanol
detektor 250oC dan suhu injektor 200oC. Berbeda dengan kromatogram sebelumnya (Gambar 7), waktu retensi etanol yang dicapai lebih cepat +100 detik
walaupun suhu yang digunakan lebih rendah dari pengaturan dengan suhu
isothermal.
Fakta ini juga ditegaskan dengan pemisahan etanol dengan n-butanol
yang sangat baik. Maka dapat dikatakan bahwa dengan pengaturan suhu
terprogramkan hasil kromatogram yang diperoleh lebih baik dan pemisahan
dengan komponen senyawa lain juga lebih baik. Kelemahan pengaturan suhu
terprogramkan yaitu sistem pengaturan ini cukup kompleks sehingga perlu banyak
komponen yang butuh dioptimasi.
2. Pengaturan Alat dengan Sistem Suhu Terprogram
Seperti yang sudah disebutkan sebelumnya bahwa kekurangan sistem
suhu terprogramkan adalah pengaturannya lebih banyak daripada sistem suhu
isothermal. Pada pengaturan suhu terprogramkan terdapat pengaturan tambahan
yang tidak digunakan pada sistem suhu isothermal antara lain initial time dan
initial temperature, final time dan final temperature, serta rate. Pengaturan
tambahan inilah yang menjadikan sistem suhu terprogram dapat menghasilkan
pemisahan komponen-komponen senyawa yang lebih baik.
Initial time merupakan pengaturan yang mengatur waktu kapan kita
menginginkan fase gerak membawa sampel menuju kolom untuk dilakukan
pemisahan komponen-komponen senyawanya. Fungsi dari menahan sampel ini
adalah memberikan waktu pada kolom untuk mencapai suhu yang dikehendaki
ada initial temperature yang merupakan suhu awal kolom yang ingin dicapai
sebelum berinteraksi dengan komponen senyawa. Initial temperature ini harus
dicapai kolom selama initial time.
Kemudian initial temperature akan meningkat sesuai rate yang
diinginkan. Rate merupakan tetapan peningkatan suhu kolom beberapa derajat
setiap menitnya sampai mencapai final temperature. Peningkatan initial
temperature dimulai setelah alat melewati initial time. Tujuan meningkatkan suhu
kolom secara bertahap adalah terjadinya pemisahan komponen-komponen
senyawa yang memiliki kadar kecil dengan jelas. Selain itu juga menyebabkan
peak senyawa berkadar tinggi menjadi lebih runcing dan simetris.
Selain pengaturan yang telah disebutkan di atas, ada pengaturan lain yang
pada umumnya harus dilakukan pada alat kromatografi gas antara lain column
head pressure, split vent, purge vent, tekanan udara, tekanan hidrogen, dan
Tabel VI. Pengaturan Awal Alat Kromatografi Gas
Jenis pengaturan Hasil
Gas Nitrogen, Hidrogen, Udara Kolom Cp-Wax 52 CB, 25 m x 0.32 mm Fase Diam Polietilen glikol
Jenis Detektor FID (Flame Ionization Detector)
Column head pressure 10 psi
Tekanan Udara 4 bar Tekanan Hidrogen 2,2 bar
Tekanan Nitrogen 1,5 bar
Split Vent 99,2 mL/min.
Purge Vent 3,22 mL/min.
Initial temperature 70oC
Initial time 2 min.
Rate 30oC/min.
Final temperature 220oC
Final time 2 min.
Suhu detektor 250oC Suhu injektor 200oC
Range 3
E. Penggunaan Flame Ionization Detector (FID)
FID atau yang biasa diartikan detektor ionisasi nyala merupakan salah
satu dari sekian banyak detektor yang digunakan dalam kromatografi gas. FID
merupakan detektor yang sudah cukup lama digunakan dalam kromatografi gas,
kemampuan detektor ini dalam mendeteksi senyawa yang memiliki karbon sangat
tinggi. Selain itu FID juga memiliki sensitivitas yang tinggi jika dibandingkan
dengan detektor lain.
Oleh sebab itu peneliti tidak melakukan optimasi untuk memilih detektor
yang paling cocok, disamping karena keterbatasan alat yang dimiliki, kemampuan
diragukan lagi. FID mampu mendeteksi semua senyawa yang memiliki atom
karbon terutama golongan alkohol. Menurut Gandjar dan Rohman (2007), untuk
memperoleh tanggapan FID yang optimal sebaiknya kecepatan aliran H2 + 30
mL/menit dan O2 sepuluh kalinya. Kedua adalah suhu FID harus diatas 100oC.
Hal ini bertujuan untuk mencegah kondensasi uap air yang mengakibatkan FID
berkarat atau kehilangan (menurun) sensitivitasnya.
Dalam penelitian ini peneliti tidak menggunakan O2tetapi menggunakan
udara sebagai bahan bakar dengan alasan keamanan laboratorium (sifat oksigen
lebih reaktif ditakutkan dapat meledak). Udara juga mengandung oksigen (O2)
tetapi dalam jumlah yang relatif aman sehingga mengurangi resiko terjadi
ledakan. Selain itu dalam penelitian ini juga diperoleh kecepatan aliran H2= 35
mL/menit, dan suhu detektor yang digunakan di atas 100oC yaitu 250oC. Berikut data kecepatan aliran gas yang diperoleh:
Kecepatan Aliran Gas Total : 452 mL/min
Kecepatan Aliran Gas Udara : 417 mL/min
Kecepatan Aliran Gas Hidrogen : 35 mL/min
Kecepatan Aliran Gas Pembawa Nitrogen : 0.8 mL/min Nitrogen make up: 27.7
mL/min
Menurut Hendayana (2010), solut yang keluar dari kolom dicampur H2
dan udara kemudian dibakar pada nyala di bagian dalam detektor. Atom karbon
senyawa organik dapat menghasilkan radikal CH yang selanjutnya menghasilkan
ion CHO+dalam nyala hidrogen–udara.
-CHO+yang dihasilkan dalam nyala bergerak ke katoda yang berada di atas nyala. Arus yang mengalir di antara anoda dan katoda diukur dan diterjemahkan sebagai
sinyal pada rekorder. Kepekaan detektor ionisasi nyala akan lebih meningkat
kalau N2digunakan sebagai gas pembawa.
Oleh sebab itu digunakannya gas hidrogen dan udara pada penelitian ini
meningkatkan jumlah atom karbon yang dengan mudah dapat dideteksi oleh FID.
Gas nitrogen yang digunakan sebagai gas pembawa juga berperan penting dalam
meningkatkan kepekaan/sensitivitas dari FID. Maka dari itu, kondisi ini sudah
berpotensi untuk menghasilkan hasil yang optimal dalam penetapan kadar dan
profil senyawa alkohol hasil produksi “ciu” rumahan di daerah kabupaten Sukoharjo.
F. Optimasi Metode Kromatografi Gas
Setelah melakukan orientasi, pemilihan kolom dan detektor yang
digunakan, maka kita sudah siap untuk melakukan optimasi metode kromatografi
gas untuk menetapkan kadar dan profil senyawa alkohol dalam “ciu”. Untuk melakukan optimasi itu sendiri perlu melalui beberapa tahap berikut ini:
1. Hasil pembuatan larutan seri baku etanol kadar sedang
Larutan seri baku etanol ini akan digunakan untuk pembuatan kurva baku
dalam bagian validasi metode dan penetapan kadar. Sedangkan larutan seri baku
yang digunakan dalam optimasi adalah larutan seri baku kadar sedang 6%v/v. Hal
ini dikarenakan larutan seri baku kadar sedang sudah dapat merepresentasikan
internal n- butanol yang memiliki fungsi mengkoreksi nilai AUC yang dihasilkan
karena instrumen kromatografi gas ini tidak dapat menghasilkan nilai AUC yang
konstan.
Total optimasi instrumen kromatografi gas yang akan dilakukan
sebanyak 18 kali, meliputi 6 kali optimasi suhu kolom, 6 kali optimasi initial time,
dan 6 kali optimasi tekanan kolom (column head pressure). Sehingga total larutan
seri baku etanol kadar sedang yang dibuat sebanyak 18 larutan.
Berikut ini adalah contoh kromatogram larutan seri baku etanol kadar
sedang yang diukur dengan pengaturan awal instrumen kromatografi gas:
Gambar 9. Kromatogram Baku Etanol Kadar Sedang
Etanol memiliki titik didih yang lebih rendah dari n-butanol sehingga
terelusi terlebih dahulu oleh fase gerak. Waktu retensi etanol adalah 253 detik dan
n-butanol 324 detik.
2. Pembuatan larutan sampel dengan standar internal n-butanol
Selain menggunakan larutan seri baku etanol kadar sedang, penelitian ini
juga ingin melihat pemisahan yang terjadi pada larutan sampel yang ditambah
A B
Ket: A= etanol B= n-butanol
dengan standar internal n-butanol. Kromatogram dari larutan sampel ini kemudian
dibandingkan dengan larutan seri baku etanol untuk melihat apakah di dalam
sampel dengan n-butanol terdapat senyawa etanol dengan cara membandingkan
waktu retensi etanol dengan waktu retensi peak kromatogram yang terbentuk pada
larutan sampel.
Contoh kromatogramnya:
Gambar 10. Kromatogram Larutan Sampel
Waktu retensi kedua peak tersebut berurutan yaitu 252 detik dan 323
detik. Maka jika dibandingkan dengan waktu retensi kromatogram pada Gambar 9
dapat dipastikan pada masing-masing larutan memiliki senyawa yang sama. Peak
no. 2 adalah standar internal n-butanol dan peak no. 1 adalah senyawa etanol.
Oleh sebab itu dapat dipastikan bahwa di dalam sampel hasil produksi “ciu” mengandung etanol sehingga dapat ditetapkan kadarnya.
3. Pembuatan larutan etanol murni, sampel murni, dan n-butanol murni
Larutan etanol murni adalah larutan etanol p.a. yang tanpa penambahan
standar internal maupun pengenceran. Hal ini sama halnya dengan larutan
n-A B
Ket: A= etanol B= n-butanol
butanol murni yang merupakan larutan n-butanol p.a. tanpa ditambahkan
pengenceran. Larutan sampel murni juga merupakan larutan sampel yang tidak
dilakukan pengenceran maupun ditambahkan standar internal. Ketiga larutan ini
dibuat dan diinjeksikan pada kromatografi gas untuk melihat waktu retensi
masing-masing larutan bila tanpa pengenceran atau penambahan apapun.
Kemudian dibandingkan dengan waktu retensi senyawa pada gambar 9 dan 10.
Berikut adalah gambar kromatogram ketiga larutan tersebut:
Gambar 11. Kromatogram Larutan Baku Etanol p.a
Gambar 13. Kromatogram Sampel
Waktu retensi senyawa etanol pada gambar 11 adalah 252 detik, waktu
retensi senyawa butanol pada gambar 12 adalah 323 detik, dan waktu retensi
senyawa etanol pada sampel gambar 13 adalah 252 detik. Waktu retensi pada
kromatogram ketiga larutan tersebut memiliki kesamaan dengan waktu retensi
peak kromatogram gambar sebelumnya. Perlu diketahui semua kromatogram dari
kelima gambar ini merupakan hasil pengukuran dari pengaturan awal instrumen
kromatografi gas.
Untuk sementara dapat disimpulkan bahwa waktu retensi senyawa etanol
pada instrumen kromatografi dengan pengaturan awal sebesar 252 detik.
Sedangkan senyawa butanol sebagai standar internal memiliki waktu retensi
sebesar 323 detik.
Pengukuran sampel ini juga memiliki tujuan lain yaitu mengecek adanya
senyawa lain selain etanol yang terkandung di dalam sampel. Dengan mengubah
nilai range (lihat tabel VI) menjadi 0 maka dapat kita lihat peak senyawa-senyawa
Gambar 14. Kromatogram Sampel Range 0
Peak kecil yang ditandai nomer 1 adalah peak senyawa lain selain etanol
di dalam sampel yang dapat terdeteksi oleh instrumen kromatografi gas. Senyawa
tersebut memiliki waktu retensi 247 detik. Senyawa tersebut memiliki kadar yang
sangat kecil di dalam sampel dan tidak terlihat dalam kromatogram dengan range
3. Oleh sebab itu, untuk memastikan profil atau nama senyawa tersebut dapat
digunakan metode kromatografi gas dengan spektrofotometri massa. Hal ini
dilakukan pada bagian penetapan kadar dan profil senyawa lain.
4. Hasil optimasi suhu kolom
Kegiatan optimasi metode diawali dengan menentukan suhu kolom atau
yang dalam sistem pengaturan suhu terprogram disebut dengan initial
temperature. Pemilihan besarnya suhu kolom yang akan dioptimasi dimulai dari
pengaturan awal suhu kolom yaitu 70oC, kemudian ditambahkan 20oC dan dikurangi 20oC sehingga diperoleh 3 suhu yang akan dicoba dalam optimasi ini yakni suhu 50oC, 70oC, dan 90oC. Pengaturan instrumen yang lain seperti tekanan,
initial time, rate dan lain-lain mengikuti nilai yang tertera pada pengaturan awal. 1