BAB I
PENDAHULUAN
1.1 Latar Belakang
Unsur transisi sebenarnya tidak jauh dari kehidupan kita sehari-hari. Bagaimana kita mengetahui unsur transisi di sekitar kita? KitaKita dapat mengenali unsur-unsur transisi di kehidupan sekitar kitadari sifat-sifatnya, antara lain : semua unsur transisi adalah unsur-unsur logam. Logam bersifat lunak, mengkilap, dan penghantar listrik dan panas yang baik, unsur-unsur logam transisi mempunyaibeberapa bilangan oksidasi dan lain-lainnya.
IUPAC kemudian mendefinisikan logam transisi sebagai semua unsur yang memiliki orbit elektron d yang tidak lengkap atau yang hanya dapat membentuk ion stabil dengan orbit d yang tidak lengkap. Unsur transisi adalah unsur yang dapat menggunakan elektron pada kulit terluar dan kulit pertama terluar untuk berikatan dengan unsur-unsur yang lain.
Logam transisi didefinisikan secara tradisional sebagai semua unsur kimia pada blok-d pada tabel periodik, termasuk Kromium (Cr), Molibdenum (Mo), Tungsten (W), dan Seaborgium (Sg). Unsur-unsur tersebut termasuk golongan VIB. Unsur dalam golongan VIB memiliki karakteristik, kegunaan dan ada unsur yang baru-baru ini di temukan dari hasil sintesis dan lainya. Karakteristik yang dimiliki unsur golongan VIB belum banyak kita ketahui. Oleh karena itu, melalui makalah ini kita akan lebih mengenal sifat-sifat dari unsur dalam golongan VI B.
1.2 Rumusan Masalah
Berdasarkan uraian latar belakang pembuatan makalah ini, maka diperoleh rumusan masalah sebagai berikut:
1. Bagaimana sejarah penemuan unsur-unsur golongan VI B ?
2. Bagaimana sifat-sifat atau reaktivitas dari unsur-unsur golongan VI B ?
1.3 Tujuan
Adapun tujuan dari pembuatan makalah ini adalah
1. Mengetahui sejarah penemuan unsur-unsur dalam golongan VI B.
2. Mengetahui kegunaan dari senyawa-senyawa yang terbentuk dari golongan
VIB dalam kehidupan manusia.
BAB II
TINJAUAN PUSTAKA
2.1 Kromium
A. Sejarah Kromium
Kromium sebagai unsur logam pertama kali ditemukan dua ratus tahun yang lalu, pada 1797. Namun sejarah kromium benar-benar dimulai beberapa dekade sebelum ini. Kromium ditemukan pada tahun 1797 oleh Louis-Nicholas Vauquelin seorang profesor kimia dan analis di School of Mines di Paris, yang menerima beberapa sampel bijih crocoites untuk dianalisis sehingga ia mengungkapkan adanya unsur baru yang ia sebut Kromium.
Nama Kromium berasal dari kata Yunani “kroma” yang berarti “warna”, dinamakan demikian karena banyaknya macam warna dalam senyawanya. Namun sebelumnya, Vauquelin menganalisis zamrud dari Peru dan menemukan bahwa warna hijau adalah karena adanya unsur baru, yaitu kromium. Satu atau dua tahun kemudian seorang kimiawan dari Jerman, Tassaert yang bekerja di Paris menemukan kromium
dalam bijih Kromit, Fe(CrO2)2, yang merupakan sumber utama kromit hingga
sekarang.
B. Sifat Fisika dan Kimia
Kromium merupakan unsur yang berwarna perak atau abu-abu baja, berkilau dan keras sehingga memerlukan proses pemolesan yang cukup tinggi. Kromium tidak ditemukan sebagai logam bebas di alam. Kromium ditemukan dalam bentuk bijih
kromium, khususnya dalam senyawa PbCrO4 yang berwarna merah. PbCrO4 dapat
digunakan sebagai pigmen merah untuk cat minyak. Kromium merupakan logam masif, berwarna putih perak dan lunak jika dalam keadaan murni dengan titik leleh kira-kira 1900 0C dan titik didih kira-kira 2690 0C.
Nama, Lambang, Nomor atom Kromium, Cr, 24
Deret kimia Logam transisi
Penampilan Perak metalik
Massa atom 51,9961 (6) g/mol
Konfigurasi electron [Ar] 3d5 4s1
Jumlah elektron tiap kulit 2,8,13,1
Sifat Kimia
Struktur Kristal Cubic body centered
Bilangan oksidasi +2, +3, +4, +6 (oksida asam kuat)
Elektronegativitas 1,66 (skala Pauling)
Afinitas electron 64,3 kJ / mol -1
Energy Ionisasi E1: 652,9 kJ/mol
Panjang Ikatan Cr-Cr 249 pm
Senyawa beracun dan mudah terbakar
Sifat Fisika
Massa Jenis 7,15 g/cm3 (250C)
Titik Lebur 2180 K, 19070C, 3465 ° F
Titik Didih 2944 K, 26710C, 4840 ° F
Entalpi Peleburan 20,5 kJ mol -1
Panas Penguapan 339 kJ mol -1
Entalpi Atomisasi 397 kJ mol -1
Kapasitas Kalor (250C) 23,25 J/mol.K
Konduktivitas Termal 94 W m -1 K -1
Koefisien ekspansi termal linier 4,9 x 10 -6 K -1
Kepadatan 7,140 kg m -3
Volum Molar 7,23 cm 3
Isotop Kromium
Isotop Massa Atom Waktu paruh Kelimpahan
di alam (%)
Momen magnetik nuklir
48Cr 47,95404 21,6 hari -
-49Cr 48,951341 42,3 menit - 0,476
50Cr 49,9460464 - 4.345
-51Cr 50,944772 27,70 detik - -0,934
52Cr 51,09405098 - 83,789
-53Cr 52,9406513 - 9,501 -0,47454
54Cr 53,9388825 - 2,365
-55Cr 54,940844 3,497 menit -
-56Cr 55,94065 5,9 menit -
-C. Sumber Kromium
Logam kromium relatif jarang ditemukan dan kandungannya dalam kerak bumi diperkirakan hanya 0,0122 % atau 122 ppm, lebih rendah daripada vanadium (136 ppm) dan klorin (126 ppm). Sumber kromium yang terpenting dalam
perdagangan adalah bijih kromit (chromite), FeCrO4, yang banyak terdapat di Rusia
dan Afrika Selatan (kira-kira 96 % cadangan kromium dunia), Pilipina, Brazil, Amerika Serikat, dan Tasmania. Selain itu, kromium juga dapat ditemukan di matahari, meteorit, kerak batu dan air laut. Sumber kromium lainnya yang lebih sedikit jumlahnya adalah krokoit (crocoites), PbCrO4, dan oker kroma (chrome),
Cr2O3. Batu-batuan permata seperti zamrud (emerald) yang berwarna hijau dan merah
ruby yang mengandung sekelumit kromium sebagai pengotor.
Tabel berikut merupakan kelimpahan dari unsur kromium dalam berbagai lingkungan. Nilai-nilai yang diberikan dinyatakan dalam satuan ppb (bagian per
miliar; 1 miliar = 10 9), baik dalam hal berat maupun dalam hal jumlah atom. Nilai
kelimpahan sulit untuk ditentukan dengan pasti, sehingga semua nilai harus diperlakukan dengan hati-hati, khususnya bagi unsur-unsur yang kurang umum.
Tempat Ppb berat Ppb oleh atom
Alam semesta 15000 400
Matahari 20000 400
Meteorit (karbon) 3100000 1200000
Kerak batu 140000 55000
Arus 1 0.02
manusia 30 4
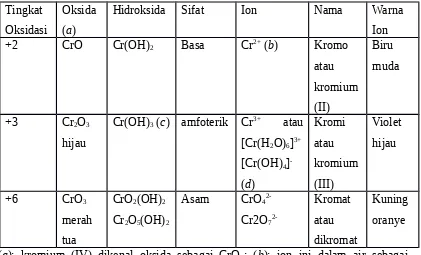
D. Persenyawaan Kromium
Reaksi dan senyawa kromium yang penting hanya menyangkut kromium dengan bilangan oksidasi +2, +3, dan +6.
Oksida Kromium
Tabel 1. karakterisasi beberapa oksida dan ion kromium
Tingkat
E. Reaksi-reaksi yang Terjadi pada Kromium
Reaksi kromium dengan udara
Logam kromium tidak bereaksi dengan udara atau oksigen pada suhu kamar.
Reaksi kromium dengan air
Logam kromium tidak bereaksi dengan air pada suhu kamar.
Reaksi kromium dengan halogen
a) Fluorida
Kromium bereaksi langsung dengan fluorin, F2, pada suhu 400°C, dan
Cr (s) + 3F2 (g) → CrF6 (s) [kuning]
Di bawah kondisi ringan, kromium (V) bereaksi dengan fluorida, membentuk CrF5
2Cr (s) + 5F2 (g) → 2CrF5 (s) [merah]
2Cr (s) + 3F2 (g) → 2CrF3 (s) [hijau]
Selain membentuk kromium heksafluorida, CrF6, kromium trifluorida, CrF3 dan
kromium pentafluorida, CrF5, reaksi kromium dengan fluorida juga dapat membentuk
kromium difluorida, CrF2, dan kromium tetrafluorida, CrF4.
b) Klorida
Di bawah kondisi yang masih ringan, logam kromium dapat bereaksi dengan
unsur klorin, Cl2 membentuk CrCl3.
2Cr (s) + 3Cl2 (g) → 2CrCl3 (s) [merah-violet]
Selain membentuk kromium triklorida, CrCl3, reaksi kromium dengan klorida juga
dapat membentuk kromium diklorida, CrCl2 dan kromium tetraklorida, CrCl4
c) Bromida
Di bawah kondisi yang masih ringan, logam kromium dapat bereaksi dengan
unsur bromida, Br2 membentuk CrBr3.
2Cr (s) + 3Br2 (g) → 2CrBr3 (s) [sangat hijau]
Selain membentuk kromium tribromida, CrBr3, reaksi kromium dengan bromida juga
dapat membentuk kromium dibromida, CrCl2 dan kromium tetrabromidaa, CrCl4
d) Iodida
Di bawah kondisi yang masih ringan, logam kromium dapat bereaksi dengan
unsur iodida, I2 membentuk CrI3
2Cr (s) + 3I2 (g) → 2CrI3 (s) [hijau gelap]
Selain membentuk kromium triiodida, CrI3, reaksi kromium dengan iodida juga dapat
membentuk kromium diiodida, CrI2 dan kromium tetraiodida, CrI4
Reaksi kromium dengan asam
Logam kromium larut dalam asam klorida encer membentuk larutan Cr(II) serta gas
hidrogen, H2. Dalam keadaan tertentu, Cr(II) hadir sebagai ion kompleks [Cr(OH2)6]2+.
Hasil yang sama terlihat untuk asam sulfat, tetapi kromium murni tahan terhadap
serangan. Logam kromium tidak bereaksi dengan asam nitrat, HNO3.
Contoh reaksi kromium dengan asam klorida:
Cr (s) + 2HCl (aq) → Cr 2+ (aq) + 2Cl - (aq) + H
2 (g)
Oksida
Reaksi kromium dengan oksida dapat membentuk beberapa senyawa, diantanya:
Kromium dioksida, CrO2, Kromium trioksida, CrO3, Dikromium trioksida, Cr2O3 dan
Trikromium tetraoksida, Cr3O4.
Sulfida
Reaksi kromium dengan sulfida dapat membentuk beberapa senyawa, diantanya :
Nitrida
Reaksi kromium dengan nitrida dapat membentuk senyawa kromium nitrida, CrN.
Karbonil
Reaksi kromium dengan karbonil dapat membentuk senyawa kromium heksakrbonil,
Cr(CO)6. Kromium juga dapat bereaksi dengan unsur tertentu membentuk senyawa
kompleks, misalnya reaksi kromium dengan kompleks nitrat membentuk nitrat
hexaaquakromium trihidrat, [Cr(NO3)3.9H2O].
F. Kegunaan Kromium
Digunakan untuk mengeraskan baja, untuk pembuatan stainless steel, dan
untuk membentuk paduan
Digunakan dalam plating untuk menghasilkan permukaan yang indah dan
keras, serta untuk mencegah korosi
Digunakan untuk memberi warna hijau pada kaca zamrud
Digunakan sebagai katalis. seperti K2Cr2O7 merupakan agen oksidasi dan
digunakan dalamanalisis kuantitatif dan juga dalam penyamakan kulit
Merupakan suatu pigmen, khususnya krom kuning
Digunakan dalam industri tekstil sebagai mordants
Industri yang tahan panas menggunakan kromit untuk membentuk batu bata
dan bentuk, karenamemiliki titik lebur yang tinggi, sedang ekspansi termal, dan stabil struktur Kristal
Dibidang biologi kromium memiliki peran penting dalam metabolisme
glukosa
Digunakan untuk aplikasi medis, seperti Cr-51 yang digunakan untuk
mengukur volume darah dan kelangsungan hidup sel darah merah
Digunakan sebagai pigmen merah untuk cat minyak, khususnya senyawa
PrCrO4
Digunakan dalam pembuatan batu permata yang berwarna. Warnanya kerap
digunakan adalah warna merah, yang diperoleh dari kristal aluminium oksida yang kedalamnya dimasukkan kromium
Bahan baku dalam pembuatan kembang api. Hal ini diperoleh dari Hasil
pembakaran amoniumdikromat, (NH4)2Cr2O7, yang berisi pellet dari raksa
tiosianat (HgCNS).
Penggunaan utama kromium adalah sebagai paduan logam seperti pada
stainless steel, chrome plating, dan keramik logam.
Chrome plating pernah digunakan untuk memberikan lapisan keperakan
Kromium digunakan dalam metalurgi sebagai anti korosi dan pemberi kesan mengkilap.
Digunakan pada pewarna dan cat, untuk memproduksi batu rubi sintetis, dan
sebagai katalis dalam pencelupan dan penyamakan kulit.
Kromium (IV) oksida (CrO2) digunakan untuk pembuatan pita magnetik.
Khrom digunakan untuk mengeraskan baja, pembuatan baja tahan karat dan
membentuk banyak alloy (logam campuran) yang berguna. Kebanyakan digunakan dalam proses pelapisan logam untuk menghasilkan permukaan logam yang keras dan indah dan juga dapat mencegah korosi. Khrom memberikan warna hijau emerald pada kaca. Industri refraktori menggunakan khromit untuk membentuk batu bata, karena khromit memiliki titik cair yang tinggi, pemuaian yang relatif rendah dan kestabilan struktur kristal.
Beberapa senyawa kromium digunakan sebagai katalis. Misalnya Phillips
katalis untuk produksi polietilen adalah campuran dari kromium dan silikon dioksida atau campuran dari krom dan titanium dan aluminium oksida. Kromium (IV) oksida (CrO 2) merupakan sebuah magnet senyawa Kromium merupakan logam tahan korosi (tahan karat) dan dapat dipoles menjadi mengkilat. Dengan sifat ini, kromium (krom) banyak digunakan sebagai pelapis pada ornamen-ornamen bangunan, komponen kendaraan, seperti knalpot pada sepeda motor, maupun sebagai pelapis perhiasan seperti emas, emas yang dilapisi oleh kromium ini lebih dikenal dengan sebutan emas putih.
Perpaduan Kromium dengan besi dan nikel menghasilkan baja tahan karat.
Kromium (IV) oksida digunakan untuk pembuatan pita magnetik digunakan dalam performa tinggi dan standar kaset audio. Asam kromat adalah agen oksidator yang kuat dan merupakan senyawa yang bermanfaat untuk membersihkan gelas laboratorium dari setiap senyawa organik. Hal ini disiapkan dengan melarutkan kalium dikromat dalam asam sulfat pekat, yang kemudian digunakan untuk mencuci aparat. Natrium dikromat kadang-kadang digunakan karena lebih tinggi kelarutan (5 g/100 ml vs 20 g/100 ml masing-masing). Kalium dikromat merupakan zat kimia reagen, digunakan dalam membersihkan gelas laboratorium dan sebagai agen titrating.
Dalam industri logam, kromium terutama digunakan untuk membuat paduan
membuat berbagai macam pernik kendaraan bermotor karena sangat mengkilap. Penggunaan kromium sebagai refraktori terutama karena mempunyai titik leleh yang tinggi (1857°C), koefisien muai yang tidak terlalu besar dan mempunyai bentuk kristal yang stabil.
Kromium digunakan untuk melapisi baja untuk variasi (pernik) kendaraan
bermotor dan untuk tujuan dekoratif lainnya. Pelapisan itu dilakukan secara elektrolisis, yaitu dengan electroplating. Untuk tujuan itu digunakan senyawa kromium dengan tingkat oksidasi +6. Dalam prosesnya, kromium mula-mula direduksi menjadi Cr+ baru kemudian menjadi kromium. Akan tetapi, jika larutan yang digunakan adalah Cr3+, ternyata pelapisan tidak teijadi. Hal itu disebabkan ion Cr3* dalam air terikat sebagi ion kompleks yang stabil, yaitu [Cr(H20)6]3+. Ion kompleks ini tidak mudah direduksi. Jika yang digunakan adalah Cr6+, maka ion Cr3"1" terbentuk dalam suatu lapisan di permukaan logam dan tidak lagi bereaksi dengan air, melainkan langsung direduksi menjadi unsur kromium (Cr).
G. Efek Kesehatan Kromium
Kromium (III) adalah esensial bagi manusia dan kekurangan dapat menyebabkan kondisijantung, gangguan dari metabolisme dan diabetes. Tapi terlalu banyak penyerapan kromium (III)dapat menyebabkan efek kesehatan juga, misalnya ruam kulit.
Kromium (VI) adalah bahaya bagi kesehatan manusia, terutama bagi orang-orang yangbekerja di industri baja dan tekstil. Orang yang merokok tembakau juga memiliki kesempatanyang lebih tinggi terpapar kromium.
Kromium (VI) diketahui menyebabkan berbagai efek kesehatan. sebuah senyawa dalamproduk kulit, dapat menyebabkan reaksi alergi, seperti ruam kulit. Pada saat bernapas ada krom(VI) dapat menyebabkan iritasi dan hidung mimisan. Masalah kesehatan lainnya yangdisebabkan oleh kromium (VI) adalah:
Bahaya kesehatan yang berkaitan dengan kromium bergantung pada keadaan oksidasi.Bentuk logam (krom sebagaimana yang ada dalam produk ini) adalah toksisitas rendah. Bentukyang hexavalent beracun. Efek samping dari bentuk hexavalent pada kulit mungkin termasukdermatitis, dan reaksi alergi kulit. Gejala pernafasan termasuk batuk, sesak napas, dan hidung gatal.
Bentuk Keracunan Kromium
Efek racun akan timbul, jika menghirup udara tempat kerja yang terkontaminasi, misalnya dalam pengelasan stainless steel, kromat atau produksi pigmen krom, pelapisan krom, dan penyamakan kulit. Selain itu, jika menghirup serbuk gergaji dari kayu yang mengandung kromium akan menimbulkan efek keracunan. Efek toksik kromium dapat merusak dan mengiritasi hidung, paru-paru, lambung, dan usus. Dampak jangka panjang yang tinggi dari kromium menyebabkan kerusakan pada hidung dan paru-paru. Mengonsumsi makanan berbahan kromium dalam jumlah yang sangat besar, menyebabkan gangguan perut,bisul, kejang, ginjal, kerusakan hati, dan bahkan kematian
Efek Klinis
Efek dari chromium terhadap kesehatan yakni bisa mengalami gangguan pernapasan dan juga mengganggu alat pencernaan. Chromium(Vi) dikenal untuk menyebabkan berbagai kesehatan mempengaruhi. Ketika chromium merupakan suatu campuran di dalam produk kulit, itu dapat menyebabkan reaksi alergi, seperti ruam kulit. Setelah bernafas chromium(VI) dapat menyebabkan gangguan hidung dan
Logam kromium sangat sulit diabsorbsi melalui saluran pencernaan. Absorbsi
dalam jumlah yang cukup dari beberapa senyawa kromium dapat menyebabkan pusing, haus berat, sakit perut, muntah, syok, oliguria atau anuria dan uremia yang mungkin bisa fatal.
Bila terhirup / inhalasi
Paparan berulang dalam jangka waktu yang lama dari beberapa senyawa
kromium dilaporkan menyebabkan borok (ulcerasi) dan berlobang (perforasi) pada nasal septum, iritasi pada tenggorokan dan saluran pernafasan bagian bawah, gangguan pada saluran pencernaan, tapi hal ini jarang terjadi, gangguan pada darah, sensitisasi paru, pneumoconiosis atau fibrosis paru dan efek pada hati hal ini jarang terjadi. Pada hakekatnya efek ini belum pernah dilaporkan terjadi akibat paparan logam.
Bila kontak dengan kulit.
Paparan berulang dalam jangka waktu yang lama dari beberapa senyawa
kromium dilaporkan menyebabkan berbagai tipe dermatitis, termasuk eksim “Chrome holes” sensitisasi dan kerusakan kulit dan ginjal. Pada hakekatnya efek ini belum pernah dilaporkan akibat paparan logam.
Bila kontak dengan mata
Paparan berulang dalam jangka waktu yang lama untuk beberapa senyawa
krom dapat menyebabkan radang selaput mata (konjungtivities) dan lakrimasi. Pada hakekatnya efek ini belum pernah dilaporkan akibat paparan logam.
Dampak Lingkungan
Ada beberapa jenis kromium yang berbeda dalam efek pada organisme. Kromium memasuki udara, air dan tanah di krom (III) dan kromium (VI) bentuk melalui proses-prosesalam dan aktivitas manusia. kegiatan utama manusia yang meningkatkan konsentrasi kromium(III) yang meracuni kulit dan manufaktur tekstil. Kegiatan utama manusia yang meningkatkan kromium (VI) konsentrasi kimia, kulit dan manufaktur tekstil, elektro lukisan dan kromium (VI) aplikasi dalam industri. Aplikasi ini terutama akan meningkatkan konsentrasi kromium dalamair. Melalui kromium pembakaran batubara juga akan berakhir di udara dan melalui pembuanganlimbah kromium akan berakhir di tanah.
Tanaman mengandung sistem yang mengatur kromium-uptake harus cukup rendah tidak menimbulkan bahaya. Tetapi ketika jumlah kromium dalam tanah meningkat, hal ini masih dapatmengarah pada konsentrasi yang lebih tinggi dalam tanaman. Peningkatan keasaman tanah jugadapat mempengaruhi pengambilan kromium oleh tanaman. Tanaman biasanya hanya menyerapkromium (III). Ini mungkin merupakan jenis penting kromium, tetapi ketika konsentrasi melebihinilai tertentu, efek negatif masih dapat terjadi.
Kromium tidak diketahui terakumulasi dalam tubuh ikan, tetapi konsentrasi tinggikromium, karena pembuangan produk-produk logam di permukaan air, dapat merusak insangikan yang berenang di dekat titik pembuangan. Pada hewan, kromium dapat menyebabkanmasalah pernapasan, kemampuan yang lebih rendah untuk melawan penyakit, cacat lahir,infertilitas dan pembentukan tumor.
Toksiksitas Kromium
Kontaminasi logam berat di lingkungan merupakan masalah besar dunia saat ini. Persoalan spesifik logam berat di lingkungan terutama karena akumulasinya sampai pada rantai makanan dan keberadaannya di alam, serta meningkatnya sejumlah logam berat yang menyebabkan keracunan terhadap tanah, udara dan air meningkat. Proses industri dan urbanisasi memegang peranan penting terhadap peningkatan kontaminasi tersebut. Suatu organisme akan kronis apabila produk yang dikonsumsikan mengandung logam berat. Kromium (Cr) merupakan elemen berbahaya di permukaan bumi dan dijumpai dalam kondisi oksida antara Cr(II) sampai Cr(VI), tetapi hanya kromium bervalensi tiga dan enam memiliki kesamaan sifat biologinya.
untuk manusia, tetap merupakan pekerjaan yang sulit, meliputi indentifkasi fungsi fisiologik khusus yang berhubungan dengan kadar kromium, tidak terang-terangan melawan dan berpengaruh terutama terhadap fungsi-fungsi tersebut dengan faktor-faktor yang berdampingan.
2.2 Molibdenum
A. Sejarah Molibdenum
Pada tahun 1778 seorang ahli kimia terkenal Swedia, C. W. Scheele telah
berhasil membuat suatu oksida unsur baru dari mineral molibdenit, MoS2, dengan
demikian ia mampu membedakan mineral ini dengan grafit yang pada waktu itu diduga identik. Kemudian setelah 3 tahun kemudian, P.J. Helm berhasil mengisolasi molibdenum dari pemanasan molibdenit dengan batubara. Nama molibdenum berasal
dari bahasa Yunani, molibdos, yang artinya mengandung makna kebingungan ketika
menghadapi mineral-mineral lunak hitam yang dapat dipakai untuk menulis, yaitu grafit yang disebut timbel hitam dan plumbako.
B. Sifat Fisika dan Kimia
Logam molibdenum merupakan logam golongan 6, dimana logam ini cenderung memiliki tingkat oksidasi rendah sehingga membuat unsure ini semakin tidak stabil dengan naiknya nomor atom. Seperti halnya kromium, konfigurasi
elektron molibdenum menyimpang dari diagram aufbau. Konfigrasi elektron tingkat
dasar Molibdenum adalah d5s1, dengan sebuah konfigurasi terisi setengah d5 yang
stabil. Apabila dilihat dari struktur elektronnya, Molibdenum diharapkan untuk membentuk senyawa-senyawa dengan tingkat oksidasi dari (+1) sampai (+6).
Tingkat oksidasi Molibdenum yang paling penting adalah (+5) dan (+6). Mo(+6) bersifat stabil, sedangkan Mo(+3) bersifat sangat mereduksi. Hal ini sesuai dengan kecenderungan bahwa semakin menurun posisi unsur dalam satu golongan maka semakin tinggi tingkat oksidasi menjadi lebih stabil dan tingkat oksidasi lebih lemah menjadi kurang stabil.
Nama, Lambang, Nomor atom Molibdenum, Mo, 42
Deret Kimia Logam transisi
Golongan, periode, Blok VIB, 5, d
Penampilan abu-abu
Konfigurasi Elektron [Kr] 4d5 5s1
Jumlah elektron tiap kulit 2, 8, 18, 13, 1
Sifat Kimia
Struktur Kristal Cubic body centered
Bilangan oksidasi +3, +4, +5, +6 (oksida asam kuat)
Elektronegativitas 1,8 (skala Pauling)
Massa jenis (sekitar suhu kamar) 10,28 g/cm3
Titik lebur 2896 K, 2623 oC, 4753 oF
Titik didih 4912 K, 4639 oC, 8382 oF
Kalor peleburan 37,48 kJ/mol
Kalor penguapan 617 kJ/mol
Kapasitas kalor (25 oC) 24,06 J/(mol.K)
Resistivitas listrik (20 °C) 53.4 nΩ·m
Konduktivitas termal (300 K) 138 W/(m·K)
Ekspansi termal (25 °C) 4.8 µm/(m·K)
C. Sumber Molibdenum
Sumber molibdenum yang terpenting adalah molibdenit sulfida, MoS2, dan yang
lainnya adalah bijih wulfenit, PbMoO4, dan powelit, Ca(Mo,W)O4 (Sugiyarto dan
Suyani, 2010). Logam molibdenum diproduksi sebagai hasil utama maupun hasil sampingan dalam pengolahan tembaga. Pada proses tersebut, bijih molibdenit terlebih dahulu dipisahkan dengan teknik flotasi, kemudian dipanggang untuk memperoleh
oksidanya, MoO3. Jika ingin digunakan langsung sebagai paduan logam seperti pada
kadang-kadang sebagai dimolibdat, [NH4]2[Mo2O7], atau sebagai paramolibdat,
[NH4]6[Mo7O24].4H2O dengan bergantung pada kondisinya. Molibdat ini kemudian
dapat direduksi dengan gas H2 menjadi serbuk logam molibdenum yang berwarna
abu-abu. Selain itu, MoO3 dapat dibuat dengan memanaskan logamnya atau
sulfidanya dalam oksigen. Oksida-oksida ini tidak bereaksi dengan asam, tetapi larut dalam larutan basa membentuk larutan molibdat.
MoO2 dapat diperoleh dari reduksi MoO3 dengan H2 atau NH3 pada temperatur di
bawah 470 oC, diatas temperatur ini terjadi reduksi lebih lanjut menjadi logamnya.
Selain itu, MoO2 juga dapat diperoleh dari reaksi molibdenum dengan uap air panas
pada suhu ~800 oC.
Mo2O5 dapat diperoleh dari reduksi MoO3 dengan serbuk molibdenum pada ~750
oC. Penambahan amonia ke dalam larutan yang mengandung Mo(V) hasil reduksi
tersebut akan diperoleh endapan coklat MoO(OH)3 dan apabila endapan ini
dipanaskan akan menghasilkan Mo2O5.
D. Persenyawaan Molibdenum
Oksida molibdenum banyak yang sudah dikenal, yaitu MoO3, Mo2O5, dan MoO2.
Oksida MoO2 berupa padatan coklat violet, tidak larut dalam asam nitrat pekat dan
terjadi oksidasi lebih lanjut menjadi Mo(VI). MoO2 mengadopsi struktur rutil (TiO2).
E. Reaksi-reaksi yang Terjadi pada Molibdenum
Molibdenum tidak dapat bereaksi dengan air pada suhu kamar. Molibdenum juga tidak dapat bereaksi dengan udara atau oksigen pada suhu kamar, akan tetapi pada
suhu tinggi (di atas suhu 790 oC) akan membentuk molibdenum(VI) trioksida:
2Mo (s) + 3O2 (g) 2MoO3 (s)
Reaksi dengan halogen akan membentuk molibdenum halida, misalnya jika molibdenum direaksikan dengan fluorin, maka akan membentuk molibdenum(VI) fluorida.
Mo (s) + 3F2 (g) MoF6 (l)
Molibdenum(VI) biasanya membentuk spesies dioksida dengan kedua ikatan Mo =
O adalah cis. Jadi, MoO3 dalam 12MHCl membentuk kompleks [MoO2Cl4]2-. Selain
itu, molibdenum(VI) juga membentuk kompleks molibdenum pentaklorida [MoCl5]
(= Mo2Cl10)
Selain itu, kompleks yang mudah didapatkan yang digunakan untuk sintesis kompleks lain adalah ion pentaklorooksomolibdat(V) yang berwarna hijau jambrut,
[MoOCl5]2-. Senyawa kompleks ini dapat diperoleh dengan reduksi MoO42- dalam
Sekitar 75 persen dari molibdenum yang digunakan di Amerika Serikat pada tahun 1996 dijadikan campuran untuk baja dan besi. Hampir setengah dari campuran ini digunakan untuk membuat stainless dan baja tahan panas. Hasilnya dapat digunakan dalam pesawat terbang, pesawat ruang angkasa, dan rudal bagian. Penggunaan penting lainnya adalah campuran molibdenum dalam produksi alat-alat khusus, seperti: busi, shaft baling-baling, senapan barel, peralatan listrik digunakan pada temperatur tinggi, dan boiler pelat.
Penggunaan penting lainnya adalah sebagai katalis molibdenum. Katalis adalah zat yang digunakan untuk mempercepat atau memperlambat suatu reaksi kimia. Katalis tidak mengalami perubahan wujud selama reaksi. Katalis molybdenum digunakan dalam berbagai operasi kimia, dalam industri minyak bumi, dan dalam produksi polimer dan plastik. Pada jumlah yang kecil, molibdenum efektif untuk mengeraskan baja. Molibdenum digunakan pada komponen pesawat terbang, peluru, filamen pada pemanas elektrik dan lapisan pelindung pada ketel. Molibdenum orange merupakan pigmen antara merah-kuning ke merah-orange terang dan digunakan pada cat, tinta, plastik, dan senyawa-senyawa karet.
Molibdenum disulfida merupakan pelumas yang baik, terutama pada suhu tinggi. Molibdenum juga digunakan pada beberapa aplikasi elektronik, sebagai pelapis logam konduktif pada transistor film-tipis.
Molibdenum merupakan salah satu bahan paduan baja yang menjadikan baja bersifat keras dan kuat. Selain itu, molibdenum digunakan dalam oksida dan sistem lain sebagai katalis untuk berbagai reaksi, salah satu contoh adalah “amonoksidasi” akrilonitril menurut persamaan reaksi.
MoS2 digunakan sebagai pelumas padat yang ditambahkan ke oli dan digunakan
sebagai katalis dalam reaksi hidrogenasi.
G. Ekstraksi Molibdenum
Logam Molibdenum murni dapat diperoleh dari Molibdenum trioksida (Mo0 3)
dalam berbagai cara. Molibdenit ini pertama dipanaskan sampai suhu 700 ° C (1292 ° F) dan sulfida yang teroksidasi menjadi oksida (VI) molibdenum melalui udara:
2MoS2 + 7O2 → 2MoO3 + 4SO2
Bijih teroksidasi kemudian dipanaskan sampai 1.100 ° C (2010 ° F) untuk menghaluskan oksida, atau pencucian dengan amonia yang kemudian bereaksi dengan oksida (VI) molibdenum untuk membentuk molybdate yang larut dalam air:
MoO3 → NH4OH + 2(NH4) 2(MoO4) + H2O
H. Efek Kesehatan Molibdenum
Pada manusia, molybdenum dikenal berfungsi sebagai kofaktor untuk tiga enzim:
Sulfit oksidase mengkatalisis transformasi sulfit ke sulfat, reaksi yang
diperlukan untuk metabolisme kandungan asam amino (metionin dan sistein).
Xanthine oksidase mengkatalisis pemecahan nukleotida (prekursor untuk
DNA dan RNA) untuk membentuk asam urat, yang berkontribusi terhadap kapasitas antioksidan plasma darah.
Oksidase Aldehyde dan xanthine oksidase mengkatalisis reaksi hidroksilasi
yang melibatkan beberapa molekul yang berbeda dengan struktur kimia yang sama. oksidase Xanthine dan oksidase aldehida juga berperan dalam metabolisme obat dan racun.
Nilai ambang batas Mo dalam tubuh manusia
Anak-anak 1-3 tahun 300 µg / hari
Anak-anak 4-8 tahun 600 µg / hari
Anak-anak 9-13 tahun 1.100 µg / hari (1,1 mg / hari
Remaja 14-18 tahun 1.700 µg / hari(1,7 mg / hari
Dewasa 19 tahun dan lebih tua 2.000 (2,0 mg / hari)
Molibdenum diperlukan untuk oksidasi belerang, suatu komponen dari protein. Molibdenum terdapat dalam susu, buncis, roti dan gandum.
Kekurangan Molibdenum
Kekurangan molibdenum yang disebabkan karena asupan yang tidak memadai pada orang yang sehat, belum pernah diteliti. Tetapi kekurangan molibdenum terjadi pada keadaan tertentu misalnya jika seorang malnutrisi yang menderita penyakit Chron mendapatkan makanan parenteral dalam waktu yang lama tanpa tambahan molibdenum.
darah dan nyeri sendi. Penambang yang terpapar debu molibdenum bisa mengalami gejala-gejala yang tidak spesifik.
2.3 Wolfram
A. Sejarah Wolfram
Wolfram atau Tungsten ditemukan oleh Juan Jose dan Fausto de Elhuyar pada tahun 1783 di negara Spain. Dalam bahasa Swedia, Tungsten memiliki arti batu berat. Nama lain dari Tungsten adalah Wolfram yang berasal dari bahasa Jerman dengan simbol W.
Pada tahun 1779, Peter Woulfe menguji mineral tungstenit dan menyimpulkan adanya zat baru dalam mineral tersebut. Pada tahun 1758, Scheele menemukan bahwa asam yang baru dapat dibuat dari tungsten. Scheele dann Bergman mengusulkan adanya kemungkinan mendapatkan logam yang baru dengan mereduksi logam ini. De Elhuyar menemukan bahwa asam dalam tungstenit sama dengan asam tungsten.
Tahun 1783, unsur tungsten diperoleh dengan mereduksi asam tungstat dengan arang. Pada tahun 1781, Scheele dan T. Bergmann mengisolasi oksida baru
dari mineral yang disebut skelit, CaWO4. Dua tahun kemudian, dua bersaudara J. J
dan F. De Elhuyar dari spanyol menunjukkan bahwa oksida yang sama merupakan konstituen dari mineral wolframit dan pemanasan oksida ini dengan barubara berhasil mereduksinya menjadi logam yang kemudian diberi nam wolfram. Nama ini direkomendasikan oleh IUPAC, namun komunikasi bahasa Inggris memilih memakai nama tungsten.
B. Sifat Fisika dan Kimia
Tungsten murni adalah logam yang berwarna putih timah hingga abu-abu baja. Tungsten yang sangat murni dapat dipotong dengan gergaji besi dan dapat dibentuk dengan mudah. Dalam keadaan tidak murni, dibutuhkan usaha keras untuk membentuk tungsten. Logam transisi yang sangat keras ini ditemukan pada mineral seperti wolframit dan schelit.
Wolfram memiliki titik lebur yang lebih tinggi dari semua unsur logam dan
pada suhu 16500C memiliki kekuatan regang tertinggi. Bentuk murni wolfram
digunakan terutama dalam perangkat elektronik. Senyawa dan aloy-nya digunakan secara luas dalam berbagai seperti filamen bola lampu, tabung sinar-X, dan superaloy. Adapun sifat-sifat dari wolfram secara rici akan disebutkan pada tabel di bawah ini :
Spesifikasi Rincian
Nama Wolfram
Lambang W
Penampilan Putih keabu-abuan mengkilap
Massa Atom 183,948 g/mol
Konfigurasi Elektron (Xe)4f14 5d4 6s2
Jumlah elektron tiap kulit 2, 8, 18, 32, 12, 2
Fase Padat
Massa Jenis (T kamar) 19,25 g/cm3
Titik lebur 3695 K, 34220C, 61920F
Titik didih 5828 K, 55550C, 100310F
Struktur Kristal Cubic body centered (kubus berpusat muka)
Bilangan Oksidasi +2, +3, +4, +5, +6 (Oksida asam lemah)
Elektronegatifitas 1,7 (skala Pauling)
Energi ionisasi E1 : 770 kj/mol
E2 : 1700 kj/mol E3 : 2300 kj/mol
C. Sumber dan Ekstraksi Wolfram
Tungsten terdapat dalam mineral tungstenit wolframit Fe(Mn)WO4, CaWO4,
huebnerit MnWO4, dan ferberit FeWO4(Cotton dan Wilkinson, 1989). Tempat
penambangan tungsten yaitu di Klifornia, Kolorado, Korea Selatan, Bolivia, Rusia dan Portugal. Di China dilaporkan memiliki persediaan tungsten 75% di dunia.
Unsur tungsten diperoleh secara komersial dengan mereduksi tungsten oksida dengan hidrogen atau karbon. Proses pembuatannya yaitu dengan menghancurkan mineral tungsten secara mekanik dan direaksikan dengan lelehan NaOH. Lelehan kemudian dilarutkan dalam air untuk memperoleh Na-tungstenat yang kemudian
diasamkan untuk mendapatkan WO3 yang selanjutnya direduksi dengan hidrogen
ungtuk memperoleh logamnya.
Logam Wolfram juga dapat diperoleh dengan pemanasan langsung campuran bijih,
tungstat scheelit, CaWO4 dan wolframit, Fe(Mn)WO4 (hingga meleleh) dengan alkali,
kemudian diendapkan dalam air sebagai WO3 dengan penambahan asam. Reduksi
oksida dengan H2 pada suhu ~8500C akan menghasilkan serbuk logam wolfram
berwarna abu-abu. Serbuk logam juga dapat diubah menjadi padatan dengan
kompresi tinggi menggunakan gas H2.
D. Persenyawaan Wolfram
Beberapa oksida yang umum adalah WO3 (kuning) dan WO2. Trioksida dibuat
dengan memanaskan logam wolfram dengan senyawa lain seperti sulfida dalam oksigen. Oksida tersebut tidak bereaksi dengan asam tetapi larut dalam basa
leleh ~1200 0C. Dioksida (WO
2) dibuat dengan mereduksi trioksida dengan hidrogen
atau NH3 pada suhu kurang lebih 4700C.
E. Reaksi-reaksi yang Terjadi pada Wolfram
Reaksi dengan air
Pada suhu ruangan, tungsten tidak bereaksi dengan air
Reaksi dengan udara
2W(s) + 3 O2 → 2WO3 (s)
Reaksi dengan Halogen
W(s) + 3F2 (g) → 3F6 (g)
W (s) + 3Cl2 (g) → WCl6 (s)
W(s) + 3Br2 (g) → WBr6 (s)
2W(S) + 5Cl2 (g) → 2WCl5 (s)
Reaksi dengan asam
Secara umum logam tungsten tidak terpengaruh oleh kebanyakan asam. Menurut Cotton dan Wilkinson (1989), wolfram tidak diserang oleh asam selain HF. Artinya logam tungsten tidak dapat bereaksi dengan asam selain HF.
Reaksi dengan basa
Logam tungsten tidak berekasi dengan larutan basa lemah.
F. Kegunaan Wolfram
Tungsten beserta aloynya dapat digunakan pada pembuatan filament lampu pijar, tabung elektron, dan televisi, untuk titik kontak pada distributor mobil, unsur windings (proses pencarian logam pada tungku listrik), pemanasan pada tungku listrik, paduan logam untuk alat pemotong bersuhu tinggi dan pada pesawat luar angkasa. Aloy yang digunakan untuk peralatan berkecepatan tinggi seperti Hastelloy.
G. Bahaya Wolfram
BAB III PENUTUP
3.1 Kesimpulan
Titik didih, titikleleh, jari-jari atom, kerapatan, elektronegativitas, dan energi
ionisasi dari atas kebawah (kromium sampai seaborgium) adalah semakin besar.
Kromium ditemukan pada Pada 26 Juli 1761, Johann Gottlob Lehmann
menemukan mineral oranye-merah di Pegunungan Ural, yang sekarang banyak digunakan sebagai komponen zat dan banyak digunakan di industri kimia, industri refraktory dan pengecoran
Molibdenum adalah salah satu logam pertama yang ditemukan oleh para ahli
kimia modern. Ditemukan pada tahun 1778 oleh kimiawan Swedia Carl Wilhelm Scheele.
Molibdenum tahan panas dan tahan zat kimia sehingga dapat digunakan sebagai
elektroda, sebagai katalis dalam pembuatan minyak bumi,sebagai pelumas pada suhu yang tinggi, dan unsur penting dalam pengikatan oksigen dan proses metabolisme
Tungsten ditemukan oleh seorang ahli Swedia yang bernama Peter
3.2 Saran
Bagi Penulis
Semoga karya tulis dapat membantu dalam memahami sifat-sifat dan kegunaan dari unsur golongan VI B dan bisa menjadi acuan bagi para penulis untuk membuat karya tulis yang lebih baik.
Bagi Mahasiswa
DAFTAR PUSTAKA
Cotton dan Wilkinson. 1989. Dasar Kimia Anorganik. UI Press, Yogyakarta. Day dan Underwood. 1981. Analisa Kimia Kuntitatif. Erlangga, Jakarta. Petrucci. 1985. Kimia Dasar: Prinsip dan Terapan Modern. Erlangga, Jakarta. Sunardi. 2006. 116 Unsur Kimia Deskripsi dan Pemanfaatannya. Yrama Widya,