KAJIAN HIDROLISIS ENZIMATIK OMEGA-3 MENGGUNAKAN
DITAMBAHKAN
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
ENZIMATIK MINYAK IKAN UNTUK PRODUKSI MENGGUNAKAN LIPASE Aspergillus niger PADA MEDIA
DITAMBAHKAN HEPTANA
Oleh Zulfatun Najah
F 34052594
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
BOGOR
UNTUK PRODUKSI PADA MEDIA YANG
Zulfatun Najah. F34052594. Kajian Hidrolisis Enzimatik Minyak Ikan Untuk Produksi Omega-3 Menggunakan Enzim Lipase Aspergillus niger Pada Media Yang Ditambahkan Heptana. Di bawah bimbingan Sapta Raharja. 2010.
RINGKASAN
Pengolahan ikan sarden selama ini terbatas pada pemanfaatan daging ikan untuk produk pangan seperti pengalengan ikan atau konsumsi daging ikan segar. Limbah yang berupa minyak dan limbah padat yang dihasilkan dari proses pengalengan tersebut terbuang dan tidak termanfaatkan lebih lanjut. Padahal, minyak ikan maupun limbah padat tersebut mengandung omega-3. Omega-3 bermanfaat untuk kesehatan diantaranya mencegah penyumbatan pembuluh darah, hipertensi, kanker, arthritis, jantung koroner, dan lain-lain (Shahidi et all., 1998).
Omega-3 merupakan asam lemak tak jenuh yang tersusun dari rantai karbon panjang. Proses pengkayaan omega-3 dapat dilakukan melalui reaksi selektif hidrolisis pada sn-1 dan sn-3 gliserida menghasilkan sn-2 gliserida yang kaya akan omega-3 dengan menggunakan enzim lipase Aspergillus niger. Menurut Bockisch (1993), asam lemak tak jenuh dengan rantai panjang menempati posisi ke dua rantai gliserida. Reaksi hidrolisis enzimatik merupakan reaksi pembentukan asam lemak dan gliserol dari triasilgliserol dengan penambahan air dan katalis enzim. Proses pengkayaan dan pemurnian omega-3 dilakukan dengan reaksi hidrolisis. Penambahan media hidrofobik, dapat meningkatkan aktivitas maupun stabilititas enzim atau bahkan meningkatkan selektifitas substrat. Pelarut heptana digunakan sebagai media untuk peningkatan aktivitas dan stabilitas enzim karena nilai hidrofobitasnya berada pada rentang 2-4.
Penelitian ini bertujuan untuk menentukan kondisi optimum faktor reaksi yaitu suhu, penambahan air, dan pH terhadap tingkat hidrolisis enzimatik minyak ikan. Selain itu, juga bertujuan untuk menentukan hubungan total omega-3 dengan tingkat hidrolisis. Tahapan penelitian ini dimulai dari karakterisasi minyak ikan, pengukuran aktivitas lipase dengan metode spectrophotometry, kemudian penentuan kondisi optimum faktor reaksi terhadap tingkat hidrolisis sebagai acuan penentuan kondisi optimum untuk reaksi hidrolisis enzimatik pada media yang ditambahkan heptana. Tingkat hidrolisis menunjukkan aktivitas katalitis enzim terhadap ikatan ester triasilgliserol. Suhu, pH, dan banyaknya air yang digunakan pada rentang 25o C-65oC, 5-9, dan 1%-5%. Prosedur penelitian dimulai dengan melakukan hidrolisis enzimatik minyak ikan kemudian melakukan hidrolisis enzimatik pada media yang ditambahkan heptana menggunakan kondisi optimum hasil hidrolisis enzimatik minyak ikan tanpa penambahan pelarut. Analisa yang dilakukan adalah bilangan asam, bilangan penyabunan dan Gas Chromatography Mass Spectrometry.
Karakterisasi minyak ikan yang diperoleh adalah bilangan asam sebesar 3,26 mg KOH/g minyak dan bilangan penyabunan sebesar 204,81 mg KOH/g. Minyak awal mengandung asam lemak tak jenuh (34,98%) mengandung omega-3 1,81%, asam lemak jenuh (22,76%), alkana (11,19%), aldehid (0,88%), squalene (4,8%) dan kolesterol (24,96%). Aktivitas enzim lipase yang diperoleh adalah 7939 U/g. Pada reaksi hidrolisis enzimatik, diperoleh aktivitas katalitis enzim optimum adalah pada pH5 dan suhu 45oC dengan tingkat hidrolisis sebesar 28,07%. Pada reaksi hidrolisis
enzimatik pada media yang ditambahkan heptana diperoleh penambahan air optimum adalah 1% dengan tingkat hidrolisis sebesar 26,16%. Dengan menggunakan nilai optimum tersebut (pH 5, suhu 45oC, dan penambahan air 1%) dilakukan reaksi hidrolisis enzimatik dengan penambahan heptana. Hasil yang diperoleh adalah terjadi peningkatan aktivitas pada setiap perlakuan suhu kecuali 65oC. Suhu optimum yang diperoleh adalah 25oC. Pada perlakuan pH, terjadi penurunan aktivitas pada tiap titik perlakukan pH kecuali pada pH 7. Penurunan aktivitas terjadi karena denaturasi enzim.
Berdasarkan analisa GC-MS, pada reaksi hidrolisis enzimatik pada media tanpa penambahan heptana pada suhu 45oC dan pH 5, kandungan omega-3 sebesar 17,51% dengan tingkat hidrolisis sebesar 28,07%. Sedangkan, pada suhu 45oC dan pH 7, kandungan omega-3 sebesar 16,89% dengan tingkat hidrolisis 6,79%. Pada reaksi hidrolisis enzimatik pada media yang ditambahkan pelarut heptana, kandungan omega-3 pada suhu 45oC, penambahan air 1%, dan pH 5 sebesar 7,14% dengan tingkat hidrolisis sebesar 22,56%. Sedangkan, pada suhu 25oC, penambahan air 1%, dan pH 5, kandungan omega-3 sebesar 10,48% dengan tingkat hidrolisis 23,94%.
Zulfatun Najah. F34052594. Study of Enzymatic Hydrolysis of Fish Oil to Produce Omega-3 Using Aspergillus niger Lipase in Added-Heptane Media. Supervised by Sapta Raharja. 2010.
SUMMARY
Nowadays, the processing of sardine fish was as canned fish. The Waste was solid waste and fish oil which discarded and unusable further. However, this waste contains Omega-3. Omega-3 fatty acids were considered of essential for normal growth. It might be an important role to in the prevention and treatment of coronary artery disease, hypertension, arthritis, other inflammatory and autoimmune disorders, and cancer (Shahidi et al., 1998).
Omega-3 was polyunsaturated fatty acids (PUFAs) contains long chain carbon double bound. Concentrate omega-3 was done by selective hydrolysis in sn-1 and sn-3 glyceride to produce sn-2 glyceride greatly in omega-3 using enzyme lipase from Aspergillus niger yeast. According Bockisch (1993), in the majority of fish oil triglycerides, PUFAs were bound to the 2-position of the glyceride backbone. Enzymatic hydrolysis was produce acylglycerol from triacylglycerol using water as reactant and enzyme as catalyst. Some studies indicate that PUFA were most promptly absorbed from the intestines when FFA was given orally, were moderately absorbed as acylglycerols and were poorly absorbed as PUFA ethyl ester (Carvalho et al., 2009). Organic solvent hydrofobic could be used as medium in the hydrolysis reaction to increased activity and stability enzyme. Even if, it increased substrat selectivity. Solvent hydrophobic heptane almost used as media to increased activity and stability due to it hydrophobocity at the range 2<log p<4.
This research aims to determined reaction factor condition that could produce maximum degree of hydrolysis of fish oil in media without or with added-heptane media. Besides, it determined the correlation between maximum degree of hydrolysis of fish oil and sum amount of omega-3 fatty acid. The step of this research are characterize fish oil, calculate Activity enzyme (unit), and determine correlation between reaction parameter such as temperature, pH, and water addition as basis optimum condition for hydrolysis enzymatic in added-heptane media. Temperature, pH and water content used in this research are 25oC-65oC, 5-9, and 1%-5% respectively. Degree of hydrolysis showed catalytic activity enzyme to the ester bound triacylglycerol. Procedure of this research started with do enzymatic hydrolysis fish oil and do hydrolysis fish oil on the medium heptane. Analysis include acid value, saponification value, and GC MS measurement.
Fish oil in this research had acid value and saponification value as much 3,26 and 204,81 respectively. Fish oil contain 34,98% unsaturated fatty acid include omega-3 as big as 1,81%,22,76% saturated fatty acid, alkana (11,19%), aldehid (0,88%), squalene (4,8%) and lanosterol (24,96%). Unit activity from the spectrophotometry measurement was 7939 U/g. Optimum condition according to the enzymatic hydrolysis were pH 5 and 45oC. The degree of this condition was 28,07%. According to the enzymatic hydrolysis in added heptane media, water addition optimum is 1% with the 26,16% degree hydrolysis. By using this optimum condition (pH 5, temperature 45oC, and water addition 1%), enzymatic hydrolysis in organic solvent were done. Heptane used as organic solvent media. According to this
research, in every point of temperature, the degree of hydrolysis increased except at 65oC due to denaturation of protein enzyme at 65oC. Temperature optimum for hydrolysis enzymatic in the organic solvent heptane was 25oC. According to the analysis effect pH on the activity resulted decreasing the activity lipase catalyzed or reduction of degree of hydrolysis in every point of pH except in pH 7. Decreasing of lipase activity due to denaturation of enzyme.
According to the GC MS measurement, total omega-3 at temperature 45oC pH 5 was 17,51% with degree of hydrolysis 28,07%. At the temperature 45oC and pH 7, total omega-3 and degree of hydrolysis was 16,89% and 6,79% respectively. According to the hydrolysis enzymatic with heptane as medium, at the temperature 45oC, water addition 1%, and pH 5, omega-3 and degree of hydrolysis are 7,14% and 22,56% respectively. But at the temperature 25oC, pH 5 and water addition 1% result in 10,48 % total omega-3 and 23,94% degree of hydrolysis. Generally, hydrolysis enzymatic could purify and enrich omega-3 in the product.
KAJIAN HIDROLISIS ENZIMATIK MINYAK IKAN UNTUK PRODUKSI OMEGA-3 MENGGUNAKAN LIPASE Aspergillus niger
PADA MEDIA YANG DITAMBAHKAN HEPTANA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh Zulfatun Najah
F 34052594
2010
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul “Kajian Hidrolisis Enzimatik Minyak Ikan Untuk Produksi Omega-3 Menggunakan Lipase Aspergillus niger Pada Media yang Ditambahkan Heptana” adalah hasil karya saya sendiri dengan arahan dosen pembimbing akademik kecuali yang dengan jelas ditunjukkan rujukannya.
Bogor, 25 Februari 2010 Yang membuat pernyataan,
Zulfatun Najah F34052594
Judul Skripsi : KAJIAN HIDROLISIS ENZIMATIK MINYAK IKAN UNTUK PRODUKSI OMEGA-3 MENGGUNAKAN LIPASE Aspergillus niger PADA MEDIA YANG DITAMBAHKAN HEPTANA Nama : Zulfatun Najah
NIM : F34052594
Menyetujui, Pembimbing I,
( Dr. Ir. Sapta Raharja, DEA) NIP. 19631026 199002 1 001
Mengetahui: Ketua Departemen
(Prof. Dr.Ir.Nastiti Siswi Indrasti) NIP. 19621009 198903 2 001
BIODATA RINGKAS
Penulis bernama Zulfatun Najah dilahirkan di Blora pada tanggal 1 Juni 1987. Penulis merupakan anak pertama dari empat bersaudara. Nama orang tua penulis adalah Ahmad Zainal Arifin dan Sad Triasri. Pada tahun 1999, Penulis menyelesaikan pendidikan dasar di SD Tempelan II Blora. Penulis menyelesaikan pendidikan Sekolah Menengah Pertama di SLTPN 1 Blora pada tahun 2002. Kemudian, penulis melanjutkan pendidikan Sekolah Menengah Atas di SMAN 1 Blora dan lulus pada tahun 2005. Pada tahun 2005, penulis diterima pada program sarjana Institut Pertanian Bogor melalui jalur USMI. Pada penentuan program studi tahun 2006, penulis diberi kesempatan untuk menimba ilmu di Program Studi Teknologi Industri Pertanian.
Pada saat menjalani kegiatan akademik, penulis pernah aktif dalam kegiatan kemahasiswaan yaitu menjadi staf reporter pada Bulletin MIND yang diterbitkan oleh Himpunan Mahasiswa Industri Pertanian. Penulis juga mengikuti kompetisi ilmiah pada Program Kreativitas Mahasiswa bidang penulisan kewirausahaan (2007). Penulis juga mejadi penyaji terbaik V dalam kompetisi penulisan ilmiah bidang lingkungan hidup dengan tema tulisan sampah organik dan sampah non organik.
Penulis menyelesaikan praktek lapang pada tahun 2008 di pabrik pembekuan udang PT. Misaja Mitra Pati dengan judul “Mempelajari Aspek Produksi dan Pengawasan Mutu Udang Beku di PT. Misaja Mitra Pati”. Untuk menyelesaikan pendidikan di Departemen Teknologi Industri Pertanian, penulis melakukan penelitian yang berjudul “Kajian Hidrolisis Enzimatik Minyak Ikan Untuk Produksi Omega-3 Menggunakan Enzim Lipase Aspergillus niger Pada Media yang Ditambahkan Heptana”. Pada Tahun 2010 penulis menyelesaikan program studi Strata-I
KATA PENGANTAR
Bismillahirrahmanirrahim,
Segala puji bagi Allah SWT Tuhan Pemilik Alam dan penguasa Ilmu, atas segala rahmat dan hidayah-Nya penulis dapat menyelesaikan penyususunan skripsi yang berjudul “Kajian Hidrolisis Enzimatik Minyak Ikan Untuk Produksi Omega-3 Menggunakan Lipase Aspergillus niger Pada Media yang Ditambahkan Heptana”.
Dalam pelaksanaan penelitian dan penyusunan karya ilmiah ini, penulis mendapat bantuan dari berbagai pihak. Untuk itu pada kesempatan ini penulis ingin mengucapkan terima kasih sebesar-besarnya kepada segenap pihak dibawah ini yang telah banyak membantu.
1. Dr. Ir. Sapta Raharja, DEA, selaku pembimbing akademik yang telah memberikan arahan dan bimbingan kepada penulis selama pendidikan di IPB dan penulisan skripsi.
2. Prayoga Suryadarma, STP, MT, dan Dr. Ir. Mulyorini Rahayuningsih, M.Sc selaku dosen yang telah memberikan arahan, bimbingan, serta bantuannya selama penelitian.
3. Drs. Purwoko, Msi dan Ir. S. Ketaren, MS selaku dosen penguji yang telah memberikan saran kepada penulis
4. Seluruh laboran dan staf di Departemen Teknologi Industri Pertanian atas segala bantuan selama penulis melaksanakan penelitian.
5. Semua pihak yang telah memberikan dukungan dan bantuan yang tidak dapat Penulis sebutkan satu persatu.
Segala daya dan kemampuan telah diupayakan demi sempurnanya karya tulis ini, namun penulis menyadari karya tulis ini belum mencapai sempurna karena adanya keterbatasan penulis. Kritik dan saran yang membangun sangat diharapkan untuk kesempurnaan di masa yang akan datang. Semoga skripsi ini bermanfaat bagi civitas akademika dan pihak yang membutuhkan
Bogor, Maret 2010
UCAPAN TERIMAKASIH
Pada kesempatan kali ini, penulis mengucapkan terima kasih dan penghargaan yang sebesar-besarnya kepada berbagai pihak yang telah membantu 1. Bapak dan ibu atas segala cinta, kasih sayang, perhatian, pengorbanan, dorongan
moral maupun material dan doa senantiasa terlantun untuk penulis. Terimakasih atas segala cinta dan kasih yang diberikan. Karya ini penulis persembahkan untuk bapak dan ibu. Semoga karya ini dapat membuat bapak dan ibu bangga.
2. Adik-adik tercinta (Ulun Najib, Ainun Navis, dan Sofia Naim) atas doa, canda tawa dan dukungannya selama ini. Penulis berharap melalui karya ini, adik-adik mempunyai dorongan, semangat, dan motivasi yang lebih besar lagi untuk adik-adik dalam memperjuangkan apa yang menjadi harapan adik-adik-adik-adik.
3. Saudara-saudara, Om Azhar, Bulik Almuftiyah, Bulik Rustin, Bulik Umi, Om Tito, Bude Sri, Bude Edi, Mbah Putri, Dik Tito dan semuanya terima kasih atas perhatian, doa dan dukungan moril yang diberikan.
4. Temen-temen satu bimbingan Mbak Zuni, Kak Yayan, Mbak Listya, Mbak Ika, Ambar, Teni, Choir, Manda atas segala bantuan yang diberikan.
5. Temen-temen TINer’42 khususnya Danu, Aulia, Arif, Ajizah, Eri, terimakasih atas kerjasamanyadi laboratoratorium Bioindustri selama penelitian serta Diar, Nutri, Prima, Deni, Rey, Sulis, Mayang, dan semua temen TIN atas kerjasamanya selama penulis menimba ilmu di IPB.
6. Temen-Temen Crew Edelweis Diar, Mbak Cita, Mbak Ninik, Malya, Risca, Sri, atas nasehat, canda tawa, dan masukan-masukan untuk penulis
DAFTAR ISI
Halaman
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... xii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 4
II. TINJAUAN PUSTAKA ... 5
A. MINYAK IKAN ... 5
B. ASAM LEMAK TAK JENUH OMEGA-3 ... 7
C. ENZIM LIPASE Aspergillus niger ... 10
D. HIDROLISIS ENZIMATIS ... 15
E. PELARUT N-HEPTANA ... 16
F. FAKTOR YANG MEMPENGARUHI AKTIVITAS DAN STABILITAS ENZIM LIPASE ... 19
1. Pengaruh Suhu ... 19
2. Pengaruh pH ... 20
3. Pengaruh Penambahan Air ... 21
A. ALAT DAN BAHAN ... 24
B. METODE ... 24
1. Tahapan Penelitian ... 24
a. Karakterisasi Minyak Ikan ... 25
b. Penentuan Aktivitas Enzim ... 26
c. Penentuan Hubungan Derajat Keasaman dan Suhu Terhadap Tingkat Hidrolisis Enzimatis Minyak Ikan ... 26
d. Penentuan Hubungan Penambahan Air, Suhu, dan Derajat Keasaman Terhadap Tingkat Hidrolisis Enzimatis Minyak Ikan Pada Media yang Ditambahkan Heptana ... 26
e. Penentuan Hubungan Tingkat Hidrolisis Dengan Kandungan Total Omega-3 ... 27
2. Prosedur Penelitian ... 28
a. Hidrolisis Enzimatis Minyak Ikan ... 28
b. Hidrolisis Enzimatis Minyak Ikan Pada Media yang Ditambahkan Heptana ... 28
c. Preparasi Konsentrat Hasil reaksi Hidrolisis Untuk Analisa GC-MS ... 30
IV. HASIL DAN PEMBAHASAN ... 31
A. KARAKTERISTIK MINYAK IKAN ... 31
1. Sifat Fisiko Kimia Minyak Ikan ... 31
2. Komponen Kimia di Dalam Minyak Ikan ... 32
B. AKTIVITAS ENZIM ... 34
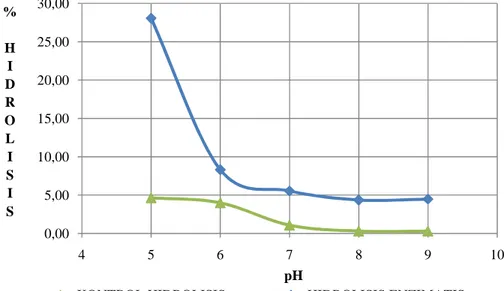
C. HUBUNGAN DERAJAT KEASAMAN DAN SUHU TERHADAP TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN ... 35
1. Hubungan Derajat Keasaman Terhadap Tingkat Hidrolisis ... 36
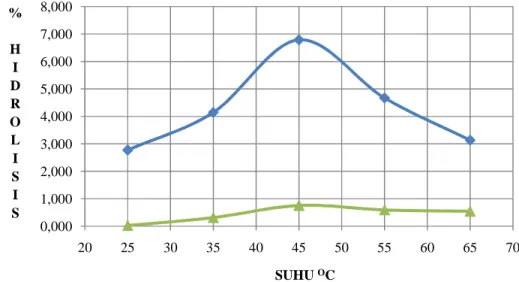
2. Hubungan Suhu Terhadap Tingkat Hidrolisis ... 38
D. HUBUNGAN PENAMBAHAN AIR, DERAJAT KEASAMAN DAN SUHU TERHADAP TINGKAT HIDROLISIS ENZIMATIS MINYAK IKAN PADA MEDIA YANG DITAMBAHKAN
HEPTANA ... 41
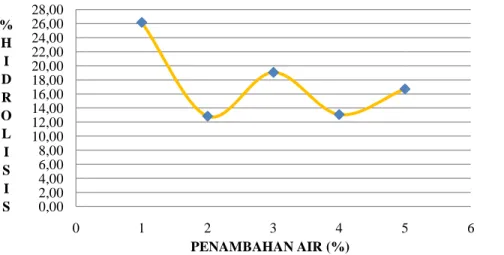
1. Hubungan Penambahan Air Dengan Tingkat Hidrolisis... 41
2. Hubungan Derajat Keasaman (pH) dengan Tingkat Hidrolisis ... 43
3. Hubungan Suhu dengan Tingkat Hidrolisis ... 45
E. HUBUNGAN TINGKAT HIDROLISIS DENGAN KANDUNGAN TOTAL OMEGA-3 ... 47
V. KESIMPULAN DAN SARAN ... 55
A. KESIMPULAN ... 55
B. SARAN ... 55
DAFTAR PUSTAKA ... 56
DAFTAR TABEL
Halaman
Tabel 1. Sifat fisikokimia minyak ikan komersial ... 6
Tabel 2. Komponen asam lemak dalam minyak ikan sarden ... 7
Tabel 3. Kandungan omega-3 pada beberapa komoditas pertanian ... 8
Tabel 4. Jenis asam lemak omega-3 ... 9
Tabel 5. Aktifitas mikrobial dan karakteristik enzim lipase ... 13
Tabel 6. Nilai kepolaran dan laju reaksi esterifikasi pelarut ... 18
Tabel 7. Karakterisasi bahan baku minyak ikan ... 31
Tabel 8. Komponen kimia bahan baku minyak ikan ... 32
Tabel 9. Ukuran sampel berdasarkan perkiraan bilangan asam ... 62
Tabel 10. Nilai karakterisasi fisiko kimia minyak ikan ... 65
Tabel 11 Komponen kimia minyak ikan hasil analisa GC-MS ... 67
Tabel 12. Hasil pengukuran aktivitas lipase Aspergillus niger ... 69
Tabel 13. Nilai % hidrolisis enzimatik minyak ikan pada media tanpa penambahan heptana pada perlakuan berbagai macam pH ulangan 1 ... 70
Tabel 14. Nilai % Hidrolisis enzimatik minyak ikan pada media tanpa penambahan heptana pada perlakuan berbagai macam pH ulangan 2 ... 71
Tabel 15. Nilai % hidrolisis kontrol minyak ikan pada media tanpa penambahan heptana pada perlakuan berbagai macam pH ... 71
Tabel 16. Nilai % hidrolisis enzimatik minyak ikan pada media tanpa penambahan heptana pada perlakuan berbagai suhu ... 72
Tabel 17. Nilai % hidrolisis kontrol minyak ikan pada mediatanpa penambahan heptana pada perlakuan berbagai suhu ... 72
Tabel 18. Nilai % hidrolisis enzimatik minyak ikan pada media yang ditambahkan heptana pada perlakuan berbagai penambahan
air ulangan 1 ... 73 Tabel 19. Nilai % hidrolisis enzimatik minyak ikan pada media yang
ditambahkan heptana pada perlakuan berbagai penambahan
air ulangan 2 ... 74 Tabel 20. Nilai % hidrolisis kontrol minyak ikan pada media yang
ditambahkan heptana pada perlakuan berbagai penambahan
air ... 74 Tabel 21 Nilai % hidrolisis minyak ikan pada media yang ditambahkan
heptana pada perlakuan berbagai pH ulangan 1 ... 75 Tabel 22 Nilai % hidrolisis minyak ikan pada media yang ditambahkan
heptana pada perlakuan berbagai pH ulangan 2 ... 77 Tabel 23. Nilai % hidrolisis minyak ikan pada media yang ditambahkan
heptana pada perlakuan berbagai suhu ulangan 1 ... 78 Tabel 24. Nilai % hidrolisis minyak ikan pada media yang ditambahkan
heptana pada perlakuan berbagai suhu ulangan 2 ... 79 Tabel 25.Komponen kimia pada konsentrat hasil reaksi hidrolisis
enzimatik pada media tanpa penambahan heptana pada pH 5
suhu 45oC ... 80 Tabel 26. Komponen kimia pada konsentrat hasil reaksi hidrolisis
enzimatik pada media tanpa penambahan heptana pada pH 7
suhu 45oC ... 83 Tabel 27. Komponen kimia pada konsentrat hasil reaksi hidrolisis
enzimatik pada media yang ditambahkan heptana pada pH 5
suhu 25oC ... 87 Tabel 28. Komponen kimia pada konsentrat hasil reaksi hidrolisis
enzimatik pada media yang ditambahkan heptana pada pH 5
DAFTAR GAMBAR
Halaman
Gambar 1. Rumus molekul dari asam lemak Omega-3 ... 8
Gambar 2. Mekanisme pembentukan asil enzim pada reaksi yang dikatalisis oleh enzim lipase ... 11
Gambar 3. Mekanisme hidrolisis spesifik triasilgliserol dengan katalis lipase ... 13
Gambar 4. Struktur asam amino penyusun enzim lipase Aspergillus niger ... 14
Gambar 5. Tahapan hidrolisis trigliserida yang dikatalis oleh lipase ... 16
Gambar 6. Mekanisme pengikatan air dan media pelarut organic dalam suatu reaksi ... 23
Gambar 7. Diagram alir tahapan penelitian ... 25
Gambar 8. Diagram alir proses hidrolisis enzimatik minyak ikan ... 29
Gambar 9. Mekanisme katalisis enzim pada paranitrobutirat ... 34
Gambar 10. Mekanisme pembentukan kompleks substrat-enzim ... 36
Gambar 11. Kurva hubungan tingkat hidrolisis dengan pH pada reaksi hidrolisis enzimatik ... 37
Gambar 12. Kurva hubungan tingkat hidrolisis dengan suhu reaksi pada reaksi hidrolisis enzimatik ... 38
Gambar 13. Kurva hubungan tingkat hidrolisis dengan penambahan air pada reaksi hidrolisis enzimatik pada media yang ditambahkan heptana ... 42
Gambar 14. Mekanisme katalisis enzim lipase regioselektif Aspergillus niger pada media organik ... 42
Gambar 15. Kurva hubungan tingkat hidrolisis dengan pH pada reaksi hidrolisis enzimatik tanpa penambahan heptana dan reaksi hidrolisis enzimatik pada media yang ditambahkan heptana ... 43
Gambar 16. Kurva hubungan tingkat hidrolisis dengan suhu pada reaksi hidrolisis enzimatik dengan penambahan heptana dan pada reaksi hidrolisis enzimatik tanpa penambahan pelarut heptana ... 45 Gambar 17. Kurva hubungan tingkat hidrolisis dan asam eikosapentanoat
pada reaksi hidrolisis enzimatis terhadap setiap perlakuan pada kondisi optimum faktor reaksi ... 48 Gambar 18. Kurva hubungan tingkat hidrolisis dan asam
dokosaheksanoat pada reaksi hidrolisis enzimatis terhadap setiap perlakuan pada kondisi optimum faktor reaksi ... 50 Gambar 19. Kurva hubungan tingkat hidrolisis dan total omega-3 pada
reaksi hidrolisis enzimatis terhadap setiap perlakuan pada kondisi optimum faktor reaksi ... 51 Gambar 20. Pathway metabolisme polyunsaturated fatty acid ... 52 Gambar 21. Peak area analisa GC-MS minyak ikan ... 66 Gambar 22. Peak area analisa GC-MS konsentrat hasil reaksi hidrolisis
enzimatik pada media tanpa penambahan heptana pada pH 5 suhu 45oC ... 77 Gambar 23. Peak area analisa GC-MS konsentrat hasil reaksi hidrolisis
enzimatipada media tanpa penambahan heptana pada pH 7 suhu 45oC ... 82 Gambar 24. Peak area analisa GC-MS konsentrat hasil reaksi hidrolisis
enzimatik pada media yang ditambahkan heptana pada pH 5 suhu 25oC ... 86 Gambar 25. Peak area analisa GC-MS konsentrat hasil reaksi hidrolisis
enzimatik pada media yang ditambahkan heptana pada pH 5 suhu 25oC ... 90 Gambar 26. Fragmentasi pada mass spectrometry ... 95 Gambar 27. Chromatogram ... 95
DAFTAR LAMPIRAN
Halaman Lampiran 1. Prosedur analisa sifat fisiko kimia minyak ikan ... 62 Lampiran 2. Prosedur pengukuran aktivitas enzim lipase dengan metode
spektrofotometri ... 64 Lampiran 3. Data hasil karakterisasi minyak ikan ... 65 Lampiran 4. Data hasil pengukuran aktivitas enzim lipase Aspergillus niger
dengan metode spektrofotometri ... 69 Lampiran 5. Data hasil hidrolisis enzimatik minyak ikan dengan
menggunakan enzim lipase Aspergillus niger dalam media
tanpa ditambahkan pelarut heptana ... 70 Lampiran 6. Data hasil hidrolisis enzimatik minyak ikan dengan
menggunakan enzim lipase Aspergillus niger dalam media
yang ditambahkan pelarut n-heptana ... 72 Lampiran 7. Data hasil analisa komponen asam lemak hasil hidrolisis
enzimatik pada kondisi optimum faktor reaksi menggunakan GC-MS (gas chromatography mass spectrometry) ... 77 Lampiran 8. Penentuan degree of hydrolysis atau tingkat hidrolisis ... 94 Lampiran 9. Mekanisme kerja GC-MS ... 95
I. PENDAHULUAN
A. LATAR BELAKANG
Selama ini, sebagian besar industri yang bergerak pada bidang perikanan memanfaatkan kekayaan laut khususnya ikan terbatas pada dagingnya untuk pengalengan ikan dan pengolahan ikan segar menjadi produk makanan jadi seperti nugget dan olahan ikan segar. Pemanfaatan hasil perikanan tersebut belum optimal. Hal ini dilihat dari masih adanya residu buangan seperti limbah padat dan minyak residu pemanasan ikan. Potensi limbah tersebut amat besar. Sebagai gambaran, volume limbah pengalengan ikan di Muncar, Kabupaten Banyuwangi, Jawa Timur, mencapai 50-60 ton per bulan (Wawasan, 10 Juni 2009). Tidak adanya pemanfaatan lebih lanjut terhadap residu buangan tersebut. Padahal limbah padat yang menghasilkan 9% minyak ikan maupun minyak ikan itu sendiri memiliki kandungan omega-3 yang bermanfaat bagi kesehatan.
Semua asam lemak yang ditemukan di dalam minyak ikan dan semua minyak yang sama merupakan campuran asam lemak jenuh dan asam lemak tak jenuh. Karakterisasi minyak ikan terdiri dari asam lemak tak jenuh dengan proporsi yang tinggi. Sebagian besar asam lemak tak jenuh tersebut adalah C16(palmitoleat), C18(oleat dengan beberapa octadecatrienoat), C20 (eikosapentanoat) dan asam C22 (dokosaheksanoat). Asam lemak tak jenuh di dalam minyak ikan berkisar antara 10-25% dari total asam (Celik, 2002). Dengan demikian, minyak ikan memiliki asam lemak tak jenuh lebih banyak.
Asam lemak dengan ikatan rangkap pada rantai atom karbon ke tiga hingga keempat dinamakan omega-3 dan biasanya disimbolkan dengan n-3. Omega-3 polyunsaturated fatty acid mempunyai peran penting dalam kesehatan. Asam lemak taki jenuh dengan banyak ikatan rangkap ini dapat diperoleh dari minyak ikan. Omega-3 polyunsaturated fatty acids cis-5,8,11,14,17-eicosapentaenoic acid (EPA, 20:5) dan cis 4,7,10,13,16,19-docosahexaenoic acid (DHA 22:6) merupakan komponen aktif pada minyak tersebut (Carvalho et al., 2002). Selain asam lemak tersebut, terdapat juga asam lemak lain yang memiliki ikatan rangkap pada atom ke tiga dengan atom karbon terakhir mengikat gugus metil. Asam lemak ini dapat mencegah penyakit jantung, penyumbatan
pembuluh darah, hipertensi, arthritis, kanker, serta penyakit ketahahan tubuh lainnya (Carvalho et al.,2009). Selain itu, asam lemak ini diperlukan untuk nutrisi otak dan mata (Tanaka et al., 1992). Menurut Carvalho et al. (2009), omega-3 polyunsaturated fatty acid dapat berbentuk free fatty acid (FFA), etil ester, atau asilgliserol. Asilgliserol dianggap sebagai bentuk kimia yang diinginkan dalam makanan karena asilgliserol diserap lebih mudah daripada etil ester selama pencernaan. Asilgliserol dapat diperoleh melalui reaksi hidrolisis minyak/lemak.
Reaksi hidrolisis memerlukan suatu katalis untuk mempercepat laju reaksi. Polyunsaturated fatty acid (PUFA) sensitif terhadap panas dan oksidasi, oleh sebab itu reaksi enzimatik merupakan proses yang cocok untuk pengkayaan PUFA ini (Shimada et al., 1997). Kelebihan penggunaan enzim sebagai katalis adalah enzim dapat bekerja bekerja pada suhu rendah dan pH netral sehingga biaya yang dikeluarkan untuk produksi lebih murah. Disamping itu, enzim juga dapat direcovery. Dengan demikian, pengaturan prosesnya lebih mudah. Enzim lipase bereaksi lemah terhadap Omega-3 karena adanya rintangan steric (Shahidi dan Wanasundara, 1998). Omega-3 pada minyak ikan sebagian besar terdapat pada posisi beta dari triacylglycerol atau yang sering disebut posisi sn-2 gliserida. Menurut Carvalho et al. (2009), salah satu jenis enzim lipase yang memberikan hasil hidrolisis selektif terbaik adalah lipase yang dihasilkan oleh Aspergillus niger. Hal tersebut dikarenakan lipase dari Aspergillus niger mempunyai spesifisitas posisional memutus ikatan triacylglycerols pada posisi stereochemical numbering (sn)1 dan 3. Dengan demikian, akan dihasilkan monoacylglycerols yang pada umumnya kaya akan PUFA omega-3 pada posisional sn-2 gliserida.
Aktivitas katalisis enzim dipengaruhi oleh pH, suhu, dan konsentrasi substrat (Kamarudin et al., 2008). Pada reaksi hidrolisis enzimatik, aktivitas katalitik dipengaruhi oleh suhu, pH, konsentrasi substrat, penambahan air dan adanya senyawa penghambat (Zaverucka dan Wimmer, 2008). Suhu berpengaruh terhadap aktivitas dan stabilitas enzim lipase. Suhu yang sesuai untuk penggunaan enzim lipase sebagai katalis adalah dibawah 70oC karena pada suhu tinggi menyebabkan terjadinya migrasi alkil secara non enzimatik,
oksidasi, isomerisasi dan denaturasi enzim (Shahidi dan Wanasundara, 1998). Enzim sangat sensitif terhadap perlakuan medium pH, karena memungkinkan perubahan status ionisasi enzim atau perubahan muatan ion, yang akan mempengaruhi aktivitas dan selektifitasnya (Kamarudin et al., 2008). Zarevucka dan Wimmer (2008) menyatakan air berguna untuk menghubungkan substrat ke sisi aktif enzim melalui ikatan nonkovalen, meningkatkan fleksibilitas dan mobilitas enzim dalam menghidrolisis substrat.
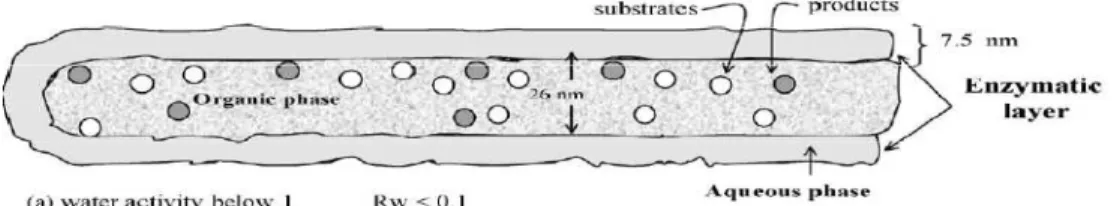
Enzim lipase memiliki sisi aktif yang ditutup oleh lid. Lid enzim lipase khususnya yang berasal dari Aspergillus niger terbuat dari triptofan yang cenderung bersifat hidrofobik. Oleh karena itu, dibutuhkan suatu pelarut organik yang mempunyai sifat non polar (hidrofobik) sehingga dapat meningkatkan kontak antara pelarut organik hidrofobik dan lid enzim yang mampu meningkatkan pembukaan lid enzim tersebut. Penambahan pelarut non polar dapat meningkatkan termostabilitas (Gubicza et al., 2000), dan aktivitas (Gupta et al., 2007).
Berdasarkan penelitian Krieger et al. (2004), stabilitas protein lebih rendah dalam air yang tak larut dalam pelarut yang ada pada nilai log P (nilai hidrofobitas) antara 2,5 sampai 0 seperti aseton dan eter daripada pada pelarut hidrofobik dengan nilai log P antara 2 sampai 4 seperti alkana atau haloalkana. Pelarut organik hidrofilik bersifat memotong ikatan air dari permukaan enzim. Ketika pelarut organik memotong ikatan air dari enzim, berakibat pada tidak adanya ikatan antara molekul gugus amino enzim. Oleh sebab itu, penerimaan stabilitas enzim lipase pada penggunaan pelarut hidrofilik jarang dilakukan. Pelarut yang bersifat hidrofobik dimana kepolarannya berada pada rentang penerimaan stabilitas enzim lipase adalah heptana. Heptana memiliki nilai log p sebesar 4. Selain itu, titik didih heptana sebesar 98 oC. Dengan demikian pelaksanaan penelitian pada suhu yang tinggi memungkinkan dilakukan. Pelarut yang kepolarannya hampir sama dengan lipase adalah heksana. Berhubung heksana memiliki titik didih yang rendah, maka penggunaan heptana menjadi solusi dalam reaksi hidrolisis pada medium non aqueous.
B. TUJUAN PENELITIAN
Penelitian ini bertujuan untuk:
a. Menentukan kondisi optimum faktor reaksi yaitu suhu, pH, dan penambahan air yang menghasilkan tingkat hidrolisis enzimatik tertinggi pada substrat minyak ikan pada reaksi hidrolisis minyak ikan tanpa dan dengan penambahan pelarut heptana.
b. Menentukan hubungan antara tingkat hidrolisis enzimatik optimum minyak ikan terhadap total asam lemak omega-3.
II. TINJAUAN PUSTAKA
A. MINYAK IKAN
Minyak ikan diproduksi melalui pengirisan, pemotogan, serta pemasakan pada suhu 90oC selama 15 menit. Minyak ikan diperoleh dari organ tubuh ikan seperti kepala ikan. Minyak kasar yang diperoleh dipisahkan dan dimurnikan dengan alkali dan diputihkan. (Chang et al., 1989). Minyak ikan merupakan fraksi lemak yang diperoleh dari ekstraksi ikan atau sebagai salah satu hasil samping dari industri pengalengan ikan yang dihasilkan karena pemanasan dan sterilisasi selama proses sehingga minyak dari ikan terekstrak dan terbuang bersamaan dengan panas (Aidos, 2002). Minyak ikan mengandung fraksi lemak seperti triasilgliserol, diasilgliserol, monoasilgliserol, fosfolipid, steril ester, sterol dan asam lemak bebas (Saify et al., 2003)
Minyak ikan ini bermanfaat bagi kesehatan. Minyak ikan yang belum dimurnikan masih berbau ikan, tengik, dan bau amis. Hal ini dikarenakan autoksidasi dari asam lemak jenuh rantai ganda serta pembusukan bahan protein (Chang et al., 1989). Menurut Ketaren (1996), bau amis pada minyak disebabkan karena adanya senyawa trimetil amin oksida akibat oksidasi komponen trimetil amin oleh peroksida yang berinteraksi dengan asam lemak tak jenuh, sedangkan minyak yang berbau tengik dapat disebabkan karena adanya oksidasi pada minyak/lemak dengan udara, aksi mikroba, absorpsi bau oleh lemak dan aksi enzim dalam jaringan yang mengandung lemak. Bau amis disebabkan oleh interaksi trimetilamin oksida dengan ikatan rangkap dari lemak tidak jenuh. Pembentukan trimetilamin oksida disebabkan karena reaksi oksidasi trimetilamin dengan gugus peroksida dalam lemak. Trimetilamin sendiri bersumber dari lesithin yang mengalami pemecahan ikatan C-N pada gugus choline (CH2OH. CH2. NMe) oleh zat pengoksida.
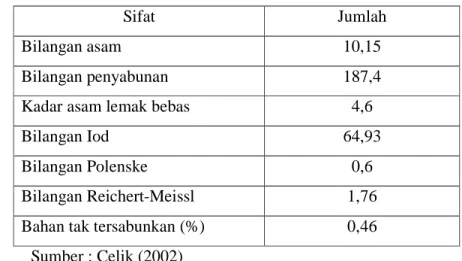
Minyak ikan komersial memiliki standar mengenai sifat fisiko kimianya. Menurut Celik (2002), sifat fisiko-kimia ditunjukkan oleh Tabel 1.
Tabel 1. Sifat fisiko-kimia minyak ikan komersial
Sifat Jumlah
Bilangan asam 10,15
Bilangan penyabunan 187,4
Kadar asam lemak bebas 4,6
Bilangan Iod 64,93
Bilangan Polenske 0,6
Bilangan Reichert-Meissl 1,76
Bahan tak tersabunkan (%) 0,46
Sumber : Celik (2002)
Perbedaan utama minyak ikan dengan minyak lain adalah keunikan jenis asam lemak yang dikandung minyak ikan. Minyak ikan mengandung asam lemak tidak jenuh dalam jumlah yang besar. Asam lemak minyak ikan mengandung 15% hingga 3 % lemak jenuh. Persentase asam lemak tak jenuh yang tinggi ditemukan di minyak yang berasal dari ikan atau komoditas laut lain. Banyaknya kandungan asam lemak dalam minyak ikan berbeda tergantung dari jenis ikan, makanan ikan, tempat hidup ikan, dan lain-lain (Wang et al., 1990).
Jumlah kandungan omega terbesar terdapat pada ikan. Asam lemak omega-3 dilambangkan dengan n-3. Minyak ikan merupakan sumber terbaik asam lemak omega-3. Keuntungan utama konsumsi omega-3 dari minyak ikan adalah mengurangi penyumbatan pembuluh darah oleh kolesterol sehingga dapat mencegah tekanan darah tinggi dan mengurangi resiko penyakit jantung (Wang et al., 1990).
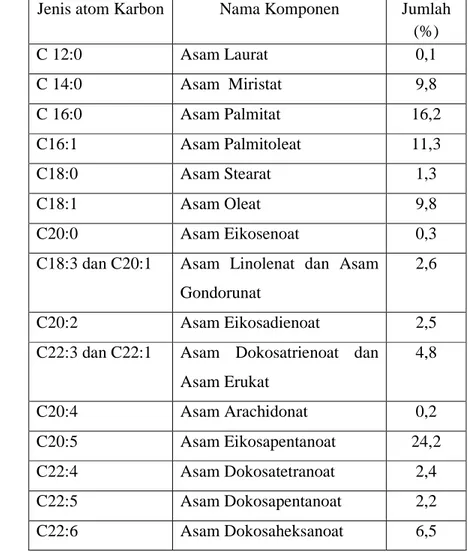
Minyak ikan sarden memiliki komponen asam lemak tak jenuh yang lebih banyak. Komposisi minyak ikan sarden menurut Gutierrez dan Silva (1993) ditunjukkan oleh Tabel 2
Tabel 2. Komponen asam lemak dalam minyak ikan sarden
Sumber : Gutierrez dan Silva (1993)
B. ASAM LEMAK TAK JENUH OMEGA-3
Asam lemak tidak jenuh jamak (Polyunsaturated Fatty Acid) adalah asam lemak yang mempunyai ikatan rangkap lebih dari satu pada rantai asam lemaknya (Rasyid, 2001). Omega-3 merupakan asam lemak dimana terdapat ikatan rangkap diantara atom karbon ketiga dan keempat terhitung dari gugus metil atom karbon pertama. Asam lemak ini dinamakan omega-3 dan biasanya
Jenis atom Karbon Nama Komponen Jumlah (%) C 12:0 Asam Laurat 0,1 C 14:0 Asam Miristat 9,8 C 16:0 Asam Palmitat 16,2 C16:1 Asam Palmitoleat 11,3 C18:0 Asam Stearat 1,3 C18:1 Asam Oleat 9,8 C20:0 Asam Eikosenoat 0,3
C18:3 dan C20:1 Asam Linolenat dan Asam Gondorunat
2,6
C20:2 Asam Eikosadienoat 2,5
C22:3 dan C22:1 Asam Dokosatrienoat dan Asam Erukat 4,8 C20:4 Asam Arachidonat 0,2 C20:5 Asam Eikosapentanoat 24,2 C22:4 Asam Dokosatetranoat 2,4 C22:5 Asam Dokosapentanoat 2,2 C22:6 Asam Dokosaheksanoat 6,5
disimbolkan dengan n-3 (Wang et al.,1990). Struktur dari asam omega-3 dapat dilihat dari Gambar 1.
CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-(CH2)7-COOH Asam Linolenat (C18:3) CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH= CH-(CH2)3-COOH Asam Eikosapentanoaot(C20:5) CH3-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2-CH=CH-CH2 -CH=CH-CH2-CH CH-(CH2)2-COOH Asam Dokosahesanoat (C22:6)
Gambar 1. Rumus molekul dari asam lemak omega-3 (Ackman, 1982) Wang et al. (1990) menyatakan bahwa kandungan minyak ikan dengan omega-3 tinggi terdapat pada ikan yang hidup pada kadar garam tinggi. Dinginnya suatu lingkungan hidup ikan tidak menjadikan indikator dalam menentukan banyaknya kandungan omega-3. Kandungan omega-3 pada beberapa komoditas pertanian menurut Wang et al. (1990) dapat dilihat pada Tabel 3.
Tabel 3. Kandungan omega-3 pada beberapa komoditas pertanian Asam Lemak Tipe Lambing Sumber
Asam α-linolenat N-3 α-LA Flax, canola, fish oil
Asam eikosapentanoat N-3 EPA Minyak ikan Asam dokosaheksaenoat N-3 DHA Minyak ikan Sumber: Wang et al. (1990)
Omega-3 yang terkandung di dalam minyak ikan dapat dimurnikan melalui proses pada suhu yang rendah. Apabila proses deodorisasi dilakukan diatas suhu 200oC akan terjadi reaksi kimia sehingga akan menurunkan manfaat biologis dari minyak ikan tersebut (Chang et al., 1989). Metode untuk pengkayaan omega-3 bermacam-macam. Namun, hanya sedikit yang cocok untuk produksi skala besar, diantaranya adsorption chromatography, fractional molekuler atau distilasi molekuler, hidrolisis enzimatik, kristalisasi temperatur rendah, dan urea complexation (Shahidi dan Wanasundara, 1998b)
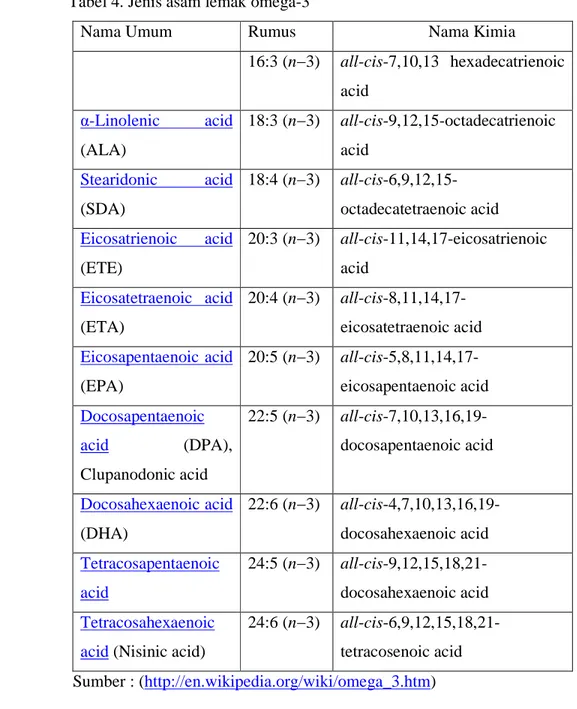
Asam lemak omega-3 bermacam-macam jenisnya. Jenis asam lemak omega-4 dapat dilihat pada Tabel 4.
Tabel 4. Jenis asam lemak omega-3
Nama Umum Rumus Nama Kimia
16:3 (n−3) all-cis-7,10,13 hexadecatrienoic acid α-Linolenic acid (ALA) 18:3 (n−3) all-cis-9,12,15-octadecatrienoic acid Stearidonic acid (SDA) 18:4 (n−3) all-cis-6,9,12,15-octadecatetraenoic acid Eicosatrienoic acid (ETE) 20:3 (n−3) all-cis-11,14,17-eicosatrienoic acid Eicosatetraenoic acid (ETA) 20:4 (n−3) all-cis-8,11,14,17-eicosatetraenoic acid Eicosapentaenoic acid (EPA) 20:5 (n−3) all-cis-5,8,11,14,17-eicosapentaenoic acid Docosapentaenoic acid (DPA), Clupanodonic acid 22:5 (n−3) all-cis-7,10,13,16,19-docosapentaenoic acid Docosahexaenoic acid (DHA) 22:6 (n−3) all-cis-4,7,10,13,16,19-docosahexaenoic acid Tetracosapentaenoic acid 24:5 (n−3) all-cis-9,12,15,18,21-docosahexaenoic acid Tetracosahexaenoic acid (Nisinic acid)
24:6 (n−3) all-cis-6,9,12,15,18,21-tetracosenoic acid Sumber : (http://en.wikipedia.org/wiki/omega_3.htm)
Kehadiran cis- ikatan ganda antara atom karbon dengan karbon pada asam lemak menyebabkan pembengkokan rantai asam lemak. Oleh karena itu, gugus metil asam lemak yang dekat dengan ikatan ester meyebabkan rintangan sterik (steric hindrance) pada lipase. Tingginya gugus cis- pada EPA dan DHA meningkatkan rintangan sterik (steric hindrance), oleh karena itu, lipase tidak
dapat mencapai ikatan ester diantara asam lemak dan gliserol. Namun, asam lemak jenuh dan asam lemak tak jenuh satu rantai ganda tidak menghalangi katalisis lipase terhadap ikatan ester dan dengan mudah reaksi hidrolisis terjadi (Shahidi dan Wanasundara, 1998b). Rintangan sterik (steric hindrance) adalah penghambatan struktur atom. Steric hindrance terjadi karena suatu gugus molekul yang membentuk suatu ruang dengan ukuran tertentu menghambat terjadinya reaksi kimia.
C. ENZIM LIPASE Aspergillus niger
Enzim adalah protein yang terdiri dari asam amino dalam komposisi dan urutan yang teratur dan tetap. Enzim berfungsi sebagai katalis biologis yang digunakan makhluk hidup untuk melaksanakan berbagai konversi senyawa kimia (Web dan Dixon, 1979). Semua enzim yang telah diamati sampai saat ini adalah protein, dan aktivitas katalitiknya bergantung kepada integritas strukturnya sebagai protein (Lehninger, 1995).
Enzim lipase didefinisikan sebagai enzim yang mengkatalis hidrolisis ikatan ester. Menurut system International Union of Biochemistry, enzim lipase diklasifikasikan sebagai enzim hidrolase dengan nama sistematik gliserol ester hidrolase (EC 3.1.1.3) yang menghidrolisis gliserida menjadi asam lemak bebas, gliserida parsial (monogliserida, digliserida) dan gliserol (Macrae, 1983).
Pengkayaan omega-3 dapat dilakukan melalui reaksi kimia seperti esterifikasi, hidrolisis, dan perubahan asam lemak dalam ester (asidolisis) dengan metode enzimatik sebagai katalis (Shahidi dan Wanasundara, 1998b). Hal ini dikarenakan keuntungan penggunaan enzim lipase sebagai katalis hanya membutuhkan suhu dan pH mendekati kondisi ruang (Moore et al., 1996). Selain itu, efisiensi katalitik dari enzim lipase sangat tinggi, sehingga hanya membutuhkan enzim dalam jumlah yang sedikit. Keuntungan lain penggunaan enzim lipase adalah selektivitasnya tinggi, menghilangkan penggunaan katalis inorganik dan bahan kimia berbahaya lainnya, bekerja optimal pada kondisi ringan sehingga dapat menghemat energi, menghasilkan produk yang kualitas warna dan kemurniannya baik, dan dapat digunakan
kembali jika enzim yang digunakan terimobilisasi (Haraldson et al., 1997). Menurut Lehninger (1982), enzim merupakan katalis yang dapat mempercepat reaksi tanpa ikut bereaksi. Mekanisme peningkatan laju reaksinya dengan cara menurunkan energi aktivasi.
Pada reaksi hidrolisis, enzim lipase mengkatalisis pelepasan ikatan ester triasilgliserol dengan membutuhkan air secara bersamaan. Penggunaan enzim sebagai katalis dapat menurunkan penggunaan energi pada suatu proses industri karena enzim dapat beroperasi pada kondisi mendekati suhu ruang. Hidrolisis enzimatik dapat dilakukan dalam suatu media organik pada suhu ruang dan menghasilkan produk yang tidak berwarna gelap serta tidak teroksidasi. Asam lemak yang diproduksi setelah reaksi hidrolisis dipisahkan dari enzim menggunakan pelarut organik (Akoh dan Min, 1998)
Gambar 2. Mekanisme pembentukan asil enzim pada reaksi yang dikatalisis oleh enzim lipase (Hariyadi, 1995)
Reaksi yang dikatalis oleh enzim lipase diperkirakan terjadi melalui pembentukan suatu senyawa antara yaitu asil-enzim (Macrae, 1983). Mekanisme katalitik yang diasumsikan untuk lipase triasilgliserol berpusat pada sisi aktif serin. Nukleofil oksigen pada sisi aktif serin berbentuk tetrahedral hemicetal intermediet dengan triasilgliserol. Hal ini ditunjukkan oleh Gambar 2. Ikatan ester pada hemicetal tersebut dihidrolisis dan diasilgliserol dilepaskan. Sisi aktif serin asil ester bereaksi dengan molekul air dan asil enzim dilepaskan sehingga asam lemak terlepas (Petterson et al,. 2001)
Menurut Gandhi (1997) ada dua kategori dimana lipase dapat digunakan sebagai katalis yaitu :
a Hidrolisis
RCOOR’ + H2O RCOOH + R’OH
b Sintesis
Reaksi sintesis dapat dipisahkan menjadi : i. Esterifikasi
RCOOH + R’OH RCOOR’ + H2O ii. Interesterifikasi
RCOOR’ + R”COOR” RCOOR” + R”COOR’ iii. Alkoholisis
RCOOR’ + R”OH RCOOR” + R’OH iv. Asidolisis
RCOOR’ + R”COOH R”COOR’ + RCOOH
Penggunaan lipase sebagai katalis untuk menghasilkan konsentrat EPA dan DHA dapat lebih menguntungkan, hal ini karena :
a. katalis lipase mempunyai efisiensi katalitik yang tinggi dan bila dalam kondisi immobilisasi dapat dipergunakan kembali.
b. rentangan selektivitasnya terhadap asam lemak telah diketahui dan sangat penting dalam penggunaan berkelanjutan (Fatimah, 2002).
Lipase mikroba diproduksi dari fermentasi bakteri, kapang dan khamir. Mikroba penghasil lipase adalah Rhizopus delemar, Aspergilus niger, Geotrichum candidum, Candida rugosa, dan Chromobacterium viscocum (Gandhi, 1997). Lipase berdasarkan cara kerjanya dibagi menjadi tiga yaitu:
a lipase non spesifik yaitu lipase yang dapat mengkatalis seluruh ikatan trigliserida
b lipase spesifik 1,3 atau 2 yaitu lipase yang dapat mengkatalis trigliserida pada ikatan 1,3 atau 2
c lipase spesifik yaitu lipase yang hanya mengkatalis jenis asam lemak tertentu (Herawan, 1993).
Menurut Carvalho
selektif enzim regio 1,3 lipase ditunjukkan oleh gambar 3 berikut.
Gambar 3. Mekanisme hidrolisis spes (Carvalho et al.
Tabel 5. Aktifitas mikrobial dan karakteristik enzim lipase Jenis Lipase Aspergillus niger Mucor meihei Rhizopus oryzae Rhizopus niveus Candida cylindracea Chromobacterium viscosum Geotrichum candidum Pseudomonas sp
Sumber : Shahidi dan Wanasundara (1998) Lipase yang
dimensi yang memiliki fenomena interfasial karena adanya loop peptide yan menutupi enzim yang dikenal dengan lid enzim. Pada suatu interfase air, lipase mempunyai struktur sekunder yang membuatnya tidak dapat dilalui substrat. Dengan adanya interfase air
terbuka. Sisi aktif lipa
suatu larutan, segmen heliks akan menutup sisi aktif lipase, namun dengan adanya lemak/minyak atau pelarut organik, terjadi perubahan bentuk dimana lid akan membuka (Ozturk, 2001). Lid enzim lipase
Carvalho et al. (2009), mekanisme reaksi hidrolisis oleh selektif enzim regio 1,3 lipase ditunjukkan oleh gambar 3 berikut.
Gambar 3. Mekanisme hidrolisis spesifik triasilgliserol dengan katalis lipase et al., 2009)
Tabel 5. Aktifitas mikrobial dan karakteristik enzim lipase Manufaktur Suhu Optimal
pH Optimal Aspergillus niger Amano Enzyme 30-40 5-7
Novo Nordisk 30-45 6,5-7,5 Rhizopus oryzae Amano Enzyme 30-45 5-8 Rhizopus niveus Amano Enzyme 30-45 5-8 Candida cylindracea Amano Enzyme 30-50 5-8 Chromobacterium viscosum Asahi Chemicals - -
Geotrichum candidum Amano Enzyme 30-45 6-8 Pseudomonas sp Amano Enzyme 40-60 5-9 Sumber : Shahidi dan Wanasundara (1998).
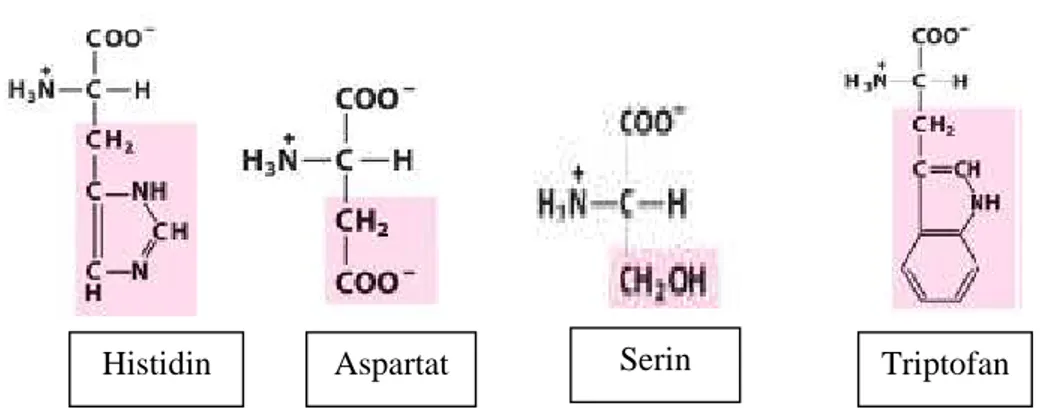
Lipase yang diproduksi oleh Aspergillus niger memiliki struktur tiga dimensi yang memiliki fenomena interfasial karena adanya loop peptide yan menutupi enzim yang dikenal dengan lid enzim. Pada suatu interfase air, lipase mempunyai struktur sekunder yang membuatnya tidak dapat dilalui substrat. Dengan adanya interfase air-pelarut hidrofobik, lipase akan menjadi struktur terbuka. Sisi aktif lipase terdiri dari asam amino aspartat-histidin
suatu larutan, segmen heliks akan menutup sisi aktif lipase, namun dengan adanya lemak/minyak atau pelarut organik, terjadi perubahan bentuk dimana lid akan membuka (Ozturk, 2001). Lid enzim lipase Aspergillus niger
(2009), mekanisme reaksi hidrolisis oleh selektif enzim regio 1,3 lipase ditunjukkan oleh gambar 3 berikut.
ifik triasilgliserol dengan katalis lipase
Optimal Spesifik 1,3 >>2 1,3 >>>2 1,3 >>>2 1,3 >>>2 Random Random Random Random
memiliki struktur tiga dimensi yang memiliki fenomena interfasial karena adanya loop peptide yang menutupi enzim yang dikenal dengan lid enzim. Pada suatu interfase air, lipase mempunyai struktur sekunder yang membuatnya tidak dapat dilalui substrat. pelarut hidrofobik, lipase akan menjadi struktur histidin-serin. Pada suatu larutan, segmen heliks akan menutup sisi aktif lipase, namun dengan adanya lemak/minyak atau pelarut organik, terjadi perubahan bentuk dimana spergillus niger
terbentuk dari asam amino triptofan yang cenderung hidrofobik (Nuraida et al, 2000). Berdasarkan penelitian yang dilakukan oleh Nuraida et al. (2000) lipase Aspergillus niger mengkatalisis asam palmitat, kaprilat, dan asam miristat lebih banyak.
Asam amino triptofan merupakan asam amino yang cenderung non polar, sedangkan asam amino aspartat merupakan jenis asam amino yang bermuatan negatif. Asam amino histidin memiliki muatan positif sehingga tergolong dalam asam amino positif, sedangkan asam amino serin cenderung polar (Lehninger, 1982).
Gambar 4. Struktur asam amino penyusun enzim lipase Aspergillus niger (Lehninger, 1982)
Enzim lipase Aspergillus niger dari Amano A Parmaceutical Manufactures Co. memiliki kandungan karbohidrat 68%, NaCL 0,1%, abu 6%, uap air 5,1%, lemak 0,1%, dan protein 20,8% pada tiap gram serbuknya (Boomer et al., 2001). Kadar protein pada enzim lipase tersebut cukup tinggi, tetapi kadar karbohidrat juga tinggi. Menurut Boomer et al. (2001), kandungan karbohidrat yang tinggi yang melebihi 50% akan menghambat aktivitas lipolitik dari enzim. Pada reaksi hidrolisis minyak ikan menhaden, lipase Aspergillus niger memiliki tingkat hidrolisis sebesar 9% selama 72 jam dengan kandungan EPA 14% dan DHA 10%. Sedangkan pada reaksi hidrolisis minyak ikan seal bubber, tingkat hidrolisis yang diperoleh selama 72 jam sebesar 25% dengan konversi EPA dan DHA sebesar 7% dan 10% (Shahidi dan Wanasundara, 1998).
D. HIDROLISIS ENZIMATIK
Salah satu reaksi yang terjadi pada produk atau bahan pangan berlemak adalah hidrolisis, yaitu pembentukan gliserol dan asam lemak bebas melalui pemecahan molekul lemak dan penambahan elemen air (Hartley, 1977). Winarno (1997) menyatakan bahwa lemak dan minyak dapat terhidrolisis menjadi gliserol dan asam lemak dengan adanya air. Reaksi ini dapat dipercepat dengan adanya katalis basa, asam, dan enzim.
Pada umumnya proses hidrolisis disebabkan karena aktivitas enzim dan mikroba. Proses hidrolisis dapat berlangsung bila tersedia sumber nitrogen, garam mineral, dan sejumlah air. Hidrolisis yang terjadi pada minyak atau lemak yang mempunyai asam-asam lemak dengan rantai karbon panjang mengalami proses yang lebih lambat (Djatmiko dan Wijaya, 1984).
Efek air terhadap kinetika reaksi hidrolisis sangat penting karena air dapat menyebabkan proses hidrolisis lemak dan akan mempengaruhi mutu produk yang dihasilkan. Hidrolisis lemak merupakan reaksi kesetimbangan yang memungkinkan terjadinya pengubahan arah reaksi dengan cara mengatur kadar air sistem reaksi atau kandungan air (Kurashige et al., 1993).
Pada awalnya hidrolisis minyak dan lemak dilakukan dengan suhu 250 oC dan pada tekanan 50-55 bar (Loebis, 1989). Penggunaan proses ini, selain membutuhkan energi yang cukup besar dan investasi peralatan yang mahal, juga menghasilkan produk yang gelap dan berbau yang relatif kurang disukai konsumen (Herawan, 1983). Untuk meminimumkan biaya, meminimumkan energi dan meminimumkan produk yang kurang baik maka dilakukan hidrolisis secara enzimatik (Macrae, 1983).
Menurut Herawan (1993), kelebihan hidrolisis enzimatik antara lain: a. Reaksi dilakukan pada suhu rendah,sehingga kualitas produk lebih baik b. Menggunakan lipase spesifik, sehingga produk yang diinginkan dapat
ditingkatkan dan produk samping dapat dikurangi. c. Investasi lebih murah
d. Lingkungan kerja aman
Reaksi hidrolisis trigliserida terjadi secara bertahap dan merupakan reaksi yang bersifat reversible (bolak-balik) sehingga akan berakhir dalam
suatu kesetimbangan (Swern, 1979). Secara sistematik, reaksi hidrolisis yang dikatalis oleh lipase disajikan pada Gambar 5
Triacylglicerol + H20 Diacylglicerol + Asam Lemak Bebas
Diacylglicerol + H20 Monoacylglicerol + Asam Lemak Bebas
Monoacylglicerol+H20 gliserol + Asam Lemak Bebas
Triacylglicerol +3 H20 gliserol + 3Asam Lemak Bebas
Gambar 5. Tahapan hidrolisis trigliserida yang dikatalis oleh lipase (Brockman, 1984)
Menurut Rahman et al.(2006), hidrolisis dengan katalis enzim lipase dapat dilakukan pada media air, pelarut organik maupun media nonkonvesional lainnya. Keuntungan penggunaan pelarut organik sebagai media yaitu dapat meningkatkan stabilitas thermal enzim, pemisahan enzim dari substrat atau produk dapat dilakukan secara mudah dan alami karena enzim tidak larut dalam pelarut organik, aktivitas lipolitik enzim meningkat, tidak menyebabkan perubahan pH media dan memungkinkan terjadinya reaksi hidrolisis dalam lingkungan yang sedikit air.
E. PELARUT HEPTANA
Media yang sesuai untuk reaksi enzimatik adalah media dimana protein tidak dapat terlarut. Karena pada media tersebut enzim akan mengubah struktur tiga dimensinya dan non aktif (Zaks dan Klibanov, 1985). Media untuk reaksi enzimatik bermacam-macam, baik yang bersifat polar maupun non polar. Media yang paling umum digunakan pada reaksi hidrolisis adalah pelarut organik.
Pelarut dapat menyebabkan modifikasi bentuk enzim yaitu mengubah efisiensi katalitiknya dan spesifitasnya. Berdasarkan Eeji dan Takashi (1999), penggunaan media non konvensional akan meningkatkan enantioselektivitas pada reaksi katalisis oleh biokatalis. Non aqueous media reaksi seperti n-heksana juga akan meningkatkan stabilitas enzim (Rahman et al., 2006). Keuntungan lain penggunaan pelarut non aqueous adalah resiko kontaminasi mikrobial yang lebih rendah daripada pada sistem aqueous.
Ketertarikan khusus terhadap non konvensional media pada reaksi hidrolisis dengan kadar air yang rendah dapat digunakan untuk reaksi sintesis yang menyediakan kelarutan yang terbaik pada substrat hidrofobik dengan lipase sebagai katalis (Krieger et al., 2004).
Stabilitas protein lebih rendah dalam air yang tak larut dalam pelarut yang ada pada -2,5<logP<0 seperti aseton dan eter daripada pada pelarut hidrofobik (2<logP<4) seperti alkana atau haloalkana. Pelarut organik hidrofobik tidak dapat memotong ikatan asam amino dengan molekul air dari permukaan enzim. Ketika pelarut organik memotong ikatan air dari enzim, berakibat pada tidak adanya ikatan antara molekul. Pelarut organik yang dapat memotong ikatan tersebut adalah bahan yang bersifat hidrofilik. Oleh sebab itu, penerimaan stabilitas enzim lipase pada penggunaan pelarut hidrofilik jarang dilakukan (Krieger et al., 2004)
Pelarut organik menghasilkan berbagai efek fisiko-kimia pada molekul enzim. Pelarut akan mengubah bentuk asli dari enzim. Mekanisme perubahan susunan proteinnya adalah dengan mengganggu ikatan hidrogen dan interaksi hidrofobik. Dengan demikian aktivitas dan stabilitasnya akan berubah (Kim et al., 2000).
Aktivitas lipase secara normal akan meningkat dengan meningkatnya kepolaran (Schneider dan Berger, 1991). Namun, walaupun kepolaran suatu larutan yang direpresentasikan sebagai log P merupakan faktor dalam optimisasi biokatalisis, faktor lain seperti kelarutan substrat pada media reaksi, dan penambahan air harus diperhatikan. Pada studi Kim et al. (2000), esterifikasi trikaprilat dengan asam linoleat terkonjugasi dengan katalis enzim lipase Rhizomucor miehei regioselektif menunjukkan tingkat esterifikasi yang lebih tinggi pada pelarut n-hexane (log P 3,5) daripada isooktana (log P 4,5). Pada media n-heksana.nilai, tingkat esterifikasinya 57% sedangkan pada isooktana bernilai 52%.
Koefisien partisi adalah rasio konsentrasi bahan yang tidak terionisasi diantara dua larutan. Harga koefisien partisi suatu senyawa atau yang sering disimbolkan dengan P didefinisikan sebagai kadar keseimbangan termodinamik senyawa tersebut dalam fase non polar dibagi
dengan kadar dalam fase polar. Nilai log p menunjukkan tingkat hidrofobitas suatu bahan. Semakin tinggi suatu senyawa terikat dengan oktanol, maka semakin hidrofobik senyawa tersebut. Makin panjang rantai karbon atau rantai samping karbon, bagian molekul yang non polar semakin tinggi. Dengan demikian titik didihnya semakin tinggi dan kelarutannya dalam air semakin kecil (http://en.wikipedia.org/wiki/ Partition_coefficient.htm).
Herees et al. (2008) menyatakan nilai log P suatu pelarut merupakan fungsi dari laju reaksi esterifikasi untuk menghasilkan asam oleat. Koefisien opartisi berbanding terbalik dengan konstanta dielektrik. Tabel 6 menjelaskan hubungan koefisien partisi, konstanta dielektrik, dengan laju reaksi.
Tabel 6. Nilai kepolaran dan laju reaksi esterifikasi pelarut Pelarut Nilai log
P Laju reaksi (x104 mol L-1s-1) Konstanta dielektrik heptana 4 8,17a 1,9b Heksana 3,5 3,33a 2,0b Toluena 2,5 2a 2,4b
Sumber : a Herees et al. (2008)
b (http://www.engineeringtoolbox.com/liquid-dielectric-constants-d_1263.html)
Menurut Klibanov (1985), penggunaan pelarut organik pada reaksi hidrolisis ester mempunyai beberapa keuntungan selain penggunaan air, yaitu:
a. Substrat organik bahan dapat larut dalam pelarut organik, dimana enzim tidak dapat larut. Oleh karena itu, produk dan enzim mudah didapatkan kembali dengan metode non ekstraksi. Dengan demikian rendemen dapat meningkat.
b. Mampu untuk menjalankan reaksi yang tidak mungkin dilakukan dengan air karena terdapat penghambatan kinetika dan termodinamika. c. Substrat yang sensitif terhadap air dapat digunakan
d. Kesetimbangan reaksi berubah e. Meningkatkan kestabilan enzim.
f. Ketidaklarutan enzim dalam media sehingga enzim mudah untuk didapatkan dan digunakan kembali tanpa harus menggunakan imobilisasi enzim.
Zaks dan Klibanov (1985) menyatakan, suatu model ideal dalam penggunaan media pelarut organik pada reaksi enzimatik harus memenuhi syarat seperti
a. Enzim yang digunakan bebas dari ikatan kovalen dengan kofaktor b. Substrat yang digunakan larut dalam media organik
Pelarut heptana (C7H16) memiliki beberapa karakteristik yaitu nilai
kepolaran 4, bobot molekul 100,21 gram/mol, densitas 0,684 gram/mL larutan, titik leleh -90,61oC, dan titik didih 98oC (http://en.wikipedia.org/wiki /heptana.htm). Berhubung titik didihnya tinggi, oleh sebab itu, penggunaan heptana sebagai media reaksi untuk aplikasi pada suhu tinggi dapat dilakukan.
F. FAKTOR YANG MEMPENGARUHI AKTIVITAS DAN STABILITAS ENZIM LIPASE
1. Pengaruh Suhu
Suhu yang tinggi dan kontak langsung panas selama distilasi akan berdampak pada hidrolisis, oksidasi thermal, polimerisasi dan isomerisasi. Degradasi asam lemak rantai panjang dengan banyak ikatan rangkap kemungkinan membentuk asam lemak siklik, dan polimer dengan bobot molekul tinggi (Shahidi dan Wanasundara, 1998b). Oleh karena itu, omega-3 yang cenderung labil membutuhkan suhu dan kondisi pH yang sesuai (Haraldson et al., 1997).
Termostabilitas enzim merupakan faktor utama pada aplikasi industri, dikarenakan thermal degradation enzim pada suhu tinggi. Suhu dihubungkan dengan keterbatasan transfer massa. Suhu yang tinggi akan menurunkan viskositas campuran minyak dan akan meningkatkan transfer subsrat-produk pada permukaan atau di dalam partikel enzim. Suhu akan berpengaruh pada stabilitas enzim dan affinitas enzim terhadap substrat dan kompetisi reaksi dalam jumlah yang besar. Semakin tinggi suhu, akan
berakibat pada penurunan densitas dan viskositas media reaksi. Pada penurunan densitas media, akan meningkatkan difusitas dan berakibat pada peningkatan transfer massa substrat dan produk (Kim et al., 2004).
Suhu dapat berpengaruh positif terhadap reaksi hidrolisis maupun sebaliknya. Kenaikan suhu akan meningkatkan laju reaksi. Namun, pada reaksi menggunakan suhu tinggi struktur tersier enzim terganggu akibat terjadi denaturasi. Pada suhu 50oC nilai tingkat konversinya berubah menjadi cukup rendah. Sedangkan suhu 45oC merupakan suhu optimum reaksi hidrolisis sebab pada suhu diatas 45oC tingkat konversinya turun secara tiba-tiba dikarenakan enzim mengalami denaturasi (Kamarudin et al., 2008).
Suhu berpengaruh terhadap aktivitas dan stabilitas enzim lipase, suhu yang sesuai untuk penggunaan enzim lipase sebagai katalis adalah dibawah 70oC karena pada suhu tinggi menyebabkan terjadinya migrasi alkil secara non-enzimatic, terjadi oksidasi, isomerisasi dan denaturasi enzim (Shahidi et al., 1998).
Stabilitas panas enzim dipengaruhi oleh dua faktor yaitu struktur primer enzim dan komponen lain pada enzim. Tingginya kadar protein hidrofobik pada molekul enzim akan membuat struktur enzim rapat dan padat, dimana pada sistem ini enzim tidak mudah terdenaturasi karena perubahan lingkungan eksternal enzim. Komponen spesifik pada enzim seperti polisakarida dan kation divalen akan menstabilkan molekul enzim (Oztrurk, 2001)
2. Pengaruh pH
Enzim sangat sensitif terhadap perlakuan medium pH, karena memungkinkan perubahan status ionisasi enzim, yang akan mempengaruhi aktivitas dan selektifitas. Studi yang telah dilakukan menunjukan pH optimum untuk reaksi hidrolisis minyak sawit pada heksana adalah pH 7,5 dengan asam lemak yang dihasilkan 97,4% menggunakan enzim lipase dari Candida rugosa. Enzim optimum pada medium alkali namun mendekati netral (Kamarudin et al., 2008)
Berdasarkan studi Microbial Lipase Potential Biocatalist for the future industry yang dilakukan oleh Saxena et al. (2009), titik isoelektrik lipase adalah 4,3. Stabilitas lipase pada kondisi asam berada pada pH diatas 4. Stabilitas lipase pada kondisi basa berada pada pH diatas 8.
Katalisis enzim lipase aktif pada pH tertentu tergantung dari asal enzim tersebut dan status ionisasi asam amino penyusunnya. Asam amino asam, basa, dan netral hanya aktif pada satu bagian status ionisasi (Ozturk, 2001).
Berdasarkan Staufer (1989), ketertarikan studi mengenai tingkat enzim sebagai fungsi pH dikarenakan karena beberapa faktor yaitu :
a. Status protonasi sisi rantai asam amino pada sisi aktif kompleks enzim substrat (ES) mungkin akan berubah. Hasilnya perubahan kemampuan enzim substrat untuk menjadi produk.
b. Perubahan ionik molekul substrat atau perubahan ionik sisi aktif yaitu kecenderungan dua molekul tersebut untuk menjadi kompleks ES.
c. Perubahan pH dari netral yang memungkinkan melemahkan kekuatan stabilitas bentuk protein, yang berakibat peningkatan denaturasi enzim (kehilangan aktivitas).
3. Pengaruh Penambahan Air
Air sangat diperlukan untuk aktivitas enzim. Air berpartisipasi dalam seluruh interaksi non kovalen untuk mempertahankan bentuk sisi aktifnya baik secara langsung maupun tidak langsung. Reaksi enzimatik yang dilakukan tanpa keberadaan air akan mengubah sisi aktifnya secara drastis sehingga menonaktifkan enzim (Zaks dan Klibanov, 1985).
Sejumlah air selalu diperlukan enzim lipase untuk mempertahankan aktivitasnya. Namun, banyaknya air yang digunakan berbeda-beda tergantung dari jenis enzim lipase. Banyaknya air juga tergantung pada media reaksi, polaritas pelarut organik, dan lain-lain. Suatu reaksi yang dilakukan dengan menggunakan enzim mengandung kurang dari 1% air dan biasanya pada konsidi tanpa air (Haraldson et al., 1997).
Laju reaksi hidrolisis membutuhkan sejumlah air. Namun, terlalu banyak air akan berakibat pada reaksi hidrolisis trigliserida yang berlebihan yang berakibat pada peningkatan asam lemak bebas dan gliserida parsial (monogliserida dan digliserida) (Dordick, 1989). Banyaknya air akan mempengaruhi fleksibilits enzim (Krieger et al.,2004). Pengaturan kadar air pada sistem ini menjadi sangat penting karena semua proses berdasarkan pada manipulasi kesetimbangan kimia secara termodinamik pada reaksi reversible dimana air berpartisipasi dalam reaksi. Selain itu, air diperlukan secara esensial untuk menjaga integritas dari struktur tiga dimensi molekul enzim. Aktivitas lipase merupakan fungsi dari kadar air. Enzim membutuhkan sedikit layer hidrasi yang bertindak sebagai komponen primer pada reaksi enzimatik pada suatu media organik. Layer ini akan bertindak sebagai buffer diantara permukaan enzim dengan medium reaksi (Dordick, 1989)
Sejumlah air dibutuhkan untuk memaksimalkan aktivitas enzim. Klibanov (1988) menyatakan bahwa sedikit air diperlukan untuk mencapai aktivitas maksimal pada pelarut hidrofobik daripada pelarut hidrofilik. Pada aktivitas kadar air yang rendah, semakin rendah polaritas suatu pelarut berakibat semakin tinggi aktivitas enzim. Ketika aktivitas katalitik diplotkan terhadap banyaknya air yang terikat dengan enzim, suatu pola muncul untuk beberapa pelarut yang berbeda.
Menurut (Salis et al., 2008), walaupun air tidak ikut serta dalam produk, namun kadar air dalam suatu reaksi sangat penting karena mengekspresikan aktivitas enzimatik secara penuh. Air digunakan sebagai pelumas pada rantai polipeptida. Hal ini akan mempengaruhi mobilitas. Mobilitas lipase menjelaskan aktivitas enzimatik. Efek aktivitas enzim dipelajari sebagai fungsi bobot sejumlah air pada reaksi trigliserida metanolisis. Terlihat pada lipase Pseudomonas fluorescens inaktif ketika media yang digunakan kering. Peningkatan aktivitas secara tajam terjadi ketika 0,5 mg air/mg katalis ditambahkan.
Menurut Medina et al. (2003), mekanisme pengikatan air dan media pelarut organik digambarkan oleh Gambar 6 sebagai berikut:
Gambar 6. Mekanisme pengikatan air dan media pelarut organik dalam suatu reaksi (Medina et al., 2003)
Pada percobaan yang dilakukan oleh Schneider dan Berger (1991) menyatakan bahwa kenaikan laju reaksi menyebabkan disebabkan oleh sejumlah air. Namun, total 1,2 dan 1,3 digliserida menurun. Pada media bi-fase, monogliserida dan digliserida relative lebih stabil terhadap migrasi asil pada pelarut organik dengan kadar air maksimum 2%.
Konsentrasi minyak dan air sebagai substrat dalam reaksi hidrolisis juga mempengaruhi aktivitas lipase. Berdasarkan studi yang dilakukan oleh Shimada et al. (1997), konsentrasi oil water ratio optimum pada reaksi selektif hidrolisis adalah 50% dan aktivitasnya semakin menurun dengan meningkatnya oil water ratio
III. METODOLOGI
A. ALAT DAN BAHAN
Bahan utama yang digunakan antara lain minyak ikan sarden murni yang diperoleh dari PT. Muncar, Banyuwangi, Jawa Timur serta enzim lipase dari Aspergillus niger yang diperoleh dari Amano Pharmaceutical Manufacturing Co, buffer phosphate (0,1M), nitrogen, pelarut organik heptana, dan metanol. Sedangkan, bahan yang digunakan untuk analisis terdiri dari KOH alkohol, toluena, aquades, isopropil alkohol, KOH 0,1N, indikator phenolphtalein, dan HCl 0,5N.
Alat yang digunakan dalam proses hidrolisis antara lain reaktor gelas bertutup karet, suntikan, dan shaker waterbath. Sedangkan, alat yang digunakan untuk analisis antara lain buret, erlenmeyer, pipet, gelas ukur, gelas piala, sudip, kondensor, dan labu takar. Alat pendukung lainnya antara lain pH meter, vortex, magnetic stirrer, hot plate, neraca analitik, dan GC-MS (Gas Chromatography Mass Spectrometry).
B. METODE
1. Tahapan Penelitian
Penelitian ini dilakukan dalam dua tahapan, yaitu penelitian pendahuluan dan penelitian utama. Tahap pertama yaitu penelitian pendahuluan meliputi karakterisasi minyak ikan dan penentuan aktivitas enzim lipase dari Aspergillus niger dengan metode spektrofotometri. Tahap kedua meliputi penentuan derajat keasaman (pH), suhu dan penambahan air optimum reaksi hidrolisis enzimatik, penentuan hubungan persentase hidrolisis pada berbagai tingkat pH dan suhu pada reaksi hidrolisis enzimatik pada media yang ditambahkan pelarut heptana, serta penentuan hubungan tingkat hidrolisis dengan total omega-3. Diagram alir tahapan penelitian disajikan dalam Gambar 7.