KONSENTRASI PREKURSOR LOGAM DAN METODE IMPREGNASI
PADA PREPARASI NiMo/ZEOLIT Y TERHADAP KARAKTER
KATALIS
Disusun Oleh ARI YUSNANI
M0303021
SKRIPSI
Ditulis dan diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET SURAKARTA
ii
HALAMAN PENGESAHAN
Skripsi ini dibimbing oleh :
Pembimbing I
Dian Maruto Widjonarko, M.Si NIP. 132 258 053
Pembimbing II
Khoirina Dwi Nugrahaningtyas, M.Si NIP. 132 258 052
Dipertahankan didepan TIM Penguji Skripsi pada : Hari : Selasa
Tanggal : 15 Juli 2008
Anggota TIM Penguji : 1. Drs. Mudjijono, Ph.D. NIP. 131 570 164 2. Saptono Hadi, MSi, Apt NIP. 132 310 096
1. ………
2. ………
Disahkan oleh
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Dekan,
Prof. Drs. Sutarno, MSc, PhD NIP. 131 649 948
Ketua Jurusan Kimia,
Drs. Sentot Budi Rahardjo, PhD NIP. 131 570 162
iii
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi saya yang berjudul ”KONSENTRASI PREKURSOR LOGAM DAN METODE IMPREGNASI PADA PREPARASI NiMo/ZEOLIT Y TERHADAP KARAKTER KATALIS” adalah benar-benar hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, Juli 2008
iv ABSTRAK
Ari Yusnani. 2008. KONSENTRASI PREKURSOR LOGAM DAN METODE IMPREGNASI PADA PREPARASI NiMo/ZEOLIT Y TERHADAP KARAKTER KATALIS. Skripsi. Jurusan Kimia. Fakultas MIPA. Universitas Sebelas Maret.
Telah dipelajari pengaruh konsentrasi prekursor logam Ni (NiO) serta perbandingan efektivitas antara metode koimpregnasi dan impregnasi terpisah pada pengembanan logam Ni (NiO) dan Mo (MoO3) dalam zeolit Y untuk
menghasilkan katalis dengan karakter yang baik, untuk melawan katalis impor. Konsentrasi (% b/b) prekursor logam Ni (NiO) yang digunakan 2, 4, 6 dan 8, dengan konsentrasi (% b/b) prekursor logam Mo (MoO3) dibuat tetap yaitu 8.
Metode pengembanan dilakukan dengan impregnasi bersama (koimpregnasi) dan impregnasi terpisah dengan urutan pengembanan logam Ni dan Mo yang berbeda. Zeolit Y yang telah diembani logam diaktivasi dengan kalsinasi dengan aliran gas N2 pada suhu 550°C, oksidasi dengan aliran gas O2 pada suhu 400°C dan reduksi
dengan aliran gas H2 pada suhu 400°C. Identifikasi dan karakterisasi yang
dilakukan meliputi analisis komposisi mineral dengan X-Ray Difraction (XRD), analisis kandungan logam dengan Atomic Absorption Spectroscopy (AAS), analisis keasaman total dengan metode adsorpsi amonia, analisis luas permukaan spesifik dengan metode adsorpsi methylen blue dan analisis luas permukaan spesifik, volume pori total serta rerata jejari pori dengan Surface Area Analyzer (SAA).
Hasil penelitian menunjukkan bahwa variasi konsentrasi prekursor logam Ni (NiO) dan cara pengembanan logam Ni dan Mo pada zeolit Y menghasilkan katalis dengan karakter yang berbeda. Konsentrasi (b/b) prekursor logam Ni sebesar 2% mempunyai karakter yang lebih baik daripada konsentrasi yang lain. Cara pengembanan logam Ni dan Mo secara impregnasi terpisah mempunyai karakter yang lebih baik daripada koimpregnasi, serta metode paling efektif adalah dengan mengembankan logam Mo terlebih dahulu baru kemudian diikuti dengan mengembankan logam Ni (MoNi/Zeolit Y).
v ABSTRACT
Ari Yusnani. 2008. METAL PRECURSOR CONCENTRATION AND IMPREGNATION METHOD ON NiMo/ZEOLITE Y PREPARATION TO CATALYST CHARACTERS. Thesis. Department of Chemistry. Faculty of Mathematics and Natural Sciences. Sebelas Maret University.
The effect of concentration precursor toward metal Ni (NiO) and comparation average effectivity between coimpregnation and impregnation method on devices supporting NiMo in zeolite Y had been studied, for producing a better catalyst against import catalyst.
Precursor concentrations (% w/w) of metal Ni (NiO) are 2, 4, 6 and 8, while precursor concentration (% w/w) of metal Mo (MoO3) was 8. The support
method was conducted by coimpregnation and sequential impregnation with different support sequence metal Ni and Mo. Zeolit Y which has been supported by metal was activated with calcinations flowed with N2 gas at temperature
550°C, oxidated with O2 gas at 400°C and reduced by H2 gas at temperature
400°C. Identification and characterization mineral compositions analysis conducted with X-Ray Diffraction (XRD), metal content analysis with Atomic Absorptions Spectroscopy (AAS), total acidity analysis with ammonia adsorption method, specific surface area analysis with methylen blue adsorption and specific surface area, total pore volume and average pore radius with Surface Area Analyzer (SAA).
The results of analysis shows that precursor concentration of metal Ni and the supporting of metal Ni and Mo on zeolit Y produces catalyst with different character. Precursor concentration of metal Ni is 2% w/w which has better character. The supporting metal Ni and Mo by sequential impregnation method has better character than impregnation method. The most effective method is supporting metal Mo first continued with supporting metal Ni (MoNi/Zeolit Y).
vi MOTTO
“Tinta bagi seorang pelajar lebih suci nilainya daripada darah martir.” (Muhammad SAW)
”Karena sesungguhnya sesudah kesulitan itu ada kemudahan. Maka apabila kamu telah selesai (urusan dunia), bersungguh-sungguhlah (dalam beribadah).
Dan hanya kepada Tuhan-Mu lah kamu berharap.” (QS Al-Insyirah: 5-8)
”Wahai Muhammad, hiduplah sesukamu tapi kau pasti mati. Berbuatlah sekehendakmu tapi kau pasti dibalas. Dan cintailah siapapun yang kau mau
tapi engkau pasti berpisah dengannya.” (HR Ath Thabrani)
“I am enough of an artist to draw freely upon my imagination. Imagination is more important than knowledge. Knowledge is limited. Imagination encircles the
world.”
(Albert Einstein)
”Everyman dies not everyman really lives”
(Gibson, Mel, Braveheart)
“To be or not to be!...that is the question.”
(shakespeare, William. Hamlet)
“Cogito ergo sum”(Aku berpikir maka aku ada) (Descartes, Rene)
“Impian, Cinta dan Kehidupan.”
Sederhana, tapi luar biasa... ada dalam diri setiap manusia jika mau meyakininya.
vii
Sebaik-baik manusia adalah manusia yang bisa memberi manfaat bagi orang lain.
PERSEMBAHAN
Atas kesempatan waktu, kejernihan pikiran kesejukan qolbu, limpahan nikmat
yang tiada terhitung, kekuatan, kesabaran, kemudahan, dan hidayah dari Alloh,
maka karya kecil ini kupersembahkan kepada:
Rabb-ku yang tidak pernah meninggalkanku,
Ibu dan Bapak tercinta yang slalu menyayangi dan mendo’akanku,
Anis dan Taufik ”Duo My Little Brother” yang selalu mengisi hariku dengan
viii
Sahabat-sahabat terbaikku atas kebersamaan dan semangat yang selalu
mengalir untukku,
Seseorang yang telah Alloh takdirkan untuk menjadi romeoku kelak,
Dan semua yang telah mewarnai hidupku...
KATA PENGANTAR
Alhamdulillah, puji dan syukur penulis panjatkan kehadirat Allah SWT, karena dengan rahmat, taufik serta hidayah-Nya, sehingga penulis dapat menyelesaikan skripsi ini. Sholawat dan salam senantiasa penulis haturkan kepada Rosululloh SAW sebagai pembimbing dan suri teladan bagi seluruh umat manusia.
Skripsi sederhana ini tidak dapat terselesaikan tanpa dukungan dari berbagai pihak yang selama ini telah banyak membantu. Oleh karena itu dengan segala kerendahan hati, penulis mengucapkan terima kasih kepada:
1. Bapak Prof. Drs. Sutarno, M.Sc, Ph.D selaku Dekan FMIPA UNS.
2. Bapak Sentot Budi Rahardjo, Ph.D. selaku Ketua Jurusan Kimia FMIPA UNS beserta seluruh stafnya.
3. Bapak Dian Maruto Widjonarko, M.Si. selaku Pembimbing I yang telah membimbing dan mengarahkan penulis selama pelaksanaan penelitian dan penyusunan skripsi.
4. Ibu Khoirina Dwi Nugrahaningtyas, M.Si. selaku Pembimbing I yang telah membimbing dan mengarahkan penulis selama pelaksanaan penelitian dan penyusunan skripsi serta yang telah membiayai penelitian ini hingga selesai melalui INSENTIF MOET DASAR MENRISTEK 2007.
5. Bapak Drs. Mudjijono, Ph.D. selaku Pembimbing Akademis yang telah membimbing penulis selama mengikuti pendidikan di Jurusan Kimia FMIPA UNS.
6. Bapak Fajar Rakhman W, Ph.D. selaku Ketua Sub Laboratorium Kimia Pusat UNS beserta seluruh stafnya.
ix
7. Bapak Abu Masykur, M.Si. selaku Ketua Laboratorium Kimia Dasar FMIPA UNS beserta seluruh stafnya Mas Anang dan Mbak Nanik atas bantuannya.
8. Bapak dan Ibu Dosen di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret, atas ilmu dan pengetahuan yang telah diberikan.
9. Amie dan Janti ”Duo Sahabatku” thanks for being my best friend.
10. Mbak Yuni, thanks for your help and kindness. You are my best sister (Inget lagu kita kan?)
11. Mbak Yani dan Mbak Rihana, thanks for being with me all this year. 12. Saudara-saudaraku Kimia ’03, atas kebersamaan dan bantuannya.
13. Penghuni “Lab Kimia Dasar Atas” : Dom (be a good koordinator ya?, wah berarti kita teman SMP, SMA sampai Kuliah dong!), Mb Anis (you know me, kita gak pernah kehabisan ide diskusi, tetep erobik terus ya?), Mb Lisa (keep your spirit!), Mb Dian, Mb Aish, Mb Risa, Mb Siwi, Mb Murni, Mb Rani, Mb Jamil, Mb Mutia, Mb Nurul (you all are my sister, remember batagor makanan favorit kita di Lab)
14. Semua pihak yang telah membantu, baik secara langsung maupun tidak langsung yang tidak dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa masih banyak kekurangan dalam penyusunan skripsi ini, namun penulis berharap semoga karya kecil ini bermanfaat bagi kemajuan penelitian bidang kimia dan ilmu pengetahuan. Semoga Allah selalu melimpahkan rahmat dan hidayah-Nya kepada kita semua, Amin.
Surakarta, Juni 2008
x DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
HALAMAN PERNYATAAN ... iii
HALAMAN ABSTRAK ... iv
HALAMAN ABSTRACT ... v
MOTTO ... vi
PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI ... x
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
TABEL LAMPIRAN... xvii
GAMBAR LAMPIRAN ... xix
BAB I PENDAHULUAN ... 1 A. Latar Belakang ... 1 B. Perumusan Masalah ... 3 1. Identifikasi Masalah ... 3 2. Batasan Masalah ... 4 3. Rumusan Masalah ... 4 C. Tujuan Penelitian ... 5 D. Manfaat Penelitian ... 5
xi
BAB II LANDASAN TEORI ... 6
A. Tinjauan Pustaka ... 6
1. Zeolit Y ... 6
1.1. Struktur ... 6
1.2. Fungsi Zeolit Y dalam Katalis ... 12
2. Logam Ni dan Mo Sebagai Katalis ... 15
Halaman 3. Katalis Logam-Pengemban ... 18
a. Metode Pengembanan Logam NiMo pada Zeolit Y ... 18
b. Aktivasi Katalis ... 19
c. Katalis Bimetal Ni dan Mo ... 20
B. Kerangka Pemikiran ... 21
C. Hipotesis ... 22
BAB III METODOLOGI PENELITIAN ... 23
A. Metode Penelitian ... 23
B. Tempat dan Waktu Penelitian ... 23
C. Alat dan Bahan ... 23
D. Prosedur Penelitian ... 24
1. Preparasi, Identifikasi dan Karakterisasi Zeolit Y ... 24
2. Pembuatan dan Karakterisasi Katalis Bimetal ... 25
a. Metode Koimpregnasi ... 25
b. Metode Impregnasi Terpisah... 26
1) Pembuatan Katalis NiMo/Zeolit Y ... 26
2) Pembuatan Katalis MoNi/Zeolit Y ... 27
3. Karakterisasi... 27
a. Penentuan Keasaman ... 27
b. Penentuan Luas Permukaan Spesifik dengan Metode Adsorpsi Methylen Blue... 28
E. Teknik Pengumpulan Data ... 29
xii
BAB IV HASIL PENELITIAN DAN PEMBAHASAN ... 32
1. Preparasi, Identifikasi dan Karakterisasi Zeolit Y Awal 32
a. Preparasi Zeolit Y Awal ... 32
b. Identifikasi Zeolit Y Awal ... 33
1). Hasil Analisis Gugus Fungsi dengan FTIR... 33
2). Kristalinitas dan Komposisi Mineral Zeolit Y ... 36
Halaman c. Karakterisasi Zeolit Y Awal... 37
1). Analisis Keasaman Total ... 37
2). Analisis Luas Permukaan Spesifik ... 38
3). Analisis Kandungan Logam ... 40
2. Katalis Bimetal ... 40
a. Metode Koimpregnasi ... 42
1). Kandungan Logam Ni dan Mo Katalis Hasil Sintesis secara Koimpregnasi... 44
2). Keasaman Total Katalis Hasil Sintesis secara Koimpregnasi ... 45
3). Luas Permukaan Spesifik Katalis Hasil Sintesis secara Koimpregnasi... 46
b. Metode Impregnasi Terpisah dengan Pengembanan Logam Ni diawal ... 47
1). Kandungan Logam Ni dan Mo Hasil Sintesis Impregnasi Terpisah dengan Logam Ni diawal .. 47
2). Keasaman Total Katalis Hasil Sintesis Impregnasi Terpisah dengan Logam Ni diawal ... 49
3). Luas Permukaan Spesifik Hasil Sintesis Impregnasi Terpisah dengan Logam Ni diawal ... 50
c. Metode Impregnasi Terpisah dengan Pengembanan Logam Mo diawal ... 51 1). Kandungan Logam Ni dan Mo Hasil Sintesis
xiii
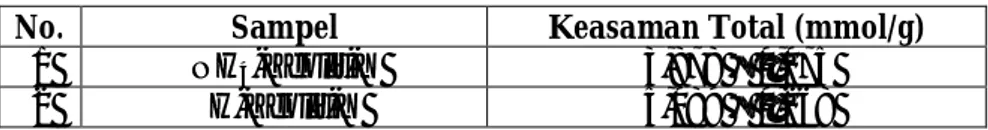
2). Keasaman Total Katalis Hasil Sintesis
Impregnasi Terpisah dengan Logam Mo diawal .. 54
3). Luas Permukaan Spesifik Hasil Sintesis Impregnasi Terpisah dengan Logam Mo diawal .. 55
3. Perbandingan Metode Koimpregnasi dan Impregnasi Terpisah ... 56
Halaman a. Perbandingan Kandungan Logam Ni dan Mo ... 56
b. Perbandingan Keasaman Total... 57
c. Perbandingan Luas Permukaan Spesifik... 58
BAB V KESIMPULAN DAN SARAN ... 64
A. Kesimpulan ... 64
B. Saran ... 64
DAFTAR PUSTAKA ... 65
xiv
DAFTAR TABEL
Halaman
Tabel 1. Frekuensi IR Beberapa Gugus-Gugus Fungsi ... 11
Tabel 2. Keasaman Total Sampel NH4-Zeolit Y dan H-Zeolit Y ... 37
Tabel 3. Luas Permukaan, Volume Pori dan Rerata Jejari Pori NH4-Zeolit Y dan H-Zeolit Y ... 38
Tabel 4. Kandungan Logam Si, Logam Al, Logam Ni dan Logam Mo dalam H-Zeolit Y... 39
Tabel 5. Komposisi Mineral Katalis Hasil Koimpregnasi ... 42
Tabel 6. Kandungan Logam Ni dan Mo Katalis Hasil Koimpregnasi . 43
Tabel 7. Keasaman Total Katalis Hasil Koimpregnasi ... 44
Tabel 8. Luas Permukaan Spesifik Katalis Hasil Koimpregnasi ... 45
Tabel 9. Komposisi Mineral Sampel Katalis Hasil Metode Impregnasi Terpisah dengan Logam Ni diawal ... 47
Tabel 10. Kandungan Logam Ni dan Mo Katalis Hasil Impregnasi Terpisah dengan Logam Ni diawal... 48
Tabel 11. Keasaman Total Katalis Hasil Impregnasi Terpisah dengan Logam Ni diawal ... 49
Tabel 12. Luas Permukaan Spesifik Katalis Hasil Impregnasi Terpisah dengan Logam Ni diawal ... 50
Tabel 13. Komposisi Mineral Sampel Katalis Hasil Metode Impregnasi Terpisah dengan Logam Mo diawal ... 52
Tabel 14. Kandungan Logam Ni dan Mo Katalis Hasil Impregnasi Terpisah dengan Logam Mo diawal ... 52 Tabel 15. Keasaman Total Katalis Hasil Impregnasi Terpisah
xv
dengan Logam Mo diawal... 53
Tabel 16. Luas Permukaan Spesifik Katalis Hasil Impregnasi Terpisah dengan Logam Mo diawal... 54
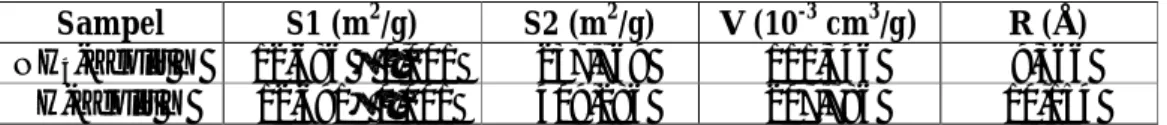
Tabel 17. Hasil Analisis Luas Permukaan Spesifik (S), Volume Pori Total (V) dan Rerata Jejari Pori (R) menggunakan alat SAA ... 59
DAFTAR GAMBAR Halaman Gambar 1. Struktur Zeolit Y dengan Pembukaan Cincin-12 ... 6
Gambar 2. Unit Pembangun Primer Zeolit ... 7
Gambar 3. Unit Pembangun Sekunder Zeolit ... 7
Gambar 4. Diagram Unit Struktur Dasar dan Mode Kombinasi Zeolit A, X dan Y ... 8
Gambar 5. Bentuk Na-Zeolit Y ... 9
Gambar 6. Bentuk Ca-Zeolit Y ... 9
Gambar 7. Bentuk H-Zeolit Y ... 14
Gambar 8. Pembentukan Situs Lewis ... 14
Gambar 9. Situs Lewis Sebenarnya ... 14
Gambar 10. Rangkaian Alat Kalsinasi, Oksidasi dan Reduksi... 26
Gambar 11. Perbandingan Serapan FTIR dari Sampel: (a) NH4-Zeolit Y (b) H-Zeolit Y ... 33
Gambar 12. Perbandingan Difraktogram: (a) NH4-Zeolit Y (b) H-Zeolit Y... 35
Gambar 13. Difraktogram H-Zeolit Y, NiMo8%/Zeolit Y, NiMo6%/ Zeolit Y, NiMo4%/Zeolit Y dan NiMo2%/Zeolit Y ... 41
Gambar 14. Perbandingan Difraktogram H-Zeolit Y dengan Katalis Impregnasi Terpisah Ni diawal ... 46
Gambar 15. Perbandingan Difraktogram H-Zeolit Y dengan Katalis Impregnasi Terpisah Mo diawal ... 51 Gambar 16. Histogram Jumlah Logam Total (Ni+Mo) yang Teremban
xvi
dalam Katalis ... 55
Gambar 17. Histogram Peningkatan Keasaman Total Katalis ... 56
Gambar 18. Histogram Perubahan Luas Permukaan Spesifik ... 58
Gambar 19. Akumulasi Logam Ni dan Mo pada Mulut Pori dan Saluran Pori Katalis ... 60
Gambar 20. Distribusi Logam Ni dan Mo yang Merata pada Permukaan Katalis ... 61
DAFTAR LAMPIRAN Halaman Lampiran 1. Perhitungan Persentase Kandungan Mineral dalam Sampel Berdasarkan Difraktogram XRD ... 68
Lampiran 2. Kondisi Operasi X-Ray Diffraction Katalis... 69
Lampiran 3. Perhitungan Keasaman Total Sampel ... 70
xvii
TABEL LAMPIRAN
Halaman Tabel Lampiran 1. Identifikasi Puncak Spektra FT-IR dari
NH4-Zeolit Y Awal... 72
Tabel Lampiran 2. Hasil Identifikasi Gugus Fungsi H-Zeolit Y ... 73 Tabel Lampiran 3. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
NH4-Zeolit Y yang sesuai dengan Standar... 74
Tabel Lampiran 4. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
H-Zeolit Y yang sesuai dengan Standar... 76 Tabel Lampiran 5. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
NiMo2%/Zeolit Y yang sesuai dengan Standar ... 78 Tabel Lampiran 6. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
NiMo4%/Zeolit Y yang sesuai dengan Standar ... 80 Tabel Lampiran 7. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
NiMo6%/Zeolit Y yang sesuai dengan Standar ... 82 Tabel Lampiran 8. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
NiMo8%/Zeolit Y yang sesuai dengan Standar ... 84 Tabel Lampiran 9. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
Ni2%Mo/Zeolit Y yang sesuai dengan Standar ... 86 Tabel Lampiran 10. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
Ni4%Mo/Zeolit Y sesuai Standar ... 88 Tabel Lampiran 11. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
Ni6%Mo/Zeolit Y sesuai Standar ... 90 Tabel Lampiran 12. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
xviii
Ni8%Mo/Zeolit Y yang sesuai dengan Standar .. 92 Tabel Lampiran 13. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
MoNi 2%/Zeolit Y yang sesuai dengan Standar .. 94 Tabel Lampiran 14. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
MoNi4%/Zeolit Y yang sesuai dengan Standar ... 96 Tabel Lampiran 15. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
MoNi6%/Zeolit Y yang sesuai dengan Standar .. 98 Halaman Tabel Lampiran 16. Pola Difraksi dan Intensitas Puncak-Puncak Katalis
xix
GAMBAR LAMPIRAN
Halaman Gambar Lampiran 1. Hasil Pengukuran Luas Permukaan NH4-Zeolit Y 102
Gambar Lampiran 2. Hasil Pengukuran Volume Pori dan Rerata Jejari
Pori NH4-Zeolit Y ... 103
Gambar Lampiran 3. Hasil Pengukuran Luas Permukaan H-Zeolit Y . 104 Gambar Lampiran 4. Hasil Pengukuran Volume Pori dan Rerata Jejari
Pori H-Zeolit Y... 105 Gambar Lampiran 5. Hasil Pengukuran Luas Permukaan
NiMo 2%/Zeolit Y... 106 Gambar Lampiran 6. Hasil Pengukuran Volume Pori dan Rerata Jejari
Pori NiMo 2%/Zeolit Y... 107 Gambar Lampiran 7. Hasil Pengukuran Luas Permukaan
Ni2%Mo/Zeolit Y ... 108 Gambar Lampiran 8. Hasil Pengukuran Volume Pori dan Rerata Jejari
Pori Ni2%Mo/Zeolit Y ... 109 Gambar Lampiran 9. Hasil Pengukuran Luas Permukaan
MoNi2%/Zeolit Y ... 110 Gambar Lampiran 10. Hasil Pengukuran Volume Pori dan Rerata
Jejari Pori MoNi2%/Zeolit Y ... 111 Gambar Lampiran 11. Standar JCPDS Powder Diffraction File Faujasit 112 Gambar Lampiran 12. Standar JCPDS Powder Diffraction File
Faujasit-Na ... 114 Gambar Lampiran 13. Standar JCPDS Powder Diffraction File Zeolit Y 117
xx
Gambar Lampiran 14. Standar JCPDS Powder Diffraction File Logam Mo 119 Gambar Lampiran 15. Standar JCPDS Powder Diffraction File Logam Ni 120 Gambar Lampiran 16. Standar JCPDS Powder Diffraction File MoNi 122 Gambar Lampiran 17. Standar JCPDS Powder Diffraction File NiMoO4 122
Gambar Lampiran 18. Spektra Inframerah NH4-Zeolit Y 123
Gambar Lampiran 19. Spektra Inframerah NH4-Zeolit Y 124
1 BAB 1
PENDAHULUAN
A. Latar Belakang
Pemenuhan energi untuk keberlanjutan pembangunan ekonomi secara global umumnya bersumber pada minyak bumi, mencapai 33%, sedangkan batubara mencapai 23%, gas mencapai 20%, hidroelektrik mencapai 6%, nuklir mencapai 7%, dan biomassa mencapai 12% (Armor, 2000). Di Indonesia, konsumsi bahan bakar minyak (BBM) 1,15 juta barel per hari, kemampuan produksi hanya 950.000 barel per hari, meskipun cadangan minyak bumi sekitar 9,7 miliar barel, namun hanya 4,7 miliar barel yang merupakan cadangan terbukti. Akibatnya, cadangan minyak bumi diperkirakan akan habis sekitar 15 tahun lagi, bila tidak ada eksplorasi baru. Untuk mengatasi masalah terbatasnya pemenuhan energi oleh minyak bumi tersebut, sintesis sumber energi alternatif menjadi sebuah prioritas (Mubarak, 2007).
Sumber energi alternatif tersebut dapat diperoleh dengan mengolah bahan yang mengandung senyawa hidrokarbon fraksi berat, seperti limbah plastik dan ban bekas, menjadi senyawa hidrokarbon yang lebih ringan, sehingga mempunyai nilai guna dan ekonomi yang lebih tinggi (Mukhamad, 1999).
Pengolahan hidrokarbon fraksi berat menjadi hidrokarbon fraksi ringan dapat dilakukan dengan dua cara, yaitu perengkahan termal dan katalisis. Perengkahan secara termal, dilihat dari segi ekonominya, kurang ekonomis dibanding perengkahan secara katalisis, karena harus dilakukan pada suhu dan tekanan yang tinggi. Perengkahan secara katalisis, akan memberikan hasil yang besar disebabkan suhu dan tekanan yang lebih rendah (Gates, 1992).
Proses pengolahan sumber energi alternatif bertujuan menekan biaya produksi dan dampak lingkungan seminimal mungkin (Inui, 1999). Namun, katalis untuk mempercepat terjadinya proses reaksi dan penghematan biaya maupun waktu di berbagai industri sebagian besar masih diimpor (Trisunaryanti dan Cahyono, 2002). Hal ini memunculkan pemikiran dan penelitian tentang
pembuatan katalis multifungsi untuk mengurangi ketergantungan terhadap katalis impor.
Katalis yang ekonomis dan ramah lingkungan tetapi efektif dipengaruhi oleh beberapa faktor seperti aktivitas, stabilitas, sensitifitas terhadap perubahan panas, dan mudah diregenerasi, yang dapat dipenuhi oleh katalis sistem logam-pengemban. Pengemban yang banyak dikembangkan pada saat ini adalah zeolit, selain silika, alumina dan karbon (Anderson and Boundart, 1981).
Salah satu jenis zeolit sebagai bahan pengemban katalis yang mampu meningkatkan kinerja dari katalis yaitu zeolit Y. Zeolit Y merupakan mineral alumina silikat terhidrasi yang mengandung kation alkali dan alkali tanah yang dapat dipertukarkan dengan kation lain sehingga zeolit Y mempunyai sifat-sifat yang memungkinkan untuk dimodifikasi menjadi katalis maupun sebagai padatan pengemban logam aktif. Zeolit Y berfungsi sebagai pengemban logam-logam transisi antara lain logam Ni (nikel) dan logam Mo (molibdenum) (Li, D.; Xu, Huifang; George D.G., Jr., 1999) yang mempunyai aktivitas dan selektivitas yang tinggi tetapi tidak terdeaktivasi (Imelik, 1985). Oleh karena itu, penggunaan zeolit Y sebagai katalis dalam industri pengolahan minyak bumi di seluruh dunia diperkirakan mampu menghemat biaya produksi sebesar US $ 10 Miliar tiap tahunnya (Weitkamp, 2000 dalam Arryanto, 2006).
Mengacu pada peneliti sebelumnya yang telah berhasil membuktikan bahwa logam Ni dan Mo merupakan logam dengan sifat hidrogenasi dan dehidrogenasi serta hidrodesulfurisasi yang cukup tinggi, sedangkan zeolit Y adalah padatan asam dengan tingkat keasaman yang cukup tinggi, maka pengembanan logam Ni dan Mo pada zeolit Y diperkirakan akan diperoleh kombinasi situs asam-hidrogenasi dan deasam-hidrogenasi serta hidrodesulfurisasi yang dapat meningkatkan efektivitas katalitik zeolit Y. Gabungan dua logam dapat memberikan efek sinergis, yaitu katalis NiMo/Zeolit Y yang terbukti mampu memberikan efek sinergis dalam proses hidrorengkah dan hidrodesulfurisasi (Li, D.; Xu, Huifang; George D.G., Jr., 1999). Gabungan efek sinergis logam NiMo didukung oleh pengemban zeolit Y diperkirakan dapat diperoleh katalis dengan aktivitas hidrorengkah dan hidrodesulfurisasi yang tinggi.
3
B. Perumusan Masalah
1. Identifikasi Masalah
Penelitian tentang penggunaan paduan logam transisi telah banyak dilakukan, diantaranya oleh Li, D.; Xu, Huifang; George D.G., Jr., (1999) yang mengembankan Ni dan Mo ke dalam zeolit Y ultrastabil, Na-zeolit Y, modernit, dan ZSM-5 untuk katalis hydrotreatment. Hasil penelitian menunjukkan bahwa katalis Ni-Mo/ultrastabil zeolit Y mempunyai aktivitas hidrodesulfurisasi (HDS) dibenzothiophene yang tinggi. Namun, pada penelitian tersebut Li hanya menggunakan satu rasio konsentrasi prekursor logam Ni dan Mo, yaitu masing-masing 2 % dan 8 %. Di sisi lain kenaikan jumlah logam Pd dapat meningkatkan keasaman katalis Ni-Pd/zeolit alam, sehingga diharapkan dengan kenaikan keasaman katalis, reaktan yang teradsorpsi pada permukaan menjadi lebih banyak dan kecepatan reaksi dapat meningkat seperti ditunjukkan oleh penelitian yang telah dilakukan Trisunaryanti dkk (2000). Oleh karena itu, perlu dilakukan sintesis untuk mengetahui pengaruh konsentrasi prekursor terhadap karakter katalis dengan menggunakan variasi konsentrasi logam Ni dan konsentrasi logam Mo tetap. Peningkatan konsentrasi logam Ni diharapkan dapat meningkatkan karakter dan aktivitas katalis NiMo/Zeolit Y, sehingga teridentifikasi masalah mengenai pengaruh penambahan konsentrasi larutan prekursor logam Ni terhadap karakter katalis.
Penempatan komponen aktif logam ke dalam pengemban pada dasarnya dilakukan dengan metode pertukaran ion, yaitu komponen logam dimasukkan ke dalam bahan pengemban dengan proses pertukaran ion dengan senyawa kation kompleks kemudian di cuci dengan air bebas ion untuk menghilangkan semua garam, dan metode impregnasi. Metode impregnasi tersebut dilakukan dengan memasukkan katalis logam secara paksa ke dalam rongga-rongga pengemban (Anderson and Boundart, 1981), dan merupakan prosedur yang umum untuk membuat katalis dengan dua logam (bimetal). Pembuatan katalis bimetal dapat dilakukan dengan memasukkan kedua garam logam secara bersama-sama (koimpregnasi), atau secara terpisah (impregnasi terpisah) (Augustine, 1996).
Preparasi katalis bimetal dengan pengemban zeolit alam aktif dengan metode impregnasi terpisah yang dilakukan oleh Maryani (2005) mempunyai efektivitas yang lebih baik daripada katalis dengan metode koimpregnasi. Selain itu, pada pembuatan katalis dengan metode impregnasi terpisah katalis MoNi/ZA mempunyai efektivitas lebih baik daripada katalis NiMo/ZA. Oleh karena itu teridentifikasi masalah berikutnya yaitu apakah urutan pengembanan logam Ni (NiO) dan Mo (MoO3) pada zeolit Y dengan metode impregnasi terpisah akan
mempengaruhi karakter katalis yang dihasilkan.
2. Batasan Masalah
Ruang lingkup penelitian ini dibatasi sebagai berikut :
a. Zeolit Y yang digunakan merupakan zeolit sintesis dari Tosoh, Jepang.
b. Logam Ni dalam bentuk NiO dan Mo dalam bentuk MoO3 yang diembankan
pada bahan pendukung dalam bentuk bimetal (gabungan dari dua logam). c. Konsentrasi logam Mo (MoO3) yang digunakan tetap yaitu 8 % b/b,
sedangkan variasi konsetrasi logam Ni (NiO) yang digunakan antara 2 % b/b sampai 8 % b/b.
d. Metode pengembanan logam dilakukan dengan metode impregnasi, yaitu impregnasi bersama (koimpregnasi) dan impregnasi terpisah.
3. Rumusan Masalah
Masalah dalam penelitian ini dapat dirumuskan sebagai berikut:
a. Berapakah rasio optimum konsentrasi prekursor logam Ni dan logam Mo yang diembankan dalam Zeolit Y?
b. Apakah perbedaan metode pengembanan logam secara koimpregnasi dan impregnasi terpisah mempengaruhi karakter katalis yang diperoleh?
c. Apakah urutan pengembanan logam Ni dan Mo pada impregnasi terpisah berpengaruh terhadap karakter katalis?
5
C. Tujuan Penelitian
Tujuan utama penelitian ini adalah untuk meningkatkan kualitas dan efektivitas katalis logam-pengemban NiMo/Zeolit Y yang meliputi: kandungan logam Ni dan Mo, keasaman total, luas permukaan, volume pori total, dan rerata jejari pori.
Secara khusus penelitian ini ditujukan untuk:
a. Menentukan konsentrasi prekursor optimum pada pengembanan logam Ni dan Mo pada Zeolit Y.
b. Membandingkan metode pengembanan logam Ni dan Mo secara koimpregnasi dan impregnasi terpisah.
c. Menentukan urutan pengembanan logam Ni dan Mo pada impregnasi terpisah terhadap karakter katalis.
D. Manfaat Penelitian
Dari hasil penelitian ini dapat diambil manfaat sebagai berikut :
a. Memberikan informasi tentang pembuatan katalis multifungsi kompleks NiMo/Zeolit Y yang efisien.
b. Secara praktis, diharapkan memperoleh katalis bimetal NiMo/Zeolit Y sebagai katalis multifungsi sehingga membantu kalangan industri dalam pemenuhan katalis yang lebih efektif.
6 BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
Pada sub bab ini akan diuraikan pustaka yang mendukung penelitian. Pustaka ini berupa uraian teori-teori atau penelitian tentang faktor-faktor yang mempengaruhi efektivitas sintesis katalis dari bahan zeolit Y yang diembani logam nikel (Ni) dan molibdenum (Mo) yang telah dilakukan sebelumnya dan mendasari penelitian yang dilakukan.
1. Zeolit Y 1.1. Struktur
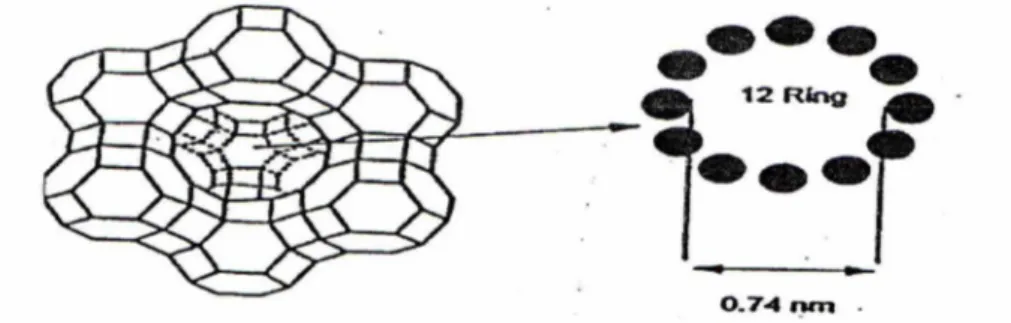
Zeolit Y dilihat dari struktur asalnya, merupakan salah satu jenis zeolit yang tersusun atas sangkar-sangkar sodalit yang disatukan melalui perluasan cincin-6 dan bergabung melalui bidang heksagonal, seperti ditunjukkan pada Gambar 1. Struktur dalam sangkar besar berdiameter 1,3 nm, mempunyai tetrahedral setiap pembukaan cincin-12. Diameter cincin-12 berukuran 0,74 nm, yang
memungkinkan molekul yang lebih besar masuk dalam sangkar. Unit substruktur dasar sangkar sodalit tersebut dibentuk dengan kombinasi beberapa bujur sangkar dan beberapa heksagonal. Polihedral-polihedral dapat mengandung lebih dari 24 tetrahedral.
Gambar 1. Struktur Zeolit Y dengan Pembukaan Cincin-12 (Augustine, 1996)
7
Unit struktur zeolit yang merupakan penyusun zeolit Y adalah gabungan dari banyak unit bangun sekunder dan unit bangun polihedral. Unit Pembangun Sekunder (UPS) tersebut dapat dibentuk dari Unit Pembangun Primer (UPP). Unit pembangun primer merupakan unit terkecil dalam struktur zeolit yang berupa tetrahedral TO4 dengan T merupakan Si4+ atau Al3+ seperti ditunjukkan pada
Gambar 2. Dalam zeolit Y rasio Si/Al antara 2 dan 5 (Augustine, 1996).
Gambar 2. Unit Pembangun Primer Zeolit (UPP); (a) Model kerangka. (b) Model ruang, (c) Model bola tongkat, (d) Model bola. Sedangkan Unit Pembangun Sekunder ditunjukkan pada Gambar 3.
Gambar 3. Unit Pembangun Sekunder Zeolit (UPS)
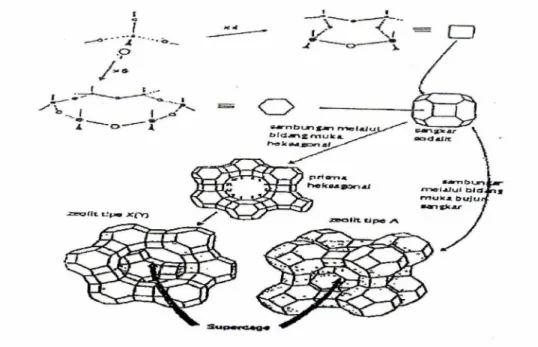
Empat tetrahedral berhubungan membentuk bujur sangkar (atom T pada pusat) dan enam tetrahedral akan membentuk heksagonal. Empat UPP bergabung menjadi ring 4 bujur sangkar, 6 UPP membentuk ring 6, 8 UPP membentuk ring 8. Bentuk 4-4 adalah hasil penggabungan 4 buah ring 4, 6-6 adalah gabungan 6 buah ring dan seterusnya, sedangkan 5-1 adalah gabungan satu ring dan satu UPP dan seterusnya. Zeolit tipe Y juga terjadi dengan penghubung sangkar sodalit dapat digambarkan seperti disajikan pada Gambar 4 (Chambellan, 1984).
Gambar 4. Diagram Unit Struktur Dasar dan Mode Kombinasi Zeolit A, X dan Y.
Zeolit Y merupakan kristal mineral alumino-silikat yang terbentuk dari koordinasi polihedral [SiO4]4- dan [AlO4]5- dengan sistem kerangka terbuka
dengan rongga-rongga dan pori-porinya ditempati oleh kation dan molekul air. Kerangka tersusun dari ion silikon mempunyai muatan 4+ yang dinetralkan oleh empat oksigen tetrahedral yang mengelilinginya sehingga tetrahedral dari silika bermuatan netral. Adanya tetrahedral alumina yang mempunyai muatan 1-, karena ion aluminium yang bermuatan 3+ berikatan dengan empat ion oksigen, sehingga ikatan dengan kation dari logam alkali atau alkali tanah terjadi pada tetrahedral alumina (Gates, 1992).
Molekul air yang menempati kerangka zeolit Y dapat dihilangkan dan kation dalam zeolit Y dapat dipertukarkan. Jumlah molekul air menunjukkan jumlah pori-pori atau volume ruang hampa yang terbentuk saat unit sel kristal tersebut dipanaskan, sedangkan jumlah kation dapat ditentukan oleh jumlah tetrahedral [AlO4]5- di dalam kerangka. Kation dalam zeolit Y berfungsi untuk menetralkan
muatan negatif pada kerangka oksigen yang disebabkan oleh substitusi Al3+ ke Si4+ (Dyer, 1988), seperti ditunjukkan pada Gambar 5 dan Gambar 6.
9
Gambar 5. Bentuk Na-Zeolit Y (Gates, 1992)
Gambar 6. Bentuk Ca-Zeolit Y (Gates, 1992)
Struktur porus (pori-pori mikro) dan dimensi tiga zeolit Y memungkinkan zeolit Y menyerap bahan lain yang ukuran molekulnya lebih kecil dari pori mikronya, sehingga dapat dimanfaatkan sebagai penyerap (adsorben). Di sisi lain adanya rongga-rongga yang terisi ion-ion logam (kation) seperti kalium dan natrium menyebabkan zeolit Y dapat digunakan sebagai penukar ion dan saringan molekuler. Struktur zeolit Y juga memiliki sifat asam Brönsted dan asam Lewis, sehingga zeolit Y dapat digunakan sebagai pengemban logam katalis. Logam dapat menempel pada seluruh permukaan zeolit Y, baik permukaan luar maupun yang di dalam pori (Syarifah, 2000).
Struktur zeolit Y tersebut dapat diketahui dengan beberapa instrumen, antara lain Difraksi sinar-X (XRD). Metode XRD ini memberikan informasi mengenai perubahan parameter kisi suatu kristal untuk mengetahui karakter zeolit Y baik secara kuantitatif maupun kualitatif, sehingga dapat memberikan gambaran rata-rata struktur sampel. Perubahan panjang kerangka mempengaruhi posisi puncak dalam difaktogram, misalnya penggantian ikatan Al-O (1,69 Å) dengan ikatan yang lebih pendek Si-O (1,61 Å) menyebabkan unit sel mengkerut. Hal ini akan menurunkan nilai d dan menggeser puncak difraksi ke arah 2θ yang lebih tinggi (Hamdan, 1992: 32-33).
Pola difraktogram yang dihasilkan baik secara kuantitatif maupun kualitatif dapat dianalisis dengan menggunakan standar dari JCPDS (Join Committe on
Powder Diffraction Standarts). Analisis kualitatif zeolit Y dilakukan dengan membandingkan sudut 2θ atau d (basal spacing) dengan data standar JCPDS. Difraktogram zeolit Y menunjukkan adanya puncak-puncak yang bersesuaian dengan jarak d dalam mineral faujasit, faujasit-Na dan Zeolit Y. Analisis
kuantitatif dilakukan dengan cara membandingkan intensitas relatif (I/I1)
puncak-puncak difraksi mineral faujasit, faujasit-Na dan Zeolit Y dengan intensitas sampel total zeolit Y. Data standar JCPDS mineral faujasit, faujasit-Na dan zeolit Y secara berurutan disajikan pada Gambar Lampiran 11, 12 dan 13.
Zeolit Y mempunyai gugus fungsional yang dapat diketahui dengan instrumen FTIR. Analisis zeolit Y dengan Spektroskopi IR dilakukan pada daerah bilangan 300-1300 cm-1, karena pada daerah tersebut frekuensi vibrasi zeolit Y memberikan informasi mengenai komposisi dan cara setiap tetrahedral SiO4 dan
AlO4 terikat satu sama lain. Analisis zeolit Y dengan spektra IR juga memberikan
informasi mengenai komposisi Si/Al kerangka, perubahan stuktur selama dekomposisi termal serta pergerakan kation selama dehidrasi dan dehidrosilasi (Flanigen, E. M., 1991).
Zeolit Y pada spektra IR terdiri dari dua jenis vibrasi yaitu vibrasi internal, yang terkait dengan vibrasi SiO4 dan AlO4 sebagai unit pembangun kerangka
zeolit Y dan vibrasi eksternal, yang terkait dengan ikatan-ikatan eksternal antar tetrahedral. Sedangkan daerah vibrasi zeolit Y dibagi menjadi lima daerah utama, yang masing-masing terkait dengan jenis yang spesifik dari vibrasi.
a) Rentangan Asimetri (900-1250 cm-1)
Rentangan daerah ini berhubungan dengan rentangan asimetri O-Si-O dan O-Al-O. Rentangan asimetri internal dari unit bangun primer memberikan pita serapan kuat 1020 cm-1. Puncak yang lebar pada 1100 cm-1 disebabkan rentangan asimetri eksternal yang disebabkan ikatan antar tetrahedral.
b) Rentangan Simetri (680-850 cm -1)
Rentang daerah ini berhubungan dengan rentang O-Si-O dan O-Al-O. Vibrasi eksternal pada 700-780 cm-1 pita ini sangat lemah, model rentangan simetri sensitif terhadap perubahan komposisi Si-Al kerangka zeolit Y. Frekuensi
11
akan bergeser ke arah yang lebih rendah dengan meningkatnya jumlah atom tetrahedral alumunium.
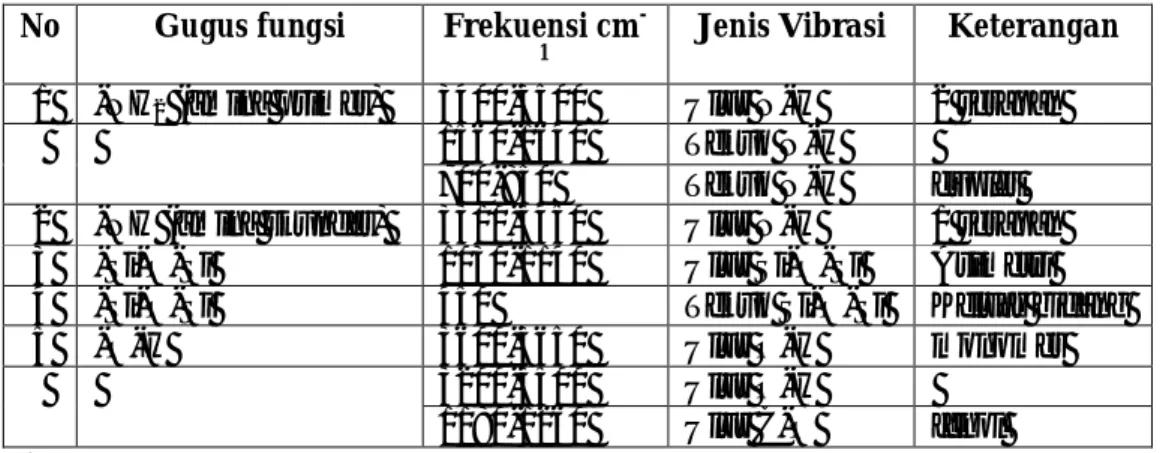
Walaupun spektrum IR suatu molekul poli atom sangat rumit untuk dianalisis dalam setiap absorbsi, gugus fungsional untuk suatu molekul tampak pada daerah-daerah yang cukup spesifik. Pada Tabel 1 dapat dilihat nilai serapan frekuensi IR dari beberapa gugus fungsi.
Tabel 1. Frekuensi IR beberapa gugus-gugus fungsi (±15 cm-1) No Gugus fungsi Frekuensi cm
-1
Jenis Vibrasi Keterangan
1 -NH2 (amina primer) 3400-3500 Ulur N-H 2 serapan
1560-1640 Tekuk N-H
700-850 Tekuk N-H duplet
2 -NH (amina skunder) 3310-3450 Ulur N-H 1 serapan
3 -Si-O-Si 1030-1140 Ulur Si-O-Si Asimetri
4 -Si-O-Si 450 Tekuk Si-O-Si Keluar bidang
5 -O-H 3600-3650 Ulur O-H monomer
3200-3500 Ulur O-H
1180-1260 Ulur C-O fenol
(Silverstein, 1984: 128-134) Besarnya logam katalis yang teremban dalam pengemban zeolit Y dapat dianalisis dengan menggunakan Atomic Absorption Spectroscopy (AAS). Jumlah logam yang dapat diukur dengan AAS ini kurang lebih 60 logam termasuk logam alkali dan alkali tanah. Metode ini memerlukan waktu yang cepat untuk melakukan percobaan (Hendayana, 1994). Zeolit Y mempunyai kandungan logam Si dan Al. Di samping itu terdapat molekul air dan ion-ion yang dapat dipertukarkan seperti Na+, K+, Ca2+, Mg2+, Ba2+, Sr2+ dan Fe3+. Selain itu unsur-unsur yang ditentukan dengan AAS yaitu kandungan logam Ni dan Mo yang terdapat dalam katalis. Setiap unsur logam yang dideteksi menggunakan AAS mempunyai kondisi optimum yang berbeda-beda.
Keasaman merupakan salah satu karakter penting dari suatu padatan yang berfungsi sebagai katalis dalam proses katalitik (Bekkum, et al., 1991). Penentuan keasaman padatan atau katalis dapat dilakukan secara gravimetri yaitu dengan menimbang padatan sebelum dan sesudah mengadsorpsi basa. Basa yang sering
digunakan sebagai zat teradsorpsi adalah quinolin, piridin, piperidin, trimetilamin, n-butilamin, pirol, dan amonia. Menurut hasil penelitian yang dilakukan oleh Yin dkk (1999) melaporkan bahwa NH3 dapat digunakan sebagai molekul uji
keasaman suatu padatan, dimana basa organik teradsorpsi pada padatan yang terjadi melalui transfer pasangan elektron dari molekul adsorbat ke situs asam Lewis (Satterfield, 1980). Jumlah basa yang teradsopsi secara kimia pada permukaan padatan merupakan jumlah gugus aktif pada permukaan padatan tersebut (Trisunaryanti, 1986). Jumlah basa yang teradsorpsi secara kimia pada permukaan padatan menunjukkan banyaknya gugus asam aktif pada permukaan padatan.
Analisis luas permukaan spesifik, volume total pori dan rerata jari pori dilakukan dengan metode yang dikembangkan oleh Brunauer, Emmet dan Teller (BET) didasarkan pada fenomena adsorpsi gas lapis tipis tunggal yang berlangsung pada temperatur tetap (Augustine, 1996). Instrumen yang digunakan adalah Surface Area Analyzer NOVA-1000. Penentuan luas permukaan spesifik juga dapat ditentukan dengan metode adsorpsi methylen blue. Luas permukaan spesifik ditentukan oleh banyaknya methylen blue yang dapat diserap oleh katalis, pengukurannya dengan menggunakan absorbansi yang diperoleh setelah methylen blue diadsorp oleh katalis pada kurun waktu tertentu.
1.2. Fungsi Zeolit Y Dalam Katalis
Fungsi zeolit Y dalam katalis didasarkan pada komposisi zeolit Y, struktur zeolit Y dan zeolit Y sebagai katalis perengkah (Oudejans, 1984).
1) Komposisi Zeolit Y
Komposisi zeolit Y akan mempengaruhi kemampuan dan stabilitasnya dalam reaksi katalisis. Zeolit Y merupakan zeolit bersilika tinggi dengan rasio Si/Al antara 2 sampai 5. Kenaikan rasio Si/Al pada zeolit Y akan mempengaruhi:
a) Stabilitas zeolit Y pada temperatur yang tinggi dan lingkungan yang reaktif, seperti kenaikan keasaman.
b) Perubahan medan elektrostatik dalam zeolit Y yang mempengaruhi interaksi adsorptif dengan molekul lain.
13
c) Kekuatan asam pada sisi asam Brönsted akan bertambah dengan naiknya rasio Si/Al. Kenaikan kekuatan asam ini disebabkan oleh posisi –Al-O-H yang lebih terisolasi pada zeolit Y yang berasio Si/Al lebih tinggi. 2) Struktur Zeolit Y
Secara umum sistem rongga zeolit Y terdiri dari: a) Saluran ke berbagai arah yang saling berhubungan.
b) Lubang atau rongga yang saling dihubungkan oleh celah oksigan.
Kedua sistem rongga tersebut mempengaruhi sifat adsorpsi zeolit Y terhadap reaktan, keadaan transisi maupun produk katalitik. Faktor geometrik umumnya dikatakan sebagai faktor utama yang mempengaruhi selektivitas bentuk molekul dalam zeolit Y (Syarifah, 2000).
3) Zeolit Y Sebagai Katalis Perengkahan
Penggunaan zeolit Y yang pertama pada tahun 1959, yaitu ketika zeolit Y digunakan oleh Union Karbida. Penggunaan zeolit Y sebagai promotor untuk perengkahan minyak yaitu produksi minyak dari minyak mentah, sangat meningkatkan hasil daya guna dan penghematan baik waktu maupun biaya.
Beberapa karakter penting dari zeolit Y yang dapat menjadikannya sebagai katalis perengkah yang mempunyai aktivitas dan selektifitas tinggi adalah sebagai berikut:
a) Mempunyai Situs Asam Aktif
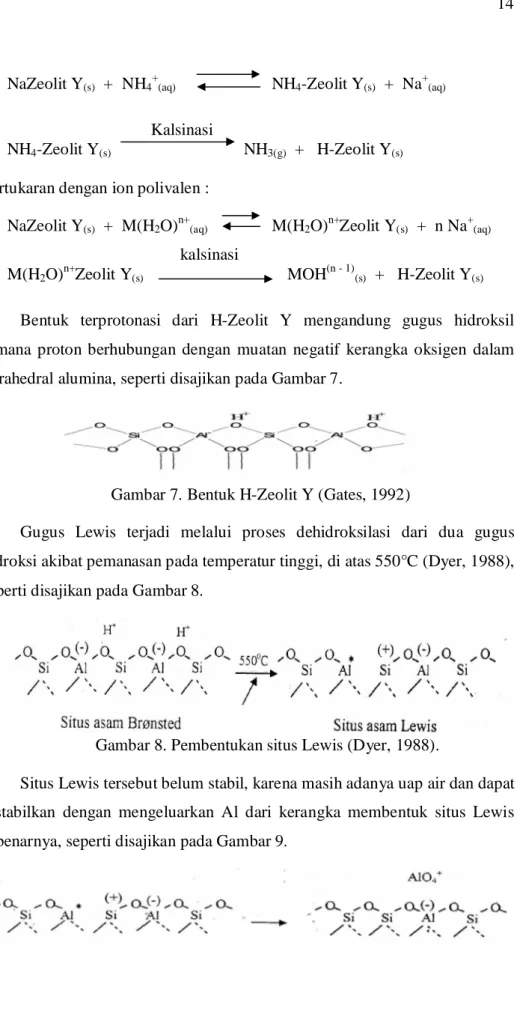
Zeolit Y digunakan secara industri sebagai katalis perengkah didasarkan situs asam Brönsted. Situs asam Brönsted yang berasal dari gugus hidroksil dalam struktur pori zeolit Y menentukan aktivitas zeolit Y sebagai katalis. Gugus hidroksil biasanya dibentuk dengan pertukaran dengan ammonium atau kation polivalen diikuti dengan kalsinasi (Dyer, 1988). Mekanisme pembentukan asam Brönsted melalui pertukaran dengan ammonium atau ion polivalen adalah sebagai berikut :
NaZeolit Y(s) + NH4+(aq) NH4-Zeolit Y(s) + Na+(aq)
Kalsinasi
NH4-Zeolit Y(s) NH3(g) + H-Zeolit Y(s)
Pertukaran dengan ion polivalen :
NaZeolit Y(s) + M(H2O)n+(aq) M(H2O)n+Zeolit Y(s) + n Na+(aq)
kalsinasi
M(H2O)n+Zeolit Y(s) MOH(n - 1)(s) + H-Zeolit Y(s)
Bentuk terprotonasi dari H-Zeolit Y mengandung gugus hidroksil dimana proton berhubungan dengan muatan negatif kerangka oksigen dalam tetrahedral alumina, seperti disajikan pada Gambar 7.
Gambar 7. Bentuk H-Zeolit Y (Gates, 1992)
Gugus Lewis terjadi melalui proses dehidroksilasi dari dua gugus hidroksi akibat pemanasan pada temperatur tinggi, di atas 550°C (Dyer, 1988), seperti disajikan pada Gambar 8.
Gambar 8. Pembentukan situs Lewis (Dyer, 1988).
Situs Lewis tersebut belum stabil, karena masih adanya uap air dan dapat distabilkan dengan mengeluarkan Al dari kerangka membentuk situs Lewis sebenarnya, seperti disajikan pada Gambar 9.
15
Gambar 9. Situs Lewis Sebenarnya (Dyer, 1988) b) Mempunyai selektivitas yang tinggi untuk menghasilkan produk.
Katalis zeolit Y mempunyai selektivitas yang tinggi untuk menghasilkan produk fraksi bensin (gasolin) dari perengkahan fraksi berat minyak bumi. c) Mempunyai struktur kristal yang sangat teratur, ukuran pori yang seragam
mengakibatkan hanya molekul reaktan dengan ukuran yang lebih kecil dari ukuran tertentu dapat bereaksi.
d) Mempunyai kestabilan panas yang tinggi
Zeolit Y mempunyai kestabilan panas yang tinggi, menghasilkan sedikit karbon, sehingga mudah diregenerasi kembali dan mempunyai umur pakai yang panjang.
Beberapa riset telah menunjukkan penggunaan zeolit sebagai pengemban logam transisi. Trisunaryanti dkk (2000) telah melakukan penelitian terhadap zeolit alam dari Tasik Malaya dan Bayah. Zeolit alam tersebut digunakan sebagai pengemban nikel dalam reaksi hidrorengkahan n-heksadekana dan diperoleh konversi tertinggi sebesar 71 %. Penelitian lain dilakukan oleh Nugrahaningtyas (2001), Windarti (2001) dan Nugrahaningtyas (2002) untuk katalis Cr/zeolit alam Wonosari yang memberikan hasil bahwa katalis tersebut dapat digunakan untuk proses perengkahan (cracking) minyak bumi, biofuel maupun tir batubara menjai fraksi bensin.
Zeolit Y sebagai katalis mempunyai keunggulan karena struktur kristal yang sangat teratur, ukuran pori yang seragam dan adanya gugus hidroksil yang sangat asam yang merupakan situs aktif dalam katalisis. Penggunaan zeolit Y sebagai katalis perengkahan mempunyai beberapa keuntungan antara lain, aktivitas katalis yang tinggi, mampu menghasilkan bensin lebih banyak dan lebih stabil pada suhu yang tinggi. Pengaruh suhu terhadap kestabilan zeolit alam dan zeolit alam aktif asal Wonosari telah dipelajari oleh Wibowo (2004). Hasil penelitian menunjukkan bahwa zeolit alam dan zeolit alam aktif stabil sampai suhu 800°C dan pada suhu 500°C memberikan aktivitas yang paling baik (Maryani, 2005). Peningkatan daya guna zeolit khususnya zeolit Y dapat dilakukan salah satunya sebagai pengemban katalis logam yang banyak dibutuhkan oleh kalangan industri.
2. Logam Ni dan Mo Sebagai Katalis
Logam-logam Ni dan Mo di dalam reaksi katalisis mempunyai salah satu fungsi penting untuk mengatomkan atau mengaktifkan molekul-molekul diatomik atau poliatomik dan kemudian memberikan atom-atom atau molekul-molekul aktif tersebut ke molekul reaktan yang lain.
Kemampuan logam Ni dan Mo dalam mengkatalisis reaksi sangat berkaitan dengan keberadaan elekton pada orbital d yang berbaur dengan keadaan elektronik orbital s dan p yang terdekat, sehingga timbul keadaan elektronik berenergi rendah dalam jumlah yang besar dan orbital kosong yang sangat ideal untuk reaksi katalis. Situs-situs yang memiliki keadaan elektronik degenerasi dalam jumlah yang besar adalah situs-situs paling aktif dalam pemutusan dan pembentukan ikatan. Keadaan elektronik seperti ini mempunyai muatan, konfigurasi dan spin yang fluktuatif dan hal ini terjadi pada situs-situs logam dengan bilangan koordinasi yang besar (Hegedus, 1987).
Logam Nikel (Ni) merupakan logam transisi golongan VIIIB pada Sistem Periodik Unsur (SPU), dengan orbital 3d yang belum penuh. Karena distribusi elektron pada orbital-orbital atom nikel harus mengikuti aturan Hund, maka terdapat elektron yang tidak berpasangan dalam orbital d. Berdasarkan sifat-sifat logam nikel tersebut, sehingga sebagai komponen aktif sistem katalis, nikel sangat efektif dalam menjamin keberhasilan reaksi katalitik. Penggunaan secara luas sebagai katalis hidrorengkah pada temperatur dan tekanan rendah membuat nikel menjadi salah satu dari beberapa katalis yang biasa digunakan (Augustine, 1996). Logam Ni dalam sistem periodik unsur mempunyai nomor atom 28 dan mempunyai elektron terluar pada orbital d dengan kofigurasi elektron [Ar] 3d8 4s2.
Logam nikel mudah membentuk ikatan kovalen koordinat, maka pembentukan intermediet pada permukaan katalis menjadi lebih mudah. Logam nikel mempunyai valensi dua membentuk dua macam bentuk kompleks utama. Umumnya adalah kompleks spin bebas (ion atom orbital terluar) logam dengan ligan H2O dan NH3 membentuk kompleks seperti Ni(H2O)62+ dan Ni(NH3)66+.
17
Pada kenyataannya Ni(NH3)66+ biasanya dibuat dengan mereaksikan
Ni(NO3)2.6H2O dengan persamaan:
Ni(NO3)2.6H2O + 6NH4OH → Ni(NH3)62+(NO3)2 + 12H2O
Fenomena seperti ini terjadi karena kemampuan komponen aktif logam pada permukaan katalis untuk mengadsorpsi reaktan yang telah terdifusi pada permukaan katalis. Kemampuan mengadsorpsi ini berkaitan dengan adanya karakteristik orbital d yang memiliki elektron tidak berpasangan atau orbital yang belum penuh.
Pada mekanisme reaksi yang menggunakan katalis padatan, terjadi adsorpsi molekul-molekul reaktan pada permukaan padatan logam yang memiliki elektron yang tidak berpasangan pada orbital d merupakan dasar yang tepat dalam aksi katalitik permukaan logam (Champbell, 1988).
Penempatan komponen aktif logam ke dalam sistem pori pengemban dengan menggunakan garam-garam logamnya, seperti garam klorida, sulfat, nitrat atau oksalat, dan untuk logam nikel biasanya digunakan garam nitratnya yaitu Ni(NO3)2.6H2O.
Selain logam nikel, logam transisi lainya yang biasa digunakan sebagai katalis adalah Molibdenum (Mo). Mo merupakan unsur transisi golongan VIB. Mo merupakan logam yang relatif inert atau sedikit bereaksi dengan larutan asam dan alkali. Logam ini memiliki titik leleh 2610°C dengan tingkat oksidasi -2, -1, 0, 1, 2, 3, 4, 5 dan 6. Molibdenum mempunyai konfigurasi elektron [Kr] 4d5 5s1.
Konfigurasi elektron logam molibdenum menunjukkan adanya orbital 4d setengah penuh sehingga terdapat elektron-elektron yang belum berpasangan. Pengembanan logam molibdenum ke dalam sistem pori pengemban biasanya menggunakan garam amoniumnya yaitu (NH4)6Mo7O24.4H2O (Li, D.; Xu,
Huifang; George D.G., Jr., 1999). Molibdenum yang digunakan dalam reaksi katalitik, umumnya digunakan dalam bentuk logam murni, atau dikombinasikan dengan logam lain dan pengemban. Kombinasi logam yang sering digunakan dalam preparasi katalis adalah dengan nikel.
Logam-logam transisi (Ni dan Mo) sangat aktif untuk katalisis, tetapi dalam keadaan murni diperlukan biaya yang sangat tinggi untuk mendapatkan luas
permukaan dan volume yang besar. Cara yang mudah untuk mendapatkan katalis yang mempunyai luas permukaan komponen aktif yang luas dan mudah dalam pemakaiannya adalah dengan mendispersikan komponen aktif pada pengemban. Cara ini dapat menghasilkan katalis dengan efisiensi yang tinggi, luas permukaan spesifik logam maksimum, menaikkan stabilitas termal sehingga waktu hidup katalis menjadi lebih lama dan menghasilkan katalis yang mudah diregenerasi (Triyono, 1994).
Pemilihan pengemban merupakan langkah awal yang sangat penting dalam proses pembuatan katalis logam-pengemban. Pengemban akan menentukan luas permukaan, porositas, stabilitas, aktivitas dan selektivitas katalis (Triyono, 1994).
3. Katalis Logam-Pengemban a. Metode Pengembanan Logam Ni dan Mo pada Zeolit Y
Ada beberapa macam metode preparasi untuk menempatkan komponen aktif logam Ni dan Mo ke dalam pengemban Zeolit Y. Moss mengelompokkan metode preparasi menjadi 4 macam yaitu metode impregnasi -yaitu memasukkan katalis logam secara paksa ke dalam rongga-rongga pengemban-, pertukaran ion, kopresipitasi, dan deposisi (Anderson, 1976). Dari keempat metode tersebut yang paling umum digunakan adalah impregnasi.
Beberapa penelitian telah mempelajari penggunaan metode pengembanan logam Ni dan Mo ke dalam pengemban zeolit, salah satunya oleh Maryani (2005) yang telah melakukan penelitian tentang perbandingan efektivitas metode koimpregnasi dengan metode impregnasi terpisah. Hasil penelitian menunjukkan bahwa pada pembuatan katalis bimetal dengan metode impregnasi terpisah mempunyai efektivitas yang lebih baik daripada pembuatan katalis dengan metode koimpregnasi.
Impregnasi merupakan prosedur yang umum untuk membuat katalis dengan dua logam pengemban (bimetal). Katalis bimetal dapat dibuat dengan cara kedua garam logam dimasukkan dalam waktu yang sama (koimpregnasi) atau dengan cara garam logam pertama dimasukkan kemudian diikuti garam logam kedua
19
(impregnasi terpisah). Dalam koimpregnasi, letak dan sifat logam dalam pengemban tergantung pada jenis garam prekursor yang digunakan dan kecenderungan untuk membentuk paduan dua komponen (Augustin, 1996). Sedangkan dalam impregnasi terpisah diharapkan logam dapat terdispersi secara merata karena tidak adanya kompetisi antara logam untuk masuk dalam pengemban.
b. Aktivasi Katalis
Tahap aktivasi yang meliputi pengeringan, kalsinasi, oksidasi, dan reduksi digunakan untuk meratakan distribusi logam dalam pengembanan. Pengeringan bertujuan untuk menghilangkan pelarut yang digunakan dengan perlakuan termal.
Kalsinasi merupakan perlakuan panas pada suhu yang relatif tinggi di dalam furnace (Hamdan, 1992). Kalsinasi bertujuan untuk menghilangkan pengotor-pengotor organik, menguraikan senyawa logam serta memperbesar struktur permukaan pengemban. Kalsinasi mempengaruhi mobilitas logam dalam pengemban dan interaksi antar logam dan pengemban. Aliran gas inert seperti gas nitrogen diperlukan untuk memperoleh mobilitas logam yang merata di setiap struktur permukaan katalis. Menurut Augustine (1996), kalsinasi yang dilakukan sebelum reduksi akan memberikan logam yang lebih terdispersi daripada direduksi secara langsung.
Oksidasi bertujuan untuk merubah garam prekursor yamg mungkin masih tersisa pada proses kalsinasi diubah menjadi bentuk oksida. Oksidasi juga diperlukan agar komponen aktif logam membentuk oksida sehungga terdistribusi lebih baik dalam pengembanan. Proses oksidasi dilakukan menggunakan aliran gas oksigen pada temperatur dan waktu tertentu.
Reduksi merupakan proses aktivasi yang terakhir dengan menggunakan gas hidrogen pada temperatur 400-600°C, untuk mengubah senyawa logam atau oksidanya menjadi logam (bilangan oksidasi = 0) sebagai situs asam Lewis. Reduksi diperlukan karena senyawa logam yang terdapat dalam pengembanan merupakan oksida yang terbentuk dari garam logam selama tahap kalsinasi atau berupa garam itu sendiri. Proses reduksi berlangsung seperti pada reaksi berikut:
MO(s) + H2(g) → M(s) + H2O
Dimana: M = Logam
(Augustine, 1996) c. Katalis Bimetal Ni dan Mo
Sistem bimetal (dua logam) yang diembankan pada suatu bahan pengemban, biasanya berupa paduan logam atau senyawa interlogam dari dua logam aktif katalitik atau salah satu diantaranya. Hasil sintesis katalis bimetal dimungkinkan akan terjadi salah satu dari dua bentuk yaitu alloy atau cluster bimetal. Terbentuknya alloy atau cluster bimetal tergantung pada kekuatan interaksi antara kedua logam. Kedua logam yang berinteraksi cukup kuat akan membentuk alloy, sedangkan kedua logam yang tidak berinteraksi akan membentuk cluster bimetal. Atom-atom kedua logam dalam cluster bimetal terdistribusi sangat baik pada pengemban (Anderson and Boundart, 1981).
Katalis campuran logam dapat menunjukkan reaktivitas dan selektivitas yang lebih besar daripada katalis logam tersebut digunakan sendiri-sendiri. Kehadiran logam kedua mempunyai pengaruh yang kuat pada aktivitas reaksi. Terdapat hasil penelitian yang menunjukkan bahwa aktivitas maksimal yang dapat dicapai oleh katalis bimetal lebih tinggi dari pada katalis monometal, antara lain adalah penelitian oleh Siswodiharjo (2006) menunjukkan bahwa katalis bimetal NiMo/Zeolit alam aktif memiliki efektivitas katalis yang lebih baik daripada katalis monometalnya Ni/Zeolit dan Mo/Zeolit pada reaksi hidrorengkah terhadap parafin.
Penggabungan kedua logam memberikan efek sinergis dan mempunyai aktivitas hidrodesulfurisasi yang tinggi, hal tersebut ditunjukkan adanya penelitian yang telah dilakukan oleh Li dkk (1999) tentang aktivitas katalitik sulfida Ni-Mo dengan variasi pengemban ultra stable Y zeolit (USY), NaY zeolit, modernit dan ZSM-5. Katalis Ni-Mo/zeolit tersebut digunakan untuk proses hidrodesulfurisasi. Efektivitas katalis yang tertinggi dihasilkan oleh katalis NiMo/USY. Aktivitas katalitik katalis sulfida Ni(Co)Mo/zeolit juga telah dipelajari untuk beberapa reaksi antara lain hidrorengkah n-heptana, alkana dan n-dekana. Di samping itu
21
juga untuk hidrodesulfurisasi thiophena, etil benzena dan hidrogenasi benzena. Efek sinergis diperoleh untuk rasio Ni/(Ni+Mo) sekitar 0,4-0,5.
B. Kerangka Pemikiran
Zeolit Y mempunyai sifat-sifat kimia penting yaitu memiliki stabilitas termal dan tingkat dispersi yang tinggi serta mampu menstabilkan logam untuk membentuk katalis bifungsional, yang mempunyai situs yang bersifat asam sekaligus logam yang mampu memberikan aktivitas hidrogenasi. Kemampuan zeolit Y sebagai pengemban logam Ni dan Mo untuk menghasilkan katalis logam-pengemban bimetal terhadap karakter katalis dipengaruhi oleh jumlah katalis, ukuran katalis, temperatur sistem, gas yang digunakan, tekanan dan konsentrasi berat logam teremban. Konsentrasi logam prekursor yang terlalu kecil menyebabkan logam yang teremban sedikit, namun konsentrasi yang terlalu besar menyebabkan jumlah logam di sekitar pori pengemban melimpah (bulk), sehingga akan menyebabkan terjadinya penumpukan logam. Oleh karena itu pada penelitian ini dilakukan variasi konsentrasi prekursor logam Ni dengan logam Mo tetap untuk mengetahui rasio konsentrasi prekursor logam Ni dan Mo pada zeolit Y. Efek sinergis diperoleh untuk rasio Ni/(Ni+Mo) sekitar 0,4-0,5.
Pengembanan logam Ni dan Mo pada zeolit Y dapat dilakukan dengan metode koimpregnasi dan impregnasi terpisah. Pengembanan logam Ni dan Mo dengan metode koimpregnasi memungkinkan terjadinya kompetisi antara prekursor Ni dan prekursor Mo ketika masuk ke dalam pori zeolit Y, akibatnya jumlah logam yang teremban pada zeolit Y lebih sedikit dan tidak terdispersi secara merata. Akan tetapi, pengembanan logam Ni dan Mo dengan metode impregnasi terpisah memungkinkan tidak terjadinya kompetisi antara prekursor Ni dan prekursor Mo dan logam yang teremban pada zeolit Y dapat terdispersi secara merata, sehingga karakter katalis yang dihasilkan lebih baik daripada katalis yang dibuat dengan metode koimpregnasi. Perbedaan urutan pengembanan logam Ni dan Mo pada zeolit Y juga dapat menghasilkan katalis dengan karakter yang berbeda. Hal tersebut dipengaruhi oleh ukuran logam Ni dan logam Mo yang
diembankan dalam zeolit Y. Logam Ni dan Mo yang teremban pada zeolit Y dalam bentuk oksidanya yaitu NiO dan MoO3, sehingga oksida MoO3 mempunyai
ukuran yang lebih besar daripada oksida NiO. Pengembanan dengan menempatkan prekursor Mo dalam zeolit Y lebih dulu akan menghasilkan jumlah logam Ni dan Mo lebih banyak daripada pengembanan dengan menempatkan prekursor lebih dulu. Hal tersebut karena logam Ni (NiO) yang berukuran lebih kecil bila diembankan diakhir dapat masuk melalui celah-celah antara logam Mo (MoO3), sehingga kemungkinan terjadi sintering (penumpukan) logam relatif
kecil.
C. Hipotesis
Dari kerangka pemikiran dan masalah yang ada, maka dapat diambil hipotesis penelitian sebagai berikut:
1. Konsentrasi prekursor logam Ni (NiO) dan logam Mo (MoO3) yang
diembankan pada zeolit Y akan mencapai optimum pada rasio antara 2% (b/b) sampai 8% (b/b).
2. Metode penggembanan logam Ni dan Mo secara impregnasi terpisah lebih efektif daripada metode koimpregnasi.
3. Urutan pengembanan logam Mo terlebih dahulu dikuti logam Ni mempunyai karakter yang paling baik.
23 BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Metode penelitian yang digunakan adalah metode eksperimen di laboratorium. Eksperimen dilakukan dalam tiga tahap. Tahap I meliputi preparasi, identifikasi, dan karakterisasi zeolit Y awal. Tahap II adalah sintesis katalis dengan metode koimpregnasi, yaitu pembuatan katalis bimetal dengan mengembankan logam Ni (NiO) dan Mo (MoO3) secara bersama-sama pada
H-Zeolit Y yang diperoleh pada tahap I. Tahap III adalah sintesis katalis dengan metode impregnasi terpisah, yaitu pembuatan katalis bimetal dengan mengembankan logam Ni (NiO) dan Mo (MoO3) pada H-Zeolit Y yang diperoleh
pada tahap I secara berurutan dengan variasi urutan pengembanan logam Ni (NiO) dan Mo (MoO3). Prosedur yang dilakukan pada ketiga tahap tersebut mengacu
pada penelitian Li, dkk (1999) dan penelitian Maryani (2005). Karakterisasi katalis meliputi: kandungan logam Ni (NiO) dan Mo (MoO3), keasaman total, luas
permukaan, dan kandungan mineral, sebagai data penunjang digunakan analisis Spektroskopi Inframerah, Surface Area Analyzer (SAA) untuk identifikasi zeolit Y awal.
B. Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Laboratorium Pusat MIPA UNS Sub Laboratorium Kimia dan Laboratorium Kimia Dasar MIPA UNS, yang dilakukan mulai bulan Februari sampai Oktober 2007.
C. Alat dan Bahan 1. Alat
Alat-alat yang digunakan dalam penelitian ini adalah : a. Seperangkat alat refluks
b. Neraca analitik Sartorius A6 Gottingen c. Furnace type KB 62 C frame 60 A d. Desikator
e. Cawan Porselin
f. Oven Yamato model DPA.30 g. Spatula
h. Termometer 100°C i. Termocouple
j. Pengukur laju alir gas (flowmeter) k. Seperangkat alat gelas
l. Pemanas listrik
m. Reaktor kalsinasi, oksidasi dan reduksi n. Surface Area Analyzer (SAA) NOVA Ver 20 o. X-Ray Diffractometer (XRD)-6000 3 kW Shimadzu p. Spektrofotometer FTIR Shimidzu 8201 PC
q. Spectrophotometer
r. Atomic Absorption Spectroscopy (AAS) 2. Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah : a. Akuades (Sub Lab Biologi Lingkungan UNS)
b. NH4-Zeolit Y yang berasal dari Tosoh Corporation, Jepang
c. Amonium heptamolybdat tetrahidrat [(NH4)6Mo7O24.4H2O] p.a E. Merck.
d. Nickel (II) nitrat hexahidrat [Ni(NO3)2.6H2O] p.a E. Merck.
e. NH3 p.a E. Merck.
f. Kertas saring Whatman 42
g. Gas N2, O2, H2 dari PT Samator, Surabaya
h. Glasswool
D. Prosedur Penelitian
1. Preparasi, Identifikasi dan Karakterisasi NH4-Zeolit Y
Sampel yang digunakan dalam penelitian ini adalah NH4-Zeolit Y yang
berasal dari Tosoh Corporation, Jepang. Preparasi dilakukan dengan tujuan untuk mengubah sampel NH4-zeolit Y menjadi H-zeolit Y melalui proses kalsinasi,
25
yaitu dengan memanaskan NH4-zeolit Y pada temperatur 550°C selama 1 jam di
dalam furnace dan dilanjutkan dengan identifikasi dan karakterisasi. Karakterisasi dilakukan dengan X-Ray Diffraction (XRD), Fourier Transform Infra Red (FTIR), Atomic Absorption Spectrocopy (AAS), metode sorpsi amonia, metode sorpsi methylen blue dan Surface Area Analyzer (SAA).
2. Pembuatan dan Karakterisasi Katalis Bimetal a. Metode Koimpregnasi
H-Zeolit Y sebanyak 10 gram direndam dalam larutan nikel (II) nitrat hexahidrat [Ni(NO3)2.6H2O] dengan variasi konsentrasi masing-masing 2%, 4%,
6% dan 8% (b/b) dan larutan garam ammonium heptamolybdat tetrahidrat [(NH4)6Mo7O24.4H2O] dengan konsentrasi masing-masing sama yaitu 8% (b/b),
dengan volume akuades 15 ml dan volume ammonia 6 ml, sehingga volume total 21 ml. Sampel tersebut direfluks pada temperatur 60°C selama 2 jam. Sampel kemudian disaring dan residu dikeringkan menggunakan vacum evaporatory pada tekanan 72 mbarr dan temperatur 85°C sampai sampel kering dan menjadi serbuk. Sampel serbuk yang telah kering tersebut kemudian dikalsinasi dengan dialiri gas N2 pada temperatur 550°C selama 3 jam, dengan rangkaian reaktor
ditunjukkan pada Gambar 10. Hasil kalsinasi dioksidasi dengan dialiri gas O2
pada temperatur 400°C selama 2 jam, kemudian direduksi dengan dialiri gas H2
pada temperatur 400°C selama 2 jam. Rangkaian reaktor oksidasi maupun reduksi sama dengan rangkaian reaktor kalsinasi hanya merubah gas yang digunakan. Katalis yang dihasilkan pada tahap ini disebut NiMo 2%/Zeolit Y (konsentrasi logam Ni2% (b/b) dan Mo8% (b/b)), NiMo 4%/Zeolit Y (konsentrasi logam Ni4% (b/b) dan Mo8% (b/b)), NiMo 6%/Zeolit Y (konsentrasi logam Ni6% (b/b) dan Mo8% (b/b)) dan NiMo 8%/Zeolit Y (konsentrasi Ni8% (b/b) dan Mo8% (b/b)).
Katalis yang dihasilkan tersebut kemudian dikarakterisasi dengan X-Ray Diffraction (XRD), Atomic Absorption Spectrocopy (AAS), metode sorpsi amonia, dan metode sorpsi methylen blue, (khusus untuk AAS dilakukan hanya untuk tiga katalis yang optimum).
b. Metode Impregnasi Terpisah
1. Pembuatan Katalis NiMo/Zeolit Y
H-Zeolit Y sebanyak 10 gram direndam dalam 10 ml larutan Nikel (II) Nitrat hexahidrat [Ni(NO3)2.6H2O], dengan variasi konsentrasi masing-masing
2%, 4%, 6% dan 8% (b/b) dan ditambahkan dengan 3 ml ammonia, direfluks pada temperatur 60°C selama 2 jam. Setelah 2 jam, sampel ditambah dengan 5 ml larutan garam ammonium heptamolybdat tetrahidrat [(NH4)6Mo7O24.4H2O]
dengan konsentrasi masing-masing sama yaitu 2%, kemudian direfluks pada temperatur 60°C selama 2 jam. Sampel kemudian disaring dan residu dikeringkan menggunakan vacum evaporatory pada tekanan 72 mbarr dan temperatur 85°C sampai sampel kering dan menjadi serbuk.
Sampel serbuk yang telah kering tersebut kemudian dikalsinasi dengan dialiri gas N2 pada temperatur 550°C selama 3 jam, dengan rangkaian reaktor
disajikan pada Gambar 10. Hasil kalsinasi dioksidasi dengan dialiri gas O2 pada
temperatur 400°C selama 2 jam, kemudian direduksi dengan dialiri gas H2 pada
temperatur 400°C selama 2 jam. Rangkaian reaktor oksidasi maupun reduksi sama dengan rangkaian reaktor kalsinasi hanya merubah gas yang digunakan. Katalis yang dihasilkan pada tahap ini disebut Ni2%Mo/Zeolit Y (konsentrasi logam Ni2% dan Mo8%), Ni4%Mo/ Zeolit Y (konsentrasi logam Ni4% (b/b) dan Mo8% (b/b)), Ni6%Mo/Zeolit Y (konsentrasi logam Ni6% (b/b) dan Mo8% (b/b)) dan Ni8%Mo/Zeolit Y (konsentrasi logam Ni8% (b/b) dan Mo8% (b/b)).
Keterangan gambar: 1. Tabung gas 2. Regulator gas 3. Flowmeter
4. Reaktor kalsinasi, oksidasi dan reduksi 5. Furnace 6. Regulator listrik 1 1 3 2 4 5 6 1 2 3 4 5 6