DAFTAR PUSTAKA
Anonim. 2007. Kajian Pasar dan Poduk Hilir Kelapa Sawit. http://209.85.175.104/search?q=cache:NoBsfQhi4v0J:seafast.ipb.ac.id/se afast.info/ 20 Agustus 2007.
Anwar, K. 2008. Optimasi Suhu dan Konsentrasi Sodium Bisulfit (NaHSO3) pada Proses Pembuatan Sodium Lignosulfonat Berbasis Tandan Kosong Kelapa Sawit (TKKS). Fakultas Teknologi Pertanian, IPB.
APCC (Asian Pacific Coconut Community). 2007. Peta Potensi Dunia Kelapa dan Sebaran Potensi Kelapa di Indonesia. Jakarta.
Balzer, D. and Luders, H., 2000. Nonionik Surfactant Alkyl Polyglucosides. Marcell Dekker Inc. New York Basel.
Bodner, G. M, dan Pardue, H. L. 1989. Chemistry An Experimental Science. John Willey and sons. Inc., New York.
BPS. 2006. Statistik Perdagangan Luar Negeri Indonesia. Badan Pusat Statistik, Jakarta
Bujang, K. dan Ahmad, F.B. 2000. Production and Utilization in Malaysia. Dalam : Sagu Untuk Ketahanan Pangan. Prosiding Seminar Nasional Sagu; Manado, 6 Oktober 2003. manado. Pusat Penelitian dan pengembangan Perkebunan manado. Halaman 16-19.
Cremlyn, R. J. 1991. Agrochemicals: Preparation and Mode of Action. John & Wiley Sons. New York. 369p.
Darto. 2008. Aplikasi Alkyl Polyglycoside (Apg) Berbasis Fatty Alcohol Minyak Kelapa Dan Pati Sagu Sebagai Surfaktan Dalam Formulasi Herbisida. Fakultas Teknologi Pertanian. IPB Bogor
Faber, R.D. 2002. Patens: Hard Surface Cleaner Containing Alkyl Polyglycosides. Dalam www.uspot.gov. 12 Februari 2007.
Flider, F.J. 2001. Commercial Consideration and Markets for Naturally Derived Biodegradable Surfactant. Inform 12(12):1161-1164.
Gibson, M.W., dan Leedy, C 2001. Patens: Process for Reducing Cycle Times in Reaction During The Production of Alkyl Polylicosides. Dalam www.uspto.gov. 12 Februari 2007.
Giribabu, K dan Ghosh, P. 2007. Adsorption of Non ionik Surfactants at Fluid-Fluid Interfaces: Importance in the Coalescence of Bubbles and drops. Chemical Engineering Science 62; 3057-3067.
Hall, et al. 2000. Sustainable Surfactant: Renewable Feedstocks for The 21st Century Fat and Oil as Oleochemical Raw Material. Dalam http://www.nf.org. 12 Maret 2007.
Harmita. 2006. Analisis Fisikokimia. Departemen Farmasi FMIPA, Universitas Indonesia.
Hart. 2003. Kimia Organik. Suatu Kuliah Singkat Edisi ke-11. Erlangga, Jakarta Haryadi. 2004. Kembangkan Sagu untuk Tekan Impor Beras dalam Jangka
Panjang. Pidato ilmiah pengukuhan Guru Besar Fakultas Teknologi Pertanian Universitas Gadjah Mada (UGM) Yogyakarta,
Herliana, E. 2005. Fraksinasi Pati Sagu (Metroxylon sp.) dengan Metode Pelarutan Air Panas. Fateta IPB. Bogor.
Hill, K., M. Biermann., Rossmaier, H., Eskuchen, R., Wuest, W., Wollmann, J., Bruns, B., Hellmann, G., Ott, K., Winkle, W., dan Wollmann, K. 1996. Patens: Process for Direct Production of Alkyl polyglycosides. Dalam www.uspto.gov. 12 Februari 2007.
Hill, K., Von Rybinski and Stoll, W.G. (Eds). 1997. Alkyl Polyglycoside Technology, Properties and Application. Dalam http:/www.scf-online.com. 12 Februari 2007.
Hill, K. 2000. Fats and Oil as Oleochemical Raw Material. Dalam Pure Appl.Chem Vol. 72, No. 7, pp. 1255-1264,. Cognis D GmbH, Germany Holmberg, K., Kronberg, B., dan Lindman, B. 2003. Surfactant and Polimer in
Aques Solution. Ed ke-2. Chichester: J. Wiley.
Humas. 2006. Sagu, Potensial Perkaya Keragaman Pangan. Dalam www.bbpt.go.id. 12 Maret 2007
Indrawanto, R., 2008. Optimasi Nisbah Mol Glukosa-Fatty Alcohol C12Dan Suhu Asetalisasi Pada Proses Pembuatan Surfaktan Nonionik Alkyl Polyglycosides (APG). Fakultas Teknologi Pertanian. IPB Bogor.
Kadir, M. 2007. Efektivitas Berbagai Dosis Dan Waktu Aplikasi Herbisida 2,4 Dimetilamina Terhadap Gulma Echinocloa Colonum, Echinocloa Cruss-Galli, Dan Cyperus Iria Pada Padi Sawah. Jurnal Agrisistem, Juni 2007, Vol. 3 No. 1 ISSN 1858-4330
Kamel, B. S. 1991. Emulsifier. Di dalam Food Additive User’s Handbook. Smith, Jim (ed). Van Nostrand Reinhoid. NY.
Kuang, D., Obaje, O.J., dan Ali, O.M. 2000. Synthesis and Characterization of Acetylated Glucose Fatty Esters from Palm and Palm Kernel Oil Fatty Methyl Esters. J. of Oil Palm Re 12 (2):14-19.
Limbongan, J. 2007. Morfologi Beberapa Jenis Sagu Potensial Di Papua.
Jurnal Litbang Pertanian, 26(1), 2007.
Margaretha, A. 1999. Synthesis of Fructosa-Based Surfactans. Ph.D dissertation: Technische Universiteit Delft.
McWhorter, C. G. 1990. Adjuvants for Herbicides chapter 2: The use of Adjuvants. Weed science Society of America, Champaign, Illinois.
McCurry, Jr.; Patrick M. Varvil; Janet R. dan Pickens; Carl E. 1996. Patens: “Process for Making Alkyl Glycosides. Dalam www. Uspto.gov, 12 Februari 2007
Metheson. 1996. Surfactant Raw Materials. Clasification, Synthesis, and Uses. In : Soap and Etergen : A Theoretical and Practical Review. Spitz, L.. (Ed). AOCS Press, Champaign, Illinois.
Moechtar. 1989. Farmasi Fisika: Bagian Larutan dan Sistem Dispersi, Gadjah Mada University Press. Yogyakarta.
Muchtadi, T.R. 1990. Emulsi Bahan Pangan. Jurusan Teknologi Pangan dan Gizi, Fateta, IPB, Bogor.
Moenandir, J. 1988. Fisiologi Herbisida (Ilmu Gulma : buku II). Rajawali Pers. Jakarta.
Noor, E. dan Sutisna, N . 1997. Pengendalian Gulma di Lahan Pasang Surut Proyek Penelitian Pengembangan Pertanian Rawa Terpadu-ISDP Badan Penelitian dan Pengembangan Pertanian.
Nurjannah, U. 2003. Pengaruh Dosis Herbisida Glifosat dan 2,4-D terhadap Pergeseran Gulma dan Tanaman Kedelai tanpa Olah Tanah. Program Studi Agronomi. Fakultas Pertanian Universitas Bengkulu. Jurnal Ilmu- Pertanian Indonesia. Vol 5 No. 1 hal. 27-33.
Pomeranz, Y. 1991. Functional Properties of Food Components. Second Edition. Academic Press Inc
Porter, M.R. 1991. Handbook of Surfactant. Chapman & Hall, New York.
Presents, Z. 2000. All About Fatty alkohol. Dalam http://www.condea.org. 12 Maret 2007.
Rieger, M.M. 1985. Surfactant in Cosmetic. Surfactant Science Series. Marcel Dekker Inc., New York. pp 488.
Roshid, I. 2006. Kajian Aplikasi Campuran Herbisida Glifosat dengan Metsulfuron Metil dalam Pengendalian Beberapa Gulma Pertanian. Program Studi Agronomi Fakultas Pertanian, IPB.
Sadi, S. 1994. Gliserolisis Minyak Sawit dan Inti Sawit dengan Piridin. Buletin PPKS 2 (3) : 155 – 164.
Samad, M. Y. 2002. Meningkatkan Produksi Industri Kecil Sagu Melalui Penerapan Teknologi Ekstraksi Semi Mekanis. Jurnal Sains dan Teknologi Indonesia Vol.4, No.5, (Agustus 2002), hal. 11-17 Humas-BPPT/ANY
Sofiyaningsih, N dan Nurcahyani, N. 2006. Esterifikasi Asam Oleat dengan Sorbitol Menggunakan H2SO4 Sebagai Katalisator Melalui Distilasi Reaktif. Pusat Penelitian Kimia LIPI.
Supriatna, D. 2008. Pengaruh Proses Pembuatan Virgin Coconut Oil (VCO) terhadap Aktivitasnya sebagai Penurun Kadar Glukosa Darah pada Tikus Diabetes Melitus. Sekolah Pascasarjana Institut Pertanian Bogor
Statistik Perkebunan Indonesia. 2006. Kelapa (Coconut). Direktorat Jenderal Perkebunan, Departemen Pertanian. Jakarta 2006.
Suryani, A., Sailah, I., dan Hambali, E. 2000. Teknologi Emulsi. Jurusan Teknologi Industri Pertanian-Fateta IPB, Bogor.
Swern, D. 1979. Bailey’s Industrial Oil and fat Products. Vol. 14 th Edition. John Willey and Son Inc., New York.
Tollenean, M., Dibo,A.A., Aguilera,A., Weise,S.F., and Swanron, C.J. 1994. Effect of Crop Density on Weed Inference in Maize. J. Agronomy 86 (4):592-595.
Tominack, R. L. 2000. Herbicide Formulations. J. Toxicol Clin Toxico l38:129– 135.
Tjitrosoedirdjo, S., I. H. Utomo dan J. Wiroatmojo. 1984. Pengelolaan Gulma di Perkebunan. PT. Gramedia. Jakarta.
Utomo, I. H. 1995. Beberapa Hasil Penelitian Pengujian Round Up 75 WSG pada Lahan Alang-alang di Perkebunan. Kumpulan Makalah Peluncuran Produk BaruHerbisida 75 WSG. PT. Monagro Kimia. Bandar Lampung. 8 hal.
Van Valkenburg, J.W. 1990. Terminology, Classificationj and Chemistry. Adjuvan for Hebicides. The Weed Science Society of America 309 West Clark Street Champaign, Illinois 51820.
Wuest, W., Eskuchen,R., Wollman, J., Hill, K., dan Biermann, M. 1992 . Patens: Process for Preparing Alkyl Glucosides Compounds from Oligo-and/or Polysaccharides. dalam www.uspto.gov. 12 Februari 2007.
Wuest, W., Eskuchen, R., Schulz, P., Bauer, V., Carduck, F., Esser, H., Zeise, C., Weuthen, M., dan Penninger, J. 1996. Patens: Process for Bleaching Discolored Surface-Active Alkyl Glycosides and for Working Up The Bleached Material. Dalam www.uspto.gov. 12 Februari 2007.
Wuryaningsih, S.R. 2007. LIPI Manfaatkan Sawit sebagai Pengganti Petrokimia. Pusat Penelitian Kimia LIPI. Jakarta
Lampiran 1. Proses produksi alkil poliglikosida dengan dua tahap
Suhu 140-145oC, 4,3 – 4,7 bar
Katalis asam (asam p-toluene sulfonat)
Suhu 115-1180C, vakum
Didinginkan pada suhu 90oC + MgO s/d pH 8-10 selama 30 menit, tekanan normal
Suhu 160-180 oC tekanan 15 mmHg +Air +H2O2 +NaOH Netralisasi Destilasi
APG Kasar Alkohol lemak
Pemucatan/Bleaching APG Reaktor 2 Transasetalisasi Reaktor 1 Butanolisis Alkohol lemak air + butanol
Air Butanol Pati Sagu
asam p-toluene sulfonat
Lampiran 2. Metode analisa APG
Stabilitas emulsi (Modifikasi ASTM D 1436, 2000)
Stabilitas emulsi diukur diantara air dan xilena. Xilena dan air dicampur dengan perbandingan 6:4. Campuran tersebut dikocok selama 5 menit menggunakan vortex mixer. Pemisahan emulsi antara xilena dan air diukur berdasarkan lamannya pemisahan antar fasa sebelum dan sesudah ditambahkan surfaktan dibandingkan nilainya. Penetapan stabilitas emulsi dengan cara yang sederhana, yaitu dengan cara pengukuran berdasarkan pemisahan dengan asumsi bahwa sistem emulsi yang sempurna bernilai 100.
% stabilitas = (Tinggi keseluruhan-tinggi pemisahan) x 100
Tinggi keseluruhan
Pengukuran tegangan permukaan metode Du Nouy (ASTM D-1331. 2000)
Peralatan dan wadah sampel yang digunakan harus dibersihkan terlebih dahulu dengan larutan asam sulfat-kromat dan dibilas dengan aquades, lalu dikeringkan. Cincin platinum yang digunakan pada alat tensiometer dan mempunyai mean circumferense = 5,945.
Posisi alat diatur agar horizontal dengan menggunakan water pass dan diletakkan pada tempat yang bebas dari gangguan, seperti getaran, angin, sinar matahari dan panas. Larutan surfaktan dengan ragam konsentrasi, dimasukkan ke dalam gelas kimia dan diletakkan di atas dudukan tensiometer. Suhu cairan diukur dan dicatat. Selanjutnya cincin platinum dicelupkan ke dalam sampel tersebut (lingkaran logam tercelup ± 3 mm di bawah permukaan cincin). Skala vernier tensiometer diatur pada posisi nol dan jarum penunjuk harus berada pada posisi terhimpit dengan garis pada kaca. Selanjutnya kawat torsi diputar perlahan-lahan sampai film cairan tepat putus, saat film cairan tepat putus, skala dibaca dan dicatat sebagai nilai tegangan permukaan.
Pengukuran tegangan antar muka (ASTM D-1331. 2000)
Metode menentukan tegangan antar muka hampir sama dengan pengukuran tegangan permukaan. Tegangan antar muka menggunakan dua cairan yang berbeda tingkat kepolarannya, yaitu larutan surfaktan dengan ragam konsentrasi dan xilena (1:1). Larutan surfaktan terlebih dahulu dimasukkan ke dalam wadah sampel, kemudian dicelupkan cincin platinum ke dalamnya (lingkaran logam tercelup ± 3 mm di bawah permukaan cincin). Setelah itu,
secara hati-hati larutan xilena ditambahkan di atas larutan surfaktan sehingga sistem terdiri atas dua lapisan. Kontak antara cincin dan larutan xilena sebelum pengukuran harus dihindari. Setelah tegangan antar muka mencapai equilibrium, yaitu benar-benar terbentuk dua lapisan terpisah yang sangat jelas, pengukuran selanjutnya dilakukan dengan cara yang sama pada pengukuran tegangan permukaan.
Penentuan nilai HLB
Nilai HLB digunakan untuk menentukan sifat kelarutan surfaktan APG di dalam air dan menentukan aplikasi surfaktan berdasarkan nilai HLB yang dimiliki surfaktan APG.
Penentuan nilai HLB (Gupta et al. 1983 dalam Kuang et al. 2000). HLB dari surfaktan APG ditentukan menggunakan metode bilangan air (water number method). Larutan surfaktan APG yang mengandung 1 g surfaktan APG dalam 25 ml campuran piridina dan benzena 95:5 (v/V) dititrasi dengan aquades sampai kekeruhan permanen. Nilai HLB dari sampel surfaktan APG diperoleh dengan interpolasi pada kurva standar HLB.
Tabel 2.1. Pengaruh nilai HLB pada kelarutan surfaktan dalam air.
Kelarutan dalam air Nilai HLB Aplikasi
Tidak mampu terdispersi dalam air
Pengemulsi w/o
Kemampuan mendispersi kurang baik
Dispersi seperti susu;
tidak stabil Wetting agent
Dispersi seperti susu;stabil
Tembus cahaya untuk larutan jernih Larutan jernih 0 2 4 6 8 10 12 14 16 18 Detergent Pengemulsi o/w Solubilizer Sumber: Adamson dalam Indrawanto (2008)
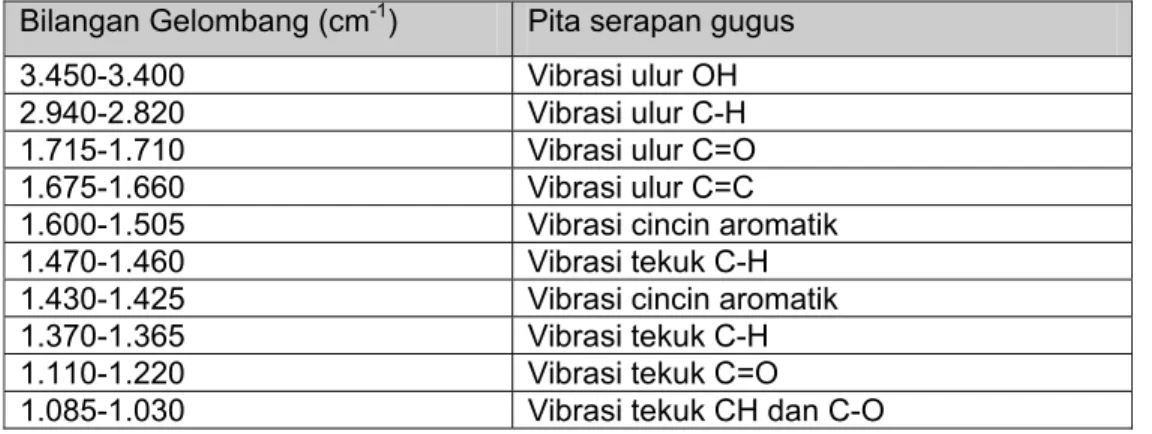
Spektroskopi infra merah
Analisis spektroskopi infra merah memberikan informasi mengenai adanya gugus fungsi yang terdapat dalam molekul. Vibrasi dari setiap gugus fungsi akan muncul pada bilangan gelombang yang berbeda.
Vibrasi ulur OH muncul pada 3.500-3.300 cm-1
Vibrasi ulur C=C cincin benzena pada 1.605,1.495 dan 1.466 cm-1 Vibrasi C=O muncul pada 1740-1675 cm-1 dan 1110-1220 cm-1
Tabel 2. 2. Pita serapan FTIR Bilangan Gelombang (cm-1) Pita serapan gugus
3.450-3.400 Vibrasi ulur OH
2.940-2.820 Vibrasi ulur C-H
1.715-1.710 Vibrasi ulur C=O
1.675-1.660 Vibrasi ulur C=C
1.600-1.505 Vibrasi cincin aromatik
1.470-1.460 Vibrasi tekuk C-H
1.430-1.425 Vibrasi cincin aromatik
1.370-1.365 Vibrasi tekuk C-H
1.110-1.220 Vibrasi tekuk C=O
1.085-1.030 Vibrasi tekuk CH dan C-O
F. Rendemen
Rendemen APG dihitung berdasarkan berat APG yang diperoleh setelah dimurnikan dengan berat total bahan baku awal yang digunakan.
Berat APG murni
Rendemen (%) = x 100 % Berat total bahan baku awal
Lampiran 3. Data proses produksi APG
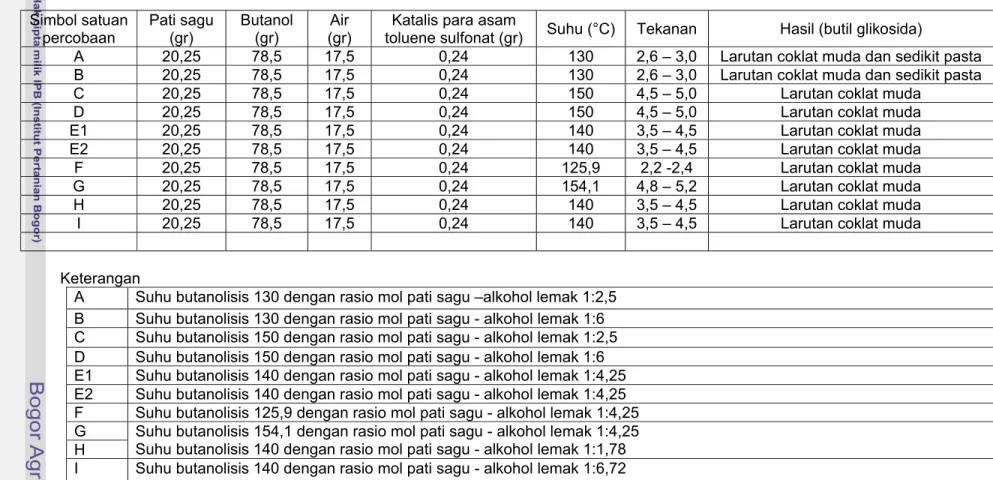
Tabel 3.1. Hasil pengamatan tahapan proses butanolisis Simbol satuan percobaan Pati sagu (gr) Butanol (gr) Air (gr)
Katalis para asam
toluene sulfonat (gr) Suhu (°C) Tekanan Hasil (butil glikosida)
A 20,25 78,5 17,5 0,24 130 2,6 – 3,0 Larutan coklat muda dan sedikit pasta
B 20,25 78,5 17,5 0,24 130 2,6 – 3,0 Larutan coklat muda dan sedikit pasta
C 20,25 78,5 17,5 0,24 150 4,5 – 5,0 Larutan coklat muda
D 20,25 78,5 17,5 0,24 150 4,5 – 5,0 Larutan coklat muda
E1 20,25 78,5 17,5 0,24 140 3,5 – 4,5 Larutan coklat muda
E2 20,25 78,5 17,5 0,24 140 3,5 – 4,5 Larutan coklat muda
F 20,25 78,5 17,5 0,24 125,9 2,2 -2,4 Larutan coklat muda
G 20,25 78,5 17,5 0,24 154,1 4,8 – 5,2 Larutan coklat muda
H 20,25 78,5 17,5 0,24 140 3,5 – 4,5 Larutan coklat muda
I 20,25 78,5 17,5 0,24 140 3,5 – 4,5 Larutan coklat muda
Keterangan
A Suhu butanolisis 130 dengan rasio mol pati sagu –alkohol lemak 1:2,5
B Suhu butanolisis 130 dengan rasio mol pati sagu - alkohol lemak 1:6
C Suhu butanolisis 150 dengan rasio mol pati sagu - alkohol lemak 1:2,5
D Suhu butanolisis 150 dengan rasio mol pati sagu - alkohol lemak 1:6
E1 Suhu butanolisis 140 dengan rasio mol pati sagu - alkohol lemak 1:4,25
E2 Suhu butanolisis 140 dengan rasio mol pati sagu - alkohol lemak 1:4,25
F Suhu butanolisis 125,9 dengan rasio mol pati sagu - alkohol lemak 1:4,25
G H
Suhu butanolisis 154,1 dengan rasio mol pati sagu - alkohol lemak 1:4,25 Suhu butanolisis 140 dengan rasio mol pati sagu - alkohol lemak 1:1,78
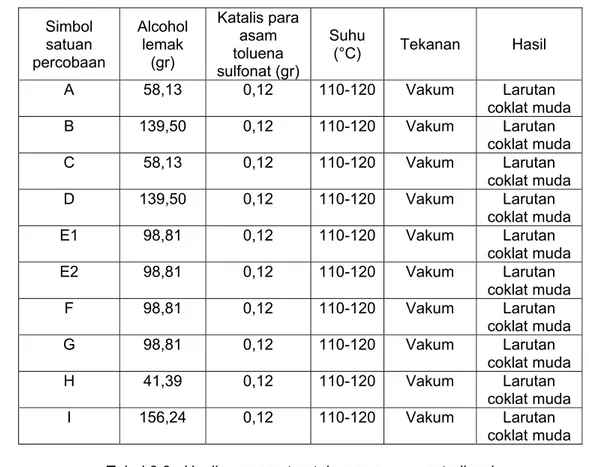
Tabel 3.2 . Hasil pengamatan tahapan proses transasetalisasi Simbol satuan percobaan Alcohol lemak (gr) Katalis para asam toluena sulfonat (gr) Suhu (°C) Tekanan Hasil A 58,13 0,12 110-120 Vakum Larutan coklat muda B 139,50 0,12 110-120 Vakum Larutan coklat muda C 58,13 0,12 110-120 Vakum Larutan coklat muda D 139,50 0,12 110-120 Vakum Larutan coklat muda E1 98,81 0,12 110-120 Vakum Larutan coklat muda E2 98,81 0,12 110-120 Vakum Larutan coklat muda F 98,81 0,12 110-120 Vakum Larutan coklat muda G 98,81 0,12 110-120 Vakum Larutan coklat muda H 41,39 0,12 110-120 Vakum Larutan coklat muda I 156,24 0,12 110-120 Vakum Larutan coklat muda Tabel 3.3 . Hasil pengamatan tahapan proses netralisasi
Netralisasai Simbol satuan percobaan Suhu (0C) (menit)Waktu pH awal NaOH 50% (tetes)
Warna awal akhir pH Warna akhir
A 80-90 30 4 20 Coklat muda 10 Coklat muda B 80-90 30 4 20 Coklat muda 10 Coklat muda C 80-90 30 4 20 Coklat muda 10 Coklat muda D 80-90 30 4 20 Coklat muda 10 Coklat muda E1 80-90 30 4 20 Coklat muda 10 Coklat muda E2 80-90 30 4 20 Coklat muda 10 Coklat muda F 80-90 30 4 20 Coklat muda 10 Coklat muda G 80-90 30 4 20 Coklat muda 10 Coklat muda H 80-90 30 4 20 Coklat muda 10 Coklat muda I 80-90 30 4 20 Coklat muda 10 Coklat muda
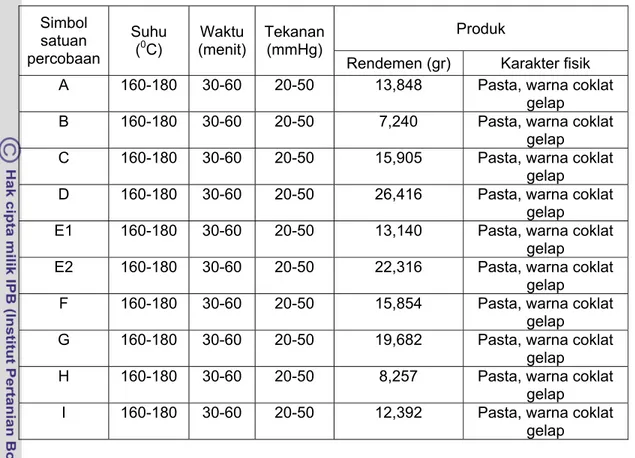
Tabel 3.4. Hasil pengamatan tahapan proses destilasi Produk Simbol satuan percobaan Suhu
(0C) (menit)Waktu Tekanan (mmHg)
Rendemen (gr) Karakter fisik A 160-180 30-60 20-50 13,848 Pasta, warna coklat
gelap B 160-180 30-60 20-50 7,240 Pasta, warna coklat
gelap C 160-180 30-60 20-50 15,905 Pasta, warna coklat
gelap D 160-180 30-60 20-50 26,416 Pasta, warna coklat
gelap E1 160-180 30-60 20-50 13,140 Pasta, warna coklat
gelap E2 160-180 30-60 20-50 22,316 Pasta, warna coklat
gelap F 160-180 30-60 20-50 15,854 Pasta, warna coklat
gelap G 160-180 30-60 20-50 19,682 Pasta, warna coklat
gelap H 160-180 30-60 20-50 8,257 Pasta, warna coklat
gelap I 160-180 30-60 20-50 12,392 Pasta, warna coklat
gelap Tabel 3 5.. Hasil pengamatan tahapan proses pemucatan
Pemucatan Simbol satuan
percobaan
Suhu
(0C) (menit) Waktu Air (ml) H2O2
(tetes) Karakter fisik
A 60-80 30 5,9 10 Pasta, warna coklat tua
B 60-80 30 3,1 10 Pasta, warna coklat tua
C 60-80 30 6,8 10 Pasta, warna coklat muda
D 60-80 30 11,3 10 Pasta, warna coklat muda
E1 60-80 30 5,6 10 Pasta, warna coklat muda
E2 60-80 30 9,0 10 Pasta, warna coklat muda
F 60-80 30 6,8 10 Pasta, warna coklat muda
G 60-80 30 8,4 10 Pasta, warna coklat muda
H 60-80 30 3,5 10 Pasta, warna coklat muda
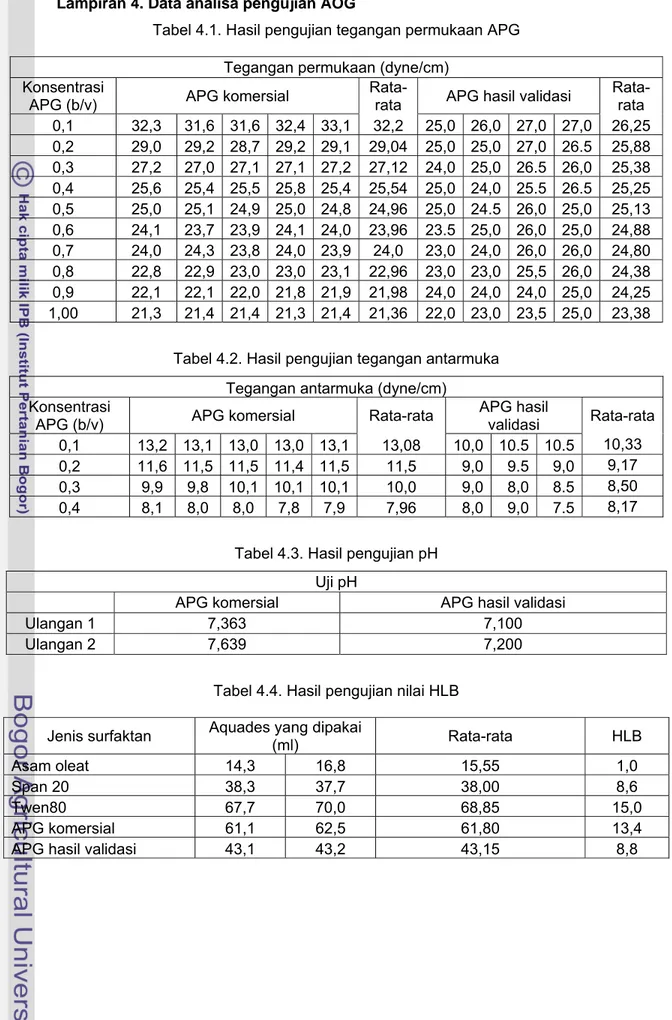
Lampiran 4. Data analisa pengujian AOG
Tabel 4.1. Hasil pengujian tegangan permukaan APG Tegangan permukaan (dyne/cm)
Konsentrasi
APG (b/v) APG komersial
Rata-rata APG hasil validasi
Rata-rata 0,1 32,3 31,6 31,6 32,4 33,1 32,2 25,0 26,0 27,0 27,0 26,25 0,2 29,0 29,2 28,7 29,2 29,1 29,04 25,0 25,0 27,0 26.5 25,88 0,3 27,2 27,0 27,1 27,1 27,2 27,12 24,0 25,0 26.5 26,0 25,38 0,4 25,6 25,4 25,5 25,8 25,4 25,54 25,0 24,0 25.5 26.5 25,25 0,5 25,0 25,1 24,9 25,0 24,8 24,96 25,0 24.5 26,0 25,0 25,13 0,6 24,1 23,7 23,9 24,1 24,0 23,96 23.5 25,0 26,0 25,0 24,88 0,7 24,0 24,3 23,8 24,0 23,9 24,0 23,0 24,0 26,0 26,0 24,80 0,8 22,8 22,9 23,0 23,0 23,1 22,96 23,0 23,0 25,5 26,0 24,38 0,9 22,1 22,1 22,0 21,8 21,9 21,98 24,0 24,0 24,0 25,0 24,25 1,00 21,3 21,4 21,4 21,3 21,4 21,36 22,0 23,0 23,5 25,0 23,38
Tabel 4.2. Hasil pengujian tegangan antarmuka Tegangan antarmuka (dyne/cm)
Konsentrasi
APG (b/v) APG komersial Rata-rata
APG hasil validasi Rata-rata 0,1 13,2 13,1 13,0 13,0 13,1 13,08 10,0 10.5 10.5 10,33 0,2 11,6 11,5 11,5 11,4 11,5 11,5 9,0 9.5 9,0 9,17 0,3 9,9 9,8 10,1 10,1 10,1 10,0 9,0 8,0 8.5 8,50 0,4 8,1 8,0 8,0 7,8 7,9 7,96 8,0 9,0 7.5 8,17
Tabel 4.3. Hasil pengujian pH Uji pH
APG komersial APG hasil validasi
Ulangan 1 7,363 7,100
Ulangan 2 7,639 7,200
Tabel 4.4. Hasil pengujian nilai HLB
Jenis surfaktan Aquades yang dipakai (ml) Rata-rata HLB
Asam oleat 14,3 16,8 15,55 1,0
Span 20 38,3 37,7 38,00 8,6
Twen80 67,7 70,0 68,85 15,0
APG komersial 61,1 62,5 61,80 13,4
Lampiran 5. Pengolahan data suhu butanolisis dan rasio mol pati sagu-alkohol lemak terhadap nilai kestabilan emulsi pada sintesa APG dua tahap
Tabel 5.1. Hasil optimasi nilai kestabilan emulsi metode permukaan respon
Ket *: hasil validasi kondisi optimum
Tabel 5.2. Kode koefisien untuk variabel independen
Faktor Ditambahkan oleh Pembagian oleh
X1 0 1,41 X2 0 1,41
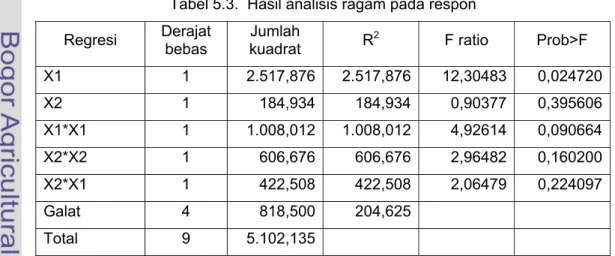
Tabel 5.3. Hasil analisis ragam pada respon
Regresi Derajat bebas Jumlah kuadrat R2 F ratio Prob>F
X1 1 2.517,876 2.517,876 12,30483 0,024720 X2 1 184,934 184,934 0,90377 0,395606 X1*X1 1 1.008,012 1.008,012 4,92614 0,090664 X2*X2 1 606,676 606,676 2,96482 0,160200 X2*X1 1 422,508 422,508 2,06479 0,224097 Galat 4 818,500 204,625 Total 9 5.102,135 Kestabilan emulsi rasio mol (gr) Suhu butanolisis Pati sagu (gr) Alcohol lemak (gr) Tinggi emulsi (cm) Rata-rata Kestabilan emulsi (%) 130 20,25 58,125 0,215 0,163 0,189 18,9 130 20,25 139,5 0,473 0,100 0,287 28,7 150 20,25 58,125 0,622 0,551 0,587 58,7 150 20,25 139,5 0,301 0,309 0,305 30,5 140 20,25 98,81 0,714 0,706 0,710 71,0 140 20,25 98,81 0,629 0,500 0,565 56,5 125,9 20,25 98,81 0,028 0,021 0,025 2,5 154,1 20,25 98,81 0,755 0,760 0,758 75,8 140 20,25 41,39 0,553 0,481 0,517 51,7 140 20,25 156,24 0,427 0,505 0,466 46,6 147,8 20,25 77,54 0,778 0,667 0,723 72,3* Kestabilan komersial 0,9 1,0 0,950 95,0
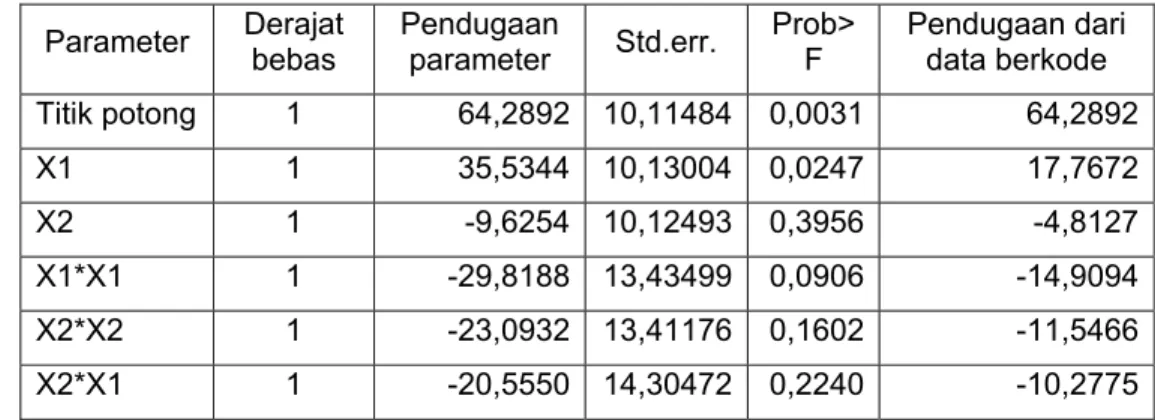
Tabel 5.4. Hasil analisis ragam pengaruh perlakuan terhadap kestabilan emulsi air : xilene setelah penambahan APG yang dihasilkan pada nilai T Parameter Derajat bebas Pendugaan parameter Std.err. Prob>F Pendugaan dari data berkode Titik potong 1 64,2892 10,11484 0,0031 64,2892 X1 1 35,5344 10,13004 0,0247 17,7672 X2 1 -9,6254 10,12493 0,3956 -4,8127 X1*X1 1 -29,8188 13,43499 0,0906 -14,9094 X2*X2 1 -23,0932 13,41176 0,1602 -11,5466 X2*X1 1 -20,5550 14,30472 0,2240 -10,2775
Tabel 5.5. Hasil analisis kanonik permukaan respon kestabilan emulsi air ; xilene setelah penambahan APG yang dihasilkan
Faktor Titik kritis
X1 (suhu butanolisis) 0,788347
X2 (rasio mol pati sagu:dodecanol -0,558144 Nilai duga pada titik stationer
Eigenvalues Eigenvectors
X1 X2
-0,125437 0,996771 -0,080303 -3,79398 0,08030 0,99677
Stationary point is a maximum
Tabel 5.6. Nilai optimum perlakuan
Faktor Nilai kritis
X1 147,86 Suhu butanolisis
X2 3,27 Rasio mol pati sagu :
Lampiran 6. Aplikasi formulasi herbisida
• Persentase penutupan gulma
Pengamatan dilakukan secara visual pada setiap petak percobaan. Selang penutupan gulma antara 0 – 100% yang diamati pada 1, 2, dan 3 MSA. Untuk menghilangkan subyektifitas, pengamatan dilakukan minimal oleh tiga orang.
• Efektivitas herbisida
Pengamatan dilaksanakan pada 1dan 2 MSA. Penilaian efektivitas herbisida dilakukan dengan membuat skoring skala 0 – 4, keterangan nilai skoring adalah sebagai berikut:
0 = efektif
1 = kurang efektif 2 = cukup efektif 3 = efektif 4 = efektif sekali
• Stabilitas formulasi herbisida
Untuk mengetahui perubahan stabilitas formulasi herbisida terhadap penyimpanan, maka formulasi herbisida yang telah dibuat disimpan selama 5 minggu pada suhu 150C, suhu ruang (26-290C), 400C. Setiap minggu diamati kestabilan formulasinya.
Lampiran 7. Analisis statistik kestabilan formulasi herbisida (%)
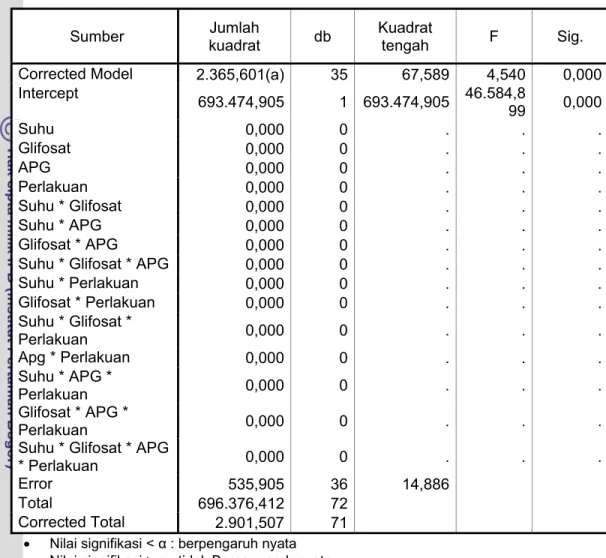
Tabel 7.1. Analisis ragam pengaruh penyimpanan pada suhu 150C, 26-290C, 400C terhadap kestabilan formulasi herbisida pada minggu pertama
Sumber kuadrat Jumlah db Kuadrat tengah F Sig. Corrected Model 2.365,601(a) 35 67,589 4,540 0,000 Intercept 693.474,905 1 693.474,905 46.584,8 99 0,000 Suhu 0,000 0 . . . Glifosat 0,000 0 . . . APG 0,000 0 . . . Perlakuan 0,000 0 . . . Suhu * Glifosat 0,000 0 . . . Suhu * APG 0,000 0 . . . Glifosat * APG 0,000 0 . . .
Suhu * Glifosat * APG 0,000 0 . . .
Suhu * Perlakuan 0,000 0 . . . Glifosat * Perlakuan 0,000 0 . . . Suhu * Glifosat * Perlakuan 0,000 0 . . . Apg * Perlakuan 0,000 0 . . . Suhu * APG * Perlakuan 0,000 0 . . . Glifosat * APG * Perlakuan 0,000 0 . . .
Suhu * Glifosat * APG
* Perlakuan 0,000 0 . . .
Error 535,905 36 14,886
Total 696.376,412 72
Corrected Total 2.901,507 71
• Nilai signifikasi < α : berpengaruh nyata • Nilai signifikasi > α : tidak Berpengaruh nyata
Tabel 7.2 Uji Duncan kestabilan formulasi herbisida pada minggu pertama untuk faktor suhu
Suhu (0C)
N Rataan Pengelompokan Duncan
26-29 24 94,4221 A
15 8 100,0000 B
40 8 100,0000 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 7.3. Uji Duncan kestabilan formulasi herbisida pada minggu pertama untuk faktor konsentrasi glifosat
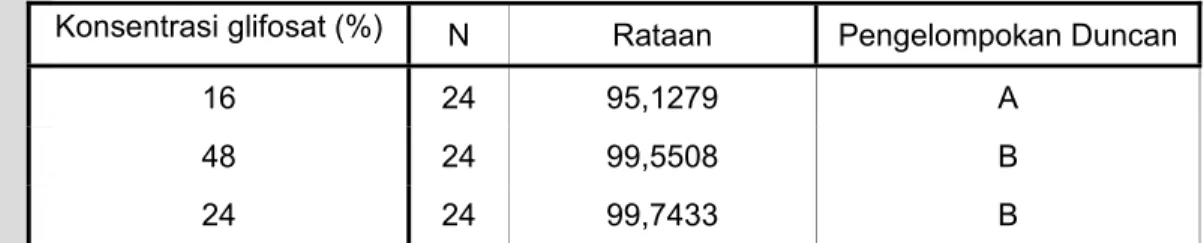
Konsentrasi glifosat (%) N Rataan Pengelompokan Duncan
16 24 95,1279 A
48 24 99,5508 B
24 24 99,7433 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata Tabel 7.4. Uji Duncan kestabilan formulasi herbisida pada minggu pertama untuk
faktor konsentrasi APG
Konsentrasi APG (%) N Rataan Pengelompokan Duncan
10 18 96,3244 A
8 18 97,7772 AB
6 18 98,9739 AB
4 18 99,4872 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata Tabel 7.5. Uji Duncan kestabilan formulasi herbisida pada minggu pertama untuk
aktor perlakuan
Perlakuan N Rataan Pengelompokan Duncan
RD 2 69,2300 A RC 2 83,0750 B RB 2 93,0750 C RA 2 96,1550 C RG 2 98,4600 C RJ 2 98,4600 C RK 2 98,4600 C RL 2 98,4600 C RF 2 99,2300 C RH 2 99,2300 C RI 2 99,2300 C RE 2 100,00 C 15A 2 100,00 C
Perlakuan N Rataan Pengelompokan Duncan 15B 2 100,00 C 15C 2 100,00 C 15D 2 100,00 C 15E 2 100,00 C 15F 2 100,00 C 15G 2 100,00 C 15H 2 100,00 C 15I 2 100,00 C 15J 2 100,00 C 15K 2 100,00 C 15L 2 100,00 C 40A 2 100,00 C 40B 2 100,00 C 40C 2 100,00 C 40D 2 100,00 C 40E 2 100,00 C 40F 2 100,00 C 40G 2 100,00 C 40H 2 100,00 C 40I 2 100,00 C 40J 2 100,00 C 40K 2 100,00 C 40L 2 100,00 C
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 7.6. Analisis ragam pengaruh penyimpanan pada suhu 15C, 26-29 C, 40C terhadap kestabilan formulasi herbisida pada minggu kedua sampai minggu kelima
Sumber kuadrat Jumlah db Kuadrat tengah F Sig. Corrected Model 2.510,143(a) 35 71,718 4,818 0,000 Intercept 691.66,.451 1 691.662,451 46.463,145 0,000 Suhu 0,000 0 . . . Glifosat 0,000 0 . . . APG 0,000 0 . . . Perlakuan 0,000 0 . . . Suhu * Glifosat .0,000 0 . . . Suhu * APG 0,000 0 . . . Glifosat * APG 0,000 0 . . .
Suhu * Glifosat * APG 0,000 0 . . .
Suhu * Perlakuan 0,000 0 . . . Glifosat * Perlakuan 0,000 0 . . . Suhu * Glifosat * Perlakuan 0,000 0 . . . Apg * Perlakuan 0,000 0 . . . Suhu * APG * Perlakuan 0,000 0 . . . Glifosat * APG * Perlakuan 0,000 0 . . .
Suhu * Glifosat * Apg
* Perlakuan 0,000 0 . . .
Galat 535,905 36 14,886
Total 694.708,500 72
Corrected Total 3.046,048 71
• Nilai signifikasi < α : berpengaruh nyata • Nilai signifikasi > α : tidak Berpengaruh nyata
Tabel 7.7. Uji Duncan kestabilan formulasi herbisida pada pada minggu kedua sampai minggu kelima untuk faktor suhu
Suhu (0C)
N Rataan Pengelompokan Duncan
26-29 24 94,0371 A
15 8 100,0000 B
40 8 100,0000 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 7.8. Uji Duncan kestabilan formulasi herbisida pada minggu kedua sampai minggu kelima untuk faktor konsentrasi glifosat
Konsentrasi glifosat (%) N Rataan Pengelompokan Duncan
16 24 94,9354 A
48 24 99,4867 B
24 24 99,6150 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 7.9. Uji Duncan kestabilan formulasi herbisida pada minggu kedua sampai minggu kelima untuk faktor konsentrasi APG
Konsentrasi APG (%) N Rataan Pengelompokan Duncan
10 18 96,2389 A
8 18 97,6917 AB
6 18 98,8028 AB
4 18 99,3161 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 7.10. Uji Duncan kestabilan formulasi herbisida pada minggu kedua sampai minggu kelima untuk faktor Perlakuan
Perlakuan N Rataan Pengelompokan Duncan
RD 2 68,4600 A RC 2 82,3050 B RB 2 92,3050 C RA 2 96,1550 C RF 2 98,4600 C RG 2 98,4600 C RI 2 98,4600 C RJ 2 98,4600 C RK 2 98,4600 C RL 2 98,4600 C RE 2 99,2300 C RH 2 99,2300 C 15A 2 100,00 C
Perlakuan N Rataan Pengelompokan Duncan 15B 2 100,00 C 15C 2 100,00 C 15D 2 100,00 C 15E 2 100,00 C 15F 2 100,00 C 15G 2 100,00 C 15H 2 100,00 C 15I 2 100,00 C 15J 2 100,00 C 15K 2 100,00 C 15L 2 100,00 C 40A 2 100,00 C 40B 2 100,00 C 40C 2 100,00 C 40D 2 100,00 C 40E 2 100,00 C 40F 2 100,00 C 40G 2 100,00 C 40H 2 100,00 C 40I 2 100,00 C 40J 2 100,00 C 40K 2 100,00 C 40L 2 100,00 C
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Lampiran 8. Analisis statistik persentase penutupan gulma
Tabel 8.1. Analisis sidik ragam pangaruh suhu penyimpanan dan formulasi herbisida terhadap persentase penutupan gulma 1 MSA
Sumber Kuadrat Jumlah db Kuadrat Tengah F Sig.
Suhu 159,896 2 79,948 2,046 0,144 Glifosat 6500,146 2 3250,073 83,158 0,000 APG 196,847 3 65,616 1,679 0,189 Suhu * Glifosat 286,646 4 71,661 1,834 0,144 Suhu * APG 220,049 6 36,675 0,938 0,480 Glifosat * APG 196,382 6 32,730 0,837 0,549
Suhu * Glifosat * APG 168,910 12 14,076 0,360 0,969
Galat 1407,000 36 39,083
Total 425.464,000 72
• Nilai signifikasi < α : berpengaruh nyata • Nilai signifikasi > α : tidak Berpengaruh nyata
Tabel 8.2 Uji Duncan persentase penutupan gulma (%) 1 MSA hasil penyimpanan suhu 150C, suhu ruang dan 400C untuk faktor konsentrasi glifosat Konsentrasi Glifosat (%) N Rataan Pengelompokan Duncan
48 24 62,7500 A
24 24 80,9792 B
16 24 84,3956 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata Tabel 8.3. Analisis sidik ragam pangaruh suhu penyimpanan dan formulasi herbisida
terhadap persentase penutupan gulma 2 MSA
Sumber Kuadrat Jumlah db Kuadrat Tengah F Sig.
Suhu 2051,340 2 1025,670 16,242 0,000 Glifosat 27788,882 2 13894,441 220,025 0,000 APG 555,622 3 185,207 2,933 0,046 Suhu * Glifosat 943,514 4 235,878 3,735 0,012 Suhu * APG 211,076 6 35,179 0,557 0,761 Glifosat * APG 518,118 6 86,353 1,367 0,254
Suhu * Glifosat * APG 504,653 12 42,054 .0,666 0,771
Galat 2273,375 36 63,149
Total 165.194,250 72
• Nilai signifikasi < α : berpengaruh nyata • Nilai signifikasi > α : tidak Berpengaruh nyata
Tabel 8.4 . Uji Duncan persentase penutupan gulma (%) 2 MSA hasil penyimpanan suhu 150C, suhu ruang, dan 400C untuk faktor suhu penyimpanan Suhu (0C)
N Rataan Pengelompokan Duncan
26-29 24 35,0833 A
15 24 45,3125 B
40 24 47,2500 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata Tabel 8.5. Uji Duncan persentase penutupan gulma (%) 2 MSA hasil penyimpanan
suhu 150C, suhu ruang, dan 400C untuk faktor konsentrasi glifosat Konsentrasi glifosat (%) N Rataan Pengelompokan Duncan
48 24 15,0417 A
24 24 52,9167 B
16 24 59,6875 C
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata Tabel 8.6. Uji Duncan persentase penutupan gulma (%) 2 MSA hasil penyimpanan
suhu 150C, suhu ruang, dan 400C untuk faktor konsentrasi APG Konsentrasi APG (%) N Rataan Pengelompokan Duncan
8 18 38,9444 A
10 18 41,0556 B
6 18 43,9444 BC
4 18 45,2500 C
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 8.7 Uji Duncan persentase penutupan gulma (%) 2 MSA hasil penyimpanan suhu 150C, suhu ruang, dan 400C untuk faktor interaksi
Perlakuan N Pengelompokan Duncan
RJ 2 A RK 2 A 40L 2 A 15L 2 A 15K 2 A 40K 2 A 15J 2 AB RL 2 AB 40J 2 AB RI 2 ABC 15I 2 ABCD 40I 2 ABCDE RG 2 BCDEF RH 2 CDEFG RE 2 DEFGH RA 2 EFGHI RF 2 FGHIJ 15G 2 GHIJK RC 2 GHIJK RD 2 GHIJK 15D 2 HIJK 15F 2 HIJK RB 2 HIJK 40F 2 HIJK 40G 2 HIJK 15H 2 IJK 40C 2 IJK 40H 2 IJK 15A 2 IJK 15C 2 JK 15B 2 JK 40D 2 JK 40E 2 JK 40A 2 K 40B 2 K 15E 2 K
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Lampiran 9. Analisis statistik bobot kering gulma
Tabel 9.1. Analisis ragam pengaruh penyimpanan pada suhu 150C, 26-290C, 400C terhadap bobot kering gulma pada 1 MSA
Sumber Kuadrat Jumlah db Kuadrat Tengah F Sig. Corrected Model 1511.102(a) 35 43.174 4.807 .000
Intercept 14257.942 1 14257.942 1587.463 .000 Suhu .000 0 . . . Glifosat .000 0 . . . APG .000 0 . . . Perlakuan .000 0 . . . Suhu * glifosat .000 0 . . . Suhu * APG .000 0 . . . glifosat * APG .000 0 . . .
Suhu * glifosat * APG .000 0 . . .
Suhu * perlakuan .000 0 . . . glifosat * perlakuan .000 0 . . . Suhu * glifosat * perlakuan .000 0 . . . APG * perlakuan .000 0 . . . Suhu * APG * perlakuan .000 0 . . . glifosat * APG * perlakuan .000 0 . . .
Suhu * glifosat *APG
* perlakuan .000 0 . . .
Galat 323.337 36 8.982
Total 16092.381 72
Corrected Total 1834.439 71
• Nilai signifikasi < α : berpengaruh nyata • Nilai signifikasi > α : tidak Berpengaruh nyata
Tabel 9.2. Uji Duncan bobot kering gulma (%) 1 MSA hasil penyimpanan suhu 150C, suhu ruang, dan 400C untuk faktor konsentrasi glifosat
Konsentrasi glifosat (%) N Rataan Pengelompokan Duncan
48 24 8,2101 A
24 24 16,0271 B
16 24 17,9794 C
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 9.3. Analisis ragam pengaruh penyimpanan pada suhu 15C, 26-29C, 40 C terhadap bobot kering gulma pada 2 MSA
Sumber Kuadrat Jumlah db Kuadrat Tengah F Sig. Corrected Model 728.444(a) 35 20.813 8.841 .000
Intercept 2081.107 1 2081.107 884.001 .000 Suhu .000 0 . . . Glifosat .000 0 . . . APG .000 0 . . . Perlakuan .000 0 . . . Suhu * glifosat .000 0 . . . suhu * APG .000 0 . . . glifosat * APG .000 0 . . .
suhu * glifosat * APG .000 0 . . .
suhu * perlakuan .000 0 . . .
glifosat * perlakuan .000 0 . . .
suhu * glifosat *
perlakuan .000 0 . . .
apg * perlakuan .000 0 . . .
suhu * APG * perlakuan .000 0 . . .
glifosat * APG *
perlakuan .000 0 . . .
suhu * glifosat * APG *
perlakuan .000 0 . . .
Galat 84.751 36 2.354
Total 2894.302 72
Corrected Total 813.195 71
• Nilai signifikasi < α : berpengaruh nyata • Nilai signifikasi > α : tidak Berpengaruh nyata
Tabel 9.4. Uji Duncan persentase bobot kering gulma (g) 2 MSA hasil penyimpanan suhu 150C, suhu ruang dan 400C untuk factor suhu
Suhu (0C)
N Rataan Pengelompokan Duncan
26-29 24 3,8894 A
15 24 5,0246 B
40 24 6,3148 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Tabel 9.5. Uji Duncan bobot kering gulma (g) 1 MSA hasil penyimpanan suhu 15 C, suhu ruang, dan 400C untuk faktor konsentrasi glifosat
Konsentrasi glifosat (%) N Rataan Pengelompokan Duncan
48 24 1,5867 A
24 24 6,5019 B
16 24 8,0402 C
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata Tabel 9.6. Uji Duncan bobot kering gulma (g) 2 MSA hasil penyimpanan suhu 150C,
suhu ruang, dan 400C untuk faktor konsentrasi APG
Konsentrasi APG (%) N Rataan Pengelompokan Duncan
8 18 4,7393 A
10 18 5,1178 AB
6 18 5,6489 AB
4 18 5,9994 B
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata Tabel 9.7. Uji Duncan bobot kering gulma (g) 2 MSA hasil penyimpanan suhu 150C,
suhu ruang, dan 400C untuk faktor perlakuan
Perlakuan N Rataan Pengelompokan Duncan
RJ 2 1.1794 A RK 2 1.1794 A 40L 2 1.2451 A 15L 2 1.2677 A 15K 2 1.3276 A 40K 2 1.3385 A 15J 2 1.5906 A RL 2 1.6897 AB 40J 2 1.7411 AB RI 2 1.9999 AB 15I 2 2.1987 ABC 40I 2 2.2833 ABC
RG 2 2.8709 ABCD RH 2 3.5524 ABCDE RE 2 3.8112 ABCDEF RF 2 4.8208 ABCEFG RA 2 5.3189 BCDEFGH 15G 2 5.6373 CDEFGHI RC 2 6.3222 DEFGHIJ RD 2 6.4751 EFGHIJK 15F 2 6.9202 FGHIJKL 15D 2 7.0876 FGHIJKL 40G 2 7.3930 GHIJKL RB 2 7.4534 GHIJKL 40F 2 7.5747 GHIJKL 40C 2 7.7268 GHIJKL 40H 2 7.7268 GHIJKL 15H 2 7.7584 GHIJKL 15A 2 8.4922 GHIJKL 15C 2 8.8576 HIJKL 15B 2 9.2576 IJKL 40D 2 9.2576 IJKL 40E 2 9.2576 IJKL 40A 2 9.9338 JKL 40B 2 10.2993 KL 15E 2 10.6993 L
• Huruf pengelompokan Duncan yang sama menunjukkan faktor tidak berbeda nyata • Huruf pengelompokan Duncan yang tidak sama menunjukkan faktor berbeda nyata
Lampiran 10. Analisis statistik efektivitas herbisida hasil penyimpanan
Tabel 10.1. Uji Kruskal Wallis untuk efektivitas formulasi herbisida 1 MSA
Tes statistik Efektivitas 1 MSA
Chi-Square 71
Df 2
Asymp. Sig. 0.000
Tabel 10.2. Uji Kruskal Wallis untuk efektivitas formulasi herbisida 1 MSA untuk konsentrasi glifosat
glifosat N Mean rank
16 24 24.50
24 24 24.50
48 24 60.50
Total 72
Tabel 10.3. Uji Kruskal Wallis untuk efektivitas herbisida 2 MSA
Tes Statistik Efektivitas 2 MSA
Chi-Square 62,495
Df 2
Asymp. Sig. 0,000
Tabel 10.4. Uji Kruskal Wallis untuk efektivitas formulasi herbisida 2 MSA untuk konsentrasi glifosat
glifosat N Mean Rank
16 24 26.00
24 24 24.50
48 24 59.00