SINTESIS, KARAKTERISASI, DAN UJI BIOAKTIVITAS ANTIMALARIA SENYAWA TRIFENILTIMAH(IV) BENZOAT DAN DIFENILTIMAH(IV) DIBENZOAT TERHADAP Plasmodium
falciparum (Skripsi)
Oleh
ISMI AMBALIKA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
BANDAR LAMPUNG 2017
ABSTRAK
SINTESIS, KARAKTERISASI, DAN UJI BIOAKTIVITAS ANTIMALARIA SENYAWA TRIFENILTIMAH(IV)BENZOAT DAN
DIFENILTIMAH(IV)DIBENZOAT TERHADAP Plasmodium falciparum
Oleh
ISMI AMBALIKA
Pada penelitian ini telah dilakukan sintesis senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat dengan cara mereaksikan senyawa trifeniltimah(IV) hidroksida dan difeniltimah(IV) dihidroksida dengan senyawa asam benzoat
sebagai ligannya, kemudian direfluks pada suhu 60oC selama 4 jam. Senyawa
hasil sintesis yang dihasilkan berupa padatan berwarna putih dengan rendemen 90,37% dan 89,48%. Kemurnian dari senyawa sintesis ini telah divalidasi dengan
karakterisasi menggunakan spektrofotometer IR, UV-Vis, NMR, dan
microelemental analyzer. Setelah itu, uji aktivitas antimalaria dilakukan pada
parasit malaria Plasmodium falciparum 3D7 dengan mengukur nilai 50%
inhibitor concentration (IC50) dari masing-masing senyawa. Senyawa
trifeniltimah(IV) benzoat memiliki nilai IC50 0,62 μg/mL (0,13 x 10-5 M) dan
difeniltimah(IV) dibenzoat memiliki nilai IC50 1,31 μg/mL (0,25 x 10-5 M).
Besarnya nilai IC50 yang dimiliki kedua senyawa tersebut, menandakan bahwa
senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat tergolong
senyawa yang sangat aktif sebagai antimalaria karena memiliki nilai IC50 <5
μg/mL. Meskipun kedua senyawa tersebut tergolong senyawa yang sangat aktif sebagai antimalaria, namun jika dibandingkan dengan klorokuin sebagai kontrol positif, aktivitas antimalaria kedua senyawa tersebut kurang efektif dibanding
klorokuin yang memiliki nilai IC50 lebih kecil yaitu 0,002 μg/mL (0,62 x 10-8 M).
ABSTRACT
SYNTHESIS, CHARACTERIZATION, AND ANTIMALARIAL BIOACTIVITY TEST OF TRIPHENYLTIN(IV) BENZOATE AND
DIPHENYLTIN(IV) DIBENZOATE FOR Plasmodium falciparum
BY
ISMI AMBALIKA
In this research, triphenyltin(IV) benzoate and diphenyltin(IV) dibenzoate have been synthesized by the reaction between triphenyltin(IV) hydroxide and diphenyltin(IV) dihydroxide with benzoic acid compound as ligand, then refluxing at 60 ° C for 4 hours. The resulting compound of this synthesis is white solid with yield of 90.37% and 89.48%. The purity of the compound has been validated by characterization using IR, UV-Vis, NMR spectrophotometers, and microelemental analyzer. Then, the antimalarial activity test was performed for malaria parasite Plasmodium falciparum 3D7 by measuring the value of 50%
concentration inhibitor (IC50) of each compound. Triphenyltin(IV) benzoate has
an IC50 value of 0.62 μg / mL (0.13x10-5 M) and diphenyltin(IV) dibenzoate has
an IC50 value of 1.31 μg / mL (0.25×10-5 M). The value of IC50 of both compounds, indicating that triphenyltin(IV) benzoate and diphenyltin(IV) dibenzoate was classified as a very active compound as antimalarial because it has
IC50 <5 μg / mL. Although both of compounds are very active as antimalarial, but
when the compounds are compared to chloroquine as a positive control, the antimalarial activity of the two compounds is less effective than chloroquine
which has a smaller IC50 value of 0.002 μg / mL (0.62x10-8 M ).
SINTESIS, KARAKTERISASI, DAN UJI BIOAKTIVITAS ANTIMALARIA SENYAWA TRIFENILTIMAH(IV)BENZOAT DAN
DIFENILTIMAH(IV)DIBENZOAT TERHADAP Plasmodium falciparum
Oleh
ISMI AMBALIKA
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar SARJANA SAINS
Pada Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
BANDAR LAMPUNG 2017
RIWAYAT HIDUP
Penulis dilahirkan di Bandar Lampung, pada tanggal 31 Agustus 1995, sebagai anak pertama dari dua bersaudara dari pasangan Bapak Warju dan Ibu Suyatmi.
Jenjang pendidikan diawali dari Sekolah Dasar (SD) di SDN 1 Marga Agung, Jati Agung Lampung Selatan, diselesaikan pada tahun 2007. Sekolah Menengah Pertama (SMP) di MTs Al-Hidayah Jati agung Lampung Selatan dan diselesaikan pada tahun 2010. Sekolah Menengah Atas di Madrasah Aliyah Negeri (MAN) 1 Bandar Lampung dan diselesaikan pada tahun 2013. Pada tahun 2013, penulis terdaftar sebagai mahasiswa Jurusan Kimia FMIPA Universitas Lampung melalui jalur Seleksi Bersama Masuk Perguruan Tinggi Negeri (SBMPTN).
Selama menjadi mahasiswa, penulis memperoleh beasiswa Peningkatan Prestasi Akademik (PPA) dan pernah menjadi finalis Olimpiade Nasional MIPA tingkat Nasional pada tahun 2016. Selain itu, penulis juga pernah menjadi asisten praktikum Kimia Anorganik I dan Kimia Anorganik II, praktikum Kimia Dasar tahun 2016 dan 2017. Penulis juga aktif mengikuti beberapa organisasi, seperti
menjadi Anggota Muda Unit Kegiatan Mahasiswa Penelitian (UKMP) Universitas Lampung tahun 2013-2014, menjadi anggota Bidang Sains dan
Penalaran Ilmu Kimia (SPIK) Himpunan Mahasiswa Kimia tahun 2014-2015, dan menjadi Sekretaris Bidang Sains dan Penalaran Ilmu Kimia (SPIK) Himpunan Mahasiswa Kimia tahun 2015-2016.
MOTTO
“Allah tidak mewajibkan orang-orang yang bodoh untuk
menuntut ilmu kecuali terlebih dahulu mewajibkan
orang-orang yang berilmu untuk mengajar”.
( Ali bin Abi Thalib )
“Belajar dari kegagalan masa lalu dan menjadi lebih baik di
masa depan”
“Kekuatan tidak datang dari kemampuan fisik, akan tetapi
dia datang dari semangat yg tidak pernah mengalah”
(Anonim)
“Keberhasilanmu adalah salah satu dari doa orang tuamu
yang telah Allah kabulkan”
Assalamu’alaikum Wr.Wb
Kupersembahkan karya sederhana ini kepada : Terkhusus untuk kedua orang tuaku yang tak pernah
lelah untuk membimbing, mengajari, dan selalu mendo’akanku hingga aku bisa menyelesaikan sekolah
hingga medapat gelar S1 ini. Terimakasih untuk semuanya.
Untuk adikku tersayang “Isma Iqwansayah” semoga kita bisa sama-sama membahagiakan dan membanggakan
orang tua kita.
Untuk orang-orang yang aku sayangi, saudara , sahabat , dan keluarga besarku yang selalu
menyemangati dan mendoakanku.
Untuk dosen pembimbing dan dosen-dosen Jurusan Kimia yang telah mengajari dan membagi ilmu selama
kuliah di Jurusan Kimia dan almamater tercinta
SANWACANA
Alhamdulillah, puji syukur senantiasa penulis haturkan kepada Allah SWT yang telah melimpahkan rahmat dan kasih sayang-Nya. sehingga penulis dapat menyelesaikan penulisan penelitian yang berjudul “Sintesis, Karakterisasi , dan
Uji Bioaktivitas Antimalaria Senyawa Trifeniltimah(IV) Benzoat dan Difeniltimah(IV) Dibenzoat terhadap Plasmodium falciparum”.
Dalam penulisan karya tulis ini, banyak pihak yang telah terlibat untuk terus memberikan bantuan dan semangat dan tentunya itu semua tidak lepas dari anugerah yang telah diberikan oleh Allah SWT sehingga penulis dapat menyelesaikan karya tulis ini. Atas segala bantuan tersebut, penulis mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Prof. Sutopo Hadi, M.Sc., Ph.D., selaku pembimbing I yang telah memberikan banyak saran dan nasihat serta penuh kesabaran dalam membimbing penulis untuk menyelesaikan penulisan penelitian ini.
2. Ibu Dr. Noviany, S.Si., M.Si., selaku pembimbing II yang telah memberikan arahan, kritik, dan saran untuk penulis sehingga penulisan penelitian ini dapat terselesaikan dengan baik.
3. Bapak Mulyono Ph.D., selaku pembahas dan pembimbing akademik yang telah memberikan masukan dan kritikan kepada penulis, serta memberikan arahan tentang perkuliahan selama penulis mejadi mahasiswa.
4. Bapak Dr. Suripto Dwi Yuwono, M.T., selaku Ketua Jurusan Kimia FMIPA Unila, yang telah memberikan banyak bantuan untuk penulis terutama dalam menjalankan perkuliahan dan semoga Jurusan Kimia dapat menjadi lebih baik lagi kedepannya.
5. Bapak Prof. Warsito, S.Si., DEA., Ph.D., selaku Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Lampung.
6. Bapak dan Ibu dosen Jurusan Kimia FMIPA Universitas Lampung yang telah mendidik dan mengajarkan penulis selama penulis menimba ilmu di Jurusan Kimia.
7. Seluruh staff administrasi Jurusan Kimia FMIPA Universitas Lampung, yang telah membantu penulis dalam penyelesaian karya tulis ini.
8. Terkhusus untuk kedua orang tuaku yang sangat penulis sayangi dan cintai. Bapakku “Warju” yang tak pernah kenal lelah mencari nafkah untuk membiayai sekolahku dan terus menasihatiku demi kebaikanku dan untuk mamakku “Suyatmi” yang selalu sabar menghadapi kekanak-kanakanku, penuh kasih sayang merawatku dan membesarkanku hingga aku dewasa seperti ini. Terimakasih untuk segala do’a, motivasi, dan pengorbanan kalian untukku menjadi lebih baik lagi. Kalian anugerah terbesar dalam hidupku. 9. Untuk adikku tersayang “Isma Iqwansyah”, yang selalu memberikan warna
dan semangat dalam kehidupan penulis. Semoga adek menjadi orang yang lebih baik lagi dan dapat membahagiakan orang tua kita.
10. Untuk saudara dan saudariku, Yuk Murni, Ema, Ana, Ani, Ida, Supri, Bari, Wulan dan yang tidak bisa penulis sebutkan satu persatu. Terimakasih untuk semangat dan bantuan dari kalian semua.
11. Keluarga Chetir “Chemistry Thirteen”, kalian adalah keluarga kedua untukku. Terimakasih untuk motivasi dan semangat yang telah kalian berikan.
12. Untuk kalian sahabat ter-gokil, Siti Mudmainah, Dian Tanti N, Antonius Wendy A, Tya Gita P, Megafhit P, Faradilla Dwi F, dan Mita Sasta V, yang selalu memberikan semangat, dan menghibur penulis disaat penulis mulai jenuh. Kalian sungguh luar biasa. Terimakasih untuk semuanya.
13. Rekan-rekan seperjuanganku, Febri Ardhiyansyah, Nova Tri Irianti, Della Mita Andini, dan Kartika Agus Kusuma yang selalu membantu, menasehati dan memberikan motivasi kepada penulis. Terimaksih atas kerjasamanya. Untuk adik-adik , Dira, Bayu, Widya, dan Deni Diora terus semangat semoga kalian cepat menyusul dan dipermudah kedepannya nanti.
14. Rekan-rekan di Laboratorium Anorganik/Fisik, Jurusan Kimia FMIPA Unila Ana, Fatimah, Indah, Anggi, Megafhit, Rado, Melita, Fentri, Murnita, Eka S, Awan, Arief, Widia, Esti, Nabila, Linda, Renita, dan Dewi Rumondang yang selalu memberi semangat dan nasehat kepada penulis.
15. Terimakasih untuk seseorang special “Rifki Husnul Khuluk” yang selalu mendukung, membantu, dan mendo’akan penulis. Semoga Allah selalu memberkahimu dan membalas semua kebaikanmu my favorite partner.
16. Terimakasih teman-teman pimpinan HIMAKI perode 2015/2016, Arief, Arni, Fentri, Melita, Rado, Febri, Dona, Yudha, Ana, Eka, Vicka, Ezra, Yuni, dan
Anggi yang selalu mengingatkan penulis dan memberi semangat kepada penulis. Terimakasih untuk kebersamaan dan pengalamannya.
17. Terimakasih Ismi Khomsiah, Sukamto, Murni Fitria, Adi Setiawan, dan Jean Pitaloka, serta kakak-kakak kimia angkatan 2012 lainnya yang selalu memberikan arahan dan semangat untuk penulis.
18. Terimakasih untuk Grace, Yusuf, Heni, Fendi, Fikri, Riri, dan adik-adik angkatan 2014 lainnya, semoga dipermudah kedepannya dan segera menyusul. Terimaksih terus mendukung dan menyemangati penulis.
19. Untuk sahabat-sahabat seperjuangan dan sekampung Wiwit Nurkhasanah, Yofita Sulfiana S, dan Gita Simarmata, terimakasih untuk dukungan dan do’a kalian. Semoga ilmu kita berkah dan yang lain segera menyusul.
20. Untuk Pemuda Karang Taruna, Rismawan/Rismawati Blok D1, Siti Mariyani, Sekar Muninggar Intani, Kiki Dwi O, Wahyudi Agus T, Irvan Hendra, Aprilia Imanuri, dan yang lainnya yang tidak bisa penulis sebutkan satu persatu. Bersama kalian menjadi pengalaman yang sangat berharga. Terus berkarya untuk desa kita.
21. Untuk para Aparat Desa Marga Agung , Bapak Dahroji (Sekdes), Mbak Siti Mariyani, Lek Ipong, Mas Yoyo, Pak Pono, Pak Mulyadi, dan Lek Sudar, dan aparat desa lainnya, terimakasih telah membagikan banyak ilmu dan pengalaman kepada penulis.
22. Terimakasih untuk adik-adik 2014, 2015, dan 2016 yang tidak bisa penulis sebutkan satu persatu, semangat kuliahnya dan semoga segera menyusul.
23. Terimakasih untuk kakak-kakak angkatan 2011, 2010, 2009 yang tidak bisa penulis sebutkan satu persatu yang selalu memberikan kritik, semangat, dan segala pegalaman untuk penulis menjadi pribadi yang lebih baik lagi.
24. Terimakasih untuk teman-teman KKN Unila 2016 Desa Payung Makmur, mbak Evi, Dea, Shintia, Yoka, Dafri, Chandra, dan Mido untuk kebersamaan dan semangat kalian.
Penulis menyadari dalam penulisan ini masih terdapat banyak kekurangan dan atas segala kebaikan Bapak/Ibu/Sdr/i, semoga Allah SWT membalasnya dengan pahala yang berlipat ganda, Aamiin.
Bandar Lampung, 31 Mei 2017 Penulis,
DAFTAR ISI Halaman DAFTAR TABEL ... DAFTAR GAMBAR ... I. PENDAHULUAN ... iii iv 1 A. Latar Belakang... 1 B. Tujuan Penelitian ... 5 C. Manfaat Penelitian ... 6
II. TINJAUAN PUSTAKA ... ... 7
A. Senyawa Organologam ... ... 7
B. Timah ... ... 9
C. Senyawa Organotimah ... ... 11
D. Senyawa Turunan Organotimah ... ... 12
1. Senyawa Organotimah Halida ... 12
2. Senyawa Organotimah Hidroksida dan Oksida ... 13
3. Senyawa Organotimah Karboksilat ... 14
E. Aplikasi Senyawa Organotimah ... 15
F. Analisis Senyawa Organotimah ... 16
1. Analisis Spektrofotometer IR ... 16
2. Analisis Spektrofotometer UV-Vis... 18
3. Analisis Spektrofotometer NMR ... 19
4. Analisis dengan microelemental analyzer ... 20
G. Senyawa Aktif Antimalaria ... ... 20
H. Mekanisme Obat Antimalaria ... 22
I. Malaria ... … 24
J. Parasit Malaria ... 25
K. Parasit Plasmodium ... 26
1. Siklus Plasmodium didalam Tubuh Manusia ... 26
2. Siklus Plasmodium didalam Tubuh Nyamuk Anopheles sp. ... 27
L. Nyamuk Anopheles sp ... 27
Dibenzoat... 46
D. Karakterisasi Menggunakan Spektrofotometer NMR ... 49
1. Karakterisasi 1H NMR ... 49
2. Karakterisasi 13C NMR ... 50
E. Analisis Unsur menggunakan Microelemental Analyzer ... 52
F. Uji Bioaktivitas Antimalaria secara In Vitro... 53
III. METODOLOGI PENELITIAN ... 29
A. Waktu dan Tempat ... 29
B. Alat dan Bahan ... 29
C. Prosedur Penelitian ... 30
1. Sintesis Senyawa Awal Trifeniltimah(IV) Hidroksida... 30
2. Sintesis Senyawa Awal Difeniltimah(IV) dihidroksida ... 31
3. Sintesis Senyawa Uji Trifeniltimah(IV) Benzoat ... 31
4. Sintesis Senyawa Uji Difeniltimah(IV) dibenzoat ... 32
5. Uji Bioaktivitas Antimalaria secara In Vitro ... 32
6. Analisis Data ... 33
IV. HASIL DAN PEMBAHASAN... 34
A. Sintesis ... 34
1. Sintesis Senyawa Trifeniltimah(IV) Hidroksida dan Trifeniltimah(IV) Benzoat ... 34
2. Sintesis Senyawa Difeniltimah(IV) dihidroksida dan Difeniltimah(IV) Dibenzoat ... 37
B. Karakterisasi Menggunakan Spektrofotometer IR ... 40
1. Senyawa Trifeniltimah(IV) Hidroksida danTrifeniltimah(IV) Benzoat ... 40
2. Senyawa Difeniltimah(IV) dihidroksida dan Difeniltimah(IV) Dibenzoat... 42
C. Karakterisasi Menggunakan Spektrofotometer UV-Vis ... 45
1. Senyawa Trifeniltimah(IV) Hidroksida dan Trifeniltimah(IV) Benzoat ... 45
2. Senyawa Difeniltimah(IV) dihidroksida dan Difeniltimah(IV) V. KESIMPULAN DAN SARAN ... 58
A. Kesimpulan ... 58
B. Saran ... 59
DAFTAR TABEL
Tabel Halaman
1. Serapan IR untuk beberapa asam-asam karboksilat... 18 2. Data Sifat Antimalaria ... 22 3. Pergeseran bilangan gelombang senyawa trifeniltimah(IV) klorida,
trifeniltimah(IV) hidroksida, dan trifeniltimah(IV) benzoat... 42 4. Pergeseran bilangan gelombang senyawa diifeniltimah(IV) diklorida,
difeniltimah(IV) dihidroksida, dan difeniltimah(IV) dibenzoat ... 44 5. Hasil Analisis Unsur Senyawa Hasil Sintesis ... 52 6. Hasil Data Nilai IC50 Senyawa Uji ... 56
DAFTAR GAMBAR
Gambar Halaman
1. Sruktur Trifeniltimah(IV) hidroksida ... 13
2. Struktur Difeniltimah(IV) dihidroksida ... 13
3. Struktur Asam Benzoat ... 14
4. Struktur Klorokuin ... 23
5. Siklus Hidup Nyamuk ... 28
6. Hasil Sintesis Senyawa Trifeniltimah(IV) hidroksida dan Trifeniltimah(IV) benzoat ... 35
7. Reaksi Pembentukan Senyawa trifeniltimah(IV) hidroksida dan Trifeniltimah(IV) benzoat ... 35
8. Deret Spektrokimia ... 36
9. Hasil Sintesis Senyawa Difeniltimah(IV) dihidroksida dan Difeniltimah(IV) dibenzoat ... 38
10. Reaksi pembentukan Senyawa Difeniltimah(IV) dihidroksida dan Difeniltimah(IV) dibenzoat ... 38
11. Spektrum IR trifeniltimah(IV) klorida, trifeniltimah(IV) hidroksida, dan trifeniltimah(IV) benzoat... 41
12. Spektrum IR difeniltimah(IV) diklorida,difeniltimah(IV) dihidroksida, dan difeniltimah(IV) dibenzoat ... 43
13. Spektrum UV-Vis trifeniltimah(IV) klorida, trifeniltimah(IV)hidroksida, asam benzoat, dan trifeniltimah(IV) benzoat ... 45
14. Spektrum UV-Vis difeniltimah(IV) diklorida, difeniltimah(IV)
dihidroksida, dan difeniltimah(IV) dibenzoat ... 47
15. Spektrum 1H NMR trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat ... 49
16. Penomoran Senyawa Trifeniltimah(IV) benzoat dan Difeniltimah(IV) dibenzoat ... 50
17. Spektrum 13CNMR Trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat ... 51
18. Kurva Regresi Linear Senyawa Trifeniltimah(IV) benzoat ... 54
19. Kurva Regresi Linear Senyawa Difeniltimah(IV) dibenzoat... 54
1
I. PENDAHULUAN
A. Latar Belakang
Penyakit malaria menjadi salah satu penyakit infeksi yang sampai saat ini tersebar hampir di seluruh dunia meliputi 109 negara yang beriklim tropis dan sub tropis (WHO, 2008). Penyakit ini disebabkan oleh empat spesies parasit protozoa yaitu
Plasmodium falciparum, P. vivax, P. ovale, dan P. malariae. Parasit tersebut
masuk ke dalam tubuh manusia melalui gigitan nyamuk Anopheles dan
menginfeksi sel darah merah sehingga dapat menularkan penyakit malaria (Trigg, 1998). Penyakit ini perlu mendapat perhatian yang serius karena saat ini, tercatat ada 515 juta kasus malaria dan umumnya menimpa daerah di Benua Afrika (Murtihapsari et al., 2010).
Menurut Poerkoesoesoemo (2003), Indonesia merupakan daerah tropis yang sering dijadikan perpindahan atau beresiko malaria. Penyakit ini terdistribusi secara merata di Indonesia, sedangkan menurut Solikhah (2013), penyakit malaria menjadi salah satu penyebab peningkatan angka kesakitan dan kematian,
gangguan kesehatan ibu dan anak, penurunan intelegensia, penurunan produktivitas angkatan kerja yang merugikan masyarakat di Indonesia. Dari 576.424 kabupaten/kota di Indonesia, 73,6% merupakan daerah endemik malaria
2
dan sekitar 45% penduduk Indonesia berisiko tertular malaria. Hasil Survei
Kesehatan Rumah Tangga (SKRT) tahun 2001, menunjukkan bahwa jumlah kasus malaria adalah sekitar 15 juta orang dengan kematian rata-rata 38 ribu orang per tahun. Pada tahun 2007, jumlah populasi berisiko terjangkit malaria sekitar 116 juta orang sementara jumlah kasus malaria klinis yang dilaporkan 1.775.845 kasus sedangkan pada tahun 2010 meningkat 10,7% dibandingkan pada tahun 2007 (Solikhah, 2013).
Penyebaran penyakit malaria di Indonesia paling tinggi terjadi di Papua. Untuk daerah Papua dan Papua Barat, penyakit ini merupakan pembunuh nomor satu dibandingkan dengan penyakit AIDS, dengan jumlah angka kematian sebesar 3 juta jiwa setiap tahunnya, sedangkan di seluruh dunia, penderita penyakit malaria tercatat sebanyak 300-500 juta orang (Adriana, 2009).
Banyaknya genangan air yang tidak terawat menjadi salah satu faktor yang dapat mempercepat perkembangbiakkan nyamuk terutama nyamuk Anopheles, sehingga penyebaran penyakit malaria ini dapat terjadi dengan begitu cepat. Banyak usaha yang dilakukan untuk mengurangi penyebaran penyakit malaria ini mulai dari mencegah hingga mengobati para penderita penyakit malaria. Pencegahan
penyakit malaria dapat dilakukan dengan mencegah perkembangbiakkan nyamuk dengan suatu insektisida. Saat ini sudah banyak insektisida yang digunakan oleh masyarakat, hanya saja efek samping yang ditimbulkan cukup mengganggu kesehatan (Ciccia, 2000).
3
Penelitian tentang senyawa bioaktif antimalaria ini telah banyak dilakukan
sebelumnya. Seperti senyawa aktif antimalaria Actinomycetes yang diperoleh dari spons genus Salinispora di perairan New Guinea dan bagian timur Papua
Indonesia diidentifikasi sebagai senyawa alkaloid (Prudhomme et al., 2008). Sebagian besar senyawa yang digunakan sebagai obat antimalaria ini berasal dari tumbuhan. Namun, penggunaan obat antimalaria yang tersedia saat ini mengalami kendala karena adanya resistensi parasit malaria, sehingga angka kematian yang disebabkan penyakit ini tetaplah tinggi. Hal ini tentunya mendorong peneliti lain untuk terus mencari senyawa aktif antimalaria baru baik dari tumbuhan maupun hasil sintesis untuk menggantikan obat antimalaria yang sudah tidak efektif lagi (Adriana, 2009).
Salah satu usaha untuk menemukan obat antimalaria baru yaitu melalui sintesis senyawa kompleks logam. Ion logam dapat mempercepat kerja suatu obat. Khasiatnya diketahui meningkat karena adanya koordinasi dengan ion logam (Klofutar et al., 1975). Bahkan, ahli kimia koordinasi anorganik berupaya untuk menemukan dan mengembangkan penelitian obat yang lebih baik untuk melawan penyakit malaria yang berasal dari kompleks logam (Wasi and Singh, 1987). Sekarang ini, ilmu bioanorganikmetalik telah banyak dikembangkan di bidang biologi, kedokteran, dan molekular bioteknologi terutama organologam. Seperti benzimidazol (BZN) dan turunannya yang merupakan senyawa penting di bidang kimia farmasi dan obat-obatan (Boiani and Gonzalez., 2005).
Menurut Thompson (1974), beberapa senyawa kompleks logam yang aktif sebagai antitumor dan antikanker, juga diharapkan memiliki aktivitas yang baik
4
sebagai antimalaria. Banyak penelitian yang telah berhasil mensintesis senyawa antimalaria dari kompleks logam. Beberapa obat antimalaria yang telah berhasil disintesis dari kompleks logam seperti 4-aminoquinolin (kloroquin, CQ), quinolin amino-alkohol (mefloquin, kina), dan turunannya artemisinin. CQ (kloroquin) merupakan obat antimalaria yang paling banyak digunakan selama beberapa tahun terakhir namun khasiatnya kini terancam oleh penyebaran resistensi terutama untuk P. falciparum (Bloland et al., 1993). Selain senyawa-senyawa tersebut, banyak senyawa organologam lain yang juga dapat disintesis dan digunakan sebagai antimalaria. Salah satu contoh senyawa organologam yang sering digunakan adalah senyawa organotimah(IV) benzoat. Penggunaan senyawa organotimah tersebut didasarkan pada ketersediaannya yang melimpah di dunia (Singh et al., 2010). Jika ditinjau dari cadangan timah dunia, Indonesia
menempati urutan keempat setelah Cina, Bolivia, dan Peru sedangkan jika ditinjau dari potensi ekspor, Indonesia menduduki peringkat kedua terbesar setelah Cina sebagai penghasil timah (Nurtia, 2011).
Pada penelitian terbaru menunjukkan bahwa senyawa organotimah memiliki aktivitas biologi sebagai insektisida terhadap nyamuk Anopheles penyebab penyakit malaria (Hansch and Rajeshwar, 2008) dan sebagai agen antimalaria (Awang et al.,2014). Menurut Pellie et al., (2006), sintesis senyawa timah(IV) ditiokarbamat menunjukkan aktivitas sebagai antimalaria. Oleh karena itu, pada penelitian ini dilakukan sintesis senyawa organotimah(IV) benzoat seperti senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat untuk diuji aktivitas biologi senyawa tersebut terhadap parasit penyebab penyakit malaria P.
5
Senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat merupakan turunan organtimah yang dapat disintesis melalui senyawa awal trifeniltimah(IV) hidroksida dan difeniltimah(IV) dihidroksida dengan ligan asam benzoat. Kedua senyawa awal tersebut diperoleh dari sintesis senyawa organotimah(IV) halida. Senyawa hasil sintesis kemudian dikarakterisasi menggunakan spektrofotometer IR, UV-Vis, NMR, dan microelemental analyzer serta dilakukan uji bioaktivitas antimalaria terhadap parasit P. falciparum secara in vitro. Dengan demikian diharapkan senyawa hasil sintesis tersebut memiliki bioaktivitas yang baik terhadap antimalaria, sehingga dapat digunakan sebagai obat antimalaria guna mengurangi penyebaran penyakit malaria.
B. Tujuan Penelitian
Tujuan dari dilakukannya penelitian ini adalah sebagai berikut :
1. Mensintesis senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat
2. Melakukan karakterisasi terhadap senyawa hasil sintesis untuk mengetahui telah terbentuk senyawa kompleks dengan membandingkan karakterisasi senyawa awal dan ligan.
3. Melakukan uji pendahuluan dan membandingkan sifat bioaktivitas antimalaria dari senyawa kompleks yang disintesis terhadap parasit P.
6
C. Manfaat Penelitian
Manfaat dari dilakukannya penelitian ini adalah sebagai uji pendahuluan bioaktivitas antimalaria senyawa turunan organotimah secara in vitro terhadap parasit P. falciparum.
8
II. TINJAUAN PUSTAKA
A. Senyawa Organologam
Senyawa organologam merupakan senyawa yang setidaknya mengandung satu atom karbon dari gugus organik yang berikatan langsung dengan logam. Sebagai
contoh suatu alkoksida seperti Ti(C3H7O)4 bukan termasuk senyawa organologam,
karena gugus organiknya terikat pada Ti melalui atom oksigen sedangkan
senyawa (C6H5)Ti(OC3H7)3 adalah termasuk senyawa organologam, karena
terdapat ikatan langsung antara karbon C dari gugus fenil dengan logam Ti. Dari bentuk ikatan pada senyawa organologam, senyawa ini dapat dikatakan sebagai jembatan antara kimia organik dan anorganik.
Pada umumnya, sifat dari senyawa organologam yakni adanya atom karbon yang bersifat lebih elektronegatif dari logam yang dimilikinya. Beberapa
kecenderungan jenis ikatan yang terbentuk dari senyawa organologam yaitu :
1. Senyawaan ionik dari logam elektropositif
Pada umumnya senyawaan organologam yang relatif sangat elektropositif bersifat ionik, tidak larut dalam pelarut organik, dan terhadap udara dan air sangat reaktif. Senyawa ini akan terbentuk jika radikal pada logam terikat pada logam dengan keelektropositifan yang sangat tinggi, contohnya logam pada alkali atau alkali
8
tanah. Kereaktifan dan kestabilan senyawaan ionik ditentukan dari satu bagian yakni oleh kestabilan ion karbon. Delokalisasi elektron yang memperkuat kestabilan dari garam logam ion-ion karbon agar lebih stabil walaupun masih relatif reaktif. Contohnya gugus dari senyawa organik dalam garam-garam seperti (C5H5)2Ca2+.
2. Senyawa yang memiliki ikatan –σ (sigma)
Senyawaan dari organologam dimana sisa organiknya yang terikat pada suatu atom logam dengan suatu ikatan dapat digolongkan sebagai ikatan kovalen (masih terdapat karakter-karakter ionik dari senyawaan ini). Ikatan tersebut dibentuk oleh kebanyakan logam dengan keelektropositifan yang relatif lebih kecil dari
golongan pertama, yang dipengaruhi oleh beberapa faktor berikut ini
a. Kemungkinan penggunaan orbital d yang lebih tinggi, contohnya pada SiR4
yang tidak tampak dalam CR4
b. Kemampuan donor dari aril atau alkil dengan pasangan elektron menyendiri c. Keasaman dari asam lewis sehubungan dengan kulit valensi yang tidak terisi
penuh, contohnya pada BR2 atau koordinasi yang tidak jenuh seperti ZnR4
d. Pengaruh dari perbedaan keelektronegatifan dari ikatan logam-karbon (M-C) atau ikatan karbon-karbon (C-C).
3. Senyawaan yang terikat nonklasik
Banyak senyawaan organologam terdapat jenis ikatan logam pada karbon yang tidak dapat dijelaskan dalam bentuk pasangan elektron/kovalen atau ionik. Contohnya, dari golongan alkali yang terdiri dari Li, Be, dan Al yang memiliki gugus alkil berjembatan. Dalam hal ini, atom ada yang memiliki sifat kekurangan
9
elektron contohnya pada atom boron pada B(CH3)3. Pada atom B termasuk
golongan IIIA, yang memiliki 3 elektron valensi, sehingga cukup sulit untuk membentuk oktet pada konfigurasi dalam senyawaannya. Pada atom B ada kecenderungan untuk memanfaatkan orbital-orbital kosong yakni dengan
menggabungkannya pada gugus suatu senyawa yang memiliki kelebihan pasangan elektron yang menyendiri senyawa ini dibagi menjadi dua golongan yaitu :
1. Senyawa organologam yang terbentuk diantara logam-logam transisi dengan alkuna, alkena, benzen, dan senyawa organik yang bersifat tak jenuh lainnya. 2. Senyawa organologam yang terdapat gugus-gugus alkil berjembatan
(Cotton dan Wilkinson, 2007).
B. Timah
Timah merupakan salah satu unsur yang berlimpah pada kerak Bumi. Dalam sistem periodik, timah merupakan unsur dengan lambang Sn yang berada pada golongan IVA . Senyawaan timah ditemukan di lingkungan dengan keadaan oksidasi +2 atau +4. Namun, bentuk trivalen tidak stabil sehingga senyawa
stannous (SnX2) yang berupa timah bivalen dan senyawa stannic (SnX4) yang berupa timah tetravalen merupakan dua jenis utama timah. Anionik stannite dan
stannate tidak larut dalam air dan stabil dibandingkan kationik Sn2+ dan Sn4+ (Bakirdere, 2013).
Timah menunjukkan kemiripan sifat kimia dengan Ge dan Pb seperti
pembentukan keadaan oksidasi +2 dan +4. Timah dalam bentuk senyawaannya memiliki tingkat oksidsasi +2 dan +4. Tingkat oksidasi +4 lebih stabil daripada +2, karena pada tingkat oksidasi +4 timah menggunakan seluruh elektron
10
valensinya yaitu 5s2 5p2 dalam ikatan sedangkan pada tingkat oksidasi +2, timah
hanya menggunakan elektron valensi 5p2 saja. Sebagai anggota dalam golongan
IVA, struktur geometri SnCl4 telah dikarakterisasi ialah tetrahedral seperti CCl4.
Pada suhu ruang, keduanya merupakan cairan tidak berwarna dengan titik didih
masing-masing 114oC dan 77oC (pada tekanan atmosfer). Namun di luar keadaan
tersebut, keduanya menunjukkan sifat yang cukup berbeda. Perbedaan tersebut dapat dijelaskan karena ukuran atom Sn lebih besar dibandingkan atom C dan dimilikinya orbital 5d pada atom Sn. Kedua faktor tersebut, membuat Sn
memungkinkan untuk “berikatan lebih” (ekstra koordinasi) dengan ligan-ligannya. Dalam hal tersebut, timah memiliki fleksibilitas valensi yang lebih besar, yaitu memiliki bilangan koordinasi yang dapat lebih dari empat (Cotton dan Wilkinson, 2007).
Timah memiliki tiga bentuk alotrop, yaitu timah abu-abu (a), timah putih (ß), dan timah rombik (γ). Pada suhu ruang, timah lebih labil sebagai logam timah putih (- Sn) dalam bentuk tetragonal sedangkan pada suhu rendah, timah putih berubah menjadi timah abu-abu (-Sn) berbentuk intan kubik berupa nonlogam. Perubahan ini terjadi dengan cepat karena timah membentuk oksida film. Peristiwa ini dikenal sebagai plak hitam atau timah plague. Timah putih mempunyai densitas yang lebih tinggi daripada timah abu-abu (Petrucci, 1999). Menurut Davies (2004), timah memainkan peran penuh dalam peningkatan aktivitas yang tinggi dalam kimia organologam yang mulai dikenal pada tahun 1949.
11
C. Senyawa Organotimah
Senyawa organotimah adalah senyawa-senyawa yang mengandung sedikitnya satu ikatan kovalen C-Sn. Sebagian besar senyawa organotimah dapat dianggap
sebagai turunan dari RnSn(IV)X4-n (n=1-4) dan diklasifikasikan sebagai mono-,
di-, tri- dan tetra- organotimah(IV), tergantung pada jumlah gugus alkil (R) atau aril (Ar) yang terikat. Anion yang terikat (X) biasanya adalah klorida, fluorida, oksida, hidroksida, suatu karboksilat atau suatu thiolat (Pellerito and Nagy, 2002). Senyawa organotimah telah dikenal sejak tahun 1850. Aplikasi komersial
organotimah sebagai PVC stabilizer dikenalkan pada tahun 1940. Gugus organik yang paling umum berikatan dengan timah adalah metil, butil, oktil, fenil, dan sikloheksil (Davies, 2004).
Senyawa organotimah merupakan monomer yang dapat membentuk
makromolekul stabil, padatan, dan cairan yang sangat mudah menguap dan tidak berwarna serta stabil terhadap hidrolisis dan oksidasi. Kecenderungan terhidrolisis dari senyawa organotimah lebih lemah dibandingkan senyawa Si atau Ge yang terkait dan ikatan Sn-O dapat bereaksi dengan larutan asam. Senyawa
organotimah tahan terhadap hidrolisis atau oksidasi pada kondisi normal
walaupun dibakar menjadi SnO2, CO2, dan H2O. Kemudahan putusnya ikatan Sn-
C oleh halogen atau reagen lainnya bervariasi berdasarkan gugus organiknya dan urutannya meningkat dengan urutan :
Butil (paling stabil) < propil < etil < metal < vinil < fenil < benzil < alil < CH2CN
12
Kereaktifan senyawa organotimah(II) tinggi seperti dialkil timah dan diaril timah sederhana yaitu mengalami polimerisasi yang cepat. Kondisi ini dapat ditemukan pada senyawa organotimah yang memilki kestabilan divalen kemungkinan besar pada senyawa organik, bentuk adduct dengan basa Lewis atau pasangan
menyendiri Sn terkoordinasi. Pada asam Lewis yang sesuai, perbedaan bilangan koordinasi dan geometri juga mungkin terjadi pada senyawa organotimah(II) pada
penggunaan orbital 5d, yaitu bentuk trigonal planar (hibridisasi sp2), tetrahedral
(sp3), trigonal bipiramida (sp3d), dan oktahedral (sp3d2) (Van der Weij, 1981).
D. Turunan Senyawa Organotimah
Menurut Wilkinson (1982), ada tiga macam turunan senyawa organotimah yaitu
1. Senyawa Organotimah Halida
Senyawa organotimah halida memilki rumus umum RnSnX4-n (n = 1-3; X = Cl,
Br, I) yang pada umumnya berbentuk padatan kristalin dan sangat reaktif. Senyawa organotimah halida ini dapat disintesis secara langsung melalui reaksi logam timah baik Sn (II) atau Sn (IV) dengan alkil halida yang reaktif. Metode ini secara luas digunakan untuk pembuatan dialkiltimah dihalida. Sintesis ini ditinjau ulang oleh Murphy dan Poller melalui persamaan reaksi berikut
2 EtI + Sn Et2Sn + I2
Metode lain yang sering digunakan untuk pembuatan organotimah halida adalah reaksi disproporsionasi tetraalkiltimah dangan timah(IV) klorida. Caranya adalah dengan mengubah perbandingan material awal, seperti ditunjukkan pada
13
3 R4Sn + SnCl4 4R3SnCl
R4Sn + SnCl4 2R2SnCl2
Senyawa organotimah klorida digunakan sebagai kloridanya dengan memakai logam halida lain yang sesuai seperti ditunjukkan pada persamaan reaksi berikut
RnSnCl4-n + (4-n) MX RnSnX4-n + (4-n) MCl
(X = F, Br atau I; M = K, Na, NH4+) (Wilkinson, 1982).
2. Senyawa Organotimah Hidroksida dan Oksida
Senyawa organotimah hidroksida dan oksida yang digunakan dalam penelitian ini adalah senyawa trifeniltimah(IV) hidroksida dan difeniltimah(IV) dihidroksida. Senyawa tersebut berperan sebagai material awal yang direaksikan dengan asam karboksilat untuk menghasilkan senyawa trifeniltimah(IV) benzoat dan
difeniltimah(IV) dibenzoat. Struktur dari kedua senyawa awal ini dapat dilihat pada Gambar 1 dan 2 berikut
Gambar 1. Trifeniltimah(IV) hidroksida
14
3. Senyawa Organotimah Karboksilat
Senyawa organotimah karboksilat pada umumnya dapat disintesis melalui dua cara yaitu dari organotimah oksida atau organotimah hidroksidanya dengan asam karboksilat, dan dari organotimah halidanya dengan garam karboksilat. Asam karboksilat yang sering digunakan adalah asam benzoat. Struktur asam benzoat dapat dilihat pada Gambar 3 berikut
Gambar 3. Asam Benzoat
Metode yang biasa digunakan untuk sintesis organotimah karboksilat adalah dengan menggunakan organotimah halida sebagai material awal. Organotimah halida direaksikan dengan garam karboksilat dalam pelarut yang sesuai, biasanya aseton atau karbon tetraklorida. Reaksi yang terjadi dapat dilihat pada persamaan berikut :
RnSnCl4-n + (4-n) MOCOR RnSn(OCOR)4-n
Reaksi esterifikasi dari asam karboksilat dengan organotimah oksida atau hidroksida dilakukan melalui dehidrasi azeotropik dari reaktan dalam toluena, seperti ditunjukkan pada persamaan reaksi berikut ini :
R2SnO + 2 R’COOH R2Sn(OCOR’)2 + H2O
R3SnOH + R’COOH R3SnOCOR’ + H2O
15
E. Aplikasi Senyawa Organotimah
Senyawa organotimah memiliki aplikasi yang luas dalam kehidupan sehari-hari. Aplikasi senyawa organotimah dalam industri antara lain sebagai senyawa
stabilizer polivinilklorida, pestisida nonsistematik, katalis antioksidan, antifouling agents dalam cat, stabilizer pada plastic dan karet sintetik, stabilizer untuk
parfum, dan berbagai macam peralatan yang berhubungan dengan medis dan gigi (Pellerito dan Nagy, 2002).
Mono dan diorganotimah digunakan secara luas sebagai stabilizer polivinilklorida untuk mengurangi degradasi polimer polivinilklorida tersebut. Empat tipe utama penstabil timah berdasarkan gugus alkilnya yaitu: oktil, butil, fenil, dan metil. Dimana oktiltimah memiliki kandungan timah paling sedikit, paling kurang efisien. Ligan-ligan utama yang digunakan untuk membedakan berbagai penstabil timah yaitu asam tioglikolat ester dan asam karboksilat.
Senyawa organotimah yang paling umum digunakan sebagai katalis dalam sintesis kimia yaitu katalis mono dan diorganotimah. Senyawa organotimah merupakan katalis yang bersifat homogen yang baik untuk pembuatan polisilikon, poliuretan, dan untuk sintesis poliester. Senyawa organotimah ditemukan
berikutnya antara lain sebagai biocide (senyawa yang mudah terdegradasi), sebagai pestisida yang pertama kali diperkenalkan di Jerman yaitu dari senyawa trifeniltimah asetat pada akhir 1950-an. Kegunaan yang utama dari agrokimia senyawa organotimah karena senyawa ini relatif memiliki fitotoksisitas (daya racun pada tanaman) yang rendah dan terdegradasi dengan cepat sehingga residunya tidak berbahaya terhadap lingkungan (Cotton dan Wilkinson, 2007 ).
16
Senyawa organotimah(IV) telah diketahui memiliki aktivitas biologis yang kuat. Sebagian besar senyawa organotimah(IV) bersifat toksik walaupun pada
konsentrasi rendah. Aktivitas biologi ini ditentukan oleh jumlah gugus organik yang terikat pada pusat atom Sn. Senyawa organotimah karboksilat diberikan perhatian khusus dikarenakan senyawa ini memiliki kemampuan biologi yang kuat dibandingkan senyawa organotimah lainnya (Mahmood et al., 2003 dan Pellerito and Nagy, 2002).
Senyawa organotimah memiliki rentang aplikasi yang luas dan merupakan salah satu bahan kimia organologam yang paling banyak digunakan. Senyawa
organotimah menunjukkan aktifitas biologis yang signifikan ( Kang et al., 2009). Senyawa-senyawa organotimah karboksilat tersebut telah diketahui menunjukkan aktivitas biologis sebagai antibakteri ( Maiti et al., 1988) dan antitumor (Mohan et
al., 1988; Hadi et al., 2012; dan Hadi and Rilyanti, 2010). Penelitian terbaru
menunjukkan bahwa senyawa organotimah juga memiliki aktivitas biologi sebagai insektisida terhadap nyamuk Anopheles penyebab penyakit malaria (Hansch and Rajeshwar, 2008), dan sebagai antimalaria (Awang et al., 2014 ; dan Pellie et al., 2006).
F. Analisis Senyawa Organotimah
Pada penelitian ini, senyawa hasil yang diperoleh dianalisis dengan menggunakan spektrofotometer IR, UV-Vis, NMR, dan microelemental analyzer.
1. Analisis Spektrofotometer IR
17
untuk menganalisis suatu senyawa kimia. Dalam menganalisis suatu senyawa, spektrofotometer IR dapat memberikan informasi tentang adanya suatu gugus fungsi dengan mengukur daerah penyerapan radiasi inframerah pada berbagai panjang gelombang. Dalam spektroskopi tersebut, frekuensi dinyatakan dengan bilangan gelombang (wavenumber) (Fessenden dan Fessenden, 1986). Selain itu, spektra inframerah suatu senyawa dapat memberikan gambaran dari struktur molekul senyawa tersebut. Spektra IR dapat dihasilkan dengan mengukur absorpsi radiasi, refleksi atau emisi di daerah IR. Semua atom di dalam molekul bervibrasi antara satu dengan yang lainnya pada temperatur di atas temperatur nol absolut. Ketika frekuensi vibrasi spesifik sama dengan frekuensi radiasi
inframerah yang mengenai langsung pada molekul, molekul tersebut akan menyerap radiasi.
Syarat suatu gugus fungsi dalam suatu senyawa dapat terukur pada spektra IR adalah adanya perbedaan momen dipol pada gugus tersebut. Vibrasi ikatan akan menimbulkan fluktuasi momen dipol yang menghasilkan gelombang listrik. Untuk pengukuran menggunakan IR biasanya berada pada daerah bilangan
gelombang 400-4500 cm-1. Daerah pada bilangan gelombang ini disebut daerah
IR sedang, dan merupakan daerah optimum untuk penyerapan sinar IR bagi ikatan-ikatan dalam senyawa organik (Harjono, 1992).
Dalam sintesis suatu senyawa organotimah(IV) reaksi dapat dilihat dari perubahan spektrum IR dari senyawa awal, ligan, dan senyawa akhir. Daerah yang menjadi fokus perhatian dalam spektrumnya adalah munculnya puncak karbonil dari senyawa akhir yang menunjukkan telah terjadinya reaksi dari senyawa awal
18
dengan ligan asam karboksilat. Beberapa serapan IR untuk senyawa asam karboksilat dapat dilihat pada Tabel 1.
Tabel 1. Serapan IR untuk beberapa asam-asam karboksilat
Tipe Getaran Posisi Serapan
cm-1 Μm
Uluran O–H 2860-3300 3,0 – 3,5
Uluran C=O 1700-1725 5,8 – 5,88
Uluran C–O 1210-1330 7,5 – 8,26
Tekukan O–H 1300-1440 6,94 – 7,71
Tekukan O–H dimer ~925 ~10,8
(Fessenden dan Fessenden, 1986).
2. Analisis Spektrofotometer UV-Vis
Spektrofotometer UV-Vis merupakan alat yang digunakan untuk menganalisis suatu senyawa didasarkan pada transisi elektronik yang dialami senyawa tersebut sebagai akibat penyerapan radiasi sinar Ultra Violet (200-380 nm) dan visible (380-780 nm) oleh senyawa yang dianalisis transisi elektronik dapat terjadi dari tingkat energi keadaan dasar ke tingkat energi pada keadaan eksitasi. Karena perbedaan energi dari berbagai transisi elektronik tersebut hanya berbeda sedikit, maka panjang gelombang absorpsinya juga berbeda sedikit dan menimbulkan pita lebar yang tampak dalam spektrum. Spektrum UV maupun visible terdiri dari pita absorbsi, lebar pada daerah panjang gelombang yang lebar. Hal ini disebabkan terbaginya keadaan dasar dan keadaan eksitasi sebuah molekul dalam subtingkat- subtingkat rotasi dan vibrasi.
Panjang gelombang serapan merupakan ukuran perbedaan tingkat-tingkat energi dari orbital-orbital. Agar elektron dalam ikatan sigma tereksitasi maka diperlukan energi paling tinggi dan akan memberikan serapan pada 120-200 nm
19
(1 nm=10-7cm=10 Å). Daerah ini dikenal sebagai daerah ultraviolet hampa, karena
pada pengukuran tidak boleh ada udara, sehingga sukar dilakukan dan relatif tidak banyak memberikan keterangan untuk penentuan struktur. Identifikasi kualitatif senyawa organik dalam daerah ini jauh lebih terbatas daripada dalam daerah inframerah, dikarenakan pita serapan pada daerah UV-Vis subtingkat subtingkat terlalu lebar dan kurang terperinci. Tetapi gugus-gugus fungsional tertentu seperti karbonil, nitro, dan sistem tergabung menunjukkan puncak karakteristik dan dapat diperoleh informasi yang berguna mengenai ada tidaknya gugus tersebut dalam suatu molekul (Day dan Underwood, 1998).
3. Analisis Spektrofotometer NMR (Nuclear Magnetic Resonance)
Spektrofotometri NMR (Nuclear Magnetic Resonance) merupakan salah satu cara analisis yang berhubungan dengan sifat magnit dari inti atom. Alat ini
mempelajari tentang molekul senyawa organik maupun anorganik yang dianalisis secara spektrofotometri resonansi magnit inti sehingga diperoleh gambaran perbedaan sifat magnit dari berbagai inti yang ada dan untuk menduga letak inti yang terdapat dalam suatu molekul (Sudjadi, 1985).
Pada umumnya, karakterisasi yang sering digunakan dalam spektrofotometri NMR
adalah NMR jenis 1H NMR, 13C NMR. Karakterisasi menggunakan 1H NMR, 13C
NMR telah menjadi alat yang paling efektif untuk menentukan struktur semua
jenis senyawa. Pergeseran kimia dapat dianggap sebagai ciri bagian tertentu struktur. Misalnya, pergeseran kimia proton dalam gugus metil sekitar 1 ppm apapun struktur bagian lainnya. Pada intensitas sinyal terintegrasi sebanding dengan jumlah inti yang relevan dengan sinyalnya. Hal ini akan sangat membantu
20
dalam penentuan struktur, bahkan bila 1H NMR, pergeseran kimia adalah satu-
satunya informasi yang dihasilkan oleh spektroskopi NMR, nilai informasi dalam penentuan struktural senyawa organik sangat besar maknanya. Selain itu,
spektroskopi NMR dapat memberikan informasi tambahan yakni informasi yang terkait dengan kopling spin-spin (Takeuchi, 2006).
4. Analisis Microelemental Analyzer
Dalam suatu analisis kimia, menentukan kandungan unsur penyusun dalam suatu senyawa dapat dilakukan dengan menggunakan alat microelemental analyzer. Unsur yang umum ditentukan adalah karbon (C), hidrogen (H), nitrogen (N), dan sulfur (S). Sehingga alat yang biasanya digunakan untuk tujuan mikroanalisis ini dikenal sebagai CHNS microelemental analyzer. Hasil yang diperoleh dari mikroanalisis ini dibandingkan dengan perhitungan secara teori. Walaupun seringnya hasil yang diperoleh berbeda, perbedaan biasanya antara 1–2%, namun analisis ini tetap sangat bermanfaat untuk mengetahui kemurnian suatu sampel (Costecsh Analytical Technologies, 2011).
G. Senyawa Aktif Antimalaria
Antimalaria merupakan salah satu kemampuan suatu senyawa dalam menghambat pertumbuhan parasit malaria. Penggunaan senyawa yang memiliki sifat aktif sebagai antimalaria tentunya dapat mengurangi penyebaran penyakit malaria. Senyawa yang memiliki sifat aktif sebagai antimalaria tersebut telah berhasil disintesis oleh para peneliti baik yang berasal dari alam maupun dari senyawa kompleks logam dan telah menjadi obat yang mampu mengurangi penyebaran
21
penyakit malaria. Contoh senyawa alam yang aktif sebagai antimalaria adalah
Actinomycetes yang telah berhasil disintesis dari spons genus Salinispora dan
diidentifikasi sebagai senyawa alkaloid (Prudhomme et al., 2008).
Selain terus berupaya untuk menemukan senyawa aktif antimalaria yang berasal dari alam, banyak peneliti kimia koordinasi anorganik yang juga berupaya untuk menemukan senyawa aktif antimalaria yang berasal dari kompleks logam (Wasi and Singh, 1987). Adanya senyawa kompleks logam dalam obat dapat
mempercepat kerja suatu obat karena akan terjadi ikatan koordinasi dengan ion logam (Klofutar et al., 1975). Contoh senyawa kompleks logam yang telah banyak digunakan sebagai obat antimalaria adalah klorokuin dan quinolin. Struktur dari senyawa klorokuin dapat dilihat seperti pada Gambar 4 berikut ini :
Gambar 4. Struktur klorokuin (Sherlyleo, 2012)
Mekanisme penghambatan obat-obat tersebut terhadap penyakit malaria didasarkan pada kemampuan obat ini untuk membentuk kompleks yang kuat dengan hematin dan menghambat pembentukan hemozoin yang terakumulasi pada vakuola pencernaan parasit malaria. Sehingga parasit tersebut tidak dapat
menerima makanan dan akan mati (Tilley et al., 2001). Namun keberdaaan obat- obat ini terancam karena adanya resistensi dari parasit malaria terutama untuk parasit P. falciparum ( Bloland et al., 1993). Selain senyawa kompleks tersebut,
22
senyawa kompleks organologam yang terkenal sebagai obat antimalaria adalah ferroquin yang juga dapat digolongkan ke dalam sisi lateral rantai klorokuin. Ferroquin dan turunannya menunjukkan aktivitas antimalaria yang tinggi dan masih dalam masa uji klinis lebih lanjut (Supan et al., 2012).
Keefektifan sebagai antimalaria dapat ditentukan berdasarkan nilai 50 inhibitor
concentration (IC50). Nilai IC50 didefiniskan sebagai konsentrasi dari senyawa yang menghasilkan penghambatan 50%. Data konsentrasi dapat dihitung secara
regresi linier, dengan menggunakan nilai IC50. Nilai IC50 inilah yang menentukan
potensial atau tidaknya suatu senyawa sebagai antimalaria. Dalam upaya
penemuan obat antimalaria yang lebih efetif, klorokuin yang telah dikenal sebagai obat antimalaria sering digunakan sebagai kontrol positif untuk membandingkan sifat antimalaria senyawa baru dengan klorokuin. Apabila suatu senyawa memiliki
nilai IC50 lebih besar dari nilai IC50 klorokuin, maka senyawa tersebut dikatakan
kurang potensial sebagai antimalaria. Namun apabila nilai IC50 suatu senyawa
lebih kecil dari nilai IC50 klorokuin, maka dapat dikatakan senyawa tersebut
potensial sebagai antimalaria. Selain itu, kemampuan antimalaria suatu senyawa
ditentukan oleh nilai IC50 yang dapat dilihat pada Tabel 3 berikut ini:
Tabel 2. Data Sifat Antimalaria
Nilai IC50 Sifat Antimalaria
<5 μg/mL Sangat aktif
5 μg/mL- 50 μg/mL Aktif
50 μg/mL – 100 μg/mL Kurang aktif
>100 μg/mL Tidak aktif
23
H. Mekanisme Obat Antimalaria
Klorokuin merupakan obat antimalaria yang paling luas penggunaannya karena mudah diperoleh, murah, dan sedikit memiliki efek samping . Selama ini klorokuin merupakan obat pilihan utama (first line drug) untuk pengobatan malaria tanpa komplikasi. Efek samping yang ditemukan adalah ringan seperti pusing,vertigo, diplopia, mual, muntah, dan sakit perut. Namun pemberantasan malaria falciparum menghadapi kendala yang serius sejak ditemukan kasus resistensi P. falciparum terhadap klorokuin di Kalimantan Timur pada tahun 1974. Resistensi ini terus meluas dan pada tahun 1996. Kasus-kasus malaria yang resisten terhadap klorokuin sudah ditemukan diseluruh provinsi di Indonesia. Berdasarkan pedoman WHO, bila ditemukan resistensi Plasmodium terhadap klorokuin di suatu daerah > 25%, maka dianjurkan untuk tidak lagi
menggunakannya sebagai antimalaria, kecuali dikombinasi dengan antimalaria lain (Acang, 2002).
Efektifitas kerja klorokuin terbatas pada saat parasit malaria berada dalam tahap eritrositik. Beberapa fakta menunjukkan bahwa klorokuin bekerja di dalam vakuola makanan (FV) dari parasit (Ginsburg et al., 1998 dan Ginsburg et al., 1999). Degradasi hemoglobin pada vakuola makanan (FV) menghasilkan heme sebagai produk. Pada parasit terdapat enzim yang penting seperti aspartic protease dikenal dengan plasmepsin yang secara in vitro maupun in vivo berperan untuk menginisiasi degradasi hemoglobin (Liu et al., 2005 dan Kublin et al., 2003). Klorokuin bekerja dengan mengikat cincin feriprotoporfirin IX suatu hematin yang merupakan hasil metabolisme hemoglobin didalam parasit. Ikatan kompleks
24
feriprotofirin IX dengan klorokuin ini bersifat melisiskan membran parasit sehingga mati (Kublin et al., 2003). Konsentrasi sitotoksik dari klorokuin pada vakuola pencernaan juga dapat menghambat pembentukan hemozoin pada eritrosit sehingga parasit tersebut tidak dapat menerima makanan dan akan mati (Yayon et al., 1984). Mekanisme kerja dari senyawa klorokuin ini, dapat dijadikan acuan untuk mengetahui mekanisme kerja obat antimalaria lainnya. Karena umumnya setiap obat antimalaria memiliki mekanisme kerja yang mirip atau hampir sama dengan senyawa klorokuin.
I. Malaria
Malaria adalah penyakit yang disebabkan oleh parasit yang disebut Plasmodium, yang ditularkan melalui gigitan nyamuk yang terinfeksi Plasmodium. Dalam tubuh manusia Plasmodium berkembang biak dihati, kemudian menginfeksi sel- sel darah merah. Mengacu dari pernyataan tersebut, malaria sebagai penyakit infeksi menular yang disebabkan oleh parasit dari genus Plasmodium, yang ditularkan melalui gigitan nyamuk Anopheles dengan gejala penyakit berupa demam yang terjadi secara periodik, anemia, pembesaran limpa, dan berbagai gejala lainnya yang dikarenakan pengaruh parasit ini pada beberapa organ tubuh misalnya otak, hati, dan ginjal (WHO, 2009).
Tumbuh dan menyebarnya resistensi terhadap semua obat antimalaria yang dipakai pada pengobatan dan pencegahan malaria telah menimbulkan banyak masalah pada program penanggulangan malaria. Seiring dengan belum
berhasilnya upaya untuk menemukan vaksin malaria yang ideal, maka aktivitas riset yang bertujuan untuk mengidentifikasi target intervensi kemoterapi dan
25
penemuan obat baru menjadi tujuan utama dalam upaya penanggulangan malaria. Hal ini yang menyebabkan pencarian senyawa baru sebagai obat antimalaria baik dari bahan alam maupun hasil sintetis terus dilakukan (Burke, 2003 dan
Sjafruddin, 2004)
J. Parasit Malaria
Penyakit malaria disebabkan oleh protozoa terdiri dari empat jenis spesies yaitu P.
vivax menyebabkan malaria tertiana, P. malariae menyebabkan malaria quartana, P. falciparum menyebabkan malaria tropika dan P. ovale menyebabkan malaria
ovale (Soemirat, 2009). Dari keempat jenis parasit malaria tersebut, parasit jenis
P. falciparum merupakan penyebab infeksi terberat bahkan dapat menyebabkan
kematian (Harijanto dkk., 2010). Infeksi P. falciparum dapat menyebabkan malaria serebral yang selanjutnya dapat mengakibatkan kebingungan mental, kejang, dan koma. Prognosis untuk infeksi P. falciparum lebih buruk dan dapat berakhir dengan kematian dalam 24 jam sekiranya tidak ditangani dengan cepat dan tepat (Medical Disability Guidelines, 2009).
K. Parasit Plasmodium
Parasit malaria (plasmodium) mempunyai dua siklus daur hidup, yaitu pada tubuh manusia dan didalam tubuh nyamuk Anopheles betina (Soedarto, 2011). Siklus yang terjadi pada tubuh manusia disebut siklus skizogoni (siklus aseksual) dan siklus yang terjadi pada tubuh nyamuk disebut siklus sporogoni (siklus seksual).
26
1. Siklus Plasmodium didalam Tubuh Manusia
Pada waktu nyamuk Anopheles sp menghisap darah manusia, sporozoit yang berada dalam kelenjar ludah nyamuk Anopheles masuk kedalam aliran darah selama lebih kurang 30 menit. Setelah itu sporozoit tersebut menuju ke hati dan menembus hepatosit, dan menjadi tropozoit. Kemudian berkembang menjadi skizon hati yang terdiri dari 10.000 sampai 30.000 merozoit hati. Siklus ini disebut siklus eksoeritrositik yang berlangsung selama 9-16 hari. Pada parasit
P.falciparum dan P.malariae siklus skizogoni berlangsung lebih cepat sedangkan
pada parasit P.vivax dan P.ovale siklus ada yang cepat dan ada yang lambat. Sebagian tropozoit hati tidak langsung berkembang menjadi skizon, akan tetapi ada yang menjadi bentuk dorman yang disebut bentuk hipnozoit. Bentuk hipnozoit dapat tinggal didalam sel hati selama berbulan-bulan bahkan sampai bertahun-tahun yang pada suatu saat bila penderita mengalami penurunan
imunitas tubuh, maka parasit menjadi aktif sehingga menimbulkan kekambuhan.
2. Siklus Plasmodium didalam Tubuh Nyamuk Anopheles sp.
Apabila nyamuk Anopheles betina menghisap darah yang mengandung gematosit, didalam tubuh nyamuk gematosit akan membesar ukurannya dan meninggalkan eritrosit. Pada tahap gematogenesis ini, mikrogamet akan mengalami eksflagelasi dan diikuti fertilasi makrogametosit. Sesudah terbentuknya ookinet, parasit menembus dinding sel midgut, dimana parasit berkembang menjadi ookista. Setelah ookista pecah, sporozoit akan memasuki homokel dan pindah menuju kelenjar ludah. Dengan kemampuan bergeraknya, sporozoit infektif segera menginvasi sel-sel dan keluar dari kelenjar ludah. Masa inkubasi adalah rentang
27
waktu sejak sporozoit masuk kedalam tubuh sampai timbulnya gejala klinis berupa demam. Lama masa inkubasi bervariasi tergantung spesies plasmodium. Masa prapaten adalah rentang waktu sejak sporozoit masuk sampai parasit dapat dideteksi dalam darah dengan pemeriksaan mikroskopik.
L. Nyamuk Anopheles sp
Malaria adalah penyakit infeksi yang ditularkan melalui gigitan nyamuk Anopheles sp. Di dunia, sedikitnya terdapat sekitar 20 spesies Anopheles yang menjadi penular malaria, 17 spesies diantaranya terdapat di Indonesia. Nyamuk penyebab malaria tersebut pada umumnya menggigit manusia pada malam hari, penularan akan lebih intensif terjadi di daerah dimana nyamuk dapat hidup dalam waktu lama (memungkinkan plasmodium dapat berkembang menjadi infektif di dalam tubuh nyamuk) dan nyamuk lebih menyukai darah manusia dibandingkan darah hewan. Klasifikasi nyamuk Anopheles sp secara umum seperti berikut ini
Kindom : Animalia Phylum : Arthropoda Class : Insecta Order : Diptera Family : Culicidae Tribe : Anophelini Genus : Anopheles
28
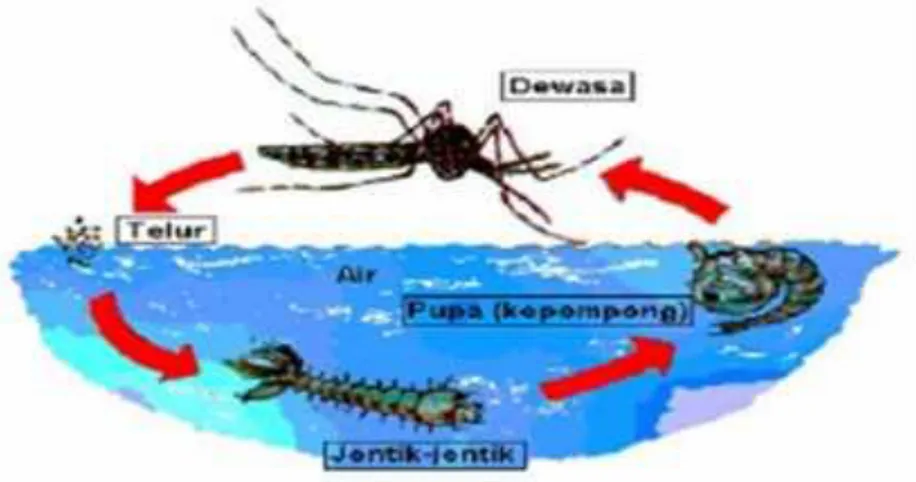
M. Siklus Hidup Nyamuk
Selama daur hidupnya (life cycle) terdapat empat stadium perkembangan nyamuk yaitu telur, larva, pupa, dan nyamuk dewasa (imago). Tiga stadium pertama, yaitu telur, larva dan pupa hidup didalam air (akuatik) berlangsung selama 5-14 hari (tergantung pada spesies dan suhu lingkungannya). Nyamuk dewasa betina di alam umumnya berumur kurang dari 2 minggu, namun nyamuk dewasa yang dipelihara dilaboratorium dapat hidup lebih dari satu bulan. Perkembangan nyamuk ini dapat dilihat seperti pada Gambar 5 berikut ini:
29
III. METODOLOGI PENELITIAN
A. Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Desember 2016 sampai April 2017 di Laboratorium Kimia Anorganik-Fisik, Jurusan Kimia, FMIPA, Universitas Lampung. Analisis senyawa menggunakan Spektrofotometer IR dilakukan di Laboratorium Instrumentasi FMIPA Terpadu Universitas Islam Indonesia. Analisis spektrofotometer UV-Vis di Laboratorium Kimia Anorganik-Fisik, FMIPA, Universitas Lampung. Analisis unsur menggunakan microelemental
analyzer dan spektrofotometer NMR dilakukan di School of Chemical and Food Technology, Universitas Kebangsaan Malaysia. Uji antimalaria/antiplasmodia
secara in vitro dilakukan di Institute of Tropical Disease, Universitas Airlangga.
B. Alat dan Bahan
Alat-alat yang digunakan dalam penelitian ini adalah alat-alat gelas dalam laboratorium, satu set alat refluks, neraca analitik, desikator, hot plate strirer, spektrofotometer IR (karakterisasi), spektrofotometer UV-Vis, spektrofotometer NMR dan microelementer analyzer.
30
Bahan - bahan yang digunakan dalam penelitian ini adalah senyawa
trifeniltimah(IV) hidroksida, difeniltimah(IV) dihidroksida, trifeniltimah(IV) klorida, difeniltimah(IV) diklorida, diklorometana, asam benzoat, DMSO, aquades, metanol, dan parasit P. falciparum.
C. Prosedur Penelitian
Prosedur untuk sintesis senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat yang digunakan dalam penelitian ini (Lampiran 1), didasarkan pada prosedur yang telah dilakukan sebelumnya (Hadi et al., 2009; Hadi and Rilyanti, 2010; Hadi et al., 2012) yang merupakan hasil adopsi dari prosedur yang
dilakukan oleh Szorcsik et al. (2002).
1. Sintesis Senyawa Awal Trifeniltimah(IV) hidroksida
Senyawa trifeniltimah(IV) klorida [(C6H5)3SnCl)] sebanyak 11,55 gram (0,03
mol) direaksikan dengan 1,2 gram NaOH (0,03 mol) (perbandingan mol 1:1) (Perhitungan dapat dilihat pada Lampiran 2). Gugus OH pada NaOH akan menggantikan gugus Cl untuk menjadi trifeniltimah(IV) hidroksida. Kedua senyawa dilarutkan dalam pelarut metanol 50 mL menggunakan hot plate stirrer
selama 1 jam pada suhu 60oC. Endapan yang dihasilkan disaring dengan kertas
saring Whattman No. 42 menggunakan corong Buchner dan dicuci dengan akuabides dan metanol. Setelah itu, endapan disimpan dalam desikator hingga
endapan mengering dan menghasilkan kristal [(C6H5)3SnOH)]. Hasil yang
diperoleh dikarakterisasi dengan spektrofotmeter IR, UV-Vis, dan microelemental
31
2. Sintesis Senyawa Awal Difeniltimah(IV) dihidroksida
Senyawa difeniltimah(IV) diklorida [(C6H5)2SnCl2)] sebanyak 15,48 gram (0,045
mol) direaksikan dengan NaOH 3,6 gram (0,09 mol) (perbandingan mol 1:2) (Perhitungan dapat dilihat pada Lampiran 2) dalam 50 mL pelarut methanol,
menggunakan hot plate stirrer selama 1 jam pada suhu 60oC. Endapan yang
dihasilkan disaring menggunakan kertas saring Whattman No.42 menggunakan corong Buchner, kemudian dicuci dengan akuabides dan metanol. Endapan yang
diperoleh disimpan dalam desikator hingga diperoleh kristal [(C6H5)2Sn(OH)2].
Hasil yang diperoleh dikarakterisasi dengan spektrofotmeter IR, UV-Vis, dan
microelemental analyzer.
3. Sintesis Senyawa Uji Trifeniltimah(IV) benzoat
Trifeniltimah(IV) hidroksida [(C6H5)3SnOH)] sebanyak 1,101 gram (0,003 mol)
direaksikan dengan asam benzoat (C6H5COOH) sebanyak 0,366 gram (0,003 mol)
(perbandingan mol 1:1) (Perhitungan dapat dilihat pada Lampiran 2) dalam
pelarut metanol p.a. sebanyak 30 mL dan direfluks selama 4 jam pada suhu 60oC.
Setelah bereaksi sempurna, kemudian metanol diuapkan dalam desikator sampai
diperoleh kristal kering [(C6H5)3Sn(C6H5COO)]. Hasil yang diperoleh
dikarakterisasi menggunakan spektrofotometer IR, UV-Vis, NMR, dan microelemental analyze serta diuji aktivitasnya sebagai antimalaria r.
32
4. Sintesis Senyawa Uji Difeniltimah(IV) dibenzoat
Difeniltimah(IV) dihidroksida [(C6H5)2Sn(OH)2] sebanyak 0,921 gram (0,003
mol) direaksikan dengan asam benzoat (C6H5COOH) sebanyak 0,732 gram (0,006
mol) (perbandingan mol 1:2) (Perhitungan dapat dilihat pada Lampiran 2) dalam pelarut metanol p.a. 30 mL dan direfluks pada suhu 60 selama 4 jam. Setelah bereaksi sempurna, metanol diuapkan dalam desikator sampai diperoleh kristal
kering [(C6H5)2Sn(C6H5COO)2]. Hasil yang diperoleh dikarakterisasi
menggunakan spektrofotometer IR, UV-Vis, NMR, dan microelemental analyzer serta diuji aktivitasnya sebagai antimalaria.
5. Uji Bioaktivitas Antimalaria secara In Vitro
Pengujian aktivitas senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat sebagai antimalaria terhadap parasit P. falciparum 3D7 yang sensitif terhadap klorokuin, dilakukan dengan cara melarutkan senyawa uji tersebut dalam pelarut DMSO kemudian dibuat variasi pengenceran dalam media RPMI (Roswell
Park Memorial Institute), sampai diperoleh konsentrasi akhir sebesar 10 µ g/mL, 1
µ g/mL, 0,1 µ g/mL, 0,01 µ g/mL, dan 0,001 µ g/mL. Kemudian, pada larutan senyawa uji ditambahkan suspensi parasit dengan kadar parasitemia ±1% dan hematokrit 5%. Dalam pengujian ini, DMSO yang ditambahkan suspensi parasit digunakan sebagai kontrol negatif dan klorokuin digunakan sebagai kontrol positif. Selanjutnya, kultur diinkubasi selama 48 jam pada suhu 37 °C. Kultur kemudian dipanen dan dibuat sediaan lapisan tipis darah dengan pewarna giemsa 20%. Kemudian, dihitung persen parasitemia dan persen penghambatan
33
x 100 %
) x 1
pertumbuhan P. falciparum dengan menghitung jumlah eritrosit yang terinfeksi setiap 1000 eritrosit di bawah mikroskop.
6. Analisis Data
Data persen penghambatan atau persen inhibisi dianalisis menggunakan analisis probit log antara konsentrasi uji terhadap persen penghambatan untuk mengetahui
nilai 50% inhibitory concentration (IC50) dari masing-masing senyawa uji. Nilai
IC50 didefiniskan sebagai konsentrasi dari senyawa yang menghasilkan
penghambatan 50% dibandingkan secara relatif terhadap kontrol yang tidak diberi perlakuan. Jumlah total parasitaemia dihitung sebagai jumlah parasit yang terlihat dibagi dengan jumlah total eritrosit dikalikan 100% dan dirumuskan sebagai berikut.
% parasitaemia =
Dari nilai % parasitemia dapat diketahui % pertumbuhan dari parasit dengan menghitung selisih % parasitaemia pada pengamatan 48jam dengan % parasitaemia pada 0jam (D0), sesuai dengan rumus berikut :
%pertumbuhan = % parsitaemia 48jam - % parasitaemia 0jam Persentase penghambatan dihitung dengan cara membandingkan antara parasitaemia pada sumur uji dengan parasitaemia kontrol dan dirumuskan sebagai berikut:
% Penghambatan = 100% - [( 00%]
Keterangan : Xu = % pertumbuhan pada sumur uji Xk = % pertumbuhan pada kontrol negatif
58
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Berdasarkan penelitian yang telah dilakukan, maka dapat diperoleh simpulan sebagai berikut :
1. Pada sintesis senyawa awal trifeniltimah(IV) hidroksida dan difeniltimah(IV) dihidroksida diperoleh hasil berupa padatan putih dengan rendemen masing- masing sebesar 98,55 % dan 93,83%.
2. Pada sintesis senyawa uji trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat diperoleh hasil berupa padatan putih dengan rendemen masing- masing sebesar 90,37 % dan 89,48%.
3. Senyawa hasil sintesis telah divalidasi kemurniannya dengan menggunakan karakterisasi IR, UV-Vis, NMR, dan Microelemental Analyzer yang
menunjukkan bahwa senyawa hasil sintesis adalah murni.
4. Uji pendahuluan aktivitas sebagai antimalaria secara in-vitro menunjukkan bahwa senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat
59
5. Meskipun senyawa trifeniltimah(IV) benzoat dan difeniltimah(IV) dibenzoat
termasuk senyawa yang sangat aktif sebagai antimalaria karena memiliki nilai
IC50<5 μg/mL, namun aktivitas antimalaria dari kedua senyawa tersebut
kurang efektif jika bandingkan dengan klorokuin yang memiliki nilai IC50
lebih kecil yaitu 0,002 μg/mL.
B. Saran
Berdasarkan hasil penelitian yang diperoleh, maka untuk penelitian selanjutnya disarankan untuk melakukan modifikasi senyawa kompleks organotimah untuk meningkatkan keefektifan sebagai antimalaria.
60
DAFTAR PUSTAKA
Acang, N. 2002. Kasus Malaria Resisten Klorokuin. Majalah Kedokteran
Indonesia. 52(11): 383-389
Adriana, R. Devri. 2009. Aktivitas Antiplasmodium Fraksi Non Polar Ekstrak Etanol Rimpang Temu Mangga (Curcuma mangga Val.) secara In Vivo.[Skripsi]. Fakultas Farmasi Universitas Muhamadiyah Surakarta. Surakarta.
Aryani, S. D. 2013. Sintesis dan Karakterisasi serta Uji Pendahuluan Aktivitas Antikanker Beberapa Senyawa Organotimah(IV) 3-Nitrobenzoat terhadap Sel Leukemia L-1210. [Skripsi]. Universitas Lampung. Bandar Lampung. Awang, N., H, Jumat., S, A, Ishak., N, F, Kamaludin. 2014. Evaluation of the Ex
vivo Antimalarial Activity of Organotimah(IV)
Ethylphenyldithiocarbamate on Erythrocytes Infected With Plasmodium
berghei Nk 65. Pakistan Journal of Biological Sciences.17(6): 836-842.
Bakirdere, S. 2013. Speciation Studies in Soil, Sediment, and Environmental
Samples. Taylor and Francis Group, LLC. France. Hal 577.
Bloland, P., E. Lackritz, P. Kazembe, J. Were, R. Steketee, and C. Campbell, J. 1993. Infectious Diseases. 167. 932.
Boiani, M. and M. Gonzalez. 2005. New Potent 5-Substituted Benzofuroxans as Inhibitors of Trypanosoma Cruzi Growth: Quantitative Structure–Activity Relationship Studies. Bioorganic and Medical Chemistry. 13: 6336-6346. Bonire, J.J., G.A. Ayoko, P.F. Olurinola, J.O. Ehinmidu, N.S.N. Jalil, and A.A.
Omachi. 1998. Synthesis and Antifungal Activity of Some Organotin(IV) Carboxylates. Metal-Based Drugs. 5(4): 233-236.
Burke E., J. Deasy, R. Hasson, R. Mc Cormack, V. Randhawa, and P. Walsh. 2003. Antimalarial Drug from Nature. Journal Trinity Student Medical. Ciccia, G., J. Cousiio, and E. Mongelli. 2000. Insecticidal Activity Againts Aedes
Aegypti Larvae of Some Medicinal South American Plants. Journal of