PENCIRIAN MEMBRAN SELULOSA ASETAT DARI KULIT
NANAS DENGAN PENAMBAHAN POLI(ETILENA GLIKOL)
SEBAGAI POROGEN
RIYA RISTIYANI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
PENCIRIAN MEMBRAN SELULOSA ASETAT DARI KULIT
NANAS DENGAN PENAMBAHAN POLI(ETILENA GLIKOL)
SEBAGAI POROGEN
RIYA RISTIYANI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2006
ABSTRAK
RIYA RISTIYANI. Pencirian Membran Selulosa Asetat dari Kulit Nanas dengan Penambahan Poli(etilena glikol) sebagai Porogen. Dibimbing oleh SRI MULIJANI dan BETTY MARITA SOEBRATA.
Membran sebagai salah satu alat dalam teknik pemisahan saat ini terus-menerus dikembangkan. Kendala yang terjadi adalah masih tingginya harga bahan baku pembuat membran. Oleh sebab itu, perlu dicari bahan baku lain yang lebih murah seperti kulit nanas untuk pembuatan membran. Pembuatan membran selulosa asetat (CA) dari kulit nanas dengan penambahan poli(etilena glikol) (PEG) sebagai porogen dilakukan dalam penelitian ini. Selulosa bakteri (BC) dari kulit nanas yang dibentuk oleh Acetobacter xylinum dimerserisasi dalam NaOH 1%(b/v). Bubuk BC kering diasetilasi dengan anhidrida asam asetat (selulosa:anhidrida 1:5) selama 2 jam. Membran CA berporogen dibuat dengan cara melarutkan serbuk CA 14%(b/v) dan PEG 10%(b/v) ke dalam diklorometana. Membran dibentuk dengan cara mencetak campuran polimer CA dan PEG dalam pelarut diklorometana menjadi film tipis. Membran CA berporogen dicirikan menggunakan seperangkat alat saring cross-flow. Alat saring cross-flow digunakan untuk pengukuran fluks air dan penyaringan bovine serum albumin (BSA). Penelitian ini menghasilkan membran CA berporogen dengan fluks air yang optimal pada tekanan 0.3470 bar dan nilai rerata fluks sebesar 1680.65 L/m2.jam. Membran CA berporogen memiliki nilai fluks BSA sebesar 1631.44 L/m2.jam dan rerata rejeksi sebesar 3.70%. Oleh karena itu, membran ini memiliki fungsi mikrofiltrasi.
ABSTRACT
RIYA RISTIYANI. Characterization of Cellulose Acetate Membrane from Pineapple Peel with Poly(ethylene glycol) Addition as Porogen. Supervised by SRI MULIJANI and BETTY MARITA SOEBRATA.
Membrane as a tool in separation techniques is continuously developed. The high cost of raw material is the main problem in manufacturing a membrane. Therefore, there is a need to seek another raw material to provide a low cost membrane. In this study, the alternative raw material to produce cellulose acetate membrane was pineapple’s peel added with poly(ethylene glycol) (PEG) as porogen. Bacterial cellulose (BC) from pineapple’s peel formed by Acetobacter xylinum was mercerized in 1%(w/v) NaOH. The dried BC powder was acetylated with acetic anhydride using 1:5 ratios for 2 hours. CA porogenous membrane was made by dissolving 14%(w/v) CA and 10%(w/v) PEG in dichloromethane. The membrane was formed by casting a thin film dichloromethane-based solution of CA and PEG polymer. Porogenous membrane was characterized using a cross flow filtration testing unit. A cross flow filtration testing unit was used to measure water flux and index rejection of bovine serum albumin (BSA). This study produced porogenous CA membrane having optimum water flux at 0.3470 bars, and average flux at 1680.65 L/m2.hour. Further, porogenous CA membrane had average permeate flux of BSA at 1631.44 L/m2.hour and average BSA rejection of 3.70%. This is the reason to categorize the membrane having microfiltration function.
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan kehadirat Allah SWT, karena atas rahmat dan karunia-Nya penulis dapat menyelesaikan karya ilmiah ini. Karya ilmiah ini berjudul Pencirian Membran Selulosa Asetat dari Kulit Nanas dengan Penambahan Poli(etilena glikol) sebagai Porogen, yang dilaksanakan dari bulan Juli sampai dengan April 2006 bertempat di Laboratorium Kimia Anorganik dan Organik Departemen Kimia, serta Teknologi Kimia Departemen Teknologi Industri Pertanian IPB.
Terima kasih penulis ucapkan kepada Ibu Dra. Sri Mulijani, M.S. dan Ibu Betty Marita Soebrata, S.Si, M.Si. selaku pembimbing yang telah banyak memberikan masukan dan pengarahan kepada penulis. Penulis juga mengucapkan terima kasih kepada Program Hibah A2 yang telah mendanai penelitian ini. Drs. Muhammad Farid, Budi Arifin S.Si, dan Drs. Achmad Sjahriza, serta Rini Purnawati, STP atas diskusi-diskusi yang berharga tentang penelitian ini, Ir. Hendra Adijuwana MST selaku Kepala Laboratorium Anorganik, kemudian kepada laboran, Pak Sawal, Mbak Nur, Pak Caca, Pak Mul, Om Eman, Pak Sabur, dan Ibu Siti Maemunah, selain itu untuk teman-teman seperjuangan khususnya (Rene), Astika, Febri, Atik I, Akbar, dan BT, serta rekan-rekan di Laboratorium Anorganik: Dyah, Eka, Aldi, dan Daeng.
Penulis juga mengungkapkan terima kasih untuk keluarga: Mama, Mbak Risna, dan Dek Alif atas doa, kasih sayang, dorongan, dan semangat yang telah diberikan selama ini, serta untuk Alm. Papa, dan Alm. Mas Yudi. Ungkapan terima kasih juga kepada Joe Arie Wawensyah atas segala semangat, doa, nasihat kepada penulis, CB, Mailo, Cynthia, Kak Vina, dan teman-teman M-16, serta mas Herry dan teman-teman Kimia 38 atas bantuan dan kebersamaannya.
Semoga karya ilmiah ini dapat bermanfaat
Bogor, Juni 2006
RIWAYAT HIDUP
Penulis dilahirkan di Bekasi pada tanggal 23 juni 1982 sebagai anak bungsu dari pasangan Alm. Jasin Tomtowi dan Siti Rozaniswati. Tahun 2000 penulis lulus dari SMU Negeri 2 Bekasi, dan pada tahun 2001 masuk Institut Pertanian Bogor melalui Ujian Masuk Perguruan Tinggi Negeri pada Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB. Tahun 2004 Penulis mengikuti kegiatan Praktik Lapangan di PT Aica Indonesia dengan judul Penentuan Waktu Proses High Pressure Laminated Melamine dan Cerarl, serta Analisis Kadar Formalin.
DAFTAR ISI
Halaman DAFTAR TABEL... ix DAFTAR GAMBAR ... ix DAFTAR LAMPIRAN... ix PENDAHULUAN ... 1 TINJAUAN PUSTAKA Nanas ... 1 Selulosa Bakteri ... 1 Selulosa Asetat ... 2 Membran... 2Membran Selulosa Asetat ... 3
Poli(etilena glikol) ... 3
BAHAN DAN METODE Bahan dan Alat ... 3
Metode Penelitian ... 4
HASIL DAN PEMBAHASAN Pembuatan BC ... 5
Pembuatan CA ... 6
Kelarutan CA & PEG ... 6
Membran CA berporogen ... 6
Nilai Fluks Air ... 7
Nilai Fluks & Rejeksi BSA... 8
Perbandingan Nilai Fluks dan Rejeksi Membran ... 8
SIMPULAN DAN SARAN Simpulan... 9
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Hubungan derajat substitusi CA, kadar asetil, dan aplikasinya ... 2
2 Kelas-kelas komersial CA... 2
3 Kisaran nilai fluks dan tekanan berbagai jenis membran... 3
4 Nilai fluks permeat BSA dan rejeksi (%) membran CA berporogen pada tekanan 5.0 psi... 8
DAFTAR GAMBAR
Halaman 1 Rumus struktur selulosa... 22 Struktur PEG... 3
3 Membran CA berporogen ... 7
4 Perbandingan antara fluks air membran CA terhadap waktu pada berbagai tekanan... 7
5 Hubungan antara fluks membran CA terhadap perubahan variasi tekanan .. 8
6 Hubungan antara nilai fluks (a) nilai rejeksi (b) seiring bertambahnya waktu pada tekanan 5.0 psi... 8
7 Perbandingan nilai fluks air antara MCA1 terhadap MCA2... 9
8 Perbandingan nilai fluks (a) dan rejeksi (b) BSA antara MCA1 terhadap MCA2 pada tekanan optimum ... 9
DAFTAR LAMPIRAN
Halaman 1 Reaksi asetilasi CA ... 132 Diagram alir penelitian ... 14
3 Data fluks air pada berbagai variasi tekanan ... 15
4 Hubungan fluks terhadap waktu pada tekanan 2.5, 5.0, 7.5, dan 10.0 psi ... 16
PENDAHULUAN
Membran sebagai salah satu alat dalam teknik pemisahan saat ini terus-menerus dikembangkan, mulai dari skala laboratorium hingga industri. Keuntungan dari teknologi membran ini adalah waktu pemisahan yang lebih cepat, tidak merusak bahan yang akan dipisahkan, dan pengoperasiannya yang sederhana. Kendala utama dalam pengembangan membran saat ini adalah masih tingginya harga bahan baku, seperti polisulfon dan poli(tetrafluoroetilena) (Safriani 2000). Oleh karena itu, perlu dicari bahan baku alternatif seperti selulosa bakteri (BC) dari kulit nanas. Ketersediaan bahan baku ini sangat melimpah, sebagaimana terlihat dari semakin tingginya tingkat produksi nanas sejak tahun 2000 sampai 2003, berturut-turut sebesar 393 760, 494 968, 555 588, dan 677 089 ton (Biro Pusat Statistik 2005). Penelitian tentang pembuatan BC telah banyak dilakukan, antara lain oleh Susanto et al. (2000), Arifin (2004), Andriansyah (2005), dan Putri (2006). Penelitian-penelitian tersebut menggunakan media yang berbeda-beda untuk mendapatkan BC. Selanjutnya BC tersebut dapat dimodifikasi lebih lanjut menjadi selulosa asetat (CA).
Selulosa asetat merupakan hasil modifikasi selulosa secara kimiawi melalui asetilasi, yaitu reaksi substitusi atom-atom hidrogen pada gugus hidroksil oleh gugus asetil (Fengel & Wegener 1984). Selulosa asetat dapat diperoleh dari selulosa tumbuhan atau bakteri, tetapi selulosa tumbuhan kurang murni dibandingkan dengan selulosa bakteri karena bercampur dengan lignin, hemiselulosa, serta produk-produk biogenik lainnya (Masaoka et al. 1993, Geyer et al. 1994). Pembentukan CA dari BC telah banyak dilaporkan (Arifin 2004, Safriani 2000, Yulianawati 2002).
Penelitian lebih lanjut membuktikan bahwa CA dari BC kulit nanas dapat dimodifikasi menjadi membran (Pasla 2006, Tresnawati 2006). Untuk mengatur daya pisah dari membran tersebut, dapat ditambahkan porogen sebagai pembentuk pori. Salah satunya adalah poli(etilena glikol) (PEG). Penambahan PEG sebagai porogen pernah dilakukan oleh Safriani (2000) dan Fadilah (2003).
Penelitian ini diharapkan dapat mencirikan membran selulosa asetat berbahan dasar selulosa bakteri dari kulit nanas dengan penambahan PEG sebagai porogen menggunakan fluks air dan indeks rejeksi. Selain itu manfaat dari penelitian ini adalah
dapat mengolah kulit nanas menjadi produk yang lebih berguna dan bernilai ekonomis tinggi seperti membran.
TINJAUAN PUSTAKA
Nanas
Nanas dengan nama botani Ananas comosus berasal dari Amerika Selatan dan Hindia Barat. Di dalam sistematika botani, nanas termasuk dalam dunia Plantae, filum Spermatophyta, kelas Monocotiledone, ordo Farinosae, famili Bromolyaceae, genus Ananas, dan spesies Ananas comosus (Morton 1987).
Buah nanas dapat dibagi menjadi tiga bagian yaitu kulit, daging, dan hati. Ketiga bagian tersebut dapat diekstrak menjadi sari buah nanas, yang banyak mengandung glukosa dan asam-asam organik. Kemampuan air nanas untuk memproduksi nata yang merupakan selulosa bakteri disebabkan kandungan nutrisinya yang relatif lengkap, serta sesuai untuk pertumbuhan A. xylinum (Arsatmojo 1996).
Selulosa Bakteri Bakteri Penghasil Selulosa
Jenis-jenis bakteri dari genus Acetobacter, Rhyzobium, Agrobacterium, dan Sarcina telah diketahui dapat menghasilkan BC. Di antara bakteri-bakteri tersebut, Acetobacter xylinum merupakan yang paling efisien sehingga banyak digunakan dan dipelajari dalam memproduksi selulosa. Baru-baru ini bakteri tersebut diklasifikasikan kembali sebagai Gluconobacter xylinus (Krystynowicz & Bielecki 2001).
Kekhasan Selulosa Bakteri
Produk BC dari suatu galur Acetobacter murni secara kimiawi, yaitu bebas dari lignin dan hemiselulosa serta produk-produk biogenik lainnya (Masaoka et al. 1993, Geyer et al. 1994). Karena itu, BC dapat dimurnikan dari media dan dari sel-sel bakteri yang terperangkap di dalamnya dengan perlakuan lembut menggunakan larutan basa encer, misalnya NaOH 0,1 N, selama 20 menit saja, pada suhu 80 ºC (Toyosaki et al. 1995). Berikut adalah struktur selulosa yang merupakan polimer tak bercabang dari unit anhidroglukosa yang dihubungkan oleh ikatan glukosidik β-1,4 (Gambar 1).
O H OH H H H H OH O H O OH O H OH H H H H O H O OH O H OH H H H H O H O OH O H OH H H H H O H O H OH n
Gambar 1 Rumus struktur selulosa. Kekhasan BC lainnya adalah kekuatan mekanisnya yang luar biasa meskipun ringan dan tipis, serta kapasitas serap air yang tinggi (Brown Jr tt). Kapasitas serap air BC mencapai 100−120 kali bobot keringnya (Geyer et al. 1994), lebih banyak daripada yang mampu diserap pulp kayu. Kedua sifat tersebut membuat BC banyak diaplikasikan dalam bidang medis. Selain itu, BC bersifat mudah terurai dan dapat didaur ulang, karena memiliki kelembaman metabolik, non-toksik, dan non-alergenik.
Selulosa Asetat
Selulosa asetat (CA) merupakan ester organik selulosa yang berupa padatan putih tidak berbau, tidak beracun, dan tidak berasa, yang dibuat dengan mereaksikan selulosa dengan anhidrida asam asetat dan asam sulfat sebagai katalis (Kroschwitch 1990). Reaksi ini dikenal sebagai reaksi esterifikasi, yaitu substitusi atom hidrogen pada gugus hidroksil oleh gugus asetil dari anhidrida asam. Reaksi pembentukan CA diberikan pada Lampiran 1. CA bersifat tidak mudah terbakar dibanding-kan dengan selulosa nitrat (Fengel & Wegener 1984) sehingga CA lebih disukai.
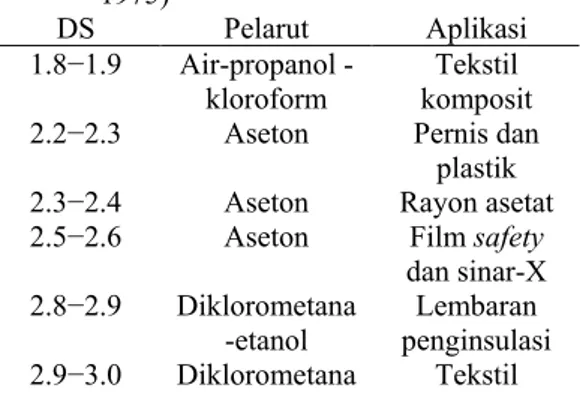
Selulosa asetat memiliki aplikasi yang luas dalam bidang industri seperti plastik, rayon, benang, dan film. Aplikasi ini bergantung pada kadar asetil CA, yang merupakan ukuran jumlah gugus asetil yang diesterifikasi pada rantai selulosa, dan lazim dinyatakan sebagai nilai derajat substitusi (DS). Semakin tinggi kadar asetil, maka semakin tinggi pula derajat substitusinya. Hubungan tersebut dapat dilihat pada Tabel 1. Lebih lanjut pada Tabel 2 dapat dilihat kelas komersial CA yang dibedakan berdasarkan DS dan pelarutnya.
Tabel 1 Hubungan antara derajat substitusi CA, kadar asetil, dan aplikasinya (Fengel & Wegener 1984)
DS Kadar Asetil (%) Aplikasi 0.6−0.9 13.0−18.6 - 1.2−1.8 22.2−32.2 plastik 2.2−2.7 36.5−42.2 benang, film 2.8−3.0 43.0−44.8 kain, pembungkus
Tabel 2 Kelas-kelas komersial CA (Immergut 1975) DS Pelarut Aplikasi 1.8−1.9 Airpropanol -kloroform Tekstil komposit
2.2−2.3 Aseton Pernis dan
plastik
2.3−2.4 Aseton Rayon asetat
2.5−2.6 Aseton Film safety
dan sinar-X 2.8−2.9 Diklorometana -etanol Lembaran penginsulasi 2.9−3.0 Diklorometana Tekstil
Pembentukan CA dari BC telah banyak dilaporkan (Safriani 2000, Yulianawati 2002, Arifin 2004). Ketiga penelitian tersebut menggunakan prosedur asetilasi yang berbeda. Arifin (2004) menggunakan nisbah selulosa-anhidrida asam asetat (s:a) 1:4, 1:5, dan 1:6 dengan proses pengeringan yang berbeda-beda, serta perendaman BC dalam NaOH dengan konsentrasi yang beragam. Perlakuan asetilasi optimum diperoleh pada nisbah (s:a) 1:5, konsentrasi NaOH 1% dan pengeringan dengan inklusi pelarut.
Membran
Membran merupakan lapisan semi-permeabel yang berupa padatan polimer tipis yang menahan pergerakan bahan tertentu (Scott & Hughes 1996). Menurut Osada & Nakagawa (1992), membran merupakan lapisan semipermeabel tipis yang dapat di-gunakan untuk memisahkan dua komponen dengan cara menahan dan melewatkan komponen tertentu melalui pori-porinya. Klasifikasi Membran
Membran dapat diklasifikasikan berdasar-kan bahan asal, morfologi, bentuk, dan fungsinya. Berdasarkan bahan asalnya, membran dibagi menjadi membran alami dan sintetik. Kemudian berdasarkan morfologinya dibedakan atas membran simetrik dan asimetrik. Selanjutnya berdasarkan bentuknya, membran terdiri atas membran datar dan tubular. Sementara berdasarkan fungsinya, membran terbagi atas membran mikrofiltrasi, ultrafiltrasi, osmosis balik, dialisis, dan elektrodialisis (Mulder 1996, Wenten 1999). Pencirian Membran
Menurut Brocks (1983), Osada & Nakagawa (1992), serta Wenten (1999),
CH
2CH
2O
n
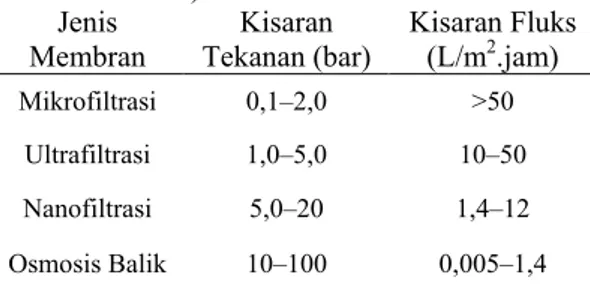
pencirian membran meliputi struktur, ukuran pori, sifat fisik, dan mekanik, serta kimia membran. Ciri-ciri ini merupakan salah satu faktor yang diperhatikan dalam menentukan kinerja membran yang contohnya antara lain nilai fluks dan rejeksi. Fluks merupakan aliran fluida yang melewati membran (Minneci & Paulson 1987) yang dipengaruhi oleh bahan polimer yang digunakan dalam pembuatan membran, gaya dorong (∆P) yang diberikan pada membran, konsentrasi polarisasi, dan fouling (Mulder 1996). Kisaran nilai fluks dan tekanan berbagai jenis membran dapat dilihat pada Tabel 3.
Tabel 3 Kisaran nilai fluks dan tekanan berbagai jenis membran (Mulder 1996) Jenis Membran Kisaran Tekanan (bar) Kisaran Fluks (L/m2.jam) Mikrofiltrasi 0,1–2,0 >50 Ultrafiltrasi 1,0–5,0 10–50 Nanofiltrasi 5,0–20 1,4–12 Osmosis Balik 10–100 0,005–1,4 Rejeksi merupakan perbandingan antara bagian yang tertahan dan bagian yang dapat melewati membran (Baker 2004). Rejeksi berhubungan dengan permeabilitas membran, yaitu ukuran kemampuan membran menahan atau melewatkan spesies tertentu (Mulder 1996). Nilai rejeksi berbanding terbalik dengan nilai fluks.
Membran Selulosa Asetat Membran dapat disiapkan dengan beberapa metode, antara lain pelelehan, pengepresan, dan pembalikan fase. Membran CA biasanya dibuat dengan pembalikan fase melalui proses pencelupan (Mulder 1996). Pembalikan fase adalah proses ketika suatu polimer diubah dari bentuk larutan menjadi bentuk padatan secara terkendali. Tahapan pembuatan membran melalui pembalikan fase dengan cara pencelupan diawali dengan pembuatan larutan homogen dengan kekentalan yang diinginkan, lalu sebelum polimer dicetak sebagai lapisan tipis, diuapkan pelarutnya dan diendapkan polimernya dengan cara pencelupan. Tahapan di atas berpengaruh terhadap ciri-ciri membran yang terlihat (Mulder 1996).
Poli(etilena glikol)
Poli(etilena glikol) (PEG) adalah molekul sederhana dengan struktur molekul linear. Pada suhu ruang, PEG dengan bobot molekul di bawah 700 berbentuk cair, pada bobot molekul 700–900 berbentuk semi padat, dan berbentuk padat pada bobot molekul 900– 1000 atau lebih. PEG larut dalam air dan beberapa pelarut organik seperti toluena, aseton, metanol, dan metil klorida, tetapi tidak larut dalam heksana dan hidrokarbon alifatik yang sejenis (Fadillah 2003). Rumus struktur PEG dapat diamati pada Gambar 2.
Gambar 2 Struktur PEG.
Menurut Fadillah (2003), terdapat pengaruh yang sangat nyata terhadap ukuran pori-pori membran akibat adanya interaksi konsentrasi PEG dengan CA. Fluks membran akan meningkat dengan bertambahnya konsentrasi PEG atau berkurangnya konsentrasi CA.
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini ialah kulit buah nanas dari pedagang rujak di depan kampus IPB Baranangsiang, cuka pekat teknis (±98% [v/v]), kertas saring, bibit nata (Balai Besar Industri Agro), gula pasir, anhidrida asam asetat, asam asetat glasial (100%), aseton teknis (± 95%), diklorometana, kristal NaOH, H2SO4 pekat (95–97%), (NH4)2SO4, bovine
serum albumin (BSA), dan air suling. Alat-alat yang digunakan dalam penelitian ini diantaranya ialah penghancur National Mega & Philips, neraca analitik, pengaduk listrik kecepatan tinggi versamix (Fisher), wadah fermentasi berukuran 30x20x4.5 cm3 merek Komet Star Plastik jenis Tripoly nomor 3, pompa vakum, pemanas listrik, oven, sentrifus Hermle Z300 (Labnet), botol bertutup ganda, alat-alat kaca, serta alat saring cross-flow.
Pembuatan Selulosa Bakteri dari Kulit Nanas (Nata de Pina) Pembuatan nata de pina dilakukan dengan modifikasi prosedur Susanto et al. 2000. Kulit buah nanas dihancurkan menggunakan penghancur sehingga didapatkan bubur kulit nanas, lalu bubur diperas menggunakan kain kasa untuk memperoleh sarinya. Sari kulit nanas tersebut masih banyak mengandung endapan atau pengotor, dan untuk mendapatkan sari buah yang baik perlu disaring menggunakan kertas saring dengan bantuan pompa vakum menggunakan corong Büchner.
Pada tahap selanjutnya, sari nanas diencerkan menggunakan air dengan nisbah sari nanas air 1:4 dengan jumlah total larutan 600 mL, lalu larutan tersebut dididihkan. Setelah mendidih, ditambahkan gula pasir sebagai sumber karbon sebanyak 7.5%(b/v) dan (NH4)2SO4 0.5%(b/v). Larutan diaduk
sampai terbentuk larutan yang homogen. Larutan yang terbentuk diatur pH-nya menjadi 4.5 (dengan kertas indikator universal) dengan penambahan cuka pekat teknis. Larutan yang telah disesuaikan pH-nya dimasukkan ke dalam tiap-tiap wadah fermentasi plastik kemudian ditutup dengan kertas koran yang telah dipanaskan menggunakan pemanas listrik dan diikat dengan karet pengikat.
Keesokan harinya ditambahkan bibit nata sebanyak 10%(v/v) dan diinkubasikan selama 4−7 hari pada suhu kamar. Pada hari ke-7, jika tidak terkontaminasi, nata de pina siap dipanen dengan ketebalan 0.6−1.0 cm.
Penyiapan Contoh Kering Selulosa Bakteri
Penyiapan contoh kering ini dilakukan berdasarkan modifikasi prosedur Safriani (2000). Lembaran nata de pina dicuci dengan air, kemudian dipotong-potong dengan pisau, sehingga berbentuk lembaran kecil dengan ukuran 4×5 cm. Lembaran tersebut direbus sampai mendidih selama 20 menit untuk menghilangkan bakteri yang tersisa atau menempel pada lembaran nata. Setelah itu, nata direndam dalam larutan NaOH 1% pada suhu kamar selama 24 jam, kemudian dinetralkan dengan perendaman dalam cuka pekat teknis 1% selama 24 jam. Jumlah NaOH dan asam asetat yang digunakan sesuai dengan jumlah nata de pina yang akan dimurnikan. Selama belum digunakan,
lembaran nata kecil ini dapat disimpan dalam kantong plastik di lemari pendingin.
Tahap selanjutnya ialah memasukkan lembaran nata ke dalam corong Büchner untuk disaring vakum guna menghilangkan air di dalam nata. Setelah disaring vakum terbentuk lembaran tipis nata. Lembaran tipis ini dikeringkan dalam suhu kamar. Nata de pina kering selanjutnya dihancurkan sampai berbentuk serbuk.
Sintesis Selulosa Asetat
Asetilasi contoh uji selulosa kering dilakukan dengan modifikasi prosedur Arifin (2004) dan Yulianawati (2002). Sebanyak 0.9 g contoh uji ditimbang teliti di dalam botol plastik bertutup ganda. Ke dalam botol, ditambahkan 100 ml cuka pekat teknis, dan botol dikocok selama 5 menit lalu ditaruh di dalam pengocok selama 15 menit. Setelah 15 menit, contoh disaring vakum dengan corong Büchner, diperas sekuat-kuatnya, lalu pe- rendaman dan penyaringan yang sama diulangi sekali lagi. Selanjutnya contoh uji direndam dalam 50 mL asam asetat glasial pada botol yang sama. Setelah 3 jam, contoh kembali disaring vakum dan diperas sekuat-kuatnya. Perendaman dalam asam bertujuan menarik air karena tidak diharapkan adanya air pada contoh sebab akan mengganggu proses asetilasi.
Contoh uji bebas air dikembalikan ke botol, lalu dimasukkan pereaksi-pereaksi asetilasi. Volume yang digunakan disesuaikan dengan bobot selulosa. Contoh uji α-selulosa yang digunakan sebanyak 0.9 g. Mula-mula dipipet 10.1 ml larutan asam asetat glasial-H2SO4 95−97%(v/v) (100:1). Botol
dikocok kuat selama 1 menit agar katalis H2SO4 terserap oleh contoh. Setelah itu,
ditambahkan anhidrida asam asetat dengan pipet tetes sedikit demi sedikit sambil diaduk dengan batang pengaduk pada suhu 40 °C. Hal ini dimaksudkan untuk menjaga suhu reaksi agar tidak terlalu tinggi karena reaksi asetilasi yang terjadi bersifat eksoterm. Nisbah selulosa:anhidrida asam asetat yang digunakan adalah 1:5, yang setara dengan volume anhidrida asam asetat sebanyak 4,5 mL.
Selanjutnya, suspensi diaduk dengan batang pengaduk kaca sampai mengental, lalu dibiarkan selama 2 jam terhitung dari dimulainya penambahan anhidrida asam asetat. Suspensi yang terbentuk berwarna merah muda kecokelatan dan kental, serta sulit dipisahkan. Asetilasi dihentikan dengan
4
menambahkan 2.4 mL larutan asam asetat glasial-air suling (2:1). Suspensi dibiarkan selama 30 menit, dengan pengadukan pada beberapa menit pertama, lalu dipindahkan ke dalam tabung sentrifus plastik 50 mL. Waktu 30 menit dihitung dari saat menambahkan pereaksi untuk hidrolisis, sampai saat sentrifugasi di mulai. Sentrifugasi dilakukan pada kecepatan 4000 rpm selama 15 menit. Supernatan lalu didispersikan ke dalam 500 mL air suling (CA yang terbentuk seperti rumput laut) diaduk sekuat mungkin dengan pengaduk magnetik dalam gelas piala 1 L.
Serpihan CA yang diperoleh (berwarna putih) disaring vakum dengan corong Büchner, dicuci dengan NaHCO3 1 N teknis
sampai tidak terbentuk gelembung gas CO2
lagi, lalu dicuci dengan air suling. Serpihan netral (pH 6.5−8.5) ini diperas, lalu dimasukkan ke dalam gelas piala 100 ml yang sebelumnya telah diketahui bobotnya lalu dikeringkan dalam oven dengan suhu (50±3) ºC selama 24 jam, bila belum kering didiamkan kembali selama 24 jam sampai contoh CA yang didapatkan benar-benar kering.
Pembentukan Membran Selulosa Asetat Berporogen
Pembuatan membran dilakukan melalui pembalikan fase dengan cara pencelupan yang mengacu pada Safriani (2000) dan Pasla (2006). Pada tahap pertama, CA dan PEG dilarutkan ke dalam diklorometana dengan jumlah yang digunakan berturut-turut sebanyak 14% dan 10%(b/v). Larutan polimer dituangkan ke atas penampang kaca 20×15 cm, kemudian dicetak sebagai lapisan tipis dengan cara menekan lalu menarik larutan polimer tersebut, sampai diperoleh lapisan tipis. Lapisan tipis ini menempel pada kaca dan dibiarkan hingga pelarut menguap seluruhnya. Kemudian, penampang kaca direndam di dalam air sampai lapisan tipis yang menempel terlepas dari penampang kaca. Selanjutnya, lapisan tipis tersebut dikeringkan, lalu dibentuk lingkaran ber-diameter 5.5 cm.
Pencirian Membran Fluks air
Sampel membran berbentuk lingkaran ditempatkan dalam modul alat saring crossflow. Modul tersebut dihubungkan dengan selang pengalir umpan, rentetat,
permeat, serta selang pengatur tekanan. Kemudian umpan dialirkan, lalu tekanannya diatur untuk mendapatkan hasil yang diinginkan. Variasi tekanan yang digunakan sebesar 0.1735, 0.3470, 0.5205, dan 0.6940 bar. Fluks masing-masing diukur dengan fungsi waktu sampai dicapai kondisi tunak. Fluks dinyatakan dengan persamaan berikut (Mulder 1996): t A V J × = dengan J = Fluks (L/m2 jam) V = Volume permeat (L)
A = Luas membran yang dilalui (m2) t = Waktu (jam)
Rejeksi membran
Perolehan rejeksi pada membran dilakukan dengan menggunakan alat yang sama pada penentuan fluks membran. Bedanya, untuk memperoleh nilai rejeksi membran, parameter yang perlu diperhatikan dan dicatat ialah jumlah konsentrasi permeat dan umpan.
Larutan BSA 200 ppm disiapkan untuk menjadi larutan umpan. Analisis BSA dalam volume permeat menggunakan spektro-fotometer (Spectronic 20D+) pada panjang gelombang 520 nm yang sebelumnya telah dibuat kurva standar BSA-nya. Persen rejeksi BSA dihitung dari perbandingan antara konsentrasi permeat (Cp) dan umpan (Cf), sebagai berikut (Baker 2004):
% 1 ×100% − = Cf Cp rejeksi
Diagram alir keseluruhan penelitian ini disajikan pada Lampiran 2.
HASIL DAN PEMBAHASAN
Pembuatan BC
Selulosa yang diperoleh pada penelitian ini berasal dari kulit nanas dengan bantuan A. xylinum. BC tersebut berwarna putih kekuningan dengan ketebalan sekitar 0.5−1.0 cm serta memiliki tekstur permukaan yang halus. Bagian limbah nanas yang digunakan adalah bagian kulitnya dan bukan daunnya. Hal ini disebabkan pada bagian kulitnya masih terdapat daging buah yang mengandung cukup nutrisi untuk pertumbuhan A. xylinum
(Arsatmojo 1996). Selain itu, pada penelitian ini digunakan bakteri A. xylinum karena bakteri tersebut telah banyak dipelajari dan dapat menghasilkan selulosa dalam jumlah relatif lebih banyak dibandingkan dengan bakteri lainnya (Tonouchi et al. 1995).
Kondisi kultivasi yang digunakan adalah dengan kondisi diam karena selulosa yang dihasilkan akan memiliki kristalinitas dan derajat polimerisasi lebih tinggi dibandingkan dengan kondisi kultivasi lainnya (Yoshinaga et al. 1997). Tingginya kristalinitas dan derajat polimerisasi ini disebabkan serat-serat fibril yang terbentuk lebih teratur karena tidak ada faktor luar yang memengaruhi seperti goncangan pada metode goyang atau pengadukan. Selain itu, pengkondisian media kultivasi pada pH 4.5 bertujuan memperoleh jumlah selulosa lebih banyak, karena A. xylinum dapat bekerja optimal pada pH 4−6 (Masaoka et al. 1993). Luas permukaan wadah kultivasi dapat pula memengaruhi jumlah selulosa yang terbentuk. Semakin luas permukaan wadah maka kontak antara media kultivasi dengan oksigen di udara lebih besar (Masaoka et al. 1993).
Pembuatan CA
Selulosa asetat yang didapat ketika supernatan hasil asetilasi disuspensikan ke dalam akuades berbentuk serpihan kasar seperti rumput laut. Setelah dikeringkan menjadi berwarna putih kecokelatan. Sebelum dilakukan proses asetilasi, BC yang didapat perlu dimurnikan, dikeringkan, dan digiling. Pemurnian dilakukan dengan NaOH 1% yang telah dioptimalisasi oleh Arifin (2004) untuk membengkakkan struktur selulosa sehingga dapat membuka serat-serat selulosa dan meningkatkan aksesibilitas gugus OH-nya terhadap pereaksi. Proses ini dinamakan merserisasi (Munk 1989). Proses pengeringan BC diperlukan karena pada proses asetilasi harus bebas-air untuk mencegah reversibilitas reaksi esterifikasi, dengan kadar air maksimum sebesar 4−7% (Yulianawati 2002). Kadar air yang didapat oleh Pasla (2006) dengan menggunakan metode yang sama dengan penelitian ini sebesar 7.65%. Kadar air yang masih lebih tinggi ini disebabkan proses pengeringan hanya dilakukan pada suhu kamar. Hal ini bertujuan mencegah terjadinya hornifikasi, yaitu deaktivasi selulosa akibat pengeringan di bawah sinar matahari dan oven sehingga menurunkan aksesibilitas selulosa (Arifin 2004). Penggilingan yang dilakukan sesudah itu bertujuan meningkatkan kecepatan
reaksi esterifikasi dengan cara menaikkan luas permukaan BC.
Proses asetilasi meliputi aktivasi, asetilasi, hidrolisis, dan pengendapan. Aktivasi juga bertujuan meningkatkan reaktivitas gugus – OH melalui perendaman BC yang telah dikeringkan dan digiling kedalam cuka pekat teknis dan asam asetat glasial. Perendaman ini bertujuan mengikat air yang masih terdapat dalam BC. Proses asetilasi BC yang telah diaktivasi dilakukan menggunakan anhidrida asam asetat dengan nisbah BC-anhidrida adalah 1:5 hasil optimalisasi Arifin (2004). Sebagai katalis, digunakan asam sulfat. Selain itu, jika digunakan pereaksi lain sebagai pengganti anhidrida asam asetat, misalnya asetil klorida tidak dianjurkan, karena kadangkala produk yang diperoleh bukan ester yang dikehendaki (Arifin 2004). Hidrolisis bertujuan menghentikan proses asetilasi. Kemudian pengendapan akan mengendapkan sisa selulosa yang tidak terasetilasi.
Kelarutan CA dan PEG
Selulosa asetat yang diperoleh pada penelitian ini larut dalam diklorometana. Hal ini menunjukkan bahwa CA yang didapat memiliki derajat substitusi 2.8−3.0 yang setara dengan kadar asetil berkisar 43.0−44.8%. Hal ini sesuai dengan penelitian yang dilakukan oleh Pasla (2006) dengan menggunakan metode yang sama. Adapun kadar asetil yang diperolehnya sebesar 42.99%. Konsentrasi CA dan PEG yang digunakan saat pelarutan dan pencetakan membran berturut-turut sebesar 14 dan 10%(b/v). Nilai ini diambil dari hasil optimalisasi Yulianawati (2002) dan Fadillah (2003).
PEG dapat larut dalam air karena kepolarannya. Dalam diklorometana, PEG sesungguhnya tidak larut melainkan hanya tersuspensi dan berada di antara matriks CA yang larut dalam diklorometana. Jika CA dan PEG yang dilarutkan tidak homogen, akan terperangkap gelembung-gelembung udara pada larutan yang akan dicetak. Hal ini mengakibatkan proses pencetakan menjadi lebih sulit dan permukaan membran menjadi tidak rata.
Membran CA Berporogen Membran yang diperoleh tampak seperti plastik, tidak transparan, dan memiliki permukaan yang halus. Ciri-ciri ini dapat dilihat pada Gambar 3.
1200 1400 1600 1800 2000 0 10 20 30 40 50 60 70 80 Waktu (menit) F lu k s ( L /m 2 .j a m ) 0.3470 bar 0.1735 bar 0.5205 bar 0.6940 bar Gambar 3 Membran CA berporogen.
Membran CA berporogen yang dihasilkan dalam penelitian ini dibuat dengan metode pembalikan fase. Membran dicetak pada permukaan kaca yang kemudian ditarik menggunakan batang pengaduk sehingga ketebalan dari membran tersebut tidak rata pada setiap sisinya. Membran yang didapat dikeringkan pada suhu kamar, dan pelepasan membran dari permukaan kaca dilakukan dengan perendaman dalam air. Perendaman ini juga berfungsi melarutkan PEG yang berada di antara matriks CA yang akan meninggalkan bekas lubang berupa pori-pori pada membran.
Nilai Fluks Air
Pencirian fluks membran pada penelitian ini menggunakan akuades dengan alat saring coss-flow yang diberi variasi tekanan sebesar 0.1735, 0.3470, 0.5205, dan 0.6940 bar (Lampiran 3). Nilai fluks yang diperoleh untuk keempat jenis tekanan tersebut dari yang terkecil sampai yang terbesar adalah 1440.4770, 1680.6494, 1644.0310, 1564.9771 L/m2.jam. Dari nilai-nilai fluks tersebut dapat dikatakan bahwa membran CA yang diperoleh pada penelitian ini termasuk ke dalam kelompok mikrofiltrasi. Hal ini sesuai dengan Mulder (1996) bahwa membran mikrofiltrasi memiliki kisaran fluks lebih dari 50 L/m2.jam. Laju alir akuades ini juga menunjukkan fenomena yang sama untuk setiap tekanan, yaitu semakin lama waktu proses laju alir, nilai fluks semakin menurun hingga tercapai kondisi tunak atau nilai yang stabil. Hal ini menunjukkan gejala fouling yang diduga dikarenakan akuades yang digunakan sebagai umpan mengandung partikel-partikel yang berukuran hampir sama atau lebih besar daripada ukuran pori-pori membran sehingga partikel tersebut akan menumpuk pada permukaan membran dan menghambat
kemampuan membran untuk melewatkan larutan umpan sehingga waktu alir permeat menjadi lebih lama. Fenomena ini ditunjukkan pada Gambar 4.
Gambar 4 Perbandingan antara fluks air membran CA dan waktu pada berbagai tekanan.
Hal ini sesuai dengan Wenten (1999) bahwa fouling merupakan gejala yang disebabkan oleh deposisi dan akumulasi secara irreversibel dari partikel submikron pada permukaan membran atau kristalisasi secara presipitasi dari partikel berukuran kecil pada permukaan atau di dalam membran itu sendiri. Fluks air murni pada proses ultrafiltrasi atau mikrofiltrasi umumnya akan mengalami penurunan nilai fluks kurang dari 5% (Mulder 1996).
Nilai fluks berbanding lurus terhadap tekanan: semakin tinggi tekanan, maka nilai fluksnya semakin bertambah. Akan tetapi, hal tersebut tidak terjadi pada nilai 0.5205 dan 0.6940 bar. Diduga pada tekanan tersebut telah terjadi peristiwa kompaksi. Kompaksi membran merupakan suatu perubahan mekanik pada struktur membran polimer yang terjadi akibat gaya dorong ∆P. Akibatnya semakin tinggi tekanan yang dikenakan, maka kompaksi membran akan berlangsung lebih cepat (Mulder 1996). Ketika terjadi kompaksi, struktur CA menjadi lebih kompak dan pori-pori membran merapat sehingga meng-hasilkan penurunan nilai fluks, bahkan setelah relaksasi (dengan cara menurunkan tekanan pada proses). Nilai fluks tidak dapat kembali sebagaimana nilai awalnya, karena gejala kompaksi bersifat tidak dapat balik. Hal ini dapat dilihat pada Gambar 5.
0.00% 10.00% 20.00% 0 10 20 30 40 waktu (menit) in d e k s r e je k s i (% ) 1400 1450 1500 1550 1600 1650 1700 0 2.5 5 7.5 10 12.5 Tekanan (bar) F lu k s ( L /m 2 .j a m ) 0 500 1000 1500 2000 2500 0 5 10 15 20 25 30 35 40 Waktu (menit) F lu k s ( L /m 2 .j a m )
Gambar 5 Hubungan antara fluks membran CA dan perubahan variasi
tekanan.
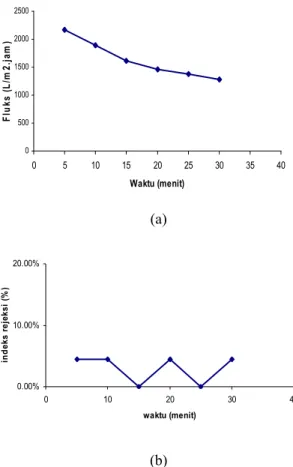
Nilai Fluks dan Rejeksi BSA Salah satu cara pencirian membran yang lainnya adalah nilai rejeksi. Prinsip kerjanya sama dengan fluks air, hanya saja larutan umpan yang digunakan berbeda, yaitu BSA dengan konsentrasi 200 ppm. Setiap 5 menit, permeat BSA diukur nilai fluks dan rejeksinya (%) menggunakan Spectronic 20D+ pada panjang gelombang 520 nm dengan bantuan kurva standar BSA (Lampiran 4). Nilai fluks dan rejeksinya ditentukan pada tekanan 0.3470 bar. Hal ini didasarkan pada optimalisasi fluks air pada berbagai variasi tekanan, yang menghasilkan nilai fluks terbesar pada tekanan 0.3470 bar. Perbedaan nilai fluks dan rejeksi BSA setiap lima menit dapat dilihat pada Tabel 4. Dari tabel tersebut, dapat dilihat bahwa seiring bertambahnya waktu nilai fluksnya semakin menurun (Gambar 6a), sedangkan nilai rejeksinya cenderung stabil (Gambar 6b).
Nilai rejeksi larutan BSA cenderung stabil meskipun nilai fluksnya turun. Gejala ini diduga disebabkan ukuran pori-pori membran yang lebih besar daripada ukuran partikel BSA dalam larutan umpan sehingga hanya sedikit partikel BSA yang dapat ditolak oleh membran.
Tabel 4 Nilai fluks permeat BSA dan rejeksi (%) membran CA berporogen pada tekanan 0.3470 bar
Waktu Fluks Rejeksi
(menit) (L/m2.jam (%) 5 2164.5516 5.18% 10 1893.9583 5.18% 15 1611.8084 0.73% 20 1456.9213 5.18% 25 1377.3904 0.73% 30 1284.018 5.18% (a) (b)
Gambar 6 Hubungan antara nilai fluks dan waktu (a), nilai rejeksi dan waktu (b) pada tekanan 0.3470 bar.
Perbandingan Nilai Fluks dan Rejeksi Membran CA Berporogen dengan Membran CA Tanpa Porogen
Membran CA yang digunakan sebagai pembanding pada penelitian ini adalah yang dibuat dari BC limbah nanas, tetapi tanpa penambahan PEG (Pasla 2006). Grafik pada Gambar 7 menunjukkan bahwa nilai rerata fluks air untuk membran CA berporogen yang selanjutnya dilambangkan dengan MCA1 lebih besar dibandingkan dengan nilai rerata fluks air membran CA tanpa porogen yang selanjutnya dilambangkan dengan MCA2. Hal ini disebabkan pada MCA1 terdapat pori-pori yang lebih besar dan lebih banyak dibandingkan dengan pori-pori pada MCA2 (Yang et al. 2001). Pengukuran fluks membran pembanding menunjukkan gejala yang sama terhadap fungsi waktu, yaitu semakin lama waktunya maka nilai fluks akan semakin menurun hingga tercapai nilai yang stabil pada keadaan tunak.
0 400 800 1200 1600 2000 2400 0 5 10 15 20 25 30 35 Waktu (menit) F lu k s ( L /m 2 .j a m )
MCA2 0.5205 bar MCA10.3470 bar
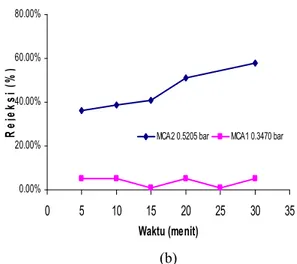
0.00% 20.00% 40.00% 60.00% 80.00% 0 5 10 15 20 25 30 35 Waktu (menit) R e je k s i (% )
MCA2 0.5205 bar MCA1 0.3470 bar
0 600 1200 1800 0 2.5 5 7.5 10 12.5 Tekanan (bar) F lu k s ( L /m 2 .j a m ) MCA1 MCA2
Gambar 7 Perbandingan nilai fluks air antara MCA1 dan MCA2.
Perbandingan nilai fluks BSA untuk MCA1 dengan MCA2 (Gambar 8a) menunjukkan bahwa nilai fluks BSA MCA1 juga lebih besar daripada MCA2 meskipun nilai fluks keduanya semakin menurun. Di sisi lain, nilai rejeksi MCA2 semakin meningkat seiring bertambahnya waktu (Gambar 8b), sementara nilai rejeksi MCA1 cenderung stabil. Gejala ini disebabkan ukuran pori-pori MCA1 jauh lebih besar dibandingkan dengan MCA2 akibat penambahan PEG sebagai porogen. Hal ini menunjukkan meskipun terjadi peristiwa fouling pada MCA1, ukuran porinya diduga lebih besar dari ukuran partikel BSA. Hal ini mengakibatkan banyak partikel BSA pada larutan umpan yang melewati membran.
(a)
(b)
Gambar 8 Perbandingan antara nilai fluks BSA MCA1 dan MCA2 (a) serta nilai rejeksi antara BSA MCA1 dan MCA2 (b) pada tekanan optimum.
Berdasarkan hasil perbandingan antara nilai fluks air, fluks BSA, dan rejeksi BSA, diketahui bahwa penambahan PEG memperbesar nilai fluks dan menurunkan nilai rejeksi membran CA. Upaya untuk mengatasinya antara lain dengan menambah konsentrasi CA atau memperkecil konsentrasi serta jenis PEG yang ditambahkan juga dapat memperkecil ukuran pori membran. Hal ini sesuai dengan pernyataan Mulder (1996) yang mengatakan bahwa konsentrasi polimer pembentuk membran sangat memengaruhi ciri membran yang terbentuk. Semakin tinggi konsentrasi polimer pembentuknya, membran yang dihasilkan semakin padat sehingga fluksnya membran akan semakin kecil.
SIMPULAN DAN SARAN
Simpulan
Membran CA yang diperoleh pada penelitian ini memiliki fluks air yang optimal pada tekanan 0.3470 bar sebesar 1680,6494 L/m2.jam. Nilai rerata fluks dan rejeksi BSA selama 30 menit pada tekanan 0.3470 bar masing masing sebesar 1631.4413 L/m2.jam dan 3.00%. dilihat dari nilai rerata fluks air dapat disimpulkan bahwa membran CA yang diperoleh termasuk membran mikrofiltrasi.
Penambahan PEG sebagai porogen dapat membentuk pori-pori membran. Hal ini dapat dilihat nilai fluks membran CA tak
9
berporogen yang dibuat oleh Pasla (2006) lebih kecil dibandingkan membran CA berporogen pada penelitian ini.
Saran
Konsentrasi dan jenis PEG dalam pembuatan membran sebaiknya dibuat bervariasi agar diketahui efektivitas penyaringan dari membran yang dibuat.
DAFTAR PUSTAKA
[Anonim]. tt. Processising routes to aceticanhydride. http://chemsystems.com/news letters/perp/Jun 04_N03S1.cfm. [27 April 2006].
Andriansyah M. 2006. Sifat-sifat Membran yang Dibuat dari Sari Kulit Buah Nanas [Skripsi]. Bogor: Departemen Kimia Institut Pertanian Bogor.
Arsatmojo E. 1996. Formulasi Pembuatan Nata de Pina [Skripsi]. Bogor: Departemen Teknologi Pangan dan Gizi Institut Pertanian Bogor.
Arifin B. 2004. Optimasi Kondisi Asetilasi Selulosa Bakteri dari Nata de Coco [Skripsi]. Bogor: Departemen Kimia Institut Pertanian Bogor.
Baker RW. 2004. Membrane Technology and Applications. Ed ke-2. London: J Wiley. [BPS]. 2005. Produksi buah-buahan tropis
Indonesia. http://BiroPusatStatistik.com. [28 November 2005].
Brocks TD. 1983. Membrane Filtration: A user’s Guide and Reference Manual. Madison:Science Tech.
Brown Jr RM. tt. Microbial cellulose: a new resource for wood, paper, textiles, food and specialty products. http://www. botany.utexas.edu/facstaff/facpages/mbro wn/position1. [29 april 2005].
Fadillah F. 2003. Pengaruh Penambahan PEG terhadap Karakterisasi membran Selulosa Asetat [Skripsi]. Bogor: Departemen Teknologi Industri Institut Pertanian Bogor.
Fengel G, Wegener G. 1984. Wood: Chemistry, Ultrastructure, Reactions. Berlin: Walter de Gruyter.
Geyer U. et al. 1994. Formation, deri-vatization and applications of bacterial cellulose. Int J Biol Macromol 16:343-347.
Immergut EH. 1975. Cellulose. Di dalam: Browning BL (ed). The Chemistry of Wood. New York: J Wiley. hlm: 97-127. Kroschwitch JI. 1990. Concise of Polymer
Science and Engineering. New York: J Wiley.
Krystynowicz, Bielecki S. 2001. Biosynthesis of bacterial cellulose and its potential applications in the different industries. Polish Biotechnology. News. [http:// www.Biotechnology-pl.com/sciene/Krys- tynowicz.htm]. [27 November 2005]. Masaoka S, Ohe T, Sakota N. 1993.
Production of cellulose from glucose by Acetobacter xylinum. J Ferment Bioeng 75:18-22.
Minneci P, Paulson D. 1987. Molecularly-bounded metal microfiltration membrane. http://www.osmonics.com. [29 April 2005].
Morton JF. 1987. Fruits of warm climates. http://www.hort.purdue.edu/newcorp/mor ton/pineapple.html. [29 April 2006]. Mulder M. 1996. Basic Principles of
Membrane Technology. Netherland: Kluwer.
Munk P. 1989. Introduction to Macro-molecular Science. Texas: J Wiley. Osada Y, Nakagawa T. 1992. Membrane
Science and Technology. New York: Marcel Dekker.
Pasla FR. 2006. Pencirian Membran Selulosa Asetat Berbahan Dasar Selulosa Bakteri dari Limbah Nanas [Skripsi]. Bogor: Departemen Kimia Institut Pertanian Bogor.
Putri TPD. 2006. Ciri Membran Selulosa Berpori dari Sari Kulit Nanas [Skripsi]. Bogor: Departemen Kimia Institut Pertanian Bogor.
Safriani. 2000. Produksi Biopolymer Selulosa Asetat dari Nata de Soya [Tesis]. Bogor: Departemen Teknologi Industri Pertanian Institut Pertanian Bogor.
Scott K, Hughes R. 1996. Industrial Membrane Separation Technology. London: Blackie Academic and Professionals.
Susanto T, Adhitia R, Yunianto. 2000. Pembuatan Nata de Pina dari kulit nanas kajian dari sumber karbon dan pengenceran medium fermentasi. Teknologi Pertanian 1:58-56.
Toyosaki H et al. 1995. Screening of bacterial cellulose producing Acetobacter strain suitable for agitated culture. J Biosci Biotech Biochem 59:1498-1502.
Tresnawati A. 2006. Kajian Spektroskopi Inframerah Transformasi Fourrier dan Mikroskop Susuran Elektron Membran Selulosa Asetat dari Limbah Nanas [Skripsi]. Bogor: Departemen Kimia Institut Pertanian Bogor.
Wenten IG. 1996. Teknologi Industrial Membran. Departemen Teknik Kimia Institut Teknologi Bandung.
Yang L, Hsiao WW, Chen P. 2001. Chitosan-cellulose composite membrane for affinity purifications of biopolymers and immunoadsorption. J Memb Sci 5084:1-13.
Yoshinaga S, Tonouchi N, Watanabe K. 1997. Reaserch progress in production of bacterial cellulose by aeration and agitation culture and its application as a new industrial material. J Biosci Biotech Biochem 6:119-124.
Yulianawati N. 2002. Kajian Pengaruh Nisbah Selulosa dengan Pereaksi Asetilasi dan Lama Asetilasi terhadap Produksi Selulosa dari Nata de Coco [Skripsi]. Bogor: Departemen Teknologi Industri Pertanian Institut Pertanian Bogor
Lampiran 1 Reaksi asetilasi CA ([Anonim] tt)
Lampiran 2 Diagram alir penelitian
Pembuatan nata de pina
Pemurnian selulosa
Asetilasi
Pembuatan membran CA berporogen
Pencirian fluks dan rejeksi
Lampiran 3 Data fluks air pada berbagai variasi tekanan
P = 0.1735 bar P = 0.3470 bar P = 0.5205 bar P = 0.6940 bar
Waktu Waktu/ 50 ml Waktu/ 50 ml Fluks Waktu/ 50 ml Waktu/ 50 ml Fluks Waktu/ 50 ml Waktu/ 50 ml Fluks Waktu/ 50 ml Waktu/ 50 ml Fluks
(menit) (detik) (jam) (L/m2.jam) (detik) (jam) (L/m2.jam) (detik) (jam) (L/m2.jam) (detik) (jam) (L/m2.jam)
3 45 0,0125 1683,5017 42 0,011667 1803,7003 40 0,011111 1893,9583 43 0,011944 1761,8696 6 46 0,012778 1646,8752 42 0,011667 1803,7003 41 0,011389 1847,7277 44 0,012222 1721,7944 9 48 0,013333 1578,3223 41 0,011389 1847,7277 42 0,011667 1803,7003 46 0,012778 1646,8752 12 48 0,013333 1578,3223 43 0,011944 1761,8696 43 0,011944 1761,8696 46 0,012778 1646,8752 15 49 0,013611 1546,0856 42 0,011667 1803,7003 45 0,0125 1761,8696 46 0,012778 1646,8752 18 50 0,013889 1515,1394 43 0,011944 1761,8696 43 0,011944 1683,5017 48 0,013333 1578,3233 21 51 0,014167 1485,4077 42 0,011667 1803,7003 45 0,0125 1683,5017 48 0,013333 1578,3233 24 51 0,014167 1485,4077 44 0,012222 1721,7944 44 0,012222 1721,7944 48 0,013333 1578,3233 27 52 0,014444 1456,9213 44 0,012222 1721,7944 45 0,0125 1683,5017 48 0,013333 1578,3233 30 52 0,014444 1456,9213 44 0,012222 1721,7944 46 0,012778 1646,8752 49 0,013611 1546,0856 33 52 0,014444 1456,9213 44 0,012222 1721,7944 46 0,012778 1646,8752 49 0,013611 1546,0856 36 52 0,014444 1456,9213 45 0,0125 1683,5017 45 0,0125 1683,5017 49 0,013611 1546,0856 39 53 0,014722 1429,4098 47 0,013056 1611,8084 47 0,013056 1611,8084 49 0,013611 1546,0856 42 53 0,014722 1429,4098 47 0,013056 1611,8084 47 0,013056 1611,8084 49 0,013611 1546,0856 45 53 0,014722 1429,4098 47 0,013056 1611,8084 46 0,012778 1646,8752 50 0,013889 1515,1394 48 56 0,015556 1352,7752 47 0,013056 1611,8084 50 0,013889 1515,1394 49 0,013611 1546,0856 51 58 0,016111 1306,1741 47 0,013056 1611,8084 50 0,013889 1515,1394 49 0,013611 1546,0856 54 58 0,016111 1306,1741 47 0,013056 1611,8084 49 0,013611 1546,0856 50 0,013889 1515,1394 57 58 0,016111 1306,1741 49 0,013611 1546,0856 51 0,014167 1485,4077 50 0,013889 1515,1394 60 58 0,016111 1306,1741 48 0,013333 1578,3223 49 0,013611 1546,0856 50 0,013889 1515,1394 63 58 0,016111 1306,1741 48 0,013333 1578,3223 50 0,013889 1515,1394 51 0,014167 1485,4077 66 58 0,016111 1306,1741 49 0,013611 1546,0856 51 0,014167 1485,4077 51 0,014167 1485,4077 69 58 0,016111 1306,1741 48 0,013333 1578,3223 50 0,013889 1515,1394 54 0,015 1402,9181
rerata 1440,4770 rerata 1680,6494 rerata 1644,0310 rerata 1564,9771
Contoh perhitungan (menit ke-3) P = 0.3470 bar Fluks : t A V J . = 1803.7003 011667 . 0 00238 . 0 050 . 0 = × = J
Keterangan V = Volume (50 ml) t = Waktu (menit)
A = luas permukaan membran (0.00238 m2)
Lampiran 4 Penentuan konsentrasi permeat BSA
Data kurva standar BSA
Konsentrasi %T Absorban Absorban
(ppm) terkoreksi 0 89.6 0.0477 0.0000 20 89.4 0.0487 0.0010 40 89.2 0.0496 0.0019 60 89.0 0.0506 0.0029 100 87.6 0.0575 0.0098 120 67.0 0.0605 0.0128 140 86.4 0.0635 0.0158 160 86.2 0.0645 0.0168 180 86.0 0.0655 0.0178 200 85.4 0.0685 0.0208
Diperoleh persamaan garis lurus dengan Y = -14,9229.10-4 + 1,1228.10-4X, dengan R = 98,83%, yang merupakan hubungan antara konsentrasi dengan absorban. Nilai absorban (Y) merupakan fungsi dari konsentrasi (X)
Data % rejeksi BSA
Waktu % T Absorban Absorban Konsentrasi Rejeksi
(menit) terkoreksi permeat (%)
(ppm) 5 85.6 0.0675 0.0198 189.64 5.18% 10 85.6 0.0675 0.0198 189.64 5.18% 15 85.4 0.0685 0.0208 198.54 0.73% 20 85.6 0.0675 0.0198 189.64 5.18% 25 85.4 0.0685 0.0208 198.54 0.73% 30 85.6 0.0675 0.0198 189.54 5.18%
Contoh perhitungan (menit ke-5)
Konsentrasi permeat (ppm) = 4 4
10
.
1228
,
1
10
.
9229
,
14
− −+
absorban
= 4 410
.
1228
,
1
10
.
9229
,
14
0198
.
0
− −+
= 189.64 ppm % rejeksi =1
×
100
%
−
f pC
C
=100
%
200
64
.
189
1
×
−
Keterangan Cp = Konsentrasi permeat (ppm)= 5.18% Cf = Konsentrasi umpan (200 ppm)