BAB 2
TINJAUAN PUSTAKA
2.1 Baterai
Sebuah baterai adalah perangkat yang mengubah energi kimia yang tersimpan langsung ke energi listrik dengan cara reaksi redoks elektrokimia (Linden, 2002). Sebenarnya, baterai terdiri dari beberapa sel elektrokimia dan setiap sel terutama mengandung elektroda negatif (anoda), elektroda positif (katoda), dan elektrolit.
Gambar 2.1. Sketsa komponen sel dengan arus mengalir selama discharge (Mahmoud, H.T. 2011)
Jika elektrolit cair, pemisahnya harus ditambahkan untuk menjaga elektroda terpisah. Sementara jika elektrolit padat, elektroda bertindak sebagai pemisah. Pada anoda, M teroksidasi lalu kehilangan satu elektron dan menjadi kation M+. Kemudian elektron mengalir melalui sirkuit eksternal, X berkurang di katoda dan satu elektron dari anoda melalui sirkuit eksternal (Mahmoud, H.T., Xu, L. 2011).
2.2. Baterai Ion Lithium
Bateria terdiri dari baterai primer dan sekunder. Baterai primer hanya dapat digunakan sekali, dan tidak mampu menjadi bermuatan listrik. Misalnya, baterai alkalin-mangan dioksida dan baterai primer zing-carbon. Baterai dengan kemampuan isi ulang diklasifikasikan sebagai baterai sekunder. Baterai sekunder
yang termasuk isi ulang yaitu timbal-asam, baterai lithium ion. Tabel 2.1 menunjukkan perbandingan karakteristik kinerja untuk baterai sekunder (Patil, 2008). Dibandingkan dengan baterai sekunder lainnya, baterai isi ulang ion lithium menunjukkan kinerja elektrokimia yang sangat baik, dan baterai ini dapat mengarah ke posisi dominan dalam industri (Sun,Xiangcheng. 2015).
Tabel 2.1 Perbandingan karakteristik kinerja untuk baterai sekunder (Patil, 2008) Tipe baterai Tegangan
(V) Energi Densitas (Wh/Kg) Ni-Cd 1,2 40 Ag-Zn 1,5 110 Ni-MH 1,2 90 Li-ion 3,6 155 Li-polimer 3,6 180
2.3. Prinsip Kerja Baterai Ion Lithium
Ada lima komponen yang membentuk sel lithium-ion. Komponen-komponen ini adalah dua elektroda, elektrolit, dan dua kolektor. Fungsi utama dari elektroda adalah untuk oksidasi atau reduksi selama rentang potensial diukur dalam volt (V). Elektrolit dapat berair atau tidak berair, dalam bentuk cair, pasta atau bentuk padat (Sun, Xiangcheng. 2015). Elektrolit berfungsi sebagai konduktor ionik antara elektroda dan harus sebagai isolasi elektronik. Para current collector saat ini adalah bahan listrik dari logam yang langsung bersentuhan elektroda. Kolektor melekat satu sama lain dengan sirkuit eksternal (Tarascon, 2001 ; Winter, 2004).
Prinsip kerja baterai ion lithium adalah reaksi oksidasi reduksi di permukaan elektroda. Sebuah baterai lithium-ion menunjukkan fungsi sel elektrokimia karena perbedaan potensial antara dua elektroda. Hal ini penuh menguntungkan untuk kedua elektroda yang datang ke arah potensi keseimbangan lebih rendah dari Open Voltage Circuit (OVC) awal di mana mereka stabil. Keseimbangan antara elektroda dicapai oleh oksidasi satu elektroda dan pengurangan elektroda lainnya. Elektroda yang tereduksi disebut katoda, sedangkan elektroda yang teroksidasi disebut anoda. Reaksi-reaksi ini dicapai
dengan dua jalur yang berbeda untuk ion dan elektron. Elektron perjalanan melalui sirkuit eksternal dari anoda ke katoda.
Gambar 2.2. Prinsip kerja baterai Li-ion
(https://www.google.com/search?q=gambar+prinsip+kerja+baterai&sa=X&biw)
Pada saat yang sama, ion keluar ke arah yang sama dengan elektron dua elektroda melalui elektrolit. Reaksi redoks terjadi dari dua elektroda, Secara umum, prinsip kerja dasar baterai ion lithium berdasarkan ion lithium reversibel de-interkalasi dan proses interkalasi antara dua elektroda (Wakihara, 2001). Akibatnya, selama charge ion lithium mengalir antara anoda dan katoda, memungkinkan konversi energi kimia menjadi energi listrik dan penyimpanan energi elektrokimia dalam baterai. Elektrolit harus melakukan ionik dan elektronik isolasi, namun sifat sebenarnya dari elektrolit jauh lebih rumit. Selama siklus pertama, solid electrolite interface lapisan akan terbentuk pada permukaan elektroda karena dekomposisi elektrolit organik (Wakihara, 2001 ; Xu. B, 2012).
2.4. Perubahan pada anoda /elektrolit
Elektrolit terurai dan bereaksi dengan anoda selama pengisian, sehingga membentuk lapisan pelindung yang menutupi permukaan. Pada beberapa site grafit , sejumlah besar ion lithium berpindah dari struktur kristal ke struktur kristal yang lain. Pada gambar 2.3 perubahan permukaan anoda/elektrolit merupakan
kerusakan lapisan SEI (Solid Electrolite Interface) atau lapisan pasivasi tipis. SEI ini lapisan melindungi elektrolit dari pengurangan lebih lanjut, dan elektroda bermuatan dari korosi. Biasanya, pembentukan SEI disertai dengan emisi produk penguraian elektrolit gas di beberapa siklus pertama. Namun, dibandingkan dengan siklus pertama, angka ini lebih rendah. Selama waktu yang lama, SEI menembus ke dalam pori-pori elektroda dan hasil dalam penurunan luas permukaan aktif diakses dari anoda, yang meningkatkan resistansi internal. Suhu tinggi menyebabkan pengaruh dramatis pada degradasi SEI. Lapisan SEI larut dan mulai terjadi pengendapan SEI. Dengan cara ini, meta-stabil lapisan SEI organik akan dikonversi menjadi produk anorganik yang stabil, yang menghasilkan konduktivitas ionik rendah dari lapisan SEI untuk lithium. Suhu rendah juga menyebabkan banyak masalah. Karena suhu rendah, kinetika penyisipan lithium dan ekstraksi sangat lambat, dan efek ini sangat terasa pada suhu rendah. Logam lithium melapisi dan membentuk dendrit lithium dianggap sebagai reaksi samping parasit selama proses pengisian. (Mahmoud, H. T., Xu, L. 2011).
2.5. Pengembangan Bahan Katoda
Bahan katoda berperan penting dalam baterai lithium-ion karena tegangan rata-rata output tinggi, kepadatan energi yang tinggi yang sangat baik mengandung LiCoO2, LiMn2O4, LiFePO4, LiNi0,5Mn1,5O4 dan Li[LiNyMn1-x-y]O2. Pada LiCoO2
menjadi bahan komersialisasi baterai lithium-ion yang memiliki kapasitas tertentu 130~150 mAh/g dan bekerja pada tegangan 3,7 V. Pada LiMn2O4 bahan
komersial aktif baterai lithium-ion dapat memberikan tegangan kerja tertinggi dari LiCoO2, tapi kapasitas khusus adalah termurah dari LiCoO2. Pada LiFePO4
memiliki kapasitas spesifik tertinggi dan tegangan kerja terendah dibandingkan dengan LiCoO2, LiNi0.5Mn1.5O4 memiliki tegangan kerja yang tinggi dan Li [Li
Ny Mn1-x-y]O2 kapasitas khusus yang tinggi. Kinerja berbagai bahan katoda
tabel 2.2 meskipun ada banyak keuntungan untuk baterai lithium-ion, konduktivitas listrik yang lebih rendah dan difusi ion lithium adalah masalah umum. Tapi baterai lithium-ion memiliki pengembangan tegangan kerja yang tinggi dan kapasitas spesifik yang tinggi di masa depan.
Tabel 2.2 Kinerja bahan katoda (Hsu.C., Lin.J., 2012)
Material LiCoO2 LiMn2O4 LiFePO4
Kapasitas teoritis (mAh/g) 274 148 170
Kapasitas praktis (mAh/g) 130~150 120 160
Tegangan kerja (V) 3.7 3.8 3.4
Konduktivitas (S/cm) 10-3 2 x 10-5 10-6
Difusi (cm2/s) 5 x 10-8 1.2 x 10-11 10-14
Densitas daya (Wh/kg) 536 456 527
2.6. Pengembangan Material Elektrolit
Elektrolit berfungsi untuk memfasilitasi ion lithium konduksi antara elektroda. Jenis elektrolit dikategorikan berdasarkan sifat material yaitu cairan, polimer padat, keramik, gel, dan cairan ionik (Kalhoff, 2015). Elektrolit polimer dibagi dua jenis yaitu gel elektrolit dan elektrolit polimer kering. Elektrolit polimer memiliki rendah dan dapat dengan mudah dipadatkan dalam proses manufaktur.
Elektrolit gel terdiri dari matriks polimer tidak aktif dan larutan garam lithium. Elektrolit mengalir seperti cairan pada suhu tinggi Elektrolit polimer kering mengandung polimer dan garam lithium. Pada suhu kamar, konduktivitas ionik elektrolit ini adalah rendah. Karena gerakan dari rantai polimer, konduktivitas ionik akan meningkat dengan suhu (Mahmoud,Heza.T., Xu,L. 2011).
2.7. Pengembangan Material Anoda 2.7.1 Graphite
Grafit adalah salah satu jenis alotrop karbon. Karbon merupakan unsur non logam dan bervalensi 4 yang berarti bahwa terdapat empat elektron yang dapat digunakan untuk membentuk ikatan kovalen. Grafit berwarna hitam, kusam, memiliki konduktor listrik yang sangat baik, titik leleh tinggi, massa jenis yang lebih kecil dibandingkan intan (http://id.m.wikipedia.org/wiki/karbon). Grafit mempunyai kapasitas secara teoritis 372 mAh/g (Hsu.C.; Lin.J., 2012). Namun, grafit menghalangi perpindahan ion Li dan ukuran partikel pada grafit yang besar berakibat jarak yang ditempuh ion Li untuk lepas dari grafit semakin jauh sehingga menurunkan energi yang dihasilkan. Selama pengisian, ion Li terdeposisi dalam partikel grafit kemudian dilepaskan saat pemakaian baterai. Ketika ion Li masuk atau meninggalkan partikel grafit, terjadi perluasan atau penyusutan partikel grafit untuk mengakomodasi ukuran ion Li yang lebih besar daripada situs partikel grafit (House et al., 2007). Penyusutan dan perluasan partikel grafit berulang mengakibatkan partikel grafit rusak serta mengurangi masa hidup baterai. Kelemahan grafit dapat diganti dengan menggunakan material anoda seperti Li4Ti5O12 dan NaLiTi3O7 untuk menghasilkan anoda yang baik.
2.7.2. Li4Ti5O12
Li4Ti5O12 pertama kali dipelajari oleh Ohkozu pada tahun 1995. Li4Ti5O12
merupakan material zero-strain insertion untuk interkalasi lithium, yang berarti Li4Ti5O12 tidak mengalami perubahan volume selama proses insersi lithium
selama cycling baterai (Nordh, 2013; & Veljković et al, 2011). Sifat fisik dan kimia dari serbuk LTO adalah: berbentuk padat (serbuk), berwarna putih, tidak berbau, titik lelehnya > 1,000 °C (> 1,832 °F) (MSDS LTO). Li4Ti5O12 atau lithium
titanium oxide merupakan suatu material yang memiliki struktur spinel (Cho et al, 2010). Struktur spinel Li4Ti5O12 mempunyai dua kisi yang berbeda yaitu
tetrahedral dan oktahedral. Pada kisi tetrahedral ion Li terikat dengan empat oksigen, dimana oksigen bertindak sebagai anion. Sedangkan pada sisi oktahedral, ion Ti terikat dengan enam anion oksigen (Veljković et al, 2011). Secara keseluruhan Li4Ti5O12 memiliki struktur kubus dengan parameter kisi a=8,3596 A
dan space group Fd-3m (Scharner, 1999).
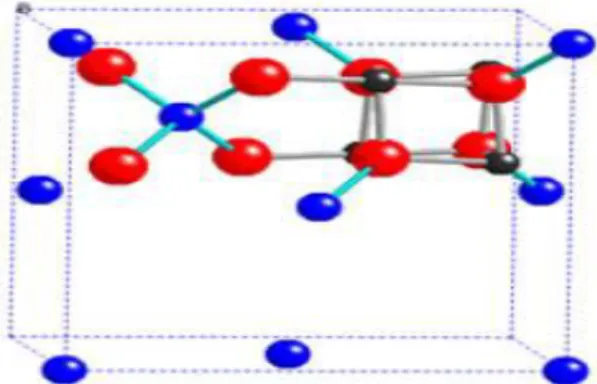
Gambar 2.4. Struktur spinel Li4Ti5O12 menunjukkan sisi tetrahedral dan sisi
oktahedral (Ogihara, 2012).
Li4Ti5O12 material anoda dengan kapasitas teoritis 175 mAh/g memiliki
penyisipan Li+ yang baik dan ekstraksi reversibilitas dalam tegangan 1,0-2,5 V dan menampilkan stabilitas struktural yang baik dengan hampir nol perubahan volume selama proses pengisian dan pengosongan. Ini juga memiliki tegangan dataran tinggi sangat datar dekat dengan 1,55 V (vs Li / Li +), yang lebih tinggi dari potensi penurunan paling elektrolit organik (Hsu.C.; Lin.J., 2012).
2.7.3 NaLiTi3O7
NaLiTi3O7 memiliki struktur kristal yang sama dengan MLi2Ti6O14 (M = Ba, Sr,
Pb) menunjukkan potensi operasi sekitar 1,25 V. Ini menunjukkan potensi sebagai bahan penyimpanan lithium yang menjanjikan dengan kapasitas teoritis yaitu 281 mAh/g. Senyawa ini dapat dengan mudah disintesis oleh reaksi tradisional solid state, metode sol gel atau cair dengan sintesis garam pada suhu kalsinasi yang cukup. NaLiTi3O7 mendapat konduktivitas elektronik instrinsik yang rendah
Dalam rangka meningkatkan kemampuan penyimpanan lithium berbagai metode telah digunakan untuk memodifikasi NaLiTi3O7 untuk mengembangkan
anoda yang cocok seperti lapisan dan doping. Hal ini dapat ditemukan bahwa lapisan karbon hitam, graphene dan karbon nanotube dapat meningkatkan konduktivitas elektronik dan kemudian menyebabkan kapasitas tertentu yang lebih tinggi dan peredaran kinerja anoda NaLiTi3O7 yang unggul. Selain itu,
diketahui bahwa modifikasi doping juga merupakan metode yang efektif untuk meningkatkan kinerja produk elektrokimia. Anion dan kation yang termasuk yaitu N3-, Br-, F-, K+, Ag+, Ni2+, Mg2+, Ca2+, Sc3+, La3+, Gd3+, Nb5+, V5+, W6+ dan Mo6+ telah banyak diteliti sebagai ion doping di titanate (Wang,P. 2015).
NaLiTi3O7 disintesis dengan metode solid state antara 500 0C dan 900 0C.
Ukuran partikel NaLiTi3O7 bertahap antara 200 mesh - 400 mesh. Analisis
morfologi partikel menunjukkan bahwa ukuran NaLiTi3O7 bertahap meningkat
dengan semakin meningkatnya suhu sintering. Pada saat kalsinasi dengan suhu 900 0C, NaLiTi3O7 menunjukkan agregasi partikel ringan dan mencair. Bahan
NaLiTi3O7 dengan suhu 800 0C menunjukkan hasil yang lebih baik (Shu, J. 2015).
2.8. Bahan Baku Pembuatan Lembaran Anoda 2.8.1 TiO2
Titanium dioxide dikenal dengan Titanium (IV) oxide atau titania, adalah oksida alami dari titanium, rumus kimia TiO2. Serbuk titanium dioksida tidak terjadi di
alam tetapi berasal dari ilmenite atau leuxocene ores. Hal ini juga lebih mudah ditambang dengan bentuk yang paling murni. Titanium dioxide terjadi dialam yang dikenal sebagai bentuk mineral rutile, anatase, dan brookite dan tambah dua bentuk tekanan tinggi, monoclinic baddeleyite dan orthorhombic α-PbO2 seperti
yang baru-baru ini ditemukan di kawah Bavaria. Bentuk yang paling umum dikenal yaitu rutile, yang paling stabil.
Tabel 2.3 Sistem kristal fase pada TiO2 (Game,O.2016)
Fasa Sistem kristal
Rutile Tetragonal
Anatase Tetragonal
Rutile : Setiap bentuk oktahedral dengan delapan tetangga dan saham tepi dengan dua tetangga lainnya, yang membentuk rantai linier. Anatase : Setiap sudut segi delapan dengan tetangga dan sudut tepi dengan
empat tetangga lainnya, yang membentuk rantai zigzag dengan sumbu sekrup .
(a) (b)
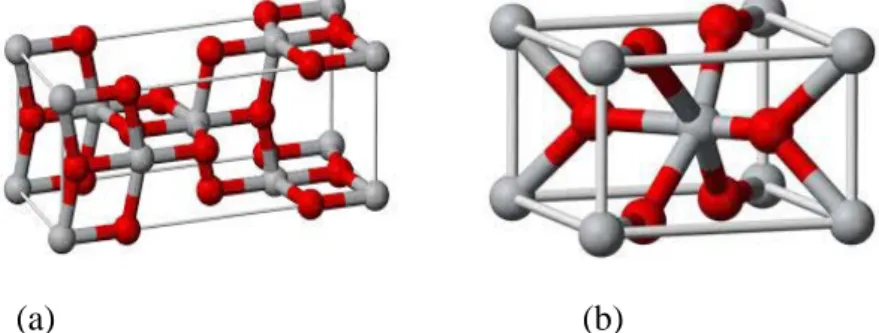
Gambar 2.5. Struktur kristal TiO2 pada (a) fasa anatase dan (b) fasa rutil
(Kamal, 2010)
Rutil adalah lebih umum dan mineral yang lebih terkenal dari tiga bentuk, sementara anatase adalah yang paling langka. interaksi logam-logam besar terjadi dalam kasus anatase (5.35Å) dan lebih kecil terjadi dalam kasus rutil (2,96 Å). Perbedaan-perbedaan dalam struktur kisi menyebabkan kepadatan massa yang berbeda dan struktur pita elektronik antara dua bentuk TiO2 (Kamal, C. 2010).
Tabel 2.4 Spesifikasi TiO2 (Kamal, C. 2010)
Formula kimia TiO2
Berat Molekul 79,9
Struktur kristal Tetragonal
Densitas, gr/cm3 pada 300 K 4,25
Jarak transmisi 0,43-6,2
Konstanta dielektrik 104-107Hz 200-160
TiO2 memiliki suhu melting tertinggi yaitu 1850oC. Sedangkan bahan Na2CO3 dan
LiOH.H2O memiliki suhu melting lebih rendah dari suhu 800oC. Jadi
reaksi namun sudah menguap sehingga yang tertinggal hanya TiO2 saja dan sifat
elektrokimia sudah berbeda dari asalnya. Salah satu bahan anoda menjanjikan diusulkan untuk aplikasi baterai ion lithium adalah TiO2 anatase karena
keuntungan besar yang seperti kelimpahan alami yang tinggi, kapasitas teoritis tinggi (335 mAh/g), kimia / stabilitas struktural, non-toksisitas, keramahan lingkungan, discharge rendah (Game. O. dkk., 2016).
2.8.2 LiOH.H2O
Lithium hidroksida monohydrate merupakan senyawa anorganik dengan rumus kimia LiOH.H2O. Bahan ini warna putih berbentuk kristal dengan berat molekul
41,96 gr/mol, densitas 1,51 gr/cm3 dapat mengurai diatas suhu 942oC. Bahan LIOH.H2O bisa digunakan sebagai bahan pembetukan anoda pada baterai.
LiOH.H2O dapat larut dalam air dan sedikit larut dalam etanol. Namun, lithium
hidroksida monohydrate dapat menyebabkan iritasi pada kulit, kebutaan, dan jika menghirup terus menerus dapat menyebabkan kerusakan paru-paru. (http://pubchem.ncbi.nlm.nih.gov/compound/Lithium_hydroxide_monohydrate#s ection=safety-and-hazard-properties)
2.8.3 Na2CO3
Natrium karbonat atau Na2CO3, adalah garam natrium dari asam karbonat yang
mudah larut dalam air. Natrium karbonat murni itu berwarna putih, tidak berbau, dapat menyerap embun dari udara, punya rasa alkalin/pahit, dan membentuk larutan alkali yang kuat. Na2CO3 memiliki massa molar senilai 105,99 gr/mol,
kapasitas kalor senilai 109,2 J/mol.K, kepadatan 2,54 gr/cm3, titik lebur 851 oC, titik didih 1.600 oC. Kegunaan Na2CO3 yaitu sebagai bahan pembuatan baterai,
dan pembuatan kaca (https://id.wikipedia.org/wiki/Natrium_karbonat).
2.9. Bahan Tambahan Pembuatan Lembaran Anoda 2.9.1 PVDF
Polyvinylidene Fluoride Difluorida (PVDF) merupakan bahan polimerisasi yang berbahaya dengan rumus kimia C2H2F2. Polyvinylidene Fluoride Difluorida (PVDF) digunakan sebagai bahan pengikat untuk menjaga integritas elektroda dan sebagai perantara filler dan zat aditif. PVDF sebagai pengikat untuk menjaga
integritas elektroda dan perantara hubungan filler dengan zat aditif. PVDF memiliki karakteristik kimia dan fisika yaitu warna putih, tidak berbau, daya serap air 0,03 %, titik leleh 169 oC, temperatur defleksi 114-118oC, kuat tarik 7,105 ps, penambahan panjang yaitu 250%. PVDF digunakan pada aplikasi seperti pembuatan pipa, pelat, lembaran anoda dan katoda (Afton Plastics, 2014).
2.9.2 Zat Aditif Acetylene Black (AB)
Acetylene Black merupakan karbon black dihasilkan dari dekomposisi terus menerus gas asetilena. Acetylene black terdiri dari komposisi kristal yang besar, Membentuk struktur panjang, Memiliki inpuritas yang paling sedikit dari karbon hitam lainnya, konduktivitas listrik yang baik, kapasitas absorpsi yang tinggi, konduktivitas termal yang baik. Acetylene black didalam baterai memiliki beberapa keunggulan yaitu dari absorpsi yang tinggi dan bersifat konduktif. Acetylene black telah digunakan sebagai bahan dasar untuk memproduksi sel baterai kering, serta sebagai zat aditif dalam karet atau plastik bahan antistatik dan elektrik konduktif yang digunakan dalam berbagai bidang industri ( Safety data sheet, 2002).
2.9.3 DMAC (Dimethylacetamide)
Dimethylacetamide merupakan bahan kimia yang umumnya digunakan dalam penyusunan formula kimia untuk aplikasi industri, pembuatan zat kimia lain (digunakan sebagai perantara), dan sebagai pelarut dalam proses industri. Sifat fisik dan kimia N,N DMAC yaitu berupa cairan tak berwarna hingga kuning dan memiliki bau amonia lemah, Kelarutan dalam air > 1.000 g/l (20°C), massa molar 87.12 g/mol. Titik beku -20°C dan titik didih 165-166°C, non-eksplosif namun dianggap sebagai cairan yang tidak mudah terbakar. Nilai pH 4 (200g/l , 20°C), titik lebur -20°C (MSDS).
2.10. Karakterisasi Serbuk dan Elektrokimia 2.10.1 X-Ray Diffraction (XRD)
X-Ray Diffraction memberikan informasi tentang susunan atom dalam padatan (kristal) sampel. Hal ini penting untuk menyebutkan bahwa XRD hanya dapat
diterapkan pada struktur kristal. Dalam kristal, atom diatur dalam pola yang teratur, yang membuat bahwa volume kecil dapat diidentifikasi, bahwa dengan pengulangan dalam tiga dimensi menggambarkan seluruh kristal. Volume kecil ini disebut sel satuan dan dapat dijelaskan oleh tiga sumbu: a, b dan c, dan sudut α,β, dan γ. Posisi puncak dan puncak intensitas yang berbeda dari pola difraksi
digunakan untuk mengidentifikasi struktur kristal atau fase bahan (Wolf, R.D. 2012).
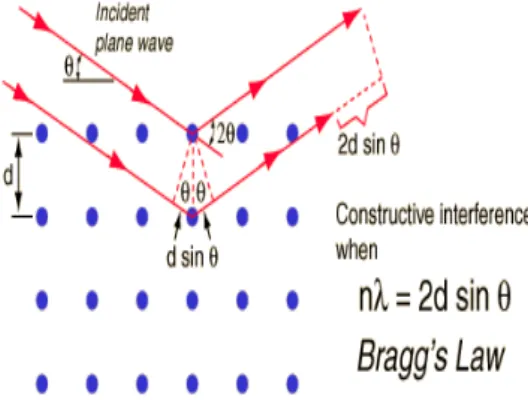
Gambar 2.6. Difraksi sinar-x hukum Bragg (Sun, Xiangcheng.2015)
Hukum Bragg adalah salah satu yang paling hukum penting yang digunakan untuk menafsirkan data difraksi sinar-X. Untuk himpunan bidang kisi dengan jarak antar-bidang d, kondisi interferensi konstruktif, sehingga puncak difraksi, dapat hanya ditulis sebagai
nλ = 2d sin θ (2.3)
Dimana λ adalah panjang gelombang sinar X-ray, θ merupakan sudut antara balok insiden X-ray dan bidang kristalografi, dan n bilangan bulat yang mewakili urutan puncak difraksi. Ketika sinar X-ray berinteraksi dengan atom dalam sampel, sebagian kecil dari kristal dengan bidang kristalografi berorientasi dengan Bragg sudut θ, di mana difraksi Bragg dapat berlangsung. Dengan sampel tahap berputar sehubungan dengan insiden sinar X-ray, pola XRD mengandung difraksi karakteristik dapat direkam oleh detektor. Pola difraksi XRD tersebut berguna untuk mengidentifikasi karakteristik kristal seperti ukuran, kristalinitas, parameter kisi dan fasa dengan database XRD komprehensif (Sun, X. 2015).
2.10.2 Scanning Electron Microscopy (SEM)
SEM digunakan untuk memperoleh informasi kualitatif dan kuantitatif tentang morfologi atau komposisi sampel dengan tujuan untuk mengoptimalkan hubungan mikroskopis dengan data kromatografi. Pada prinsipnya, analisa SEM harus mengekstrak jumlah maksimum informasi yang diperoleh per fitur dan meminimalkan baik kompleksitas dan waktu yang dibutuhkan untuk analisis (J. I. Goldtein, D. E. Newbury, P. Enchin, D. C. Joy, C.Fiori, E. Lifshing., 1981).
Dalam SEM, berkas elektron dilewatkan melalui ruang dan dievakuasi kemudian difokuskan oleh lensa elektromagnetik ke permukaan sampel. Balok dipulihkan selama proses spesimen dan kemudian disinkronkan dengan sinar tabung katoda (CRT). Setelah dilakukan pelampiasan pada elektron sampel elektron sekunder secara inelastic dipancarkan dari sampel dan dikumpulkan oleh sintilator. Sinyal yang dihasilkan digunakan untuk memodulasi kecerahan tabung sinar katoda untuk membentuk tampilan layar CRT. Pencitraan SEM diperbesar dengan manipulasi yang dikendalikan sepenuhnya secara terkomputerisasi dari berkas elektron (M. Postek, K. Howard, A. Johnson, K. Mcmchael., 1980).
2.10.3 Cyclic Voltammetry (CV)
CV adalah jenis pengukuran elektrokimia potensio dinamik,dan merupakan salah satu metode elektrokimia yang paling sering digunakan karena relatif sederhana dan isi informasi yang tinggi. Selama pengujian CV, pada gambar 2.7 (a) potensi linear pemindaian siklik (yaitu, elektroda potensial landai linear terhadap waktu) dikenakan ke elektroda dan arus yang dihasilkan dicatat.
Gambar 2.7. Tipikal Cyclic Voltammogram untuk proses redoks reversibel (Sun, Xiangcheng.2015)
Gambar 2.7 (b) dikenal sebagai scan rate (V/s). Kurva arus-tegangan (untuk voltamogram siklik) menunjukkan respon arus sebagai fungsi dari tegangan daripada waktu, yang dapat memberikan informasi tentang kinetika dan termodinamika reaksi elektroda. Sistem yang paling sederhana melibatkan reaksi redoks reversibel dengan transfer elektron tunggal dalam media solusi di mana tingkat maju dan mundur reaksi yang dekat dengan keseimbangan. CV sering digunakan untuk menampakkan proses difusi pengontrol di mana spesies electroactive masukkan ke elektroda. Koefisien difusi kimia lithium ion di elektroda dihitung dari data CV. Singkatnya, CV adalah alat yang nyaman untuk memperoleh informasi kualitatif tentang proses transfer elektron, serta metode cepat untuk memperoleh perkiraan yang baik dari potensi pengurangan dan konstanta pembentukan (Sun, Xiangcheng.2015).
2.10.4 Charge Discharge (CD)
Charge-discharge adalah teknik elektrokimia yang paling umum digunakan untuk karakterisasi perangkat penyimpanan energi. Dalam pengujian ini sebuah cell diisi dan dikosongkan dengan menggunakan arus konstan di antara tegangan atas dan tegangan bawah. Batas tegangan atas dan bawah ditentukan oleh energi bebas Gibbs dari bahan elektroda.
Jenis paduan elektroda negatif, secara praktik batas bawah berkisar 10 mV sampai 50 mV dan batas atas berkisar 1 V sampai 2 V, Batas bawah yang dipilih lebih rendah dari 0 V vs Li/Li+ karena pada potensi rendah lithium cenderung untuk deposit (penyetor) pada permukaan elektroda yang akhirnya menyebakan pertumbuhan dendrit lithium.Arus yang diterapkan secara langsung berkaitan dengan outpit daya elektroda. Biasanya “laju C” digunakan untuk menetukan tingkat cycle LIBs, dimana xC didefinisikan sebagai 1/x jam per charge atau discharge (Juchuan, 2012).
2.10.5 Electrochemical Impedance Spectroscopy (EIS)
Electrochemical Impedance Spectroscopy adalah alat yang sangat ampuh untuk analisis sistem yang kompleks elektrokimia. Alat yang digunakan yaitu LCR meter, HIOKI 3522 Autolab tahun 2012. Parameter yang dihasilkan yaitu
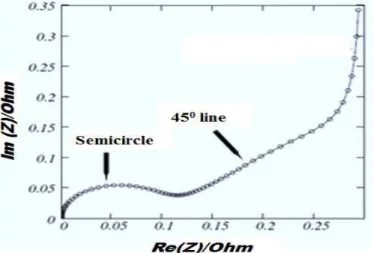
impedansi ril, impedansi imaginer, pergeseran sudut fasa, dan impedansi total, dengan variasi spektrum frekuensi dalam skala logaritmik. Spektrum frekuensi dibangkitkan dari 4 Hz- 1 MHz. Metode EIS digunakan untuk mengamati interkasi elektron maupun ion yang berpindah pada komponen sel pada saat reaksi elektrokimia. Spektrum frekuensi yang dinaikkan akan mengidentifikasi perubahan impedansi komplek yang terkait dengan reaksi elektrokimia yang terjadi, menginterprestasikan gejala dinamika internal reaksi elektrokimia. Pada pengukuran dilakukan menggunakan signal pertubasi AC ditumpangkan pada tegangan DC bias, sehingga tidak terganggu kesetimbangan dari reaksi elektrokimia. Interaksi signal dalam sampel menghasilkan signal yang tereduksi mengalami pergeseran sudut fasa. bentuk respon gelombang dikorelasikan pada komponen impedansi ril, impedansi imaginer, pergeseran sudut fasa (Subhan, 2011). Pada gambar 2.8 Impedansi real diplot pada sumbu X dan impedansi imaginery diplot pada sumbu Y sehingga terbentuk grafik "Nyquist plot. Metode EIS telah secara luas diterapkan untuk menyelidiki interkalasi reversibel lithium ke elektroda untuk baterai ion lithium yang terkait dengan kinetika difusi ion lithium di elektroda (Sun, Xiangcheng.2015). Kelebihan pada EIS adalah memiliki arus listrik AC, bukan DC, sehingga dapat mengukur impedansi elektrokimia pada kondisi equilibrium, kondisi setimbang tanpa mengganggu atau membebani sel sehingga impedansi yang terukur lebih baik dibandingkan cara uji arus DC. Namun kekurangan EIS adalah sampel memunculkan kurva yang kurang ideal dari bentuk komponen impedansi RLC (Subhan, 2011).
Gambar 2.8. Tipikal Nyquist plot pada sistem elektrokimia (Sun, Xiangcheng.2015).