IMUNO GL OBULI N G DAN I MUNO GL OBULI N M PADA
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Prog Studi Farmasi
Oleh :
Ellen Naomi Nauli S inaga
NIM : 088114077
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
PE NGARUH PEMB ERIAN MADU H UT AN T ERH ADAP
i
IMUNO GL OBULI N G DAN I MUNO GL OBULI N M PADA
HEWAN UJI T I KUS JANTAN GAL UR WISTAR
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S. Farm)
Prog Studi Farmasi
Oleh :
Ellen Naomi Nauli S inaga
NIM : 088114077
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
2012
iv
Aku bersyukur kepadaMu oleh karena kejadianku
dahsyat dan ajaib, ajaib apa yang Kau buat dan jiwaku
benar-benar menyadarinya (Mazmur 139 : 14)
Tetapi karena kasih karunia Allah aku adalah sebagaimana aku
ada sekarang dan kasih karunia yang dianugerahkan-Nya
kepadaku tidak sia-sia ( 1 Korintus 15:10a)
Karya kecil ini kupersembahkan untuk :
Tuhan Yesusku, Papah, Mamah, Kak Ellys, Kak Yeyen,
Lia, Kak Gendhe, Kak Beng, Malaikat keciku Renata dan
Gabriel, dan Mereka yang membuatku tersenyum
vi
segala berkat dan anugrah-Nya sehingga penulis dapat menyelesaikan skripsi
dengan judul “P engaruh Pem beri an Madu Hut an Terhadap Im unogl obuli n G Dan Imunogl obul in M Pada Hewan Uji Tikus
Jantan Galur Wi star” untuk memenuhi syarat memperoleh gelar Sarjana Farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata Dharma.
Dalam penulisan skripsi ini, penulis banyak menemui kendala dan
hambatan, namun berkat dukungan, bimbingan, kritik dan saran dari berbagai
pihak penulis dapat menyelesaikannya. Oleh sebab itu, pada kesempatan ini
penulis mengucapkan banyak terima kasih kepada :
1. Ibu Yunita Linawati M.Sc, Apt selaku Dosen Pembimbing atas
kebijaksanaan, perhatian, dan kesabarannya dalam membimbing
penyusunan skripsi ini.
2. Prof. Dr. C. J. Soegihardjo, Apt selaku Dosen Penguji yang telah
memberikan saran yang menjadikan penulisan skripsi menjadi lebih baik.
3. Dr. Ag. Yuswanto, SU, Apt, PhD selaku Dosen Penguji atas masukan
yang menjadikan penulisan skripsi menjadi lebih baik.
4. Bapak Ipang Djunarko, M.Sc., Apt selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma.
5. Ibu CM. Ratna Rini Nastiti, M.Pharm., Apt selaku Ketua Program Studi
Farmasi Fakultas Farmasi Universitas Sanata Dharma.
6. Pimpinan Laboratorium Pengembangan dan Penelitian Terpadu
Universitas Gadjah Mada Yogyakarta yang telah mengijinkan untuk
melakukan penelitian khususnya kepada Bapak Sutari dan Ibu Istini atas
bimbingan dan bantuannya dalam pengerjaan skripsi ini.
7. Balai Laboratorium Kesehatan Yogyakarta yang membantu dalam
penyediaan bahan selama penelitian khususnya Ibu Darwani.
PRAKATA
vii
8. Teman-teman seperjuangan penelitian: Perthy Melati Kasih dan Kartika
Sari Senas.
9. Sahabatku tersayang Liani, Devia, Eureka Gracia Letitia; Mezcovits
Team : Matraisa Bara Asi, Rudi Frianto, Wina Gracelia, Fellin Nabella,
Ade Satrya, Edward Setiade, Stephani Nurina, Michael Andrean;
Bojoners : Adityawarman, Primaboti, Christina Putranti, Wiria Sende,
Agatha Novita, Ketut Ary Widiasih, Yohanes Hermawan; Teman
seperjuangan praktikum : Jepta Willy, Margaretha Ratih, Ledy Yoanita,
Arumsih Kristiningtyas, Elisabeth Primadhani, Deni Utik, Reyneldis
Adista; dan Jossi Arizon Purba untuk kebersamaan, canda, tawa, suka
dan duka.
10. Teman-teman angkatan 2008 khususnya FKK A ’08.
11. PMK Apostolos tempatku bertumbuh dalam Kristus dan tempatku
menemukan keluarga baru yang sangat luar biasa.
12. Semua pihak yang tidak dapat penulis sebutkan satu persatu, yang telah
membantu dalam kelancaran penyelesaian skripsi ini.
Penulis menyadari bahwa skripsi ini jauh dari sempurna. Oleh karena itu,
segala kritik dan saran yang membangun sangat penulis harapkan demi
sempurnanya skripsi ini. Semoga skripsi ini dapat bermanfaat dan memberi
informasi bagi pembaca.
ix
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSETUJUAN PUBLIKASI ... v
PRAKATA ... vi
PERNYATAAN KEASLIAN KARYA ... viii
DAFTAR ISI ... ix
3. Manfaat penelitian ... 3
a. Manfaat teoritis ... 3
b. Manfaat praktis ... 3
B.Tujuan Penelitian ... 3
x
B.Sistem Imun ... 9
1. Respon imun nonspesifik ... 9
2. Respon imun spesifik ... 10
C.Imunoglobulin ... 11
1. Jenis imunoglobulin ... 12
2. Pembentukan antibodi ... 15
D.Imunomodulator ... 17
E. Enzyme Linked Immunosorbant Assay ... 18
F. Landasan Teori ... 19
G.Hipotesis ... 20
BAB III. METODE PENELITIAN A.Jenis dan Rancangan Penelitian ... 21
B.Variabel dan Definisi Operasional ... 22
1. Variabel penelitian ... 22
2. Definisi operasional ... 22
C.Bahan Penelitian ... 23
D.Alat Penelitian ... 24
E. Tata Cara Penelitian ... 24
1. Tahap penentuan dosis madu hutan ... 24
2. Tahap orientasi dosis madu hutan ... 25
3. Tahap percobaan ... 26
4. Penetapan imunoglobulin G dan imunoglobulin M ... 27
F. Analisis Hasil ... 28
BAB IV. HASIL DAN PEMBAHASAN A.Pengukuran Imunoglobulin G dan Imunoglobulin M ... 29
B.Tahap Orientasi Dosis ... 33
1. Pengaruh pemberian madu hutan terhadap imunoglobulin M pada tahap orientasi dosis ... 33
xi
C.Pengaruh Pemberian Madu Hutan Dosis 0,27 mL/200 g BB; 0,54 mL/200 g
BB; 1,08 mL/200 g BB terhadap Imunoglobulin M dan Imunoglobulin G ... 38
1. Pengaruh pemberian madu hutan terhadap imunoglobulin M ... 38
2. Pengaruh pemberian madu hutan terhadap imunoglobulin G ... 40
BAB V. KESIMPULAN DAN SARAN A.Kesimpulan ... 43
B.Saran ... 43
DAFTAR PUSTAKA ... 44
LAMPIRAN ... 47
xii
Tabel I. Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M pada
Tahap Orientasi Dosis setelah Pemberian Madu Hutan ... 33
Tabel II. Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin G pada
Tahap Orientasi Dosis setelah Pemberian Madu Hutan ... 35
Tabel III. Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M
setelah Pemberian Madu Hutan ... 38
Tabel IV. Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin G
setelah Pemberian Madu Hutan ... 40
xiii
Gambar 1. Struktur Prototip Ig G : Struktur Rantai dan Ikatan Disulfide... 13
Gambar 2. Pentamer Imunoglobulin M ... 14
Gambar 3. Kurva Produksi Antibodi Respon Imun Primer dan Sekunder ... 16
Gambar 4. Indirect ELISA ... 18
Gambar 5. Grafik Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M pada Tahap Orientasi Dosis setelah Pemberian Madu Hutan ... 34
Gambar 6. Grafik Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin G pada Tahap Orientasi Dosis setelah Pemberian Madu Hutan ... 35
Gambar 7. Grafik Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M setelah Pemberian Madu Hutan ... 38
Gambar 8. Grafik Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin G setelah Pemberian Madu Hutan ... 40
xiv
Lampiran 1. Surat Kelaikan Etik ... 48
Lampiran 2. Surat Keterangan Penelitian ... 49
Lampiran 3. Foto Perbandingan Madu Hutan dan Madu Monoflora... 50
Lampiran 4. Komposisi ELISA... 51
Lampiran 5. Perhitungan Dosis Madu Tahap Orientasi Dosis ... 52
Lampiran 6. Titer Imunoglobulin G Hasil Orientasi Dosis ... 53
Lampiran 7. Titer Imunoglobulin M Hasil Orientasi Dosis ... 54
Lampiran 8. Pengujian Statistik Imunoglobulin G Hasil Orientasi Dosis ... 55
Lampiran 9. Pengujian Statistik Imunoglobulin M Hasil Orientasi Dosis... 57
Lampiran 10. Perhitungan Dosis Madu Tahap Percobaan ... 59
Lampiran 11. Penimbangan Berat Badan Tikus ... 60
Lampiran 12. Titer Imunoglobulin G Tahap Percobaan ... 61
Lampiran 13. Titer Imunoglobulin M Tahap Percobaan ... 62
Lampiran 14. Pengujian Statistik Imunoglobulin G Hasil Percobaan ... 63
Lampiran 15. Pengujian Statistik Imunoglobuilin M Hasil Percobaan ... 65
xv
Madu hutan mengandung beberapa senyawa organik, salah satunya flavonoid yang dapat meningkatkan sistem kekebalan tubuh. Flavonoid diketahui memiliki aktivitas sebagai antioksidan dan antibakteri serta berpotensi sebagai imunomodulator. Tujuan penelitian ini untuk mengetahui pengaruh pemberian madu hutan terhadap imunoglobulin G dan imunoglobulin M pada hewan uji tikus jantan galur Wistar.
Jenis penelitian ini adalah eksperimental murni dengan rancangan acak pola searah. Sebanyak 20 ekor tikus dibagi menjadi 4 kelompok, yaitu kelompok perlakuan diberikan madu hutan dengan dosis 0,27 ml/200 g BB tikus; 0,54 mL/200 g BB tikus; dan 1,08 ml/200 g BB tikus; serta kelompok kontrol negatif diberikan aquadest 2,5 mL/200 g BB tikus. Pada hari ke-1 dan ke-14 tikus diinduksi peritoneal dengan Staphylococcus epidermidis. Serum diambil pada hari 7 untuk pengukuran imunoglobulin M dan pada hari ke-18 untuk pengukuran imunoglobulin G melalui sinus orbitalis dengan menggunakan metode ELISA tak langsung. Data dianalisis dengan uji one way
ANOVA dilanjutkan dengan uji Tukey.
Hasil penelitian menunjukkan bahwa pemberian madu hutan tidak berpengaruh terhadap imunoglobulin G dan imunoglobulin M.
Kata kunci: Madu hutan, imunomodulator, imunoglobulin G, imunoglobulin M
xvi
Honey forest contains some organic compounds, like flavonoids that can increase the immune system. Flavonoids potentially has antioxidant, antibacterial and immunomodulator. The aim of this research was to evaluate the effect of honey forest to immunoglobulin G and immunoglobulin M on animals test of male rats Wistar strain.
This research is experimental with one way complete randomized design. Total of 20 rats was divided into 4 groups. Each group was given honey forest with dose of 0,27 ml/200 g BW ; 0,54 mL/200 g BW ; 1,08 ml/200 g BW, and negative control group given aquadest 2,5 mL/200 g BW. On the day 1 and 14, rats were induced peritoneal by Staphylococcus epidermidis. The serum were taken from sinus orbitalis on the day 7 and 18. The immunoglobulin G and immunoglobulin M were measured by indirect ELISA method. Data were analyzed by one way ANOVA test followed by Tukey test.
The result shows that there is no effect of honey forest to immunoglobulin G and immunoglobulin M
Key words: Forest honey, immunomodulator, immunoglobulin G, immunoglobulin M
1
PENGANTAR
Madu merupakan cairan yang berasal dari nektar tanaman yang diproses
oleh lebah menjadi madu dan tersimpan dalam sel-sel sarang lebah. Di Indonesia
terdapat beberapa jenis madu berdasarkan jenis flora yang menjadi sumber
nektarnya, yaitu madu monoflora dan madu poliflora (Suranto, 2007). Madu
monoflora merupakan madu yang diperoleh dari satu tumbuhan utama dan
mempunyai wangi, warna, dan rasa yang spesifik sesuai dengan sumbernya. Madu
poliflora atau yang biasa disebut madu hutan merupakan madu yang berasal dari
nektar beberapa jenis tumbuhan bunga, diproduksi oleh lebah-lebah liar dan
dianggap memiliki manfaat yang lebih baik dibandingkan madu monoflora.
Madu telah digunakan sejak zaman kuno sebagai bagian dari obat
tradisional. Penggunaan madu dalam beberapa aspek pengobatan
mengindikasikan bahwa madu memiliki fungsi sebagai antibakteri, antitumor,
antiinflamasi, antivirus, dan antioksidan (Rahadiyani, 2011). Madu mengandung
beberapa senyawa organik, yang telah terindentifikasi antara lain seperti polifenol,
flavonoid, dan glikosida (Rostinawati, 2009). Adanya kandungan flavonoid yang
terkandung di dalam madu hutan, dapat diperkirakan madu berpotensi sebagai
imunomodulator. Imunomodulator merupakan golongan obat yang mampu
mempengaruhi sistem imun atau sistem kekebalan tubuh (Sari, 2008). Menurut
Krell (cit., Jaya, dkk, 2008) kandungan flavonoid dapat meningkatkan sistem
BAB I
kekebalan tubuh baik seluler maupun humoral, salah satunya imunoglobulin.
Imunoglobulin menyediakan perlindungan yang sangat kuat untuk perawatan dan
pencegahan infeksi yang disebabkan oleh virus dan bakteri dan juga terhadap
jamur (Yaniesa, 2011). Imunoglobulin terdiri dari imunoglobulin M (Ig M),
imunoglobulin G (Ig G), imunoglobulin A (Ig A), imunoglobulin E (Ig E), dan
imunoglobulin D (Ig D) (Baratawidjaja, 2010). Jika terpapar suatu antigen asing
untuk pertama kali, maka tubuh akan meningkatkan respon imun. Dalam respon
ini, kelas pertama immunoglobulin yang dihasilkan adalah IgM diikuti oleh IgG
(dengan penurunan serentak dalam sintesis IgM) (Kresno, 2010). Imunoglobulin
M merupakan antibodi yang paling awal muncul setelah terjadi perangsangan
antigen untuk mengikat komplemen (Louise, 2011). Imunoglubulin G merupakan
imunoglobulin utama pada serum manusia yang meliputi 75 % dari seluruh
imunoglubulin yang dibentuk atas rangsangan antigen dan dapat menembus
plasenta dan masuk ke dalam peredaran darah janin sehingga pada bayi yang baru
lahir imunoglobulin G yang berasal dari ibu yang akan melindungi bayi dari
infeksi. Imunoglobulin G melapisi mikroorganisme sehingga partikel akan lebih
mudah difagositosis dan membantu dalam menetralisasi toksin dan virus (Kresno,
2010).
Melalui penelitian ini peneliti ingin mengetahui pengaruh dari pemberian
madu hutan terhadap immunoglobulin G dan immunoglobulin M sehingga dapat
diperoleh informasi mengenai penggunaan madu hutan sebagai imunomodulator
1. Permasalahan
Apakah pemberian madu hutan berpengaruh terhadap imunoglobulin G dan
imunoglobulin M pada hewan uji tikus jantan galur Wistar?
2. Keaslian penelitian
Sejauh yang diketahui penulis, penelitian mengenai pengaruh pemberian
madu hutan terhadap imunoglobulin G dan imunoglobulin M pada hewan uji tikus
jantan galur Wistar belum pernah dilakukan.
3. Manfaat penelitian a. Manfaat teoritis
1. Memberikan sumbangan ilmiah bagi ilmu pengetahuan mengenai
manfaat madu hutan sebagai imunomodulator.
2. Menambah informasi dalam bidang ilmu kefarmasian tentang
efektivitas madu hutan untuk kesehatan.
b. Manfaat praktis
Memberikan informasi dan menambah wawasan bagi masyarakat
mengenai manfaat madu hutan sebagai imunomodulator dalam meningkatkan
kesehatan.
B. Tujuan Penelitian 1. Tujuan umum
Memperoleh informasi mengenai pengaruh pemberian madu hutan pada
2. Tujuan khusus
Memperoleh informasi mengenai pengaruh pemberian madu hutan
terhadap immunoglobulin G dan immunoglobulin M pada hewan uji tikus jantan
5
BAB II
PENELAAHAN PUSTAKA
A. Madu
Madu adalah cairan yang berasal dari nektar tanaman yang diproses oleh
lebah pekerja menjadi madu dan tersimpan dalam sel-sel sarang lebah. Berbagai
kelebihan madu sebagai makanan bernutrisi tinggi sudah diketahui sejak zaman
dahulu (Haryati, 2010).
1. Jenis madu
Berdasarkan asal cairan yang diambil oleh lebah, madu dibedakan atas
tiga jenis yaitu madu nektar, honey dew dan madu buatan. Madu nektar berasal dari cairan nektar baik dari satu macam bunga (monoflora), beberapa macam bunga (polyflora) ataupun dari bagian tanaman selain bunga (extraflora). Honey dew berasal dari cairan manis yang dikeluarkan oleh insekta pengisap tanaman yang dikumpulkan dan disimpan oleh lebah di dalam sarangnya, sedangkan madu
buatan adalah madu yang berasal dari cairan gula yang dikumpulkan dan
disimpan (Suranto, 2004).
Berdasarkan warnanya, madu dapat dibedakan menjadi beberapa jenis,
yaitu jernih (water white), amber, hitam (dark amber), putih (white) (National Honey Board, 2001). Madu amber telah diketahui mempunyai aktivitas
bakteriostatik dan bakterisida, baik terhadap bakteri Gram positif maupun Gram
negatif (Mulu, Tessema, Derby, 2004). Madu hitam mempunyai rasa pahit dan
lainnya (Ismail, 2007) dan madu putih mempunyai rasa yang sangat manis, aroma
yang khas, dan after taste yang kuat (Sukartiko, 1986).
Di Indonesia terdapat beberapa jenis madu berdasarkan jenis flora yang
menjadi sumber nektarnya. Madu monoflora merupakan madu yang diperoleh dari
satu tumbuhan utama. Madu ini biasanya dinamakan berdasarkan sumber
nektarnya, seperti madu kelengkeng, madu rambutan, dan madu randu. Madu
monoflora mempunyai wangi, warna, dan rasa yang spesifik sesuai dengan
sumbernya, sedangkan jenis yang lain yaitu madu poliflora yang merupakan madu
yang berasal dari nektar beberapa jenis tumbuhan bunga. Madu ini biasanya
berasal dari hutan yang diproduksi oleh lebah-lebah liar yang bernama Apis dorsata. Madu hutan juga sangat baik untuk kesehatan karena mengandung antibiotik alami yang diproduksi oleh lebah-lebah liar. Kualitas madu hutan
dianggap lebih baik daripada madu hasil lebah ternak sebab bunga yang
dikonsumsi lebah-lebah tersebut tidak mengandung pestisida yang kemungkinan
besar ditemukan pada tanaman atau pohon yang sengaja ditanam untuk
perternakan lebah (Suranto, 2007).
2. Komposisi madu
Madu yang baik harus dapat memenuhi ketentuan yang ditetapkan oleh
Standar Industri Indonesia (SII) tahun 1977 dan 1985. Kadar yang sesuai dengan
standar SII hanya mungkin terdapat pada madu murni, yaitu madu yang belum
diberi campuran dengan bahan-bahan lain (Suranto, 2007). Komposisi kimia
madu bervariasi tergantung pada sumber tanaman, musim dan metode produksi
adalah dua gula utama yang terdapat pada madu secara umum, dengan jumlah
sukrosa yang kurang (sekitar 1%), serta disakarida dan oligosakarida yang lain. Di
dalam madu juga terdapat kandungan mineral dan garam atau zat lain seperti
potassium, zat besi, sulfur, magnesium, kalsium, kalium, khlor dan natrium dan
fosfor. Potassium merupakan mineral utama pada madu. Madu mengandung
vitamin A, B1, B2, B3, B5, B6, C, D, E, K, beta karoten, flavonoid, asam fenolik,
asam urat, asam nikotinat, asam glukonat, antibiotika, enzim pencernaan serta
asam amino. Madu memiliki keasaman yang rendah dengan pH sekitar 3,9.
Kandungan air madu sekitar 17%, dengan aktivitas air antara 0,56-0,62. Selain itu,
madu mengandung asam glukonat dan jumlah protein yang kecil serta asam
amino (Haryati, 2010).
3. Manfaat Madu
Madu telah lama digunakan sebagai obat tradisional untuk mengobati
penyakit infeksi seperti infeksi pada saluran pernafasan, gastrointestinal, dan
luka-luka pada kulit (Mulu et al., 2004). Madu merupakan salah satu sumber makanan yang baik yang dapat meningkatkan stamina tubuh. Selain itu, madu
juga dapat digunakan sebagai pengganti gula atau suplementasi nutrisi. Produk
lebah ini dapat menyembuhkan berbagai macam penyakit seperti jantung,
paru-paru, lambung, sistem pencernaan, influenza, katarak, luka infeksi, dan masih
banyak lagi khasiat dari madu. Madu juga banyak digunakan dalam dunia
kosmetika, baik dalam bentuk sabun, masker, dan krim pelembut. Madu dapat
Madu mengandung zat antibiotik yang berguna melawan bakteri patogen
penyebab penyakit infeksi (Hariyati, 2010). Menurut Winarno (cit., Hariyati, 2010), gula dan mineral dalam madu berfungsi sebagai tonikum bagi jantung.
Antioksidan madu diyakini mampu mencegah terjadinya kanker, penyakit
jantung, dan penyakit lainnya. Selain itu madu juga dapat membunuh dan
mencegah kuman untuk berkembang sehingga madu dipercaya dapat
menyembuhkan berbagai macam luka seperti luka bakar, luka infeksi, luka setelah
operasi dan lain-lain.
Madu mengandung flavonoid dan menurut Krell (cit., Jaya, dkk, 2008) kandungan flavonoid dapat meningkatkan sistem kekebalan tubuh baik seluler
maupun humoral. Flavonoid merupakan golongan senyawa tanaman yang
memiliki aktivitas bilologi yang cukup luas salah satunya adalah sebagai
imunostimulator. Aktivitas flavonoid sebagai imunostimulator sangat erat
kaitannya dengan aktivitas sebagai antimikroba, antiviral, antioksidan,
antiploriferatif, sitotoksik dan antiinflamasi. Mekanisme imunostimulator
flavonoid sangat beragam. Middleton dan Kandaswami (cit., Arsani, 2010) melaporkan bahwa flavonoid dapat berefek pada sel T, B, makrofag, NK, basofil,
mast, neutrofil, eosinofil, dan platelet. Selain itu beberapa flavonoid berefek pada
sistem enzim yg berperan dalam respon imun seperti tirosin kinase, treonin
kinase, fosfolipase A2, fosfolipase C, lipooksigenase, dan lain-lain. Enzim
tersebut berperan dalam sinyal transduksi dan aktivasi sel sistem imun. Flavonoid
dalam tubuh manusia berfungsi sebagai antioksidan untuk mencegah kanker,
dengan mengganggu fungsi dari mikroorganisme dari bakteri atau virus. Efek
lainnya adalah mencegah alergi karena flavonoid mampu mencegah lepasnya zat
utama peyebab alergi, yaitu histamin dan serotonin (Suranto, 2007).
Konsumsi madu untuk pencegahan penyakit pada manusia adalah 1-2
kali/hari 1 sendok makan, sedangkan untuk menyembuhkan suatu penyakit,
dianjurkan untuk minum lebih banyak, yaitu 3-4 kali/hari 1 sendok makan
(Suranto, 2007).
B.Sistem Imun
Sistem imun memiliki fungsi utama melindungi tubuh dari mikroba
patogen yang terpapar ke tubuh. Fungsi tersebut melalui dua tingkatan dari respon
imun yaitu munculnya respon imun spesifik melawan paparan mikroba patogen
dan kontrol infeksi kemudian membentuk memori dari paparan pertama dan
respon imun yang cepat pada paparan patogen yang sama (Ahmed,Lanier, Pamer
,2002). Pertahanan tubuh terhadap mikroba patogen diperantarai oleh reaksi awal yang disebut respon imun nonspesifik dan respon imun spesifik sebagai respon
selanjutnya (Abbas, et al, 2000)
1. Respon imun non-spesifik(Innate immunity)
Respon imun non-spesifik atau imunitas alami terdiri dari mekanisme
yang sudah ada dalam tubuh sebelum terjadinya infeksi yang mampu memberikan
respon secara cepat terhadap mikroba dan merupakan reaksi utama melalui cara
atau mekanisme yang sama untuk infeksi berulang. Komponen dasar dari respon
lapisan epithelial dan substansi antimikroba yang diproduksi pada permukaan
epithelial; sel fagosit seperti neutrofil dan makrofag dan sel natural killer (NK); protein darah termasuk sistem komplemen dan mediator inflamasi; protein yang
disebut sitokin yang meregulasi dan mengkordinasi banyak dari aktivitas sel
innate immunity (Abbas et al., 2000)
2. Respon imun spesifik(Adaptive immunity)
Respon imun spesifik adalah imunitas tubuh yang diperoleh dengan cara
beradaptasi atau belajar mengenali secara spesifik berbagai jenis patogen dan
mempertahankan memori terhadap patogen tersebut untuk memberikan respon
yang cepat terhadap infeksi dimasa mendatang. Adaptasi tersebut terjadi selama
respon primer dari sistem imun terhadap berbagai jenis patogen. Respon primer
biasanya lambat dan terjadi beberapa hari setelah infeksi awal. Setelah respon
membersihkan infeksi, sistem imun akan mempertahankan memori dari berbagai
jenis patogen yang menyebabkan infeksi. Apabila tubuh terinfeksi patogen dari
jenis yang sama, tubuh tidak harus beradaptasi kembali terhadap patogen tersebut,
karena sudah ada memori terhadap patogen tersebut dan terjadi respon yang lebih
cepat yaitu respon sekunder yang biasanya terjadi dengan cepat. Memori tersebut
memberikan proteksi seumur hidup terhadap patogen tersebut (Hofmeyr, 2000).
Respon imun spesifik mencakup rangkaian interaksi seluler yang diekspresikan
dengan penyebaran produk-produk spesifik (Kresno, 2010).
Ada dua tipe respon imun spesifik yaitu imunitas humoral dan seluler
yang diperantarai oleh komponen yang berbeda dari sistem imun dan berfungsi
oleh molekul dalam darah yang disebut antibodi yang diproduksi oleh sel limfosit
B dan imunitas seluler yang dimediasi oleh limfosit T (Abbas et al., 2000). Respon imun adaptive (spesifik) dibagi ke dalam 3 fase yaitu pengenalan antigen, aktivasi limfosit, dan fase efektor (Abbas et al., 2000).
Respon imun spesifik dapat bersifat pasif atau aktif. Imunitas pasif
adalah imunitas yang dihasilkan dari pemberian antibodi atau produk dari sistem
imun lain misalnya limfosit aktif yang telah dibentuk sebelumnya pada tubuh
individu yang lain. Imunitas aktif adalah imunitas yang diinduksi oleh terpaparnya
antigen ke dalam tubuh individu sehingga individu tersebut akan membentuk
antibodi atau produk sistem imun lain untuk menetralkan antigen tersebut.
Paparan antigen dapat berasal dari infeksi klinik, imunisasi dengan agen infeksi,
misalnya vaksin dan transplatasi sel asing (Nairn, 2005).
C. Imunoglobulin
Imunoglobulin atau antibodi adalah suatu glikoprotein yang diproduksi
oleh sel B sebagai respon terhadap terpaparnya tubuh oleh molekul asing
(imunogen). Antibodi berikatan secara spesifik dengan antigen. Antibodi
didistribusikan ke semua cairan biologis tubuh dan ditemukan pada permukaan
sejumlah kecil dari beberapa jenis sel. Semua jenis antibodi ditandai dengan
karakteristik struktur dasar yang sama, yaitu memiliki struktur inti yang terdiri
dari dua rantai ringan (berat kira-kira 24 kD) dan dua rantai ringan (berat kira-kira
Imunoglobulin atau antibodi adalah sekelompok glikoprotein yang
terdapat dalam serum atau cairan tubuh pada hampir semua mamalia.
Imunoglobulin termasuk dalam glikoprotein yang mempunyai struktur dasar
sama, terdiri dari 82-96% polipeptida dan 4-18% karbohidrat (Akib, 2008).
Imunoglobulin dibentuk oleh sel plasma yang berasal dari proliferasi sel B yang
terjadi setelah kontak dengan antigen (Baratawidjaja, 2010). Molekul ini disintesis
oleh sel B dalam dua bentuk yang berbeda, yaitu sebagai reseptor permukaan dan
sebagai antibodi yang disekresikan ke dalam cairan ekstraseluler (Kresno, 2010).
1. Jenis imunoglobulin
Pada manusia dikenal lima kelas imunoglobulin. Tiap kelas mempunyai
perbedaan sifat fisik, tetapi pada semua kelas terdapat tempat ikatan antigen
spesifik dan aktivitas biologi berlainan (Akib, 2008). Ada dua jenis rantai ringan
(kappa dan lambda) yang terdiri atas 230 asam amino serta lima jenis rantai berat yang tergantung pada kelima jenis immunoglobulin, yaitu IgM, IgG, IgE, IgA,
dan IgD. Rantai berat terdiri atas 450-600 asam amino, sehingga berat dan
panjang rantai berat tersebut adalah dua kali rantai ringan. Molekul imunoglobulin
mempunyai rumus bangun yang heterogen, meskipun hanya terdiri atas empat
a) Imunoglobulin G
Gambar 1. Struktur Prototip Ig G: Struktur Rantai dan Ikatan Disulfide (Baratawidjaja, 2010)
Imunoglobulin G adalah imunoglobulin yang paling banyak dalam tubuh,
berada di intravaskuler dan ekstravaskular dan memiliki waktu paro relatif lama
(23 hari) (Bellanti, 1993). Dalam serum orang dewasa normal, imunoglobulin G
merupakan 75% dari total imunoglobulin dan dijumpai dalam bentuk monomer.
Imunoglobulin G merupakan imunoglobulin utama yang dibentuk atas rangsangan
antigen, menembus plasenta dan masuk ke dalam peredaran darah janin, sehingga
pada bayi yang baru lahir imunoglobulin G yang berasal dari ibu akan melindungi
bayi dari infeksi. Dari semua kelas imunoglobulin, imunoglobulin G paling
mudah berdifusi ke dalam jaringan ekstravaskuler dan melakukan aktivitas
antibodi di jaringan. Imunoglobulin G melapisi mikroorganisme, sehingga partikel
akan lebih mudah difagositosis dan membantu dalam menetralisasi toksin dan
b) Imunoglobulin M
Gambar 2. Pentamer Imunoglobulin M (Louise, 2011)
Imunoglobulin M merupakan sebuah pentamer sehingga imunoglobulin
M merupakan imunoglobulin berukuran paling besar. Imunoglobulin M terdapat
di intravaskuler dan merupakan 10% dari imunoglobulin total dalam serum
(Kresno, 2010). Imunoglobulin M merupakan antibodi yang paling awal muncul
setelah terjadi perangsangan antigen untuk mengikat komplemen (Louise, 2011).
Apabila antigen masuk ke dalam tubuh, sintesis imunoglobulin M mendahului
imunoglobulin G hingga mencapai puncaknya kemudian menurun lebih cepat dari
kadar imunoglobulin G (Bellanti, 1993).
c) Imunoglobulin A
Imunoglobulin A terdapat dalam tiga bentuk yaitu suatu monomer, suatu
dimer (didalamnya suatu rantai J mengikat dua monomer), dan suatu dimer
dengan satu potongan sekretorik. Imunoglobulin A ditemukan dalam konsentrasi
tinggi di dalam sekresi dan di dalam serum imunoglobulin A muncul dalam
bentuk dimer dengan waktu paruh 5 hari. Imunoglobulin A menempati dan
menghalangi bakteri, virus, dan toksin agar tidak melekat pada sel-sel inang
(Louise, 2011).
d) Imunoglobulin D
Imunoglobulin D merupakan 1% dari total imunoglobulin dan
merupakan komponen permukaan sel B dan pertanda dari diferensiasi sel B yang
lebih matang. Dalam serum, imunoglobulin D ditemukan dengan kadar yang
sangat rendah karena imunoglobulin D tidak dilepas sel plasma dan sangat rentan
terhadap degradasi oleh proses proteolitik. Imunoglobulin D diduga dapat
mencegah terjadinya toleransi imun akan tetapi mekanismenya belum jelas
(Baratawidjaja, 2010).
e) Imunoglobulin E
Imunoglobulin E dibentuk oleh sel plasma dalam selaput lendir saluran
napas dan cerna. Pada alergi, kadar imunoglobulin E yang tinggi ditemukan pada
infeksi cacing, skistosomiasis, penyakit hidatid, trikinosis, dam diduga berperan
dalam imunitas parasit (Baratawidjaja, 2010).
2. Pembentukan antibodi
Tahap awal pembentukan antibodi adalah fagositosis antigen oleh sel
fagosit terutama makrofag yang akan menjadi antigen presenting cell (APC) dan akan menyajikan antigen tersebut kepada sel T helper. Sel T helper yang teraktivasi akan menstimulasi sel B. Sel B membawa imunoglobulin permukaan
yang spesifik terhadap antigen dan dirangsang untuk berploriferasi dan
berdiferensiasi sel plasma yang membentuk protein antibodi spesifik atau
2005). Respon pembentukan antibodi dibedakan menjadi dua yaitu respon primer
dan respon sekunder.
Gambar 3. Kurva Produksi Antibodi Respon Imun Primer dan Sekunder (Sheehan, 1997)
1. Respon primer
Bila antigen terpapar pada tubuh pertama kali akan menimbulkan respon
imun primer. Pada respon imun primer sel B immature distimulasi oleh antigen untuk berproliferasi dan berdiferensiasi menjadi antibody-secreting cells yang akan memproduksi antibodi spesifik terhadap antigen tersebut dan juga menjadi
sel B memori yang hidup dalam jangka waktu yang lama. Respon imun primer
timbul setelah 5-10 hari setelah terpapar antigen, ditandai dengan munculnya
imunoglobulin M sehingga produksi imunoglobulin M lebih besar dari Ig G dan
dapat diinduksi oleh semua imunogen (Kresno, 2010).
Ketika individu terpapar imunogen untuk pertama kali terjadilah respon
imun primer yang ditandai dengan munculnya imunoglobulin M beberapa hari
setelah pemaparan. Saat antara pemaparan imunogen dan munculnya
puncaknya setelah kira-kira 7 hari. Selama 6-7 hari setelah pemaparan,
imunoglobulin G mulai dapat dideteksi dalam serum, sedangkan imunoglobulin M
mulai berkurang sebelum kadar imunoglobulin G mencapai puncaknya, yaitu
10-14 hari setelah pemaparan imunogen (Kresno, 2010).
2. Respon sekunder
Bila terjadi pemaparan kedua dari imunogen yang sama, akan timbul
respon imun sekunder. Pada respon imun sekunder, sel B memori di stimulasi
oleh imunogen yang sama dan akan menyebabkan sel B berploriferasi dan
berdiferensiasi dengan cepat dan memproduksi antibodi spesifik yang lebih
banyak jumlahnya dari pada respon imun primer. Respon imun sekunder timbul
1-3 hari setelah paparan imunogen, ditandai dengan meningkatnya produksi
imunoglobulin G sehingga imunoglobulin G lebih banyak dari imunoglobulin M
dan hanya dapat diinduksi oleh imunogen yang sama (Abbas et al., 2000).
D. Imunomodulator
Imunomodulator merupakan senyawa yang mampu mempengaruhi
sistem imun atau sistem kekebalan tubuh. Berdasarkan efek yang ditimbulkannya,
imunomodulator terbagi menjadi imunostimulan dan imunosupresan (Sari, 2008).
Imunostimulan adalah bahan yang dapat meningkatkan sistem imun
dengan cara menginduksi atau meningkatkan aktivitas dari
komponen-komponennya. Imunostimulan dikategorikan dalam dua bagian yaitu
imunostimulan spesifik dan imunostimulan tak spesifik. Imunostimulan spesifik
imun, seperti vaksin dan beberapa antigen, sedangkan imunostimulan non spesifik
adalah zat yang beraksi tidak hanya pada satu antigenik spesifik untuk menambah
respon imun dari antigen lain atau dapat meningkatkan komponen dari sistem
imun tanpa sifat antigenik spesifik, seperti adjuvan (Sari, 2008).
Imunosupresan merupakan senyawa (obat atau nutrisi) yang bekerja
dengan menekan respon imun. Obat imunosupresi digunakan pada pasien yang
akan menjalani transplantasi dan penyakit autoimun karena kemampuannya dalam
menekan respon imun (Baratawidjaja, 2010).
E. Enzyme Linked Immunosorbant Assay
ELISA adalah suatu teknik deteksi dengan metode serologis yang
berdasarkan atas reaksi spesifik antara antigen dan antibodi, mempunyai
sensitivitas dan spesifisitas yang tinggi dengan menggunakan enzim sebagai
indikator.
Beberapa metode telah dikembangkan dalam ELISA. Pemilihan metode
tergantung sifat sampel, kemampuan reagen, presisi, akurasi ( Kresno, 2010).
Salah satu metode ELISA adalah ELISA tak langsung (indirect ELISA). Prinsip dasar dari ELISA tak langsung adalah bahwa suatu antibodi dapat mengenali
suatu epitop dari antigen tertentu secara spesifik, yang kemudian divisualisasikan
dengan cara penambahan konjugat (antibodi kedua yang dikonjugasikan dengan
enzim misalnya alkalin fosfatase). Selanjutnya ditambah substrat tertentu yang
sesuai sehingga akan terbentuk warna yang dapat diukur menggunakan metode
kolorimetri. Pengukuran serapan warna yang terbentuk pada ELISA dapat
dilakukan pada ELISA reader pada panjang gelombang tertentu tergantung enzim dan substrat kromogenik yang digunakan (Amri, 2008). Kelebihan teknik ELISA
adalah cukup sensitif, reagen mempunyai waktu paruh yang panjang, dapat
menggunakan spektrofotometer dan yang paling penting tidak mengandung
bahaya radioaktif (Kresno, 2010).
Madu hutan merupakan salah satu jenis madu yang berasal dari beberapa
jenis nektar tumbuhan dan diproduksi oleh lebah liar bernama Apis dorsata. Madu hutan dianggap memiliki kualitas yang lebih baik dibandingkan madu monoflora
karena tidak mengandung pestisida yang kemungkinan ditemukan pada madu
monoflora. Madu memiliki kandungan yang diduga dapat meningkatkan sistem
imun, yaitu flavonoid. Kandungan flavonoid ini diduga berpotensi sebagai
imunomodulator, yang merupakan suatu senyawa yang mampu mempengaruhi
sistem kekebalan tubuh, baik respon imun nonspesifik maupun respon imun
spesifik, salah satunya imunoglobulin. Ketika molekul asing masuk ke dalam
tubuh, sel B akan membentuk imunoglobulin sebagai respon pertahanan tubuh
dan akan berikatan secara spesifik dengan molekul asing tersebut. Imunoglobulin
yang pertama kali terbentuk adalah imunoglobulin M diikuti dengan
imunoglobulin G. Adanya kandungan flavonoid yang terdapat dalam madu,
diperkirakan madu hutan dapat mempengaruhi sistem imun, khususnya
imunoglobulin G dan imunoglobulin M.
Pemberian madu hutan dapat mempengaruhi imunoglobulin G dan
imunoglobulin M pada hewan uji tikus jantan galur Wistar.
21
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan
rancangan acak pola searah. Eksperimental murni karena dilakukan dengan
memberikan perlakuan terhadap kelompok perlakuan dan hasilnya dibandingkan
dengan kelompok kontrol yang tidak diberikan perlakuan. Rancangan acak yaitu
sampel yang digunakan ditetapkan dengan pengacakan agar setiap sampel
memperoleh kesempatan yang sama untuk dapat masuk ke dalam kelompok
perlakuan dan kelompok kontrol. Pola searah ditunjukkan dengan adanya
perlakuan yang sama pada kelompok perlakuan. Penelitian menggunakan subjek
uji tikus jantan galur Wistar yang diperoleh dari Unit Praklinik Laboratorium Penelitian dan Pengujian Terpadu Universitas Gadjah Mada Yogyakarta. Kriteria
inklusi yaitu tikus jantan, berat badan lebih kurang 100-300 g, berumur 2-3 bulan,
bergalur Wistar. Kriteria drop out adalah tikus yang mati selama perlakuan. Penelitian dilakukan di Unit Praklinik dan Unit III Laboratorium Penelitian dan
Pengujian Terpadu Universitas Gadjah Mada Yogyakarta.
B. Variabel dan Definisi Operasional
1. Variabel penelitian
a. Variabel utama
1) Variabel bebas : dosis madu hutan
2) Variabel tergantung : kadar imunoglobulin G dan imunoglobulin M
b. Variabel pengacau
1) Variabel pengacau terkendali : jenis makanan, variasi genetik, jenis
kelamin, berat badan dan umur, galur tikus.
2) Variabel pengacau tak terkendali : kondisi psikologis dan
patofisiologis.
2. Definisi operasional
a. Madu hutan atau madu poliflora merupakan madu yang diproduksi oleh
lebah liar dari tumbuh-tumbuhan obat yang ada di hutan (Suranto, 2007).
Madu yang digunakan merupakan madu hutan yang diperoleh dari salah
satu distributor madu di kota Yogyakarta yaitu Madu Pramuka.
b. Imunoglobulin G merupakan imunoglobulin yang paling banyak di
dalam serum darah dan berperan dalam menetralkan toksin dan kuman
patogen yang berbahaya (Tizard 2004).
c. Imunoglobulin M merupakan imunoglobulin yang pertama kali muncul
setelah terjadi perangsangan antigen untuk mengikat komplemen
dan virus. Selain itu mudah dideteksi karna metode assay imunoglobulin M mempunyai sensitivitas besar
d. Penetapan imunoglobulin G dan imunoglobulin M dilakukan dengan
menggunakan metode ELISA (Ausubel et al., 1995). Prinsip dasar dari ELISA tak langsung adalah bahwa suatu antibodi dapat mengenali satu
epitop dari antigen secara spesifik yang kemudian divisualisasikan
dengan cara penambahan konjugat. Selanjutnya ditambah substrat
tertentu yang sesuai sehingga terbentuk warna yang dapat diukur
menggunakan metode kolorimetri. Pengukuran yang terbentuk pada
ELISA dapat dilakukan dengan ELISA reader pada panjang gelombang tertentu, tergantung enzim dan substrat kromogenik yang digunakan
(Kresno, 2010).
C. Bahan Penelitian
1. Madu
Madu yang digunakan adalah madu yang berasal dari hutan Kalimantan yang
diperoleh dari salah satu distributor madu di Yogyakarta yaitu Madu
Pramuka.
2. Bakteri uji
3. Hewan uji
Tikus dengan jenis kelamin jantan berat badan lebih kurang 100 – 300 g
berumur 2 – 3 bulan dan bergalur Wistar.
4. Bahan ELISA
Natrium klorida, kalium klorida, natrium dihidrogen fosfat, natrium fosfat,
tween 20, p- nitrophenylphospat dinatriumsalt (p-npp) (Merck), dietanolamin 0,15 M magnesium diklorida, alkalin phosphatase conjugat antimouse IgM
(Sigma), alkalin phosphatase conjugat antimouse IgG (Sigma), bovine serum albumine (Gibco).
D. Alat Penelitian
Spuit injeksi oral, spuit injeksi intraperitonial, tabung reaksi, gelas beker,
gelas ukur, hematokrit, efendrof, yellow tip, blue tip, pipet Pasteur, micropipet, neraca analitik, sentrifus Eppendorf (Sorvall MC 124, Dupon), Super mixer
(Vortex), microplate 96 well (Nunc), ELISA reader (BioRad), freezer.
E. Tata Cara Penelitian 1. Tahap penentuan dosis madu hutan
Penggunaan madu untuk pencegahan penyakit pada manusia adalah
1-2 kali/hari 1 sendok makan (Suranto, 2007). Dosis dikonversikan dari
manusia 70 kg ke tikus 200 g menggunakan tabel konversi Ngatidjan (1991)
dengan faktor konversi 0,018 sehingga ditemukan dosis yang sesuai untuk
Madu hutan 1 sendok makan = 15 mL
Faktor konversi = 0,018
Dosis madu hutan untuk tikus 200 g adalah
= 0,018 x 15 mL
= 0,27 mL/200 g BB tikus
2. Tahap orientasi dosis madu hutan
Tahap orientasi dosis dilakukan untuk mengetahui dosis yang dapat
meningkatkan imunoglobulin G dan imunoglobulin M. Dalam orientasi dosis
digunakan 12 ekor tikus yang dibagi menjadi menjadi empat kelompok, yaitu:
a. Kelompok kontrol akuades : volume pemberian 2,5 mL/200 g BB tikus.
b. Kelompok madu hutan 1 : dosis 0,27 mL/200 g BB tikus dengan volume
pemberian 1,35 mL/200 g BB tikus.
c. Kelompok madu hutan 2 : dosis 0,405 mL/200 g BB tikus dengan
voluime pemberian 2,025 mL/200 g BB tikus.
d. Kelompok madu hutan 3 : dosis 0,54 mL/200 g BB tikus dengan volume
pemberian 2,7 mL/200 g BB tikus.
Masing-masing kelompok terdiri dari tiga ekor tikus dan diberikan
larutan madu hutan secara per oral sekali setiap hari selama tujuh hari. Pada
hari ke-8 dan hari ke-22, setiap tikus diinfeksi intraperitonial dengan 0,5 mL
suspensi bakteri Staphylococcus epidermidis. Pada hari ke-15 dan ke-29 dilakukan pengambilan serum tikus melalui sinus orbitalis kemudian
dilakukan penetapan imunoglobulin G dan imunoglobulin M menggunakan
3. Tahap percobaan
Dalam penelitian ini digunakan 20 ekor tikus yang dibagi menjadi
empat kelompok dimana setiap kelompok terdiri dari lima ekor tikus, yaitu
kelompok kontrol akuades, kelompok madu hutan perlakuan 1, kelompok
madu hutan perlakuan 2, dan kelompok madu hutan perlakuan 3. Dosis madu
hutan pada tahap perlakuan ini disesuaikan dengan hasil orientasi dan
dijadikan sebagai dosis pertama. Dosis ini kemudian ditingkatkan dua kali
untuk kelompok perlakuan 2 dan kelompok perlakuan 3.
Tikus yang memenuhi kriteria inklusi diadaptasikan dengan
dikandangkan per-kelompok dan diberi pakan standar serta minum yang sama
secara ad libitum. Pembagian 4 kelompok tersebut yaitu :
a. Kelompok kontrol akuades : volume pemberian 2,5 mL/200 g BB tikus
b. Kelompok madu hutan 1 : dosis 0,27 mL/200 g BB tikus dengan volume
pemberian 0,675 mL/200 g BB tikus
c. Kelompok madu hutan 2 : dosis 0,54 mL/200 g BB tikus dengan volume
pemberian 1,35 mL/200 g BB tikus
d. Kelompok madu hutan 3 : dosis 1,08 mL/200 g BB tikus dengan volume
pemberian 2,7 mL/200 g BB tikus
Pemberian akuades maupun larutan madu pada setiap kelompok
dilakukan selama 18 hari perlakuan. Pada hari ke-1 dan hari ke-14 setiap tikus
melalui sinus orbitalis kemudian dilakukan penetapan imunoglobulin G dan
imunoglobulin M menggunakan metode ELISA.
4. Pengukuran imunoglobulin G dan imunoglobulin M
Microplate dilapisi dengan antigen Staphylococcus epidermidis
kadar 5 µg/mL dalam buffer bicarbonate sebanyak 100 µL per-sumuran kemudian diinkubasi semalam pada suhu 40C. Microplate dicuci tiga kali dengan PBST20 0,05 % sebanyak 200 µL setiap sumuran, kemudian di blok
dengan Bovine Serum Album (BSA) 1% dalam PBS sebanyak 100 µL per sumuran, diinkubasikan selama 1 jam pada suhu 370C, dan dicuci 3 kali dengan PBST20 0,05 % sebanyak 200 µL per-sumuran. Serum diencerkan
1:100 dengan PBS, dimasukkan ke dalam microplate sebanyak 100 µL per-sumuran dan diinkubasikan pada suhu 370C selama 1 jam, kemudian
microplate dicuci tiga kali dengan PBST20 0,05 % sebanyak 200 µL
per-sumuran. Konjugat antimouse Ig G dan Ig M alkaline fosfatase dimasukkan
pada masing-masing microplate sebanyak 100 µL per-sumuran dan diinkubasikan pada 37oC selama 1 jam. Microplate dicuci tiga kali dengan PBST20 0,05% sebanyak 200 µL per sumuran. Substrat p-NPP (p-nitriphenyl
phospatase) dimasukkan ke dalam microplate sebanyak 100 µL per-sumuran dan diinkubasikan pada suhu kamar selama 30 menit hingga terjadi
F. Analisis Hasil
Data yang diperoleh dievaluasi secara statistik. Pertama dilakukan uji
normalitas data dengan metode Kolmogorov-Smirnov yang dilanjutkan uji one way ANOVA dengan taraf kepercayaan 95%, kemudian bila terdapat perbedaan yang bermakna (p<0,05) maka dilanjutkan dengan uji Tukey.
29
BAB IV
HASIL DAN PEMBAHASAN
Penelitian ini bertujuan untuk mengetahui pengaruh pemberian madu
hutan dalam mempengaruhi imunoglobulin G dan imunoglobulin M sehingga
dapat digunakan sebagai imunomodulator untuk meningkatkan kesehatan.
Pengukuran imunoglobulin G dan imunoglobulin M menggunakan metode ELISA
tak langsung dan hasilnya akan dianalisis dengan uji Kolmogorov-Smirnov untuk mengetahui normalitas data yang dilanjutkan uji one way ANOVA dengan taraf kepercayaan 95%.
A. Pengukuran Imunoglobulin G dan Imunoglobulin M
Tikus dibagi menjadi empat kelompok perlakuan yang terdiri dari kontrol
negatif akuades dan tiga kelompok pemberian madu hutan. Kontrol negatif
dibandingkan dengan kelompok perlakuan dengan tujuan untuk melihat
kemampuan tikus dalam memproduksi antibodi tanpa dan dengan adanya
pengaruh suatu senyawa yang dapat meningkatkan respon imun. Tikus diinduksi
peritoneal dengan Staphylococcus epidermidis yang berperan sebagai antigen.
Staphylococcus epidermidis merupakan bakteri gram positif dan salah satu spesies bakteri dari genus Staphylococcus yang diketahui dapat menyebabkan infeksi oportunistik. Bakteri ini merupakan flora normal kulit dan merupakan bakteri non
patogen (Yanti, 2004). Metode induksi secara peritoneal merupakan metode yang
yang diinjeksikan dapat lebih banyak dibanding teknik lain. Menurut Subowo
(cit., Sasmito, 2006), induksi bertujuan untuk membangkitkan imunitas yang efektif sehingga terbentuk imunoglobulin dan sel-sel memori dan dilakukan
berulang agar sel memori yang terbentuk semakin banyak. Dalam penelitian ini,
induksi Staphylococcus epidermidis dilakukan sebanyak dua kali dengan tujuan menurut Hia (2007), induksi pertama akan menghasilkan respon imun primer
yang bertujuan untuk mengenalkan antigen yang akan menstimulasi sel limfosit
untuk berproliferasi dan berdiferensiasi menjadi sel plasma yang mampu
memproduksi antibodi serta membentuk sel memori yang dapat hidup lama pada
respon primer dan induksi kedua sebagai induksi sekunder untuk mengaktifkan
sel-sel memori akibat respon imun primer dan menghasilkan antibodi lebih cepat
dibandingkan pada pemaparan antigen yang pertama. Antibodi yang dihasilkan
pertama adalah imunoglobulin M, kemudian setelah imunisasi berulang dari
antigen yang sama maka produksi imunoglobulin M akan menurun dan terjadi
proses switch dari imunoglobulin M ke imunoglobulin G (Rachmandani, 2008). Pada tahap orientasi dosis, induksi antigen dilakukan pada hari ke-8
setelah 7 hari masa penyesuaian terhadap pemberian madu hutan sehingga tubuh
sudah terlindungi terlebih dahulu sebelum pemberian antigen. Hal ini disesuaikan
dengan penelitian Arsani (2010), yaitu pemberian madu secara berturut-turut
bertujuan untuk melindungi tubuh sebelum diberikan senyawa asing. Induksi
antigen kedua dilakukan pada hari ke-22. Pemilihan waktu ini bertujuan agar
antibodi yang terbentuk pada induksi pertama mencapai puncak sebelum induksi
menghasilkan antibodi lebih cepat dibanding pada pemaparan antigen yang
pertama (Arsani, 2010). Pada tahap percobaan, induksi antigen diberikan pada
hari ke-1. Pada penelitian yang dilakukan oleh Zurmiati (2003), pengenalan
antigen dilakukan pada hari pertama bertujuan agar proses pengenalan antigen
oleh sel limfosit lebih cepat. Induksi kedua dilakukan pada hari ke-14 bertujuan
agar imunoglobulin yang terbentuk pada vaksinasi pertama mencapai puncak
sebelum vaksinasi kedua dan menghasilkan antibodi yang lebih banyak dalam
tubuh (Arsani, 2010).
Sampel yang digunakan pada pengukuran imunoglobulin ini adalah
serum darah. Pengambilan darah melalui sinus orbitalis karena cara ini mudah dilakukan dan menghasilkan darah yang cukup volumenya untuk penelitian. Pada
tahap orientasi dosis, serum diambil pada hari ke-15 atau satu minggu setelah
induksi pertama. Puncak imunoglobulin M setelah kira-kira 7 hari setelah
pemberian antigen sehingga dalam penelitian ini dilakukan pengambilan serum
pada hari ke-15. Serum yang digunakan untuk pengukuran imunoglobulin G
dilakukan pada hari ke-29 yaitu satu minggu setelah induksi kedua karena
diperkirakan pada hari tersebut antibodi meningkat dalam tubuh. Pada tahap
percobaan, serum untuk pengukuran imunoglobulin M dilakukan pada hari ke-7
atau satu minggu setelah induksi antigen pertama karena imunoglobulin M
mencapai puncaknya setelah 7 hari pemaparan antigen (Kresno, 2010).
Pengambilan serum untuk pengukuran imunoglobulin M dilakukan pada hari
ke-18 atau empat hari setelah induksi antigen kedua. Pengambilan serum ini
mengenali antigen. Fase lag terjadi 3-5 hari setelah antigen diinjeksikan sehingga diperkirakan pada waktu ini antibodi telah meningkat dalam tubuh (Levinson dan
Jawetz, 2003, cit., Sasmito, 2006).
Pengukuran antibodi dilakukan dengan metode ELISA tak langsung.
Metode ini dipilih karena metode ini sudah umum digunakan dan merupakan
konfigurasi yang dapat digunakan untuk mengukur titer antibodi. Pada metode ini,
antigen secara pasif teradsorbsi pada substrat padat, yaitu microplate. Serum dimasukkan ke dalam microplate sehingga setiap antibodi dalam serum berikatan dengan antigen yang terikat substrat. Untuk mengetahui adanya antibodi yang
terikat, dapat diketahui dengan penambahan antibodi sekunder terikat enzim
(konjugat). Pada penelitian, konjugat yang digunakan adalah antibodi antimouse
alkalin phospat dan substrat yang digunakan, yaitu p-NPP. Pengukuran titer
antibodi berdasarkan intensitas warna yang terbentuk dari reaksi enzim yang
terlabel di konjugat dengan substrat, dalam hal ini berwarna kuning. Substrat
p-NPP merupakan substrat ideal karena mempunyai puncak absorban yang optimal
pada panjang gelombang 405-410 nm, tidak karsinogenik dan mampu
menghasilkan warna yang maksimal dengan cepat. Intensitas warna yang
dihasilkan sebanding dengan jumlah antibodi. Semakin tinggi intensitas warna,
antibodi yang dihasilkan semakin banyak. Warna yang terbentuk diukur
B. Tahap Orientasi Dosis
Tahap orientasi dosis bertujuan untuk mengetahui dosis yang dapat
mempengaruhi imunoglobulin G dan imunoglobulin M dan dosis tersebut akan
digunakan pada tahap percobaan. Tahap orientasi dosis menggunakan dosis madu
hutan hasil dari konversi dari manusia ke tikus yaitu 0,27 mL/200 g BB yang
ditingkatkan satu setengah dan dua kali dari dosis pertama yaitu 0,405 mL/200 g
BB dan 0,54 mL/200 g BB.
1. Pengaruh pemberian madu hutan terhadap imunoglobulin M pada tahap orientasi dosis
Hasil pengujian Kolmogorov-Smirnov menunjukkan data terdistribusi normal (Lampiran 9). Data yang diperoleh dari hasil pengukuran imunoglobulin
M adalah sebagai berikut :
Tabel I. Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M pada Tahap Orientasi Dosis setelah Pemberian Madu Hutan
Kelompok n Rata-rata OD±SD p Akuades 2,5 mL/200 g BB 5 0,160±0,048 0,852(TB) Madu 0,27 mL/200 g BB 5 0,145±0,016
Madu 0,405 mL/200 g BB 5 0,162±0,036 Madu 0,54 mL/200 g BB 5 0,142±0,032
Gambar 5. Grafik Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M pada Tahap Orientasi Dosis setelah Pemberian Madu
Hasil pengujian statistik menggunakan one way ANOVA (Tabel I) menunjukkan tidak ada perbedaan yang bermakna p=0,852 (p>0,05) antara
kelompok perlakuan madu hutan dengan kelompok kontrol akuades, tetapi terlihat
adanya perbedaan antara kelompok akuades terhadap kelompok perlakuan madu
hutan dosis 0,405 mL/200 g BB (Gambar 5). Kelompok perlakuan madu hutan
dosis 0,405 mL/200 g BB menunjukkan peningkatan nilai rata-rata OD
dibandingkan kelompok akuades yang berarti bahwa pemberian madu hutan
memberikan pengaruh terhadap imunoglobulin M. Namun, pada kelompok
perlakuan madu hutan dosis 0,27 mL/200 g BB dan dosis 0,54 mL/200 g BB
menunjukkan penurunan nilai rata-rata OD dibandingkan kelompok akuades. Hal
ini mungkin disebabkan karena beberapa hal, yaitu 1) dosis madu hutan belum
mampu mempengaruhi imunoglobulin M. 2) adanya sistem imunitas alamiah dari
tikus yang diberikan antigen pada kelompok kontrol akuades sehingga
menunjukkan nilai rata-rata OD yang tinggi.
2. Pengaruh pemberian madu hutan terhadap imunoglobulin G pada tahap orientasi dosis
Hasil uji Kolmogorov-Smirnov menunjukkan data terdistribusi normal (Lampiran 8). Data yang diperoleh dari hasil pengukuran imunoglobulin G adalah
sebagai berikut :
Tabel II. Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin G pada Tahap Orientasi Dosis setelah Pemberian Madu Hutan
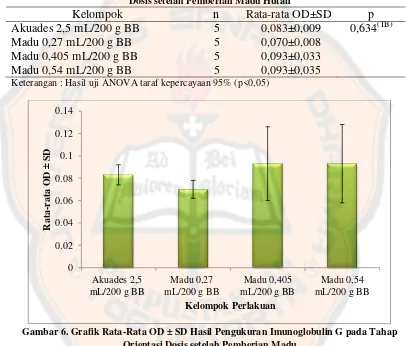
Kelompok n Rata-rata OD±SD p Akuades 2,5 mL/200 g BB 5 0,083±0,009 0,634(TB) Madu 0,27 mL/200 g BB 5 0,070±0,008
Madu 0,405 mL/200 g BB 5 0,093±0,033 Madu 0,54 mL/200 g BB 5 0,093±0,035
Keterangan : Hasil uji ANOVA taraf kepercayaan 95% (p<0,05)
Gambar 6. Grafik Rata-Rata OD ± SD Hasil Pengukuran Imunoglobulin G pada Tahap Orientasi Dosis setelah Pemberian Madu
Hasil pengujian menggunakan one way ANOVA (Tabel II) menunjukkan bahwa tidak ada perbedaan yang bermakna p=0,634 (p>0,05) antara kelompok
perlakuan madu hutan dengan kelompok kontrol akuades. Berdasarkan Gambar 6,
terlihat adanya perbedaan rata-rata OD antara kelompok akuades terhadap
kelompok perlakuan madu hutan dosis 0,405 mL/200 g BB dan kelompok madu
hutan dosis 0,54 mL/200 g BB. Kelompok madu hutan dosis 0,405 mL/200 g BB
dan kelompok madu hutan dosis 0,54 mL/200 g BB menunjukkan peningkatan
nilai rata-rata OD dibandingkan kelompok akuades. Namun, kelompok madu
hutan dosis 0,27 mL/200 g BB menunjukkan nilai rata-rata OD lebih rendah
dibandingkan akuades 2,5 mL/200 g BB. Hal ini kemungkinan disebabkan karena
dosis madu hutan yang diberikan terlalu rendah sehingga aktifitas dalam
merespon sistem kekebalan tubuh kurang maksimum. Selain itu, adanya
kemungkinan pengaruh madu hutan dalam meningkatkan respon imunitas dalam
tubuh hanya sampai batas tertentu, yang apabila batas itu sudah tercapai, maka
efeknya akan menurun didalam tubuh hewan uji sebelum dilakukan pengukuran
karena pada tahap orientasi pemberian madu hutan hanya tujuh hari dari 29 hari
penelitian sehingga pada tahap percobaan perlu dilakukan pemberian madu hutan
selama penelitian berlangsung.
Pemilihan waktu penelitian dilakukan sedemikian rupa agar diketahui
pengaruh pemberian madu hutan terhadap imunoglobulin G dan imunoglobulin
M. Dalam penelitian ini, waktu penelitian berbeda dengan waktu tahap orientasi
dosis. Penelitian dilakukan selama 18 hari penelitian dan diberikan madu hutan
berturut-turut diharapkan terjadi sensitasi sel B yang akan berproliferasi,
berdeferensiasi, dan berkembang menjadi sel plasma yang memproduksi antibodi.
Pertimbangan adanya perubahan hari dikarenakan beberapa hal, yaitu 1) pada
tahap orientasi pemberian madu hutan yang hanya dilakukan 7 hari telah menurun
dalam tubuh sebelum dilakukan pengukuran; 2) kemungkinan kurang tepatnya
dilakukan pengukuran tidak menunjukkan perbedaan yang bermakna. Hasil yang
diperoleh pada tahap orientasi ini menunjukkan bahwa dosis 0,405 mL/200 g BB
merupakan dosis yang dapat memberikan pengaruh berupa peningkatan
imunoglobulin G dan imunoglobulin M. Namun, hasil uji statistik tidak
menunjukkan perbedaan yang bermakna sehingga dalam tahap percobaan, dosis
yang digunakan adalah dosis 0,27 mL/200 g BB. Selain itu, dosis 0,27 mL/200 g
BB merupakan dosis minimal konsumsi madu pada manusia. Konsumsi madu
untuk pencegahan penyakit pada manusia adalah 1-2 kali/hari 1 sendok makan
(Suranto, 2007). Menurut Bellanti (1993) dan Weir (1990) (cit., Jaya, dkk , 2008) dosis dan interval antara suntikan yang berbeda menghasilkan kelompok antibodi
dengan titer dan kekuatan yang berbeda-beda. Dalam percobaan ini, diharapkan
dengan digunakannya dosis 0,27 mL/200 g BB dapat memberikan gambaran
penggunaan madu hutan dengan dosis minimal. Dosis 0,27 mL/200 g BB sebagai
dosis pertama dan akan ditingkatkan dua kali dan empat kali sehingga diharapkan
C. Pengaruh Pemberian Madu Hutan Dosis 0,27 mL/200 g BB; 0,54 mL/200 g BB; 1,08 mL/200 g BB terhadap Imunoglobulin M dan Imunoglobulin
G
1. Pengaruh pemberian madu hutan terhadap imunoglobulin M
Hasil pengujian statistik Kolmogorov-Smirnov menunjukkan bahwa data terdistribusi secara normal (Lampiran 15). Hasil yang diperoleh adalah sebagai
berikut:
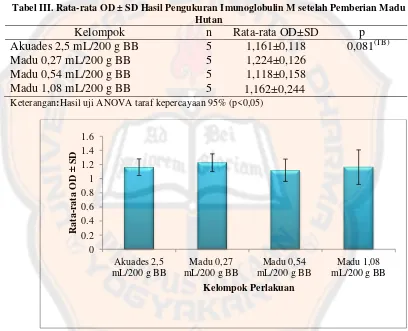
Tabel III. Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M setelah Pemberian Madu Hutan
Keterangan:Hasil uji ANOVA taraf kepercayaan 95% (p<0,05)
Gambar 7. Grafik Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin M setelah Pemberian Madu Hutan
Pada tabel III, berdasarkan hasil uji dengan one way ANOVA menunjukkan tidak ada perbedaan bermakna p= 0,081 (p>0,05) antara kelompok
kontrol akuades dan kelompok perlakuan sedangkan pada Gambar 7, terlihat
adanya peningkatan rata-rata OD kelompok madu hutan dosis 0,27 mL/200 g BB
dan madu hutan dosis 1,08 mL/200 g BB terhadap kontrol akuades 2,5 mL/200 g
BB. Adanya peningkatan rata-rata OD ini menunjukkan bahwa pemberian madu
hutan dapat mempengaruhi imunoglobulin M.
Pada kelompok madu hutan dosis 0,54 mL/200 g BB, nilai rata-rata OD
yang ditunjukkan lebih rendah dari kelompok akuades (Gambar 7). Adanya
peningkatan rata-rata OD yang ditunjukkan akuades kemungkinan dikarenakan
sistem imunitas alami hewan uji akibat adanya induksi antigen (Sasmito, 2006).
Berdasarkan Gambar 7, dosis 0,27 mL/200 g BB menunjukkan nilai rata-rata OD
yang lebih tinggi dibandingkan dosis 0,54 mL/200 g BB dan dosis 1,08 mL/200 g
BB. Hal ini kemungkinan disebabkan dosis 0,27 mL/200 g BB memiliki
kemampuan dalam meningkatkan respon imun (imunostimulan), sedangkan dosis
0,54 mL/200 g BB dan dosis 1,08 mL/200 g BB memiliki kemampuan dalam
menekan respon imun (imunosupresan). Menurut Wibowo (2006), efek suatu
senyawa tergantung dari dosis, dimana pada dosis yang tinggi akan menimbulkan
efek imunosupresif sedangkan pada dosis rendah akan menimbulkan efek
imunostimulator. Kemungkinan lain terjadi penurunan dikarenakan karena salah
satu kandungan madu hutan, yaitu flavonoid yang diduga dapat meningkatkan
sistem imun memiliki aktivitas biologis yang lain seperti antimikroba, antiviral,
antioksidan, sitotoksik, antiploriferatif, dan antiinflamasi. Hal ini berdasarkan
pendekatan dari penelitian Arsani (2010) mengenai ekstrak etanolik daun kersen
yang mengandung flavonoid, pada dosis tertentu terjadi penurunan sistem imun
yang disebabkan aktivitas lain dari flavonoid sebagai antiinflamasi, sitotoksik, dan
karena sistem imun memiliki mekanisme homeostasis yang menjaga agar tidak
terjadi peningkatan respon imun yang berlebihan yang dapat menyerang tubuhnya
sendiri (Batubara, 2006).
2. Pengaruh pemberian madu hutan terhadap imunoglobulin G
Hasil uji statistik menggunakan Kolmogorov-Smornov menunjukkan data terdistribusi normal (Lampiran 14). Hasil pengukuran imunoglobulin G adalah
sebagai berikut :
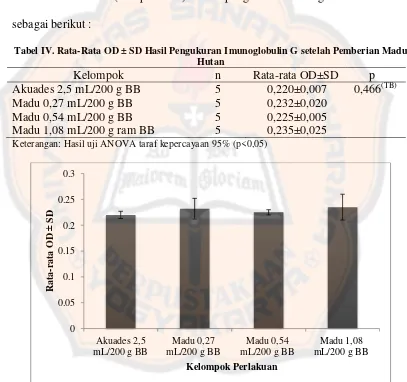
Tabel IV. Rata-Rata OD ± SD Hasil Pengukuran Imunoglobulin G setelah Pemberian Madu Hutan
Keterangan: Hasil uji ANOVA taraf kepercayaan 95% (p<0,05)
Gambar 8. Grafik Rata-rata OD ± SD Hasil Pengukuran Imunoglobulin G setelah Pemberian Madu Hutan
Hasil uji one way ANOVA (Tabel IV), tidak terdapat perbedaan yang bermakna p=0,466 (p>0,05) antara kelompok kontrol akuades dengan kelompok
perlakuan sedangkan pada Gambar 8, terlihat adanya kenaikan rata-rata OD
imunoglobulin G pada setiap kelompok madu hutan dibandingkan dengan
kelompok akuades. Hal ini menunjukkan bahwa pemberian madu hutan dapat
meningkatkan imunoglobulin G.
Kelompok madu dosis 0,54 mL/200 g BB tikus menunjukkan rata-rata
OD lebih rendah dibandingkan dengan kedua kelompok madu lainnya (Gambar
8). Hal ini kemungkinan disebabkan kelipatan peningkatan dosis dari 0,27
mL/200 g BB ke dosis 0,54 mL/200 g BB yang hanya meningkat dua kali belum
mampu meningkatkan imunoglobulin G, sedangkan dari dosis 0,27 mL/200 g BB
ke dosis 1,08 mL/200 g BB meningkat empat kali sehingga menunjukkan adanya
peningkatan imunoglobulin G.
Respon imun primer ditandai dengan munculnya imunoglobulin M
beberapa hari setelah pemaparan yang kemudian diikuti dengan munculnya
imunoglobulin G. Kadar imunoglobulin M mencapai puncaknya kira-kira 7 hari
setelah pemaparan antigen dan imunoglobulin G mencapai puncaknya yaitu 10-14
hari setelah pemaparan (Kresno, 2010). Dalam penelitian ini, kadar imunoglobulin
M yang dihasilkan menunjukkan nilai yang lebih tinggi dibandingkan dengan
kadar imunoglobulin G. Hal ini dimungkinkan karena pengambilan serum
imunoglobulin M saat mencapai puncaknya, yaitu hari ke-7 setelah pemaparan
antigen sehingga menunjukkan kadar yang sangat tinggi. Selain itu, menurut
Bellanti (1993), imunoglobulin M mudah dideteksi karena metode assay
imunoglobulin M memiliki sensitivitas yang besar.
Berdasarkan kurva pembentukan imunoglobulin (Gambar 1), hari ke-14
imunoglobulin telah menurun. Kemungkinan rendahnya kadar imunoglobulin G
dikarenakan pada saat imunoglobulin G mencapai puncaknya, dilakukan induksi
antigen yang kedua, sehingga kemungkinan antibodi telah menghilang dari serum.
Jika antibodi masih dalam serum pada saat injeksi antigen kedua, maka antibodi
akan menghilang lebih cepat dalam fase penurunan respon primer (fase negatif)
dikarenakan cepatnya reaksi antibodi yang ada sebelumnya terhadap antigen yang
baru diinduksikan untuk membentuk kompleks antigen-antibodi (Bellanti, 1993).
Selain itu, kemungkinan imunoglobulin yang terbentuk belum mencapai kadar
puncaknya dan dimungkinkan masih termasuk dalam respon primer.
Sistem imunitas tubuh terdiri dari respon imun non-spesifik dan respon
imun spesifik. Pada penelitian ini, imunoglobulin G dan imunoglobulin M
termasuk dalam respon imun spesifik, khususnya imunitas humoral. Berdasarkan
hasil yang diperoleh dari penelitian ini, pemberian madu hutan tidak berpengaruh
terhadap imunoglobulin G dan imunoglobulin M. Akan tetapi, hasil penelitian ini
tidak dapat menunjukkan bahwa pemberian madu hutan tidak berpengaruh
terhadap sistem imun karena penelitian ini hanya melihat salah satu respon imun
43
BAB V
KESIMPULAN DAN SARAN
A. Kesimpulan
Pemberian madu hutan tidak berpengaruh terhadap imunoglobulin G dan
imunoglobulin M pada hewan uji tikus jantan galur Wistar.
B. Saran
Perlu dilakukan penelitian lebih lanjut mengenai dosis madu hutan yang
berpengaruh terhadap imunoglobulin G dan imunoglobulin M untuk mengetahui