KATA PENGANTAR
Puji syukur kepada Tuhan Yang Maha Esa atas kesempatan dan karunia yang
telah diberikanNya sehingga buku Petunjuk Praktikum Dasar-Dasar Proses 2014 ini dapat terselesaikan.
Buku panduan ini dimaksudkan untuk membantu kelancaran pelaksanaan Praktikum Praktikum
Dasar-Dasar Proses Jurusan Teknik Kimia Fakultas Teknik Universitas Gadjah Mada Tahun 2014.
Materi yang ada didalam buku ini disusun berdasarkan urutan kode mata praktikum yang
bersangkutan secara terpisah satu dengan yang lain agar dapat lebih mudah dipahami. Uraian mata
praktikum yang terdiri atas tujuan , dasar teori dan prosedur percobaan yang diharapkan dapat membuka
wawasan tentang mata praktikum sebagai revisi dan perbaikan dari edisi sebelumnya. Hal ini antara lain
menyangkut beberapa perubahan yang terjadi pada Praktikum Dasar-Dasar Proses itu sendiri.
Penyusun menyadari bahwa buku ini masih jauh dari sempurna, baik dari segi materi maupun
penulisan. Oleh karena itu, penyusun mengharapkan saran dan kritik yang bersifat membangun dari
pembaca dan pengguna buku ini demi perbaikan di masa mendatang. Ucapan terima kasih penyusun
sampaikan kepada semua pihak yang telah membantu dalam penyusunan ini antara lain :
1. Ir. Harry Sulistyo, S.U., Ph.D., selaku Kepala Laboratorium Dasar-Dasar Proses.
2. Ir. Suprihastuti Sri Rahayu, M.Sc. ; Sang Kompiang Wirawan, ST., MT., Ph.D. ; Yuni Kusumastuti,
S.T., M.Eng ; Himawan Tri Bayu Murti Petrus, S.T., ME., D.Eng. ; Ahmad Tawfiequrrahman Y.,
S.T., MT., D.Eng. ; Chandra Wahyu Purnomo, S.T., M.Eng., D.Eng. ; Indra Perdana, S.T., MT.,
Ph.D. ; selaku Dosen Pembimbing Mata Praktikum Dasar-Dasar Proses.
3. Bapak Heri dan Risma Wati selaku Laboran Laboratorium Praktikum Dasar-Dasar Proses.
4. Seluruh Asisten Praktikum Dasar-Dasar Proses 2014/2015.
Semoga buku ini bermanfaat untuk kemajuan dan perkembangan pendidikan di Jurusan Teknik Kimia
Fakultas Teknik Universitas Gadjah Mada.
Yogyakarta, Oktober 2014
DAFTAR ISI
Kata Pengantar ... i
Daftar Isi ... ii
Daftar Dosen Pembimbing Praktikum dan Asisten ... iii
Format Penulisan Laporan Ringkas ... iv
Format Penulisan Laporan Resmi ... vi
Ketentuan Pengumpulan Laporan Resmi ………. ix
Tata Cara Penulisan Laporan ... x
Keselamatan Kerja di Laboratorium ...xii
(A) Hidrolisis Pati... 1
(B) Esterifikasi Asam Asetat ... 10
(C) Pemungutan Pektin ... 20
(D) Analisis Minyak Nabati ... 27
(E) Distilasi Campuran Immiscible ... 38
(F) Pengambilan Minyak Atsiri...………… 46
(G) Analisis Kadar Protein ... 56
DAFTAR DOSEN PEMBIMBING PRAKTIKUM DAN ASISTEN
A. HIDROLISIS PATI
Dosen Pembimbing : Ir. Harry Sulistyo, S.U., Ph.D.
Asisten Praktikum : 1. Veronica Candra Gunawan (pagi)
2. Ardina Lukita Diyani Putri (siang)
B. ESTERIFIKASI ASAM ASETAT
Dosen Pembimbing : Ir. Suprihastuti Sri Rahayu, M.Sc.
Asisten Praktikum : 1. Shinta Lieviana Handoko (pagi)
2. Lavenia Rinda Sari (siang)
C. PEMUNGUTAN PEKTIN
Dosen Pembimbing : Sang Kompiang Wirawan, S.T., M.T., Ph.D.
Asisten Praktikum : 1. Daniswara Krisna Prabatha (pagi)
2. Laras Prasakti (siang)
D. ANALISIS MINYAK NABATI
Dosen Pembimbing : Yuni Kusumastuti, S.T., M.Eng
Asisten Praktikum : 1. Erlina Rosa Evasari (pagi)
2. Fildzah Hanifati (siang)
E. DISTILASI CAMPURAN IMMISCIBLE
Dosen Pembimbing :. Himawan Tri Bayu Murti Petrus, S.T., ME., D.Eng.
Asisten Praktikum : 1. Kikis Yulianti (pagi)
2. Alvin Febrian Riandi (siang)
F. PENGAMBILAN MINYAK ATSIRI
Dosen Pembimbing : Ahmad Tawfiequrrahman Y., S.T., M.T., D.Eng.
Asisten Praktikum : 1. Baskoro Ajie (pagi)
2. Albertus Fuad Prajna Harto Subagyo (siang)
G. ANALISIS KADAR PROTEIN
Dosen Pembimbing : Chandra Wahyu Purnomo, S.T., M.Eng., D.Eng.
Asisten Praktikum : 1. Fendy Setiawan (pagi)
2. Septiana Damayanti (siang)
H. REKRISTALISASI ASAM OKSALAT
Dosen Pembimbing : Indra Perdana, S.T., M.T., Ph.D.
Asisten Praktikum : 1. Rendy Bayu Aji (pagi)
FORMAT PENULISAN LAPORAN RINGKAS
JUDUL MATA PRAKTIKUM
I. TUJUAN PERCOBAAN
Tujuan percobaan ini adalah:
1. ....
2. ....
II. CARA KERJA
Cara kerja berupa uraian secara lengkap dan rinci mengenai tahap-tahap dalam percobaan. Uraian
tersebut dituliskan dalam bentuk narasi menggunakan kalimat pasif.
Setiap kalimat yang diawali dengan angka atau rumus senyawa tertentu, maka harus dituliskan dalam
kata-kata. Contoh : 5 gram ….. ditulis Lima gram…., H2SO4 …. ditulis Asam sulfat…..
III. HASIL PERCOBAAN A. Data
Semua data yang ada di laporan sementara ditulis kembali di bagian ini.
B. Analisis Data
Berisi persamaan-persamaan yang digunakan untuk perhitungan, lengkap dengan nomor
persamaan dan keterangan dari variabel-variabel yang digunakan, dilengkapi dengan perhitungan.
IV. PEMBAHASAN
Berisi penjelasan mengenai hasil percobaan yang diperoleh serta penjelasan mengenai grafik yang
V. KESIMPULAN
Kesimpulan yang dapat diambil dari percobaan ini adalah:
1. ....
2. ....
VI. SARAN
Berisi saran untuk kemajuan Praktikum Analisis Bahan (bukan saran untuk asisten secara pribadi).
Yogyakarta, 2014
Asisten, Praktikan,
Nama Lengkap Asisten Nama Lengkap Praktikan
Catatan: Laporan sementara harus disertakan di akhir laporan.
KETENTUAN PENGUMPULAN LAPORAN RINGKAS
1. Laporan dikumpulkan kepada asisten jaga maksimal 1 (satu) minggu setelah praktikum dilakukan dan
juga sebagai syarat untuk mengikuti praktikum selanjutnya.
2. Laporan dikumpulkan dalam bentuk sudah dijilid rapi.
3. Laporan akan dikoreksi oleh asisten dan dikembalikan kepada praktikan maksimal 2 (dua) minggu
setelah tanggal pengumpulan laporan untuk direvisi oleh praktikan.
4. Laporan yang telah direvisi dikembalikan kepada asisten dengan waktu sesuai dengan kebijakan
asisten.
5. Keterlambatan pengumpulan laporan yang telah direvisi akan dikenai pengurangan nilai sebanyak 2
(dua) poin per hari atau sesuai kebijakan asisten.
FORMAT PENULISAN LAPORAN RESMI
JUDUL MATA PRAKTIKUM
I. TUJUAN PERCOBAAN
Tujuan percobaan ini adalah:
1. ....
2. ....
II. DASAR TEORI
Berisi teori-teori yang berhubungan dengan praktikum terkait. Sumber dari dasar teori yang digunakan
harus dicantumkan. Contoh: …dikenal sebagai ‘pektin’(Kertesz, 1951).
III. PELAKSANAAN PERCOBAAN A. Bahan
Bahan-bahan yang digunakan dalam percobaan ini adalah:
1. ....
2. ….
Sumber bahan juga harus ditulis, misalnya: Aquadest yang diperoleh dari laboratorium
Dasar-Dasaar Proses.
B. Alat
Gambar 1. Rangkaian Alat ...
Alat yang digambar hanya alat utama saja. Merk dagang dari alat yang digunakan harus di cantumkan, misalnya : Gelas beker pyrex 250 ml.
C. Cara Percobaan
Cara kerja berupa uraian secara lengkap dan rinci mengenai tahap-tahap dalam percobaan. Uraian
tersebut dituliskan dalam bentuk narasi menggunakan kalimat pasif.
D. Analisis Data
Berisi persamaan-persamaan yang digunakan untuk perhitungan, lengkap dengan nomor persamaan
dan keterangan dari variabel-variabel yang digunakan.
IV. HASIL DAN PEMBAHASAN
Berisi hasil percobaan dan penjelasan mengenai hasil percobaan yang diperoleh serta penjelasan
mengenai grafik yang dibuat (jika ada).
V. KESIMPULAN
Kesimpulan yang dapat diambil dari percobaan ini adalah:
1. ....
VI. DAFTAR PUSTAKA
Berisi daftar pustaka yang dijadikan acuan dalam penulisan laporan. Cara penulisan dijelaskan pada
bagian selanjutnya.
VII. LAMPIRAN
A. Identifikasi Hazard Proses dan Bahan Kimia
Identifikasi hazard terdiri dari:
• Identifikasi hazard proses selama praktikum, merupakan identifikasi kegiatan yang memiliki
potensi bahaya selama praktikum beserta penanganannya. Contoh: mengambil H2SO4 di
lemari asam.
• Identifikasi hazard dari bahan-bahan yang digunakan dalam percobaan. Contoh: HCl.
B. Penggunaan Alat Perlindungan Diri
Berisi poin-poin alat perlindungan diri apa saja yang harus digunakan selama percobaan beserta
kegunaannya. Contoh: Jas laboratorium lengan panjang.
C. Manajemen Limbah
Berisi poin-poin limbah yang dihasilkan dalam percobaan disertai dengan penanganannya.
Contoh: Sisa larutan NaOH.
D. Data Percobaan
Semua data yang ada di laporan sementara ditulis kembali di bagian ini.
E. Perhitungan
Berisi perhitungan yang diperoleh dari hasil percobaan.
KETENTUAN PENGUMPULAN LAPORAN RESMI
1. Laporan resmi yang ditulis tangan dikumpulkan kepada asisten jaga maksimal 1 (satu) minggu setelah
praktikum dilakukan. Setiap praktikan membuat satu laporan.
2. Laporan dikumpulkan dalam bentuk sudah dijilid rapi.
3. Laporan akan dikoreksi oleh asisten dan dikembalikan kepada praktikan maksimal 1 (satu) minggu
setelah tanggal pengumpulan laporan untuk direvisi oleh praktikan.
4. Laporan yang telah direvisi dikembalikan kepada asisten dengan waktu sesuai dengan kebijakan
asisten.
5. Laporan yang telah di-acc oleh asisten dikembalikan lagi kepada praktikan untuk diketik. Setiap
kelompok membuat satu laporan.
6. Laporan yang telah diketik kemudian dikonsultasikan kepada dosen pembimbing masing-masing
mata praktikum.
7. Batas waktu pengumpulan laporan resmi yang sudah dikonsultasikan kepada dosen pembimbing
adalah 4 (empat) minggu setelah praktikum dilakukan.
TATA CARA PENULISAN LAPORAN
1. Laporan yang ditulis tangan ditulis dengan tinta berwarna hitam di kertas folio bergaris.
2. Laporan yang diketik dicetak pada kertas HVS 80 gram/m2 ukuran A4 dengan line spacing 1,5
dan margin: Atas : 4 cm Bawah : 3 cm Kiri : 4 cm Kanan : 3 cm.
3. Menggunakan bahasa Indonesia yang baku.
4. Tidak diperbolehkan menyingkat kata.
5. Menggunakan tanda baca yang tepat.
6. Tidak diperbolehkan menggunakan kata penghubung untuk memulai kalimat.
7. Permulaan kalimat yang berupa bilangan, lambang, atau rumus kimia ditulis dengan kata-kata.
Contoh: NaOH dibuat.... Natrium hidroksida dibuat....
8. Menggarisbawahi setiap istilah asing (jika ditulis tangan) atau dicetak miring (jika diketik).
Contoh: aquadest atau aquadest.
9. Penulisan sumber dijadikan satu dengan kalimat.
Contoh: ... dikenal sebagai ‘pektin’ (Kertesz, 1951).
10. Penulisan pada cover menggunakan huruf kapital.
11. Judul mata praktikum ditulis dengan huruf kapital.
12. Contoh: ANALISIS MINYAK NABATI
13. Judul bab ditulis dengan huruf kapital (jika diketik) dan digaris bawah (jika ditulis tangan).
Contoh:
I. TUJUAN PERCOBAAN (jika diketik)
I.TUJUAN PERCOBAAN (jika ditulis tangan).
14. Daftar/ tabel diberi border atas dan bawah dengan garis double dan tidak boleh dipenggal kecuali
lebih dari satu halaman. Nomor dan judul daftar ditempatkan di atas daftar.
15. Yang termasuk gambar adalah gambar alat, bagan serta grafik. Gambar alat merupakan gambar
penampang depan alat utama dan rangkaian alat. Keterangan dituliskan di tempat yang kosong
pada gambar, sedangkan nomor dan judul gambar ditempatkan di bawah gambar.
• Daftar/ tabel diberi nomor urut dengan angka romawi besar. Jika diketik tulisan dibuat
bold, sedangkan jika ditulis tangan tulisan diberi garis bawah. Contoh: Daftar I. .... atau Daftar I. ....
• Gambar diberi nomor urut dengan angka arab. Jika diketik tulisan dibuat bold, sedangkan jika ditulis tangan tulisan diberi garis bawah. Contoh: Gambar 1. .... atau Gambar 1. ....
• Persamaan diberi nomor urut dengan angka arab di dalam kurung pada tepi kanan.
Contoh:
CaSO4 + K2CO3 ↔ CaCO3 + K2SO4 (1)
17. Ketentuan penulisan daftar pustaka:
Ke bawah menurut abjad nama akhir penulis pertama.
Ke kanan:
• Buku : Nama akhir penulis, tahun terbit, “judul buku”, jilid, edisi ke, nomor halaman,
nama penerbit, kota.
• Majalah/ jurnal : Nama akhir penulis, tahun terbit, “judul penelitian”, nama majalah
(singkatan resmi), jilid, nomor halaman.
18. Syarat tidak inhall laporan:
• Harus sesuai ketentuan (format) laporan.
• Seluruh bab dan sub bab harus ada.
KESELAMATAN KERJA DI LABORATORIUM
Di dalam laboratorium praktikan harus:
• Mencuci tangan ketika masuk dan keluarla boratorium, dan ketika kontak dengan bahan-bahan
kimia.
• Selalu memakai jas laboratorium lengan panjang yang dikancingkan.
• Memakai alat perlindungan diri seperti masker,sarung tangan,dan goggle.
• Mengikat rambut panjang ke belakang.
• Memastikan bahwa label telah sesuai dengan bahan-bahan kimia yang ada di dalamnya dan
dalam kondisi yangbaik.
• Mencabut dan mematikan aliran listrik dan air di akhir percobaan.
Di dalam laboratorium praktikan dilarang:
• Bekerja diluar area kerja.
• Menggunakan gelang, kalung, dan lengan yang terlalu longgar.
• Bekerja sendiri di laboratorium,khususnya untuk resiko tinggi.
• Merokok, makan,dan minum.
• Meletakkan makanan di kulkas bersama bahan-bahan kimia.
• Menggunakan lensa kontak.
• Menggunakan kembali suatu wadah untuk bahan kimia lain tanpa membuang label awal.
• Membawa bahan kimia dalam saku baju atau saku jas laboratorium.
• Menghisap menggunakan mulut.
• Menyentuh bahan kimia.
• Menyimpan bahan kimia dalam jumlah besar dilaboratorium.
Beberapa contoh simbol bahaya yang terdapat pada label bahan kimia:
Untuk nformasi lebih lengkap lihat poster “Keselamatan Kerja di Laboratorium” yang ada di
Laboratorium Dasar-Dasar Proses
(A)
I. TUJUAN PERCOBAAN
1. Memahami prinsip dasar proses hidrolisis.
2. Menentukan kadar pati (karbohidrat) dalam suatu bahan makanan. 3. Analisis konsentrasi glukosa dengan metode Lane dan Eynon.
II. DASAR TEORI
Pati adalah karbohidrat yang merupakan polisakarida dengan rumus umum (C6H10O5)n yang merupakan polimer glukosa yang saling berikatan melalui ikatan 1,4
alfa-glukosa. Di dalam pati terdapat amilosa dengan rantai lurus dan amilopektin yang rantainya bercabang.
Sifat-sifat pati :
1. Tidak mereduksi Fehling A dan Fehling B.
2. Tidak dapat larut dalam air dingin sebab memiliki gugus hidroksil terbuka. 3. Pati akan membentuk warna biru bila bereaksi dengan iodin.
4. Dapat dipisahkan menjadi 2 fraksi utama berdasarkan kelarutannya dalam air panas, yaitu amilosa (larut) dan amilopektin (tidak larut).
Contoh bahan-bahan yang mengandung pati antara lain beras, sagu, kentang, singkong, jagung, dan gandum.
Reaksi hidrolisis merupakan reaksi pengikatan gugus hidroksil (OH) oleh suatu senyawa. Reaksi hidrolisis pati :
[C6H10O5]n + nH2O n[C6H12O6]
Faktor-faktor yang mempengaruhi hidrolisis pati adalah :
1. Waktu reaksi. Semakin lama waktu reaksi, maka semakin banyak pati yang terhidrolisis.
2. Suhu reaksi. Semakin tinggi suhu, maka semakin cepat reaksi sehingga pati yang terhidrolisis lebih banyak pada waktu reaksi yang sama.
Untuk analisis kadar glukosa dalam pati ini digunakan larutan Fehling A dan Fehling B yang akan bereaksi dengan glukosa dalam larutan hasil hidrolisis dengan indikator metil biru. Pada akhir titrasi, titik ekivalen ditandai dengan terbentuknya larutan bening dengan endapan merah bata.
III. PELAKSANAAN PERCOBAAN
A. Bahan 1. Pati kanji
2. Larutan Fehling A 3. Larutan Fehling B 4. NaOH pellets
5. Larutan HCl 6. Glukosa standar 7. Air suling
8. Indikator metil biru 9. Kertas lakmus merah 10.Kertas saring
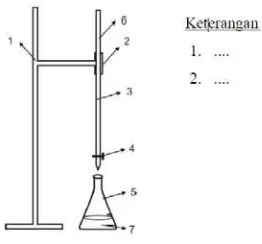
B. Alat
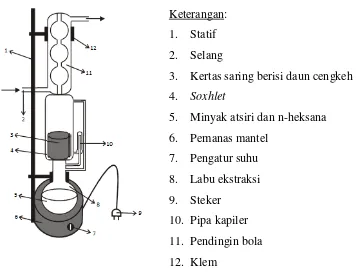
Rangkaian alat percobaan tertulis pada Gambar 1
Keterangan :
1. Statif
2. Pendingin Bola 3. Klem
4. Steker
C. Cara percobaan
Percobaan yang dilakukan meliputi: pembuatan larutan HCl 1N, pembuatan larutan NaOH 1N, proses hidrolisis pati, pembuatan larutan glukosa standar, titrasi blangko dan titrasi blangko + larutan hasil hidrolisis dengan larutan glukosa standar.
a) Pembuatan Larutan HCl 1N :
1. Isi gelas beker 250 mL dengan 50 mL air suling.
2. Ambil sebanyak 20,8 mL HCl pekat dari lemari asam dengan menggunakan pipet ukur 10 ml dan masukkan ke dalam gelas beker berisi air suling. 3. Pindahkan larutan HCl ke dalam labu ukur 250 mL dengan corong gelas. 4. Tambahkan air suling hingga tanda batas dan gojog hingga homogen.
b) Pembuatan Larutan NaOH 1N :
1. Timbang 2 gram NaOH dengan botol timbang menggunakan neraca analitis digital.
2. Ambil air suling sebanyak 50 mL dengan pipet volume dan masukkan ke dalam gelas beker.
3. Larutkan NaOH yang sudah ditimbang ke dalam gelas beker yang berisi air suling.
c) Hidrolisis Pati :
1. Timbang pati kanji sebanyak 5 gram pada gelas arloji menggunakan neraca analitis digital.
2. Campurkan pati dan larutan HCl 1 N dalam gelas beker 250 mL dan aduk hingga homogen dengan gelas pengaduk.
3. Masukkan campuran pati dan larutan HCl 1N serta batu didih ke dalam labu leher tiga, lalu rangkai alat dan alirkan air pada pendingin bola.
4. Hidupkan pemanas mantel dan tunggu larutan mulai mendidih, kemudian lakukan hidrolisis selama 1 jam dihitung sejak mulai mendidih.
5. Matikan pemanas mantel setelah 1 jam mendidih, kemudian dinginkan larutan yang telah dihidrolisis dengan tetap menggunakan pendingin bola. 6. Saring larutan hasil hidrolisis ke dalam erlenmeyer 250 mL dengan kertas
7. Ambil filtrat cairan hasil hidrolisis 25 mL dengan pipet volume 25 mL dan masukkan ke dalam gelas beker 250 mL.
8. Masukkan kertas lakmus ke filtrat dalam gelas beker 250 mL. Netralkan filtrat dengan larutan NaOH 1N. Cek dengan kertas lakmus, sehingga warna kertas lakmus berubah dari merah menjadi biru.
9. Masukkan filtrat yang sudah dinetralkan ke dalam labu ukur 100 mL dan tambahkan air suling hingga tanda batas, lalu gojog hingga homogen.
d) Pembuatan Larutan Glukosa Standar
1. Timbang 1 gram glukosa monohidrat dengan gelas arloji menggunakan neraca analitis digital.
2. Larutkan glukosa monohidrat dengan 50 mL air suling di dalam gelas beker 250 mL.
3. Kemudian masukkan larutan ke dalam labu ukur 250 mL, tambahkan air suling sampai tanda batas, dan gojog hingga homogen.
e) Titrasi Blangko (Fehling A + Fehling B) dengan Larutan Glukosa Standar 1. Masukkan larutan glukosa standar ke dalam buret 50 mL.
2. Ambil 10 mL larutan Fehling A dan 10 mL larutan Fehling B, kemudian masukkan ke dalam erlenmeyer 125 mL dan goyang hingga homogen. 3. Didihkan di atas kompor listrik, kemudian titrasi dengan larutan glukosa
standar pada keadaan mendidih hingga warna birunya hampir hilang dan terbentuk endapan berwarna merah bata.
4. Tambahkan 3 tetes metil biru ke dalam larutan tersebut dan teruskan titrasi hingga cairan berubah warna menjadi bening dan terbentuk endapan merah bata, kemudian catat volume larutan glukosa standar yang diperlukan untuk titrasi.
5. Lakukan langkah 2 sampai 4 untuk 2 sampel lainnya.
f) Titrasi Larutan Fehling A + Fehling B yang ditambahkan larutan hasil
hidrolisis dengan Larutan Glukosa Standar
2. Ambil 10 mL larutan Fehling A, 10 mL larutan Fehling B, dan 10 mL larutan hasil hidrolisis yang telah dinetralkan, kemudian masukkan ke dalam erlenmeyer 125 mL dan goyang hingga homogen.
3. Didihkan di atas kompor listrik, kemudian titrasi dengan larutan glukosa standar pada keadaan mendidih hingga warna birunya hampir hilang dan terbentuk endapan merah bata.
4. Tambahkan 3 tetes metil biru ke dalam larutan tersebut dan meneruskan titrasi hingga cairan berubah warna menjadi bening dan terbentuk endapan merah bata, kemudian catat volume larutan glukosa standar yang diperlukan untuk titrasi.
5. Lakukan langkah 2 sampai 4 untuk 2 sampel lainnya.
D. Analisis data
1. Penentuan konsentrasi glukosa dalam larutan glukosa standar
Cs =Wmonohidrat Vlarutan x
BMglukosa BMmonohidrat
dengan, Cs = konsentrasi larutan glukosa standar, mg glukosa/mL
Wmonohidrat = massa glukosa monohidrat standar, mg
Vlarutan = volume larutan glukosa standar, mL
BMglukosa = berat molekul glukosa, mg/mmol
BMmonohidrat = berat molekul glukosa monohidrat, mg/mmol
2. Penentuan konsentrasi glukosa dalam larutan hidrolisis pati
a. Menghitung selisih volume larutan glukosa standar yang digunakan untuk titrasi larutan blangko dengan glukosa standar yang digunakan untuk titrasi larutan blangko + larutan hasil hidrolisis pati
∆Vn = Vbn−Vhn
dengan, ΔVn = selisih volume larutan glukosa standar yang digunakan untuk
titrasi larutan Fehling A + Fehling B (Vb n) dengan yang
digunakan untuk larutan Fehling A + Fehling B + hasil hidrolisis pati (Vh n), mL
Vb n = volume larutan glukosa standar yang digunakan untuk titrasi
Vh n = volume larutan glukosa standar yang digunakan untuk titrasi
larutan blangko(fehling A + fehling B) + larutan hasil hidrolisis sampel n, ml
n = 1, 2, 3
b. Menghitung konsentrasi glukosa dalam larutan hidrolisis pati setelah diencerkan
Chen= ΔVn x Cs V
dengan, V = volume larutan hidrolisis setelah diencerkan yang ditambahkan ke larutan blangko, mL
Che n = konsentrasi glukosa sampel n dalam larutan hidrolisis setelah
diencerkan, mg glukosa/mL
c. Menghitung konsentrasi glukosa dalam larutan hidrolisis pati sebelum diencerkan
Chpn= Chen x Vhe Vhp
dengan, Chp n = konsentrasi glukosa dalam larutan hidrolisis pati sebelum
diencerkan
Vhp = volume larutan hidrolisis pati yang diencerkan, mL
Vhe = volume larutan hidrolisis pati setelah diencerkan, mL
3. Penentuan ekivalen glukosa dalam larutan hidrolisis pati mp n = Chp n x Vp
dengan, mp n = massa ekivalen glukosa dalam larutan hidrolisis pati sebelum
diencerkan, mg glukosa
Vp = volume larutan hidrolisis pati total, mL
4. Penentuan jumlah glukosa yang terbentuk hasil hidrolisis
mbn = mpn Wpati
dengan, mb n = massa ekivalen glukosa yang terbentuk hasil hidrolisis pati, mg
glukosa/ mg pati
Wpati = massa pati yang dianalisis, mg pati
mkn = mbn x BMpati
BMglukosa x 100 %
dengan, mk n = kadar pati, %
BM pati = berat molekul pati, mg/mmol
IV. HASIL DAN PEMBAHASAN
Hal-hal yang perlu dibahas antara lain:
1. Penjelasan tentang proses hidrolisis dalam percobaan 2. Penjelasan hasil percobaan
3. Kesalahan relatif
4. Asumsi-asumsi yang digunakan
V. KESIMPULAN
Poin-poin kesimpulan, diantaranya :
1. Metode yang dapat digunakan untuk analisis hasil hidrolisis 2. Faktor-faktor yang mempengaruhi hidrolisis pati
3. Perbandingan antara hasil hidrolisis dengan teori
VI. DAFTAR PUSTAKA
Woodman, A.G.,1941, “Food Analysis”, 4 ed., pp. 254-306, McGraw-Hill Book Company, New York.
Groggins, P.H., 1985, “Unit Process in Organic Synthesis” , 5 ed., pp. 750-753, 761-765, 770-771, McGraw-Hill Book Company, New York.
Kirk, R.E., and Othmer, D.E.,1987, “Encyclopedia of Chemical Technology”, 3 ed. Vol 21, p.76, The Interscience Encyclopedia, Inc., New York.
VII. LAMPIRAN
A. Identifikasi Hazard Proses dan Bahan Kimia
Proses yang harus diidentifikasi hazard adalah : 1. Proses Hidrolisis Pati
2. Proses Titrasi Analisis Kadar Glukosa
Bahan-bahan kimia yang harus diidentifikasi hazard adalah : 1. Pati kanji
3. Larutan Fehling B (K-Na-Tartrat) 4. NaOH pellets
5. Larutan HCl 6. Glukosa standar 7. Air suling
8. Indikator metil biru
B. Penggunaan Alat Perlindungan Diri
Alat perlindungan diri yang harus dipakai dalam percobaan ini dan dijelaskan penggunaannya adalah jas lab, masker, sarung tangan, dan kacamata lab (goggle).
C. Manajemen Limbah
Limbah yang dihasilkan dari sisa hidrolisis pati adalah glukosa yang terlarut dalam HCl. Penanganan larutan ini adalah dengan membuangnya pada wadah limbah halogenik karena mengandung zat klor yang termasuk dalam golongan halogen.
Limbah yang harus dibahas adalah : 1. Limbah sisa hidrolisis pati
2. Limbah hasil titrasi
3. Limbah sisa larutan glukosa standar
D. Data percobaan
LAPORAN SEMENTARA PRAKTIKUM PROSES
Waktu praktikum : Pagi / Sore
Asisten : Veronica Candra Gunawan / Ardina Lukita Diyani Putri
DATA PERCOBAAN
Massa glukosa monohidrat : gram Massa NaOH : gram Volume larutan glukosa monohidrat : mL Volume larutan HCl : mL Massa pati : gram Lama hidrolisis : jam Warna larutan sebelum hidrolisis :
Warna larutan setelah hidrolisis :
Volume larutan yang dinetralkan : mL Volume larutan setelah pengenceran : mL
A. Titrasi larutan Fehling A + Fehling B dengan larutan glukosa standar
No. Fehling A, mL Fehling B, mL Volume larutan glukosa standar, mL 1.
2. 3.
ESTERIFIKASI ASAM ASETAT
(B)
I. TUJUAN PERCOBAAN
Percobaan ini bertujuan untuk mempelajari perubahan konversi asam asetat terhadap waktu reaksi esterifikasi asam asetat dengan etanol menggunakan katalisator asam sulfat.
II. DASAR TEORI
Konsentrasi zat-zat yang terlibat dalam suatu reaksi berubah dengan waktu.Seiring bertambahnya waktu, konsentrasi reaktan semakin rendah, sedangkan konsentrasi produk semakin tinggi. Perubahan konsentrasi reaktan per satuan waktu disebut laju reaksi pengurangan reaktan, sedangkan perubahan konsentrasi produk per satuan waktu disebut laju reaksi pembentukan produk. Reaksi kimia ada yang berlangsung cepat, ada pula yang lambat. Konsentrasi reaktan memiliki peranan yang sangat penting dalam laju reaksi. Semakin besar konsentrasi, semakin banyak tumbukan antar molekul reaktan, sehingga laju reaksi semakin cepat. Begitu juga sebaliknya, semakin kecil konsentrasi reaktan, semakin kecil laju reaksi.
Selain konsentrasi reaktan yang tinggi, suhu reaksi yang tinggi juga meningkatkan laju reaksi. Hubungan nilai konstanta laju reaksi dan suhu didefinisikan dengan persamaan Arrhenius:
k = Ae−RT E (1)
dengan, k = konstanta laju reaksi, A = faktor tumbukan, E = energi aktivasi, R = tetapan gas ideal, dan T = suhu absolut.
Esterifikasi merupakan proses membuat ester dari asam karboksilat dengan alkohol. Persamaan reaksi pembentukan ester dari asam asetat (CH3COOH) dengan
etanol (C2H5OH) menghasilkan ester etilasetat (CH3COOC2H5) dan air, sbb.:
CH3COOH(aq) + C2H5OH(aq) CH3COOC2H5(aq)+ H2O(l) (2)
Persamaan (2) menggambarkan bahwa ester yang terbentuk juga bereaksi dengan air, kembali membentuk asam asetat dan etanol (proses hidrolisis). Karena reaksi ini bersifat dapat balik, maka pada suatu saat konsentrasi reaktan dan konsentrasi produk akan setimbang (equilibrium). Hubungan konsentrasi reaktan dan produk pada saat setimbang diberikan sebagai konstanta kesetimbangan reaksi :
K =CEeCWe
CHeCAe (3)
dalam hal ini, K = konstanta kesetimbangan reaksi, sedang CEe, CWe, CHe dan CAe,
berturut turut adalah konsentrasi ester, air, asam asetat dan etanol pada saat setimbang. Untuk menggeser kesetimbangan, dilakukan pengusiran salah satu hasil terutama yang titik didihnya lebih rendah (biasanya ester), sehingga jumlah ester menjadi relatif sedikit, laju reaksi ke arah reaktan (hidrolisis) berkurang atau kesetimbangan bergeser ke kanan. Penggunaan salah satu reaktan berlebih (perbandingan molar alkohol terhadap asam asetat >>1) dimaksudkan untuk menggeser kesetimbangan ke arah kanan juga.
Nilai K dipengaruhi suhu dan persamaan hubungan suhu dengan K, persamaan van’t Hoff :
Jika konversi asam asetat didefinisikan sebagai perbandingan mol asam asetat yang bereaksi terhadap mol asam asetat mula-mula, yaitu :
x =nHo−nH
nHo (5)
atau x =CHo− CH
CHo (6)
dalam hal ini nHo dan nH berturut-turut adalah jumlah mol asam asetat pada saat t = 0
dan pada saat t = t, sedang CHo dan CH berturut-turut adalah konsentrasi asam asetat
III. PELAKSANAAN PERCOBAAN
A.Bahan Percobaan
Bahan – bahan yang digunakan : 1. Asam asetat glasial
2. Etanol teknis 3. H2SO4 pekat
4. Aquadest
5. NaOH padat 6. Larutan HCl
7. Indikator phenolpthalein
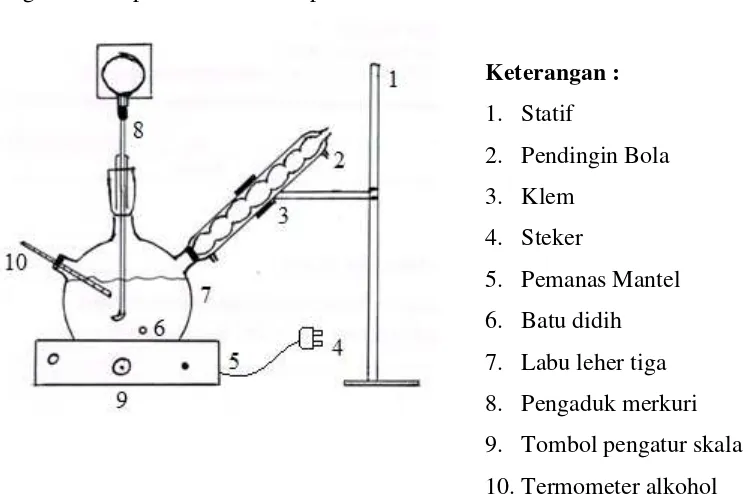
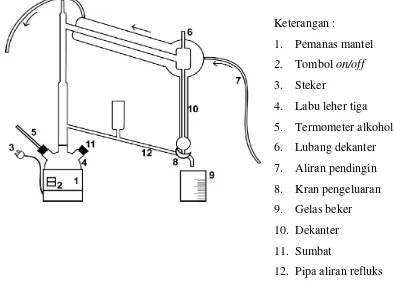
B.Alat Percobaan
Alat yang digunakan berupa rangkaian alat (gambar 1) dan alat-alat gelas untuk titrasi.
Keterangan:
1. Labu leher tiga 500 mL 2. Pemanas mantel
3. Motor listrik 4. Pengaduk merkuri 5. Pendingin bola
6. Pengatur skala pemanas 7. Termometer alkohol 8. Pengambil cuplikan 9. Penyumbat
C.Cara Percobaan
1. Buat larutan NaOH 0,1 N sebanyak 500 mL.
2. Standardisasi larutan NaOH dengan larutan HCl 0,1 N. 3. Titrasi larutan asam asetat dengan larutan NaOH 0,1 N
Ambil 5 mL larutan asam asetat lalu diencerkan menjadi 100 mL, kemudian dari larutan asam asetat yang telah diencerkan, ambil lagi 5 mL lalu diencerkan menjadi 100 mL.
4. Esterifikasi Asam Asetat
a. Ambil 25 mL asam asetat menggunakan pipet volume 25 mL lalu tuang ke dalam labu ukur 250 mL. Lalu tambahkan 2 mL asam sulfat dengan menggunakan pipet ukur 2 mL. Gojog hingga sempurna.
b. Ambil 5 mL campuran asam asetat-asam sulfat menggunakan pipet volume 5 mL lalu tuang ke dalam labu ukur 100 mL. Dari pengenceran 1 diambil lagi 5 mL lalu diencerkan 100 mL.
c. Ambil 25 mL campuran asam asetat-asam sulfat dari pengenceran ke-2. Gunakan pipet volume 25 mL. Tuang ke dalam Erlenmeyer 250 mL. Tambahkan 5 tetes indikator phenolphthalein lalu titrasi denganNaOH 0,1 N yang telah diketahui normalitasnya. Catat volume NaOH yang dibutuhkan.
d. Ulangi pekerjaan (c) hingga 3 kali, lalu hitung volume NaOH rata-rata (=Vaa).
e. Hitung normalitas asam asetat dalam campuran reaktan (=Aa).
f. Ambil 200 mL etanol menggunakan gelas ukur lalu tuang ke dalam Erlenmeyer 250 mL, pasang sumbat beserta termometer, kemudian panaskan di atas kompor listrik. Amati suhu larutan. Jika suhu telah melebihi ±70oC, matikan kompor.
g. Panaskan sisa campuran asam asetat-asam sulfat di dalam labu leher tiga. Nyalakan pengaduk merkuri, pemanas mantel pada skala 4 serta pendingin bola. Amati suhu larutan.
i. Amati suhu larutan dalam labu leher tiga, kemudiancatat. Jika telah mencapai suhu konstan, turunkan skala pemanas mantel menjadi skala 2. j. Ambil kira-kira 10 mL cuplikan di dalam reaktor setelah 15 menit sejak
pemanasan. Catat suhu reaksi. Gunakan pipet volume, ambil 5 mL cuplikan lalu tuang ke dalam labu ukur 100 mL. Encerkan dengan aquadest hingga tanda. Gojog hingga tercampur sempurna.
k. Ambil 25 mL cuplikan yang telah diencerkan. Tuang ke dalam Erlenmeyer 125 mL. Tambahkan 5 tetes indikator phenolphthalein lalu titrasi dengan NaOH 0,1 N. Catat volume NaOH yang dibutuhkan.
l. Ulangi pekerjaan j) hingga 3 kali lalu hitung volume NaOH rata-rata (=Vat).
m.Hitung normalitas asam campuran (=At)
n. Ulangi pekerjaan j) hingga m) setelah reaksi berlangsung selama 30 menit, 60 menit, 90 menit, dan 120 menit.
o. Hitung konversi asetat lalu buat grafik perubahan konversi asetat dan konsentrasi terhadap waktu.
D.Analisis Data
Normalitas larutan HCl
NHCl = 2 . Wboraks
BMboraks × VHCl (7)
dengan,
N HCl = normalitas larutan HCl, N
W boraks = berat boraks, mgram
BM boraks = berat molekul boraks =... mgram/mmol V HCl = volume larutan HCl untuk titrasi, mL
NHCl = ( NHCl 1 + NHCl 2 + NHCl 3) / 3 (8)
Normalitas NaOH
NNaOH= VHClrerata × NHCl
VNaOH (9)
dengan,
NNaOH = Normalitas larutan NaOH, N
NHCl = Normalitas larutan HCl
VHCl = Volume larutan HCl rata-rata, mL
Konversi Asam Asetat
Konversi asetat(X) = At0− At
Aa × 100 % (10)
dengan, Ato = normalitas asam campuran (asetat dan sulfat) dalam reaktan,
mgrek/mL
At = normalitas asam campuran (asetat dan sulfat) pada saat t = t,
mgrek/mL
Aa = normalitas asam asetat dalam campuran reaktan, mgrek/mL
Nilai Ato danAa dihitung sebagai berikut:
Ai = VNaOHi × NNaOH
5 × 5 × Vc × 100 × 100 (11)
dengan, Ai = AtoatauAa
Vc = volume cuplikan yang dititrasi (25 mL)
VNaOHi = Vto atau Vaa, mL
NNaOH = normalitas larutan NaOH, N
Nilai At dihitung sebagai berikut:
At= VNaOHt × NNaOH
5(Vc) × 100 (12)
dengan, At = normalitas asam campuran (asetat dan sulfat) pada saat t = t,
mgrek/mL
Vc = volume cuplikan yang dititrasi (25 mL)
VNaOHt = volume larutan NaOH yang digunakan untuk titrasi sampel
yang diambil pada waktu t, mL
NNaOH = normalitas larutan NaOH, N
Konversi Setimbang Teoritis
Reaksi esterifikasi asam asetat dengan etanol mengikuti reaksi berikut ini:
Tabel Stoikhiometri
Komponen mol mula-mula mol yang
bereaksi/terbentuk mol yang tersisa CH3COOH NA0 NA0 X NA0 (1-X)
C2H5OH NB0 NA0 X NB0- NA0X
CH3COOC2H5 0 NA0 X NA0 X
H2O 0 NA0 X NA0 X
Pada kondisi kesetimbangan, konversi (X) sama dengan Xe, sehingga nilai
konstanta kesetimbangan menjadi:
K = (NA0∙Xe)
2
�NA0(1−Xe)�(NB0−NA0∙Xe) (13)
dengan, K = konstanta kesetimbangan reaksi pada suhu percobaan NA0 = mol asam asetat mula-mula, mol
NB0 = mol etanol mula-mula, mol
Xe = konversi asam asetat pada kondisi setimbang
Nilai konstanta kesetimbangan reaksi dihitung dengan persamaan van’t Hoff:
dlnK
dengan, K1 = konstanta kesetimbangan reaksi pada suhu referensi
K2 = konstanta kesetimbangan reaksi pada suhu percobaan
∆Hr = entalpi reaksi esterifikasi asam asetat, J/mol T1 = suhu referensi, K
T2 = suhu percobaan, K
R = konstanta gas ideal, J/mol/K
Jumlah mol asam asetat mula-mula dapat dihitung dengan persamaan:
NA0 = Aa× VA (16)
dengan, NA0 = jumlah mol asam asetat mula-mula, mol
VA = volume asam asetat, mL
Jumlah mol etanol mula-mula dapat dihitung dengan persamaan:
NB0= VB.ρB. % B
MrB (17)
dengan, NB0 = jumlah mol etanol mula-mula, mol
VB = volume etanol, mL
ρB = massa jenis etanol pada suhu percobaan, g/mL
% B = kadar etanol
MrB = berat molekul etanol, 46 gram/mol
IV. HASIL DAN PEMBAHASAN
Beri sedikit penjelasan perubahan konsentrasi, warna, dan bau yang teramati. Selanjutnya hasil perhitungan disajikan dalam tabel dan grafik dan selanjutnya dibahas bagaimana perubahan konsentrasi reaktan, konsentrasi produk, dan konversiberubah terhadap waktu reaksi. Periksa apakah kesetimbangan telah dicapai. Bandingkan dengan konversi setimbang teoritis. Apa saja usaha-usaha agar dicapai konversi yang lebih tinggi?
V. KESIMPULAN
Tuliskan kesimpulan sesuai dengan tujuan dan hasil percobaan saudara.
VI. DAFTAR PUSTAKA
Griffin, R.C., 1921, “Technical Methods of Analysis”, 2 ed., pp.309-311, McGraw-Hill Book Company, Inc., New York.
Groggins, P. H., 1958, “Unit Processes In Organic Synthesis”, 5th ed., pp 694-702, McGraw-Hill Book Company, Inc., New York
VII. LAMPIRAN
A. Identifikasi Hazard Bahan Kimia dan Proses
Format :
Identifikasi hazard terdiri dari :
• Jenis bahan
• Sifat-sifat bahan
• Cara penanganan
Identifikasi hazard untuk unsafe acts terdiri dari :
• Jenis tindakan berbahaya
• Bahaya yang ditimbulkan
• Tindakan yang seharusnya
B. Penggunaan Alat Perlindungan Diri
(Jelaskan penggunaan masing-masing alat perlindungan diri)
C. Manajemen Limbah
Identifikasi semua limbah yang dihasilkan dari percobaan ini, termasuk jenis dan pembuangannya. Pisahkan dalam wadah tersendiri : larutan NaOH sisa agar bisa digunakan lagi, campuran hasil reaksi, hasil titrasi.
D. Data Percobaan
LAPORAN SEMENTARA PRAKTIKUM PROSES
Asisten : Shinta Lieviana Handoko / Lavenia Rinda Sari
Data Percobaan
Asisten Jaga, Praktikan,
PEMUNGUTAN PEKTIN
(C)
I. TUJUAN PERCOBAAN
Tujuan percobaan ini adalah sebagai berikut :
1.Mempelajari proses pemungutan pektin dari kulit jeruk.
2.Mempelajari pengaruh jenis dan volume dari bahan kimia penggumpal terhadap jumlah
pektin yang diperoleh.
3. Mempelajari pengaruh waktu pengovenan terhadap hasil pektin yang diperoleh.
II. DASAR TEORI
Pektin adalah polisakarida heterogen yang didominasi oleh gugus homogalakturonat
(kopolimer yang tersusun dari asam galakturonat dan metal ester dari asam galakturonat)
(Walter, 1991). Semula pektin hanya digunakan sebagai bahan pembentuk gel dan
pemodifikasi tekstur dalam industri yang berkaitan dengan makanan. Dalam
perkembangan selanjutnya, pektin dikenal sebagai senyawa yang berguna untuk
modifikasi aspek rasa dan estetika pada makanan, studi - studi modern juga telah
mengungkapkan manfaat pektin sebagai senyawa fungsional dalam tubuh manusia, antara
lain berfungsi untuk menstimulasi sistem pertahanan tubuh dan menurunkan kadar
kolesterol dalam darah.
Pektin adalah senyawa utama penyusun dinding sel tumbuhan yang berfungsi
mengikat sel-sel satu sama lain. Dalam jaringan tumbuhan (terutama pada buahnya) yang
masih muda, senyawa pektin masih dalam bentuk protopektin yang sifatnya tidak larut
dalam air. Hal ini karena protopektin terbentuk dari reaksi pectic substances dengan
selulosa. Selulosa terdapat pada dinding sel tanaman dan protopektin terletak pada bagian
tengah lamela antara dinding-dinding sel (Nagodawithana, 1993). Oleh karena itu,
dimungkinkan mereka saling bergabung (bereaksi) membentuk makromolekul yang tidak
larut dalam air. Senyawa ini dapat dipisahkan dari jaringan tumbuhan dengan cara
hidrolisis untuk mengubah protopektin tersebut menjadi senyawa pektat yang dapat
terdispersi dalam air. Dengan penambahan senyawa-senyawa polar (misalnya alkohol
rantai pendek, keton rantai pendek, atau garam-garam logam), senyawa pektat terdispersi
dapat diendapkan sebagai senyawa polisakarida yang sehari-hari disebut “pektin”.
Kandungan pektin dalam beberapa sumber antara lain: apel 1-15%, aprikot 1%, ceri
0,4%, jeruk 0,5-3,5%, wortel 1,4%. Pektin yang banyak dijual merupakan hasil ekstraksi
dikeringkan (Walter, 1991). Salah satu sumber pektin yang sangat potensial adalah
limbah dari industri produk olahan buah-buahan, misalnya pabrik jus jeruk, jus apel, dan
lain-lain. Limbah tersebut dapat berupa kulit buah, ampas daging buah, dll. Produksi
pektin dari bahan baku limbah akan memberikan keuntungan tambahan karena pektin
murni dapat dijual dengan harga tinggi dan proses produksinya tidak terlalu rumit.
Walaupun demikian, diperlukan pertimbangan yang matang dalam pemilihan kondisi
proses dan bahan kimia penggumpal agar dipeoleh percent recovery optimum dan
kemurnian maksimum.
III. PELAKSANAAN PERCOBAAN
A. Bahan
Bahan-bahan yang digunakan pada percobaan ini adalah:
1. Serbuk albedo jeruk bali
2. HCl pekat 37%
3. Aquadest
4. Air kran
5. Etanol 96 %
6. Isopropil alkohol
7. Aseton
8. HCl 0,05 N
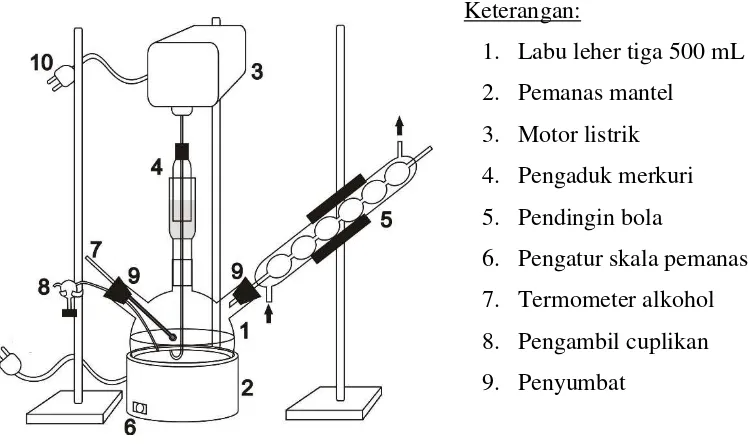
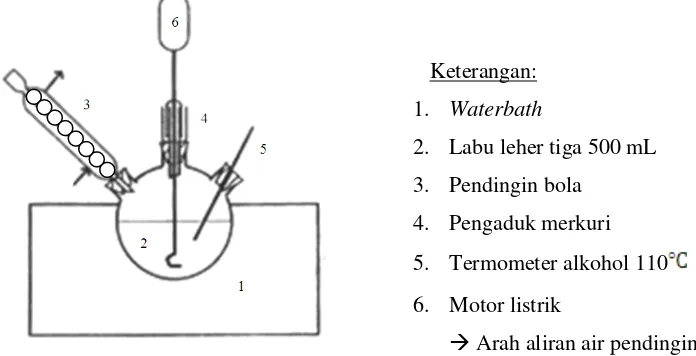
B. Alat
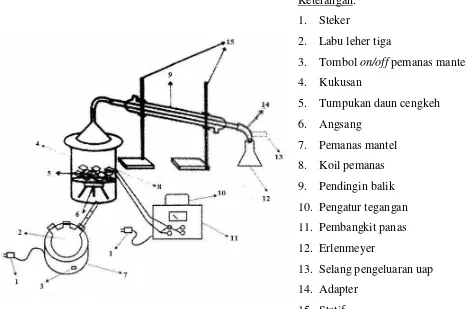
Alat-alat dalam percobaan ini dirangkai seperti gambar berikut :
Keterangan:
1. Waterbath
2. Labu leher tiga 500 mL
3. Pendingin bola
4. Pengaduk merkuri
5. Termometer alkohol 110
6. Motor listrik
Arah aliran air pendingin
C. Cara Kerja
Percobaan dilaksanakan dengan prosedur sebagai berikut:
1. Proses hidrolisis protopektin menjadi senyawa pektat
a. Hidupkan waterbath dan thermostat 30 menit sebelum praktikum serta diatur
pada suhu ±65 .
b. Buat larutan HCl dengan pH 1 sebanyak 250 mL dengan cara mengambil
2,10 mL larutan HCl pekat 37% dan masukkan ke dalam gelas beker 600 mL
yang berisi ±50 mL aquadest, lalu tambahkan aquadest hingga volume
larutan 250 mL.
c. Rangkai alat percobaan seperti pada gambar 1.
d. Pisahkan larutah HCl tersebut ke dalam tiga buah gelas beker 250 mL dengan
volume yang sama banyak.
e. Masukkan larutan HCl yang terdapat pada salah satu gelas beker tersebut ke
dalam labu leher tiga 500 mL.
f. Hidupkan motor pengaduk dan alirkan air melalui pendingin bola.
g. Panaskan larutan hingga suhunya sekitar 70 .
h. Timbang serbuk albedo jeruk bali sebanyak 10 gram dengan Petri dish
menggunakan neraca analitis digital.
i. Masukkan serbuk albedo jeruk bali yang telah ditimbang ke dalam salah satu
gelas beker yang berisi larutan HCl tersebut. Aduk hingga terbentuk slurry.
j. Masukkan slurry tersebut dengan bantuan corong gelas setelah suhu larutan
dalam labu leher tiga 500 mL mencapai 70 .
k. Bilas sisa slurry pada gelas beker 250 mL tersebut dengan larutan HCl yang
tersisa.
l. Lakukan hidrolisis selama 1 jam pada suhu ±60 .
m. Matikan dan lepaskan semua rangkaian alat setelah hidrolisis selesai dengan
tetap nyalakan pendingin bola serta catat suhu akhir hidrolisis.
n. Dinginkan larutan dalam labu leher tiga 500 mL sampai suhunya ±40
dengan merendamnya dalam baskom berisi air kran.
o. Saring larutan dari labu leher tiga 500 mL dengan menggunakan kain saring
yang dipasang pada corong gelas dan tampung filtrat dalam erlenmeyer 500
mL.
a. Masukkan 5 krus porselen kosong dan tutup ke dalam oven selama 10 menit,
kemudian masukkan 5 krus porselen kosong dan tutup tersebut ke dalam
eksikator selama 10 menit.
b. Siapkan 5 buah gelas beker 250 mL dan masukkan 25 mL filtrat dengan pipet
volume 25 mL ke dalam setiap gelas beker 250 mL untuk gelas beker I, II,
III, IV dan V.
c. Masukkan 25 mL aseton ke dalam gelas beker I, 15 mL aseton ke dalam
gelas beker II, 25 mL isopropil alkohol ke dalam gelas beker III, 25 mL
etanol 96% ke dalam gelas beker IV, dan 25 mL HCl 0,05 N ke dalam gelas
beker V.
d. Aduk larutan dalam masing-masing gelas beker 250 mL, selama kurang lebih
5 menit dan biarkannya selama kurang lebih 15 menit.
e. Timbang berat kering 5 kertas saring yang akan digunakan untuk menyaring
pektin dan 5 krus porselen kosong yang akan digunakan untuk penentuan
berat kering pektin.
f. Pisahkan pektin yang terbentuk pada gelas beker I, II, III, IV, dan V dari
cairan dengan menyaringnya menggunakan kertas saring yang dipasang pada
corong gelas dan tampung filtratnya dalam erlenmeyer 125 mL.
g. Masukkan kertas saring dengan pektin yang tertahan ke dalam krus porselen
(masing-masing krus porselen diisi dengan satu kertas saring).
3. Penentuan berat kering pektin
a. Masukkan 5 krus porselen yang berisi kertas saring dan pektin ke dalam oven
dan lakukan pengovenan selama 1 jam, lalu masukkan 5 krus porselen
tersebut ke dalam eksikator selama 10 menit kemudian timbang beratnya
menggunakan neraca analitis digital dan catat hasilnya.
b. Lakukan pengovenan kedua selama 2 jam, lalu masukkan krus porselen berisi
kertas saring tersebut ke dalam eksikator selama 10 menit, kemudian timbang
beratnya menggunakan neraca analitis digital dan catat hasilnya.
c. Ulangi langkah 2 di atas sekali lagi.
d. Cuci krus porselen dan letakkan di tempat pektin.
D. Analisis Data
• Penentuan volume HCl pekat yang harus diencerkan dapat menggunakan
persamaan sebagai berikut :
a =
Keterangan :
a = volume HCl pekat yang harus diencerkan, mL
M = molaritas atau konsentrasi hasil pengenceran, M
V = volume hasil pengenceran, mL
k = kadar HCl pekat, % ρ = densitas HCl pekat, g/mL BM = berat molekul HCl
• Penentuan berat kering pektin yang terambil
= –
Massa krus + kertas saring + pektin diambil dari data terakhir penimbangan
(setelah pengovenan ketiga)
• Penentuan total pektin yang terdapat dalam cairan hidrolisis
Massa total pektin (gram) =
Keterangan :
V1 = volume total filtrat cairan hidrolisis, mL
V2 = volume filtrat dalam sampel, mL
X3 = massa pektin dalam sampel, gram
• Perhitungan Percent Recovery
% Recovery =
IV. HASIL DAN PEMBAHASAN
Hal - hal yang perlu dibahas adalah perlakuan – perlakuan dalam percobaan (tujuan,
langkah - langkah, fungsi bahan, asumsi yang diambil, faktor yang mempengaruhi, hal
menyimpang yang terjadi, dan lain – lain) dan juga pengetahuan umum tentang pektin.
Selain itu yang penting adalah berdasarkan hasil analisa data, dibahas pengaruh jenis
bahan kimia penggumpal terhadap % recovery pektin. Pembahasan perlu difokuskan
pada penjelasan ilmiah terhadap fenomena yang teramati dalam percobaan ini, khususnya
pada proses penggumpalan pektin (pelajari pula mekanisme pemecahan dispersi dan efek
polaritas molekul terhadap keberhasilan usaha pemecahan dispersi tersebut).
V. KESIMPULAN
Kesimpulan menjadi poin akhir dari pembahasan hasil percobaan serta menjawab tujuan
percobaan.
... (2)
... (3)
VI. DAFTAR PUSTAKA
Walter, Reginald H, 1991, “The Chemistry and Technology of Pectin”, pp. 2 – 5, 68,
Academic Press, Inc., California.
Nagodawithana, Tilak, 1993, “Enzymes in Food Processing”, pp. 363 - 365, Academic
Press, Inc., California.
VII. LAMPIRAN
A. Identifikasi Hazard Proses dan Chemical
Mengidentifikasi tingkat hazard suatu bahan kimia yang digunakan dalam
praktikum ini sesuai MSDS dan mengidentifikasi potensi bahaya dari setiap proses
yang dilakukan.
B. Penggunaan Alat Perlindungan Diri
Masker, jas laboratorium, sarung tangan, goggle, sepatu tertutup.
C. Manajemen Limbah
Menjelaskan tentang cara penanganan dan pembuangannya limbah-limbah
yang dihasilkan pada praktikum pemungutan pektin ini. Beberapa contoh limbah hasil
praktikum ini adalah limbah larutan aseton, isopropil alkohol, sisa HCl, etanol 96%
dan pektin.
D. Data Percobaan
LAPORAN SEMENTARA PRAKTIKUM PROSES
Volume cairan hidrolisis awal : mL pH larutan hidrolisis :Suhu hidrolisis : ºC
Asisten Jaga Yogyakarta,
Praktikan 1.
ANALISIS MINYAK NABATI
(D)
I. TUJUAN PERCOBAAN
Percobaan ini bertujuan untuk menentukan bilangan asam dan bilangan penyabunan minyak nabati.
II. DASAR TEORI
Minyak dan lemak merupakan salah satu golongan lipid, terdiri dari trigliserida campuran yang berupa ester dari gliserol dan asam lemak rantai panjang. Kedua senyawa ini bersifat non-volatil, tidak larut dalam air, tetapi dapat larut dalam pelarut organik, seperti alkohol, eter, dan hidrokarbon. Trigliserida dapat berwujud padat atau cair pada suhu kamar. Kondisi ini tergantung dari komposisi asam lemak yang ada di dalamnya.
Pada umumnya, minyak nabati mengandung asam lemak tidak jenuh yang memiliki titik cair yang rendah sehingga minyak nabati berbentuk cair pada suhu kamar. Sebaliknya, lemak hewani berbentuk padat pada suhu kamar dengan adanya kandungan asam lemak jenuh (asam palmilat dan stearat) yang memiliki titik cair lebih tinggi (Ketaren, 1986).
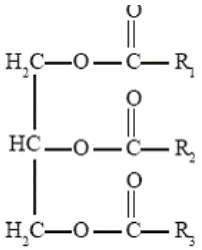
Dari rumus bangunnya, lemak atau minyak dapat dipandang sebagai hasil kondensasi satu molekul gliserol (gliserin) dengan 3 molekul asam lemak.
Gambar 1. Rumus Bangun Lemak atau Minyak
Zat warna yang terkandung dalam minyak dapat berupa zat warna alamiah
(misalnya α dan β karoten, xantofil, klorofil, dan anthosyanin) maupun zat warna hasil degradasi zat warna alamiah.
Sifat fisis lainnya adalah kemampuan minyak atau lemak menimbulkan bau amis yang mirip bau tidak sedap pada ikan (fishy flavor) yang disebabkan interaksi antara trimetilamin oksida dengan ikatan rangkap dari lemak tidak jenuh. Minyak dan lemak tidak larut dalam air, sedikit larut dalam alkohol. Namun dalam pelarut non-polar (etil eter, karbon disulfida, dan pelarut halogen), minyak dan lemak akan larut sempurna.
b. Sifat Kimia
Senyawa ini memiliki sifat mudah dihidrolisis menjadi asam lemak bebas dan gliserol, mudah membentuk sabun dengan penambahan basa dan mudah dihidrogenasi oleh hidrogen murni dengan nikel sebagai katalis membentuk asam lemak jenuh (Ketaren, 1986). Minyak yang mengandung asam lemak sangat tidak jenuh mudah dioksidasi secara spontan oleh oksigen pada suhu ruang. Reaksi oksidasi akan mengakibatkan munculnya bau tengik.
Asam-asam lemak penyusun minyak nabati mempunyai rantai hidrokarbon yang panjang dan tak bercabang, ada yang tidak mengandung ikatan rangkap (asam lemak jenuh), misalnya asam palmitat dan stearat. Ada pula yang mengandung ikatan rangkap (asam lemak tidak jenuh), misalnya asam oleat dan linoleat. Semakin panjang rantai atom C, makin tinggi titik lebur dan titik didihnya.
Pengujian mutu minyak digunakan untuk menentukan penentuan bilangan asam dan bilangan penyabunan.
1. Bilangan asam atau angka asam adalah bilangan yang menunjukkan jumlah miligram KOH atau NaOH yang dibutuhkkan untuk menitrasi kandungan asam lemak bebas dalam 1 gram minyak. Yang dimaksud dengan asam lemak bebas adalah asam lemak yang tidak terester dengan gliserol. Bilangan asam atau angka asam ini menunjukkan derajat ketengikan (rancidity) dari minyak.
III. METODE PERCOBAAN
A. Bahan
Bahan yang digunakan dalam percobaan ini adalah sebagai berikut : 1. Minyak goreng
2. Larutan etanol 96 % 3. Larutan HCl 1 N 4. Larutan NaOH 0,1 N 5. KOH pelet
6. Indikator phenolphtalein 7. Aquadest
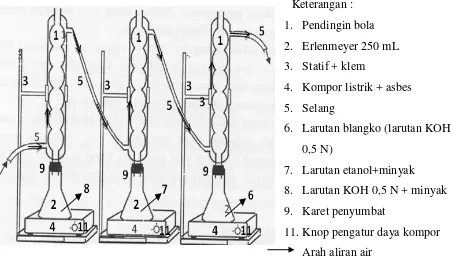
B. Rangkaian Alat Percobaan
Keterangan : 1. Pendingin bola 2. Erlenmeyer 250 mL 3. Statif + klem
4. Kompor listrik + asbes 5. Selang
6. Larutan blangko (larutan KOH 0,5 N)
7. Larutan etanol+minyak 8. Larutan KOH 0,5 N + minyak 9. Karet penyumbat
11.Knop pengatur daya kompor Arah aliran air
Gambar 2. Rangkaian Alat Penentuan Bilangan Asam dan Bilangan Penyabunan
C. Cara Kerja
1. Standardisasi larutan NaOH 0,1 N dengan larutan HCl 0,1 N
warna dari ungu menjadi bening. Volume HCl yang digunakan untuk titrasi dicatat, kemudian tahap ini diulangi dua kali lagi.
2. Penentuan bilangan asam
a. Pembuatan larutan etanol netral
Ambil 120 mL larutan etanol. Tambahkan 3 tetes indikator phenolphtalein. Lalu titrasi larutan dengan larutan NaOH 0,1 N menggunakan pipet tetes hingga titik ekivalen, yaitu saat tetesan NaOH 0,1 N berwarna merah muda. b. Pelarutan minyak ke dalam etanol netral
Lima gram (5 g) minyak ditimbang dalam erlenmeyer 250 mL. Setelah itu, tambahkan 50 mL larutan etanol netral dan 3 tetes indikator
phenophtalein. Rangkai alat seperti gambar 2, kemudian alirkan air pendingin dan nyalakan kompor selama 15 menit terhitung sejak mendidih. Matikan kompor listrik dan dinginkan larutan.
c. Titrasi dengan NaOH 0,1 N atau KOH 0,1 N
Seluruh isi erlenmeyer dititrasi dengan larutan NaOH 0,1 N sampai titik ekivalen tercapai, yaitu terjadi perubahan warna dari putih keruh menjadi merah muda. Catat volume NaOH yang diperlukan. Percobaan diulangi sekali lagi.
3. Penentuan bilangan penyabunan
a. Pembuatan Larutan KOH alkoholis
Ambil 250 mL etanol teknis dengan dituangkan ke dalam gelas beker 500 mL. Selanjutnya, tambahkan 7,5 gram KOH. Aduk campuran hingga KOH terlarut sempurna. Hasilnya adalah larutan KOH alkoholisis 0,5 N. b. Pembuatan larutan sampel
Minyak ditimbang 4 gram di dalam erlenmeyer 250 mL. Tambahkan 50 mL larutan KOH alkoholis, menggunakan pipet volume 25 mL. Tiga tetes indikator phenolphtalein ditambahkan ke dalam masing – masing larutan. Kemudian air pendingin dialirkan dan kompor dinyalakan selama 60 menit terhitung sejak mendidih. Matikan kompor listrik dan dinginkan larutan. c. Pembuatan larutan blangko
Kemudian alirkan air pendingin dan nyalakan kompor selama 60 menit terhitung sejak mendidih. Matikan kompor listrik dan dinginkan larutan. d. Titrasi larutan sampel dan blangko
Masing-masing larutan (larutan sampel dan blangko) dititrasi dengan HCl 1 N sampai titik ekivalen tercapai, yaitu terjadi perubahan dari merah muda menjadi putih keruh. Dicatat volume HCl yang diperlukan untuk titrasi sampel dan larutan blangko. Percobaan diulangi sekali lagi.
D. Analisis Data
a) Standardisasi larutan NaOH 0,1 N dengan larutan HCl 0,1 N
NNaOH =NHCl.����
����� ... (5) Dengan : NNaOH : normalitas larutan NaOH, N
VNaOH : volume larutan NaOH yang dititrasi, mL
NHCl : normalitas larutan HCl, N
b) Penentuan bilangan asam (acid number)
Bilangan asam =
BMNaOH = berat molekul NaOH, gram/mol
W = massa minyak goreng yang ditimbang, gram
c) Penentuan bilangan penyabunan
Dengan : VHCl blangko = volume larutan HCl blangko, mL
VHCl sampel = volume larutan HCl sampel, mL
NHCl = normalitas larutan HCl, N
BMKOH = berat molekul KOH, gram/mol
Berat cuplikan = massa minyak goreng yang ditimbang, gram
Bilangan penyabunan rata – rata =
2
2
1 sampel
sampel +
... (10)
IV. HASIL PERHITUNGAN DAN PEMBAHASAN
Hal-hal yang harus ada pada percobaan: 1. Asumsi-asumsi yang ada percobaan.
2. Hasil dari percobaan dan pembahasannya, kaitkan dengan teori yang ada dan beri penjelasannya mengenai pencapaian tujuan percobaan.
3. Bandingkan kualitas minyak nabati percobaan dengan standar kualitas minyak nabati yang digunakan, bila ada ketidaksesuaian beri penjelasan logis mengapa hal itu bisa terjadi.
V. KESIMPULAN
Berisi kesimpulan-kesimpulan yang diperoleh dari praktikum ini. Kesimpulan dibuat berkaitan dengan tujuan dan berhubungan dengan pembahasan.
VI. DAFTAR PUSTAKA
Griffin, R.C., 1927, “Technical Methods of Analysis”, 2 ed, pp. 309-311, McGraw Hill Book Company, Inc., New York.
Groggins, P.H., 1958,”Unit Processes in Organic Synthesis”, pp. 107-110, Mc Graw Hill Book Compant, Inc., New York.
Ketaren, S., 1986, “Minyak dan Lemak Pangan”, hal 22-23, 61-72, Penerbit Universitas Indonesia, Jakarta.
Kirk, R.E., and Othmer, D.F., 1950, “Encyclopedia of Chemical Technology”, vol 5, pp 817-819, Interscience Encyclopedia, Inc., New York.
VII. LAMPIRAN
A. Identifikasi Hazard Proses dan Bahan Kimia 1. Hazard Proses
Pada percobaan ini digunakan suhu yang tinggi dengan menggunakan kompor listrik sebagai sumber panas. Kompor listrik dan steker harus dijaga agar tidak terkena cairan untuk mencegah bahaya hubungan singkat. Karena bekerja pada suhu yang tinggi, ada potensi bahaya terjadinya luka bakar pada kulit jika menyentuh sumber panas ataupun terkena cairan panas, maka praktikan harus berhati-hati dalam percobaan.
2. Bahan Kimia
a. Kalium Hidroksida
Senyawa ini berwujud padatan, bersifat racun, non-flamable, higroskopis, korosif, iritan, dan non-explosive. Jika mata terpapar, segera basuh dan siram mata dengan air dingin minimal 15 menit secara terus – menerus. Jika kulit terkena senyawa ini, segera siram dengan banyak air minimal 15 menit sambil melepas pakaian dan sepatu yang terkontaminasi. Jika terhirup, korban segera dibawa ke tempat dengan udara yang segar. Jika korban pingsan, segera diberi nafas buatan.
Jika terdapat tumpahan dalam jumlah kecil, gunakan alat yang tepat untuk menempatkan tumpahan ke wadah pembuangan limbah. Jika terdapat tumpahan dalam jumlah besar, jangan menyentuh bahan yang tertumpah tersebut, gunakan semprotan air untuk mengurangi uap, dan menetralisir residu dengan larutan encer asam sulfat. Simpan dalam wadah kering yang di tempat yang sejuk dan berventilasi baik. Jangan menambahkan air ke dalam bahan.
b. Larutan Etanol 96 %
Senyawa ini bersifat irritant, volatil, flammable, non-explosive, dan tidak toxic. Jika mata terpapar, segera siram mata dengan air dingin minimal 15 menit. Jika terkena kulit, segera siram dengan air dan gunakan sabun pada area kulit yang terkena bahan kimia. Jika terhirup, segera bawa korban ke tempat terbuka. Jika korban pingsan, beri korban pernapasan buatan.
api, serap dengan pasir atau bahan yang tidak mudah terbakar lainnya, dan jangan menyentuh bahan yang tertumpah. Simpan pada wadah tertutup rapat dan tersegel di tempat yang sejuk dan berventilasi baik, serta jauhkan dari panas dan sumber api.
c. Natrium hidroksida
Senyawa ini bersifat higroskopis, non-flammable, korosif, iritan, tidak beracun,
non-explosive, dan berupa padatan. Jika mata terpapar, segera basuh dan siram mata dengan banyak air dingin minimal 15 menit. Jika terkena kulit, segera siram dengan air dan lepaskan pakaian yang terkena bahan kimia, cuci kulit dengan sabun desinfektan, lalu oleskan krim anti-bakteri. Jika terhirup, segera bawa korban ke tempat terbuka. Jika korban pingsan, beri napas buatan. Jika tertelan, segera hubungi petugas medis.
Jika terdapat tumpahan dalam jumlah kecil, gunakan alat yang tepat untuk menempatkan tumpahan ke wadah pembuangan limbah dan menetralisir residu dengan larutan encer asam asetat jika perlu. Jika terdapat tumpahan dalam jumlah besar, gunakan semprotan air untuk mengurangi uap dan menetralisir residu dengan larutan encer asam asetat. Simpan pada wadah kering tertutup rapat di tempat yang sejuk dan berventilasi baik. Jauhkan dari oksidator, reduktor, logam, asam, alkali, dan tempat lembab.
d. Asam hidroklorida
Senyawa ini bersifat korosif, iritan, non-flamable, non-explosive, non-toxic, dan berwujud cairan. Jika mata terpapar, segera basuh dan siram mata dengan banyak air dingin minimal 15 menit. Jika terkena kulit, segera siram dengan banyak air pada bagian kulit yang terkena minimal 15 menit, dan gunakan sabun desinfektan dan krim anti-bakteri. Jika terhirup, segera bawa ke tempat terbuka dan diberi nafas buatan jika pingsan. Jika tertelan, segera hubungi petugas medis.
Jika terdapat tumpahan dalam jumlah kecil, encerkan dengan air kemudian dipel, atau diserap dengan bahan kering inert dan tempatkan dalam wadah pembuangan limbah, serta menetralisir residu dengan larutan natrium karbonat jika perlu. Jika terdapat tumpahan dalam jumlah besar, serap dengan pasir atau bahan tidak mudah terbakar lainnya, gunakan semprotan air untuk mengurangi uap, dan menetralisir residu dengan larutan encer natrium karbonat.
Bahan kimia ini tidak berbahaya bagi manusia dan tidak perlu penanganan khusus untuk penyimpanan dan pertolongan jika terpapar.
f. Phenolphtalein
Senyawa ini bersifat tidak beracun, flammable, irritant, explosive, non-corrosive, tidak berwarna, dan reaktif dengan oksidator. Jika mata terpapar, segera basuh dan siram mata dengan banyak air dingin minimal 15 menit. Jika terkena kulit, segera siram dengan banyak air minimal 15 menit dan gunakan sabun serta krim anti-bakteri. Jika terhirup, segera bawa korban ke tempat terbuka dan beri pernapasan buatan jika pingsan. Lepaskan aksesoris yang sifatnya menekan seperti ikat pinggang dan berhati - hati pada saat memberi napas buatan supaya tidak ikut terpapar bahan kimia beracun ini. Segera hubungi petugas medis jika keadaan semakin parah.
Jika terdapat tumpahan dalam jumlah kecil, encerkan dengan air kemudian dipel, atau diserap dengan bahan kering inert, dan ditempatkan dalam wadah pembuangan limbah. Jika terdapat tumpahan dalam jumlah besar, karena sifat bahan mudah terbakar maka jauhkan dari panas dan sumber api. Simpan dalam wadah tertutup rapat di tempat yang sejuk dan berventilasi baik.
g. Minyak nabati (minyak goreng)
Minyak ini bersifat flammable. Jika berkontak dengan kulit, cuci dengan air dan gunakan sabun. Jika terhirup, segera bawa korban ke tempat terbuka dengan udara bebas. Jika keadaan semakin parah, hubungi petugas kesehatan.
B. Penggunaan Alat Perlindungan Diri
Alat perlindungan diri yang digunakan dalam percobaan ini adalah :
1. Jas laboratorium lengan panjang untuk melindungi tubuh dari percikan zat berbahaya.
2. Masker untuk melindungi saluran pencernaan dan pernapasan dari bahan volatil dan beracun.
3. Sarung tangan untuk melindungi tangan dari zat yang iritan dan korosif. 4. Sepatu tertutup untuk melindungi kaki dari percikan bahan kimia korosif.
C. Manajemen Limbah
Limbah yang dihasilkan pada percobaan ini adalah : 1. Limbah NaOH.
Masukkan limbah ini ke dalam wadah limbah basa karena larutan ini tergolong basa kuat.
2. Limbah HCl + NaOH.
Masukkan limbah ini ke dalam wadah limbah non-halogen karena larutan ini mengandung NaCl.
3. Limbah KOH alkoholisis.
Masukkan limbah ke wadah limbah basa. 4. Limbah minyak + KOH alkoholisis + HCl.
Limbah ini berasal dari proses penentuan asam lemak total. Masukkan limbah ini ke wadah limbah non-halogen.
D. Data Percobaan
LAPORAN SEMENTARA PRAKTIKUM PROSES
Asisten : Erlina Rosa Evasari / Fildzah Hanifati
Jenis minyak yang dianalisis :
1. Standardisasi larutan NaOH 0,1 N dengan larutan HCl 0,1 N
No. Volume Larutan NaOH, mL Volume Larutan HCl, mL
1. 2. 3.
2. Penentuan bilangan asam
Berat minyak : 1.
2.
Lama pemanasan :
Volume larutan etanol netral dalam larutan :
Volume larutan NaOH untuk titrasi : 1
2. Perubahan warna larutan setelah titrasi : 1. 2.
3. Penentuan bilangan penyabunan
Berat minyak : 1.
2.
Berat KOH :
Lama Pemanasan :
Volume larutan KOH alkoholis dalam larutan : Volume larutan HCl untuk titrasi larutan blangko : 1.
2. Volume larutan HCl untuk titrasi larutan sampel : 1. 2. Perubahan warna larutan blangko setelah titrasi : 1. 2. Perubahan warna larutan sampel setelah titrasi : 1. 2.
Yogyakarta,
Asisten Jaga Praktikan
1 .
DISTILASI CAMPURAN
IMMISCIBLE
(E)
I. TUJUAN PERCOBAAN
Percobaan ini bertujuan untuk:
1. Memahami cara melakukan operasi distilasi untuk pengambilan minyak atsiri dari campuran immiscible dengan konsentrasi rendah.
2. Memahami cara menentukan recovery minyak atsiri dengan proses distilasi yang dilakukan.
II. DASAR TEORI
Proses pemisahan merupakan salah satu inti dari bidang teknik kimia. Pada industri kimia, pemisahan dilakukan pada unit persiapan untuk mendapatkan bahan baku yang dibutuhkan pada unit proses dan juga dilakukan pada unit finishing untuk memurnikan produk hasil reaksi agar produk yang didapatkan memiliki nilai ekonomis yang lebih tinggi.
Proses pemisahan terjadi pada campuran. Campuran dapat dipisahkan menjadi campuran homogen dan campuran heterogen. Campuran homogen yakni pencampuran antara dua bahan atau lebih yang berfase sama dan pada akhir pencampuran tidak terlihat batas antar bahan karena molekul-molekulnya yang bercampur, seperti garam yang larut dalam airCampuran heterogen adalah pencampuran dua bahan atau lebih yang memiliki beda fase dan terlihat jelas batas fase antar kedua bahan. Proses pemisahan untuk campuran heterogen biasanya didasarkan pada perbedaan ukuran partikel antar fase atau atas perbedaan densitas (Purwono dkk, 2005).
Pemungutan minyak atsiri pada campuran immiscible ini biasa digunakan untuk memungut minyak atsiri dari campuran immiscible dengan konsentrasi minyak rendah. Dengan melakukan proses distilasi ini, konsentrasi minyak akan semakin berkurang pada campuran immiscible-nya. Setelah konsentrasi minyakyang diperoleh dari hasil distilasi cukup tinggi, maka proses pemisahan dapat dilanjutkan dengan melakukan proses dekantasi yang lebih sederhana.
Distilasi merupakan suatu cara yang digunakan untuk memisahkan dua atau lebih komponen cairan berdasar perbedaan titik didihnya. Uap yang dibentuk selama distilasi makin lama makin jenuh dan makin banyak mengandung komponen yang lebih mudah menguap (yaitu komponen yang titik didihnya rendah) (Perry, 1999). Sehingga komponen yang diuapkan tersebut diembunkan, dan campuran dapat dipisahkan.
Campuran immiscible merupakan campuran antara dua atau lebih cairan yang tidak saling larut akibat sifat molekul yang berbeda (misalnya: kepolaran bahan), seperti minyak yang bersifat non polar tidak bisa larut dalam air yang bersifat polar. Karena minyak dan air bersifat immiscible, maka kedua zat tersebut akan mendidih bersama pada suhu campuran yang lebih rendah dari titik didih solvennya yakni air sehingga minyak pada hasil uap akan lebih banyak karena titik didih minyak di bawah titik didih air. Hal ini sangat menguntungkan karena suhu opersai menjadi rendah sehingga kerusakan alat dapat diminimalisir.
Untuk suatu keadaan, dimana bahan volatil (A) yang tidak larut dalam air (immiscible) maka komponen A dapat dipisahkan dengan operasi distilasi kukus. Cairan akan mendidih jika tekanan uap total dari cairan sama dengan tekanan sistem. Berdasarkan keadaan ini, maka suhu didih cairan dapat diturunkan dengan penurunan tekanan sistem. Selain itu untuk menurunkan titik didih cairan dapat dilakukan dengan menambahkan uap inert ke dalam sistem. Uap inert tersebut akan memiliki kontribusi pada tekanan uap, sehingga cairan akan mendidih pada tekanan yang lebih rendah. Bahan inert harus mudah dipisahkan dari distilat dan tidak bereaksi dengan komponen-komponen yang diambil sebagai produk. Uap bahan inert yang ditambahkan ke dalam sistem biasanya berupa kukus (steam), sehingga distilasi ini sering disebut sebagai distilasi kukus.
komponen A lebih rendah dari titik didih komponen A dan titik didih air. Oleh karena itu, dengan distilasi kukus ini titik didih campuran menjadi lebih rendah. Rasio jumlah molekul kukus dan komponen volatil yang terdistilasi dalam uap dapat ditentukan berdasarkan rasio tekanan parsialnya, yang dapat dituliskan sebagai berikut:
PA
Contoh distilasi di industri ialah pemisahan minyak mentah ke dalam fraksi-fraksi, yang memiliki titik didih tertentu dan berbeda-beda. Hal ini karena jenis komponen hidrokarbon begitu banyak, sehingga memiliki titik didih yang beragam. Secara sederhana prosesnya, minyak mentah dipanaskan dalam boiler padasuhu tinggi (± 600 °C), kemudian minyak dialirkan ke menara distilasi, dalam menara distilasi uap minyak mentah bergerak keatas, dalam pergerakannya, uap minyak mentah menjadi dingin karena terkondensasi dalam bentuk cairan, cairan tersebut diperoleh dalam suhu tertentu ini disebut fraksi. Fraksi yang memiliki titik didih tinggi akan terkondensasi bagian bawah menara, dan yang memiliki titik didih rendah terkondensasi di bagian atas.
Dekantasi merupakan pemisahan fluida immiscible berdasarkan perbedaan densitasnya. Semakin besar perbedaan antar densitas antar fluida tersebut maka pemisahan fluida akan semakin mudah. Proses dekantasi biasa dilakukan untuk memisahkan campuran dengan kadar zat yang akan dipisahkan telah cukup tinggi. Hasil pada akhir proses akan diperoleh light product dan heavy product. Seberapa baik derajat pemisahan atau kemurnian produk yang diinginkan tergantung pada optimasi variabel prosesnya.
Contoh dekantasi dalam dunia industri seperti :
1. Pemisahan minyak atsiri yang bercampur dengan air di industri parfum. 2. Pemisahan krim dengan susu pada pabrik susu skim.