PENGARUH EKSTRAK BIJI KAKAO (Theobroma cacao) TERHADAP HEPATOTOKSISITAS PARASETAMOL PADA MENCIT (Mus musculus)
SKRIPSI
Untuk Memenuhi Persyaratan Memperoleh Gelar Sarjana Kedokteran
YESSI OKTIARI G0006026
FAKULTAS KEDOKTERAN UNIVERSITAS SEBELAS MARET
ii
PENGESAHAN SKRIPSI
Skripsi dengan judul : Pengaruh Ekstrak Biji Kakao (Theobroma cacao) terhadap Hepatotoksisitas Parasetamol pada Mencit (Mus musculus)
Yessi Oktiari, NIM/ Semester : G0006026/ VIII, Tahun: 2010 Telah diuji dan sudah disahkan di hadapan Dewan Penguji Skripsi
Fakultas Kedokteran Universitas Sebelas Maret Pada Hari Senin, Tanggal 24 Mei Tahun 2010
Pembimbing Utama
Nama : S. Bambang W., dr., MPd., PHK
NIP : 19481231 197609 1 001 ……… Pembimbing Pendamping
Nama : Lilik Wijayanti, dr., M. Kes
NIP : 19690305 199802 2 001 .………... Penguji Utama
Nama : E. Listyaningsih S., dr., M. Kes
NIP : 19640810 199802 2 001 ………
Anggota Penguji
Nama : Drs. Bagus Wicaksono, M. Si
NIP : 19620901 198903 1 003 ………
Surakarta, ………2010
Ketua Tim Skripsi
Sri Wahjono, dr., M.Kes., DAFK NIP:19450824 197310 1 001
Dekan FK UNS
iii
PERNYATAAN
Dengan ini menyatakan bahwa dalam skripsi ini tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu Perguruan Tinggi dan sepanjang pengetahuan saya juga tidak terdapat karya atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah dan disebutkan dalam daftar pustaka.
Surakarta, Mei 2010
iv ABSTRAK
Yessi Oktiari, G0006026, 2010. Pengaruh Ekstrak Biji Kakao (Theobroma
cacao) terhadap Hepatotoksisitas Parasetamol pada Mencit (Mus musculus).
Skripsi, Fakultas Kedokteran, Universitas Sebelas Maret, Surakarta.
Tujuan Penelitian: Penelitian ini bertujuan untuk mengetahui pengaruh pemberian ekstrak biji kakao (Theobroma cacao) dalam mengurangi kerusakan histologis sel hepar mencit (Mus musculus) akibat pemberian parasetamol.
Metode Penelitian: Penelitian ini bersifat eksperimental laboratorik dengan post
test only controlled group design. Sampel berupa mencit (Mus musculus) jantan,
galur Swiss webster berumur 2-3 bulan dengan berat badan + 20 gr. Sampel sebanyak 40 ekor dibagi dalam 4 kelompok, masing-masing kelompok terdiri dari 10 ekor mencit. Teknik sampling yang dipakai adalah purposive sampling. Kelompok kontrol (K), mencit diberi aquades 0,2 ml peroral perhari selama 17 hari. Kelompok perlakuan 1 (P1) mencit diberi aquades 0,2 ml peroral perhari selama 17 hari dan parasetamol dosis 0,1 ml/ 20grBB mencit pada hari ke 15, 16, dan 17. Kelompok perlakuan 2 (P2), mencit diberi ekstrak biji kakao dosis 0,2 ml/ 20grBB dan parasetamol dosis 0,1 ml/ 20grBB mencit pada hari ke 15, 16, dan 17. Kelompok perlakuan 3 (P3) mencit diberi ekstrak biji kakao dosis 0,4 ml/ 20grBB dan parasetamol dosis 0,1 ml/ 20grBB mencit pada hari ke 15, 16, dan 17. Hari ke-18 mencitdikorbankan kemudian hepar mencit dibuat preparat dengan metode blok parafin dan pengecatan Hematoksilin Eosin (HE). Gambaran histologis sel hepar mencit diamati dan dinilai berdasarkan kerusakan histologis berupa inti
pyknosis, karyorrhexis, dan karyolysis, dimana dari setiap jenis kerusakan ini,
masing-masing diberi skor 1. Data dianalisis dengan menggunakan uji One-Way
ANOVA (α = 0,05) dan dilanjutkan dengan uji Post Hoc Multiple Comparisons
(LSD)(α = 0,05).
Hasil penelitian. Hasil uji One-Way ANOVA menunjukkan adanya perbedaan yang bermakna antara keempat kelompok perlakuan. Hasil uji Post Hoc
menunjukkan adanya perbedaan yang bermakna antara K-P1, K-P2, P2, P1-P3, dan menunjukkan perbedaan yang tidak bermakna antara kelompok K-P3 dan P2-P3.
Simpulan Penelitian: Ekstrak biji kakao (Theobroma cacao) dapat mengurangi kerusakan histologis sel hepar mencit (Mus musculus) akibat pemberian parasetamol.
v ABSTRACT
Yessi Oktiari, G0006026, 2010. The Influence of Cacao Bean Extract
(Theobroma cacao) to Hepatotoxicity of Paracetamol on Mice (Mus musculus).
Paper, Faculty of Medicine, Sebelas Maret University.
Objective: Cacao bean has flavonoid, an antioxidant that can reduces oxidant from a proccess of metabolism of paracetamol. This metabolism creates NAPQI. This paper will explain the effect of cacao bean extract (Theobroma cacao) to reduce histologic impairment of mice’s (Mus musculus) liver that has been toxicated by paracetamol.
Methods: This was laboratory experimental research with post test only
controlled group design. Sample in this research were fourty male mices (Mus
musculus), Swiss webster type, 2-3 months old age and + 20 gr of each weight.
Samples divided into 4 groups, each group has ten mices. Mice for control group (K) will not be given paracetamol and cacao bean extract, it was only given aquades 0,2 ml/20 gr weight of mice for 17 days in a row. The first treatment group (P1) will be given paracetamol with dose 0,1 ml/20 gr weight of mice on the day 15, 16 and 17. The second treatment group (P2) will be given cacao bean extract dose I which consist of 0,02 ml/20 gr weight of mice for 17 days in a row and also paracetamol dose 0,1 ml/ 20 gr weight of mice on day 15, 16 and 17. The third treatment group (P3) will be given extract dose II which consist of 0.04 ml/20 gr weight of mice for 17 days in a row and also paracetamol dose 0,1 ml/ 20 gr weight of mice on day 15, 16 and 17. Finally on day 18th, mices were sacrificed with neck dislocation. After that, we made preparate from the liver that painted by Hematoxillin Eosin (HE).
Result: Result of One-Way ANOVA showed that there was a significant difference between 4 groups. Result of LSD method showed that there was a significant difference between K-P1, K-P2, K-P3, and P1-P2 groups, but there was not the significant difference between group K-P3 and P2-P3.
Conclusion: Cacao bean (Theobroma cacao) extract can reduces histologic impairment of mice’s (Mus musculus) liver that has been toxicated by paracetamol.
vi PRAKATA
Segala puji bagi Tuhan Yesus Kristus, yang selalu melimpahkan berkat dan anugerahNya, sehingga penulis dapat menyelesaikan skripsi yang berjudul “Pengaruh Ekstrak Biji Kakao (Theobroma cacao) terhadap Hepatotoksisitas Parasetamol pada Mencit (Mus musculus)”.
Dalam penyusunan skripsi ini, penulis banyak menemui kendala dan hambatan, namun berkat bimbingan, arahan dan bantuan berbagai pihak, penulis dapat menyelesaikannya. Untuk itu perkenankanlah dengan setulus hati penulis menyampaikan rasa terima kasih kepada:
1. Prof. Dr. A.A. Subijanto, dr., M.S, selaku Dekan Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
2. Sri Wahjono, dr., M.Kes, selaku Ketua Tim Skripsi Universitas Sebelas Maret Surakarta.
3. S. Bambang W., dr., MPd., PHK, selaku Pembimbing I yang telah banyak memberikan bimbingan, masukan, saran dan arahan dalam penelitian ini. 4. Lilik Wijayanti, dr., M.Kes, selaku Pembimbing II yang telah banyak
memberikan bimbingan, masukan, saran dan arahan dalam penelitian ini. 5. E. Listyaningsih, dr., M.Kes, selaku Penguji I yang telah berkenan menguji
serta memberikan saran dan masukan dalam penelitian ini.
6. Drs. Bagus Wicaksono, M. Si, selaku Penguji II yang telah berkenan menguji serta memberikan saran dan masukan dalam penelitian ini.
7. Seluruh staf bagian skripsi dan staf Laboratorium Histologi Fakultas Kedokteran Universitas Sebelas Maret yang telah banyak membantu dalam penelitian ini.
8. Bapak dan mama tercinta, mas Ian, mbak Yenni, mbak Debbie, atas doa, saran dan motivasi di setiap waktu pada penulis.
9. Keluarga besar PMPA Vagus dan sahabat-sahabat semua atas setiap petualangannya.
10. Semua pihak yang telah membantu dalam penyusunan skripsi ini.
Penulis berharap semoga skripsi ini dapat bermanfaat bagi yang berkepentingan khususnya dan bagi pembaca umumnya.
Surakarta, Mei 2010
vii BAB II. LANDASAN TEORI... A. Tinjauan Pustaka... 1. Kakao... a. Taksonomi... b. Asal Usul Tanaman Kakao... c. Kandungan Kimia... d. Mikroskopis Kerusakan Hepar Setelah Pemberian
Parasetamol... 4. Mekanisme kerusakan hepar oleh parasetamol dan
viii
G. Definisi Operasional Variabel Penelitian... 1. Variabel Bebas... 2. Variabel Terikat... 3. Variabel Luar... H. Alat dan Bahan Penelitian... 1. Alat... 2. Bahan... I. Cara Kerja... 1. Dosis dan Pengenceran Ekstrak Biji Kakao... 2. Dosis dan Pengenceran Parasetamol... 3. Persiapan Mencit... 4. Pengelompokan Subyek... 5. Pengukuran Hasil... J. Teknik Analisis Data Statistik... BAB IV. HASIL PENELITIAN...
ix
DAFTAR TABEL
Tabel 1. Rata-rata Skor Kerusakan Sel Hepar Mencit yang Diinduksi Parasetamol pada Masing-masing Kelompok
Tabel 2. Ringkasan Hasil Uji LSD
Tabel 3. Jumlah Inti Sel Hepar yang Mengalami Piknosis, Karyoreksis, Karyolisis dari Tiap 100 sel di Zona Sentrolobuler Beserta Skornya dengan Perbesaran 1000 Kali.
Tabel 4. Hasil Tes Normalitas Sebaran Data 4 Kelompok Tabel 5. Sebaran Data Secara Deskriptif
Tabel 6. Hasil Uji Homogeneity of Variances
Tabel 7. Hasil Uji One-Way ANOVA
Tabel 8. Hasil Uji Post Hoc Multiple Comparisons Menggunakan Uji LSD
Multiple Comparisons
Tabel 9. Tabel Konversi Dosis Untuk Manusia dan Hewan
x
DAFTAR GAMBAR
Gambar 1. Kelompok Kontrol dengan Perbesaran 1000x Gambar 2. Kelompok Perlakuan 1 dengan Perbesaran 1000x Gambar 3. Kelompok Perlakuan 2 dengan Perbesaran 1000x Gambar 4. Kelompok Perlakuan 3 dengan Perbesaran 1000x Gambar 5. Mencit yang Digunakan dalam Penelitian Gambar 6. Ekstrak Biji Kakao
xi
DAFTAR LAMPIRAN
Lampiran 1. Tabel 3
Lampiran 2. Tabel 4-Tabel 8
Lampiran 3. Foto Preparat (Fotomikrograf) Lampiran 4. Gambar Alat dan Bahan Penelitian Lampiran 5. Tabel 9
Lampiran 6. Tabel 10
12 BAB I PENDAHULUAN
A. Latar Belakang Masalah
Kakao atau yang juga populer dengan sebutan cokelat dikenal dan digunakan sejak ratusan tahun lalu. Kakao adalah salah satu bahan makanan yang memiliki kandungan flavonoid tertinggi (Keen, 2001). Kandungan flavonoid utamanya adalah epicatechin, proantocyanidin dan catechin. Kandungan flavonoid kakao lebih tinggi dari pada bahan makanan lainnya seperti apel, bawang putih, anggur, yang dikenal mengandung banyak flavonoid (Raventós et al., 2005). Flavonoid berperan sebagai antioksidan karena dapat menangkap radikal bebas (free radical scavengers) dengan melepaskan atom hidrogen dari gugus hidroksilnya. Pemberian atom hidrogen ini akan menyebabkan radikal bebas menjadi stabil sehingga tidak merusak lipida, protein, dan deoxyribonucleic acid (DNA) yang menjadi target kerusakan seluler ( Ide, 2008).
Penelitian membuktikan bahwa kakao memiliki manfaat kardioprotektif melalui pencegahan aktivasi platelet (Rein et al., 2000) dan vasodilatasi koroner (Flammer et al., 2007). Selain itu kakao juga meningkatkan fecal bulk, dan menurunkan rasio kolesterol Low Density
Lipoprotein (LDL)/ High Density Lipoprotein (HDL) (Jenkins et al., 2000).
13
ditemukan dalam kakao bisa mencegah early alcohol-induced liver injury
(McKim et al., 2002). Di Indonesia sendiri penelitian tentang khasiat kakao belum banyak dilakukan. Manfaat kakao sebagai hepatoprotektif juga belum banyak diteliti.
Parasetamol dipilih sebagai penginduksi kerusakan histologi hepar mencit karena parasetamol merupakan salah satu obat yang paling sering digunakan secara overdosis (Gunnell et al., 2000). Parasetamol atau yang dikenal juga sebagai asetaminofen digunakan secara luas sebagai analgesik dan antipiretik yang banyak ditemui di toko-toko obat maupun sebagai obat resep. Walaupun parasetamol relatif aman digunakan pada dosis terapi, overdosis dapat menyebabkan nekrosis sentrilobular dan tubulus proksimalis pada manusia dan hewan coba (Lucas et al., 2000).
Parasetamol diaktifkan oleh enzim sitokrom P450 menjadi bahan metabolit bernama N-acetyl-p-benzoquinon imine (NAPQI) yang reaktif sehingga menekan glutation hepar kemudian berikatan kovalen dengan protein. Ikatan kovalen ini berhubungan dengan toksisitas parasetamol yang mengakibatkan kerusakan hepar (James et al., 2003).
14 B. Perumusan Masalah
Perumusan masalah pada penelitian ini adalah:
Apakah pemberian ekstrak biji kakao (Theobroma cacao) dapat mengurangi kerusakan histologis sel hepar mencit (Mus musculus) akibat pemberian parasetamol?
C. Tujuan Penelitian
Untuk mengetahui pengaruh pemberian ekstrak biji kakao (Theobroma
cacao) dalam mengurangi kerusakan histologis sel hepar mencit (Mus
musculus) akibat pemberian parasetamol.
D. Manfaat Penelitian 1. Manfaat teoritis
Penelitian ini diharapkan dapat dipakai sebagai bahan informasi dan bahan kajian mengenai pengaruh ekstrak biji kakao sebagai hepatoprotektor. 2. Manfaat Aplikatif
15 BAB II
LANDASAN TEORI
A. Tinjauan Pustaka
A. Kakao (Theobroma cacao) a. Taksonomi
Kingdom : Plantae
Divisi : Spermatophyta Anak divisi : Angiospermae Kelas : Dicotyledoneae Anak kelas : Dialypetale Bangsa : Malvales Suku : Sterculiaceae Jenis : Theobroma cacao (Dikutip dari Susanto, 2005)
b. Asal usul Tanaman Kakao
16
Gelembung busa itulah bagian yang paling mereka sukai. Kurang lebih pada tahun 600 M bangsa Maya berpindah ke bagian utara Amerika Selatan dan menemukan tanaman kakao di Yucatan (Ide, 2008).
Pengenalan kakao kepada orang-orang di Eropa terjadi pada tahun 1528. Pada saat itu orang-orang Spanyol membawa pulang beberapa kakao yang sudah mereka olah dan dipersembahkan kepada rajanya, Charles V. Karena rasanya yang sangat lezat, cokelat pun menjadi terkenal di Spanyol sebagai produk makanan dan minuman baru. Pada awal tahun 1550, pengenalan kakao semakin meluas ke seluruh daratan Eropa (Wahyudi dan Rahardjo, 2008).
Bangsa Spanyol juga memperkenalkan kakao di Indonesia, yakni pada tahun 1560, tepatnya di Celebes (sekarang Sulawesi), Minahasa. Penanaman kakao di Jawa baru dimulai sekitar tahun 1880 (Wahyudi dan Rahardjo, 2008).
Pohon kakao merupakan pohon kecil yang indah, dengan tinggi 12-25 kaki, serta bercabang di bagian puncaknya. Batangnya tegak lurus dengan panjang 1,5-2 meter. Kayunya terang dan putih, kulit kayunya tipis, halus, dan kecokelatan. Benihnya banyak, berukuran 2,5 cm, bagian luar berwarna merah kecokelatan, bagian dalam cokelat gelap dan dibungkus dengan lapisan keputih-putihan, manis serta berminyak (Ide, 2008).
17
berjumlah ribuan berupa bunga kecil berwarna merah muda (pink) atau putih yang tumbuh dalam kelompok dan mekar bersamaan di batang dan cabang tua pohon kakao. Tetapi hanya 3-10% yang akan matang menjadi buah (Ide, 2008).
Buahnya berwarna hijau atau kadang merah tua. Bentuknya mirip melon panjang, sering kali kulitnya berubah menjadi keemasan saat matang atau kadang merah berbintik-bintik. Pohon kakao yang sudah dewasa, mencapai tinggi 15-25 kaki, bahkan pohon yang tumbuh liar bisa mencapai 60 kaki atau lebih (Ide, 2008).
Pohon kakao membutuhkan perlindungan dari angin dan memerlukan tempat teduh pada kondisi tertentu. Terutama untuk 2-4 tahun pertama pertumbuhannya (Ide, 2008).
c. Kandungan Kimia
Biji kakao mengandung sekitar 600 komponen kimia dan sekitar 230 dianggap bermanfaat bagi kesehatan. Kebanyakan dari komponen ini berupa polifenol (atau flavonoid) yang mampu bertindak sebagai antioksidan. Biji kakao mengandung jumlah flavonoid alami yang lebih kaya dibanding brokoli atau teh hijau (Ide, 2008).
18
phosporus, riboflavin, rutin, tanin, teobromin, tiamin, dan masih banyak lagi (Ide, 2008).
Benih kakao mengandung lemak, umumnya sebanyak 40%, terdiri dari minyak kakao, mentega kakao, theobromin (0,9-2,35%), thein dalam kadar rendah (0,05-0,37%), serat, abu, dan protein (6-17%). Theobromin bertindak sebagai diuretik. Theobromin dan teofilin, seperti juga kafein ketiganya terkandung dalam kakao dan digunakan dalam pengobatan modern sebagai obat antiasma (Ide, 2008).
Kandungan polifenol dan asam fenolik dalam biji kakao kering yang tidak difermentasi sekitar 14%. Biji kakao mentah mengandung 12-18% flavonoid yang setidaknya 60%nya merupakan oligomer procyanidin dari epicatechin. Seperti dalam teh, polifenol yang dominan dalam kakao merupakan derivat flavan-3-ol (Ide, 2008).
Komponen yang ada dalam biji segar adalah (-)-epicatechin, dimer procyanidin B-2 dan B-5, trimer C-1 dan oligomer yang lebih besar. Flavonoid lainnya adalah gallocatechin, epigallocatechin, epicatechin gallate, quercetin dan glikosida quercetin. Selain itu asam
caffeic, ferulic, dan 4-coumaric juga ditemukan pada biji kakao,
padatan, dan bubuk (Ide, 2008).
19
Penelitian membuktikan bahwa polifenol biji kakao memiliki beberapa aktifitas fisiologi yang bermanfaat misalnya sebagai
oxidative stress-reducing effect pada tikus yang mengalami defisiensi
vitamin E, aktivitas anti-ulcer, dan efek antimutagenik melawan amin heterosiklik Polifenol kakao juga terbukti menurunkan kerentanan oksidasi LDL pada kelinci hiperkolesterolemi (Osakabe et al., 2001). d. Flavonoid Pada Kakao
Flavonoid merupakan salah satu subkelas dari polifenol dan termasuk dalam 7 kelompok utama. Identifikasi tanaman yang mengandung antioksidan telah mendorong berbagai penelitian secara in vitro dan in vivo yang mempelajari tentang flavonoid dan polifenol lain dalam makanan dan minuman, termasuk kakao (Murphy et al., 2003). Flavonoid utama dalam kakao adalah flavan-3-ols, epicatechin, dan catechin (unit monomerik), dan polimerik yaitu proanthocyanidins yang juga disebut dengan procyanidin (Noe et al., 2004).
20
oleh enzim-enzim yang sebagian besar berlokasi dalam hepar dan ginjal. Metabolisme lanjutan tersebut meningkatkan jumlah
O-methylated, O-glucoronidated, dan derivat flavonol O-sulfated dalam
plasma. Konsentrasi metabolitnya dalam plasma mencapai 1-2 µM, sedangkan dimer flavonol hanya mencapai 40nM. Sementara itu, oligomer yang lebih panjang daripada dimer tidak terdeteksi dalam plasma. Hal ini membuktikan bahwa flavonol utama yang berperan dalam kakao adalah komponen monomer dan dimernya. Monomer dan oligomer flavonol yang tidak diabsorbsi di usus kecil kemudian akan dimetabolisme oleh mikroflora kolon dalam usus besar yang menghasilkan berbagai asam fenolik sederhana. Metabolit asam fenolik dapat dideteksi dalam urin 9 jam setelah konsumsi kakao, dan konsentrasi tertinggi dicapai dalam waktu 24-48 jam. Hal ini menunjukkan bahwa flavonol dan metabolitnya diserap baik melalui usus bagian atas maupun bagian bawah (Uribe and Bektash, 2008).
21 B. Struktur Histologis Hepar
Hepar merupakan kelenjar yang terbesar dalam tubuh. Hepar dilapisi oleh kapsul tipis yang bernama Kapsul Glisson dan memiliki jaringan pengikat retikuler serta pembuluh darah di antara parenkimnya. Tipe sel yang mendominasi adalah hepatosit. Sel-sel tersebut tersusun dalam satu atau dua lapisan tebal yang dipisahkan oleh sinusoid hepar. Suplai darah hepar berasal dari vena porta dan arteri hepatik. Hepar juga memiliki tiga sistem drainase yaitu vena hepatik, pembuluh limfa, dan saluran empedu (Paulsen, 2000). 1. Lobulus Hepar
Pembagian lobulus hepar sebagai unit fungsional dibagi menjadi 3 zona: (1) zona I, zona aktif yang sel-selnya paling dekat dengan pembuluh darah, akibatnya zona ini yang pertama kali dipengaruhi oleh perubahan darah yang masuk, (2) zona II, zona intermedia yang sel-selnya memberi respon kedua terhadap darah, (3) zona III, zona pasif aktifitas sel-selnya rendah dan tampak aktif bila kebutuhan meningkat (Leeson et al., 1996).
Lobulus hepar sebagai kesatuan histologis berbentuk prisma poligonal, diameter 1-2 mm, penampang melintang tampak sebagai heksagonal dengan pusatnya vena sentralis dan di sudut-sudut luar lobuli terdapat kanalis porta (Leeson et al., 1996).
2. Parenkim Hepar
22
lebih nukleoli serta terdapat bercak-bercak kromatin. Sitoplasma sel hepar bervariasi dalam penampakan, tergantung dari nutrisi dan status fungsionalnya. Mengandung sejumlah besar ribonukleoprotein, mitokondria, droplet lipid, lisosom, dan peroksisom (Bergman et al., 1996).
3. Sinusoid Hepar
Bagian yang membentuk jaringan intralobuler yang kaya akan susunan pembuluh-pembuuh darah yang saling bertemu satu sama lainnya pada vena sentralis. Menurut tipe kapilernya dibedakan menjadi dua: (1) sinusoid yang lebar dan bervariasi dalam ukuran diameter, dan (2) sinusoid yang dindingnya terdiri atas dua tipe sel yang dapat dibedakan, yaitu sel endotel dan sel Kupffer (Jones, 1993). Sinusoid mengandung sel-sel darah, dan pada neonatus mengandung elemen
hemopoetik. Diantara sinusoid terdapat sebuah celah, disebut celah disse,
memisahkan permukaan hepatosit yang menghadap sinusoid dengan barisan sel endotel (Damjanov, 1996).
d. Mikroskopis Kerusakan Hepar Setelah Pemberian Parasetamol
Hepatitis akut, dengan maupun tanpa kolestasis, merupakan gambaran histologis yang paling umum dari drug-induced liver injury
(DILI) dan obat-obatan seperti parasetamol merupakan penyebab penting
dari gagal ginjal akut (Ramachandran and Kakar, 2009).
Drug-induced liver injury disebabkan oleh dua mekanisme
23
intrinsik menyebabkan kerusakan hepatoselular pada mekanisme yang tergantung pada dosis baik secara langsung oleh obat tersebut maupun melalui metabolitnya. Parasetamol termasuk dalam mekanisme hepatotoksisitas intrinsik ini. Hepatotoksisitas intrinsik bermanifestasi dengan nekrosis hepatoselular dengan sedikit inflamasi, sementara pada hepatotoksisitas idiosinkratik lebih sering terjadi inflamasi (Ramachandran and Kakar, 2009).
Nekrosis zona central (zona 3) merupakan karakteristik asetaminofen dan halotan, serta toksin seperti karbon tetraklorid (Ramachandran and Kakar, 2009).
C. Parasetamol
a. Farmakodinamik
Efek analgesik parasetamol serupa dengan salisilat yaitu menghilangkan atau mengurangi nyeri ringan sampai sedang Parasetamol menurunkan suhu tubuh dengan mekanisme yang diduga juga berdasarkan efek sentral sepert salisilat (Wilmana dan Gunawan, 2007).
24 b. Farmakokinetik
Parasetamol diabsorpsi cepat dan sempurna melalui saluran cerna. Konsentrasi tertinggi dalam plasma dicapai dalam waktu ½ jam dan masa paruh plasma antara 1-3 jam. Obat ini tersebar ke seluruh cairan tubuh. Dalam plasma, 25% parasetamol terikat protein plasma. Parasetamol dimetabolisme oleh enzim mikrosom hati. Sebagian parasetamol (80%) dikonjugasi dengan asam glukoronat dan sebagian kecil lainnya dengan asam sulfat. Selain itu parasetamol juga dapat mengalami hidroksilasi. Metabolit hasil hidroksilasi ini dapat menimbulkan methemoglobinemia dan hemolisis eritrosit. Obat ini diekskresi melalui ginjal, sebagian kecil sebagai parasetamol (3%) dan sebagian besar dalam bentuk terkonjugasi (Wilmana dan Gunawan, 2007).
c. Indikasi
25
aspirin pada pasien dengan hemofilia atau dengan riwayat ulkus peptikum dan juga pada mereka yang mengalami bronkospasme yang dipicu akibat aspirin (Katzung, 2002).
d. Efek Samping
Efek samping yang sering terjadi antara lain reaksi hipersensitivitas dan kelainan darah (Tjay dan Raharja, 2002). Efek merugikan paling serius akibat overdosis asetaminofen akut berupa nekrosis hati yang fatal. Nekrosis tubulus ginjal dan koma hipoglikemik mungkin juga terjadi (Hardman et al., 2008). Hepatotoksisitas dapat terjadi pada pemberian dosis tunggal 10-15 gram (200-250 mg/ kgBB) parasetamol (Wilmana dan Gunawan, 2007). Selain itu overdosis dapat menimbulkan antara lain mual, muntah, dan anoreksia. Penanggulangannya dengan cuci lambung, di samping perlu pemberian zat penawar (asam amino N-asetilsistein atau metionin) sedini mungkin, sebaiknya dalam 8-10 jam setelah intoksikasi. Wanita hamil dapat menggunakan parasetamol dengan aman, juga selama laktasi walaupun mencapai air susu ibu (Tjay dan Raharja, 2002).
D. Mekanisme kerusakan hepar oleh parasetamol dan mekanisme hepatoprotektor ekstrak biji kakao
Hepatotoksisitas tidak terjadi sebagai akibat langsung dari parasetamol, tetapi melalui metabolitnya, yaitu N-acetyl-p-benzoquinone
imine (NAPQI) (Sherlock and Dooley, 2002). Parasetamol dimetabolisme oleh
26
NAPQI oleh aktivitas sitokrom P450 (Wu and Israel, 1998). NAPQI didetoksifikasi oleh glutation (GSH) yang kemudian membentuk konjugasi parasetamol-GSH. Ketika terjadi dosis toksis parasetamol, glutation hepar total menurun hingga 90%. Akibatnya metabolit parasetamol tersebut berikatan kovalen dengan sistein. Ikatan kovalen antara metabolit parasetamol dan protein menyebabkan sel kehilangan fungsi atau aktivitasnya bahkan terjadi kematian sel dan lisis. Target organel sel utamanya adalah mitokondria yang berperan dalam produksi energi serta kontrol ion selular, sehingga terjadi transisi permeabilitas mitokondria. Akibatnya adalah penurunan adenosine triphosphate (ATP), peningkatan Ca2+ yang bersifat oksidan, aktivasi protease dan endonuklease, serta kerusakan rantai DNA (James et al., 2003).
Aktivitas sitokrom P450 serta transisi permeabilitas mitokondria menyebabkan terbentuknya superoksida. Pembentukan superoksida yang meningkat menyebabkan reaksi hidrogen peroksida dan peroksidasi melalu mekanisme tipe Fenton. Pada dosis toksis parasetamol terjadi pembentukan NAPQI yang berlebihan, sementara konsentrasi glutation di sel sentrilobular sangatlah rendah, sehingga glutation peroksidase terhambat (James et al., 2003).
27
28
Nekrosis sel hepatosit terkendali: kondisi psikologis Variabel luar yang tidak dan keadaan awal hepar
29 C. Hipotesis
30 BAB III
METODE PENELITIAN
A. Jenis Penelitian
Penelitian ini merupakan penelitian eksperimental laboratorik.
Peneliti mengadakan perlakuan terhadap sampel yang telah ditentukan yaitu berupa hewan coba di laboratorium.
B. Lokasi Penelitian
Penelitian dilakukan di Laboratorium Histologi Fakultas Kedokteran Universitas Sebelas Maret Surakarta.
C. Subyek Penelitian
Populasi : Mencit (Mus musculus) jantan dengan galur Swiss webster berusia 2-3 bulan dengan berat badan ± 20 gram.
Sampel : Menurut Purawisastra (2001), jumlah sampel yang digunakan berdasarkan rumus Federer yaitu :
(k-1)(n-1) > 15 (4-1)(n-1) > 15 3 ( n-1) > 15
31 Keterangan :
k : Jumlah kelompok
n : Jumlah sampel dalam tiap kelompok
Pada penelitian ini jumlah sampel untuk tiap kelompok ditentukan sebanyak 10 ekor mencit (n > 6), dan jumlah kelompok mencit ada 4 sehingga penelitian ini membutuhkan 40 mencit dari populasi yang ada. Sample didapatkan dari Laboratorium Penelitian dan Pengujian Terpadu (LPPT) Universitas Gajah Mada (UGM), Yogyakarta.
D. Teknik Sampling
Teknik sampling yang dipakai adalah purposive sampling (Murti, 2006).
E. Desain Penelitian
Rancangan penelitian ini adalah The post test only control group
design (Taufiqqurohman, 2003).
KK : (-) O0 KP1: (X 1) O1 KP2: (X 2) O2 KP3 : (X 3) O3 Sampel
Mencit 40 ekor
Bandingkan dengan uji
32 Keterangan :
KK : (-) = Kelompok kontrol tanpa diberi ekstrak biji kakao maupun parasetamol. Pemberian aquades 0,2 ml/ 20grBB mencit perhari selama 17 hari berturut-turut.
KP1: (X1) = Kelompok perlakuan I yang diberi parasetamol tanpa diberi ekstrak biji kakao. Pemberian aquades peroral sebanyak 0,2 ml/ 20grBB mencit perhari selama 17 hari berturut-turut dan pada hari ke-15, 16 dan 17 diberi parasetamol 0,1 ml/ 20grBB mencit perhari.
KP2: (X 2) = Kelompok perlakuan II yang diberi parasetamol dan ekstrak biji kakao dosis I. Pemberian ekstrak biji kakao peroral dosis I 0,2 ml/ 20grBB mencit perhari selama 17 hari berturut-turut, dimana hari ke-15, 16 dan 17 diberikan juga parasetamol dosis 0,1 ml/ 20grBB mencit perhari 1 jam setelah pemberian ekstrak biji kakao.
KP3 : (X 3) = Kelompok perlakuan III yang diberi parasetamol dan ekstrak biji kakao dosis II. Pemberian ekstrak biji kakao dosis II yaitu 0,4 ml/ 20grBB mencit perhari selama 17 hari berturut-turut, dimana hari ke-15, 16 dan 17 diberikan juga parasetamol dosis 0,1 ml/ 20grBB mencit perhari 1 jam setelah pemberian ekstrak biji kakao.
33
O1 = Pengamatan jumlah inti sel hati piknosis, karyoreksis dan karyolisis dari 100 sel di sentrolobuler hepar KP1.
O2 = Pengamatan jumlah inti sel hati piknosis, karyoreksis dan karyolisis dari 100 sel di sentrolobuler hepar KP2.
O3 = Pengamatan jumlah inti sel hati piknosis, karyoreksis dan karyolisis dari 100 sel di sentrolobuler hepar KP3
Pengamatan jumlah inti sel hepar piknosis, karyoreksis dan karyolisis dilakukan pada hari ke-18.
F. Identifikasi Variabel Penelitian 1. Variabel Bebas
Pemberian ekstrak biji kakao. 2. Variabel Terikat
Kerusakan sel hepar mencit. 3. Variabel luar
a. Variabel luar yang dapat dikendalikan
Variasi genetik, jenis kelamin, umur, suhu udara, berat badan, dan jenis makanan mencit semuanya diseragamkan.
34 G. Definisi Operasional Variabel Penelitian
1. Variabel bebas.
a. Pemberian ekstrak biji kakao
Ekstrak biji kakao diberikan secara per oral dengan sonde lambung dalam 2 dosis.
Dosis I: 1,12 mg/ 20grBB mencit/ hari yang diencerkan hingga 0,2 cc diberikan pada mencit KP2.
Dosis II: 2,24 mg/ 20grBB mencit/ hari yang diencerkan hingga 0,4 cc diberikan pada mencit KP3.
Pada kelompok perlakuan ketiga diberikan dosis sebesar dua kali lipat dosis awal untuk melihat adanya perbedaan pengaruh ekstrak biji kakao dalam mengurangi kerusakan hepar akibat parasetamol pada dosis yang lebih besar.
35
simplisia tidak mudah rusak. Cara pengeringan yang dilakukan adalah pengeringan alamiah dengan dipanaskan dengan sinar matahari selama dua hari. Setelah hampir kering kemudian digunakan oven untuk mendapatkan simplisian yang lebih kering, dengan suhu 60o C selama 30 menit. Simplisia yang sudah kering kemudian diblender, sehingga didapatkan serbuk simplisia dan diayak dengan pengayak nomer 25 supaya didapatkan serbuk yang sangat halus sebanyak 100 gram.
Setelah diperoleh serbuk simplisia dilanjutkan dengan proses ekstraksi dengan metode maserasi. Pelarut yang digunakan adalah etanol. Serbuk simplisia direndam dalam pelarut selama tiga hari pada temperatur kamar dan terlindung dari cahaya matahari. Pelarut harus diganti setiap hari. Setelah perendaman selesai dilanjutkan dengan pengeringan dengan oven sampai benar-benar kering.
Skala pengukuran variabel ini adalah ordinal. 2. Variabel terikat :
a. Kerusakan sel hepar
Kerusakan sel hepar adalah gambaran mikroskopis sel hepar mencit yang dipapar parasetamol setelah diberi ekstrak biji kakao. Adapun tanda-tanda kerusakan sel :
36
b. Sel yang mengalami karyorrhexis inti mengalami fragmentasi atau hancur dengan meninggalkan pecahan-pecahan zat kromatin yang tersebar di dalam sel.
c. Sel yang mengalami karyolisis yaitu kromatin basofil menjadi pucat, inti sel kehilangan kemampuan untuk diwarnai dan menghilang begitu saja (Price et al,. 1994).
Pengamatan jaringan hepar dengan perbesaran 100 kali untuk mengamati seluruh lapang pandang, kemudian ditentukan daerah yang mengalami kerusakan terberat pada zona III. Dari daerah zona III dengan perbesaran 400 kali kemudian ditentukan jumlah inti yang mengalami pyknosis, karyorrhexis, dan karyolisis dari 100 sel. Kemudian masing-masing kerusakan diberi skor 1 dan dijumlahkan setiap 100 sel. Jadi misalnya dari suatu preparat (seekor mencit) dari 100 sel yang diamati ternyata terdapat 10 inti
pyknosis, 15 inti dengan karyorrhexis, dan 5 inti dengan karyolisis,
maka jumlah skor dari preparat tersebut adalah (10x1) + (15x1) + (5x1) = 30. Makin tinggi skor bermakna kerusakan hepar makin berat. Skala pengukuran ini adalah rasio.
3. Variabel luar
37 1) Variasi genetik
Jenis hewan coba yang digunakan adalah mencit (Mus
musculus) dengan galur Swiss webster.
2) Jenis kelamin
Jenis kelamin mencit yang digunakan adalah jantan. 3) Umur
Umur mencit pada penelitian ini adalah 2-3 bulan. 4) Suhu udara
Hewan percobaan diletakkan dalam ruangan dengan suhu udara berkisar antara 25-28o C.
5) Berat badan.
Berat badan hewan percobaan + 20 gram. 6) Jenis makanan.
Makanan yang diberikan berupa pellet dan minuman dari air PAM.
b. Variabel luar yang tidak dapat dikendalikan : kondisi psikologis, dan keadaan awal hati mencit.
38
2) Keadaan awal hati mencit tidak diperiksa pada penelitian ini sehingga mungkin saja ada mencit yang sebelum perlakuan hatinya sudah mengalami kelainan.
H. Alat dan Bahan Penelitian 1. Alat.
Alat yang digunakan adalah sebagai berikut :
a. Kandang mencit 4 buah masing-masing untuk 10 ekor mencit. b. Timbangan hewan.
c. Timbangan obat.
d. Alat bedah hewan percobaan (scalpel, pinset, gunting, jarum, meja lilin).
e. Sonde lambung.
f. Alat untuk pembuatan preparat histologi. g. Mikroskop cahaya medan terang.
h. Gelas ukur dan pengaduk. i. Kamera digital
2. Bahan.
Bahan yang akan digunakan adalah sebagai berikut : a. Parasetamol.
39 c. Aquades.
d. Bahan untuk pembuatan preparat histologi dengan pengecatan HE. e. Ekstrak biji kakao.
I. Cara Kerja
1. Dosis dan Pengenceran Ekstrak Biji Kakao
Dosis yang diberikan ditentukan berdasar hasil konversi dari tikus ke mencit (Ngatidjan, 1991) dengan menggunakan dosis pada penelitian sebelumnya yaitu sebesar 400 mg/ kgBB/ hari pada tikus (McKim et al., 2002). Dosis pemberian ekstrak biji kakao ini diberikan dalam dua dosis, yaitu dosis I = 0,2 ml/ 20grBB mencit perhari dan dosis II = 0,4 ml/ 20grBB mencit perhari. Masing-masing dosis yang disondekan tersebut adalah ekstrak biji kakao yang diencerkan dengan aquades menjadi volume 0,2 ml (untuk dosis I) dan 0,4 ml (untuk dosis II). Ekstrak biji kakao diberikan sehari sekali selama 17 hari berturut-turut pada KP2. Sedangkan ekstrak biji kakao dosis II diberikan sehari sekali selama 17 hari berturut-turut pada KP3.
Perhitungan dosis ekstrak biji kakao: a. Dosis I ekstrak biji kakao
Nilai konversi x 400 mg/ kgBB = 0,14 x 400 mg/ kgBB
40 Pengenceran ekstrak biji kakao :
56 mg ekstrak biji kakao + aquades à 10 ml larutan ekstrak biji kakao Dalam 1 ml larutan mengandung 5,6 mg ekstrak biji kakao
à 0,2 ml larutan mengandung 1,12 mg ekstrak biji kakao
Ekstrak biji kakao yang disondekan adalah ekstrak biji kakao yang telah diencerkan. Ekstrak biji kakao yang disondekan pada 1 ekor mencit dengan berat badan 20 gram = 0,2 ml perhari yang diberikan selama 17 hari berturut-turut.
b. Dosis II ekstrak biji kakao
Ekstrak biji kakao dosis II adalah 2 kali dosis ekstrak biji kakao dosis I yaitu sebesar 2,24 mg perhari.
Jadi larutan ekstrak biji kakao yang disondekan pada 1 ekor mencit (20 gram) = 0,4 ml perhari yang diberikan selama 17 hari berturut-turut. Pemberian ekstrak biji kakao selama 17 hari berturut-turut dimaksudkan untuk meningkatkan kadar antioksidan sehingga kerusakan hepar dapat dicegah ketika terpapar parasetamol dosis toksik. Menurut Engler et al. (2004), pemberian cokelat dengan kandungan flavonoid yang tinggi selama dua minggu dapat meningkatkan konsentrasi epicatechin dalam plasma.
Di luar jadwal perlakuan, mencit diberi makan pellet dan minum air
41 2. Dosis dan pengenceran parasetamol
LD-50 untuk mencit secara peroral yang telah diketahui adalah 338 mg/KgBB atau 6,76 mg/20 gBB mencit (Alberta, 2006). Dosis parasetamol yang dapat menimbulkan efek kerusakan hepar berupa nekrosis sel hepar tanpa menyebabkan kematian mencit adalah dosis 3/4 LD-50 perhari (Sabrang, 2008). Dosis yang digunakan adalah 338 mg/ KgBB x 0,75 = 253,5 mg/ KgBB = 5,07 mg/ 20grBB mencit. Parasetamol 500 mg dilarutkan dalam aquades hingga 9,86 ml, sehingga dalam 0,1 ml larutan parasetamol mengandung 5,07 mg parasetamol.
Parasetamol diberikan selama 3 hari berturut-turut yaitu pada hari ke-15, 16, dan 17. Pemberian parasetamol dengan cara ini dimaksudkan untuk menimbulkan kerusakan pada sel hepar berupa nekrosis pada daerah sentrolobularis tanpa menimbulkan kematian pada mencit. Menurut Wilmana dan Gunawan (2007) pemberian parasetamol dosis tunggal sudah dapat menimbulkan kerusakan sel hepar berupa nekrosis pada daerah sentrolobularis dalam waktu 2 hari setelah pemberian parasetamol.
3. Persiapan mencit
Mencit diadaptasikan selama tujuh hari di Laboratorium Histologi Fakultas Kedokteran UNS, Surakarta. Sesudah adaptasi, keesokan harinya dilakukan penimbangan untuk menentukan dosis dan dilakukan perlakuan. 4. Pengelompokan Subjek
masing-42
masing kelompok terdiri dari 10 mencit. Adapun pengelompokan subjek adalah sebagai berikut:
a. KK = Kelompok kontrol diberi aquadest peroral sebanyak 0,2 ml/ 20grBB mencit perhari selama 17 hari berturut-turut.
b. KP1 = Kelompok perlakuan I diberi aquades peroral sebanyak 0,2 ml/ 20grBB mencit perhari selama 17 hari berturut-turut dan pada hari ke 15, 16 dan 17 juga diberi parasetamol 0,1ml/ 20grBB mencit peroral perhari.
c. KP2 = Kelompok perlakuan II diberi ekstrak biji kakao peroral dengan dosis 0,2 ml/ 20grBB mencit perhari selama 17 hari berturut-turut, dimana hari ke-15, 16 dan 17 diberikan juga parasetamol dengan dosis 0,1ml/ 20grBB mencit perhari setelah 1 jam pemberian ekstrak biji kakao.
d. KP3 = Kelompok perlakuan III diberi ekstrak biji kakao dosis II peroral yaitu 0,2 ml/ 20grBB mencit perhari selama 17 hari berturut-turut, dimana hari ke-15, 16 dan 17 diberikan juga parasetamol dosis 0,1 ml/ 20grBB mencit perhari setelah 1 jam pemberian ekstrak biji kakao.
43
Skema Pemberian Perlakuan
5. Pengukuran hasil.
Parameter yang digunakan pada sistem penilaian derajat kerusakan sel hepar adalah piknosis, karyoreksis dan karyolisis. Kemungkinan ketiga parameter ini merupakan proses yang tidak berkelanjutan atau masing-masing berdiri sendiri. Oleh karenanya, skor yang diberikan pada penelitian ini adalah 1 untuk masing-masing tipe kerusakan.
Pada hari ke-18 setelah perlakuan pertama diberikan, semua hewan percobaan dikorbankan dengan cara dislokasi vertebra servikalis,
Parasetamol dengan dosis 0,1ml/ 20grBB pada hari ke 15, 16, 17.
Perlakuan sampai hari ke-17. Pemberian parasetamol hanya dilakukan pada hari ke 15, 16 dan 17. Pembuatan preparat pada hari ke-18.
Setelah + 1 jam
Aquades 0,2 ml Ekstrak biji
kakao 0,2 ml/ 20grBB Dipuasakan selama + 5 jam
44
45 D. Teknik Analisis Data Statistik
Data yang diperoleh dianalisa secara statistik dengan Uji Oneway
Analysis of Variant (ANOVA). Jika terdapat perbedaan yang bermakna maka
dilanjutkan dengan uji Post Hoc. Derajat kemaknaan yang digunakan adalah α = 0,05 (Riwidikdo, 2007).
Syarat menggunakan uji One-Way ANOVA:
1. Variabel data berupa variabel numerik/ kontinu/ rasio. Data pada penelitian ini adalah skor kerusakan histologis sel hepar mencit yang dinyatakan dengan angka rasio.
2. Sebaran data harus normal, dibuktikan dengan nilai uji Kolmogorov-Smirnov atau Saphiro-Wilk yang memiliki nilai p lebih besar daripada
nilai alfa. Misal, alfa = 0,05 maka nilai p untuk uji sebaran data harus > 0,05.
3. Varians data harus sama. Hal ini dapat diketahui dengan menggunakan uji
Homogeneity of Variances, dimana untuk varians data yang sama akan
memiliki nilai p > nilai alfa.
46 BAB IV
HASIL PENELITIAN
A. Data Hasil Penelitian
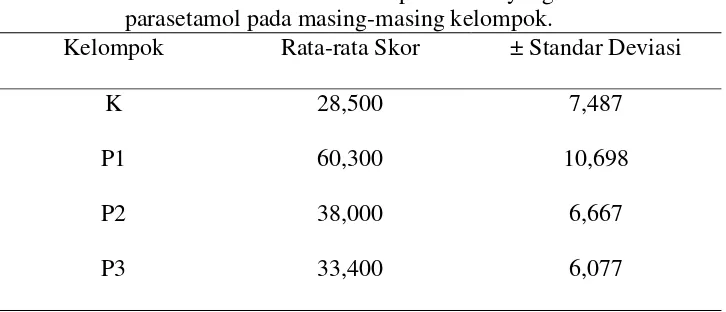
Data hasil penelitian yaitu hasil rata-rata skor jumlah kerusakan sel hepar mencit yang diinduksi parasetamol pada masing-masing kelompok disajikan pada tabel 1.
Tabel 1. Rerata skor kerusakan sel hepar mencit yang diinduksi parasetamol pada masing-masing kelompok.
47
Gambaran histologis (fotomikrograf) zona sentrolobuler hepar mencit kelompok kontrol (K), kelompok perlakuan 1 (P1), kelompok perlakuan 2 (P2), kelompok perlakuan 3 (P3), yang ditandai dengan piknosis, karyoreksis, dan karyolisis dapat dilihat pada lampiran 3.
B. Analisis Data
Data yang diperoleh dari hasil penelitian, pertama kali diuji apakah ada perbedaan skor rata-rata kerusakan sel hepar mencit yang bermakna antara keempat kelompok dengan uji One-Way ANOVA. Analisis data dilakukan dengan menggunakan program komputer Statistical Product and Service
Solution (SPSS) 17.0 for Windows.
Metode analitik yang dapat digunakan untuk menentukan sebaran data
normal atau tidak normal adalah uji Kolmogorov-Smirnov (sampel > 30) atau uji Saphiro-Wilk (sampel < 30). Penelitian ini
menggunakan 40 sampel, maka digunakan uji Kolmogorov-Smirnov untuk menentukan apakah sebaran data normal atau tidak. Hasil uji Kolmogorov-Smirnov dapat dilihat pada lampiran 2, tabel 4.
48
kelompok perlakuan 2 normal, dan (4) sebaran data kelompok perlakuan 3 normal.
Syarat kedua untuk menggunakan uji One-Way ANOVA terpenuhi, selanjutnya dilakukan uji Homogeneity of Variances untuk mengetahui apakah varians data sama atau tidak.
Sebaran data secara deskriptif dapat dilihat pada lampiran, dan hasil uji
Homogeneity of Variances dapat dilihat pada lampiran 2, tabel 6. Nilai p yang
didapatkan dari uji Homogeneity of Variances adalah 0,670 di mana nilai ini lebih besar dari 0,05 dan dapat diartikan bahwa varians data antar kelompok sama. Syarat ketiga untuk menggunakan uji One-Way ANOVA terpenuhi sehingga uji One-Way ANOVA bisa dilakukan.
Hasil uji One-Way ANOVA dapat dilihat pada lampiran 2, tabel 7. Nilai p dari hasil uji One-Way ANOVA adalah 0,000 (p<0,05), jadi terdapat perbedaan skor rata-rata kerusakan histologis sel hepar yang bermakna antara kelompok kontrol, kelompok perlakuan 1, kelompok perlakuan 2 dan kelompok perlakuan 3.
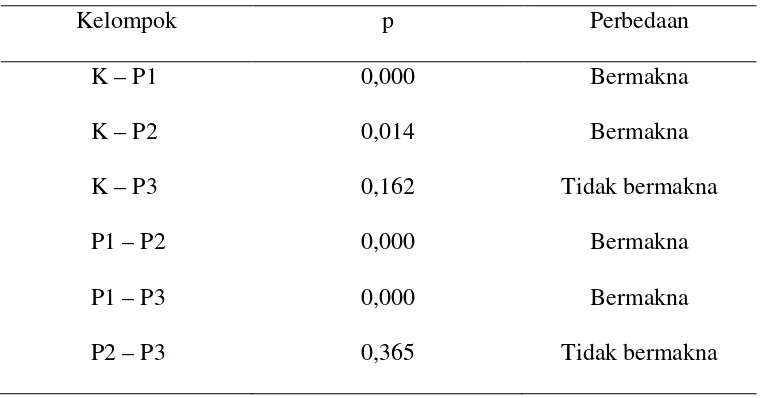
Karena didapatkan adanya perbedaan yang signifikan dari empat kelompok tersebut maka uji statistik dilanjutkan dengan Uji Post Hoc untuk mengetahui antar kelompok mana perbedaan rata-rata skor jumlah kerusakan histologis sel hepar dan yang digunakan dalam penelitian ini adalah Uji LSD.
49 Ringkasannya adalah sebagai berikut: Tabel 2. Ringkasan hasil uji LSD (α = 0,05)
Kelompok p Perbedaan
K – P1 K – P2 K – P3 P1 – P2 P1 – P3 P2 – P3
0,000 0,014 0,162 0,000 0,000 0,365
Bermakna Bermakna Tidak bermakna
Bermakna Bermakna Tidak bermakna
50 BAB V PEMBAHASAN
Sel-sel hati berbentuk poligonal, dengan 6 permukaan atau lebih dan mempunyai garis tengah kira-kira 20-30µm. Ukurannya bermacam-macam, inti besar, bulat atau lonjong, dengan permukaan teratur dan besarnya bervariasi dari satu sel dengan lainnya, vesicular atau kadang-kadang berinti dua dan mempunyai sitoplasma granula asidofil. Pada potongan yang diwarnai dengan hematoksilin dan eosin, sitoplasma hepatosit eosinofilik terutama karena adanya mitokondria dalam jumlah besar dan sedikit retikulum endoplasma halus. Pada sel hati jarang ditemukan mitosis, tetapi banyak gambaran mitosis ditemukan selama penyembuhan setelah cedera (Fiore dan Mariano, 1996; Junqeira and Carneiro, 1995; Lesson et al., 1996).
51
sebagai placebo dan diharapkan kerusakan sel hepar yang terjadi minimal, dimana derajat kerusakan pada kelompok kontrol akan dianggap sebagai derajat normal.
Dari uji One-Way ANOVA didapatkan perbedaan yang bermakna antara keempat kelompok perlakuan. Hasil uji LSD menunjukkan perbedaan bermakna pada kelompok K-P1, K-P2, P1-P2, P1-3, tetapi pada kelompok K-P3 dan P2-P3 menunjukkan perbedaan yang tidak bermakna.
Hasil uji LSD menunjukkan adanya perbedaan yang bermakna dari skor rata-rata kerusakan sel hepar kelompok kontrol dan kelompok P1. Hal ini terjadi karena kelompok P1 mengalami kerusakan sel hepar akibat pemberian parasetamol dosis toksik. Hasil tersebut sesuai dengan teori yang menyatakan bahwa parasetamol dosis toksik mengakibatkan kerusakan sel hepar (Hardman and Limbird, 2001).
Kerusakan sel hepar disebabkan oleh metabolit antara parasetamol yang berikatan dengan protein sel. Metabolit antara ini dikenal dengan quinoneimin yang dibentuk oleh enzim P450. Pada dosis terapeutik parasetamol, quinoneimin yang terbentuk akan berkonjugasi dengan glutation. Pada dosis yang lebih besar, glutation yang tersedia akan semakin sedikit dan akhirnya habis. Akibatnya, quinoneimin akan berikatan dengan gugus sulfihidril (-SH) protein sel dan menyebabkan nekrosis sel hepar (Hodgson and Levi, 2000; Smith and Reynard, 1992). Glutation berperan sebagai antioksidan. Sebagai antioksidan, tripeptida tersebut difasilitasi oleh gugus sulfihidril dari sistein (Winarsi, 2007).
52
oleh proses penuaan dan kematian sel secara fisiologis setiap 150 hari serta karena pengaruh variabel luar yang tidak dapat dikendalikan (Gartner and Hiatt, 2007).
Hasil analisis skor kerusakan sel antara kelompok P1-P2 didapatkan perbedaan yang bermakna. Hal ini berarti pemberian ekstrak biji kakao dengan dosis I yaitu 1,12 mg/ 20grBB mencit selama 14 hari berturut-turut dapat mengurangi jumlah inti sel hepar yang mengalami kerusakan akibat pemberian parasetamol. Menurut Kumas et al. (2005), hepatotoksisitas dapat dikurangi dengan pemberian antioksidan. Kakao mengandung antioksidan dalam bentuk flavonoid. Flavonoid menangkap radikal bebas (free radical scavengers) dengan melepaskan atom hidrogen dari gugus hidroksilnya (Keen, 2001; Ide, 2008). Melalui mekanisme antioksidan ini ekstrak biji kakao dapat mencegah kerusakan histologis sel hepar.
Kelompok P2 merupakan kelompok perlakuan setelah pemberian ekstrak biji kakao dosis 1,12 mg/ 20grBB mencit dan parasetamol. Hasil analisis kerusakan sel hepar pada kelompok P2 menunjukkan perbedaan bermakna dengan kelompok kontrol dan kelompok P1. Hal ini berarti pemberian ekstrak biji kakao dengan dosis 1,12 mg/ 20grBB mencit dapat mengurangi kerusakan sel hepar mencit akibat pemberian parasetamol, tetapi tidak dapat mengembalikan sel hepar pada kondisi seperti kelompok kontrol.
53
parasetamol dan mempertahankan sel hepar pada kondisi seperti kelompok kontrol.
Derajat kerusakan sel hepar kelompok P2 lebih besar dari pada kelompok P3, namun hasil uji LSD menunjukkan perbedaan yang tidak bermakna. Hal ini berarti peningkatan dosis ekstrak biji kakao dapat meningkatkan efek proteksi terhadap kerusakan sel hepar yang ditimbulkan oleh parasetamol, tetapi peningkatannya tidak signifikan. Menurut Bourne dan Roberts (1998), kurva hubungan antara dosis dan efek obat berbentuk sigmoid dengan suatu bagian tengah yang lurus atau linier. Dengan bertambahnya dosis obat, peningkatan respon berkurang, dan akhirnya dosis maksimal tercapai di mana responnya tidak bisa ditingkatkan lagi. Pengaruh ekstrak biji kakao terhadap kerusakan sel hepar yang diinduksi parasetamol dapat dianalogikan dengan cara kerja obat tersebut. Apabila dosis ekstrak biji kakao digambarkan dalam kurva hubungan antara dosis dan efek obat, maka efek dosis I dan dosis II berada pada bagian kurva yang hampir lurus atau linier sehingga peningkatan efeknya tidak terlalu signifikan.
54 BAB VI
SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian dan pembahasan, maka dapat disimpulkan:
1. Pemberian ekstrak biji kakao (Theobroma cacao) dapat mengurangi kerusakan histologis sel hepar mencit (Mus musculus) akibat pemberian parasetamol.
B. Saran
1. Perlu dilakukan penelitian lebih lanjut untuk mengetahui zat aktif dalam ekstrak biji kakao yang paling berperan sebagai hepatoprotektor.
55
Klinik. Edisi VI. Alih Bahasa : Agoes H. A. dkk. Jakarta: EGC, pp: 11-13.
Damjanov L. 1996. Hepatobiliary System. In: Colour Atlas of Histopathology. USA: Williams & Wankins, p: 211.
Engler M. B., Engler M. M ., Chen C. Y., Malloy M. J., Browne A., Chiu E. Y., Kwak H. Y., Milbury P., Paul S. M., Blumberg J., Synder M. L. M. 2004. Flavonoid-rich dark chocolate improves endothelial function and increases plasma epicatechin concentration in healthy adults. J Am Coll Nutr. 23: 197-204.
Fiore, Mariano S. H. 1996. Atlas Histologi Manusia. Alih Bahasa: Martoprawiro H. M, dkk. Edisi 6. Jakarta: EGC, p: 165.
Flammer A. J. et al. 2007. Dark chocolate improves coronary vasomotion and reduces platelet reactivity. Circulation. 116: 2380.
Gartner L. P. and Hiatt J. L. 2007. Color Textbook Of Histology. 3rd ed. China: Elsevier Inc., p: 433.
Gunnell D., Murray V., Hawton K. 2000. Use of paracetamol (acetaminophen) for suicide and nonfatal poisoning: worldwide patterns of use and misuse.
Suicide Life Threat Behav. 30(4): 313.
Hardman J.G, Limbird L. E, Gilman A.G (ed). 2008. Goodman & Gilman’s The
Pharmalogical Basis of Therapeutics. 10th ed. McGraw-Hill Companies. p:
683, 704.
56
Hodgson E. and Levi P. E. 2000. A Textbook Of Modern Toxicology. Singapore: McGraw-Hill Companies Inc., p: 102.
Ide P. 2008. Dark Chocolate Healing. Jakarta: PT Elex Media Computindo, pp: xiv, 5, 8-10, 105, 107.
James L. P., Mayeux P. R., Hinson J. A. 2003. Acetaminophen-induced hepatotoxicity. Clin Pharmacol Ther. 31: 1499-506.
Jenkins D. J. A., Kendall C. W. C., Vuksan V., Vidgen E., Wong E., Agustin L. S. A., Fulgoni V. 2000. Effect of cocoa bran on low-density lipoprotein oxidation and fecal bulking. Arch Intern Med. 160: 2374.
Jones A. L. 1993. Anatomy of The Normal Liver. In: Zakimand Bayer Hepatology, A Text Book of Liver Disease. Philadelphia: W.B. Saunders, p:14.
Junqeira L. C. and Carneiro J. 1995. Histologi Dasar. Alih Bahasa: Adji Dharma. Ed 3. Jakarta: EGC, p: 346.
Katzung, B. 2002. Basic & Clinical Pharmacology. 8th ed. Jakarta: Salemba Medika, pp: 485-6.
Keen, C. L. 2001. Chocolate: food as medicine/ medicine as food. J Am Coll Nutr. 20: 436-7.
Kumar V., Abbas A. K., Fausto N. 2005. Pathologic Basis Of Disease.7th ed. China: Elesevier Inc., p: 26.
Leeson C. R, Leeson T. R., and Paparo A. A. 1996. Buku Teks Histologi. Alih Bahasa: Yann Tambayong, dkk. Jakarta: Penerbit Buku Kedokteran EGC, pp: 383-7.
Lucas A. M., Hennig G., Dominick P. K., Whiteley H. W., Roberts J. C., Cohen S. D. 2000. Rybose cysteine protects againts acetaminophen-induced hepatic and renal toxicity. Toxicol Pathol. 28: 697.
McKim S. E., Konno A., Uesugi T., Froh M., Sies H., Thurman R. G., Arteel G. E. 2002. Cocoa extract protects against early alcohol-induced liver injury in the rat. Arch Biochem Biophys. 406(1): 40.
57
Murti, B. 2006. Desain dan Ukuran Sampel Untuk Penelitian Kuantitatif dan
Kualitatif di Bidang Kesehatan. Gajah Mada University Press, p: 67.
Ngatidjan. 1991. Petunjuk Laboratorium Metode Laboratorium dalam
Toksikologi. Yogyakarta: Pusat Antar Universitas Bioteknologi UGM, pp:
94-152.
Noe V., Penuelas S., Raventos R. S. M., Permanyer J., Ciudad C. J., Pulido M. I. 2004. Epicatechin and a cocoa polyphenolic extract modulate gene expression in human caco-2 cells. J. Nutr. 134:2509.
Osakabe N. et al. 2001. Catechins and their oligomers linked by C4→C8 bonds are major cacao polyphenols and protect low-density lipoprotein from oxidation in vitro. Exp Biol Med. 227 (1): 51.
Paulsen F. D. 2000. Histology and Cell Biology. Lange Medical Book, p: 206. Price S.A. and Wilson L.M. 1994. Patofisiologi, Konsep Klinis Proses-proses
Penyakit. Edisi 4. Jakarta: EGC, pp: 773-5.
Purawisastra S. 2001. Penelitian Pengaruh Isolat Galaktomannan Kelapa terhadap Penurunan Kadar Kolesterol Serum Kelinci.
http://digilib.itb.ac.id/index.php?mod=browse&op=read&id=jkpkbppk-gdl-grey-2001-suryana-108-galaktoman&newlang=english. (26 November 2009)
Ramachandran R. and Kakar S. 2009. Histological patterns in drug-induced liver disease. J Clin Pathol. 62: 481-2.
Raventós R. M. L., Pérez A. I. R., Lacueva C. A., Tornero A. 2005. Health effects of cocoa flavonoids. SAGE Journals. 11: 159.
Rein D., Paglieroni T. G., Wun T., Pearson D. A., Schmitz H. H., Gosselin R., Keen C. L. 2000. Cocoa inhibits platelet activation and function. Am J Clin Nutr. 72: 34.
Riwidikdo H. 2007. Statistik Kesehatan, Belajar Mudah Teknik Analisis Data
Dalam Penelitian Kesehatan. Yogyakarta : Mitra Cendikia Press, pp: 60-70,
140-9.
Sabrang R. 2008. Pengaruh Minyak Jintan Hitam (Nigella Sativa) Terhadap Kerusakan Histologis Hepar Mencit (Mus Musculus) Yang Diinduksi
Parasetamol. Skripsi. FK UNS, p: 18.
58
Smith C. M. and Reynard A. M. 1992. Textbook of Pharmacology. Philadelpia: W. B. Saunders Company, p: 1002-3.
Susanto F. X. 1994. Tanaman Kakao Budidaya dan Pengolahan Hasil. Yogyakarta: Kanisius, p: 20.
Taufiqqurohman M.A. 2003. Metodologi Penelitian Kedokteran & Kesehatan.
Surakarta : CSGF.
Tjay, TH. & Raharja, K. 2002. Obat-Obat Penting : Khasiat, Penggunaan, dan
Efek-Efek Sampingnya. Ed 5. Jakarta: Gramedia, pp: 318-319
Uribe C. K. and Bektash R. M. 2008. Cacao flavonols: measurement, bioavailability dan bioactivity. Asia Pac J Clin Nutr. 17 (S1): 282.
Wahyudi T.dan Rahardjo P. 2008. Kakao: Manajemen agribisnis dari hulu
hingga hilir. Dalam: Wahyudi T., Panggabean T. R., Pujiyanto (eds). Sejarah
dan Prospek. Depok: Penebar Swadaya, pp: 12-3.
Wilmana P.F. dan Gunawan S.G. 2007. Analgesik-Antipiretik Analgesik Anti-Inflamasi Nonsteroid dan Obat Gangguan Sendi Lainnya. Dalam: Gunawan S.G. (ed). Farmakologi dan Terapi. Edisi 5. Jakarta : Gaya Baru, pp:237-9. Winarsi H. 2007. Antioksidan Alami dan Radikal Bebas. Yogyakarta: Kanisius, p:
105.
Wu G. Y. and Israel J (ed). 1998. Diseases of The Liver and Bile Ducts, Diagnosis