Kelompok 3
•
Annisa Nurhidayati
•
Argy Fadillah Valon
•
Barron Benvico M.
•
Fanti Afna utri
•
Hariz Aff riyoga
•
M. Hafdh Raditya
•
Salfarras Rafiandra Aqil
•
Sri Aji Cakraningrum
KiMiAkImIaKmIaKiMiAkImIa
Laju
ENGERTIAN LAJU REAKSI
Laju Reaksi :
“Berkurangnya jumlah pereaksi untuk setiap satuan waktu atau bertambahnya konsentrasi hasil reaksi setiap satu satuan waktu”
Laju Reaksi dapat dinyatakan sebagai
berikut :
Laju Reaksi =
atau
Laju Reaksi =
Reaktan(pereaksi)
→
produk (hasil
reaksi)
A
→
B
Laju reaksi = atau laju
reaksi =
t A
Contoh :
Data percobaan laju reaksi untuk
konsentrasi reaktan dan produk sebagai fungsi waktu pada suhu 300C
untuk reaksi, 2NOWaktu 2(g) 2NO(g) + O2(g)
(detik) (NO2), M (NO), M (O), M
0 100 0 0
50 79 21 10
100 65 35 18
embahasan 2NO
2(g)
2NO
(g)+ O
2(g)Laju reaksi setelah 50 detik, dapat dinyatakan
embahasan
Laju reaksi setelah 50 detik, dapat dinyatakan
Orde Reaksi
Orde
reaksi
adalah
bilangan
pangkat dari faktor konsentrasi
dalam persamaan laju reaksinya.
Orde Reaksi
Orde reaksi 0
: laju reaksi tidak
bergantung pada konsentrasi
Orde Reaksi
Orde reaksi 1 : laju reaksi berbanding
lurus dengan konsentrasi pereaksi
Orde Reaksi
Orde reaksi 1 : laju reaksi berbanding
lurus dengan konsentrasi pereaksi
Orde Reaksi
Orde reaksi 2: ada reaksi orde dua, kenaikan laju reaski akan sebanding dengan kenaikan konsentrasi pereaksi pangkat dua.
ersamaan Laju Reaksi
Untuk reaksi A + B C,
ersamaan laju reaksi nya adalah :
v = k [A]
m[B]
nOrde reaksi = m
+
n
Keterangan :
v = laju reaksi ( mol dm-3 det-1 )
k = tetapan laju reaksi
m = tingkat reaksi (orde reaksi) terhadap A
n = tingkat reaksi (orde reaksi) terhadap B
[A] = konsentrasi awal A ( mol dm -3)
Cara Menentukan Orde
Reaksi
Jika tahap – tahap reaksi diketahui, maka orde reaksi terhadap masing – masing zat adalah koefsien tahap yang paling lambat.
Konsentrasi zat tersebut dinaikkan
C
O
N
T
O
H
1. Data percobaan untuk reaksi A + B AB
ersamaan laju reaksi adalah ???
NO. [A] [B] v(M/s) 1.
2. 3.
10 30 10
5 5 20
pEmBaHaSaN
Orde 2 terhadap [A] Orde 2 terhadap [B]
Faktor-Faktor Yang
Mempengaruhi Laju Reaksi
1. Konsentrasi
2. Luas Permukaan
3. Suhu
K
o
n
s
e
n
t
r
a
s
i
R
e
a
k
s
i
Konsentrasi Tinggi
Konsentrasi Rendah
Semakin banyak partikel atom / molekul berarti semakin banyak peluang
terjadinya tumbukan efektif sehingga
Kalsium karbonat (CaCO3) dengan massa yang sama direaksikan dengan asam
klorida (HCl) 1M, 2M, 3M.
CaCO
3
1M
HCl
HCl
2M
3M
HCl
Maka HCl 3M akan lebih cepat bereaksi
semakin luas permukaan sentuh, semakin banyak tempat terjadinya tumbukan antaramolekul yang bereaksi,
sehingga laju reaksi lebih cepat berlangsung.
Asam klorida (HCl) dengan konsentrasi yang sama di reaksikan dengan Besi (Fe)
bongkahan, lempengan, dan serbuk
dengan massa yang sama.
1
2
3
Fe serbuk akan lebih cepat
bereaksi
L
u
a
s
S
u
h
u
Suhu Tinggi
Suhu Tinggi Suhu Rendah
Energi Kinetik artikel
Meningkat
artikel Bergerak Cepat
Energi Kinetik artikel
Yang bergerak itu Tinggi
Mereaksikan logam magnesium (Mg) dengan massa yang sama dengan asam
klorida,
25°C
35°C
45°C
1 2 3
maka pada suhu yang lebih tinggi logam Mg akan lebih cepat habis bereaksi
S
u
h
u
Bila pada setiap kenaikan toC suatu reaksi
S
u
h
u
Laju suatu reaksi menjadi dua kali lebih cepat pada setiap kenaikan suhu 10oC. Bila pada suhu
20oC reaksi berlangsung dengan laju reaksi 2 x
10-3 mol/L detik, maka berapa laju reaksi yang
terjadi pada suhu 50oC.
Energi engaktifan /
Energi Aktivasi
adalah energi minimal yang
E
N
E
r
g
i
aktiv
a
s
i
&
k
a
t
a
l
is
Reaksi Eksoterm Reaksi Endoterm Ea
H
Ea
H
A + B c + Q R AB*
A B
C Q
Q*
Katalis adalah suatu zat yang
memercepat laju reaksi kimia pada
suhu tertentu, tanpa mengalami
mengalami perbuahan atau terpakai
oleh reaksi itu sendiri
Energi Aktivasi Jalur reaksi
yang
ditambahka n katalis
Energi Aktivasi Jalur reaksi
yang
ditambahka n katalis
Energi Aktivasi Jalur reaksi
biasanya
Energi Aktivasi Jalur reaksi
biasanya
k
a
t
a
l
is
Produk
Ea Ea1
ΔH = + Reaksi
Energi
Reaktan
Teori
Teori Tumbukan
Suatu zat dapat bereaksi dengan zat lain apabila partikel-partikelnya saling bertumbukan.
Menghasilkan energi untuk memulai terjadinya reaksi.
Disebabkan oleh karena partikel-partikel (molekul-molekul) zat selalu bergerak dengan arah yang tidak teratur.
Hanya tumbukan yang menghasilkan energi yang
ENERA
AN
1.Laju reaksi yang berkaitan dengan luas bidang permukaan
oIbu di rumah atau pedagang bubur kacang mengiris terlebih dahulu gula merah yang akan di masukan ke dalam bubur kacang.
o enduduk pedesaan membelah kayu gelondongan menjadi beberapa
bagian sebelum dimasukkan ke dalam tungku perapian.
o enjual gado-gado, lontong, dan pecel terlebih dulu menggerus kacang goreng sebelum dicampurkan dengan bahan lain.
oDalam pembuatan kertas, bahan baku pembuat kertas digerus terlebih
dahulu untuk membuat bubur kertas. Agar memperluas pemukaan bidang sentuh sehingga campuran menjadi homogen danreaksi berlangsung sempurna.
oBahan baku yang sering di tambang, tersedia dalam bentuk
A. Industri pembuatan amonia
o Amonia meruapakan zat kimia yang
digunakan sebagai bahan baku pada pupuk dan pabrik peledak.
o ada sushu kamar (25 C) reaksi berlangsung lambat. Untuk mempercepatnya harus
menggunakan katalis.
o Katalis ini ditemukan oleh ahli kimia jerman, fritz haber pada 1905. Sehingga proses ini dinamakan proses haber.
o Katalis yang digunakan adalah logam besi yang merupakan katalis heterogen.
2. Laju reaksi dengan katalis, biasanya
konsep ini di pakai untuk industri
B. Industri pembuatan asam nitrat
ometode yang sering digunakan dalam industri asam nitrat adalah metode proses ostwald, yang dikembangkan oleh ahli kimia jerman, wilhelm ostwald.
oBahan baku industri asam nitrat adalah amonia. Mula-mula, amonia
dibakar pada suhu 800 C.
oOksida NO terbentuk teroksida dengan cepat membentuk NO.
okemudian gas NO diserap oleh air menghasilkan asam nitrit dan asam nitrat.HNO diubah mnjadi HNO (g) melalui persamaan,
C. Industri Perminyakan
o Kebutuhan akan bensin meningkat
seiring dengan meningkatnya jumlah kendaraan bermotor, Itulah sebabnya perlu dilakukan pengembangan
metode distilasi yang menghasilkan bensin.
o Metode yang dikembangkan tersebut,
yaitu pemecahan katalis dan alkilasi.
o Katalis yang digunakan, diantaranya
asam, oksida alumunium, silikon, dan krom.
Terima
ada percobaan reaksi antara lgam alumunium dan asam sulfat sesuai ersamaan reaksi :
AAl(s) + 3H2SO(aq) → Al2(SO4)3(Aq) + 3H2(g)
Gas hidrogen ditamung dan diukur volumenya ada temperatur yang tetap. Data pengukuran tiap waktu sesuai tabel
Laju reaksi pembentukan gas hidrgen setelah 30 detik sebesar ?
A. 0,83 mL/detik D. 2,50 mL/detik B. 1,33 mL/detik E. 7,50 mL/detik C. 2,6 7 mL/detik
No
. Waktu reaksi (detik) Volume gas (mL)
1 0 0
2 15 40
3 30 80
erhatikan gambar pelarutan 50 gram gula dalam air berikut!
Laju yang hanya dipengaruhi oleh suhu terdapat pada gambar nomer?
a. I terhadap 2 d. 3 terhadap 5 b. I terhadap 4 e. 4 terhadap 5 c. I terhadap 3
1 2 3 4 5
25⁰C 25⁰C 50⁰C 50⁰C 50⁰C
1. 1 gr Zn 3. 2 gr Zn 5. 2 gr Zn
HCL 0,5 m HCl 1 m HCL 2m
t= 25˚C t= 27˚C t= 27˚C
2. 1 gr Zn 4. 1 gr Zn
HCl 1 m HCL 0,5 m
t= 28˚ C t= 25˚C
Laju reaksi yang hanya dipengaruhi oleh konsentrasi terdapat pada gambar
Sebanyak 2gr logam seng direaksikan dengan larutan asam sulfat dengan berbagai kondisi sebagai berikut:
1 2 3 4 5
30˚C 30˚C 30˚C 50˚C 50˚C H₂SO₄ 3M H₂SO₄ 3M H₂SO₄ 4M H₂SO₄ 3M H₂SO₄ 3M
Laju reaksi yang hanya dipengaruhi oleh konsentrasi terdapat pada nomor ?
80. Perhatikan gambar reaksi CaCo3 dengan larutan 10 ml HCl berikut !
(1) (2) (3) (4) (5)
81. Perhatikan percobaan berikut
(1) (2) (3)
(4) (5)
Sebanyak 5gr logam magnesium masing-masing dilarutkan dalam 5 wadah yang berbeda . Laju reaksi yang hanya dipengaruhi oleh konsentrasi pada tabung nomer
A.1 terhadap 2 D. 3 terhadap 4 B.1 terhadap 3 E. 4 terhadap 5 C.2 terhadap 4
82. Berikut ini beberapa gambar proses
pelarutan gula dengan massa yang sama
:
1 2 3 4 5
25
C 50C 25
C 25
C 50
C 7
•
Gambar berikut merupakan reaksi
antara 2 gram pualam dan 100 mL
larutan HCl
1 2 3 4 3Laju reaksi yang hanya dipengaruhi oleh konsentrasi adalah nomor...
83. Gambar berikut merupakan reaksi antara 2 gram pualam dan 100 mL larutan HCl
1 2 3 4 3
Laju reaksi yang hanya dipengaruhi oleh konsentrasi adalah nomor...
86.Gambar berikut merupakan percobaan reaksi 1 gram pualam dengan 100 mL larutan HCl.
Laju reaksi yang hanya dipengaruhi oleh luas permukaan terdapat pada gambar nomor ...
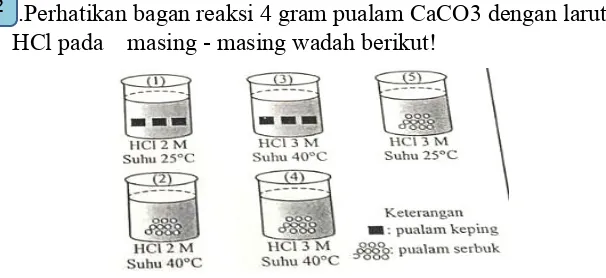
11
87.Perhatikan bagan reaksi 4 gram pualam CaCO3 dengan larutan HCl pada masing - masing wadah berikut!
Laju reaksi yang hanya dipengaruhi oleh suhu terdapat pada gambar nomor ...
12
mL/detik
No. Waktu reaksi (detik) Volume gas (mL)
2.( C ) 1 terhadap 3