6 BAB 2
LANDASAN TEORI
2.1. TINJAUAN PUSTAKA
2.1.1. Systemic Lupus Erythematosus (SLE) 2.1.1.1. Definisi
Systemic Lupus Erythematosus (SLE) adalah penyakit autoimun kompleks ditandai dengan autoantibodi terhadap inti sel dan melibatkan banyak sistem organ (Mocarzel et al., 2015) (Suarjana, 2014), serta respon imun hiperaktif dan produksi abnormal autoantibodi yang menyebabkan kerusakan jaringan dan organ (Sawla et al., 2012) (Mocarzel et al., 2015)(Comte et al., 2015)(Chen et al., 2015). Menurut Perhimpunan Reumatologi Indonesia (2011), SLE adalah penyakit inflamasi autoimun kronis yang belum jelas etiologinya dengan gambaran klinis dan perjalanan penyakit yang luas dan beragam.
2.1.1.2. Epidemiologi
Prevalensi SLE di Buenos Aires, sebesar 58.6 per 100.000 penduduk dengan kejadian pada wanita 4 kali lipat dibandingkan pria (Sconik et al., 2014). Insiden tahunan SLE di Inggris 4.91 per 100.000 penduduk dengan prevalensi yang meningkat dari tahun 1999 sebesar 64.99 per 100.000 penduduk menjadi 97.04 per 100.000 penduduk pada 2012. Kejadian SLE pada wanita 6 kali lipat lebih tinggi dibandingkan pria (Rees et al., 2014). Data
7
tahun 2002 di RSUP Cipto Mangunkusumo (RSCM) Jakarta, dilaporkan kasus SLE 1.4% dari total kunjungan pasien di poliklinik Reumatologi Penyakit Dalam. Data di RS Hasan Sadikin Bandung terdapat 291 pasien SLE atau 10.5% dari total pasien yang berobat ke poliklinik reumatologi selama tahun 2010 (Perhimpunan Reumatologi Indonesia, 2011). Data pasien SLE di RSUD Dr. Moewardi Surakarta tahun 2011 adalah 2,75% dari seluruh kunjungan pasien Poli Reumatologi (Adnan, 2012).
2.1.1.3. Imunopatogenesis
Etiologi SLE terdiri dari faktor genetik dan faktor lingkungan dengan jenis kelamin wanita sangat kuat mempengaruhi patogenesis. Faktor-faktor tersebut memicu kerusakan ireversibel toleransi imunologis yang bermanifestasi pada respon imun terhadap antigen inti endogen (Bertsias et al., 2012). SLE ditandai hilangnya toleransi diri secara global dengan aktivasi sel T autoreaktif dan sel B yang mengakibatkan produksi autoantibodi patogen dan kerusakan jaringan. Mekanisme imun innate berperan penting terhadap respon imun adaptif yang abnormal pada SLE (Choi et al., 2012). Gangguan mekanisme regulasi imun seperti gangguan pembersihan sel-sel apoptosis dan kompleks imun berperan penting dalam perkembangan SLE. Hilangnya toleransi imun, meningkatnya antigenic load, bantuan sel T yang berlebihan, gangguan supresi sel B dan peralihan respons imun dari T helper 1(Th1) ke Th2 mengakibatkan hiperaktivitas sel B dan memproduksi autoantibodi patogenik. Respons imun akibat terpapar faktor lingkungan seperti radiasi
8
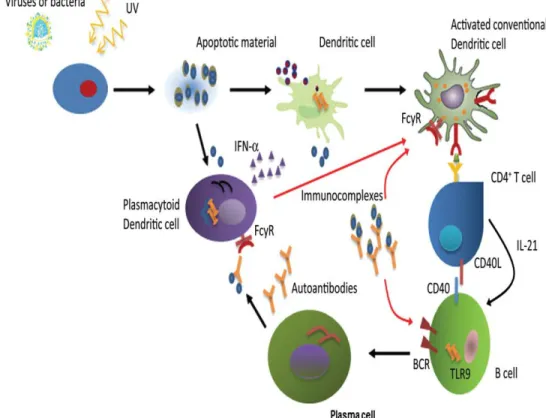
ultraviolet atau infeksi virus yang cukup lama dapat mengakibatkan disregulasi sistem imun (Suarjana, 2014; Musai, 2010). Faktor genetik, lingkungan, hormonal, epigenetik, dan imunoregulasi berperan berurutan dan simultan pada sistem imun. Faktor-faktor tersebut berinteraksi sehingga muncul autoantibodi, kompleks imun, sel T autoreaktif, dan sitokin-sitokin inflamasi yang mengawali dan memperkuat inflamasi dan kerusakan berbagai organ. Organ target yang terpengaruh dirusak lebih lanjut oleh faktor lokal seperti pada gambar 1 (Tsokos, 2011).
9
aGambar 1. Ikhtisar patogenesis SLE
Aktivasi sel T dan B memerlukan stimulasi gen yang spesifik. Bahan kimia iritatif seperti pristan, DNA, fosfolipid dinding sel bakteri, dan antigen virus dapat menginduksi antibodi anti-DNA pada mencit. Selain itu antigen diri seperti kompleks protein-DNA dan protein-RNA dapat menginduksi produksi autoantibodi. Antigen lingkungan dan antigen diri ditangkap oleh antigen presenting cell (APC) atau diikat antibodi pada permukaan sel B. APC dan sel B memproses antigen menjadi peptida kemudian menyajikannya pada sel T melalui molekul HLA (Human Leukocyte Antigen) pada permukaan sel. Sel T aktif akan merangsang sel B memproduksi autoantibodi patogenik. Interaksi APC, sel T dan sel B difasilitasi oleh berbagai sitokin dan membutuhkan molekul tambahan seperti sistem CD40/CD40L dan B7/CD28/CTLA4 untuk menginisiasi sinyal kedua (Hahn, 2013)(Mok dan Lau, 2003).
Perkembangan SLE terjadi dalam beberapa tahap. Periode waktu panjang yaitu sejak predisposisi sampai dengan autoimunitas yang dipengaruhi oleh kecenderungan genetik, jenis kelamin dan paparan
10
lingkungan, kemudian sebagian kecil akan berkembang menjadi autoantibodi yang biasanya mengawali gejala klinis dalam periode bulan sampai dengan tahun. Sebagian individu dengan autoantibodi berkembang menjadi SLE secara klinis, dimulai dengan keterlibatan sejumlah kecil sistem organ, pemeriksaan laboratorium abnormal dan akhirnya terdiagnosis SLE. Setelah beberapa tahun individu akan mengalami kekambuhan penyakit secara intermiten dan perbaikan walau tidak total, kerusakan organ, komorbiditas, inflamasi kronik (Hahn, 2013).
Gambar 2. Imunopatogenesis SLE (Bertsias et al., 2012)
Imunopatogenesis SLE dapat dijelaskan melalui berbagai tahapan, seperti ditunjukkan pada gambar 2. Diawali stimulasi respon imun innate dan
11
adaptif oleh autoantigen. Peningkatan produksi autoantigen selama apoptosis baik terkait dengan paparan sinar ultraviolet dan atau spontan akan merangsang sistem imun innate dan adaptif. Nukleosom mengandung ligan endogen yang mengikat pathogen associated molecule pattern yang tergabung dengan blebs apoptosis sehingga memicu aktivasi sel dendritik untuk memproduksi interferon dan memicu sel B untuk memproduksi autoantibodi (Bertsias et al., 2012). APC adalah sel makrofag/monosit, sel dendritik, dan sel limfosit B yang berproses dan mempresentasikan antigen. Sel-sel pada sistem imun innate diaktifasi melalui jalur TLR (toll like receptors) oleh protein DNA atau RNA. Sel dendritik teraktivasi, berubah dari tolerogenik menjadi sel dendritik pro inflamasi yang mensekresi sitokin inflamasi (IFNα), sel makrofag/monosit mensekresi TNF-α dan IL-1, IL-12, serta IL-23. Sitokin-sitokin tersebut adalah hasil aktifasi sel T efektor yang membantu sel B membentuk imunoglobulin G yang bersifat autoantibodi, menginfiltrasi jaringan dan bersifat sitotoksik. Aktifasi sel limfosit B secara langsung oleh DNA/RNA melalui jalur TLR dan IFNα, dibantu oleh sel T untuk mensekresi autoantibodi juga maturasinya menjadi sel plasma oleh BLyS (B-lymphocyte stimulator)/BAFF (B cell–activating factor), IL-6, dan beberapa sitokin lainnya (Hahn, 2013).
Autoantibodi merupakan efektor utama pada SLE. Namun tidak cukup menimbulkan gejala penyakit, sehingga penumpukan autoantibodi di jaringan membutuhkan aktifasi sistem komplemen dan atau mediator inflamasi
12
lainnya, serta kemotaksis limfosit dan polimorfonuklear, pelepasan sitokin, kemokin, enzim proteolitik, sehingga mengakibatkan kerusakan organ (Hahn, 2013). Kompleks imun adalah penyebab utama kerusakan jaringan pada SLE. Kompleks imun terbentuk dalam jumlah besar sebagai antibodi antinuklear terikat pada materi nuklear di darah dan jaringan yang tidak dapat dibersihkan dengan baik karena reseptor Fc dan komplemen berkurang dalam hal jumlah maupun fungsinya (Tsokos, 2011). Hiperaktifasi sel T dan atau sel B mengakibatkan SLE dengan meningkatkan jumlah autoantibodi dan sitokin pro inflamasi (Hahn, 2013).
2.1.2. Interleukin 17 (IL-17)
Sitokin berperan penting dalam patogenesis SLE. Sitokin adalah faktor terlarut yang berperan dalam diferensiasi, maturasi dan aktivasi berbagai sel imun. Sitokin juga menyebabkan respon inflamasi lokal yang pada akhirnya menyebabkan kerusakan jaringan (Yap dan Lai, 2010). Pelepasan dan fungsi abnormal berbagai sitokin terjadi pada pasien SLE maupun hewan coba baik in vitro maupun in vivo. Sitokin-sitokin tersebut dapat memiliki efek pro inflamasi maupun anti inflamasi, atau keduanya tergantung pada lingkungan spesifiknya (Su et al., 2011).
Interleukin-17 (IL-17) merupakan sitokin proinflamasi yang kuat yang diproduksi oleh limfosit T yang teraktivasi. Sel Th17 merupakan subset dari CD4+ limfosit T dinamakan setelah sitokin penanda IL-17, yang mewakili prototipe dari keluarga sitokin yang telah diidentifikai sebelumnya berisikan
13
6 anggota (IL-17A, IL-17B, IL-17C, IL-17D, IL-17E, IL-17F) dan lima reseptor (IL-17RA, IL-17RB, IL-17RC, IL-17RD, IL-17RE). Produksi IL-17 distimulasi oleh IL-23. IL-17 memicu inflamasi dengan menginduksi kemokin lokal dan sekresi sitokin dan penting untuk pembersihan dari beberapa patogen seperti bakteri dan jamur. Frekuensi dari sel T memproduksi IL-17 meningkat pada darah perifer pasien SLE, dan produksi Il-17 abnormal pada pasien SLE. Kadar IL-17 meningkat pada SLE dewasa dan berhubungan dengan aktivitas penyakit.(Pelicari et al,. 2015)(Vincent et al,. 2013) (Tabarkiewic et al., 2015)
IL-17 dianggap berperan penting dalam pembentukan karakteristik lingkungan pada SLE dan mempromosikan survival sel B dan produksi autoantibodi. IL-17 merupakan sitokin proinflamasi yang terlibat dalam pertahanan host melawan patogen ekstraseluler, intraseluler dan jamur. IL-17 meningkatkan inflamasi pada beberapa tingkat, seperti reseptornya diekspresikan pada sel hematopoetik dan non hematopoetik. Sebagai tambahan terhadap kemampuan proinflamasi yang kuat, IL-17 menggunakan efeknya melalui pengambilan monosit dan netrofil dengan meningkatkan produksi lokal kemokin (IL-8, monocyte chemoattractant protein-1, growth-related oncogene protein-α), fasilitasi dari inflitrasi dan aktivasi sel T dengan menstimulasi ekspresi dari molekul adhesi interseluler. IL-17 juga dapat menstimulasi produksi antibodi sel B.(Hassan et al,. 2014) (Nalbandian et al,. 2009)(Comte et al., 2015)
14
IL-17 bersinergi dengan sitokin lain, khususnya dengan IL-1b, tumour necrosis factor (TNF)-α, and interferon (IFN)-g. IL-17RA diekspresikan secara luas dan memediasi efeknya melalui beberapa sel imun dan non imun (terutama sel endotel dan epitel)(Nalbandian et al,. 2009).
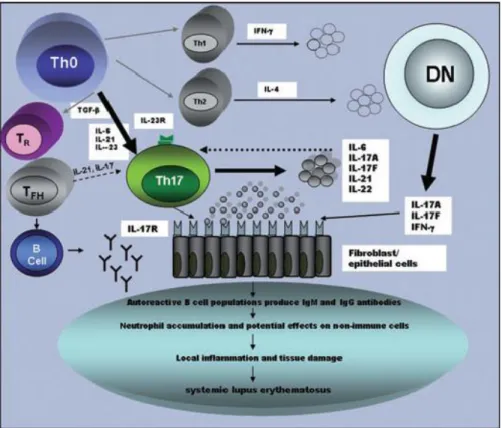
Gambar 3. Peran Th 17 dan IL-17 dalam patogenesis SLE (Nalbandian et al,.2009) 2.1.3. Tumor Necrosis factor - α (TNF-α)
TNF-α merupakan sitokin pleiotrofik yang diproduksi oleh banyak tipe sel, termasuk makrofag, monosit, limfosit, keratinosit, dan fibroblas, dalam respon terhadap inflamasi, infeksi, luka, dan tantangan lingkungan lainnya. TNF-α bukan hanya sitokin proinflamasi yang kuat tetapi juga memainkan
15
peran penting dalam aktivasi dan migrasi lekosit, demam, respon fase akut, proliferasi sel, diferensiasi, dan apoptosis. TNF-α merupakan sitokin proinflamasi dan imunoregulator. TNF-α memiliki efek yang berbeda pada sel B, sel T, dan sel dendritik, juga pada proses kematian sel terprogram. Selama respon (auto)imun, TNF-α bertindak sebagai faktor pertumbuhan untuk sel B dan merangsang maturasi sel dendritik tetapi menyebabkan hiporesponsif sel T dan ekspresi molekul anti apoptosis. Terakhir ini sangat penting dalam homeostasis imun : pada satu sisi, TNF-α menahan autoreaktif sel T melalui regulasi negatif dari transduksi sinyal reseptor sel T di darah perifer; pada sisi lain, TNF-α menetralkan apoptosis yng dimediasi Fas melalui aktivasi dari NF-κB dan induksi molekul anti apoptosis, kemudian menurunkan stimulasi sistem imun yang disebabkan oleh apoptosis nukleosom yang diturunkan, dan menghambat produksi autoantibodi. Dilihat dari aspek inflamasi, TNF diinduksi oleh sel dendritik dan merangsang inflamasi dan kerusakan jaringan sekunder; pelepasan autoantigen selama nekrosis dapat memicu autoimunitas. Produksi TNF-α yang tidak teratur, bisa rendah atau tinggi, menandai banyak penyakit. Bukti terbaru mendukung sifat dualistik, peran proinflamasi dan imun atau supresi penyakit untuk TNF-α pada kondisi ini. Dikarenakan kompleks genetik dari SLE dan ikatan yang kuat dai gen Tnf dengan lokus MHC, peran fisiologi dari TNF- α dan adaptornya pada patogenesis lupus masih belum jelas.(Zhu et al,. 2010)
16
Pada SLE, TNF-α memiliki dua aksi yang berbeda. Pertama, TNF-α dapat menjadi mediator imunosupresif dari sintesa autoantibodi. Kedua, TNF-α sebagai faktor proinflamasi yang secara akut dilepaskan ke jaringan lokal. Kadar TNF-α yang menurun sebagai fungsi dari aktivitas penyakit menunjukkan kemungkinan peran melindungi pada SLE. Namun, kemungkinan besar TNF-α memiliki sel target dan molekul yang berbeda pada satdium imunopatologi lupus yang berbeda.(Hirankarn et al,. 2007)
Pada kebanyakan penelitian, TNF-α ditemukan meningkat tajam dan menjadi bioaktif dalam serum pasien SLE aktif, dan kadar TNF-α berhubungan dengan aktivitas penyakit SLE. Penelitian sebelumnya menemukan bahwa pasien SLE terjadi peningkatan kadar TNF-α plasma, namun tidak ada hubungan dengan aktivitas penyakit. Sebuah penelitian telah menunjukan bahwa kadar TNF-α dan rasio TNF/IL-10 lebih tinggi pada pasien dengan penyakit inaktif dibandingkan dengan pasien dengan penyakit sangat aktif dan kontrol, menyimpulkan bahwa TNF-α dapat menjadi faktor pelindung pada pasien SLE.(Zhu et al,. 2010)
Sitokin proinflamasi (IL-6, IL-8, TNF-α) hadir dengan kadar yang tinggi dalam serum, sehingga menjamin proliferasi dan diferensiasi limfosit B, bertanggung jawab untuk hiperaktivitas karakteristiknya dengan produksi antibodi pada gangguan autoimun ini. (Avrămescu et al,. 2010)
17
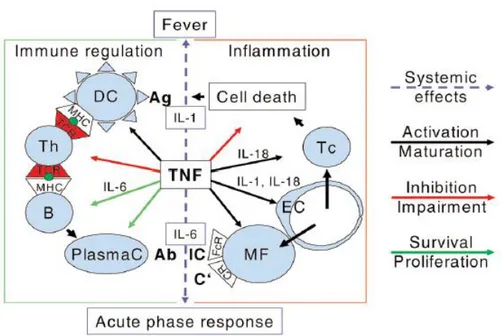
Gambar 4. Efek Tumor Necrosis Factor (Aringer dan Smolen, 2008)
2.1.4. Mencit Model Lupus
Mencit BALB/c yang diinjeksi pristan menghasilkan gambaran yang memenuhi kriteria lupus yaitu artritis, ANA, anti-dsDNA, anti-Sm, immune complex-mediated glomerulonephritis, pulmonary capillaritis (pulmonary vasculitis) dan IFN1 pada darah perifer. Inflamasi perikardium dan pleura juga terjadi pada mencit induksi pristan. Mencit yang diberikan injeksi pristan memenuhi 4 kriteria ACR 1997 untuk penegakan SLE, yaitu anti ds DNA, artritis, lupus nefritis, dan vaskulitis. Seperti SLE pada manusia, SLE pada mencit juga cenderung terjadi pada mencit betina (Reeves et al., 2009). Calvani (2005) meneliti mencit Balb/c yang diberikan injeksi minyak hidrokarbon (pristan) 0,5 ml secara intraperitoneal, menunjukkan bahwa mencit normal dapat mengalami
18
sindrom autoimun seperti lupus. Penelitian tersebut membuktikan bahwa pristan dapat memicu apoptosis in vitro dan in vivo. Pristan menghentikan pertumbuhan sel dan memicu kematian sel secara apoptosis melalui jalur mitokondria dengan aktivasi caspase. Terbentuknya autoantigen inti yang dipicu oleh pemberian pristan tersebut sehingga terjadi apoptosis sel-sel limfoid di dalam kavum peritoneal yang akan memulai perkembangan autoimunitas (Calvani et al., 2005). Pristan (Tetramethylpentadecane/TMPD) merupakan alkalin isoprenoid yang terdapat pada tumbuhan dan organisme laut (alga, plankton) yang dapat menginduksi SLE pada hewan bila diberikan secara intraperitoneal. Pristan dapat memicu autoantibodi dan manifestasi klinis SLE (Calvani et al., 2005). Injeksi pristan intraperitoneal pada mencit BALB/c akan mengakibatkan glomerulonefritis, arthritis, ANA dan berbagai autoantibodi lupus seperti anti-dsDNA dan anti-Sm. Produksi autoantibodi karena pristan ini melalui jalur signal IFN 1 yang merupakan mediator kunci SLE dan menghubungkan respon imun innate dan adaptif. Peningkatan IFN 1 terjadi pada pasien SLE (Reeves et al., 2009).
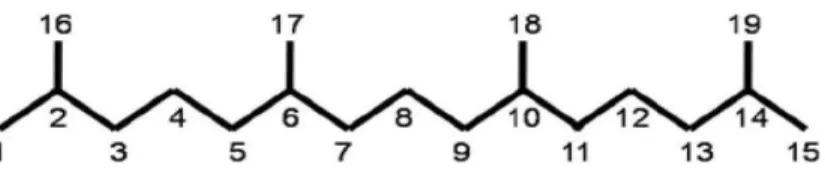
Gambar 5. Struktur kimia pristan (2,6,10,14-tetramethylpentadecane) (Reeves et al, 2009)
19
Imunoglobulin G antoantibodi yang diinduksi pristan berhubungan dengan SLE, dengan target komponen inti sel yaitu ds DNA, single-stranded DNA, kromatin, Sm, RNP dan ribosomal P. Pristan memicu produksi IFNα dan IFNß oleh monosit imatur (Ly6Chi). Injeksi pristan intrapritoneal akan memicu produksi MCP-1 (CCL2), kemokin yang menginduksi produksi IFN 1 dan menyebabkan keluarnya monosit imatur dengan penanda permukaan sel CD11b, Ly6Chi, Mac-3, F4/80, dan CCR2 dari sumsum tulang menuju kavum peritoneum. Gambar 6 menunjukkan mekanisme pristan menginduksi lupus (Reeves et al., 2009).
Gambar 6 . Mekanisme pristan menginduksi lupus (Reeves et al., 2009) 2.1.5. Secretome sel punca mesenkimal
Sel punca merupakan sel tubuh yang memiliki kemampuan istimewa memperbaharui atau meregenerasi diri sendiri dan berdiferensiasi menjadi sel
20
lain, sehingga dapat membentuk jaringan dan organ (Hui et al., 2012). Sel punca mesenkimal merupakan prototipe sel punca dewasa yang mempunyai kapasitas memperbarui diri dan berdiferensiasi dengan jaringan distribusi yang luas (Williams dan Hare, 2011). Sel punca messenkimal diidentifikasi di sumsum tulang dan dapat dimurnikan dari berbagai jaringan seperti adiposa (Madrigal et al, 2014), jantung (Hoogduijn et al, 2007), Wharton 's jelly tali pusat (Chao et al, 2008), darah haid (Meng et al, 2007) dan vili korionik (Yang et al, 2013), darah perifer (He et al, 2007). Sel tersebut dapat dikembangkan luas secara in vitro untuk digandakan sampai 50 sel tanpa diferensiasi (Carrion dan Figueroa, 2011).
Sel punca mesenkimal dapat menghindar dari pengenalan sel T, menekan respon sel T terhadap mitogen dan memperpanjang survival skin graft pada babon. Ini ditemukan pada penelitian oleh Bartholomew tahun 2002. Meskipun memiliki efek imunomodulasi yang beragam dan kemudian terbukti mempengaruhi limfosit T dan B, natural killer dan APC, sel punca mesenkimal bersifat hipoimunogenik (Carrion dan Figueroa, 2011).
Sel punca mesenkimal menghasilkan sejumlah besar faktor yang disekresikan seperti sitokin, kemokin dan faktor pertumbuhan yang memediasi beragam fungsi melalui sinyal antara berbagai tipe sel. Di dalam niche, sel punca mesenkimal mengendalikan survival, proliferasi dan diferensiasi sel punca, juga berperan dalam regenerasi jaringan baik secara lokal maupun jarak jauh. Mediator terlarut tersebut dapat bertindak secara langsung, memicu mekanisme intraseluler pada sel yang cedera atau secara tidak langsung memicu sekresi mediator aktif
21
oleh sel-sel di sekitarnya (Maumus et al., 2013). Aktivitas memodulasi penyakit oleh sel punca mesenkimal karena produk yang disekresikan oleh sel punca tersebut (Madrigal et al, 2014). Efek parakrin ini pertama kali diamati pada mencit model penyakit jantung, sel punca mesenkimal sumsum tulang disuntikkan ke infark jantung tidak berdiferensiasi menjadi kardiomiosit secara fisiologis dalam kondisi in vivo (Murry et al, 2004). Sel punca mesenkimal yang diberikan dengan cara injeksi intravena, sebagian dari sel punca tersebut didapatkan di paru-paru dan jantung dan hanya sebagian kecil memasuki jaringan patologi yang rusak di jantung (Wang et al, 2012). Lee (2009) menunjukkan efek anti-inflamasi dan pengurangan ukuran infark jantung merupakan akibat dari sekresi sel punca. Pada mencit model kandung kemih hiperaktif, sel punca mesenkimal tidak tertanam ke dalam kandung kemih yang rusak, tetapi meningkatkan ekspresi gen sel (Song et al, 2014).
Penelitian eksperimental dan uji klinis telah membuktikan bahwa manfaat sel punca mesenkimal sebagian besar bergantung pada faktor pertumbuhan dan sitokin, dan bukan karena transplantasi sel (Gallina et al., 2015). Faktor regulasi yang disekresikan oleh sel punca messenkimal terdiri dari faktor pertumbuhan, sitokin dan kemokin. Sel punca mesenkimal tidak hanya mensekresi faktor regeneratif namun juga faktor akibat respon terhadap stimulus. Kondisi hipoksia, penambahan rangsang inflamasi, dan penumbuhan sel kultur dalam bidang 3 dimensi akan merangsang sekresi dari faktor terapi sesuai yang diharapkan (Madrigal et al., 2014).
22
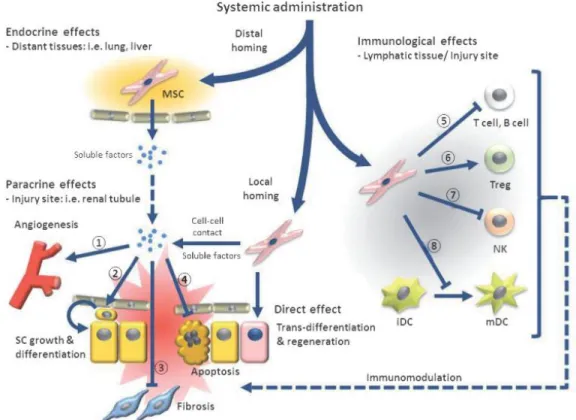
Gambar 7. Pemberian sistemik sel punca mesenkimal menimbulkan efek jauh / lokal Sel punca mesenkimal yang diberikan kondisi hipoksia akan mensekresi berbagai mediator terapeutik parakrin. Kondisi hipoksia tersebut mengakibatkan keluarnya VEGF, Fibroblast Growth Factor 2 (FGF-2), Hepatocyte Growth Factor (HGF), Insulin like Growth Factor-1 (IGF-1) melalui jalur NFκB. Kondisi hipoksia juga menambah aktifitas imunomodulator (Madrigal et al, 2014).
Pemberian secara sistemik sel punca mesenkimal akan menimbulkan efek jauh atau efek lokal (parakrin) meliputi angiogenesis, diferensiasi dan pertumbuhan sel, hambatan fibrosis dan hambatan apoptosis. Efek imunomodulasi
23
yaitu : supresi sel T dan sel B, diferensiasi sel T, inhibisi sel NK, inhibisi maturasi sel dendritik, seperti ditunjukkan gambar 6 (Carrión dan Figueroa, 2011).
VEGF merupakan modulator kunci angiogenesis, proliferasi sel endotel dan migrasi, kemotaksis, dan permiabilitas kapiler, yang diregulasi dalam sejumlah kondisi fisiologis dan patologis yang berhubungan dengan hipoperfusi dan/atau hipoksia. VEGF bekerja sebagai molekul anti-apoptosis dengan menekan p53 yang dimediasi apoptosis oleh aktivasi FAK (focal adhesi kinase), dan juga dengan mempromosikan Bcl-2 dan A1 (Tachi et al, 2008).
HGF sebagai anti apoptotis dengan menghambat peningkatan jumlah sel B, ekspresi MHC kelas II oleh sel B dan IgG serum serta anti-DNA. Terapi menggunakan HGF akan menurunkan ekspresi IL4, ekspansi sel B, dan produksi autoantibodi. Sehingga terapi HGF ini menghambat penyakit lupus dengan inhibisi pada sel Th2. Mekanisme HGF menghambat Th2 masih belum diketahui secara pasti. Mekanisme yang mungkin adalah HGF menekan ekspresi MHC kelas 2 oleh sel B sehingga mengurangi presentasi APC ke sel T CD4+. (Kuwoira et al, 2006). Mekanisme lain adalah menekan sel dendritik, induksi fenotip sel CD4+ yang memproduksi IL-10 dan TGF β (Okunishi et al, 2007).