BIO 30271 PTA PRAKTIKUM MIKROBIOLOGI 2011/2012
Drs. IMAN SANTOSO, M. Phil. FMIPA UI
Dra. SITARESMI, M. Sc.
LAPORAN PRAKTIKUM MIKROBIOLOGI PEMERIKSAAN AIR
NAMA : FURKAN NPM : 0906632890 KELOMPOK : II (DUA) B
TANGGAL PRAKTIKUM : 21 DESEMBER 2011 ASISTEN : NUR EL FADHILA
SEYLA FENINA
UNIVERSITAS INDONESIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM DEPARTEMEN BIOLOGI
DEPOK 2011
PEMERIKSAAN AIR
I. TUJUAN
1. Mengetahui cara pengambilan sampel air. 2. Mengetahui kualitas air.
3. Membuktikan keberadaan coliform dalam sampel air.
II. TEORI
Air merupakan materi esensial di dalam kehidupan. Tidak satu pun makhluk hidup di dunia ini tidak memerlukan atau tidak mengandung air. Salah satu peranan air dalam kehidupan adalah sebagai air minum, keperluan memasak, mencuci, dan lain sebagainya. Sebelum dapat digunakan air harus dalam kondisi yang baik (bersih). Menurut Peraturan Menteri kesehatan Republik Indonesia No. 416/MENKES/PER/IX/1990 ada beberapa persyaratan air bersih sebagai berikut : 1. Persyaratan fisik
Kualitas fisik yang harus dipertahankan bukan hanya semata-mata dengan pertimbangan dari segi kesehatan saja akan tetapi juga menyangkut keamanan dan dapat diterima oleh masyarakat pengguna air dan mungkin pula menyangkut segi estetika.
2. Persyaratan kimiawi
Kandungan unsur kimia di dalam air harus mempunyai kadar dan tingkat konsentrasi tertentu yang tidak membahayakan kesehatan manusia atau mahluk hidup lainnya, pertumbuhan tanaman, atau tidak membahayakan kesehatan pada penggunaannya dalam industri serta tidak minumbulkan kerusakan-kerusakan pada instalasi sistem penyediaan air minumnya sendiri. Beberapa unsur tertentu, sebaliknya diperlukan dalam jumlah yang cukup untuk penciptaan suatu kondisi air minum yang dapat mencegah suatu penyakit atau kondisi kualitas yang menguntungkan.
Dalam hubungannya dengan masalah kualitas kimiawi tersebut di atas pada dasarnya unsur-unsur kimiawi dapat dibedakan atas 4 golongan:
Unsur-unsur yang bersifat racun.
Unsur-unsur tertentu yang dapat mengganggu kesehatan.
Unsur-unsur yang dapat menimbulkan gangguan pada sistem atau penggunaannya untuk keperluan atau aktivitas manusia.
Unsur-unsur yang merupakan indikator pengotoran. 3. Persyaratan bakteriologi
Dalam persyaratan ini ditentukan batasan tentang jumlah bakteri pada umumnya dan khususnya bakteri penyebab penyakit (E. coli)
(Menkes RI).
Istilah mikroorganisme indikator (bioindikator) yang digunakan dalam analisis air mengacu pada sejenis mikroorganisme yang kehadirannya di dalam air merupakan bukti bahwa air tersebut terpolusi oleh bahan tinja dari manusia atau hewan berdarah panas, artinya terdapat peluang bagi berbagai macam
mikroorganisme patogen yang secara berkala terdapat di dalam saluran pencernaan, untuk masuk ke dalam air tersebut (Pelczar & Chan 1988: 873).
Walaupun sejumlah besar penyakit tersebut dapat dideteksi, namun pada umumnya, seorang ahli mikrobiologi lingkungan menggunakan mikroorganisme indikator sebagai indeks kontaminasi air oleh patogen. Para peneliti masih mencari indikator yang ideal, yang digunakan untuk mikrobiologi sanitasi. Kriteria yang harus dimiliki oleh mikroorganisme indikator antara lain:
1. Mikroorganisme indikator terdapat dalam air yang terpolusi, tetapi tidak ada pada air yang dapat diminum.
2. Mikroorganisme indikator harus sesuai untuk analisis dari segala jenis air, seperti: air sungai, air tanah, limbah, air keran, dan air laut.
3. Mikroorganisme indikator ada jika patogen enteric juga ada.
4. Mikroorganisme indikator harus memiliki kemampuan hidup yang lebih lama daripada mikroorganisme patogen.
5. Mikroorganisme indikator tidak berbahaya bagi manusia dan tidak menimbulkan suatu patogenisitas.
7. Jumlah mikroorganisme indikator lebih banyak daripada patogen, dan tergantung dari tingkat polusi air.
8. Indikator mikroorganisme mudah dideteksi dengan metode pengujian yang sederhana.
9. Prosedur pengujian mikroorganisme indikator memiliki spesifisitas yang besar, dengan kata lain, mikroorganisme-mikroorganisme yang lain tidak memberikan hasil yang positif. Prosedur tersebut memiliki sensitivitas yang tinggi dan dapat mendeteksi mikroorganisme indikator dalam kadar yang rendah.
(Prescott dkk. 1999: 876).
Tipe bakteri utama yang terdapat dalam air terpolusi adalah bakteri
coliform, termasuk di dalamnya bakteri gram negatif yang tidak mempunyai spora berbentuk basil (batang), yang biasanya ditemukan di dalam usus. Bakteri
tersebut melakukan fermentasi terhadap laktosa menjadi asam dan gas ketika diinkubasi selama 24--48 jam pada suhu 32 oC. Bakteri yang termasuk ke dalam grup tersebut adalah E. coli dan spesies-spesies dari Enterobacter. Bakteri dengan bentuk bukan coli (non coliform bacteria) yang juga ditemukan pada air tercemar adalah Streptococcus, Proteus, dan Pseudomonas (Alcamo 1984: 755).
Coliform, termasuk Escherichia coli, adalah anggota-anggota dari kelompok Enterobacteriaceae. Bakteri coliform terdapat sekitar 10% pada usus manusia dan hewan, serta ditemukan sebagai mikroorganisme indikator yang tersebar luas. Bakteri tersebut kehilangan viabilitasnya pada perairan tawar pada tingkat yang lebih rendah jika dibandingkan dengan bakteri patogen yang hidup di saluran pencernaan. Jika bakteri enteric tersebut tidak ditemukan pada volume air yang spesifik (100 ml), hal itu menunjukkan bahwa air bersifat potable, atau dapat dipakai untuk konsumsi manusia (Prescott dkk. 1999: 876).
Bakteri-bakteri yang termasuk ke dalam kelompok coliform antara lain adalah Escherichia coli, Enterobacter aerogenes, dan Klebsiella pneumoniae. Ciri-ciri bakteri coliform adalah gram negatif, berbentuk batang, tidak membentuk spora bersifat aerob atau anaerob fakultatif, dan dapat menfermentasi laktosa dengan menghasilkan asam dan gas dalam 48 jam pada suhu 35 oC. Salmonella
dan Shigella juga bersifat coliform, tetapi bersifat patogen dan tidak menfermentasi laktosa (Prescott dkk. 1999: 876).
Uji kualitas air dapat menggunakan metode membran filter dan metode Most Probable Number (MPN). Metode filter membran merupakan metode yang biasa digunakan untuk mengevaluasi karakterisitik air secara mikrobiologis. Metode tersebut terdiri dari beberapa tahap, yaitu:
1. Membran filter yang steril diletakkan pada saringan yang sebelumnya telah disterilkan.
2. Air yang diuji dituangkan ke suatu filter, disedot dengan pompa vakum, sehingga bakteri tersaring pada permukaan filter.
3. Filter yang berisi bakteri yang tersaring dipindahkan ke medium padat atau diletakkan pada absortive pad yang telah diberi medium yang sesuai.
4. Filter diinkubasi, koloni yang timbul dihitung dengan bantuan kaca pembesar. Penggunaan medium yang sesuai dapat mendeteksi jumlah coliform total, coliform fecal atau streptococci fecal dengan adanya koloni yang terbentuk. (Prescott dkk. 1999: 878).
Keuntungan metode filter membran adalah sampel yang digunakan cukup banyak sehingga dapat memberikan gambaran kualitas air yang benar, hasilnya cepat dan menghemat waktu, perkiraan secara kuantitatif beberapa jenis bakteri dapat dengan cepat diuji, dan filter dapat dipindahkan ke dalam medium yang berbeda. Kerugian metode tersebut adalah air dengan turbiditas tinggi dapat membatasi volume sampel, bakteri dengan populasi yang tinggi dapat
menyebabkan pertumbuhan yang berlebihan dan senyawa-senyawa logam dan fenol dapat ikut tersaring dan menghambat pertumbuhan bakteri (Prescott dkk. 1999: 878).
Bakteri coliform juga dapat dideteksi dengan teknik Multiple-Tube Fermentation yang disebut uji Most Probable Number. Tes tersebut dilakukan dengan cara menginokulasikan sampel bakteri ke dalam medium yang cocok untuk pertumbuhan bakteri. Jika sampel yang diinokulasi cukup, maka hasil akhir yang ingin dicapai adalah adanya bakteri coliform yang ada pada sampel. Hasil akhir tersebut digunakan untuk memperkirakan populasi coliform yang
Uji mikrobiologis terhadap bakteri-bakteri coliform, khususnya
Escherichia coli, sebagai parameter pencemaran dengan metode Most Probable Number (MPN) terbagi dalam 3 tahap utama, yaitu uji penduga (presumptive test), uji penguat (confirmed test) dan uji pelengkap (completed test) (Gandjar dkk. 1992: 68--69).
Tiga tahap analisis standar air bagi keberadaan bakteri coliform adalah: 1. Uji penduga (Presumptive test)
Uji untuk mendeterminasi kehadiran bakteri coliform dikenal dengan uji penduga. Uji tersebut ditunjukkan dengan menginokulasikan lactose broth yang berisi tabung durham dengan sejumlah sampel air. Tabung yang telah diinokulasi kemudian diinkubasi pada suhu 30 oC dan diamati terbentuknya gas dan asam atau tidak setelah 24 dan 48 jam. Terbentuknya gas dan asam setelah 24 jam
menunjukkan bahwa tes positif terhadap bakteri coliform dan merupakan bukti bahwa air terpolusi oleh kotoran (Sarles dkk. 1956: 278)
2. Uji penguat (Confirmed test)
Semua tabung fermentasi lactose broth yang menunjukkan adanya gas pada 24 atau 48 jam inkubasi pada suhu 30 oC digunakan pada uji penguat. Sejumlah medium Bile Green Lactose Broth (BGLB) dengan tabung durham di dalamnya diinokulasi satu ose biakan dari setiap tabung yang positif dan
diinkubasi pada suhu 35 oC dan 44,5 oC. Inokulasi juga dilakukan pada medium Endo Agar pada cawan petri dengan streak method (Gandjar dkk. 1992: 69). 3. Uji pelengkap (Completed test)
Uji dilakukan dengan memindahkan koloni coliform yang tipikal pada tabung durham dari lactose broth dan pada medium NA. Produksi gas pada lactose broth dan pertumbuhan dari bakteri batang Gram negatif yang tidak berspora pada medium agar miring merupakan bukti akhir adanya bakteri coliform pada air (Sarles dkk. 1956: 278). Jika pada percobaan timbul gas dan asam, morfologi bakteri berbentuk batang, hasil pengecatan Gram negatif, dan tidak membentuk spora, maka bakteri yang diisolasi dari biakan berwarna hijau metalik adalah Escherichia coli (Gandjar dkk. 1992: 70).
III. HASIL PENGAMATAN
Hasil pengamatan dapat dilihat pada lampiran.
IV. PEMBAHASAN
Sampel air yang digunakan berasal dari air sumur di daerah Kutek (air diambil melalui air keran masjid). Wilayah di sekitar sumber air adalah wilayah perumahan yang agak padat. Kelompok lainnya mengambil sampel air di beberapa titik lokasi di sekitar lingkungan UI, diantaranya Kober, jalan Pinang, danau, dan es batu dalas. Sampel air tidak diambil dari sumber PDAM, karena air PDAM sudah melalui berbagai macam tahap pengolahan yang menyebabkan mikroorganisme dalam air PDAM sudah sangat minim jumlahnya atau bahkan tidak ada sama sekali, sehingga jika praktikum yang dilakukan menggunakan air PDAM sebagai sampelnya, diperkirakan tidak akan menghasilkan apa-apa.
Sampel air dapat diambil melalui keran atau langsung dari sumbernya (danau, sungai, dll). Teknik pengambilannya pun berbeda, cara pengambilan air dari keran mula-mula kran dibuka, biarkan air mengalir 2-3 menit. Kemudian keran ditutup kembali. Mulut keran dipanaskan dengan nyala api secara langsung sampai sisa air yang ada di mulut keran menguap semua. Keran dibuka kembali dan air dibiarkan mengalir beberapa saat. Buka tutup botol sampel lalu panaskan mulut botol sampel dengan api, lalu isilah dengan air sampel sebanyak 100 ml. Lewatkan mulut botol di atas nyala api dan tutup kembali. Tujuan dari pemanasan mulut keran dan mulut botol sampel adalah supaya tidak ada pengaruh
kontaminasi dari lingkungan sekitar (Gandjar dkk. 1992: 67).
Cara pengambilan sampel dari danau adalah mula-mula botol steril diisi setengahnya dengan contoh air yang akan diperiksa, ditutup dan dikocok sampai merata, buang airnya dan botol ditutup kembali. Masukkan botol dalam keadaan tertutup ke dalam air, sedalam 20-30 cm dari permukaan. Buka tutup botol lalu isi botol sampai penuh, kemudian botol ditutup kembali (semua pekerjaan tersebut dilakukan di bawah permukaan air) (Gandjar dkk. 1992: 67).
Sampel air yang berasal dari air sumur Kutek mula-mula diamati secara makroskopik terlebih dahulu. Hasil yang didapat adalah air dari Kutek berwarna bening, berbau air normal (tidak berbau), dan memiliki pH 7. Sehingga secara makroskopis air tersebut tergolong layak untuk dijadikan sumber air minum.
Selanjutnya dilakukan pemeriksaan air menggunakan metode MTF (Multiple Tube Fermentation). Metode MTF dibagi menjadi 3 tahap, yaitu uji penduga, uji penguat dan uji pelengkap.
1. Uji Penduga (Presumptive Test)
Penginokulasian sampel pada uji penduga dibuat dalam 3 seri. Medium yang digunakan merupakan Enrichment medium, tujuannya adalah supaya mikroorganisme yang akan diuiji dapat berkembang dengan baik. Seri I terdiri dari 5 ml sampel air ke dalam 5 tabung medium Lactose Broth ganda, seri II terdiri dari 5 tabung medium Lactose Broth tunggal yang diinokulasikan 0,5 ml sampel, serta seri III terdiri dari 0,05 sampel yang diinokulasikan pada 5 tabung medium Lactose Broth tunggal. Hal tersebut dilakukan dengan asumsi bahwa jumlah mikroorganisme dalam air sampel 5 ml lebih banyak daripada sampel yang bervolume 0,5 dan 0,05 ml, sehingga laktosa yang digunakan sebagai
sumber nutrisi juga banyak. keseluruhan tabung tersebut diinkubasi pada suhu 37
o
C selama 24 jam (Gandjar dkk. 68).
Uji penduga bertujuan untuk mendeteksi adanya bakteri coliform. Reaksi positif ditunjukkan dengan terbentuknya asam yang menyebabkan medium berwarna merah berubah menjadi kuning dan juga terbentuk gas pada tabung durham (Gandjar dkk. 68). Hasil yang didapat dari uji penduga adalah semua sampel air menunjukkan hasil positif, yang berarti diduga air tersebut sudah tercemar oleh mikroorganisme. Tahap selanjutnya adalah melakukan uji penguat. 2. Uji Penguat (Confirmed Test)
Uji penguat dilakukan bertujuan untuk membuktikan dan memperkuat dugaan bahwa jenis bakteri yang terdapat pada sampel termasuk jenis coliform atau tidak, karena mikroorganisme lain juga dapat memfermentasi laktosa.
Biakan pada seluruh tabung reaksi dari uji penduga yang menunjukkan hasil positif diinokulasikan ke dalam medium Brilliant Green Lactose Bile Broth (BGLBB). BGLBB merupakan medium selektif, yang berarti hanya akan
ditumbuhi oleh bakteri tertentu saja. Perlakuan tersebut merupakan awal dari uji penguat. Medium BGLBB mengandung ekstrak empedu yang berfungsi
menghambat bakteri-bakteri yang menfermentasi laktosa selain bakteri coliform dan bakteri Gram positif yang lain. Setelah diinokulasikan, tabung-tabung itu diinkubasikan pada suhu 37 oC dan 44,5 oC, untuk memisahkan fecal coliform dan non fecal coliform. Suhu 44,5 oC mengindikasikan bahwa hanya coliform dari usus manusia dan hewan saja yang dapat tumbuh, oleh karena itu hasil positif yang pada tabung-tabung tersebut menunjukkan adanya coliform fecal, sedangkan suhu 37 oC mengindikasikan suhu optimum bakteri coliform yang berasal dari lingkungan untuk melakukan pertumbuhan (Volk & Wheller 1993: 261--262). Pengamatan setelah 24 jam menunjukkan hasil positif adanya coliform lingkungan pada sampel air dai es batu dalas, air Kutek, dan danau kel.3.
Sedangkan air tanah jalan pinang dan air tanah kober menunjukkan hasil negatif baik coliform faecal atau lingkungan. Sedangkan danau kel.6 menunjukkan hasil positif di kedua jenis coliform.
Tahap kedua dari uji penguat menggunakan medium Endo Agar, dan dilakukan dengan menginokulasikan sampel yang positif medium Endo Agar dengan cara streak. Medium Endo Agar bertindak sebagai medium selektif, yang berfungsi untuk membedakan jenis-jenis bakteri coliform. Bila pada medium Endo Agar tumbuh koloni bakteri berwarna hijau metalik, maka bakteri tersebut adalah Escherichia coli. Bila koloni berwarna merah muda atau bukan hijau metalik, maka koloni bakteri tersebut adalah selain E. coli (Klebsiella atau Enterobacter ). Warna hijau metalik dari E. coli timbul karena hasil fermentasi laktosa yang menghasilkan asetaldehid. Senyawa asetaldehid tersebut akan membebaskan fuchsin dari kompleks fuchsin sulfite yang ada di dalam medium Endo Agar. E. coli dapat mereaksikan fuchsin dengan keras sehingga akan terjadi kristalisasi fuchsin yang berwarna hijau metalik (Salle 1961: 555).
Berdasarkan hasil pengamatan pada medium Endo Agar, bakteri yang terdapat pada sampel air Kutek dan danau kel.3 merupakan jenis Escherichia coli. Hal tersebut ditandai dengan koloni yang berwarna hijau metalik. Sampel yang berasal dari air di lokasi lainnya menampakkan pertumbuhan koloni bakteri yang
berwarna pink, yang berarti bahwa bakteri tersebut bukan Escherichia coli, melainkan bakteri coliform lainnya.
3. Uji Pelengkap (Completed Test)
Uji pelengkap dilakukan untuk melihat morfologi bakteri coliform, dengan cara melakukan pengecatan gram pada bakteri tersebut, baik pada Escherichia coli maupun bakteri coliform lainnya. Hasil yang diperoleh dari pengecatan gram adalah bakteri yang diperoleh dari kedua sampel positif (berwarna hijau metalik) menampakkan morfologi yang sama, yaitu bakteri berbentuk batang pendek, tidak berspora dan berwarna merah (bakteri Gram negatif). Hal tersebut sesuai dengan literatur yang menyatakan bahwa uji pelengkap memberikan hasil yang positif bila hasil pengecatan menunjukkan morfologi bakteri berbentuk batang, termasuk Gram negatif dan tidak membentuk spora (Prescott dkk. 1999: 877). Namun, pada praktikum yang dilakukan tidak sampai pada uji pelengkap.
V. KESIMPULAN
1. Pengambilan sampel dilakukan dengan menggunakan botol steril, mewakili air yang akan diuji dan diusahakan agar terhindar dari kontaminasi
mikroorganisme lainnya.
2. Kualitas air dapat diketahui dengan uji MTF. Sampel air dari lokasi jalan Pinang dan Kober adalah air dengan kualitas baik dibandingkan dengan air dari lokasi lainnya.
3. Sampel air dari lokasi Kutek, danau (kel.3), dan es batu dalas mengandung coliform lingkungan dan sampel air dari lokasi danau (kel.6) mengandung coliform lingkungan dan faecal.
VI. DAFTAR ACUAN
Alcamo, I.E. 1984. Fundamental of microbiology. Addison Wesley Publishing Company, Inc., Kanada: xxvii + 834 hlm.
Gandjar, I., I.M. Koentjoro, W. Mangunwardoyo, & L. Soebagya. 1992. Pedoman praktikum mikrobiologi dasar. Jurusan Biologi FMIPA UI, Jakarta: vii + 87 hlm.
McKane, L. & J. Kandel. 1996. Microbiology: Essentials and application. Ed. ke-2. McGraw-Hill, Inc., New York: xxviii + 843 hlm.
Menkes RI. 1990. Peraturan Menteri kesehatan Republik Indonesia. http://ksrpmiunhas.or.id/artikel/item/193-beberapa-syarat-air-bersih-menurut-menkes-ri. 30 Desember 2011, pk. 21.25.
Pelczar, M.J. & E.C.S. Chan. 1988. Dasar-dasar mikrobiologi. Terj.dari Elements of microbiology, oleh Hadioetomo, R.S., T. Imas, S.S. Tjitrosomo, & S.L. Angua. UI Press, Jakarta: viii + 997 hlm. Prescott, L.M. , J.P. Harley & D.A. Klein. 1999. Microbiology. Ed. Ke-4.
McGraw-Hill, Boston: xxvi + 962 hlm.
Salle, A. J. 1961. Fundamental principles of bacteriology. Ed. Ke-5. McGraw Hill Book Company, Inc., New York: viii + 812 hlm.
Sarles, W.B., W.C. Frazier, & J.B. Ford. 1956. Microbiology. Ed. Ke-2. Harper & Brothers., New York: xi + 491 hlm.
Volk, W.A. & M.F. Wheeler. 1993. Mikrobiologi dasar I. Terj. dari Basic microbiology, oleh Markham. Erlangga, Jakarta: xii + 396 hlm.
LAMPIRAN
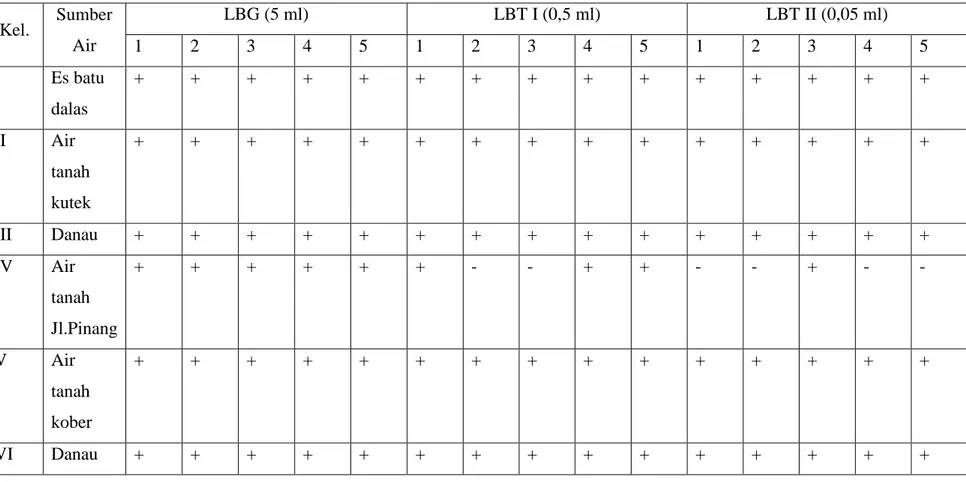
Tabel 1. Hasil pengamatan uji penduga (24 jam)
Kel. Sumber Air LBG (5 ml) LBT I (0,5 ml) LBT II (0,05 ml) 1 2 3 4 5 1 2 3 4 5 1 2 3 4 5 I Es batu dalas + + + + + + + + + + + + + + + II Air tanah kutek + + + + + + + + + + + + + + + III Danau + + + + + + + + + + + + + + + IV Air tanah Jl.Pinang + + + + + + - - + + - - + - - V Air tanah kober + + + + + + + + + + + + + + + VI Danau + + + + + + + + + + + + + + + 11
Tabel 2. Hasil pengamatan uji penguat I dengan medium BGLB Kel Suhu 35 o C Suhu 44,5oC LBG (5 ml) LBT I (0,5 ml) LBT II (0,05 ml) LBG (5 ml) LBT I (0,5 ml) LBT II (0,05 ml) I + + + + + + + + + + + + + + + - - - - II + + + + + + + + + + + + + + + + + + + + + + + + + + + + + + III + + + + + + + + + + + + + + + - - - - IV - - - - V - - - - VI + + + + + + + + + + + + + + + + + + + + + + + + + + + + + +
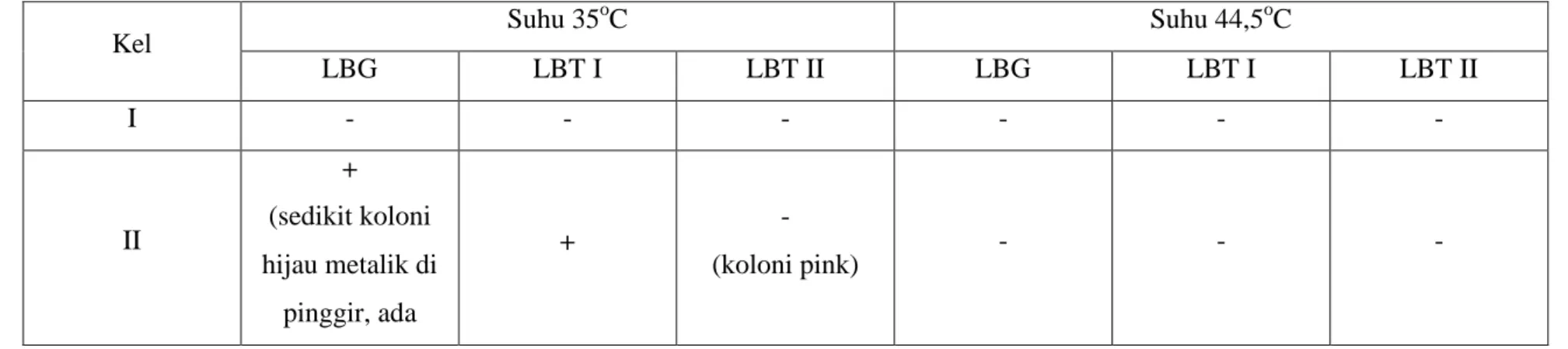
Tabel 3. Hasil pengamatan uji penguat II dengan medium Endo Agar
Kel Suhu 35 o C Suhu 44,5oC LBG LBT I LBT II LBG LBT I LBT II I - - - - II + (sedikit koloni hijau metalik di pinggir, ada + - (koloni pink) - - -
koloni pink) III - - + - - - IV - - - - V - - - - VI - - - - Keterangan:
- : tidak ada koloni hijau metalik (E. coli) + : ada koloni hijau metalik (E.coli)
Gambar 1. Hasil positif (hijau metalik) [Sumber: Dokumentasi pribadi]
Gambar 2. Hasil negatif (pink) [Sumber: Dokumentasi pribadi].
![Gambar 1. Hasil positif (hijau metalik) [Sumber: Dokumentasi pribadi]](https://thumb-ap.123doks.com/thumbv2/123dok/1907037.3004678/15.892.250.634.182.471/gambar-hasil-positif-hijau-metalik-sumber-dokumentasi-pribadi.webp)