II TINJAUAN PUSTAKA
2.1 Klasifikasi dan Morfologi
Tripneustes gratilla adalah bulubabi yang termasuk dalam phylum
Echinodermata dengan klasifikasi sebagai berikut: Phylum : Echinodermata
Klass : Echinoidea Ordo : Temnopleuroida Famili : Toxopneutidae Spesies : Tripneustes gratilla
Gambar 1 Bulubabi Tripneustes gratilla.
Secara morfologi bulubabi dibagi ke dalam dua kelompok, yaitu; kelompok reguler dan kelompok irregular (Jenkins 2002; Aslan 2005). Kelompok reguler adalah kelompok bulubabi yang memiliki bentuk tubuh
hemisfer, membulat di bagian atas dan merata di bagian bawah. Hewan ini
memiliki duri yang panjang dan kadang berwarna menyolok. Kelompok irreguler adalah kelompok bulubabi yang memiliki bentuk tubuh yang memipih, misalnya: bulu hati dan dolar pasir.
Beberapa jenis bulubabi reguler terbagi ke dalam beberapa ordo, yaitu: ordo Arbacioida, ordo Temnopleuroida, dan ordo Echinoida (Aslan 2005). Karakteristik dari ordo Arbacioida adalah periprok (area sekeliling anus) memiliki
4 atau 5 keping (plate) berukuran besar. Ordo Arbacioida hanya terdiri dari satu famili yaitu Arbaciidae. Hidup pada habitat bersubstrat keras dan terlindung dari ombak besar. Bergerak pada malam hari dan hidup pada ganggang yang mengandung kalkareus, contohnya: Arbacia lixula. Ordo Temnopleuroida terdiri dari 2 famili, yaitu: (1) famili Temnopleuridae memiliki ukuran tubuh yang kecil dan diameter cangkang 6 – 7 mm dan berduri pendek, dan (2) famili Toxopneustidae, tergolong ke dalam famili bulubabi yang dapat dikonsumsi, contohnya: Lytechinus variagatus, Toxopneutes pileolus (sangat mudah dikenali memiliki pedicellaria berukuran besar), dan Tripneustes gratilla. Ordo Echinoida terdiri dari 3 famili, yaitu: (1) famili Echinoidae, termasuk famili dari bulubabi yang dapat dikonsumsi, contoh: Echinus esculentus, Paracentrotus lividus; (2) famili Echinometridae, termasuk famili dari bulubabi yang dapat dijadikan bulubabi hias, contoh: Echinometra spp., Echinometra viridis, Echinometra
lucunter, Echinometra oblonga, dan Echinometra vanbrunti; (3) famili
Strongylocentroidae, termasuk famili dari bulubabi yang dapat dikonsumsi, contoh: Strongylocentrotus droebachiensis, S. Franciscanus, dan S. Purpuratus. Beberapa bulubabi yang dapat dikategorikan sebagai bulubabi ekonomis penting adalah: Diadema setosum, Tripneustes gratilla, Toxopneustes pileolus, Echinotrix
calamaris, Mespilia globulus, Heterocentrotus mammilatus, Salmacis belli, dan Echinometra spp. (Aslan 2005).
Bulubabi Tripneustes gratilla memiliki karakter warna tubuh yang didominasi oleh warna oranye, putih dan coklat, sehingga nampak indah. Bulubabi ini di Indonesia umumnya hidup di padang lamun dan jarang ditemukan pada pantai berkarang atau bebatuan. Gonadnya sangat enak dimakan serta bernilai ekonomis penting karena dijual hingga ke manca negara. Bulubabi ini dijadikan salah satu bulubabi hias karena keindahannya (Aslan 2005). Jenis bulubabi Tripneustes gratilla berdiameter 10 cm dan tinggi 6 cm, mempunyai daerah penyebaran yang luas mulai India hingga perairan Pasifik sebelah barat.
Pada cangkang bulubabi terdapat 5 segmen ambulakral dengan barisan kaki tabung dan 5 segmen interambulakral tanpa kaki tabung. Segmen tersebut tersusun secara berselang seling (Jenkins 2002; Aslan 2005).
Mulut terletak tepat di tengah dari sisi aboral tubuh. Organ ini dikelilingi oleh kaki tabung yang berguna membantu dalam bergerak dan menjaga stabilitas tubuh khususnya saat makan dan saat berada di substrat /tidak melaksanakan aktivitas pergerakan. Bagian mulut dan gigi merapat jadi satu dan dilekatkan oleh bahan kapur membentuk struktur yang dinamakan lentera aristoteles (Romimohtarto dan Juwana 2005). Lentera aristoteles terdapat di bagian tengah aboral. Organ ini berfungsi untuk merumput pada substrat. Lentera aristoteles dilengkapi oleh 5 pasang gigi yang tajam pada bagian ujungnya. Gigi-gigi ini apabila rusak maka akan tumbuh kembali. Semua bagian dari lentera aristoteles ini dapat dijulurkan atau dimasukkan secara fleksibel ke dalam mulut khususnya pada saat merumput (Aslan 2005).
Anus terletak di bagian tengah dari sisi aboral tubuh berdekatan dengan madreporit (tempat masuknya air laut ke dalam tubuh dan berperan dalam sistim pembuluh air) dan gonopor. Pada bulu hati, sebagai kekecualian, anusnya terletak antara sisi atas dan sisi bawah, di ujung berlawanan dengan mulut.
2.2 Reproduksi Bulubabi
Bulubabi adalah organisme dioecious. Bulubabi bentuk regular mempunyai 5 lobul gonad. Gonad berukuran besar saat matang dan memanjang dari pusat aboral ke lentera (Jenkins 2002). Gonad ditutupi oleh lipatan-lipatan epitelium perivisceral dari bagian inter ambulakral pada separuh apikal rongga tubuh. Setiap lobul gonad memiliki sebuah saluran gonad (gonaduct) yang terbuka ke bagian luar melalui sebuah lubang genital (Fuji 1960). Contoh gonad primer disajikan pada Gambar 2.
Semua jenis bulubabi sangat unik dalam hal seksnya (unisexual). Struktur kelamin jantan dan betina hampir sama, sehingga perbedaan jenis kelamin hampir tak nampak morfologisnya akibat sifatnya dimorfisme (Yamaguchi 1991). Rasio individu jantan dan betina bulubabi secara umum adalah 1:1 (Aslan 2005).
Gambar 2 Gonad primer bulubabi Stronggylocentrotus intermedius (Fuji 1960)
Keterangan: Ac ; acinus , Gd; gonaduct.
Sperma dan telur dilepaskan ke laut, dan fertilisasi terjadi secara eksternal (Fuji 1960; Jenkins 2002). Setelah pembuahan, telur akan mengalami proses perkembangan embrio yang diawali oleh pembelahan sel dari 2 hingga 64 sel, dan berlanjut hingga mencapai tahap blastula dan gastrula (Aslan 2005). Setelah menetas, larva berkembang berbentuk prisma. Tangkai memanjang dan membentuk empat lengan pada larva awal pluteus dengan sepasang lengan antero lateral dan sepasang lengan postero oral. Pada tahap pluteus dengan enam lengan, terbentuk lengan postero dorsal, dan pada tahap pluteus dengan delapan lengan, bagian cangkang, kaki tabung primitif, dan duri terbentuk. Metamorfosis dimulai dengan munculnya primordium bulubabi dan berakhir dengan perkembangan anus dan mulut dengan perubahan dari bentuk pelagik menjadi bentik setelah metamorfosis (Yamaguchi 1991).
2.3 Perkembangan Gonad
Selama perkembangan gonad berlangsung akan terjadi perubahan-perubahan, baik secara kuantitatif maupun secara kualitatif. Perubahan yang terjadi pada gonad secara kuantitatif dapat dinyatakan dengan suatu indeks yang dinamakan gonad somato indeks (Effendie 1997). Nilai gonad somato indeks akan
mencapai batas maksimum pada saat akan terjadi pemijahan dan akan menurun sesudah pemijahan. Selain itu, distribusi ukuran diameter telur pada bulubabi betina, dapat pula menunjukkan tahapan-tahapan perkembangan gonad (Lango-Reynoso et al. 2000) dan interval pemijahan pada ikan yang memijah secara bertahap (partial spawner). Perubahan gonad secara kualitatif dapat dinyatakan dengan pengamatan histologi dan morfologi gonad. Perubahan-perubahan yang terjadi pada perkembangan gonad dikelompokkan ke dalam tingkatan kematangan gonad.
Tahapan-tahapan selama perkembangan gonad bulubabi Evechinus
chloroticus menurut Brewin et al. (2000) diacu dalam Lamare et al. (2002) dan
Fuji (1960), digambarkan sebagai berikut:
Oogenesis
Tahap I (recovery/pemulihan): ovari terdiri dari oosit primer gelap ( diameter <25 μm ), menempel pada dinding ascinal. Sisa-sisa oosit berwarna gelap berada di antara pagosit nutritif.
Tahap II (growing /perkembangan): ovari didominasi oleh pagosit nutritif, dengan oosit vitelogenik awal ( diameter 25 – 70 µm) menempel pada dinding ascinal. Kelimpahan material sisa-sisa oosit menurun.
Tahap III (pre-mature): Kelimpahan pagosit nutritif menurun selama vitelogenesis berlanjut. Ovari terdiri dari oosit pada semua tingkatan perkembangan (diameter 25 – 100 μm). Sejumlah kecil ova yang matang terlepas dari dinding ascinal dan terpusat pada lumen ovari.
Tahap IV (mature / pre-spawning): Ovari didominasi oleh ova yang matang (diameter 100 µm). Tertutup dalam lumen. Pagosit nutritif tidak ada atau sebagian kecil bergabung dengan oosit primer di sepanjang dinding ascinal.
Tahap V (partially spawned): Ova matang kurang padat dalam lumen mengikuti permulaan pelepasan ova. Vitelogenesis penuh dan oosit premature dan pagosit nutritif tidak ada atau bergabung dengan dinding ascinal dalam jumlah kecil.
Tahap VI (spent / post-spawning): Ovari kosong, mengandung hanya sejumlah kecil sisa sisa oosit. Dinding ascinal tipis dengan sejumlah kecil oosit primer disekitar peripheri ovari. Kelimpahan pagosit nutritif meningkat disekitar periferi ovari dengan sisa-sisa oosit pagositosis yang nyata.
Spermatogenesis
Tahap I (recovery): Testis didominasi warna pucat, pagosit nutritif, butiran material nutritif yang berwarna gelap. Lapisan spermatogonia tipis (< 50 μm) dan spermatosit primer menempel pada epitelium germinal. Sisa-sisa spermatozoa berada dalam lumen.
Tahap II (growing/ perkembangan): Pagosit nutritif dominan dalam testes, namun frekuensi butiran material nutritif menurun. Ketebalan lapisan spermatogonia dan spermatosit primer meningkat (50 – 100 µm), dengan kolom spermatofor memanjang ke arah lumen.
Tahap III (pre mature): Kelimpahan pagosit nutritif terhalau ke periferal karena lapisan spermatogonial menebal (100 – 120 μm). Kolom spermatosit bertambah panjang dan memanjang ke bagian lumen, dan akumulasi spermatozoa terpusat di dalam lumen testes.
Tahap IV (mature / pre-spawning): Testes didominasi oleh kumpulan spermatozoa padat tanpa pagosit nutritif atau hanya berupa lapisan periferal tipis. Ketebalan lapisan spermatogonial menurun (70 – 100 μm) karena spermatogenesis berakhir. Tahap V (partially spawned): Kepadatan spermatozoa menurun mengikuti permulaan pemijahan dengan ruang kosong yang jelas terlihat di dalam lumen.
Ketebalan epitelium germinal terus menurun (25 – 70 µm) sedangkan lapisan periferal pagosit nutritif mulai bertambah tebal.
Tahap VI (spent / post spwning): Testes didominasi oleh lumen besar yang kosong yang terdiri dari sejumlah kecil sisa-sisa spermatozoa. Dinding ascinal sangat tipis (<25 µm), sedang lapisan pagosit nutritif terus bertambah tebal.
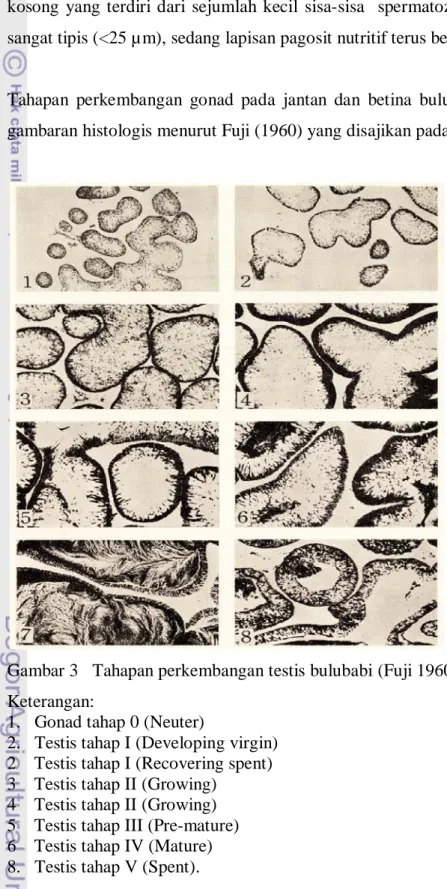
Tahapan perkembangan gonad pada jantan dan betina bulubabi diperjelas pada gambaran histologis menurut Fuji (1960) yang disajikan pada Gambar 3 dan 4.
Gambar 3 Tahapan perkembangan testis bulubabi (Fuji 1960). Keterangan:
1. Gonad tahap 0 (Neuter)
2. Testis tahap I (Developing virgin) 2 Testis tahap I (Recovering spent) 3 Testis tahap II (Growing)
4 Testis tahap II (Growing) 5 Testis tahap III (Pre-mature) 6 Testis tahap IV (Mature) 8. Testis tahap V (Spent).
Gambar 4 Tahapan perkembangan ovari bulubabi (Fuji 1960). Keterangan:
9. Ovari tahap I (Developing virgin) 10. Ovari tahap I (Recovering spent) 11. Ovari tahap II (Growing)
12. Ovari tahap III (Pre-mature) 13. Ovari tahap IV (Mature) 14 Ovari tahap V (Spent).
2.4 Kebutuhan Protein dan Rasio Energi Protein
Jaringan ikan mengandung sekitar 65 – 75% protein dalam bobot kering. Protein adalah nutrien yang sangat dibutuhkan untuk pemeliharaan tubuh; pembentukan jaringan; penggantian jaringan tubuh yang rusak; dan penambahan protein tubuh dalam proses pertumbuhan. Dalam proses reproduksi, protein merupakan faktor utama dalam menyokong perkembangan gonadal. Pakan yang mengandung atau menggunakan sumber protein nabati ataupun hewani dapat mempengaruhi komposisi biokimia gonad dan produksi gonad. Kandungan protein pakan akan mempengaruhi kandungan protein gonad yang ditandai dengan peningkatan ukuran pagosit nutritif yang berkapasitas sebagai penyimpan protein
(Schlosser et al. 2005). Untuk tujuan tersebut banyak faktor yang mempengaruhi, yaitu: jumlah dan jenis asam-asam amino esensial; kandungan protein yang dibutuhkan; kandungan energi pakan; dan faktor fisiologis ikan. Protein juga dapat digunakan sebagai sumber energi jika kebutuhan energi dari lemak dan karbohidrat tidak mencukupi dan juga sebagai penyusun utama enzim, hormon, dan antibodi.
Setiap spesies bulubabi membutuhkan kadar protein yang berbeda untuk pertumbuhannya dan dipengaruhi oleh umur/ukuran bulubabi. Kebanyakan pakan bulubabi mengandung 20 – 40% protein (Schlosser et al. 2005). Akiyama et al. (2001) mendapatkan kadar protein 20 % optimal untuk pertumbuhan bulubabi
Pseudocentrotus depressus ukuran 15 mm, sedang Hammer et al. (2004)
mendapatkan kadar protein pakan ≥21% memberikan pertumbuhan dan
kelangsungan hidup yang maksimal pada Lytechinus variegatus berukuran 14 mm. Pada Strongylocentrotus droebachiensis ukuran 60 mm, kadar protein pakan 19% yang optimal menghasilkan gonad berkualitas baik (Pearce et al. 2002), sedang Hammer et al. (2006) mendapatkan protein pakan 20% optimal untuk induk Lythecinus variegatus berukuran 36 mm.
Selain protein, kandungan energi pakan merupakan salah satu faktor pembatas selama perkembangan dan pematangan gonad pada siklus reproduksi (Schlosser et al. 2005). Pakan yang kandungan energinya rendah akan menyebabkan ikan/bulubabi menggunakan sebagian protein sebagai sumber energi untuk metabolisme, sehingga bagian protein untuk proses perkembangan dan pematangan gonad menjadi berkurang. Sebaliknya jika kandungan energi pakan terlalu tinggi akan membatasi jumlah protein yang dimakan. Pengaruh energi pakan khususnya keseimbangan antara protein dan energi dalam pakan terhadap produksi gonad bulubabi belum banyak diketahui. Protein dan energi dialokasikan untuk meningkatkan ukuran tubuh atau produksi gonad, tergantung pada kondisi reproduksi bulubabi.
2.5 Peranan Karotenoid
Warna kuning, kemerahan, dan oranye dari gonad bulubabi, disebabkan oleh karotenoid terutama β-echinenon (Agatsuma et al. 2005). Echinenon
merupakan karotenoid dominan pada kebanyakan gonad bulubabi yang disintesis dari β- karoten (Shpigel et al. 2005). Warna gonad berubah secara musiman dipengaruhi oleh siklus reproduksi dan aktivitas merumput. Warna gonad juga dipengaruhi oleh spesies alga yang dimakan oleh bulubabi (Agatsuma et al. 2005).
Bulubabi yang memakan pakan buatan sering menghasilkan gonad yang besar tetapi berwarna pucat. Beberapa penelitian mendapatkan bahwa sumber karotenoid alami dari rumput laut paling efektif menciptakan pewarnaan yang baik dibandingkan dengan karotenoid yang ditambahkan dalam pakan buatan (Robinson et al. 2002; Shpigel et al. 2005). Pakan alga alami atau penambahan β-karoten alami yang dihasilkan dari alga Dunaliella salina kering, memberikan peningkatan warna gonad, sedang β-karoten sintetik atau astaxantin tidak memperbaiki warna gonad (Shpigel et al. 2005). Pada penelitian pemberian pakan kombinasi alga Gracilaria conferta dan Ulva lactula dengan pakan buatan pada bulubabi Paracentrotus lividus, menunjukkan pakan buatan sangat efektif dalam meningkatkan massa gonad, sementara alga dapat digunakan untuk memperbaiki warna dan kualitas gonad. Pada studi ini didapatkan korelasi positif antara kadar echinenon dan warna gonad. Echinenon telah diidentifikasi sebagai karotenoid dominan pada kebanyakan gonad bulubabi, dan β-karoten digambarkan sebagai prekursor untuk proses metabolisme dalam memproduksi echinenon. Oleh karena kandungan echinenon sebesar 83% dari total karotenoid pada berbagai studi gonad echinoid, Plank et al. (2002) menyimpulkan bahwa gonad bulubabi adalah terminal karotenoid dan kadarnya yang tinggi di dalam gonad, mengindikasikan pentingnya bagi perkembangan gamet, telur, dan embrio.
Pada beberapa spesies ikan salmon, karotenoid berfungsi dalam reproduksi, dengan mobilisasi karotenoid pada daging dan deposisinya pada kulit dan ovari, yang terjadi selama maturasi. Kadar karotenoid dalam plasma kemungkinan dipengaruhi oleh absorpsi karotenoid dari makanan. Selain itu, kadar karotenoid plasma dipengaruhi oleh waktu dan proses pematangan. Kadar karotenoid dalam plasma ikan yang matang, relatif menurun dibandingkan pada ikan yang belum matang. Hal ini mungkin disebabkan oleh menurunnya konsumsi pakan. Kadar astaxantin pada ovari lebih tinggi daripada dalam daging, menunjukkan bahwa ovari mempunyai afinitas yang tinggi untuk deposisi
karotenoid. Selama pematangan, karotenoid dimobilisasi dari otot dan diinkorporasi ke dalam perkembangan ovari (Torinsen dan Torinsen 1985).
Warna oranye pada otot dan telur salmon Atlantik terutama karena adanya astaxantin karotenoid (3,3’-dihidroxi-β, β-karoten-4,4’-dione). Seperti pada spesies ikan lain, salmon tidak dapat mensintesis astaxantin atau karotenoid lain tetapi diabsorpsi dari makanan dan dideposit ke dalam berbagai jaringan tubuh termasuk gonad. Kadar astaxantin dalam plasma dipengaruhi oleh waktu dan tingkat kematangan sexual. Kadar astaxantin pada daging dan ovari menurun secara signifikan selama pematangan, tetapi jumlah total dalam ovari terus meningkat.
Kandungan karotenoid juga berkaitan dengan kemampuan telur dalam mentoleransi kondisi lingkungan, misalnya: elevasi temperatur air, elevasi kadar amoniak, dan bahaya pengaruh cahaya UV. Konsentrasi karotenoid yang tinggi dalam telur dilaporkan dapat meningkatkan derajat fertilisasi (Christiansen dan Torinsen 1997).
Deufel (1965) diacu dalam Christiansen dan Torrissen (1997), mendapatkan terjadi peningkatan jumlah betina matang dan pematangan awal pada rainbow trout yang diberi suplemen kantaxantin dibandingkan dengan ikan yang tidak diberi suplemen. Menurut Cabello et al. (2002), pada crustacea, pematangan ovari dicirikan oleh akumulasi bahan karotenoid. Defisiensi karotenoid pada pakan induk udang diduga dapat menyebabkan pigment
deficiency syndrome (PDS) yang dicirikan oleh bleaching pada ovari betina yang
matang dan pada kuning telur, yang selanjutnya berdampak pada rendahnya nafsu makan, dan tingginya deformities pada zoea 1, serta rendahnya kelangsungan hidup pada zoea 2 (Regunathan dan Wesley 2006).
Wyban et al. (1997) diacu dalam Cabello et al. (2002) mendapatkan paprika merupakan bahan pakan tambahan, yang baik bagi pematangan ovari
Pennaeus vannamei, karena dapat mensuplai beberapa nutrien essensial yang
diperlukan bagi produksi nauplius berkualitas. P. vannamei mampu mengubah karotenoid (α-karoten, α-kriptoxantin, kaptaxantin, kapsorubin) pada paprika menjadi astaxantin.
Tahap oogenesis pada crustacea dicirikan oleh penimbunan kuning telur ke dalam oosit. Lipoprotein utama di dalam kuning telur adalah vitelin, yang kemudian akan digunakan sebagai sumber nutrisi bagi perkembangan embrio. Vitelin crustacea merupakan High Density Lipoprotein (HDL) yang sering berhubungan dengan karotenoid. Vitelin ini sebenarnya adalah lipo-gliko-karotenoprotein (Chein et al. 1993). Telur crustacea mengakumulasi karotenoid dalam jumlah yang signifikan sehingga memungkinkan untuk berfungsi selama vitelogenesis. Lebih lanjut dinyatakan bahwa warna telur memberikan suatu indikasi dari kualitas telur. Selain itu, ada dugaan bahwa berkurangnya kualitas larva, disebabkan oleh kurangnya kadar karotenoid dalam kuning telur, pada saat perkembangan embrio udang.
Karotenoid mempunyai kemampuan memicu vitelogenesis udang, dan berpengaruh langsung pada transkripsi gen hormon, yang terlibat dalam pematangan ovari. Selama vitelogenesis sekunder, karotenoid dimobilisasi dari hepatopankreas ke ovari melalui hemolim, dimana karotenoid tersebut terakumulasi dalam oosit, sebagai bagian utama dari protein kuning telur (lipovitelin). Karotenoid juga berhubungan dengan produksi vitamin A dan melindungi lemak tak jenuh terhadap oksidasi. Selain itu, karotenoid dapat berfungsi untuk melindungi cadangan makanan dan perkembangan embrio dari oksidasi radikal bebas dan radiasi cahaya matahari, serta mensuplai cadangan pigmen untuk embrio dan larva (Regunathan dan Wesley 2006).
2.6 Kualitas Gonad Bulubabi
Kualitas gonad (uni atau roe) sangat penting dan mempengaruhi harga produk. Salah satu faktor yang menentukan kualitas gonad adalah warna. Mutu warna gonad bulubabi dapat dikelompokan sebagai berikut: (1) mutu sangat baik, gonad berwarna kuning terang, oranye merah (2) mutu baik, gonad berwarna orange, (3) mutu jelek, gonad berwarna pucat, atau coklat (Sphigel et al. 2005).
Pearce et al. ( 2004) mendapatkan warna gonad bulubabi yang dihasilkan, lebih baik pada bulubabi yang diberi pakan buatan yang ditambahkan mikroalga
Dunaliella salina dibandingkan yang diberi pakan kelp (Laminaria longicruris
berukuran besar. Ukuran dan tipe pakan tidak signifikan mempengaruhi tekstur, tetapi kedua faktor secara signifikan mempengaruhi kekompakan dan rasa. Gonad bulubabi yang diberi pakan buatan, lebih lembek dan mempunyai kandungan air lebih banyak dibandingkan dengan gonad bulubabi yang diberi kelp.
Selain warna, tekstur, rasa dan aroma juga menentukan mutu gonad. Gonad bulubabi yang baik adalah teksturnya kompak, manis, dan berbau seperti rumput laut segar. Rasa enak (manis) dari gonad berhubungan dengan tingginya konsentrasi asam amino, seperti; alanina, arginina, asam glutamat, glisina, lisina, serina dan taurina. Sebaliknya, rasa pahit dari gonad berhubungan dengan tingginya kadar valina dan puserrimina (Pearce et al. 2004).
Gonad bulubabi mengandung nilai gizi yang tinggi. Gonad mengandung protein, lemak, glikogen, kalsium, fosfor, vitamin B kompleks, dan vitamin A. Protein adalah komponen yang dominan dalam pakan yang dapat mempengaruhi produksi gonad. Gonad bulubabi juga diperkirakan mengandung sekitar 18 asam amino yang penting untuk pertumbuhan. Kandungan kimia gonad maupun nilai gizi gonadnya sangat bervariasi menurut jenis bulubabi dan faktor lainnya, antara lain: jenis T. gratilla dalam kondisi segar mempunyai kadar air, protein, lemak, dan abu masing – masing sebesar 81.39%; 14.43%; 1.89%; dan 3.92%, jenis E.
calamaris dalam kondisi segar sebesar 69.34%; 15.64%; 3.61%, dan 2.48%, dan
jenis D. Setosum sebesar 69.47; 16.99; 2.45; 2.25 (Murniyati dan Setiabudi 1998).
2.7 Makanan
Jenis makanan bulubabi T. gratilla sangat bervariasi sesuai dengan tingkat perkembangannya. Larva biasanya memakan diatom – diatom plantonik, tetapi pada tahap juvenil memakan diatom – diatom sesil, dan yang telah berukuran besar memakan makroalga, lamun, dan mikro flora (Yamaguchi 1991). T.
gratilla yang telah dewasa dapat memakan bermacam – macam makroalga, antara
lain: Sargassum spp., Padina spp., Hydroclathrus clathrus, Cladosiphon
okamwarmus., Hypnea charoides, Gracilaria blodgettii, Ceratodictyon spongiosum. Berdasarkan hasil analisa lambung T. gratilla yang diambil dari
alam, menunjukkan bahwa yang paling dominan sebagai makanannya adalah
Makroalga merupakan makanan alami bulubabi dan mengandung Poly
Unsaturated Fatty Acid (PUFA), yang secara taxonomi dikarakterisasi sebagai
berikut: makroalga hijau kaya 16:4n-3, 18:3n-3, dan 18:4n-3; makroalga merah kaya 20:4n-6 dan 20:5n-3; dan makroalga coklat kaya 18:3n-3, 18:4n-3, 20:4n-6 dan 20:5n-3 (Floreto dan Ishikawa 1996).
2.8 Kontrol Hormon dalam Reproduksi Bulubabi
Reproduksi pada ikan berada di bawah kontrol poros hipothalamus – hipofisis – gonad. Ada tiga faktor yang terlibat dalam reproduksi ikan yaitu sinyal lingkungan, hormon, dan organ reproduksi. Sistim hormon pada reproduksi ikan dibedakan dalam dua hal, yaitu pematangan gonad serta ovulasi dan pemijahan (Zairin 2003).
Pada echinodermata, pematangan seksual dan pemijahan diatur oleh suatu sistem hormon yang sederhana, yakni: (1) Gonad-Stimulating Substance (GSS) dihasilkan oleh syaraf radial, (2) Maturating-Inducing Substance (MIS) disintesis oleh sel-sel folikel ovari, dan (3) Gonad- Inhibiting Substance (GIS) yang dibentuk oleh syaraf radial. Gonad Stimulating Substance adalah protein sederhana dengan bobot molekul sekitar 2000 sedangkan hormon folikular adalah purin 1-metiladenin (Lafont 2000). Selain hormon 1-metil adenin (MIS) pada kelompok echinodermata dan moluska ditemukan hormon vertebrate-type
steroid. Gonad moluska dan echinodermata dapat memproduksi steroid secara de novo dan sintesis steroid ini dibantu oleh enzim cytokrom P-450. Keberadaan
steroid pada hewan fitofage kemungkinan juga berasal dari tumbuhan yang dimakan, oleh karena molekul steroid banyak terdapat pada tumbuhan (Lafont 2000).
Perkembangan gonad bulubabi dipengaruhi oleh akumulasi nutrien ke dalam pagosit nutritif melalui sintesis vitelogenin (vitelogenesis) dibawah rangsangan hormon steroid (Unuma 1999). Vitelogenesis terjadi karena adanya sinyal lingkungan yang diterima oleh syaraf radial. Sebagai respon, syaraf radial akan melepaskan GSS ( Gonad Stimulating Substance) yang akan merangsang sel-sel folikel gonad mensintesis MIS (Maturating Inducing Substance) seperti 1-metiladenin dan hormon steroid (testosteron dan estradiol) secara de novo dengan
bantuan enzim cytokrom P450. Testosteron dan estradiol merangsang pelepasan nutrien ke gonad melalui cairan koelomik dari usus dan juga merangsang pengambilan nutrien dari cairan koelomik melalui sel gonadal nutritif (pagosit nutritif) yang selanjutnya mensuplai nutrien ke gamet secara langsung melalui lumen gonadal. Akibatnya gonad berkembang hingga mencapai ukuran maksimum dan menunggu sinyal lingkungan berikutnya. Selanjutnya sinyal lingkungan diterima oleh syaraf radial, dan sebagai respon syaraf radial melepaskan neurosekresi (polipeptida) yang berperan langsung pada sel-sel folikel untuk merangsang sintesis 1-metiladenin, dan selanjutnya merangsang ovulasi, pelepasan gamet, dan tingkah laku reproduksi.
Penelitian Unuma (1999) mendapatkan hormon steroid (androstenedion, estron, dan derivatnya) dapat merangsang perkembangan gonadal dan gametogenesis pada juvenil bulubabi merah (Pseudocentrotus depressus). Jantan
P. depressus berdiameter 20 mm yang diberi pakan bersteroid (androstenedion
dan estron) menghasilkan IKG yang signifikan lebih tinggi dibandingkan dengan kontrol. Spermatogenesis juga lebih cepat dibandingkan dengan kelompok kontrol. Sebaliknya pada betina P. depressus perlakuan pakan bersteroid tidak menunjukkan pengaruh, kemungkinan karena masih terlalu muda sehingga juvenil betina belum siap melaksanakan gametogenesis.
Tidak seperti hewan ovipar lainnya, pada bulubabi, protein yolk tidak hanya khusus pada betina. Protein yolk terakumulasi dalam pagosit nutritif sebagai sumber nutrien untuk gametogenesis, tidak hanya pada betina tetapi juga pada jantan (Unuma 1999). Akumulasi nutrien ke dalam pagosit nutritif telah ditingkatkan oleh steroid melalui sintesis vitelogenin.