KAJIAN TERMODINAMIKA PADA PROSES EKSTRAKSI
ASAM LEMAK BEBAS DARI CPO DENGAN
METANOL DAN ETANOL
Silviana
Jurusan Teknik Kimia, Fakultas Teknik Universitas Diponegoro Jl. Prof Sudarto, SH, Kampus Tembalang, Semarang 50239
e-mail: [email protected]
Abstrak
Konversi minyak sawit menjadi derivat alkil ester melalui transesterifikasi sangat dipengaruhi oleh keberadaan asam lemak bebas dalam minyak sawit. Asam lemak bebas akan bereaksi dengan katalis yang digunakan, sehingga asam lemak bebas perlu kurangi kadarnya dalam minyak sawit karena akan berpengaruh terhadap kebutuhan katalis dan produk alkil ester yang dihasilkan. Suatu alternatif proses dalam pengkonversian minyak sawit menjadi alkil ester asam lemak melalui proses awal berupa ekstraksi asam lemak bebas dengan pelarut metanol dan etanol perlu dikaji secara termodinamika. Selain data kesetimbangan cair-cair untuk sistem tersebut, penelitian ini untuk mendapatkan harga koefisien distribusi asam lemak bebas dan selektivitas pada temperatur 40 °C, 45 °C, dan 50 °C. Kelayakan data telah diuji konsistensi termodinamikanya dengan korelasi Othmer dan Tobias. Hasil penelitian ini menunjukkan bahwa kondisi optimum tercapai pada temperatur 50 °C dengan rata-rata koefisien distribusi asam oleat sebesar 1,65 dan selektivitas rata-rata 18,17 bagi pelarut metanol serta 6,09 dan 27,27 bagi pelarut etanol. Hal ini menunjukkan bahwa pelarut etanol memiliki kemampuan lebih baik dari pelarut metanol. Namun demikian, proses ekstraksi asam lemak bebas dalam minyak sawit dapat dilakukan baik dengan pelarut metanol maupun etanol.
Kata Kunci: alkil ester asam lemak, transesterifikasi, asam lemak bebas, kesetimbangan cair-cair,
ekstraksi, metanol, etanol
Abstract
The convertion of palm oil into fatty acid alkyl ester derivatives through transesterification reaction extremely is influenced by free fatty acid presence in crude palm oil. Free fatty acid will react with catalyst and will effect its demand and yield of alkyl ester , so it needs to reduce free fatty acid content. The alternative process in crude palm oil convertion into fatty acid alkyl ester through initial process by the extraction of free fatty acid with methanol and ethanol as solvent require to study its thermodynamics.In this research not only to obtain liquid-liquid equilibrium data for these system, but also to obtain distribution coefficient values of free fatty acid and its selectivity at 40 °C, 45 °C, dan 50 °C temperatures. Reliability of data was already examined thermodynamics consistency with Othmer and Tobias correlation.. The result shows that optimum condition attain to temperature 50°C with oleic acid distribution coefficient and selectivity: 1,65 and 18,17 for methanol as solvent; 6,09 and 27,27 for ethanol as solvent. Ethanol has more capability than methanol to remove free fatty acid in crude palm oil; nevertheless the extraction process of free fatty acid in crude palm oil can be carried out with methanol and ethanol as solvent.
Keyword: fatty acid alkyl ester, transesterification, free fatty acid, liquid-liquid equilibrium, extraction, methanol, ethanol
,
1. Pendahuluan
Upaya pendayagunaan sumber daya alam Indonesia semakin digalakkan, khususnya sektor non migas. Seperti halnya komoditas minyak sawit yang merupakan aset nasional yang terbesar, sehingga memberikan peluang bagi berdirinya industri kimia hilir dari derivat minyak sawit itu sendiri. Salah satunya adalah derivat alkil ester asam lemak yang dapat dijadikan sebagai sumber energi alternatif yang terbarukan (biodisel) ataupun sebagai produk oleokimia lainnya. Selama ini, konversi minyak sawit sebagian besar berupa produk pangan, di mana kebutuhan alkyl ester bagi industri kimia semakin meningkat. Dari alasan ini, dikemukakan alternatif
proses konversi minyak sawit menjadi alkyl ester asam lemak. Produksi alkil ester dapat melalui beberapa alternatif reaksi, salah satunya reaksi transesterifikasi, di mana trigliserida sebagai komponen utama minyak sawit direaksikan dengan alkohol menggunakan katalis basa. Keberhasilan reaksi ini sangat ditentukan oleh kandungan asam lemak bebas dalam minyak sawit. Keberadaan asam lemak bebas dapat bereaksi dengan katalis basa yang digunakan, sehingga berpengaruh baik terhadap kebutuhan katalis (ekses) dan produk rendah. Berikut ini merupakan reaksi transesterifikasi minyak sawit.
H2C–OOC-R1 R–OOCR1 H2C–OH H C – OOC-R2 + 3R-OH
katalis
R– OOCR2 + H C–OH H2C – OOC-R3 R– OOCR3 H2C–OH
trigliserida alkohol alkil ester gliserol asam lemak
Dari kendala tersebut, dikaji suatu alternatif removal asam lemak bebas dengan proses ekstraksi dengan pelarut alkohol. Produk ekstrak mengandung pelarut dan asam lemak bebas dapat dikenai reaksi esterifikasi pada kolom esterifikasi dengan katalis asam untuk menghasilkan alkyl ester asam lemak, sedangkan produk rafinat berupa minyak sawit bebas asam lemak bebas sebagai umpan bagi kolom transesterifikasi dengan katalis basa. Dari alternatif proses ini, terlihat bahwa terdapat peningkatan produk alkil ester asam lemak, hemat energi, produk samping yang bernilai (gliserol), dan hemat katalis basa.
Kelebihan allternatif proses tersebut perlu ditinjau kemampuan pelarutnya dalam mengambil asam lemak bebas dalam minyak sawit. Untuk itu, dalam penelitian ini, perlu dikaji lebih dalam mengenai data kesetimbangan cair-cair sistem minyak sawit-asam lemak bebas-alkohol. Dari data kesetimbangan cair-cair akan diperoleh beberapa faktor separasi dari proses ekstraksi untuk melihat layak tidaknya proses ekstraksi dilakukan. Adapun pelarut yang digunakan dalam penelitian ini adalah metanol dan etanol yang merupakan alkohol primer.
Adapun faktor separasi yang diperoleh adalah koefisien distribusi asam lemak bebas (D2), koefisien distribusi minyak sawit (D1), dan selektivitas (S). Secara umum, proses ekstraksi suatu komponen solut dapat dilakukan jika selektivitas lebih besar dari 1
Koefisien distribusi secara umum dapat dituliskan dalam bentuk rumusan sebagai berikut:
diluen fasa dalam berat fraksi solven fasa dalam berat fraksi Di= (1)
di mana: Di = koefisien distribusi komponen i
wi3 = fraksi berat komponen i dalam fasa kaya solven wi1 = fraksi berat komponen i dalam fasa kaya diluen
sedangkan faktor separasi dapat dinyatakan dalam rumusan sebagai berikut:
1 2 D D S= (2) di mana: S = selektivitas;
D1 = koefisien distribusi komponen 1 D2 = koefisien distribusi komponen 2 1,2,3 = CPO, Asam oleat, MeOH
2. Bahan Dan Metode Penelitian
Minyak sawit yang digunakan diperoleh dari PT. Megah Bonanza (Semarang). Asam oleat pa, methanol pa, dan etanol pa dibeli dari CV. Jurus Maju (Semarang). Bahan kimia untuk keperluan analisa (air, NaOH, dan indikator pp), diperoleh dari Jurusan Teknik Kimia Fakultas Teknik Undip. Variabel percobaan dalam pengukuran data kesetimbangan cair-cair adalah temperatur. Adapun temperatur percobaan ditetapkan pada 40
°C, 45 °C, dan 50 °C, karena proses ekstraksi cair-cair dilakukan di sekitar temperatur ini dan jenis pelarut yang digunakan memiliki titik didih di atas temperatur operasi. Jenis pelarut yang akan digunakan adalah metanol dan etanol. Asam lemak bebas yang digunakan adalah asam oleat.
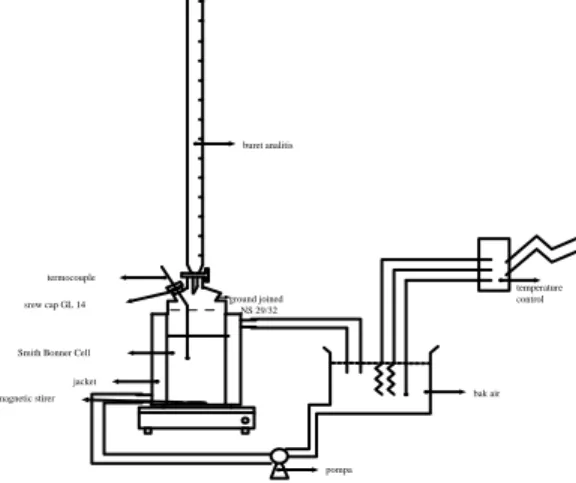
Kurva binodal sistem CPO-alkohol-asam oleat diperoleh dengan metode titrasi dengan TAT: cloudy method (Alders, 1959). Campuran biner yang telah diketahui komposisinya diaduk dalam alat kesetimbangan (Gambar 1.) yang dilengkapi dengan magnetik stirrer dan jaket. Komponen ketiga ditambahkan sedikit demi sedikit hingga tercapai TAT-nya. Tie line ditentukan dengan pencampuran ketiga komponen dengan perbandingan komposisi di bawah kurva binodal lalu menitrasi dengan alkohol. Komposisi tie line selanjutnya
diperoleh dari perbandingan berat kedua fasa cair yang terbentuk dan kurva binodal yang diperoleh sebelumnya. Tie line ditentukan dengan pencampuran ketiga komponen dengan komposisi di bawah kurva binodal. Komposisi tie line selanjutnya diperoleh dari perbandingan berat kedua fasa cair yang terbentuk dan kurva binodal yang diperoleh sebelumnya dengan menggunakan Lever Rule.
+ -bak air temperature control pompa buret analitis
Smith Bonner Cell jacket magnetic stirer termocouple ground joined NS 29/32 srew cap GL 14
Gambar 1. Rangkaian Alat Percobaan
Adapun konsistensi termodinamika data tie line yang diperoleh dari percobaan dihitung dengan menggunakan korelasi Othmer and Thobias (Othmer, and Tobias, 1942), dengan persamaan sebagai berikut:
⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − + = ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ − 11 11 33 33 ln 1 1 ln w w B A w w (3) di mana:
w33 = fraksi berat R-OH dalam fasa ekstrak; w11 = fraksi berat CPO dalam fasa rafinat
3. Hasil Penelitian
Penelitian ini menghasilkan data kesetimbangan yang dinyatakan dalam kurva binodal (Gambar 1 dan 2) serta data komposisi tie line (Tabel 1 dan 2) untuk masing-masing pelarut dan temperatur percobaan. Pada gambar kurva binodal menunjukkan bahwa kenaikan temperatur ternyata berpengaruh terhadap luasan daerah di bawah kurva binodal yang semakin menyempit.
0 0.2 0.4 0.6 0.8 1 xmetanol 1,0 0,2 0,0 0,4 0,6 0,8 xmin ya k 0,0 0,2 0,4 0,6 0,8 1,0 Metanol Minyak Asam lemak x a sam le m ak 0,0 0,2 0,4 0,6 0,8 1,0 40 oC 45 oC 50 oC
Gambar 2. Kurva Binodal
Sistem CPO-Asam Lemak Bebas-Metanol Gambar 3. Kurva Binodal
Sistem CPO-Asam Lemak Bebas-Etanol 0 0.2 0.4 0.6 0.8 1 xmetanol 1,0 0,2 0,0 0,4 0,6 0,8 x minyak 0,0 0,2 0,4 0,6 0,8 1,0 Metanol Minyak Asam lemak xasam lemak 0,0 0,2 0,4 0,6 0,8 1,0 40 oC 45 oC 50 oC x
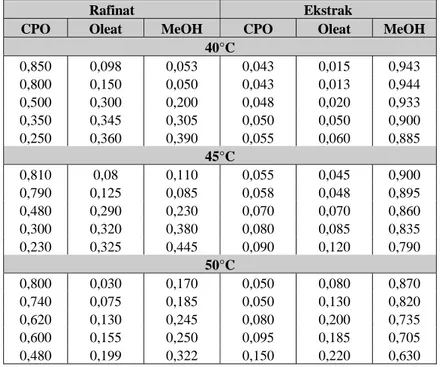
Tabel 1. Komposisi tie line sistem CPO-asam lemak bebas-metanol
Rafinat Ekstrak
CPO Oleat MeOH CPO Oleat MeOH
40°C 0,850 0,098 0,053 0,043 0,015 0,943 0,800 0,150 0,050 0,043 0,013 0,944 0,500 0,300 0,200 0,048 0,020 0,933 0,350 0,345 0,305 0,050 0,050 0,900 0,250 0,360 0,390 0,055 0,060 0,885 45°C 0,810 0,08 0,110 0,055 0,045 0,900 0,790 0,125 0,085 0,058 0,048 0,895 0,480 0,290 0,230 0,070 0,070 0,860 0,300 0,320 0,380 0,080 0,085 0,835 0,230 0,325 0,445 0,090 0,120 0,790 50°C 0,800 0,030 0,170 0,050 0,080 0,870 0,740 0,075 0,185 0,050 0,130 0,820 0,620 0,130 0,245 0,080 0,200 0,735 0,600 0,155 0,250 0,095 0,185 0,705 0,480 0,199 0,322 0,150 0,220 0,630
Tabel 2. Komposisi tie line sistem CPO-asam lemak bebas-etanol
Rafinat Ekstrak
CPO Oleat MeOH CPO Oleat MeOH
40°C 0.753 0.198 0.050 0.075 0.010 0.915 0.755 0.197 0.048 0.075 0.003 0.922 0.741 0.203 0.057 0.083 0.030 0.888 0.758 0.196 0.047 0.076 0.006 0.918 0.735 0.208 0.058 0.084 0.039 0.877 45°C 0.710 0.026 0.265 0.108 0.035 0.858 0.738 0.015 0.248 0.118 0.043 0.840 0.598 0.045 0.358 0.268 0.073 0.660 0.683 0.034 0.283 0.181 0.064 0.755 0.706 0.026 0.268 0.118 0.036 0.846 Rafinat Ekstrak
CPO Oleat MeOH CPO Oleat MeOH
50°C 0.648 0.007 0.346 0.145 0.052 0.803 0.645 0.011 0.344 0.145 0.052 0.803 0.649 0.005 0.347 0.138 0.051 0.812 0.646 0.010 0.345 0.133 0.045 0.823 0.600 0.029 0.372 0.325 0.048 0.628
Namun demikian, dari penelitian didapatkan bahwa kenaikan temperatur penelitian meningkatkan nilai koefisien distribusi asam lemak bebas dan selektivitasnya, baik pelarut metanol maupun etanol., seperti yang tertuang dalam Tabel 3 dan 4. Ditinjau dari parameter separasi baik koefisien distribusi asam lemak bebas maupun selektivitasnya, penelitian ini didapatkan kondisi optimum pada temperatur 50°C.
Tabel 3. Koefisien distribusi dan selektivitas sistem CPO-asam lemak bebas-metanol 40°C 45°C 50°C D2 D1 S D2 D1 S D2 D1 S 0,153 0,051 3,00 0,562 0,068 8,26 2,667 0,063 42,33 0,087 0,054 1,61 0,384 0,073 5,26 1,733 0,068 25,49 0,067 0,096 0,70 0,241 0,143 1,69 1,538 0,129 11,92 0,145 0,143 1,01 0,266 0,267 1,00 1,194 0,158 7,56 0,167 0,22 0,76 0,369 0,391 0,94 1,108 0,313 3,54
Tabel 4. Koefisien distribusi dan selektivitas sistem CPO-asam lemak bebas-etanol
40°C 45°C 50°C D2 D1 S D2 D1 S D2 D1 S 0.196 0.100 3,08 1.353 0.152 8.89 8.000 0.224 35.72 0.063 0.099 1,61 2.833 0.159 17.78 4.727 0.225 21.03 0.531 0.111 0,70 1.629 0.448 3.64 11.333 0.212 53.45 0.128 0.100 1,01 1.882 0.265 7.10 4.737 0.205 23.09 0.671 0.114 0,76 1.369 0.167 8.19 1.667 0.542 3.08
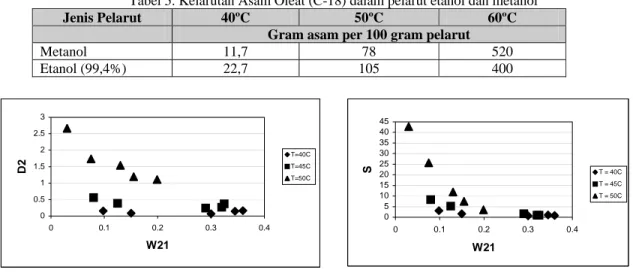
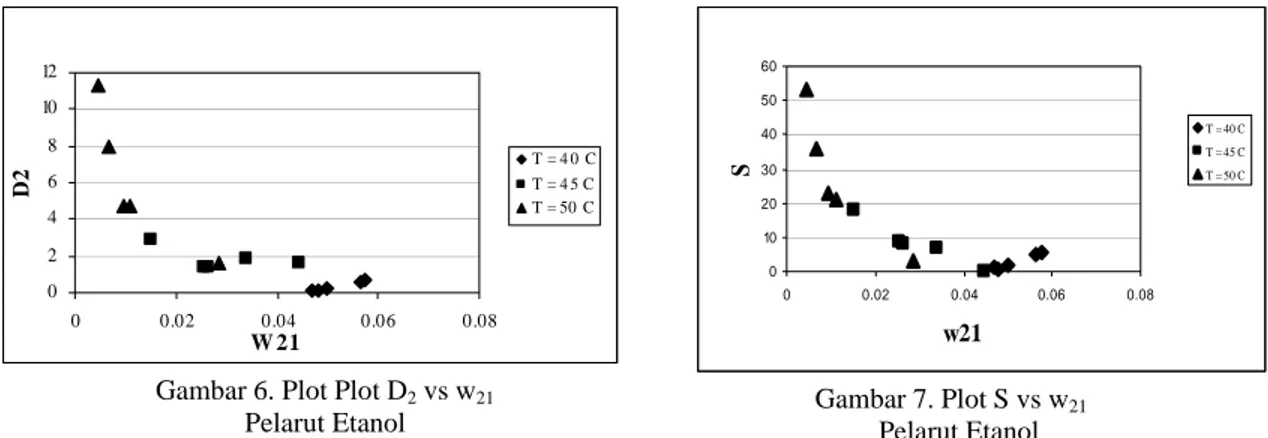
Selain itu, dari gambar kurva binodal terlihat bahwa sistem dengan pelarut etanol memiliki daerah homogen yang lebih luas dibandingkan metanol. Pada proses ekstraksi biasanya dilakukan pada sistem dengan luasan homogen yang lebih kecil atau luasan kurva binodal yang paling besar agar kebutuhan pelarut rendah sehingga lebih mudah pengambilan kembali pelarut. Namun perlu ditegaskan bahwa produk dari proses ekstraksi ini tidak akan dilakukan pengambilan pelarut kembali melainkan produk baik ekstrak maupun rafinat akan dikonversi menjadi alkil ester asam lemak. Dari kedua pelarut yang digunakan dapat dilihat bahwa pelarut etanol memiliki kemampuan untuk mengambil asam lemak bebas lebih baik dibandingkan metanol. Hal ini dapat dilihat dari kekuatan pelarut yang dapat dilihat dari Gambar 4 – Gambar 7 untuk masing-masing pelarut dari hasil penelitian ini. Rata-rata koefisien distribusi asam oleat sebesar 1,65 dan selektivitas rata-rata 18,17 bagi pelarut metanol serta 6,09 dan 27,27 bagi pelarut etanol masing-masing pada kondisi optimum 50°C. Hal ini berarti proses ekstraksi asam lemak bebas dari CPO dengan pelarut metanol dan etanol layak dilakukan. Data tersebut juga ditunjang dengan data literatur yang menunjukkan bahwa kelarutan asam oleat dalam pelarut etanol lebih tinggi dibanding dalam pelarut metanol, seperti yang ditunjukkan pada Tabel 5 (Markley, 1960) berikut ini.
Tabel 5. Kelarutan Asam Oleat (C-18) dalam pelarut etanol dan metanol
Jenis Pelarut 40ºC 50ºC 60ºC
Gram asam per 100 gram pelarut
Metanol 11,7 78 520 Etanol (99,4%) 22,7 105 400 0 0.5 1 1.5 2 2.5 3 0 0.1 0.2 0.3 0.4 W21 D2 T=40C T=45C T=50C
Gambar 4. Plot Plot D2 vs w21 Pelarut Metanol 0 5 10 15 20 25 30 35 40 45 0 0.1 0.2 0.3 0.4 W21 S T = 40C T = 45C T = 50C Gambar 5. Plot S vs w21 Pelarut Metanol
0 2 4 6 8 10 12 0 0.02 0.04 0.06 0.08 W 21 D2 T = 4 0 C T = 4 5 C T = 50 C
Gambar 6. Plot Plot D2 vs w21 Pelarut Etanol 0 10 20 30 40 50 60 0 0.02 0.04 0.06 0.08 w21 S T = 40 C T = 45 C T = 50 C Gambar 7. Plot S vs w21 Pelarut Etanol
Adapun data yang diperoleh secara eksperimen telah diuji konsistensi termodinamika dengan menggunakan korelasi Othmer and Tobias (persamaan 3). Dari hasil perhitungan dapat dilihat pada Tabel 6 – 7 berikut ini. Linieritas dari plot data tie line merupakan derajat konsistensi data yang diperoleh.
Tabel 6. Konstanta Persamaan Othmer-Tobias Tabel 7. Konstanta Persamaan Othmer-Tobias untuk sistem CPO-Asam Oleat-MeOH untuk sistem CPO-Asam Oleat-EtOH
Korelasi Othmer-Tobias T/˚C A B R2 40 45 50 -2,424 -0,292 -0,558 0,273 0,292 0,940 0,879 0,958 0,992 Korelasi Othmer-Tobias T/˚C A B R2 40 45 50 1,063 0,027 0,590 4,321 1,828 4,642 0,963 0,839 0,980
Selektivitas dengan solvent free basis dapat diperoleh plot pada Gambar 8 – 9 berikut ini menunjukkan bahwa perubahan kenaikan temperatur mengubah nilai selektivitas secara signifikan.
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0 0,2 0,4 0,6 0,8 W21/(W21+W11) W23/(W23+W13) T = 40 C T = 45 C T = 50 C
Gambar 7. Diagram seletivitas pada temperatur eksperimen (free-solven basis; metanol)
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0 0.02 0.04 0.06 0.08 W21/(W21+W11) W 23/ (W 23+ W 13) T = 4 0 C T = 4 5 C T = 5 0 C
Gambar 8. Diagram seletivitas pada temperatur eksperimen (free-solven basis; etanol)
4. Kesimpulan
Data kesetimbangan sistem terner: CPO-asam lemak bebas-metanol dan CPO-asam lemak bebas-etanol telah diperoleh pada temperatur 40, 45, dan 50 °C.Dari data koefisien distribusi asam oleat menunjukkan bahwa pada kenaikan temperatur akan meningkatkan kelarutan asam oleat dalam pelarut (D2) dan selektivitas secara signifikan, sedangkan kenaikan temperatur tidak memberikan perubahan yang signifikan terhadap kelarutan pelarut dalam CPO (D1).
Daftar Pustaka
1. Alders, L., (1959), “Liquid-liquid Extraction: Theory and Laboratory Practice”, 2nd edition, p. 5-20, Elsevier Publishing Company, New York.
3. E.Ince and S.Ismail Kirbaslar, (Pr/June 2002), ”Liquid-Liquid Equilibria Of The Water-Acetic Acid-Butyl Acetate System,” Braz. J. Chem. Eng. vol.19 no.2, p.1-12, São Paulo
4. Markley, K.S., (1960), “Fatty Acids, The Chemistry, Properties, Production, and Uses”, 2ndedition, p.636, 644, 654 ,Interscience Publishers, Inc. New York.
5. Othmer, D.F and Tobias P.E, (1942), “Liquid-Liquid Extraction Data: Tie Line Correlation”, Industrial and Engineering Chemistry, vol.34 No.6, 1942, p.694
6. Prausnitz, J.W., (1959) “Molecular Thermodynamics of Fluid Phase Equilibria”, 2nd edition, Elsevier Publishing Company.
7. Silviana, (2001), “Pengukuran dan Perhitungan Kesetimbangan Cair-Cair Sistem Minyak Nabati-Asam Lemak Bebas-Metanol”, Tesis S-2, Institut Teknologi Bandung.
8. Smith, T.E., Bonner, R.F., (1950), “n-Propyl Alcohol-n-Propyl Acetate-Water Solubility Data in 20°C and 35°C”, Industrial and Engineering Chemistry, Vol.42, p.896-898