100 µL stop solution pada tiap-tiap sumur ditambahkan untuk menghentikan reaksi enzimatik, dan diamkan selama 10 menit. Setelah 10 menit, densitas optik (OD) dibaca pada panjang gelombang 415 nm dengan menggunakan microtiter plate reader.
Penentuan Kadar Dihidrotestosteron
Penentuan kadar dihidrotestosteron didasarkan pada metode IBL International (2006) dengan menganalisis serum darah tikus percobaan dengan menggunakan kit ELISA. Sebanyak 50 µL dipipet dari masing-masing blanko, standar, dan sampel serum darah tikus ke dalam sumur berlabel yang sesuai beberapa kali, kemudian 100 µL larutan konjugat dipipet ke dalam tiap-tiap sumur (dengan pipet multichannel). Campuran larutan diinkubasi di dalam plate shaker (sekitar 200 rpm) selama 1 jam dalam suhu ruang. Sumur-sumur dicuci sebanyak 3 kali dengan menggunakan 300 µL bufer pencuci yang telah diencerkan per sumur dan plat diletakkan secara perlahan-lahan pada kertas tisu untuk memastikan bahwa plat benar-benar kering. Setelah itu 150 µL substrat 3,3,5,5 -tetrametilbenzidin (TMB) dipipet ke dalam tiap-tiap sumur dengan interval waktu yang tepat, kemudian diinkubasi di dalam plate shaker selama 10-15 menit pada suhu ruang (sampai kalibrator A memiliki warna biru tua untuk mendapatkan nilai OD yang diinginkan). Sebanyak 50 µL stopping solution dipipet ke dalam tiap-tiap sumur dengan interval waktu yang tepat, dan diamkan selama 20 menit. Setelah 20 menit, plat dibaca dengan menggunakan microwell plate reader dengan panjang gelombang 490 nm.
Analisis Data
Analisis data penelitian yang diperoleh mengacu pada Mattjik (2002). Rancangan percobaan yang digunakan adalah rancangan acak lengkap. Model persamaan yang digunakan adalah sebagai berikut:
Yij= µ + τi+ εij Keterangan:
yij= pengamatan perlakuan ke-i dan ulangan ke-j
µ = pengaruh rataan umum
τi = pengaruh perlakuan ke-i, i=1,2,3,4,5,6,7 εij= pengaruh galat perlakuan ke-i dan ulangan ke-j i1 = kelompok kontrol i2 = kelompok perlakuan K1 i3 = kelompok perlakuan K2 i4 = kelompok perlakuan K3 i5 = kelompok perlakuan I1 i6 = kelompok perlakuan I2 i7 = kelompok perlakuan I3
Data bobot badan, konsumsi pakan, efisiensi pakan, berat feses, dan kadar androgen diolah dengan analisis one-way analysis of varians (ANOVA) pada tingkat kepercayaan 95% dan taraf α=0.05, dan uji lanjut yang digunakan adalah uji Duncan. Pengolahan data statistika ini menggunakan perangkat lunak Statistical Product and Service Solution (SPSS) versi 17.0. Korelasi antara data yang diperoleh dihitung menggunakan koefisien korelasi Pearson (r).
HASIL DAN PEMBAHASAN
Pengaruh Perlakuan Pemberian Pakan terhadap Bobot Badan Hewan Coba
Hewan coba yang digunakan pada penelitian ini adalah tikus Sprague-Dawley jantan berumur ±2 bulan. Tikus betina tidak digunakan karena kondisi hormonal yang berfluktuasi pada waktu beranjak dewasa, sehingga dikhawatirkan akan memberikan respon yang berbeda, dan dapat mempengaruhi hasil penelitian. Selain itu parameter yang diuji pada penelitian ini adalah androgen. Kadar androgen pada betina lebih rendah jika dibandingkan dengan jantan sehingga untuk memudahkan dalam mendapatkan kadar androgen digunakan tikus jantan (Dabbs et al. 1997).
Hewan percobaan yang sehat merupakan faktor penting dan merupakan syarat untuk memenuhi asumsi percobaan. Kondisi hewan yang sehat berguna untuk memperkecil galat percobaan. Bobot badan merupakan parameter yang mudah diukur dan diamati untuk memantau kondisi kesehatan tikus (Tara 2011). Bobot badan tikus rata-rata pada akhir adaptasi atau awal perlakuan (minggu ke-0) sebesar 142.61 gram dengan bobot badan berkisar antara 116-162 gram (Lampiran 7). Menurut lembaga riset Ace Animal (2006) dalam Meutia (2011), bobot badan tikus jenis Sprague-Dawley pada usia 59-61 hari adalah 275-299 gram. Bobot tikus Sprague-Dawley penelitian lebih rendah 50.31% yang dilaporkan Ace Animal (2006). Hal ini diduga disebabkan perbedaan kadar protein pada pakan, konsumsi pakan, ataupun faktor genetik tikus percobaan.
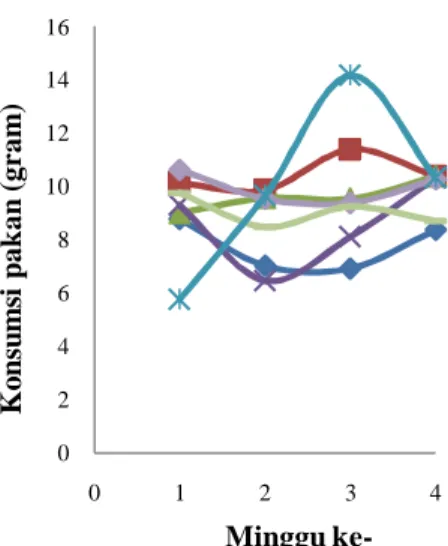
Setelah dilakukan adaptasi, hewan coba kemudian masuk masa perlakuan. Perlakuan yang diberikan adalah perlakuan pakan selama 1 bulan. Terlihat setelah perlakuan bobot badan tikus mengalami perubahan.
Peningkatan bobot badan terjadi pada K2, K3, dan I1. Kontrol, I2, dan 13 juga mengalami peningkatan bobot badan tetapi fluktuatif. Bobot badan kelompok tikus meningkat dari rata-rata 142.83±10.31 g menjadi 165.29±17.80 g dengan presentase kenaikan sebesar 15.72%. Berbeda dengan kelompok lainnya, kelompok K1 mengalami penurunan bobot badan dengan presentase penurunan sebesar 3.72%, menurun dari rata-rata bobot badan 141.25±14.75 g menjadi 136±20.51 g (Gambar 6). Penurunan bobot badan ini diduga disebabkan tikus mengalami sakit diare selama masa perlakuan. Fluktuasi bobot badan yang terjadi diduga karena nafsu makan yang berbeda-beda antar tikus dengan tikus yang lainnya.
Bobot badan kelompok tikus yang diberikan pakan perlakuan kecuali K1 lebih besar jika dibandingkan dengan bobot badan kelompok tikus yang diberi pakan kontrol (tanpa kandungan isoflavon) (Tabel 4). Hal ini menunjukkan bahwa isoflavon yang terkandung dalam pakan diduga berpengaruh meningkatkan bobot badan. Hasil uji korelasi Pearson juga menunjukkan terdapat korelasi antara kandungan isoflavon pada pakan dengan pertambahan bobot badan kelompok tikus perlakuan pakan kacang kedelai (K) (0.7<r<1) dan isolat kacang kedelai (I) (0.2<r<0.4) (Lampiran 6).
Peningkatan bobot badan yang terjadi pada kelompok tikus perlakuan penelitian ini sejalan dengan hasil penelitian Astuti (1999) yang melaporkan bahwa terjadi peningkatan bobot badan tikus jantan setelah pemberian kedelai dan Suharma (2011) yang menunjukkan bahwa pemberian isolat protein juga memberikan peningkatan bobot badan pada tikus jantan. Namun menurut Weber et al. (2001), konsumsi fitoestrogen justru menurunkan bobot badan tikus Sprague-Dawley jantan dengan meningkatkan aktivitas fisik dan menurunkan kadar leptin. Hal ini didukung juga oleh penelitian Oh et al. (2005) yang menyatakan bahwa konsumsi kedelai pada tikus jantan dapat meningkatkan kadar adiponektin dan berakibat menurunkan bobot badan. Hal ini terjadi karena adiponektin menurunkan resistensi insulin dan menurunkan kadar trigliserida otot dan hati (Yamauchi et al. 2001). Isoflavon juga mampu mendorong lipolisis dan menghambat adipogenesis baik pada kultur sel maupun in vivo sehingga berpotensi mengurangi lemak tubuh (Harmon dan Harp 2001). Hasil penelitian ini berbeda dengan pernyataan diatas. Hal ini diduga karena isoflavon dapat bersifat estrogenik atau antiestrogenik, termasuk pada bobot badan (Tolman et al. 2008).
Korelasi negatif terjadi antara isoflavon yang terkandung pada pakan kacang kedelai dengan pertambahan bobot badan tikus perlakuan pakan kacang kedelai (Lampiran 6). Hal ini menunjukkan bahwa semakin tinggi kandungan isoflavon kacang kedelai semakin menurunkan bobot badan. Hasil ini serupa dengan pengaruh testosteron terhadap bobot badan tikus jantan dan menandakan isoflavon kacang kedelai pada penelitian bersifat antiestrogenik terhadap bobot badan. Menurut Davis et al (2012), testosteron mengurangi bobot badan tikus jantan dengan bertindak antiadipogenik melalui aktivitas lipolisis. Hal ini terjadi karena kemampuan katekolamin meningkat untuk menstimulasi lipolisis pada sel-sel lemak akibat adanya peningkatan reseptor β-adrenergik, aktivitas adenilat siklase, aktivitas protein kinase A, atau hormon sensitif lipase (Oh et al. 2005).
Korelasi antara kandungan isoflavon pada pakan isolat kacang kedelai dengan pertambahan bobot badan kelompok tikus perlakuan pakan isolat kacang kedelai adalah korelasi positif (Lampiran 6). Semakin tinggi kandungan isoflavon pakan isolat kacang kedelai berarti semakin meningkatkan bobot badan. Hal ini serupa dengan pengaruh
0 20 40 60 80 100 120 140 160 180 200 0 1 2 3 4 B o b o t b ad an (gr am ) Minggu
ke-Gambar 6 Bobot badan selama perlakuan ( kontrol, K2, K3, I3, I1, I2, K1). Keterangan: K1=
kedelai 100%, K2= kedelai 50%, K3= kedelai 10%, I1= isolat 100%, I2= isolat 50%, dan I3 = isolat 10%
estrogen terhadap bobot badan tikus betina dan menandakan konsumsi isoflavon isolat kacang kedelai mengakibatkan efek estrogenik pada bobot badan tikus jantan. Menurut Hardjopranjoto (1995) dalam Suprihatin (2008), pada metabolisme tubuh, estrogen meningkatkan sintesis dan sekresi hormon pertumbuhan sehingga dapat menstimulasi pertumbuhan sel-sel dalam tubuh, mempercepat pertambahan bobot badan, dan merangsang kelenjar korteks adrenal untuk meningkatkan metabolisme karena adanya retensi nitrogen yang meningkat. Oh et al. (2005) juga menyatakan bahwa estrogen juga dapat bertindak proandrogenik, meningkatkan jumlah adiposit melalui proliferasi dan diferensiasi sehingga meningkatkan massa jaringan adiposa.
Hasil uji statistika menunjukkan bahwa perlakuan kelompok pakan berpengaruh signifikan terhadap bobot badan (p<0.05) (Tabel 4). Hasil uji lanjut Duncan menunjukkan peningkatan bobot badan K2, K3, I1, I2, I3 dan penurunan bobot badan K1 tidak berbeda signifikan dengan kelompok kontrol sedangkan peningkatan bobot badan K3 berbeda signifikan dengan kontrol. Hal ini menunjukkan bahwa pakan K3 merupakan pakan yang paling berpengaruh meningkatkan bobot badan. Faktor penyebabnya diduga karena tikus K3 memiliki konsumsi pakan dan efisiensi pakan yang tinggi (Tabel 4).
Pertambahan bobot badan dipengaruhi oleh konsumsi pakan, semakin tinggi konsumsi pakan semakin tinggi pula pertambahan bobot badan (Farida et al. 2008). Peningkatan bobot badan kelompok kontrol, K2, K3, dan I3 didukung oleh konsumsi pakan tikus yang juga mengalami peningkatan, walaupun fluktuatif (Gambar 7). Lain halnya pada K1, I1, dan I2, terjadi penurunan bobot badan pada K1 tetapi konsumsi pakan kelompok ini meningkat sedangkan terjadi peningkatan bobot badan pada I1 dan I2 tetapi konsumsi pakan kelompok ini menurun (Gambar 6 dan Gambar 7). Namun konsumsi pakan rata-rata kelompok yang diberikan pakan perlakuan lebih tinggi dibandingkan kelompok yang diberikan pakan kontrol (Tabel 4). Hal ini menunjukkan bahwa isoflavon yang terkandung pada pakan diduga berakibat pula pada pola konsumsi pakan tikus. Uji korelasi Pearson juga menunjukkan bahwa isoflavon yang terkandung pada pakan juga berkorelasi dengan konsumsi pakan kelompok tikus perlakuan kacang kedelai (K) (0.4<r<0.7) dan isolat kacang kedelai (I) (0.2<r<0.4) (Lampiran 6).
Weickert et al. (2006) menunjukkan bahwa estradiol atau senyawa mirip estradiol dapat berinteraksi dengan peptida YY (PYY), suatu hormon yang mempengaruhi rasa kenyang. Konsumsi isoflavon kedelai diketahui meningkatkan konsentrasi PYY dan berakibat menurunkan nafsu makan. Namun hasil penelitian ini tidak sesuai dengan pernyataan di atas. Hal ini diduga disebabkan sifat estrogenik atau antiestrogenik isoflavon terhadap konsumsi pakan (Dixit et al. 2011).
Selain PYY terdapat senyawa lain yang mempengaruhi nafsu makan yaitu ghrelin dan leptin. Ghrelin merupakan hormon yang disekresikan ke dalam darah dan berfungsi merangsang nafsu makan sedangkan leptin merangsang rasa kenyang (Hyde et al. 2010). Keberadaan testosteron dapat meningkatkan konsentrasi ghrelin dan menurunkan leptin, yang berarti testosteron bertindak meningkatkan nafsu makan (Klatz dan Goldman 2004). Hasil ini serupa dengan yang terjadi pada K1, K2, dan K3, dan I1. Kelompok ini mengalami peningkatan nafsu makan atau konsumsi pakan selama perlakuan. Hal ini menunjukkan bahwa pakan K1, K2, dan K3, dan I1, bersifat antiestrogenik terhadap konsumsi pakan tikus. Penurunan bobot badan terjadi pada K1 namun konsumsi pakan pada kelompok ini tinggi. Hal ini diduga karena tikus mengalami sakit diare selama perlakuan. Menurut Harianto (2004), bahaya utama diare adalah
0 2 4 6 8 10 12 14 16 0 1 2 3 4 K o n su m si p ak an (gr am ) Minggu
ke-Gambar 7 Konsumsi pakan kelompok tikus ( kontrol, K2, K3, I3, I1, I2, K1. Keterangan:K1= kedelai 100 %, K2= kedelai 50%, K3= kedelai 10%, I1= isolat 100 % I2= isolat 50%, dan I3= isolat 10 %
kematian yang disebabkan karena tubuh banyak kehilangan air dan garam terlarut yang disebut dehidrasi. Dehidrasi yang terjadi pada penderita diare karena usus bekerja tidak sempurna sehingga sebagian besar air dan zat-zat yang terlarut didalamnya dibuang bersama feses sampai akhirnya tubuh kekurangan cairan. Derajat dehidrasi diukur menurut persentase terjadinya penurunan bobot badan selama diare.
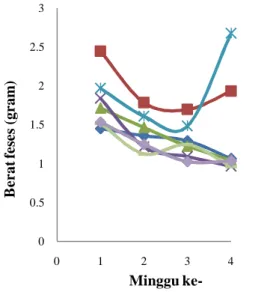
Terlihat pada Gambar 8 dan Tabel 4 berat feses K1 tinggi dan meningkat sedangkan kelompok lain berat fesesnya menurun. Selain itu selama penelitian feses kelompok ini juga terlihat lembek, berwarna hijau tua, dan lebih berbau padahal normalnya feses tikus seharusnya berwarna hitam dan padat. Meningkatnya frekuensi feses disertai adanya perubahan bentuk, dan konsistensi feses (Harianto 2004), feses menjadi lembek atau cair menandakan bahwa K1 terkena diare (Adnyana et al. 2004). Kondisi ini terjadi diduga karena zat nutrisi yang terkandung dalam pakan kacang kedelai terutama serat (Mardiah et al. 2006).
Kedelai merupakan bahan makanan yang tinggi serat (Mardiah et al. 2006). Serat kedelai diketahui dapat mempercepat waktu transit makanan (waktu yang diperlukan sejak dimakan sampai dikeluarkan berupa feses) sehingga meningkatkan volume feses. Serat yang terlalu banyak juga merupakan salah satu faktor penyebab diare (Hartiningrum 2010). Serat mempunyai daya serap air yang tinggi. Adanya serat makanan dalam feses menyebabkan feses dapat menyerap air yang banyak sehingga volumenya menjadi besar dan teksturnya menjadi lunak (Mardiah et al. 2006).
Kelompok I1 dan I2 mengalami peningkatkan bobot badan tetapi tidak disertai dengan konsumsi pakan yang mengalami peningkatan melainkan konsumsi pakan kelompok ini menurun (Gambar 6 dan Gambar 7). Hal ini sejalan dengan pengaruh estrogen terhadap bobot badan dan konsumsi pakan. Estrogen dapat menyebabkan peningkatan bobot badan dan bertindak menurunkan nafsu makan. Hal ini dikarenakan adanya leptin, suatu protein yang disekresi oleh sel lemak putih, yang dengan adanya estrogen kadarnya akan meningkat dan berpengaruh mengurangi nafsu (Nirwana et al. 1998).
Kandungan isoflavon pada pakan kacang kedelai maupun isolat kacang kedelai berkorelasi positif dengan konsumsi pakan kelompok tikus perlakuan (Lampiran 6).
Tabel 4 menunjukkan pakan K1 dan K2 juga I1 dan I2 lebih banyak meningkatkan konsumsi pakan tikus dibandingkan K3 atau I3. Berdasarkan hasil uji statistik didapatkan bahwa perlakuan kelompok pakan berpengaruh signifikan terhadap konsumsi pakan (p<0.05) (Tabel 4). Uji lanjut Duncan menunjukkan konsumsi pakan I1 dan I3 tidak berbeda signifikan dengan kontrol sedangkan konsumsi pakan K1, K2, K3, dan I2 berbeda signifikan dengan kontrol. Hal ini menunjukkan bahwa pakan K1, K2, K3, dan I2 merupakan pakan yang paling berpengaruh terhadap konsumsi pakan. Pakan K1, K2, dan K3 berpengaruh meningkatkan konsumsi pakan tikus sedangkan pakan I2 menurunkan. Adapun faktor-faktor lain yang mempengaruhi konsumsi pakan di antaranya keadaan lingkungan, kondisi tikus, serta kondisi pakan (bau, rasa, tekstur dan temperatur) (Rasmada 2008).
Pengamatan efisiensi pakan bertujuan untuk mengetahui kemampuan hewan coba untuk secara efisien memanfaatkan pakan. Efisiensi pakan merupakan perbandingan antara pertambahan bobot badan dengan jumlah konsumsi pakan dalam jangka waktu tertentu (Farida et al. 2008). K3 memiliki efisiensi pakan tertinggi sebesar 12, disusul dengan I2, K2, I1, I3, dan kontrol. K1 memiliki efisiensi pakan yang rendah bahkan bernilai minus (Tabel 4). Ketidakefisienan pakan K1 disebabkan karena tikus mengalami sakit diare selama masa perlakuan.
0 0.5 1 1.5 2 2.5 3 0 1 2 3 4 B e r at fe se s (gr am ) Minggu
ke-Gambar 8 Berat feses selama perlakuan ( kontrol, K2, K3, I3,
I1, I2, K1. Keterangan: K1= kedelai 100%, K2= kedelai 50%, K3= kedelai 10%, I1= isolat 100%, I2= isolat 50%, dan I3= isolat 10%
Menurut Usman dan Susilowati (2006), pakan yang berkualitas akan digunakan seefisien mungkin oleh hewan untuk produksi atau pertumbuhan maksimal sehingga konversi pakannya rendah. Efisiensi pakan selanjutnya dikatakan merupakan salah satu tolok ukur untuk menilai tingkat efisiensi penggunaan pakan, dengan semakin tinggi efisiensi pakan berarti penggunaan pakan lebih efisien. Efisiensi pakan tinggi berarti kualitas pakan lebih baik karena hewan coba dengan mengkonsumsi pakan sedikit dapat meningkatkan pertambahan bobot badan tinggi.
Kualitas pakan dapat diukur dari ketersediaan zat-zat nutrisi seperti protein, lemak, dan karbohidrat dalam pakan karena zat-zat ini dapat mempengaruhi terbentuknya jaringan-jaringan tubuh dan menyebabkan pertumbuhan bobot badan (Linder 1992 dalam Astuti 1999). Pakan perlakuan kacang kedelai dan isolat kacang kedelai memiliki kadar protein yang tinggi jika dibandingkan dengan pakan kontrol (Tabel 3) dan dapat dilihat pada Tabel 4, efisiensi pakan keduanya juga tinggi. Konsumsi pakan tikus perlakuan kacang kedelai dan isolat kacang kedelai juga lebih tinggi jika dibandingkan dengan kontrol (Tabel 4). Kandungan protein juga konsumsi pakan yang tinggi ini diduga menyebabkan kelebihan protein yang dikonversi menjadi lemak, disimpan dalam jaringan adiposa, dan dapat mempengaruhi pertambahan bobot badan (Astuti 1999).
Efisiensi pakan kelompok yang diberi pakan perlakuan kecuali pakan K1 lebih tinggi dibandingkan dengan kelompok yang diberi pakan kontrol. Hal ini menunjukkan bahwa isoflavon yang terkandung pada pakan diduga juga mempengaruhi efisiensi pakan. Uji korelasi Pearson juga menunjukkan terdapat korelasi antara kandungan isoflavon pada pakan dengan efisiensi pakan kelompok
perlakuan kacang kedelai (K) (0.7<r<1) dan isolat kacang kedelai (I) (0.2<r<0.4) (Lampiran 6).
Efisiensi pakan dipengaruhi oleh beberapa faktor seperti spesies hewan, jenis kelamin, dan usia. Menurut Payne et al. (2001) dalam Qian dan Sun (2009), konsumsi isoflavon pada tikus betina meningkatkan bobot badan sedangkan pada tikus jantan menurunkan bobot badan dan efisiensi pakan. Pernyataan ini tidak sejalan dengan hasil penelitian. Hal ini diduga dikarenakan efek estrogenik atau antiestrogenik isoflavon terhadap efisiensi pakan (Jo dan Choi 2008).
Korelasi negatif terjadi antara kandungan isoflavon pada pakan kacang kedelai dengan efisiensi pakan tikus perlakuan pakan kacang kedelai (Lampiran 6). Tikus jantan diketahui mempunyai testosteron yang jauh lebih tinggi dibandingkan betina (Ostner et al. 2003). Isoflavon pada pakan kacang kedelai diduga bersifat antiestrogenik terhadap efisiensi pakan sehingga menurunkan efisiensi pakan dan juga bobot badan tikus jantan. Namun antara isoflavon yang terkandung pada isolat kacang kedelai dengan efisiensi pakan kelompok perlakuan isolat kacang kedelai terjadi korelasi positif. Estrogen lebih tinggi pada betina dibandingkan jantan (Shabsigh et al. 2005) dan isoflavon isolat kacang kedelai diduga bersifat estrogenik pada efisiensi pakan tikus sehingga meningkatkan efisiensi pakan dan bobot badan tikus jantan penelitian (Payne et al. 2001 dalam Qian dan Sun 2009).
Analisis statistik menunjukkan bahwa perlakuan kelompok pakan berpengaruh signifikan terhadap efisiensi pakan (p<0.05) (Tabel 4). Berdasarkan uji lanjut Duncan efisiensi pakan K2, I1, I2, dan I3 dan ketidakefisienan pakan K1 tidak berbeda signifikan dengan kontrol sedangkan efisiensi pakan K3 berbeda signifikan dengan kontrol. Hal ini menunjukkan pakan yang paling Tabel 4 Bobot badan, konsumsi pakan, efisiensi pakan, dan berat feses
Kelompok Pertambahan bobot badan (g/hari)
Konsumsi pakan
(g/hari) Efisiensi pakan Feses (g/hari) Kontrol 0.25 ±0.38ab 7.82 ±0.47a 0.03 ±0.05ab 1.28 ±0.27a K1 -0.18 ±0.56a 10.03 ±1.69bc -0.02 ±0.06a 1.98 ±0.23b K2 0.93 ±0.17bc 10.44 ±0.35c 0.09 ±0.01bc 1.96 ±0.26b K3 1.18 ±0.50c 9.68 ±0.49bc 0.12 ±0.05c 1.34 ±0.12a I1 0.66 ±0.17bc 9.03 ±1.08abc 0.07 ±0.02bc 1.20 ±0.04a I2 0.98 ±0.73bc 9.96 ±0.38bc 0.10 ±0.07bc 1.20 ±0.17a I3 0.50 ±0.46abc 8.67 ±0.83ab 0.06 ±0.05bc 1.26 ±0.16a Keterangan: Data disampaikan dalam rata-rata±standar deviasi. Huruf yang berbeda di kolom yang sama bermakna
berbeda signifikan (p<0.05). Persentase efisiensi pakan= pertambahan bobot badan/konsumsi pakan. K= kedelai 100%, K2= kedelai 50%, K3 = kedelai 10%, I1 = isolat 100%, I2 = isolat 50%, dan I3= isolat 10%
berpengaruh terhadap efisiensi pakan adalah pakan K3. Ini terjadi diduga akibat konsumsi pakan dan pertambahan bobot badan K3 yang juga berbeda signifikan dengan kontrol karena nilai efisiensi pakan secara kuantitatif dipengaruhi oleh banyaknya konsumsi pakan dan nilai pertambahan bobot badan (Usman dan Susilowati 2006).
Pengaruh Perlakuan Pemberian Pakan terhadap Kadar Testosteron dan
Dihidrotestosteron Hewan Coba
Fitoestrogen memiliki dua gugus hidroksil (OH) yang berjarak 11.0 – 11.5 amstrong pada intinya, sama persis dengan estrogen. Selain itu cincin fenolat fitoestrogen juga memiliki kemiripan dengan struktur cincin fenolat estrogen pada mamalia. Gugus OH dengan jarak 11 amstrong dan cincin fenolat inilah yang menjadi struktur pokok suatu substrat agar mempunyai efek estrogenik sehingga mampu berikatan dengan reseptor estrogen. Fitoestrogen juga merupakan kompetitor aktif untuk reseptor estrogen, terutama reseptor estrogen β. Mekanisme kompetisi fitoestrogen terhadap estrogen endogen adalah dengan menghambat aktivitas enzim DNA isomerase II sehingga ekspresi protein dalam sel terhambat. Mekanisme tersebut juga terjadi dalam penghambatan fitoestrogen terhadap siklus sel (Sitasiwi 2009).
Empat senyawa fenolik yang dihasilkan oleh tanaman yang dianggap fitoestrogen yaitu isoflavon, stilben, lignan dan coumestan (Cornwell et al. 2004). Dua isoflavon yang berlimpah pada kedelai adalah genistein dan daidzein (Fanti 1999). Genistein dan daidzein pada tumbuhan terutama terdapat dalam bentuk glikosida yang bersifat tidak aktif yaitu genistin dan daidzin. Namun, ketika residu gula terputus melalui dekonjugasi oleh bakteri dalam usus, genistin dan daidzin akan berubah menjadi bentuk aglikon yang aktif yaitu genistein dan daidzein (Pan et al. 2008). Genistein menyumbang sekitar 50% dari total isoflavon kedelai sedangkan daidzein sekitar 40% (Rimbach et al. 2008).
Testosteron adalah bentuk androgen dominan pada jantan. Tempat produksi utama testosteron pada jantan adalah sel Leydig testis (Fargo et al. 2009). Sejumlah kecil testosteron juga diproduksi di kelenjar adrenal dan perifer (Murray et al. 2003).
Isoflavon berkompetisi dengan estrogen endogen untuk mengikat reseptor estrogen. Konsumsi isoflavon yang tinggi dapat menyebabkan afinitas isoflavon yang rendah
jika dibandingkan dengan 17β-estradiol untuk mengikat reseptor estrogen, dengan isoflavon kedelai memiliki sekitar 1/1000 dan 1/3 dari afinitas 17β-estradiol masing-masing untuk ERα dan ERβ, menjadi dapat mengikat reseptor estrogen, dan mengakibatkan estrogen endogen meningkat (Rimbach et al. 2008). Normalnya ketika estrogen endogen meningkat, estrogen akan menghambat hipotalamus dan hipofisis anterior melalui reaksi umpan balik negatif. Estrogen menghambat secara langsung sekresi GnRH pada hipotalamus, akibatnya pengeluaran LH yang dipicu oleh GnRH menjadi tertekan, tetapi efek primernya terhadap hipofisis anterior yakni menurunkan kepekaan sel penghasil gonadotropin (Nasution 2011). Sintesis testosteron di sel Leydig menurun, kadar testosteron berkurang, dan aromatisasi testosteron terhambat sehingga produksi estrogen endogen menurun (Hoffman et al. 2009).
Ketika isoflavon berikatan dengan reseptor estrogen, isoflavon diduga memicu inhibisi umpan balik negatif estrogen terhadap GnRH. Isoflavon berikatan dengan reseptor, mencegah estrogen dari membatasi pelepasan GnRH. Hipotalamus kemudian melepaskan GnRH dan mensekresinya ke hipotalamus-hipofisis. Setelah mencapai hipofisis anterior, GnRH merangsang pelepasan LH maupun FSH. LH diambil oleh sel-sel Leydig yang berikatan pada reseptor spesifik membran, dan menyebabkan sekresi testosteron (Wahyuni 2012). Hal ini diduga efek antiestrogenik isoflavon. Senyawa antiestrogenik bertindak sebagai estrogen antagonis yang dapat berikatan dengan reseptor estrogen namun menghambat respon estrogen sedangkan senyawa estrogenik adalah senyawa yang kemampuannya untuk bertindak sebagai estrogen agonis yang dapat berikatan dengan RE dan menstimulasi respon estrogen. Isoflavon bersifat antiestrogenik ketika kadar estrogen tinggi, sebaliknya isoflavon dapat juga bersifat estrogenik ketika kadar estrogen rendah (Robertson 2000).
Efek antiestrogenik ini terjadi diduga untuk menjaga homeostasis tubuh antara testosteron dan estrogen. Normalnya kisaran optimal untuk rasio testosteron dengan estrogen adalah sekitar 3-4 per 1 untuk jantan, dan 1 sampai 2 untuk betina (Shabsigh et al. 2005). Isoflavon, salah satunya biochanin A juga merupakan inhibitor aromatase, enzim kunci yang berperan dalam pembentukan estradiol dari testosteron dan androstenedion, yang bertugas bila kadar estrogen meningkat
sementara testosteron menurun pada jantan. Selain itu genistein dan biochanin A juga inhibitor 17-β-hidroksisteroid dehidrogenase, enzim yang mengubah androgen menjadi estrogen (Gaynor et al. 2003).
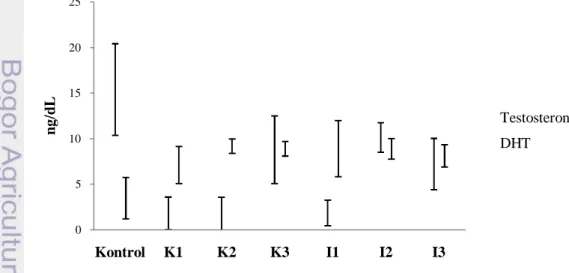
Gambar 9 menunjukkan adanya penurunan rata-rata kadar hormon testosteron pada kelompok yang diberi isoflavon (kelompok perlakuan) dibandingkan dengan kelompok yang tidak diberi isoflavon (kelompok kontrol) pada tikus jantan. Hasil uji korelasi Pearson menunjukkan terdapat korelasi antara kandungan isoflavon pada pakan dengan kadar testosteron kelompok tikus perlakuan pakan kacang kedelai (K) (0.7<r<1) dan isolat kacang kedelai (I) (0.4<r<0.7) (Lampiran 10). Hasil penelitian ini sejalan dengan penelitian yang dilakukan oleh Wahyuni et al. (2012) yang menyatakan bahwa pemberian isoflavon dosis 1.26 mg per 200 gram berat badan tikus secara oral selama 48 hari pada tikus jantan juga menyebabkan penurunan kadar hormon testosteron. Hasil penelitian Akinola et al. (2007) juga menunjukkan bahwa kadar testosteron tikus jantan menurun secara signifikan dengan pemberian isoflavon 1.5 mg/kg/ekor/hari.
Penurunan kadar testosteron pada penelitian ini terjadi diduga karena tikus jantan yang digunakan normal, tidak mengalami kekurangan testosteron, atau umur kekurangan testosteron (>6 bulan) sehingga hormon dan organ reproduksi tikus dalam keadaan normal. Induksi testosteron eksogen atau senyawa upregulation testosteron eksogen pada tikus normal (pada penelitian berupa isoflavon kedelai) diduga dapat menyebabkan kadar testosteron berlebih dan menjadikan umpan balik negatif bagi ketersediaan testosteron (Ibekwe et al. 2009).
Kadar testosteron yang tinggi akan menghambat sekresi LH dari hipofisis anterior melalui suatu efek langsung pada hipofisis dan suatu efek penghambat pada tingkatan hipotalamus untuk menghambat sintesis testosteron dan mengakibatkan produksi testosteron menurun. Selain itu efek umpan balik negatif lain diduga diperantarai oleh estradiol yang dapat dihasilkan lokal dari aromatisasi testosteron (Wahyuni 2012). Hal ini dapat terjadi karena baik reseptor androgen dan estrogen terletak di bagian otak, hipotalamus dan hipofisis. Jadi estrogen juga dapat memicu respon umpan balik negatif dalam organ ini (Akinola et al. 2007). Selain itu, isoflavon pada konsentrasi tinggi juga menghambat kerja enzim 17-β-hidroksisteroid dehidrogenase, enzim yang dibutuhkan untuk
sintesis testosteron untuk mengkonversi androstenedion menjadi testosteron (Rice dan Whitehead 2006).
Reseptor estrogen dalam jaringan tubuh terdiri atas dua macam, reseptor estrogen α (REα) dan reseptor estrogen β (REβ) dengan tempat distribusi yang berbeda. REα lebih banyak terdistribusi pada jaringan penyusun organ reproduksi sedangkan REβ terdistribusi di luar jaringan reproduksi. REα terdapat jaringan reproduksi, ginjal, tulang, jaringan adiposa putih, dan hati, sedangkan REβ berada pada prostat, paru, saluran pencernaan, kandung kemih, sel-sel hematopoietik, dan sistem saraf pusat (Matthews dan Gustafsson 2003). Perbedaan letak reseptor ini menyebabkan perbedaan efek paparan isoflavon pada hewan uji. Fitoestrogen memiliki afinitas yang lebih kuat pada REβ yang terdistribusi pada jaringan di luar organ reproduksi (Sitasiwi 2009). Hal ini juga diduga menyebabkan isoflavon tidak memberikan peningkatan kadar testosteron pada tikus jantan pada penelitian ini.
Selain itu menurut Lehninger et al. (1982), pada saat penghentian sekresi, konsentrasi hormon kembali dengan cepat ke taraf istirahat. Kehadirannya tidak diperlukan lagi, dengan cepat hormon dijadikan tidak aktif. Hormon-hormon dalam darah berada pada kondisi istirahat konsentrasinya sangat rendah, berkisar dalam satuan mikromolar (10-6 M) sampai pikomolar (10-12 M). Pengambilan darah pada waktu yang tepat misalnya saat hormon aktif disintesis atau disekresikan penting dilakukan. Faktor lain yang mempengaruhi pemeriksaan hormon antara lain usia, jenis kelamin, keadaan stres, dan
obat-obatan (Howaritz dan Henry 2001). Allen dan Key (2000) mengungkapkan
bahwa nutrisi atau gizi sangat mempengaruhi metabolisme hormon. Salah satunya pada keadaan kekurangan gizi. Situasi ini paling jelas pada betina, dengan penurunan dalam konsentrasi gonadotropin dan estrogen darah, serta terganggunya siklus menstruasi. Kekurangan gizi kronis pada jantan juga dapat menyebabkan konsentrasi yang sangat rendah pada testosteron dan LH. Penurunan testosteron pada K1 diduga karena tikus mengalami diare sehingga meningkatkan waktu transit makanan di usus dan menyebabkan menurunnya laju absorpsi nutrisi untuk mendukung ketersediaan testosteron (Sinthamurniwaty 2006).
Presentase rata-rata penurunan kadar testosteron terendah terdapat pada kelompok perlakuan pakan I2 sebesar 16.24% sedangkan
presentase rata-rata penurunan terbesar terjadi pada kelompok perlakuan pakan K2 sebesar 95.11% (Tabel 5). Bila penurunan ini diakibatkan perlakuan pakan memicu testosteron yang berlebih pada tikus, bisa dikatakan pemurnian kedelai menjadi isolat dengan protein 90% ternyata tidak memberikan kadar testosteron lebih tinggi jika dibandingkan dengan kedelai.
Kandungan isoflavon pada pakan berkorelasi negatif dengan kadar testosteron tikus baik kelompok tikus perlakuan pakan kedelai maupun isolat. Semakin tinggi kandungan isoflavon pada pakan berarti semakin menurunkan kadar testosteron. Pakan K3 dengan kosentrasi isoflavon 0.01±0.0005 mg daidzein total/g menurunkan kadar testosteron kelompok tikus K3 sebesar 46.58%. Kadar testosteron semakin menurun menjadi sebesar 95.11% ketika kelompok tikus diberikan pakan K2 (0.08±0.0003 mg daidzein total/g pakan) (Tabel 5).
Penurunan kadar testosteron sebesar 16.24% terdapat pada kelompok tikus perlakuan pakan I2 (0.07±0.0026 mg daidzein total/g pakan). Penurunan kadar testosteron menjadi sebesar 87.24% pada kelompok tikus yang diberikan pakan pakan I1 (0.14±0.0052 mg daidzein total/g pakan). Penurunan kadar testosteron yang lebih rendah pada kelompok I3 jika dibandingkan dengan I1 dan I2 diduga disebabkan isoflavon yang terkandung pada pakan I3 belum cukup untuk dapat meningkatkan kadar testosteron. Selain itu kandungan isoflavon lebih tinggi pada K1 (0.15 mg daidzein total/g pakan) dibandingkan K2 (0.08 mg daidzein total/g pakan) namun penurunan kadar testosteron
pada K1 yang lebih rendah dibandingkan dengan K2 diduga disebabkan tikus mengalami diare (Tabel 5).
Penelitian Astuti et al. (2008) melaporkan bahwa pada konsentrasi isoflavon 22.2 mg/g dapat memberikan peningkatkan kadar testosteron pada tikus jantan. Isoflavon hasil penelitian lebih rendah jika dibandingkan isoflavon pada penelitian Astuti et al. (2008) namun belum dapat meningkatkan kadar testosteron (Tabel 5). Hal ini diduga karena perbedaan komposisi pakan dan penggunaan metode analisis hormon. Hormon pada penelitian ini dianalisis menggunakan ELISA sedangkan penelitian Astuti et al. (2008) menggunakan Radioimmunoassay (RIA). RIA memiliki sensivitas lebih tinggi jika dibandingkan dengan ELISA (Asihara dan Kasahara 2001).
Hasil uji statistik menunjukkan bahwa perlakuan kelompok pakan berpengaruh nyata terhadap kadar testosteron (p<0.05) (Lampiran 11). Uji lanjut Duncan menunjukkan penurunan kadar testosteron I2, K3, I3 tidak berbeda signifikan dengan kelompok kontrol sedangkan pada K1, K2, I1 berbeda signifikan dengan kelompok kontrol. Hal ini menunjukkan pakan K1, K2, dan I1 merupakan pakan yang paling menurunkan kadar testosteron. Kandungan isoflavon pada pakan diduga menyebabkan pakan tersebut berpengaruh. Tabel 5 menunjukkan kandungan isoflavon pakan K1, K2, dan I1 lebih tinggi jika dibandingkan dengan kelompok perlakuan lain. Semakin tinggi kandungan isoflavon pada pakan diduga semakin tinggi pula menurunkan kadar testosteron. 0 5 10 15 20 25 Kontrol K1 K2 K3 I1 I2 I3 n g/ d L Testosteron DHT
Gambar 9 Kadar testosteron dan DHT kelompok tikus. Keterangan: K1=kedelai 100%, K2=kedelai 50%, K3=kedelai 10%, I1=isolat 100%, I2=isolat 50%, dan I3=isolat 10%