HASIL DAN PEMBAHASAN
Karakterisasi Bahan
Bahan baku ubi jalar diperoleh dari balai penelitian CIP Muara, Bogor dan Balai Penelitian Kacang-kacangan dan Umbi-umbian, Malang.
Ubi jalar yang diperoleh dari CIP Muara, Bogor adalah ubi jalar berdaging umbi warna oranye, masih tergolong klon hasil pemuliaan, yaitu klon BB 00105.10 yang ditanam pada ketinggian sekitar 750 m diatas permukaan laut, dengan perkiraan produksi/panen sebesar 19,4 ton/hektar, sedangkan ubi jalar dari Malang berdaging umbi warna putih dan memiliki semburat-semburat warna oranye atau kuning, merupakan varietas ubi jalar yang sudah ada di masyarakat dengan nama varietas sewu. Menurut Litbang Balikabi Malang, ubi jalar varietas sewu ini memiliki kadar beta karoten sebesar 14 mikrogram/gram. Keduanya dipanen 3-4 bulan setelah masa tanam.
Penelitian Pendahuluan
Penelitian pendahuluan meliputi pemilihan pelarut yang akan digunakan selama ekstraksi untuk persiapan analisa HPLC, dan pemilihan pelarut sebagai fase gerak untuk analisa HPLC.
Pemilihan Pelarut untuk Ekstraksi Karotenoid Ubi jalar
Ubi jalar terutama yang berdaging umbi warna kuning atau oranye memiliki kandungan karotenoid yang didominasi oleh beta karoten dan ditemukan dalam bentuk trans (Bauernfeind & Klaul 1981; Khachik & Beecher 1987; Gross 1991). Komponen karotenoid lain dalam ubi jalar selain beta karoten adalah α karoten, γ karoten, ξ karoten, phytoene dan phytofluene yang kadar totalnya masih kurang dari 1% (Purcell & Walter 1968). Dalam beberapa penelitian yang dituliskan oleh Gross (1991) ubi jalar mentah memiliki kadar beta karoten yang terdiri dari neo-beta karoten B (0,1%), all trans beta karoten (96,7%) dan neo beta karoten U (1,3%) setelah pemasakan selama 20 menit persentase komposisi masing-masing menjadi 24,9%, 69,7% dan 5,4%, trans beta karoten masih mendominasi. Oleh
karena itu, penelitian ini menggunakan standar beta karoten all trans type 1 dari Sigma.
Karotenoid termasuk senyawa lipida yang tidak tersabunkan, larut dengan baik dalam pelarut-pelarut organik, seperti karbon disulfida, benzena, kloroform, aseton, metanol, etanol, eter dan petroleum eter, tetapi tidak larut dalam air (Goodwin 1976; Hasan 1987 dalam Muchtadi 1992). Sifat ini penting dipelajari lebih dahulu terutama pada tahap ekstraksi karotenoid dari bahan uji yang lain. Delgado-Vargas dan Paredes-Lopez (2003) menyatakan bahwa ekstraksi dengan pelarut kimia adalah salah satu metode pemisahan yang memiliki beberapa keunggulan dibanding metode yang lain seperti Super Critical Fluida Extraction (SFE), yaitu biaya yang lebih rendah. Namun demikian, pada metode ini perlu diperhatikan jenis pelarut yang digunakan yaitu memiliki titik didih rendah, tidak mudah terbakar, dan tidak beracun.
Tahap ekstraksi ini disiapkan dengan mengacu pada jenis analisa yang akan dilakukan yaitu pengukuran kadar trans-beta karoten menggunakan HPLC. Hal ini perlu mendapat perhatian lebih sebagai persiapan analisis karena sejauh ini belum ada prosedur standar untuk ekstraksi beta karoten maupun karotenoid disebabkan oleh banyaknya jenis produk makanan yang mengandung senyawa ini, dan luasnya kisaran kandungan karotenoid yang dapat ditemukan pada sampel (Oliver & Palou 2000). Di samping itu, belum ada solven tunggal yang optimal untuk mengekstrak semua karotenoid dalam sampel bahan pangan. Karbon disulfida adalah yang terbaik tapi sifatnya yang volatil, mudah terbakar, toksik, dan mudah rusak telah membatasi penggunaannya (Oliver & Palou 2000). Proses ekstraksi melibatkan pemisahan karotenoid yang hidrofob dari medium yang hidrofili. Oleh karena itu, pelarut yang digunakan untuk proses ekstraksi satu komoditi berbeda untuk komoditi yang lain, bahkan untuk komoditi yang sama karena komoditi tersebut memiliki bemacam-macam varietas dan karakteristik maupun komposisi hidrofilik-hidrofobiknya masing-masing.
Eder (1996) menyarankan penggunaan dietil eter atau petroleum eter untuk proses ekstraksi, Amaya (1997) menggunakan tetra-hidrofuran (THF) untuk sampel ubi jalar afrika berdaging umbi warna putih. Jaarsveld et al. (2006) menggunakan campuran THF-metanol 1:1 (v/v) untuk sampel ubi jalar. Dengan
memperhatikan tingkat polaritas masing-masing pelarut dan efektivitasnya menarik atau mengekstrak karotenoid dari tepung ubi jalar, maka telah dilakukan percobaan menggunakan beberapa pelarut dan kombinasi berbagai pelarut (Lampiran 5).
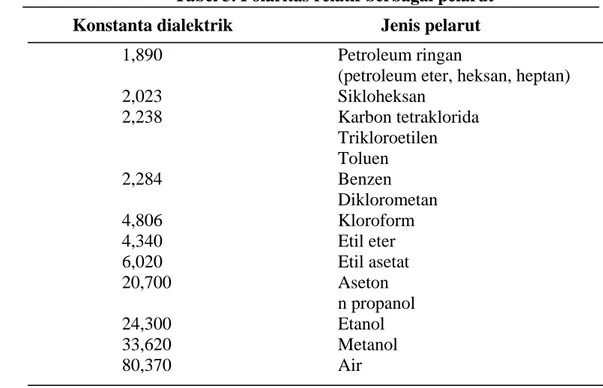
Pemilihan pelarut yang akan digunakan tersebut dievaluasi efektivitasnya pada kecepatan pemisahan fase polar dan non polar serta absorbansi hasil ekstraksi yang dihasilkannya. Besarnya polaritas dari zat pelarut proporsional dengan besarnya konstanta dialektriknya (Adnan 1997), seperti terlihat pada Tabel 3 berikut ini :
Tabel 3. Polaritas relatif berbagai pelarut* Konstanta dialektrik Jenis pelarut
1,890 Petroleum ringan
(petroleum eter, heksan, heptan)
2,023 Sikloheksan 2,238 Karbon tetraklorida Trikloroetilen Toluen 2,284 Benzen Diklorometan 4,806 Kloroform 4,340 Etil eter 6,020 Etil asetat 20,700 Aseton n propanol 24,300 Etanol 33,620 Metanol 80,370 Air * Adnan 1997
Secara umum proses ekstraksi beta karoten biasanya memakai heksan karena sifat non polarnya yang paling tinggi, namun dari hasil percobaan diperoleh hasil bahwa kombinasi pelarut heksan:aseton (10:1) relatif lebih cepat dan tinggi nilai absorbansi hasil ekstraksinya. Hal ini pernah pula dilakukan oleh Masni (2004) dan Jaren et al. (1999) yang mengungkap bahwa penambahan sedikit aseton mampu menambah daya tarik pelarut terhadap beta karoten, maka untuk ekstraksi awal karotenoid dari tepung ubi jalar digunakan pelarut
heksan:aseton (10:1). Ekstrak yang diperoleh dari ekstraksi awal masih merupakan campuran antara karotenoid non polar dan sedikit karotenoid polar serta beberapa senyawa lipofilik lain sehingga disebut ekstrak kasar.
Ekstrak kasar selanjutnya akan disaponifikasi dengan larutan kalium hidroksida 5% dalam metanol untuk membebaskan karotenoid yang ada dalam bentuk ester dengan asam lemak, selain menyabunkan lemak yang belum tersabunkan. Setelah proses penyabunan, sabun yang terbentuk dipisahkan menggunakan pelarut yang bersifat non polar yaitu heksan karena dari hasil percobaan menunjukkan absorbansi tertinggi pada hasil ekstraksinya walaupun waktu yang digunakan lebih lama. Penambahan pelarut ini mengakibatkan karotenoid non polar saja yang terlarut, sedangkan sabun terbawa ke dalam pelarut yang lebih polar, yaitu air yang ditambahkan.
Proses saponifikasi tetap dilakukan dengan mempertimbangkan bahwa kadar lemak tepung ubi jalar adalah sekitar 2,97% (hasil analisa proksimat tepung ubi jalar). Hal ini bertentangan dengan beberapa metode analisa karotenoid yang akhir-akhir ini berkembang yaitu tidak dilakukannya tahap saponifikasi untuk bahan-bahan yang mengandung kadar lemak dibawah 45% dengan alasan proses tersebut dapat merusak vitamin yang terkandung (Oliver & Palou 2000). Namun demikian, persiapan analisa beta karoten yang dilakukan pada penelitian ini tetap menggunakan tahap saponifikasi untuk meminimalkan pengotor yang akan menghasilkan pengganggu-pengganggu pada hasil kromatogram HPLC. Tahap ini dilakukan dengan modifikasi waktu, suhu pemanasan, penghembusan gas N2 sebelum pemanasan, tabung digoyang 10 menit sekali serta pendinginan tabung segera setelah proses pemanasan. Waktu saponifikasi adalah 30 menit, berbeda dari waktu yang biasa dilakukan yaitu 60 menit dan suhu yang digunakan adalah 500C (Eder 1996). Penghembusan N2 dilakukan untuk mengantisipasi terjadinya oksidasi selama pemanasan, jika pemanasan dilakukan dengan penghembusan N2 lebih dahulu maka enzim polifenol yang mungkin masih ada tidak sempat bereaksi dengan oksigen tapi dengan N2, sehingga mencegah proses pencoklatan yang mengindikasikan terjadinya proses oksidasi.
Proses ekstraksi dilakukan secepat mungkin dan penghembusan N2 setiap saat terutama sebelum vortex tabung untuk meminimalkan penurunan kadar beta
karoten selama persiapan analisa. Semua proses persiapan sampel dilakukan dalam ruang gelap untuk meminimalkan terjadinya fotooksidasi. Proses persiapan ini juga harus dilakukan secara ringkas (dalam 1 hari dan jika perlu penyimpanan maka harus dilakukan dalam kondisi kering atau tidak terlarut dalam pelarut non polar) untuk mencegah terjadinya oksidasi meskipun antisipasi terjadinya oksidasi telah dilakukan yaitu dengan penambahan antioksidan berupa BHT (0,01%) dalam setiap pelarut (Bauernfeind & Klaul 1981) dan penghembusan N2, sehingga selain mencegah terjadinya oksidasi, data yang dihasilkan juga lebih akurat dan konsisten. Hasil yang diperoleh adalah ekstrak kering yang diperkirakan didominasi oleh trans-beta karoten yang pada analisa berikutnya akan dibandingkan dengan standar all trans beta karoten untuk mendapatkan data kuantitatif kadar beta karoten sampel.
Data yang konsisten juga diperoleh dari keseragaman ukuran partikel bahan pangan yang diekstrak, karena ukuran partikel berpengaruh pada efektivitas penetrasi pelarut menarik senyawa yang diinginkan dari bahan asalnya. Makin halus ukuran, makin luas permukaannya, makin efektif proses ekstraksi (Tabel 4).
Tabel 4. Hasil perhitungan luas permukaan tepung dan kadar beta karoten
Bahan Luas muka (m2) [beta karoten] (ppm)
Var Sewu - blanching 3.17 9.79
Var Sewu – non blanching 16.50 11.52 • Data ukuran partikel berdasarkan pengamatan mikroskop polarisasi (Lampiran 7)
• Hitungan lengkap mengenai luas permukaan tepung ini ada di Lampiran 9
Tepung ubi jalar varietas sewu yang memiliki luas permukaan lebih besar ternyata memiliki kadar beta karoten yang lebih besar pula. Hal ini pernah pula dilakukan Suismono (1995) dalam membuat tepung ubi jalar dengan berbagai ukuran, total karoten tepung dengan mesh 100 lebih besar daripada tepung dengan mesh 80 dan 60 (Suismono 1995). Meskipun demikian, perlakuan proses tanpa blanching menyebabkan kadar beta karoten terutama bentuk trans relatif lebih banyak daripada proses dengan blanching.
Pemilihan Pelarut untuk Fase Gerak pada Analisa Trans Beta Karoten Menggunakan HPLC
HPLC atau High Performance Liquid Chromatography digunakan sebagai salah satu alat untuk mengidentifikasi dan mengkuantifikasi komponen-komponen pembentuk karotenoid hasil ekstraksi, termasuk kadar trans beta karoten.
Suatu penelitian tentang penggunaan spektrofotometer sebagai alat untuk mengukur kadar karotenoid telah dilakukan Zukhrawardi (1994) dan menyatakan bahwa pengukuran kadar beta karoten menggunakan spektrofotometer berbeda nyata dengan pengukuran kadar beta karoten yang menggunakan HPLC (p<0,05) pada pemisahan beta karoten dari limbah pemucatan minyak sawit. Hal ini menunjukkan bahwa spektrofotometer memiliki kemampuan yang lebih rendah untuk mendeteksi kadar beta karoten dari limbah pemucatan minyak sawit apabila dibandingkan dengan HPLC. HPLC lebih efektif apabila dibandingkan dengan spektrofotometer karena memiliki sensitivitas dan akurasi yang tinggi serta analisis dapat langsung dimonitor komputer dan rekorder (Zukhrawardi 1994). Alat lain yang dapat digunakan untuk mengidentifikasi karotenoid selain
HPLC adalah teknik kromatografi lapis tipis (TLC). Identifikasi dengan kromatografi lapis tipis didasarkan atas nilai Rf dan jumlah noda (spot), sedangkan HPLC berdasarkan waktu retensinya dalam suatu pelarut. Waktu retensi yang sama seperti ditunjukkan oleh standar menyatakan zat yang sama pada sampel, karenanya pengujian HPLC memerlukan suatu standar (contoh hasil kromatogram HPLC dapat dilihat pada Lampiran 10).
Dalam hal penggunaan kolom, baik kolom normal-phase maupun reverse-phase dapat dengan baik memisahkan komponen senyawa karotenoid, meskipun sistem reverse-phase lebih sering digunakan (Cserhati & Forgacs 2001). Reverse-phase HPLC seperti kolom C8 dan C18 cukup baik dalam memisahkan senyawa-senyawa karotenoid (Su et al. 2002).
Secara umum, sistem elusi solven gradien lebih baik dibandingkan isokratik (Cserhati & Forgacs 2001). Kondisi tersebut berlaku universal pada sampel, termasuk senyawa karotenoid. Namun pemilihan antara sistem elusi solven isokratik ataupun gradien tergantung pada tujuan pemisahan. Bila menggunakan
isokratik tujuan pemisahan sudah tercapai, maka tidak perlu dilanjutkan dengan gradien untuk mencapai yang lebih baik (Cserhati & Forgacs 2001).
Ada beberapa macam detektor untuk HPLC seperti UV-Visible, Electrochemical array detection (ED), Thermal lens spectrometry (TLS), Mass Spekroscopy (MS) dan sebagainya. Detektor UV-Visible dengan panjang gelombang tunggal telah digunakan sebagai komponen dari sistem HPLC untuk kuantitasi karotenoid. Pendeteksian dengan detektor ini memungkinkan sensitivitas yang cukup untuk beberapa tujuan rutin ( Su et al. 2002).
Sebelum memulai analisis sampel dengan HPLC dilakukan tahap pengkondisian sistem HPLC. Tahap ini sangat perlu dilakukan untuk mendapatkan pemisahan dan kuantitasi analat sampel yang akurat, tidak terganggu oleh faktor-faktor pengganggu (yang menimbulkan noise) yang berasal dari adanya pengotor atau bubble pada sistem pelarut. Pengkondisian ini juga untuk penyesuaian kolom dengan sistem pelarut yang akan digunakan. Pengkondisian sistem HPLC yang baik ditunjukkan oleh base line yang lurus pada kromatogram dan stabilitas tekanan pompa dapat dilihat pada monitor di HPLC.
Untuk menghindari adanya gelembung udara yang terlarut dalam pelarut maka sebelum digunakan perlu dilakukan degassing (penghilangan gelembung). Penghilangan gelembung udara ini dapat dilakukan dalam wadah pelarut yang berupa botol gelas dengan menggunakan Helium yang dialirkan ke wadah pelarut. Degassing juga dapat dilakukan dengan vakum, panas atau ultrasonifikasi. Perlunya dilakukan penghilangan udara/gas terlarut dalam pelarut untuk mencegah terbentuknya gelembung-gelembung udara pada keseluruhan sistem alat HPLC yang akan mempengaruhi kerja pompa dan kesalahan deteksi akibat adanya udara yang terperangkap di dalam sel (detektor) (Apriyantono 2003).
Pada penelitian ini pengkondisian sistem HPLC dilakukan dengan mengalirkan pelarut polar yaitu metanol dengan kecepatan alir 1 ml/menit dan tekanan yang dinaikkan secara bertahap hingga tekanan yang diperlukan secara spesifik melihat kinerja sistem dengan base line yang dihasilkannya. Hal ini menghasilkan kolom yang terkondisi dan pengotor-pengotor dapat tercuci. Setelah pelarut polar menunjukkan kinerja yang baik, pelarut diganti menggunakan fase
gerak. Lamanya tahap pengkondisian biasanya 1 jam, sangat tergantung pada kondisi HPLC dan kolom yang digunakan. Jika base line sudah lurus berarti sistem HPLC sudah siap digunakan untuk analisis sampel.
Berbagai kombinasi pelarut sebagai fase gerak untuk identifikasi karotenoid baik dari bahan sintetis maupun dari bahan alami telah dilakukan. Untuk analisis beta karoten sintetis, dapat disebutkan antara lain, Marty dan Berset (1990) menggunakan kombinasi pelarut heksan:dietil eter (95:5), Pesek dan Warthesen (1990) menggunakan asetonitril:metanol: THF (42:58:1), Saleh dan Tan (1991) menggunakan kombinasi asetonitril:metanol:THF (40:56:4), Chen et al. (1998) menggunakan asetonitril:metanol (90:10) dan sebagainya. Sementara itu, analisis beta karoten dari bahan alami pernah dilakukan Sulaeman et al. (2001) menggunakan fase gerak dengan kombinasi pelarut asetonitril: THF: metanol: 1% ammonium asetat (65:25:6:4) pada pemisahan karotenoid dari wortel, Spanos et al. (1993) menggunakan metanol:kloroform (94:6) pada pemisahan karotenoid dari ubi jalar beku, Wagner dan Warthesen (1995) menggunakan metanol:asetonitril:air (88:9:3) pada pemisahan beta karoten dari wortel yang dienkapsulasi, Yusianti (1999) menggunakan asetonitril:metanol: diklorometane (60:35:5) pada bahan tepung ubi jalar, Simonne et al. (1993) menggunakan asetonitril: metanol: THF (28:25:2) pada ubi jalar dan sebagainya.
Pada penelitian pendahuluan ini dicobakan 3 kombinasi fase gerak yaitu metanol:kloroform (1:1), asetonitril:metanol: diklorometan (60:35:5) dan asetonitril: metanol: THF (28:25:2). Masing-masing fase gerak digunakan untuk melarutkan ekstrak tepung ubi jalar dan data-data yang mencukupi untuk uji sensitivitas fase gerak hanya diperoleh dari 2 kombinasi fase gerak saja yaitu kombinasi metanol:kloroform (1:1) dan asetonitril: metanol: THF (28:25:2). seperti ditunjukkan pada Gambar 8.
Sensitivitas ditandai dengan besarnya gradien (slope) yang menunjukkan bahwa konsentrasi kombinasi fase gerak tertentu (sebagai sumbu x) dalam menghasilkan kisaran luas area kromatogram (sebagai sumbu y). Semakin tajam suatu grafik, yang ditunjukkan dengan nilai slope yang besar, semakin sensitif pelarut itu terhadap luas area yang dihasilkannya. Oleh karena itu, kombinasi
y = 1E+06x - 1993.4 R2 = 0.9899 y = 2E+06x - 2219.2 R2 = 0.9933 -20000 0 20000 40000 60000 80000 100000 120000 0 0.01 0.02 0.03 0.04 0.05 0.06 0.07 0.08
konsentrasi beta karoten standar (mg/ml)
lu a s ar ea k ro m at o g ra m metanol:kloroform (1:1) asetonitril:metanol:tetrahidrofuran (28:25:2)
Gambar 8. Uji sensitivitas 3 kombinasi fase gerak
pelarut asetonitril:metanol:THF yang memiliki nilai slope terbesar dibanding kombinasi pelarut lain dipilih sebagai fase gerak pada analisis trans beta karoten dari tepung ubi jalar ini.
Karena begitu cepatnya proses kerusakan trans beta karoten maka pada fase gerak ditambahkan BHT 0,01% (Bauernfeind & Klaul 1981). Demikian pula pada bahan-bahan pelarut standar maupun sampel.
Penelitian Inti
Pemilihan titik-titik kontrol proses dilakukan melalui pengkajian tiap tahap proses produksi tepung ubi jalar yang dimulai setelah tahap pencucian dan sortir yaitu tahap pengupasan. Ada 2 alternatif perlakuan pada tahap ini yaitu dikupas dan tidak dikupas. Perlakuan dengan pengupasan adalah proses yang biasa dilakukan, namun memberi kesempatan enzim fenolase, penyebab pencoklatan enzimatis, untuk kontak langsung dengan udara sehingga menyebabkan bahan mengalami pencoklatan. Sedangkan perlakuan tanpa pengupasan akan mencegah proses pencoklatan dan uji organoleptik yang pernah dilakukan Suismono (1995) menyatakan bahwa tepung ubi jalar tanpa pengupasan masih dapat diterima konsumen dari sisi warna, aroma dan rasa. Namun dari aspek keamanan pangan
memiliki resiko karena beberapa bakteri tanah maupun kapang atau khamir yang mungkin berkembang melalui penularan tanah akan tertahan di kulit bahan. Demikian pula antisipasi terhadap kemungkinan umbi ubi jalar terserang hama (terutama hama boleng) yang biasanya menyerang ubi jalar dengan adanya lubang pada umbi, tidak dapat dilakukan. Dengan demikian, proses yang dipilih adalah dengan pengupasan. Sementara itu, untuk mengendalikan terjadinya pencoklatan maka pengupasan selalu dilakukan dalam rendaman air dan dihindari terpaan sinar matahari langsung.
Tahap selanjutnya adalah blanching. Tahap blanching ini dilakukan untuk mendapatkan warna produk yang baik dan inaktivasi enzim fenolase penyebab browning selama proses berikutnya. Dari percobaan yang dilakukan, diperoleh hasil bahwa irisan membujur ubi jalar (1 umbi dibelah 4 bagian) menghasilkan produk dengan warna yang lebih merata daripada jika blanching dilakukan pada ubi jalar utuh. Warna tepung yang lebih menarik dengan blanching tampak baik secara visual (Lampiran 1) maupun berdasarkan pengukuran kromameter pada parameter +b (warna kuning) yang meningkat dan hue yang menurun. Blanching yang dilakukan adalah blanching uap karena tahap sebelumnya telah ditetapkan proses produksi dengan pengupasan sehingga agar tidak banyak nutrisi yang hilang maka blanching uap dipilih daripada blanching air. Proses dilakukan pada suhu sekitar 70oC selama 10 menit.
Berikutnya adalah proses pengeringan. Yang diperlukan pada tahap ini adalah ukuran bahan yang seragam dan jumlah permukaan bahan yang luas sehingga proses pengeringan berlangsung efektif. Ada beberapa alternatif metode pengeringan. Jika pengeringan dilakukan dengan drum dryer maka diperlukan bahan berbentuk pasta (Lawrence et al. 1988) dan untuk itu pada perlakuan tanpa blanching pasti akan mengalami pencoklatan lebih dahulu sebelum dikeringkan. Selain hal tersebut, perlu juga dipertimbangkan faktor biaya pengadaan alat itu nantinya pada skala rumah tangga. Dengan demikian, perlakuan dengan pengeringan drum dryer tidak dapat dilakukan. Sedangkan perlakuan pengeringan dengan sinar matahari menyebabkan ubi jalar akan lebih banyak terpapar oksigen dan terjadi oksidasi sehingga menyebabkan kerusakan beberapa vitamin, terutama provitamin A. Maka proses pengeringan yang dipilih pada penelitian ini adalah
pengeringan menggunakan oven. Perlakuan proses yang dilakukan pada tahap ini adalah pengeringan ubi jalar dengan irisan bulat (sesuai diameter ubi), irisan panjang (sesuai panjang ubi) dan bentuk sawut. Dari hasil percobaan, bentuk irisan atau slice dipilih karena lebih efisien dalam pelaksanaannya menggunakan alat pengiris berupa slicer dan hasil setelah pengeringan cukup bagus, baik warna, maupun lama pengeringan. Irisan memanjang tidak cukup efisien karena akan saling tumpang tindih dan tepung yang dihasilkannya agak menggumpal/lemas.
Dengan demikian, secara garis besar proses produksi yang dipilih adalah pencucian, sortir, pencucian ulang, pengupasan (dalam air), blanching uap, pengirisan menggunakan slicer, pengeringan dengan oven, dan penepungan.
Analisa Efek O2, Cahaya dan Panas Selama Proses Produksi
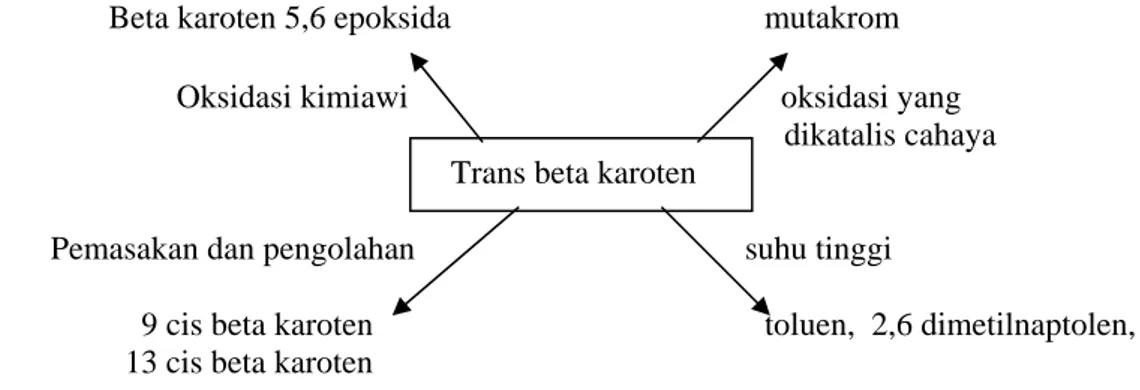
Setelah proses produksi ditetapkan, langkah berikutnya adalah melakukan analisa efek dari faktor-faktor yang menyebabkan penurunan kadar beta karoten yaitu O2, cahaya dan panas serta tahap-tahap pengendalian untuk menentukan perlu/tidaknya kontrol proses. Namun demikian, efek cahaya selama proses produksi penelitian ini tidak dapat menghasilkan data secara kuantitatif sehingga efek cahaya pada tabel kendali (Tabel 5) dihilangkan. Secara kualitatif faktor cahaya menyebabkan fotooksidasi dengan menghasilkan produk turunan trans beta karoten seperti mutakrom (Andarwulan & Koeswara 1990). Produk turunan trans beta karoten yang lain akibat proses oksidasi dan proses pengolahan secara skematik dapat dilihat pada Gambar 9.
Beta karoten 5,6 epoksida mutakrom
Oksidasi kimiawi oksidasi yang dikatalis cahaya Trans beta karoten
Pemasakan dan pengolahan suhu tinggi
9 cis beta karoten toluen, 2,6 dimetilnaptolen, dll
13 cis beta karoten
Tabel 5. Tabel kendali proses
Kontrol proses adalah tahapan produksi yang memperoleh efek dari O2, cahaya dan panas namun efeknya tetap ada meskipun sudah dilakukan langkah-langkah pengendalian. Langkah-langkah-langkah pengendalian ini dinilai sebagai kurang, cukup dan layak (Tabel 5) sesuai dengan beberapa percobaan yang dilakukan dalam penelitian ini. Berdasarkan data pada Tabel 5 maka dapat dikatakan bahwa tahap proses yang memerlukan kontrol pada penelitian ini adalah tahapan proses blanching, pengeringan dan penepungan, salah satu metode kontrol adalah penggunaan kromameter sebagai alat kontrol warna bahan pada setiap tahapan proses tersebut.
Efek blanching
Selama proses blanching dilakukan percobaan dengan perlakuan blanching dan tanpa blanching. Analisa kadar beta karoten pada tepung hasil perlakuan
Kelayakan pengendalian
Kontrol proses No Tahap proses Faktor
perusak Cara pengendalian
(kurang/cukup/layak) (perlu/tidak)
1 Ubi jalar mentah - - - -
2 Pencucian - - - -
3 Sortir - - - -
4 Pencucian - - - -
5 Pengupasan O2 Dalam rendaman air bersih cukup tidak
Hindari cahaya langsung cukup
6 Blanching uap O2 suhu 700C, 10 menit kurang perlu
Panas
7 Pengirisan O2 Pengirisan cepat cukup tidak
langsung direndam air
Hindari cahaya langsung cukup
8 Perendaman O2 Menggunakan bahan pelindung layak tidak
Hindari cahaya langsung cukup
9 Pengeringan oven O2 Pengeringan cepat kurang perlu
Panas Pemanasan oven suhu max 500C cukup
Hindari cahaya langsung cukup
10 Penepungan O2 Penepungan cepat kurang perlu
Panas Teknologi alat penepungan cukup
Hindari cahaya langsung cukup
11 Tepung ubi jalar O2 Kemasan vakum layak tidak
blanching dan tanpa blanching menggunakan HPLC (Tabel 6) menunjukkan hasil bahwa proses blanching menyebabkan penurunan kadar trans beta karoten sebesar 20,47% pada tepung ubi jalar klon BB dan 15,03% pada tepung ubi jalar varietas sewu.
Tabel 6. Hasil perhitungan kadar beta karoten pada tahap blanching
Sebagai pembanding, Jaarsveld (2006) melakukan penelitian dengan merebus ubi jalar oranye varietas Resisto selama 20 menit dalam wadah tertutup dengan perlakuan semua bahan ubi jalar terendam dalam air seluruhnya dan terendam sebagian, artinya kesempatan oksigen kontak dengan bahan berbeda sedangkan suhu perebusan sama dan diperoleh hasil bahwa penurunan kadar trans beta karoten masing-masing sebesar 8 dan 17%. Sedangkan jika kondisi perebusan sama-sama dilakukan dengan bahan terendam air seluruhnya, namun lama perebusan masing-masing 20 dan 30 menit maka diperoleh penurunan kadar beta karoten yang lebih sedikit daripada perlakuan pertama yaitu masing-masing 8 dan 12 %, artinya pengaruh oksigen memiliki efek penurunan atau perusakan trans beta karoten yang lebih besar daripada suhu perebusan.
Penelitian ini dilakukan dengan perlakuan blanching uap sehingga dengan demikian kontak oksigen pada bahan lebih besar daripada blanching air apalagi jika kondisi bahan terendam air seluruhnya sehingga persentase penurunan kadar trans beta karotennya pun lebih besar. Blanching adalah pemanasan dengan suhu yang tidak terlalu tinggi secara cepat untuk inaktivasi enzim oksigenase dan lipoksigenase dan pengaruh suhu blanching ini relatif kecil terhadap kerusakan beta karoten (Gross 1991). Dengan demikian dapat dikatakan bahwa efek oksigen lebih besar daripada suhu blanching terhadap kerusakan struktur trans beta karoten selama proses blanching ini.
Proses Bahan baku Kadar trans beta karoten (ppm)
Tanpa blanching Ubi jalar klon BB (dari CIP) 6.64
Ubi jalar var sewu (dari Balitkabi) 11.52
Dengan blanching Ubi jalar klon BB (dari CIP) 5.28
Efek alat pengering
Tahapan proses lain yang menggunakan panas adalah proses pengeringan. Percobaan dilakukan menggunakan bahan baku berupa ubi jalar saja, tanpa proses perendaman dengan bahan pelindung. Pengeringan dilakukan pada suhu yang sama yaitu 500C namun menggunakan alat atau sistem kerja pengeringan yang berbeda sedemikian sehingga lama prosesnya berbeda.
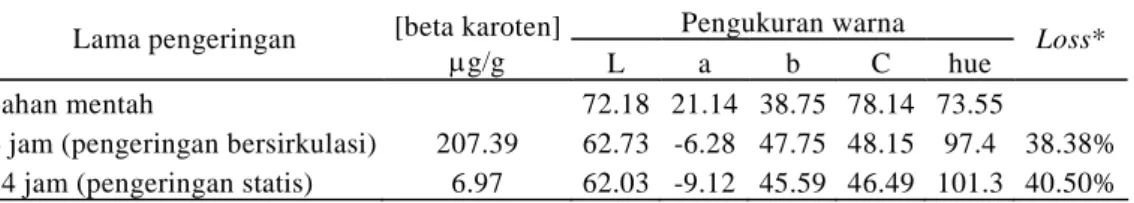
Pengeringan dengan sistem sirkulasi memiliki sistem pemasukan dan pengeluaran panas secara sinergis sehingga dapat melakukan tugas pengeringan lebih cepat dari pada cabinet dryer yang tidak memiliki sistem sinergis untuk mengeluarkan udara panas hasil penguapan bahan. Cabinet dryer atau pengeringan dengan sistem statis hanya menggunakan sistem termostat untuk mengendalikan panas di dalam pengering. Pengeringan sistem sirkulasi dapat melakukan tugas pengeringan selama 4 jam sedangkan pengeringan dengan sistem statis memerlukan waktu sekitar 24 jam untuk menghasilkan bahan kering yang memiliki 3 kali berat akhirnya tetap (karakteristik laju pengeringan dapat dilihat pada Lampiran 11).
Selama proses pengeringan terdapat semua faktor-faktor produksi penyebab turunnya kadar beta karoten seperti O2, cahaya dan panas. Kehilangan beta karoten dari bahan mentahnya akibat proses pengeringan diperkirakan dari nilai C kromameter dan diperoleh kisaran kehilangan (loss) 38 – 40 % (Tabel 7).
Tabel 7. Hasil pengukuran warna dan kadar beta karoten tepung ubi jalar oranye dari klon BB 105.010 menggunakan 2 alat pengering yang berbeda
Pengamatan warna pada ubi jalar oranye akibat pengeringan menggunakan pengeringan dengan sistem statis maupun bersistem sirkulasi menghasilkan nilai a yang bernilai positif pada bahan mentahnya menjadi bernilai negatif pada hasil
Pengukuran warna
Lama pengeringan [beta karoten]
μg/g L a b C hue Loss*
bahan mentah 72.18 21.14 38.75 78.14 73.55
4 jam (pengeringan bersirkulasi) 207.39 62.73 -6.28 47.75 48.15 97.4 38.38%
24 jam (pengeringan statis) 6.97 62.03 -9.12 45.59 46.49 101.3 40.50%
• loss adalah persentase kehilangan kadar trans beta karoten hasil perkiraan menggunakan parameter C dari bahan mentah hingga produk jadinya
• L = Lightness (100 = putih, 0 = hitam), +a = merah, -a = hijau, +b = kuning, -b = biru
pengeringannya. Hal ini mengindikasikan adanya kerusakan struktur trans beta karoten karena berubahnya nilai dari positif ke negatif dan semakin besar penurunannya, kadar trans beta karoten juga semakin rendah. Nilai b bahan mentah menunjukkan nilai kuning yang relatif rendah daripada produk hasil pengeringannya, hal ini disebabkan karena warna dasar ubi jalar mentah masih didominasi oleh warna merah (nilai +a yang tinggi), tetapi semakin kuning hasil pengeringannya (semakin besar nilai b) semakin tinggi kadar trans beta karotennya, demikian pula nilai L dan C. Hal ini mungkin disebabkan oleh karotenoid larut air yang ikut hilang selama proses pengeringan. Sementara itu, nilai hue yang makin turun dengan kenaikan lama pengeringan mengindikasikan naiknya kadar beta karoten yang dimiliki tetapi tetap dalam kisaran warna kuning (90 – 126).
Jika diperhatikan pada panas yang digunakan, keduanya diset pada suhu 500C, namun keduanya memiliki sistem kerja yang berbeda, sehingga menyebabkan perbedaan lama proses pengeringan. Demikian juga dengan efek cahaya, dapat dikatakan keduanya mendapatkan efek cahaya yang sama karena keduanya adalah alat pengering buatan yang tertutup.
Hal penting yang menunjukkan signifikansi perbedaan kedua proses ini adalah lama proses. Lama proses menyebabkan efek dari bahan kontak dengan O2 dan suhu pengeringan yang menggunakan sistem statis lebih besar daripada pengeringan yang menggunakan sistem sirkulasi, atau dapat dikatakan bahwa proses oksidasi berlangsung lebih lama sehingga penurunan kadar trans beta karoten lebih besar.
Perkiraan kadar beta karoten selama proses penepungan dengan pengamatan warna
Proses penepungan adalah proses penghancuran irisan kering ubi jalar hingga terbentuk butiran tepung dengan diameter tertentu. Amaya (2004) menyebutkan bahwa apapun metode proses pengolahan yang dilakukan, kadar karotenoid pada umumnya maupun beta karoten pada khususnya akan mengalami penurunan terutama dengan waktu proses yang lebih lama, temperatur proses yang lebih tinggi dan adanya pemotongan atau penghancuran. Proses
penghancuran ini menimbulkan akibat luas permukaan bahan yang lebih luas dari semula (bentuk irisan kering). Lebih lanjut, dengan luas permukaan yang makin luas maka kontak bahan dengan udara atau O2 juga lebih besar.
Namun demikian, makin besarnya kontak bahan dengan oksigen kadang kurang terdeteksi pada analisa beta karoten atau total karoten. Hal ini karena ada 2 akibat yang berbeda dari luas permukaan yang makin besar. Jika dalam proses oksidasi luas permukaan yang makin besar menyebabkan makin besarnya kesempatan bahan kontak dengan udara, maka dalam proses ekstraksi konvensional menggunakan pelarut kimia, luas permukaan menyebabkan penetrasi pelarut menarik senyawa yang diinginkan makin besar (Tabel 4). Hal ini pernah dilakukan Suismono (1995) dalam membuat tepung ubi jalar dengan berbagai ukuran. Makin halus ukuran, makin besar total karotennya.
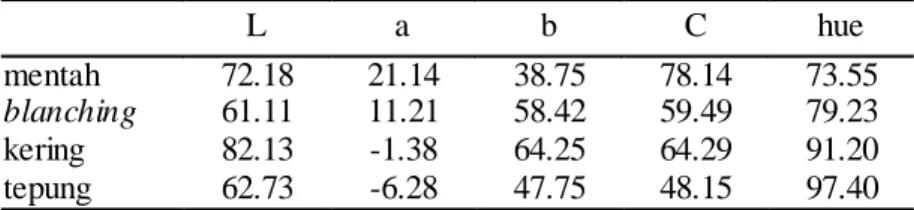
Oleh karena itu, salah satu cara yang dapat digunakan untuk memperkirakan pengaruh penepungan terhadap kadar beta karoten adalah dengan pengamatan warna. Gross (1991) menyatakan adanya perbedaan spektral karotenoid yang mengalami isomerisasi. Karotenoid yang telah mengalami isomerisasi memiliki intensitas warna yang lebih kecil. Demikian pula, pada proses produksi tanpa perlakuan perendaman bahan pelindung (Tabel 8), intensitas warna makin besar ditandai dengan nilai hue yang makin kecil. Tepung yang diperoleh menghasilkan penurunan intensitas warna sekitar 24,5% dari bahan mentahnya. Demikian pula pada parameter C dan L.
Tabel 8. Hasil pengamatan warna menggunakan kromameter selama proses produksi tepung ubi jalar oranye tanpa perlakuan perendaman bahan pelindung
Sementara itu pada parameter a (Tabel 8), memperlihatkan parameter warna merah yang makin berkurang demikian seterusnya hingga nilai a menjadi bernilai negatif (-a) yang menunjukkan bahwa bahan terukur dalam kisaran warna hijau.
L a b C hue
mentah 72.18 21.14 38.75 78.14 73.55
blanching 61.11 11.21 58.42 59.49 79.23
kering 82.13 -1.38 64.25 64.29 91.20
Gross (1991) menjelaskan bahwa warna hijau pada ubijalar olahan diasosiasikan dengan adanya karotenoid jenis epoksida, artinya telah terjadi kerusakan karotenoid.
Oleh karena itu, tahap penepungan memerlukan kontrol proses karena menurunnya intensitas warna dari bahan mentahnya. Hal ini terjadi karena makin luasnya luas permukaan, adanya panas karena friksi alat selama penghancuran dan hal ini berlanjut jika proses ini tidak dilanjutkan dengan tahap perlindungan menggunakan kemasan yang mampu melindungi bahan dari kontak dengan udara atau O2 , cahaya serta panas.
Penetapan Alat Ukur in line Produksi
Struktur trans beta karoten mendominasi total pigmen yang ada pada ubi jalar (Bauernfeind 1981; Gross 1991). Mekanisme pengukuran yang dapat didekati antara lain adalah bahwa penyerapan photon atau cahaya oleh karotenoid termasuk beta karoten dapat terjadi karena adanya ikatan rangkap karbon-karbon terkonjugasi pada struktur kimia molekulnya (Schoefs 2002). Ketika cahaya diserap oleh molekul, seluruh energi photon ditransfernya. Molekul yang telah menransfer energi photon tersebut kemudian memiliki energi lebih untuk berpindah dari kondisi normalnya yaitu tingkat energi rendah ke tingkat energi tinggi atau energi tereksitasi. Selanjutnya energi yang tereksitasi tersebut ditangkap oleh suatu detektor. Sebelum sampai pada detektor untuk mendapatkan panjang gelombang molekul yang ditembak tersebut, energi tereksitasi akan melalui suatu filter. Perbedaan prinsip kerja spektrofotometer dan kromameter adalah jika spektrofotometer menggunakan filter berupa prisma yang akan meneruskan warna pelangi (spektrum warna mejikuhibiniu) maka kromameter hanya menggunakan 3 filter warna yaitu merah, hijau dan biru. Namun keduanya sama-sama meneruskan warna komplementer dari warna yang diserap (www.italocorotondo.it).
Kelebihan kromameter daripada spektrofotometer adalah pada fisik alatnya, kromameter bersifat portable sehingga dapat dibawa-bawa dan mampu melakukan pengukuran di lini produksi sekalipun.
Pengukuran warna untuk memprediksi kadar karotenoid maupun kadar beta karoten pada komoditi tertentu telah banyak dilakukan. Hal ini memang dilakukan untuk mendapatkan nilai pendekatan secara cepat (rapid estimation) sebelum dilakukan analisis lebih lanjut yang hingga saat ini masih memerlukan biaya, waktu dan tenaga cukup besar untuk menyelesaikannya. Intensitas warna beta karoten pada ubi jalar telah dianggap sebagai indikator nilai provitamin A pada suatu komoditi (Lauber et al.1967; Takahata,et al. 1993; Camire et al.1994; Ameny & Wilson 1997).
Penelitian ini dapat dikatakan masih merupakan penelitian awal penggunaan alat pengukur warna untuk memperkirakan kadar beta karoten tepung ubi jalar. Nilai –a pada pengamatan semua tepung perlakuan menunjukkan kerusakan struktur trans beta karoten dalam bentuk epoksida. Nilai hue semua tepung perlakuan masih ada dalam kisaran warna kuning (90 – 126) yang juga merupakan kisaran warna absorbansi beta karoten.
Dari perhitungan korelasi linear antara pengamatan kroma L, a, b, C dan hue dengan kadar beta karoten tepung ubi jalar diperoleh hasil r tertinggi pada parameter C dan b, yaitu masing-masing sebesar 0.86 dan 0.85 (Tabel 9). Secara
Tabel 9. Kadar beta karoten dan hasil pengukuran warna tepung ubi jalar hasil perlakuan.
statistik nilai korelasi dapat diartikan sebagai tingkat keeratan hubungan linear antara dua peubah atau lebih yang dinyatakan dengan nilai yang mendekati nilai 1 atau –1. Dengan demikian dapat dikatakan bahwa nilai C dan b memiliki nilai
C L a b h beta karoten (ppm) S10 47.17b 62.92a -5.44c 46.86b 96.55b 136.72 S30 47.81a 62.71a -4.02a 47.64a 94.80d 142.44 A10 46.93c 61.39b -5.43c 46.62d 96.55b 103.94 A30 46.81d 61.62b -6.09d 46.42e 97.40a 106.87 Gum 46.96e 59.61c -4.50b 46.75c 95.40c 114.88 r2 0.75 0.42 0.39 0.71 0.34 r 0.86 0.65 0.58 0.85 -0.59
• Data kadar beta karoten diperoleh dari triplo, sedangkan data kroma meter dari 5-6 kali pengukuran
• Data yang tercetak tebal menunjukkan nilai terbesar
• Huruf yang sama pada satu kolo m menunjukkan nila i yang tidak berbeda nyata (pada taraf nyata
keeratan linear dengan kadar beta karoten paling tinggi dibandingkan nilai kromameter yang lain.
Hasil penelitian Ameny dan Wilson (1997) juga menunjukkan bahwa nilai kroma b adalah alat pengukur terbaik untuk memperkirakan kadar beta karoten pada ubi jalar afrika berdaging umbi putih dengan nilai r sebesar 0.74. Meskipun demikian, penelitian ini selanjutnya akan menggunakan parameter C karena selain memiliki nilai korelasi tertinggi, bahan baku tepung ubi jalar pada penelitian ini diperoleh dari ubi jalar berdaging umbi warna oranye (bahan berwarna, bukan putih). Nilai C diperoleh dari dua parameter warna yaitu a (+a = merah, -a = hijau) dan b (+b = kuning) dengan rumus : C = (a2 + b2)1/2
Perlakuan-perlakuan untuk pengendalian stabilitas beta karoten selama proses produksi tepung ubi jalar.
Jenis perlakuan pada penelitian ini dilakukan pada tahap pengeringan yaitu dengan proses perendaman sebelum pengeringan dengan sulfit 3000 ppm (0.3%) selama 10 menit dalam air bersuhu 600 C, sulfit 3000 ppm selama 30 menit dalam air bersuhu ruang. Perendaman dengan sulfit ini mengacu pada penelitian Santosa dkk (1994) dan Zhao dan Chang (1995). Perlakuan lain yang dilakukan adalah perendaman dengan asam askorbat dengan metode yang sama dengan perendaman sulfit. Perendaman dengan asam askorbat ini mengacu pada penelitian Morais et al (2002). Perlakuan terakhir adalah dengan perendaman menggunakan gum arab:maltodekstrin (1:1) sebagai modifikasi coating dengan pati pada penelitian Zhao dan Chang (1995). Sebagai kontrol dilakukan dengan proses ubi jalar yang direndam pada air suhu ruang tanpa penambahan bahan lain.
Perlakuan dilakukan sebelum proses pengeringan karena pengeringan merupakan salah satu proses yang memerlukan kontrol (lihat Tabel 5) terutama karena terjadinya kontak antara bahan dengan oksigen selain adanya panas selama periode waktu tertentu.
Menurut Lindsay (1996) peran sulfit selama proses pangan adalah (1) mencegah pencoklatan nonenzimatis, (2) mencegah reaksi yang dikatalis enzim, (3) mencegah dan mengontrol mikroorganisme serta (4) berperan sebagai
antioksidan dan agen pereduksi. Dalam hal ini, sulfit lebih berperan dalam perannya yang pertama dan kedua.
Penggunaan asam askorbat terutama sebagai antioksidan. Namun demikian, asam askorbat dapat juga berperan sebagai prooksidan selain antioksidan tergantung konsentrasi dan aktivitas airnya (Hutchings 1994). Sementara penggunaan gum-dekstrin terutama berperan sebagai penyalut irisan ubi jalar selama pengeringan. Fungsi penyalut dapat terjadi karena dari struktur kimianya jelas mengindikasikan bahwa karotenoid adalah senyawa lipofilik dan tidak larut air kecuali pada kelompok yang sangat polar seperti polisakarida (Schoefs 2002).
Kadar beta karoten pada kelima perlakuan (lihat Tabel 9) menunjukkan bahwa perlakuan dengan sulfit menghasilkan tepung ubi jalar dengan kadar beta karoten tertinggi, terutama pada perlakuan sulfit dengan perendaman selama 30 menit. Perusakan karotenoid menurun cepat dengan penambahan konsentrasi SO2 lebih dari 2000 ppm (Baloch et al. 1977 dalam Gross, 1991). Penelitian Sulaeman et al. (2001) pada chips wortel yang direndam dalam sodium metabisulfit dan erythorbic acid menghasilkan produk dengan kadar beta karoten yang tidak berbeda nyata sedangkan penelitian Zhao dan Chang (1995) pada wortel kering dengan 3 perlakuan perendaman sulfit terlebih dahulu menghasilkan produk dengan kadar beta karoten yang berbeda secara nyata.
Pada pengamatan warna dengan parameter kroma L diperoleh hasil yang berbeda nyata antara perlakuan dengan sulfit, askorbat dan gum. Hal yang berbeda terjadi pada pengamatan warna dengan parameter kroma b, kelima perlakuan memiliki perbedaan yang nyata. Hasil kroma L ini sama dengan penelitian Sulaeman (2001) untuk produk wortel yang direndam dalam sodium metabisulfit (0,2% selama 15 menit) dan erythorbic acid (0,3% selama 15 menit) lebih dahulu, namun pengamatannya dengan kroma b tidak berbeda secara nyata. Sementara itu pada pengamatan kroma a, diperoleh hasil yang tidak beda nyata pada perlakuan sulfit 0,03% dan askorbat 0,03% masing-masing dengan perendaman 10 menit (S10 dan A10), namun pada perendaman 30 menit (S30 dan A30) diperoleh hasil yang beda nyata seperti pada penelitian Sulaeman (2001). Demikian pula pada pengamatan hue. Hal ini mengindikasikan bahwa perbedaan
konsentrasi antioksidan dan waktu perendaman memberikan efek yang cukup signifikan pada warna produk yang dihasilkan.
Seluruh parameter a pada semua tepung hasil perlakuan memiliki nilai negatif yang mengacu pada warna hijau. Hal ini dapat dijelaskan oleh Gross (1991) yang menyatakan bahwa warna hijau pada ubijalar olahan diasosiasikan dengan adanya karotenoid jenis epoksida, artinya telah terjadi kerusakan karotenoid.
Stabilitas Beta Karoten selama Proses Produksi Tepung Ubi Jalar Hasil Perkiraan dari Pengukuran Warna dengan Parameter C
Stabilitas beta karoten selama proses produksi tepung ubi jalar (dengan parameter kroma C selanjutnya menjadi indikator untuk memperkirakan (rapid estimation) kadar beta karoten pada bahan baku ubi jalar selama proses produksi tepung ubi jalar yaitu sejak bahan baku mentah, ubi jalar di blanching 10 menit (700C), slicing, lalu dikeringkan dengan suhu 500C dan akhirnya ditepungkan dengan alat Willey Mill. Pengukuran warna selama proses produksi diperoleh data seperti terlihat pada Tabel 10 dan 11.
Tabel 10. Perkiraan persentase degradasi beta karoten selama proses produksi tepung ubi jalar klon BB 00105.010 perlakuan S30 dengan oven rak.
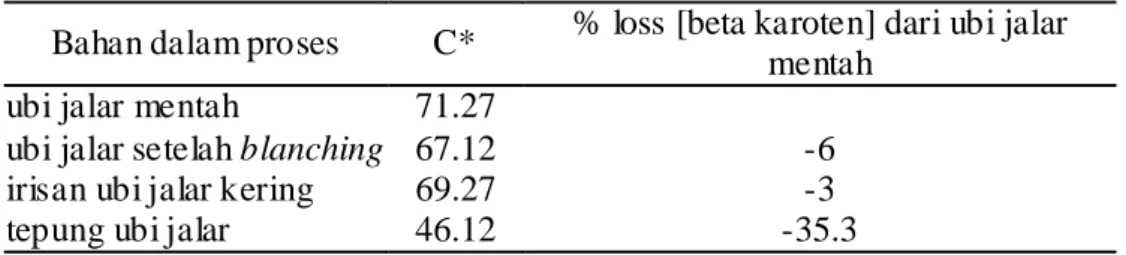
Data pada Tabel 10 diatas memperlihatkan bahwa tepung yang dihasilkan oleh bahan baku ubi jalar klon BB 0105.010 (dari CIP, Bogor) dengan perendaman sulfit selama 30 menit sebelum pengeringan diperkirakan mengalami kerusakan atau penurunan kadar beta karoten sebesar 37,55% dari bahan baku awalnya. Selama proses, pada tahap blanching diperkirakan mengalami penurunan kadar beta karoten sebesar 23,87%. Hal ini telah dibahas pada subbab sebelumnya terutama karena bahan baku sempat mengalami oksidasi sebelum dan
Bahan dalam proses C* % loss [beta karoten] dari ubi jalar mentah
ubi jalar mentah 78.14
ubi jalar setelah blanching 59.49 -23.87
irisan ubi jalar kering 65.07 -16.73
tepung ubi jalar 48.8 -37.55
selama proses blanching, meskipun hal ini sudah diantisipasi dengan selalu merendam bahan baku dalam air setiap saat.
Setelah tahap pengeringan kadar beta karoten perkiraan mengalami penurunan sebesar 16,73% dari bahan baku awal, dengan kata lain justru mengalami kenaikan perkiraan kadar beta karoten sebesar 9,38% dari tahap blanching. Hal ini kemungkinan disebabkan oleh perlakuan sebelum pengeringan yaitu perendaman sulfit dan hal ini juga terjadi jika proses pengeringan berlangsung cepat dengan penataan yang baik sehingga bahan tidak mendapat kesempatan untuk mengalami browning non enzimatis atau proses oksidasi berlanjut.
Pada tahap penepungan, bahan diperkirakan mengalami penurunan sebesar 37,55% dari bahan baku awal atau terjadi penurunan kadar beta karoten perkiraan sebesar 25% dari tahap pengeringan. Hal ini mengindikasikan bahwa tahap penepungan memberikan kontribusi terbesar pada penurunan kadar beta karoten selama proses produksi tepung ubi jalar ini. Apapun metode proses pengolahan yang dilakukan, kadar karotenoid umumnya maupun beta karoten khususnya akan mengalami penurunan terutama dengan waktu proses yang lebih lama, temperatur proses yang lebih tinggi dan adanya pemotongan atau penghancuran (Amaya 2004).
Hal ini diperkuat dengan produksi tepung ubi jalar varietas sewu pada tahapan proses yang sama memiliki perkiraan persentase penurunan kadar beta karoten tepung dari bahan mentahnya sebesar 35,3% (Tabel 11). Chandler dan Schwartz (1988) membuat tepung ubijalar menggunakan drum dryer dan telah melakukan analisis secara detail sehingga diperoleh penurunan kadar trans beta karoten sebesar 40,1%.
Tabel 11. Perkiraan persentase degradasi beta karoten selama proses produksi tepung ubi jalar varietas sewu perlakuan S30 dengan oven rak.
Bahan dalam proses C* % loss [beta karoten] dari ubi jalar
mentah
ubi jalar mentah 71.27
ubi jalar setelah blanching 67.12 -6
irisan ubi jalar kering 69.27 -3
tepung ubi jalar 46.12 -35.3
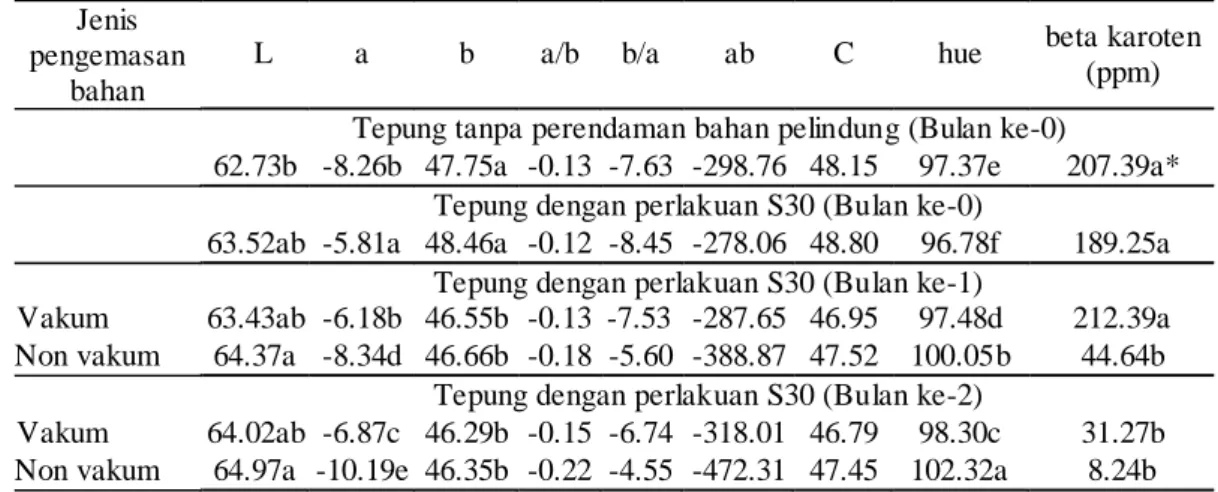
Akhirnya, proses produksi yang baik harus diikuti dengan cara penyimpanan yang baik pula terutama karena masih adanya efek oksigen, cahaya dan panas selama penyimpanan. Hasil pengukuran kadar beta karoten dan pengamatan warna hasil kendali proses dengan kemasan vakum dan non vakum selama penyimpanan menunjukkan bahwa pada bulan ke 1 tepung ubi jalar yang dikemas non vakum mengalami kehilangan beta karoten sekitar 79% bila dibandingkan dengan tepung ubi jalar yang dikemas vakum. Selanjutnya pada bulan ke 2, tepung ubi jalar yang dikemas seal mengalami kehilangan beta karoten sekitar 74% jika dibandingkan dengan tepung ubi jalar yang dikemas vakum (Tabel 12).
Seiring dengan menurunnya kadar beta karoten selama penyimpanan, nilai C dan b juga semakin menurun, sementara nilai a semakin besar nilai negatifnya, artinya terjadi kerusakan struktur beta karoten yang makin besar pula. Nilai L
Tabel 12. Kadar beta karoten dan hasil pengukuran warna tepung ubi jalar klon BB 00105.010 dengan perlakuan Sulfit 30 menit selama penyimpanan
makin besar mengindikasikan warna tepung yang semakin terang atau intensitas warnanya makin kecil artinya proses kerusakan struktur trans beta karoten makin besar.
Sementara itu kehilangan beta karoten pada tepung ubi jalar yang dikemas vakum setelah penyimpanan 1 bulan dapat dikatakan 0% karena data
Jenis pengemasan
bahan
L a b a/b b/a ab C hue beta karoten (ppm) Tepung tanpa perendaman bahan pelindung (Bulan ke-0)
62.73b -8.26b 47.75a -0.13 -7.63 -298.76 48.15 97.37e 207.39a* Tepung dengan perlakuan S30 (Bulan ke-0)
63.52ab -5.81a 48.46a -0.12 -8.45 -278.06 48.80 96.78f 189.25a Tepung dengan perlakuan S30 (Bulan ke-1)
Vakum 63.43ab -6.18b 46.55b -0.13 -7.53 -287.65 46.95 97.48d 212.39a Non vakum 64.37a -8.34d 46.66b -0.18 -5.60 -388.87 47.52 100.05b 44.64b
Tepung dengan perlakuan S30 (Bulan ke-2)
Vakum 64.02ab -6.87c 46.29b -0.15 -6.74 -318.01 46.79 98.30c 31.27b Non vakum 64.97a -10.19e 46.35b -0.22 -4.55 -472.31 47.45 102.32a 8.24b * huruf yang sama pada kolo m yang sama menunju kkan n ila i yang tidak berbeda nyata (pada taraf nyata
menunjukkan tidak berbeda nyata dengan kadar awalnya. Hal ini mengindikasikan bahwa adanya oksigen dalam headspace kemasan berpengaruh secara signifikan pada kadar beta karoten yang dimilikinya. Goldman et al (1983) yang menyatakan bahwa adanya oksigen dalam headspace adalah faktor penting yang mempengaruhi penurunan kadar beta karoten.
Kadar trans beta karoten tepung ubi jalar oranye yang dikemas alumunium foil lalu ditutup menggunakan mesin sealer (kemas non vakum) selama penyimpanan menunjukkan besarnya penurunan sebesar 76,42% pada bulan ke-1 demikian selanjutnya sebesar 99,69% pada bulan ke-4 (Tabel 13).
Tabel 13. Presentase penurunan kadar trans beta karoten selama penyimpanan pada suhu ruang (250C) dengan kemasan non vakum
Kadar beta karoten (ppm)
Bulan ke-0 189.25
Bulan ke-1 44.64
Bulan ke-2 8.24
Bulan ke-3 2.31
Bulan ke-4 0.59
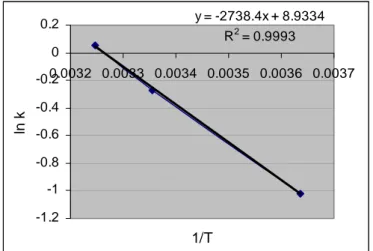
Perhitungan energi aktivasi untuk penurunan kadar trans beta karoten dalam kemasan non vakum terhitung sebesar 5.4x103 kal/mol yang diperoleh dengan nilai slope (k = 2738,4) dari grafik seperti terlihat pada Gambar 10 berikut ini (perhitungan lengkap ada di Lampiran 8).
y = -2738.4x + 8.9334 R2 = 0.9993 -1.2 -1 -0.8 -0.6 -0.4 -0.2 0 0.2 0.0032 0.0033 0.0034 0.0035 0.0036 0.0037 1/T ln k Gambar 10. Plot ln k vs 1/T untuk kerusakan beta karoten selama penyimpanan
Jika dilihat pada perhitungan Lampiran 8, nilai energi aktivasi diperoleh dari perhitungan slope (k) dari masing-masing grafik antara ln [beta karoten] sebagai sumbu y dengan t (waktu) sebagai sumbu x selama penyimpanan pada suhu rendah (20C), suhu kamar (250C), dan suhu tinggi (350C). Dengan demikian dapat dikatakan bahwa slope (k) pada grafik tersebut menunjukkan suatu konstanta laju reaksi. Ketiga konstanta laju reaksi dari masing masing suhu penyimpanan tersebut kemudian diplot dalam grafik antara ln(k) sebagai sumbu y dan 1/T sebagai sumbu x sehingga diperoleh slope yang berbanding lurus dengan nilai energi aktivasi.
Penelitian Lund (1977) memberikan data umum energi aktivasi penurunan vitamin selama pengeringan udara adalah sebesar 2,03 x 104 kal/mol. Sedangkan Chen dan Huang (1998) secara lebih spesifik memberikan data energi aktivasi untuk penurunan beta karoten sintetis sebesar 3,9 x 104 J/mol atau sama dengan 9,36 x 103 kal/mol. Sementara Surfiana (2002) menghitung energi aktivasi untuk penurunan kadar beta karoten dalam minuman emulsi kaya beta karoten sebesar 4,02x103 kal/mol lebih kecil daripada pada perhitungan energi aktivasi pada penurunan kadar beta karoten tepung ubi jalar kemungkinan disebabkan karena produk tersebut ada dalam bentuk minuman emulsi dari minyak sawit merah, yaitu karoten terlarut dalam fase non polar.
Sadler (1987) mengelompokan besaran energi aktivasi dalam 3 golongan. Pertama adalah golongan reaksi yang memiliki energi aktivasi rendah (2-15 kkal/mol) seperti reaksi kerusakan pigmen karoten, klorofil dan oksidasi lemak. Kedua adalah golongan reaksi dengan energi aktivasi sedang (15-30 kkal/mol) seperti kerusakan vitamin, kerusakan pigmen larut air pada umumnya serta reaksi maillard. Ketiga adalah golongan reaksi dengan energi aktivasi tinggi (50-100 kkal/mol) seperti reaksi denaturasi enzim, inaktivasi mikroorganisme dan inaktivasi spora mikroba. Dengan demikian, energi aktivasi untuk penurunan kadar all trans beta karoten pada tepung ubi jalar klon BB 00105.10 yang di kemas seal tergolong pada energi aktivasi rendah.
Energi aktivasi yang rendah selama penyimpanan produk tepung ubi jalar yang dikemas secara non vakum ini artinya bahwa energi permulaan untuk memulai suatu reaksi, terutama reaksi kerusakan trans beta karoten, termasuk
kecil atau dapat dikatakan bahwa reaksi kerusakan dapat terjadi dengan mudah. Selain itu, Gambar 10 juga menunjukkan bahwa laju reaksi tidak cukup sensitif terhadap kisaran suhu yang relatif besar (slope kecil), hingga suhu tertinggi yang digunakan selama penyimpanan yaitu 350C.
Perbandingan Fisik antara Tepung Ubi Jalar Hasil Perlakuan dengan Tepung Ubi Jalar Komersial
Faktor utama yang perlu diperhatikan dalam analisa kelayakan proses produksi tepung ubi jalar kuning dan oranye selain masalah nutrisi dan dapat diterima konsumen dari sisi harga dan rasa juga aspek stabilitas nutrisi terutama dalam penelitian ini difokuskan pada stabilitas beta karoten selama proses produksi.
Selain aspek stabilitas terdapat beberapa aspek teknis lain yang perlu diperhatikan, salah satunya adalah karakter/sifat fisik produk. Sifat fisik produk dapat digunakan sebagai alat untuk mengetahui sifat alir atau karakter proses yang perlu dilakukan. Lebih lanjut, sifat fisik produk dapat digunakan sebagai alat untuk merancang proses produksi maupun alat yang akan digunakan. Hasil pengukuran sifat fisik tepung hasil perlakuan dan tepung ubi jalar komersial, yaitu tepung yang telah diproduksi dalam skala pabrik dan dipasarkan secara umum di masyarakat memperlihatkan beberapa sifat fisik tepung berupa kadar air, sudut curah, densitas kamba dan sebagainya (Tabel 14).
Tabel 14. Hasil pengukuran sifat fisik tepung ubi jalar hasil perlakuan dengan tepung ubi jalar komersial “Sariumbi kuning”
Analisa BB 010 Sariumbi aw 0.34 0.40 Kadar air (db) 4.59 4.38 Sudut curah ( 0 ) 32.53a* 37.68a Densitas kamba (g/ml) 0.60a 0.56a Densitas padat (g/ml) 0.73a 0.76a
Ukuran partikel (mikron) 12 – 132 12 - 54
Kroma "hue" 96.78 103.50
[trans beta karoten] (ppm) 189.25 0.78
• huruf yang sama pada baris yang sama menunjukkan bahwa data tidak berbeda nyata pada taraf
Ukuran partikel adalah salah satu sifat fisik penting yang mempengaruhi daya alir tepung. Tepung dengan ukuran partikel lebih besar dari 200 mikron dapat bebas mengalir sementara tepung halus adalah bahan yang lebih bersifat kohesif dan sulit mengalir, hal ini disebabkan oleh kadar air yang lebih tinggi sehingga menyebabkan “jembatan air” antar partikel dan sulit mengalir (Teunou et al. 1999). Menurut Teunou et al. (1999) pula, tepung dengan ukuran partikel rata-rata 73 – 98 mikron termasuk tepung berukuran halus, sedangkan tepung dengan ukuran partikel rata-rata 25 mikron termasuk tepung berukuran sangat halus.
Ukuran partikel tepung komersil relatif seragam dibanding tepung perlakuan, namun demikian kisaran ukuran partikel tersebut masih termasuk dalam tepung dengan ukuran partikel halus dan sebagian halus sekali, sehingga tepung ubi jalar ini tergolong sulit mengalir. Daya alir bahan ini berpengaruh kuat pada kecepatan dan efisiensi proses pengosongan silo vertikal untuk memindahkan bahan menuju unit penimbangan atau pencampuran misalnya. Oleh karena itu, dengan mempertimbangkan stabilitas beta karoten dari lama kontak bahan dengan oksigen dan sifat alir tepung ubi jalar kaya beta karoten maka jarak hubung antar proses harus dirancang sedemikian pendeknya, bahkan jika memungkinkan proses alir ini dihilangkan saja, baik selama proses produksi tepung ubi jalar maupun proses produksi aplikasinya.
Daya alir ditentukan pula oleh sifat pembentukan sudut curah dari bahan tersebut. Besar sudut curah sangat dipengaruhi oleh ukuran, bentuk dan karakteristik permukaan partikel, kadar air, berat jenis dan kerapatan tumpukan (Khalil 1999). Khalil (1999) menyatakan pula bahwa semakin kecil ukuran partikel semakin besar sudut curah, hal ini terlihat pula pada Tabel 14 dimana ukuran partikel tepung komersial relatif kecil dan seragam dibandingkan ukuran partikel tepung perlakuan sehingga sudut curahnya pun makin besar.
Sementara itu, densitas kamba dan densitas padat perlu menjadi bahan pertimbangan dalam mendesain ukuran alat seperti silo, tangki ataupun hopper. Kapasitas silo, kontainer, dan kemasan (seperti karung) terletak antara besaran nilai densitas kamba dan densitas padat (Khalil 1999). Khalil (1999) juga mengungkapkan bahwa ukuran partikel memiliki pengaruh pada besaran densitas
kamba dan densitas padat tepung-tepungan. Semakin kecil ukuran partikel, densitas kamba semakin kecil, tetapi sebaliknya dengan densitas padat. Semakin kecil ukuran partikel, densitas padat semakin besar. Hal ini juga berlaku dengan
tepung ubi jalar hasil perlakuan terhadap tepung ubi jalar komersial (Tabel 14). Namun demikian, besar nilai densitas kamba dan densitas padat tepung perlakuan
dan tepung komersial tidak berbeda nyata secara statistik. Hal ini menunjukkan bahwa keperluan alat/mesin untuk tepung dengan karakteristik tepung perlakuan tidak banyak berbeda dengan keperluan alat/mesin untuk tepung yang telah dilakukan secara komersial.
Dengan demikian, sifat fisik tepung perlakuan yang perlu dipertimbangkan sebagai kendali stabilitas beta karoten adalah ukuran partikel dan kadar air. Semakin halus ukuran partikel semakin perlu pengendalian pada aliran bahan yaitu dengan meminimalkan jarak perpindahan atau menghilangkan proses pemindahan bahan tepung, karena bahan ini tergolong sulit mengalir sehingga memberi kesempatan bahan kontak dengan oksigen maupun cahaya.
Selain itu, kendali stabilitas beta karoten selama proses produksi tepung ubi jalar juga dilakukan terutama dengan memperhatikan waktu pengeringan untuk mencapai kadar air produk yang diinginkan. Semakin cepat proses pengeringan, semakin berkurang kontak bahan dengan oksigen dan suhu panas pengering.
Aspek teknis lain yang perlu diperhatikan adalah teknik pengemasan, karena setelah proses produksi yang terkendali terhadap stabilitas kadar beta karoten, produk perlu mendapat perlindungan selama penyimpanannya. Teknis pengemasan dan bahan kemasan yang digunakan hendaknya dipilih dengan pertimbangan untuk memberikan perlindungan maksimum tepung dari pengaruh cahaya dan udara.
![Tabel 4. Hasil perhitungan luas permukaan tepung dan kadar beta karoten Bahan Luas muka (m 2 ) [beta karoten] (ppm) Var Sewu - blanching 3.17 9.79 Var Sewu – non bla](https://thumb-ap.123doks.com/thumbv2/123dok/1999657.2683641/5.892.195.774.691.757/tabel-perhitungan-permukaan-tepung-karoten-bahan-karoten-blanching.webp)