SKRIPSI
Oleh :
SILTA RESLITA BR GINTING 0925010003
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS PEMBANGUNAN NASIONAL “ VETERAN” JAWA TIMUR SURABAYA
SKRIPSI
Diajukan untuk Memenuhi Sebagian Persyaratan
Dalam Memperoleh Gelar Sarjana Pertanian
Program Studi Agroteknologi
Oleh :
SILTA RESLITA BR GINTING 0925010003
PROGRAM STUDI AGROTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS PEMBANGUNAN NASIONAL “ VETERAN” JAWA TIMUR SURABAYA
2013
Disusun oleh :
SILTA RESLITA BR GINTING NPM : 0925010003
Telah Ujian dan Diterima
Fakultas Pertanian Program Studi Agroteknologi Universitas Pembangunan Nasional “Veteran” Jawa Timur
pada tanggal ...-...-...
Telah disetujui oleh :
Pembimbing : Tim Penguji :
1. Pembimbing Utama 1. Ketua
Dr. Ir. Sukendah, MSc. Dr. Ir. Sukendah, MSc.
2. Pembimbing Pendamping 2. Sekertaris
Dr. Ir. Pangesti Nugrahani, MSi. Dr. Ir. Pangesti Nugrahani, MSi.
3. Anggota
Ir. Penta Suryaminasih, MP.
4. Anggota
Ir. Yonny Koentjoro, MM.
Mengetahui :
DEKAN
FAKULTAS PERTANIAN
Dr. Ir. Ramdan Hidayat, MP
KETUA PROGRAM STUDI AGROTEKNOLOGI
Ir. Mulyadi, MS
Telah Direvisi
Tanggal : ... 2013
Dr. Ir Sukendah, MSc. Dosen Pembimbing Utama
viii
KATA PENGANTAR
Puji syukur penulis ucapkan kehadirat Allah SWT, atas segala limpahan
rahmat dan hidayah-Nya serta segala kuasa dan perlindungan-Nya sehingga
penulis dapat menyelesaikan skripsi yang berjudul “Pertumbuhan Embrio Kelapa
Kopyor (Cocos nucifera L.) Pada Berbagai Modifikasi Media Kultur In-Vitro.”
Penyusunan skripsi ini merupakan salah satu syarat untuk memperoleh
gelar Sarjana Pertanian Program Studi Agroteknologi pada Fakultas Pertanian
Universitas Pembangunan Nasional “Veteran” Jawa Timur.
Penulis menyampaikan ucapan terima kasih yang sebesar-besarnya
kepada yang terhormat Dr. Ir. Sukendah, MSc. selaku Dosen Pembimbing
Utama dan Dr. Ir. Pangesti Nugrahani, M.Si. selaku Dosen Pembimbing
Pendamping, yang telah memberikan saran dan masukan yang sangat berarti
bagi penulis selama penulisan skipsi ini. Ucapan terimakasih juga penulis
sampaikan kepada :
1. Orang tua dan keluarga besar Ginting yang selalu mendukung penulis
dalam berbagai hal, khususnya dalam dukungan material dan spiritual.
Demikian juga pada Mas Mardi sekeluarga yang memberikan motivasi.
2. Dr. Ir. Ramdan Hidayat, MS., selaku Dekan Fakultas Pertanian UPN
“Veteran” Jawa Timur.
3. Ir. Mulyadi, MS., selaku Ketua Program Studi Agroteknologi Fakultas
Pertanian UPN “Veteran” Jawa Timur.
4. Para Bapak dan Ibu Dosen serta teman-teman yang senantiasa memberi
dukungan penulis dalam menyelesaikan skripsi ini.
5. Semua pihak yang telah membantu yang tidak dapat penulis sebutkan
ix
Penulis menyadari bahwa penyusunan skripsi ini masih belum sempurna
karena keterbatasan kemampuan dan pengetahuan yang dimiliki, untuk itu
penulis mengharapkan saran yang sifatnya membangun dari semua pihak.
Akhir kata penulis berharap semoga skripsi ini dapat memberikan sesuatu
yang berguna khususnya bagi penulis serta bagi para pembaca pada umumnya.
Surabaya, Mei 2013
Penulis
x
3.4. Pelaksanaan Penelitian ... 16
3.4.1. Sterilisasi Alat ... 16
3.4.2. Pembuatan Media ... 17
3.4.3. Sterilisasi Media ... 18
3.4.4. Sterilisasi, Isolasi dan Penanaman Embrio ... 18
3.4.5. Subkultur ... 19
3.5. Variabel Pengamatan ... 19
3.5.1. Pengamatan Secara Deskriptif ... 19
3.5.2. Pengamatan Secara Kuantitatif... 20
3.5.2.a. Tahap Perkecambahan ... 20
Hak Cipta © milik UPN "Veteran" Jatim :
xi
IV. HASIL DAN PEMBAHASAN ... 24
4.1. Hasil Penelitian ... 24
4.1.1. Pertumbuhan Embrio pada Tahap Perkecambahan ... 24
4.1.2. Pertumbuhan Embrio pada Tahap Pertumbuhan Planlet . 28 4.1.3. Pertumbuhan Embrio dan Planlet Browning, Stagnan dan mati ... 33
4.2. Pembahasan ... 34
V. KESIMPULAN DAN SARAN ... 40
5.1. Kesimpulan ... 40
5.2. Saran ... 40
DAFTAR PUSTAKA ... 41
LAMPIRAN ... 44
Hak Cipta © milik UPN "Veteran" Jatim :
xii
Nomor Halaman
Judul
1. Rata-rata panjang embrio pada berbagai media umur 14 HSI, 28 HSI, 42 HSI dan 56 HSI ... 25
3. Rata-rata persentase embrio kelapa kopyor yang berkecambah menjadi bakal tunas, akar dan tunas + akar (planlet sempurna) pada berbagai media modifikasi ... 26
4. Rata-rata panjang tunas pada berbagai media perlakuan umur 10 sampai 16 MSI ... 31
5. Rata-rata panjang tunas pada berbagai media perlakuan umur 18 sampai 24 MSI ... 31
6. Persentase planlet kelapa kopyor yang mengalami browning, stagnan dan mati pada fase pertumbuhan planlet berbagai
media modifikasi ... 33
Hak Cipta © milik UPN "Veteran" Jatim :
xiii
Nomor Halaman
Judul
1. Grafik pola pertumbuhan panjang embrio kelapa kopyor
pada umur 14 HSI, 24 HSI, 48 HSI dan 56 HSI ... 26
2. Pertumbuhan embrio dalam perlakuan media pada tahap
perkecambahan ... 27
3. Embrio pada media gandasil d 2 g/l + air kelapa 150 ml/l
yang mengalami browning setelah subkultur I... 29
4. Pertumbuhan akar planlet kelapa kopyor dalam media perlakuan y3 (a.) akar planlet setelah subkultur i, (b.) akar planlet setelah
subkultur II. ... 29
5. Planlet perlakuan media air kelapa 150 ml/l + santan 100 ml/l
setelah subkultur II ... 30
6. Grafik pola pertumbuhan embrio kelapa kopyor terhadap
berbagai modifikasi media ... 32
7. Pertumbuhan Planlet pada Berbagai Perlakuan Modifikasi
Media Setelah Subkultur II. ... 32
8. Kondisi planlet yang mengalami browning pada media
modifikasi gandasil d 2 g/l + air kelapa 150 ml/l ... 34
Hak Cipta © milik UPN "Veteran" Jatim :
xiv
Nomor Halaman
Judul
1. Komposisi media kultur Eeuwens (Y3)... 44
2. Komposisi media kultur Murashige dan Skoog (MS) ... 45
3. Komposisi Kimia Air Kelapa ... 45
4. Komposisi Gandasil D ... 46
5. Komposisi Kimia Daging Buah Kelapa Segar pada 3 (Tiga) Tingkatan Umur ... 46
6. Hasil analisis ragam panjang embrio pada umur 14 HSI ... 46
7. Hasil analisis ragam panjang embrio pada umur 14 HSI setelah transformasi ... 46
8. Hasil analisis ragam panjang embrio pada umur 28 HSI ... 47
9. Hasil analisis ragam panjang embrio pada umur 28 HSI setelah transformasi ... 47
10. Hasil analisis ragam panjang embrio pada umur 42 HSI ... 11. hasil analisis ragam panjang embrio pada Umur 42 HSI setelah transformasi ... 47
12. Hasil analisis ragam panjang embrio pada umur 56 HSI ... 47
13. Hasil analisis ragam panjang embrio pada umur 56 HSI setelah transformasi ... 47
14. Hasil analisis ragam panjang tunas pada umur 10 MSI ... 47
15. Hasil analisis ragam panjang tunas pada umur 10 MSI Setelah transformasi ... 48
16. Hasil analisis ragam panjang tunas pada umur 12 MSI ... 48
17. Hasil analisis ragam panjang tunas pada umur 12 MSI setelah transformasi ... 48
18. Hasil analisis ragam panjang tunas pada umur 14 MSI ... 48
19. Hasil analisis ragam panjang tunas pada umur 14 MSI setelah transformasi ... 48
20. Hasil analisis ragam panjang tunas pada umur 16 MSI ... 48
21. Hasil analisis ragam panjang tunas pada umur 16 MSI setelah transformasi ... 48
22. Hasil analisis ragam panjang tunas pada umur 18 MSI ... 49
23. Hasil analisis ragam panjang tunas pada umur 18 MSI setelah transformasi ... 49
24. Hasil analisis ragam panjang tunas pada umur 20 MSI ... 49
Hak Cipta © milik UPN "Veteran" Jatim :
xv
26. Hasil analisis ragam panjang tunas pada umur 22 MSI ... 49
27. Hasil analisis ragam panjang tunas pada umur 22 MSI
setelah transformasi ... 49
28. Hasil analisis ragam panjang tunas pada umur 24 MSI ... 49
29. Hasil analisis ragam panjang tunas pada umur 24 MSI
setelah transformasi ... 50
30. Rekapitulasi hasil analisis sidik ragam ... 50
31. Rekapitulasi hasil perhitungan duncan 5% ... 50
32. Rata-rata pertumbuhan panjang embrio pada umur 14 sampai
56 HSI (Hari Setelah Inokulasi) ... 51
33. Rata-rata Pertumbuhan Panjang Tunas pada Umur 10 sampai
16 MSI (Minggu Setelah Inokulasi) ... 51
34. Rata-rata Pertumbuhan Panjang Tunas pada Umur 18 sampai
24 MSI (Minggu Setelah Inokulasi) ... 52
Hak Cipta © milik UPN "Veteran" Jatim :
RINGKASAN
Kelapa kopyor mempunyai nilai ekonomi cukup tinggi, karena memiliki daging buah yang bertekstur gembur serta rasa yang gurih. Kelapa kopyor merupakan salah satu kelapa yang spesifik di Indonesia, memiliki endosperm yang abnormal, yaitu sebagian besar endospermnya (daging buah) terlepas dari tempurung yang menyebabkan buah kelapa kopyor gagal untuk berkecambah, karena daging buah (endosperm) yang merupakan sumber bahan makanan embrio kelapa cepat membusuk jika ditanam dengan cara konvensional.
Adanya kondisi tersebut menyebabkan pengembangan produksi buah kopyor sangat lambat dan terbatas. Salah satu alternatif metode untuk meningkatkan persentase buah kopyor perpohon adalah dengan menyelamatkan embrio kelapa kopyor dan menanamnya dalam media agar secara aseptik yang disebut teknik kultur embrio mampu berbuah banyak yaitu 90-100%, sedangkan tanaman yang diperbanyak secara konvensional hanya mampu menghasilkan beberapa % atau hanya terdapat 1-2 butir pertandan.
Tujuan dari penelitian ini adalah untuk mengetahui respon pertumbuhan embrio kelapa kopyor yang ditanam pada berbagai media kultur in vitro yang dimodifikasi.
Penelitian ini dilaksanakan mulai bulan Oktober 2012 sampai dengan Maret 2013 dan tempat pelaksanaan penelitian adalah di Laboratorium Bioteknologi Fakultas Pertanian Universitas Pembangunan Nasional “Veteran” Jawa Timur.
Penelitian ini disusun berdasarkan Rancangan Acak Lengkap (RAL) 1 faktor dengan 6 perlakuan yang diulang sebanyak 7 kali. Berikut ini adalah bentuk perlakuan yang dilakukan Media 1 (M1) = Media Eeuwens (Media Padat)/(Kontrol), Media 2 (M2) = Media Eeuwens + Air kelapa 150 ml/l + Grow Quick S (GQS) 2 ppm/l + Grow Quick R (GQR) 2 ppm/l (Media Padat), Media 3 (M3) = Gandasil D 2 g/l + Air Kelapa 150 ml/l (Media Padat), 4). Media 4 (M4) = Air Kelapa 150 ml/l (Media Cair), Media 5 (M5) = Air Kelapa 150 ml/l + Santan 100 ml/l (Media Padat), Media 6 (M6) = Media MS (Media Padat)
Data yang diperoleh dianalisis dengan menggunakan analisis sidik ragam RAL. Apabila FHitung ≥ FTabel maka dilanjutkan uji perbandingan rata-rata hasil dengan Uji Jarak Duncan 5% (UJD 5%).
ABSTRAK
Penanaman embrio kelapa kopyor dalam media agar secara aseptik dilakukan untuk menyelamatkan embrio kelapa kopyor yang sulit dikembangkan dengan cara konvensional. Media aseptik yang sudah dikembangkan yaitu media Eeuwens (Y3) dan Murashige dan Skoog (MS) yang merupakan media buatan yang tersusun dari bahan kimia murni yang mahal harganya. Oleh karena itu, dibuat media alternatif sebagai pengganti media yang ada, melalui modifikasi media terhadap media yang telah ada dan membuat beberapa media baru dengan komposisi lebih murah, sederhana dan mudah didapat. Embrio kelapa kopyor yang digunakan berasal dari Pati, Jawa Tengah yang kemudian ditanam pada berbagai modifikasi media yakni (Media 1). Eeuwens (Y3) (Kontrol), (Media 2). Eeuwens (Y3) + Air kelapa 150 ml/l + Grow Quick S (GQS) 2 ppm/l + Grow Quick R (GQR) 2 ppm/l, (Media 3). Gandasil D 2 g/l + Air Kelapa 150 ml/l, (Media 4). Air Kelapa 150 ml/l, (Media 5). Air Kelapa 150 ml/l + Santan 100 ml/l dan (Media 6). MS. Dari ke-6 perlakuan, embrio yang paling baik pertumbuhannya hingga tahap penumbuhan planlet adalah embrio yang ditanam di dalam media Y3 dengan rata-rata panjang tunas 2.54 cm dan MS 2.45 cm. Kedua media tersebut merupakan media tumbuh buatan yang tersusun dari bahan kimia murni yang mengandung nutrisi lengkap tersebut merupakan media yang sumber nutrisinya berasal dari pupuk daun Gandasil D, air kelapa dan santan yang berbahan murah dan mudah untuk didapat. Media tersebut juga menunjukkan respon embrio kelapa kopyor dapat tumbuh dan berkecambah walaupun pertumbuhannya lambat, dengan demikian dapat diketahui bahwa media modifikasi tersebut dapat dikembangkan lebih lanjut sebagai media kultur embrio kelapa kopyor.
Kata Kunci : embrio, kelapa kopyor, modifikasi media
I. PENDAHULUAN
1.1. Latar Belakang
Kelapa kopyor (Cocos nucifera L.) merupakan salah satu kelapa yang
spesifik di Indonesia, memiliki endosperm yang abnormal, yaitu sebagian besar
endospermnya (daging buah) terlepas dari tempurung. Abnormalitas endosperm
ini bersifat genetik dan disebabkan oleh beberapa faktor genetik (Mashud, 2012).
Menurut Khoironi (2010), kelapa kopyor tidak dapat dikecambahkan seperti
kelapa pada umumnya, karena daging buah yang merupakan cadangan
makanan tidak dapat mendukung pertumbuhan embrionya. Hal itu disebabkan
karena sifat “kopyor” yang dalam bahasa jawa berarti antara daging dan air
kelapa bercampur menjadi satu, tetapi tidak larut sehingga masih terlihat ada
gumpalan-gumpalan daging kelapa yang menjadi satu dengan air kelapa. Sifat
kekopyoran itulah yang menyebabkan kelapa kopyor tersebut mempunyai nilai
ekonomi cukup tinggi, karena memiliki daging buah yang bertekstur lunak serta
rasa yang gurih.
Menurut Prasetyo dan Rachmad (2003) Buah kelapa kopyor ditandai
dengan tekstur daging buah yang lunak, berbutir dan mudah lepas dari
tempurungnya. Karakter daging buah yang demikian menyebabkan buah kelapa
kopyor gagal untuk berkecambah, karena daging buah (endosperm) yang
merupakan sumber bahan makanan embrio kelapa cepat membusuk jika
ditanam dengan cara konvensional.
Adanya kondisi tersebut menyebabkan pengembangan produksi buah
kopyor sangat lambat dan terbatas. Salah satu alternatif metode untuk
meningkatkan persentase buah kopyor perpohon adalah dengan menyelamatkan
embrio kelapa kopyor dan menanamnya dalam media agar secara aseptik yang
disebut teknik kultur embrio (Sukendah, 2009). Tanaman kelapa kopyor hasil
banyak, yaitu dapat mencapai 90%-100%. Sedangkan tanaman kelapa kopyor
hasil perbanyakan secara konvensional, yaitu membibitkan buah kelapa normal
yang berasal dari pohon berbuah kopyor, hanya menghasilkan buah kopyor
sebanyak 1-2 butir per tandan atau 10-20% untuk tipe Dalam dan 30%-40%
untuk tipe Genjah (BPTP, 2010).
Saat ini terdapat beberapa macam media kultur untuk tanaman kelapa
yang dikembangkan oleh PCA (Philippine Coconut Authority), CPCRI (Central
Plantation Crops Research Institute) India, UPLB (University of Philippines at Los
Banos) dan ORSTOM/CIRAD Perancis. Media tersebut umumnya menggunakan
media padat dan media cair selama tahap kultur. Media kultur yang digunakan
adalah media Y3 (Eeuwens) dan MS (Murashige dan Skoog) (Engelmann, 1997
dalam Batugal dan Engelmann, 1998).
Di Indonesia, media untuk embrio kelapa kopyor sudah banyak
dikembangkan yang sebagian besar merupakan hasil modifikasi dari medium
yang dikembangkan sebelumnya, yang telah terbukti sesuai untuk kultur embrio
kelapa kopyor. Komposisi media yang cocok adalah media Y3 yang kaya akan
unsur klor (Cl) dan besi (Fe) yang mungkin banyak dibutuhkan oleh tanaman
kelapa. Media Y3 memang dimodifikasi oleh Eeuwens khusus untuk tanaman
kelapa (Sukendah, 2002). Di Indonesia media untuk kelapa kopyor telah
dikembangkan oleh Balai Penelitian Bioteknologi Perkebunan Bogor dengan
media dasar MS (Tahardi dan Warga-Dalem, 1982).
Berdasarkan uraian diatas, penulis melakukan penelitian ini untuk
mempelajari pertumbuhan dari kultur embrio kelapa kopyor yang berasal dari
daerah Pati, Jawa Tengah dengan menumbuhkan embrio ke dalam media
tumbuh buatan yang tersusun dari bahan kimia murni Eeuwens (Y3) dan
Murashige dan Skoog (MS). Namun, mengingat bahwa media tumbuh buatan
tersebut memiliki harga yang mahal dan sulit untuk melakukan pemesanan
dalam jumlah sedikit, penulis juga melakukan pembuatan media alternatif
sebagai pengganti media yang ada, melalui modifikasi media terhadap media
yang telah ada dan membuat beberapa media baru dengan komposisi lebih
murah, sederhana, mudah dijangkau oleh masyarakat.
Setiap media yang dimodifikasi mengandung air kelapa 150 ml/l, karena
berdasarkan hasil penelitian Sukendah (2009) embrio yang dikulturkan pada
media dengan air kelapa 150 ml/l lebih cepat berkecambah, yaitu kurang dari
satu bulan (29 hari) dan nyata berbeda dengan media tanpa bahan aditif. Selain
itu bahan media yang digunakan juga berupa Zat Pengatur Tumbuh Grow Quick
R, Grow Quick S, pupuk daun Gandasil D dan santan.
Pembentukan media baru tersebut didasarkan pada berbagai
pertimbangan antara lain; pencegahan stagnasi, pengendalian browning dan
pertumbuhan planlet yang lambat dengan harapan akan didapatkannya
modifikasi media serta rangkaian media baru dengan komposisi media yang
sesuai bagi pertumbuhan embrio kelapa kopyor.
1.2. Rumusan Masalah
Bagaimanakah pertumbuhan embrio kelapa kopyor dari berbagai media
kultur in vitro ?
1.3. Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengetahui respon pertumbuhan
embrio kelapa kopyor yang ditanam pada berbagai media kultur in vitro yang
II. TINJAUAN PUSTAKA
2.1. Kelapa Kopyor
Buah kelapa kopyor diperoleh dari pohon kelapa yang memiliki sifat
kopyor (gen kopyor) sehingga sebagian buahnya normal dan sebagian
buahnya tidak normal (kopyor). Sifat kopyor dibawakan oleh pasangan gen
resesif (kk) yang merupakan gabungan dari dua gen kopyor yang berasal
dari pohon yang sama ataupun berbeda. Sifat tersebut tidak akan muncul
apabila gen kopyor yang resesif (k) berpasangan dengan gen kelapa biasa
(K) yang dominan. Jadi, buah kelapa kopyor hanya terbentuk apabila terjadi
persilangan antar buah yang memiliki sifat kopyor (Zuniga, 1953 dalam
Tahardi, 1997).
Perbanyakan tanaman kelapa kopyor dapat dilakukan dengan 2 (dua)
cara yaitu, secara alami atau secara konvensional dan secara kultur embrio.
Para petani biasanya memperbanyak tanaman kelapa kopyor secara
konvensional yaitu menanam buah kelapa terpilih sebagai bibit yang dihasilkan
dari pohon kelapa yang memiliki gen kopyor (Sukamto, 2006). Secara alami
kelapa kopyor sulit untuk diperbanyak karena daging buah sebagai
cadangan makanan untuk embrio mengalami kerusakan sehingga embrio tidak
dapat berkecambah (Tahardi, 1997).
Sukendah (2009) melaporkan bahwa perbanyakan tanaman kelapa
kopyor selama ini dikembangkan melalui kultur jaringan dengan menanam
embrio zigotik kelapa kopyor dalam media agar secara aseptik yang disebut
teknik kultur embrio. Teknik kultur embrio ini bertujuan untuk menyelamatkan dan
menumbuhkan embrio kelapa kopyor yang disebut embryo rescue. Meskipun
demikian, efisiensi dalam teknik kultur embrio ini masih diperlukan
perbaikan-perbaikan proses kultur embrio karena dalam menghasilkan planlet dan bibit
kelapa kopyor masih tergolong rendah.
2.2. Kultur Embrio
Kultur embrio adalah cara untuk menyelamatkan embrio kelapa kopyor,
mengecambahkan dan menumbuhkannya pada media kultur buatan dalam
kondisi yang aseptik (Catibog, 2001 dalam Prasetyo 2003). Dengan adanya
teknik kultur embrio pada embrio kelapa kopyor bertujuan untuk mendapatkan
tanaman kelapa kopyor dan mampu berbuah kopyor per pohon. Tanaman kelapa
hasil kultur embrio tersebut memiliki beberapa keunggulan yaitu keturunan yang
dibawa pasti membawa gen yang mengontrol sifat kopyor, presentase buah
kopyor yang dihasilkan tinggi dan kualitas buah kopyor lebih seragam
(Novarianto, 1999)
Wahyuni (2000) melaporkan perbanyakan kelapa kopyor secara kultur
embrio sangat menguntungkan karena tanaman kelapa merupakan tanaman
berbiji tunggal yang sampai saat ini tidak dapat dikembangbiakkan secara
cangkok atau stek. Selain itu hasil kultur embrio dapat menghasilkan kelapa
kopyor cukup tinggi yaitu dapat mencapai 90-100% berupa kelapa kopyor dari
keseluruhan buah kelapa dalam satu pohon.
2.3. Media Kultur Embrio
Dalam kultur jaringan dikenal ada 3 (tiga) jenis media yang digunakan
yaitu media padat, semi padat dan cair. Pertumbuhan kultur dan laju
pembentukan tunas sangat dipengaruhi oleh keadaan fisik dari media ini
(Wattimena, 1992).
Media cair merupakan campuran komponen-komponen zat kimia (garam
mineral, sumber karbon, vitamin dan zat pengatur tumbuh) dengan air suling,
sedangkan media padat merupakan media cair yang terdiri dari
komponen-komponen zat kimia (garam mineral, sumber karbon, vitamin dan zat pengatur
2.3.1. Komposisi Media Kultur
Menurut Sukendah (2002), secara umum embrio kelapa membutuhkan
media dengan kandungan garam organik yang tinggi terutama unsur Klor (Cl)
dan Besi (Fe) dalam menunjang pertumbuhan media-media tersebut
antaranya media Murashige dan Skoog (MS) dan Eeuwens (Y3).
Menurut Eengelmann (1997) dalam Batugal dan Engelmann (1998)
media kultur yang sering digunakan untuk kultur embrio kelapa kopyor adalah
media yang diadaptasi dari Eeuwens (Y3) dan Murashige dan Skoog (MS). Del
Rosario (1997) dalam Batugal dan Eengelmann (1998) menjelaskan bahwa
media Eeuwens dan MS lebih sering digunakan untuk kultur embrio kelapa
kopyor karena terbukti memberikan pertumbuhan yang lebih baik
dibandingkan dengan penggunaan media kultur yang lain.
Media Eeuwens (Y3) mempunyai komposisi media yang cocok untuk
nutrient tanaman kelapa (Sukendah, 2002). Hal ini dikarenakan media Y3
memang dimodifikasi oleh Eeuwens khusus untuk tanaman kelapa.
Unsur-unsur yang terdapat dalam median ini antara lain : NH4Cl, KNO3,
MgSO4.7H2O, COCl2. 2H2O, KCl, NaH2PO.2H2O, KI, H3BO3,MnSO4.4H2O,
ZnSO4.4H2O, CuSO4.5H2O, CoCl2.6H2O, NaMoO4.H2O dan NiCl.6H2O
(Batugal et al., 1997).
Melalui pengujian berbagai protokol bentuk media (padat dan cair)
selama dua tahun (dua kali periode pengujian), ternyata embrio kelapa
kopyor asal Sumenep Jawa Timur hanya bisa tumbuh baik pada serangkaian
media Eeuwens padat (fase perkecambahan; fase pertumbuhan planlet;
fase penguatan planlet) dengan persentase perolehan planlet sekitar 40%
(Sukendah, 2005).
Sedangkan media MS merupakan media dasar yang mempunyai
konsentrasi garam-garam mineral yang tinggi dan senyawa N dalam bentuk
NO3- dalam bentuk NH4+ (Hendaryono et al., 1994). Media MS mengandung 40
mM dalam bentuk NO3 dan 29 mM dalam bentuk NH4+. Kandungan N ini, 5
(lima) kali lebih tinggi dari N total yang terdapat pada media Miller, 15 kali
lebih tinggi dari media tembakau Hildebrant dan 19 kali lebih tinggi dari media
White. Kalium juga ditingkatkan sampai 20 mM, sedangkan P 1,25 mM. Unsur
makro lainnya juga sedikit dinaikkan (Triandani, 2004).
2.3.2. Unsur Hara
Unsur-unsur esensial yang dibutuhkan tanaman dalam jumlah relatif
besar diistilahkan sebagai unsur-unsur makro (Salisbury dan Ross, 1992).
Unsur-unsur makro karbon, hydrogen dan oksigen tersedia bagi tanaman
melalui air dan udara. Sementara itu, kebutuhan akan unsur-unsur makro
yang lain seperti nitrogen, fosfor, kalium, kalsium, magnesium dan belerang
dipenuhi melalui medium tumbuh. Pada kultur in vitro, nitrogen diberikan
dalam jumlah terbesar dalam bentuk KNO3 atau NH4NO3. Kebutuhan akan
magnesium dan belerang dapat dipenuhi melalui pemberian MgSO4.7H2O.
Sementara itu fosfor dapat diberikan dalam bentuk NaH2PO4.H2O atau
KH2PO4. Sedangkan CaCl2.2H2O, Ca(NO3)2.4H2O, atau bentuk-bentuk
anhidrat dari kedua garam tersebut dapat diberikan untuk memenuhi
kebutuhan akan kalsium (Dodds dan Roberts, 1985).
Di samping unsur-unsur makro, sel-sel tanaman pun membutuhkan
unsur-unsur mikro tertentu. Unsur-unsur mikro yang dibutuhkan oleh semua
tanaman tingkat tinggi meliputi besi, mangan, seng, boron, tembaga, molibdat
dan klor. Walaupun natrium tidak umum dibutuhkan oleh tanaman tingkat
tinggi, unsur ini diperlukan oleh jaringan-jaringan yang mengandung klorofil,
seperti tanaman dengan lintasan fotosintesis C4 dan tanaman dengan
metabolisme asam craculacean (Crasulacean Acid Metabolism, CAM). Stok
besi disiapkan secara terpisah karena adanya masalah pada kelarutan unsur
natrium feriric ethylenediamine tetra-acetic (NaFeEDTA). Di samping
unsur-unsur mikro yang telah banyak dikenal, beberapa medium mengandung
unsur-unsur mikro kobalt dan iodium (Dodds dan Roberts, 1985) Sementara
itu, unsur-unsur lain, seperti nikel, titanium, berilium dan aluminium masih
belum banyak digunakan, kecuali untuk tujuan tertentu.
Menurut Wetter dan Constabel (1991), medium hara untuk kultur
jaringan tanaman mengandung 5 kelompok senyawa, yaitu :
a. Garam Organik
Kadar kalium dan nitrat masing-masing sekurang-kurangnya 20-25
mM. Amonium mungkin diperlukan juga, walaupun jumlah diatas 8 mM dapat
membahayakan. Kebutuhan untuk natrium atau klorida tidak nyata. Kadar
fosfat, sulfat, dan magnesium 1-3 mM tampaknya sudah mencukupi. Hara
mikro yang dianjurkan adalah iodide, asam borat dan garam mangan, seng,
molybdenum, tembaga, kobalt dan besi
b. Sumber Karbon
Sukrosa atau glukosa 2-4% merupakan sumber karbon yang paling
cocok. Berbagai asam organik digunakan bersama ammonium yang juga
mempercepat pertumbuhan sel yang dikultivasi pada rapatan rendah.
c. Vitamin
Tiamin merupakan satu-satunya vitamin yang penting. Peridoksin,
asam nikotinat dan mio-inositol seringkali dapat meningkatkan pertumbuhan
sel. Vitamin lainnya mungkin amat bermanfaat untuk kultur sel tunggal pada
rapatan rendah.
d. Pengatur Tumbuh
Pengatur tumbuh dibutuhkan untuk menginduksi pembelahan sel.
Senyawa yang paling sering digunakan adalah asam 2,4-diklorofenoksiasetat
(2,4-D) dan asam naftalenasetat (NAA). Senyawa ini digunakan pada kadar
0,1-50 µM. Asam indolasetat menginduksi pembelahan sel, tetapi senyawa ini
tidak stabil dan dapat diuraikan oleh enzim yang dibebaskan oleh sel
tumbuhan dan stabil pada pemanasan dengan autoklaf. Sitokinin seperti
kinetin atau benziladenin (0,1-10 µM) kadang-kadang dibutuhkan bersama
2,4-D atau NAA untuk mendapatkan pembentukan kalus yang baik.
e. Pelengkap Organik
Contohnya hidrolisat protein, ekstrak ragi, ekstrak tetes dan air kelapa
(endosperm cair). Ekstrak ini dapat memasok berbagai senyawa yang dapat
merangsang laju pertumbuhan sel, walaupun umumnya sel dapat tumbuh baik
dalam medium tanpa pelengkap ini apabila kadar garam cukup tinggi dan
metabolit ditambahkan.
Berikut ini adalah beberapa unsur hara tambahan yang digunakan oleh
penulis, antara lain:
- Air Kelapa
Air kelapa merupakan endosperma cair yang berfungsi sebagai
sumber nutrisi (selain endosperma padat) bagi perkembangan embrio
kelapa. Komposisi air kelapa mengandung beberapa hormon seperti
auksin, sitokinin dan giberelin. Air kelapa juga mengandung bahan organik
gula dan vitamin; asam amino serta bahan anorganik seperti fosfat (P),
magnesium (Mg) dan kalium (K) (Raghavan, 1977 dalam Fitriswari 2011).
Air kelapa merupakan salah satu bahan aditif yang umumnya
digunakan dalam kegiatan kultur jaringan. Pemberian air kelapa
dimaksudkan untuk mendorong induksi tunas adventif, karena
penambahan air kelapa dapat meningkatkan pembelahan sel (Steward,
1958 dalam Fitriswari 2011).
Berdasarkan hasil penelitian Sukendah dan Rachmad (2003),
ternyata dari berbagai bahan aditif yang diuji (sari tauge dan tomat, air
kelapa dan ekstrak ragi) hanya air kelapa yang dapat meningkatkan
kopyor. Sukendah (2009) melaporkan embrio kelapa kopyor yang
dikulturkan pada media dengan air kelapa 150 ml/l lebih cepat
berkecambah yaitu kurang dari satu bulan (29 hari) dan nyata berbeda
dengan media tanpa bahan aditif.
Hasil penelitian Fitriswari (2011) menunjukkan bahwa lebih dari
50% eksplan belahan kecambah dapat tumbuh pada media perlakuan
mengandung air kelapa 150 ml/l, BAP 5 mg/l, BAP 5 mg/l + 2,4-D 2.5 mg/l
dan BAP 5 mg/l + 2.4-D 2.5 mg/l + air kelapa 150 ml/l. Namun, pada
perlakuan air kelapa 150 ml/l memberikan hasil lebih baik untuk
pertumbuhan embrio kelapa kopyor yang dibelah dengan prosentase
sebesar 65.63%.
Hasil penelitian Prihatmanti dan Mattjik (2004) bahwa penggunaan
bahan alami air kelapa pada konsentrasi 100 sampai 200 ml/l untuk
multiplikasi tunas Anthurium andreanum dapat meningkatkan daya
tumbuh biakan in vitro. Selanjutnya Bey, et al., (2006) mengemukakan
bahwa perlakuan air kelapa secara tunggal pada konsentrasi 250 ml/l
mampu menghasilkan daun dan akar lebih cepat pada kultur in vitro
anggrek (Phalaenopsis amabilis BL.).
- Zat Pengatur Tumbuh Grow Quick
Menurut Widyastuti dan Tjokrokusumo (2007) Zat Pengatur
Tumbuh (ZPT) adalah senyawa organik yang bukan hara (nutrisi) tanaman
yang aktif dan dalam jumlah sedikit dapat mendukung, menghambat serta
dapat merubah proses fisiologi tumbuhan. Peranan ZPT sebagai
pendukung maupun penghambat pertumbuhan sangat ditentukan oleh
konsentrasinya, suhu, cahaya, kelembapan udara, cara penggunaan serta
pengaruh ZPT bergantung pada spesies tumbuhan. ZPT tidak bekerja
sendiri dalam mempengaruhi pertumbuhan dan perkembangan tumbuhan,
pada umumnya keseimbangan kosentrasi dari beberapa ZPT yang akan
mengontrol pertumbuhan dan perkembangan tumbuhan. Dalam kultur in
vitro terdapat 2 (dua) golongan ZPT yang sangat penting yaitu auksin dan
sitokinin. ZPT ini mempengaruhi pertumbuhan dan morfogenesis dalam
kultur sel, jaringan dan organ. Interaksi dan perimbangan dalam ZPT yang
diberikan dalam media dan yang diproduksi oleh sel secara endogen
menentukan arah suatu kultur.
Media kultur jaringan berisi campuran berbagai nutrisi dan hormon
tanaman. Hormon yang biasa digunakan dalam kultur jaringan adalah
kelompok dari sitokinin dan auksin. Hormon sintesis yang kerjanya mirip
sitokinin antara lain Benzyl Amino Purine (BAP), sedangkan yang mirip
auksin antara lain Naphtalen Acetic Acid (NAA).
Ada 2 (dua) Grow Quick yang digunakan yaitu Grow Quick R dan
Grow Quick S. Grow Quick R (GQR) mengandung Auksin, IBA dan NAA
sedangkan Grow Quick S (GQS) mengandung Sitokinin dan BAP.
Pada penelitian Rahmani (2008), menunjukkan bahwa pemberian
GQR 1 ml/l dan GQS 1 ml/l berpengaruh terhadap pertumbuhan planlet
anggrek. Hal ini dapat diketahui dari pengamatan setiap bulannya terjadi
perubahan panjang planlet, jumlah daun dan jumlah akar. Hal ini sesuai
dengan fungsi dari hormon sitokinin yang berperan memacu pertumbuhan
daun dan fungsi dari hormon auksin yang berperan dalam memacu
pertumbuhan akar dan tinggi tanaman.
• Auksin
Auksin merupakan salah satu golongan fitohormon yang tidak
terlepas dari perumbuhan dan perkembangan suatu tanaman (Abidin, 1982
dalam Fitriswari 2011). Aktifitas auksin dalam kultur jaringan dikenal
mampu berperan menginduksi kalus, mendorong proses morfogenesis
dapat mempengaruhi kestabilan genetik sel tanaman (Santoso dan
Nursandi, 2003).
Golongan auksin lainnya seperti IBA dan NAA juga digunakan untuk
meningkatkan perakaran planlet in vitro khususnya pada komoditi kelapa.
Hal ini dikarenakan beberapa peneliti kelapa berpendapat bahwa akar-akar
lateral sangat penting untuk menunjang penyerapan unsur hara sehingga
planlet lebih biasa bertahan pada kondisi luar pada tahap aklimatisasi.
Untuk merangsang keluarnya akar lateral pada eksplan kelapa
kopyor konsentrasi IBA 2 mg/l dengan persentase 60% lebih efektif
daripada 1 mg/l atau 3 mg/l. Pada konsentrasi IBA 2 mg/l menghasilkan
jumlah akar lateral nyata lebih banyak daripada IBA 1 mg/l. Planlet yang
mempunyai akar primer dan akar lateral, maka persentase planlet yang
berhasil diaklimatisasi mencapai ± 75-80% (Sukendah, 2009).
• Sitokinin
Sitokinin merupakan hormon tumbuhan turunan adenine dan
berfungsi untuk merangsang pembelahan sel. Sitokinin mempunyai
kemampuan mendorong terjadinya pembelahan sel dan diferensiasi
jaringan mitosi dalam pembentukan tunas pucuk, pertumbuhan akar dan
traslokasi melalui pembuluh xilem. Sitokinin digunakan secara komersial
dalam kultur in vitro adalah Benzyl Adenin (BA), 6-Benzyl Aminopurine
(BAP) dan kinetin.
Hasil penelitian yang dilakukan oleh Sukendah (2009) menunjukkan
bahwa lebih dari 80% eksplan belahan embrio kelapa kopyor tumbuh pada
media dengan BAP 2.5 mg/l. Eksplan belahan embrio yang tumbuh
semakin menurun dengan meningkatnya konsentrasi BAP, pada
konsentrasi 7.5 mg/l hanya sekitar 58% yang berhasil tumbuh. Tanpa
pemberian BAP, belahan embrio masih bisa tumbuh tetapi eksplan yang
berhasil tumbuh hanya 37.5% yang terdiri dari 25% tumbuh tunas
dan sisanya 12.5% tumbuh akar. Pada penelitian Fitriswari (2011)
menunjukkan pertumbuhan planlet kelapa kopyor pada perlakuan kontrol
dan BAP 2.5 mg/l planlet membentuk tunas dan akar dengan sempurna.
- Pupuk Daun Gandasil D
Menurut Rachmad (2011) Gandasil D atau sering disebut sebagai
Gandasil Daun yang tergolong sebagai Pupuk NPK Majemuk / Pupuk Daun
dengan kandungan unsurnya sebagai berikut :
§ N - Nitrogen - 20 %
§ P2O5 - Fosfor - 15 %
§ K2O - Kalium - 15 %
§ MgSO4 - Magnesium - 1%.
Serta dilengkapi dengan unsur-unsur mikro seperti Mangan (Mn),
Boron (B), Tembaga (Cu), Kobalt (Co), dan Seng (Zn), serta
vitamin-vitamin untuk pertumbuhan tanaman seperti : Aneurine, Lactoflavine, dan
Nicotinic acid amide.
Jari (2005) melaporkan bahwa penggunaan Gandasil 0.5 g/l yang
dikombinasikan dengan vitamin dan air kelapa 10% pada media preservasi
ubi jalar, menghasilkan jumlah tunas yang tidak berbeda nyata dengan
penggunaan media MS dan vitamin. Media yang mengandung Gandasil 0.5
g/l + air kelapa 10 % dapat dijadikan media alternatif pada preservasi ubi
jalar.
Pembentukan tunas anggrek Dendrobium Kanayo dipengaruhi oleh
perlakuan konsentrasi Gandasil, air kelapa dan interaksi keduanya.
Pertumbuhan tunas yang paling banyak dihasilkan pada kombinasi media
Gandasil 1 g/l + air kelapa 100 ml/l hingga 8 MST (Afrianita, 2006).
- Santan
Santan adalah cairan yang diekstrak dari daging kelapa yang
dengan cara memeras campuran air dan daging buah kelapa yang diparut.
Santan ini kaya akan kandungan mineral, vitamin, elektrolit, potassium,
khlorida, kalsium juga protein. Level protein yang terkandung dalam santan
kelapa terhitung rendah. Jenis protein yang ditemukan dalam santan
antara lain alanin, sistin, arginin, dan serene (Anonymous, 2012).
Santan kaya akan kandungan asam laurat. Setengah dari
kandungan asam lemak jenuh terdiri dari bahan asam laurat ini yang
mempunyai khasiat untuk dijadikan sebagai anti bakteri, anti virus, anti
jamur, dan juga anti mikroba (Anonymous, 2012).
Beberapa penelitian menggunakan air santan yang diperoleh dari
endosperma padat buah kelapa untuk meningkatkan pertumbuhan kultur
in vitro (Al-Khayri et al. 1992; Boase dan Wright, 1993 dalam Sukendah,
2009). Air kelapa merupakan endosperma cair yang berfungsi sebagai
sumber nutrisi (selain endosperma padat) bagi perkembangan dan
perkecambahan embrio kelapa. Oleh sebab itu sangat menarik untuk
mengkaji jenis air kelapa yang mana yang lebih baik yaitu air kelapa biasa
atau air kelapa dari endosperma padat (santan) untuk proses
perkecambahan in vitro embrio kelapa kopyor (Sukendah, 2009).
2.4. Hipotesis
Embrio kelapa kopyor memberikan respon yang berbeda pada berbagai
komposisi bahan media kultur yang diuji.
III. METODE PENELITIAN
3.1. Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Oktober 2012 sampai dengan
Maret 2013 dan tempat pelaksanaan penelitian adalah di Laboratorium
Bioteknologi Fakultas Pertanian Universitas Pembangunan Nasional “Veteran”
Jawa Timur.
3.2. Bahan dan Alat
3.2.1. Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan
tanam, media dan penunjang lain. Bahan tanam yang digunakan sebagai
sumber eksplan adalah embrio kelapa kopyor yang berasal dari pohon kelapa
berbuah kopyor genjah yang berumur 11-12 bulan. Buah kelapa kopyor
diambil dari kebun kelapa petani di daerah Pati, Jawa Tengah.
Bahan media yang digunakan meliputi sukrosa 30 g/l, arang aktif 2,5
g/l, agar 7 g/l, bahan kimia murni penyusun media Y3 (Eeuwens) dan MS
(Murashige dan Skoog), dan unsur hara tambahan seperti, Growmore
Sitokinin dan Auksin serta bahan alami air kelapa, Gandasil D dan santan.
Bahan penunjang lain adalah alkohol 70% dan 90%, spiritus, klorox, aquadest
steril dan betadine.
3.2.2. Alat
Alat-alat yang digunakan dalam penelitian ini yaitu, Laminar Air Flow
(LAF) sebagai tempat penanaman eksplan. Autoklaf digunakan untuk
mensterilkan alat-alat seperti botol kultur, dissecting kit dan media kultur.
Timbangan analitik sebagai pengukur bahan media dalam satuan kecil yaitu
milligram (mg). Magnetic stirrer digunakan untuk mengaduk dan kertas lakmus
Alat-alat penting lain yang digunakan adalah kompor, oven, tabung
reaksi, erlenmeyer, gelas ukur, cawan petri, pipet, pengaduk, pinset, scalpel,
lampu bunsen, plastik penutup, karet, aluminium foil, penggaris dan kamera.
3.3. Metode Penelitian
Penelitian ini merupakan percobaan yang disusun berdasarkan
Rancangan Acak Lengkap (RAL) 1 faktor dengan 6 perlakuan yang diulang
sebanyak 7 kali. Berikut ini adalah bentuk perlakuan yang dilakukan :
1). Media 1 (M1) = Media Eeuwens (Media Padat) (Kontrol)
2). Media 2 (M2) = Media Eeuwens + Air kelapa 150 ml/l + Grow Quick S
(GQS) 2 ppm/l + Grow Quick R (GQR) 2 ppm/l
(Media Padat)
3). Media 3 (M3) = Gandasil D 2 g/l + Air Kelapa 150 ml/l (Media Padat)
4). Media 4 (M4) = Air Kelapa 150 ml/l (Media Cair)
5). Media 5 (M5) = Air Kelapa 150 ml/l + Santan 100 ml/l (Media Padat)
6) Media 6 (M6) = Media MS (Media Padat)
3.4. Pelaksanaan Penelitian
3.4.1. Sterilisasi Alat
Alat-alat yang akan digunakan seperti gelas ukur, pinset, scalpel,
petridish, erlenmeyer, corong dan botol kultur dicuci terlebih dahulu dengan
air sabun hingga bersih kemudian ditiriskan hingga kering. Kemudian, seluruh
alat tersebut dibungkus dengan kertas bersih dan dimasukkan dalam autoklaf
atau oven untuk disterilkan selama ± 1 jam.
Alat bantu aseptik lain seperti scalpel dan pinset dapat disterilkan
dengan pencelupan ke dalam alkohol 96% kemudian dibakar di atas lampu
bunsen ketika ingin digunakan.
3.4.2. Pembuatan Media
Media tanam kelapa kopyor yang digunakan adalah media Y3
(Eeuwens), media MS (Murashige dan Skoog), modifikasi media Y3
(Eeuwens) serta modifikasi media sederhana dalam bentuk padat dan cair.
Setiap media mengandung sukrosa 30 g/l, arang aktif 2.5 g/l dan agar 7 g/l.
Khusus pada media cair tidak menggunakan agar sebagai pemadat.
Cara pembuatan 1 Liter Media 1 (M1) yaitu, mengambil unsur makro
100 ml, unsur mikro, besi dan vitamin 10 ml dari larutan stok Y3,
menambahkan sukrosa 30 g, arang aktif 2,5 g dan agar 7 g. Pembuatan 1
Liter Media 2 (M2) yaitu, mengambil unsur makro 100 ml, unsur mikro, besi
dan vitamin 10 ml dari larutan stok Y3,mengambil 2 ml growmore sitokinin dan
auksin dari masing-masing larutan stok, menambahkan air kelapa 150 ml,
sukrosa 30 g, arang aktif 2,5 g dan agar 7 g. Pembuatan 1 Liter Media 3 (M3)
yaitu, menambahkan air kelapa 150 ml, pupuk daun Gandasil-D 2 g, sukrosa
30 g, arang aktif 2,5 g dan agar 7 g. Pembuatan 1 Liter Media 4 (M4) yaitu,
menambahkan air kelapa 150 ml, sukrosa 30 g dan arang aktif 2,5 g.
Pembuatan 1 Liter Media 5 (M5) yaitu, menambahkan air kelapa 150 ml,
santan 100 ml, sukrosa 30 g, arang aktif 2,5 g dan agar 7 g. Pembuatan 1
Liter Media 6 (M6) yaitu, mengambil unsur makro 100 ml, unsur mikro, besi
dan vitamin 10 ml dari larutan stok MS, menambahkan sukrosa 30 g, arang
aktif 2,5 g dan agar 7 g.
Masing-masing perlakuan media dilakukan hal yang sama yaitu,
seluruh bahan dicampur menjadi satu dalam gelas ukur kemudian
ditambahkan aquadest steril hingga mendekati volume 1000 ml. Larutan
diletakkan di atas Magnetic stirrer serta mengatur derajat kemasaman media
dengan kertas lakmus dengan tingkat kemasaman berkisar antara 5,5-5,8.
Jika pH media terlalu tinggi atau rendah, maka dapat menambahkan larutan
Media tersebut diatur volumenya hingga 1000 ml kemudian dimasak sambil
diaduk hingga mendidih. Media tersebut dituangkan ke dalam tabung/botol
kultur. Untuk tabung kultur dituang sebanyak 10 ml dan untuk botol kultur 80
ml. Setelah itu, tabung/botol kultur segera ditutup dengan aluminiumfoil dan
dilapisi plastik, kemudian dirapatkan dengan karet.
3.4.3. Sterilisasi Media
Sterilisasi media dilakukan dengan menggunakan autoklaf selama
± 1 jam hingga suhu mencapai 121ºC atau tekanan 1,5 atm. Media yang telah
disterilkan, diaduk terlebih dahulu agar arang aktif merata sebelum media
memadat.
.
3.4.4. Sterilisasi, Isolasi dan Penanaman Embrio
Embrio kelapa kopyor yang digunakan berasal dari buah kelapa kopyor
yang berumur 11-12 bulan. Buah kelapa kopyor tersebut diperoleh dari kebun
petani di daerah Pati, Jawa Tengah. Pengambilan embrio dapat dilakukan
dengan menghilangkan sabut buahnya terlebih dahulu kemudian membelah
buah secara melintang. Silinder endosperma yang didalamnya terdapat
embrio diambil dengan sendok dengan diameter 1-2 cm, kemudian diletakkan
ke dalam erlenmeyer yang berisi aquadest. Setelah itu, segera dibawa ke
Laboratorium untuk disterilkan.
Silinder endosperma dicuci dengan air mengalir hingga bersih,
kemudian direndam dengan larutan klorox 20% selama 20 menit dan dibilas
dengan aquadest steril sebanyak 3-5 kali.
Sebelum melakukan kegiatan isolasi dan penanaman embrio, lampu
UV Laminar Air Flow (LAF) dinyalakan terlebih dahulu selama 30 menit dan
kemudian menyiapkan semua alat yang akan dipergunakan. Setelah itu, di
dalam LAF, embrio dipisahkan dari silinder endospermnya. Embrio kemudian
disterilkan dengan alkohol 70% dengan merendamnya selama 5 menit.
Setelah itu, embrio dibilas dengan aquadest steril sebanyak 3 kali kemudian
disterilkan dengan larutan klorox 10% dengan merendamnya selama 5 menit
dan membilasnya dengan aquadest steril sebanyak 3 kali. Kemudian,
disterilkan kembali dengan larutan klorox 5% dengan merendamnya selama 5
menit dan membilasnya dengan aquadest steril sebanyak 3 kali. Sebelum
melakukan penanaman, embrio direndam terlebih dahulu dalam aquadest
steril yang ditetesi dengan betadine 5-8 tetes.
Penanaman embrio secara keseluruhan dilakukan di dalam Laminar
Air Flow (LAF). Embrio yang sudah steril segera ditanam pada keenam media.
Masing-masing tabung/botol kultur ditanami 1 (satu) embrio. Tabung/botol
kultur segera ditutup dengan aluminium foil atau plastik penutup dan diikat
dengan karet. Setelah itu, diletakkan pada ruang tumbuh yang gelap dengan
suhu ± 20ºC selama 6-8 minggu.
3.4.5. Subkultur
Subkultur merupakan pemindahan kultur dari media yang lama ke
media yang baru dengan tujuan untuk menjaga ketersediaan nutrisi bagi
pertumbuhan embrio. Subkultur dilakukan setiap 6-8 minggu sejak embrio
diinokulasikan. Subkultur dilakukan di dalam Laminar Air Flow (LAF) dalam
kondisi steril. Setelah melakukan subkultur yang pertama, embrio
ditumbuhkan di dalam ruang yang terang dengan suhu ± 20ºC.
3.5. Variabel Pengamatan
Pengamatan terhadap variable penelitian dilakukan secara deskriptif dan
kuantitatif, sebagai berikut :
3.5.1. Pengamatan Secara Deskriptif
Pengamatan secara deskriptif dilakukan dengan menjelaskan
visual dengan cara menggambarkan atau mengilustrasikan keadaan embrio
atau planlet dengan bentuk penjelasan tertulis yang didukung dengan
gambar/foto dari obyek yang diamati.
3.5.2. Pengamatan Secara Kuantitatif
3.5.2.a. Tahap Perkecambahan
Selama tahap perkecambahan, pengamatan dilakukan dengan
interval waktu 14 hari sekali dengan variabel yang diamati pada tahap
perkecambahan terdiri dari :
1). Panjang Embrio
Pengukuran panjang embrio dilakukan dengan menggunakan
penggaris. Panjang embrio mulai dari bagian ujung titik tumbuh tunas.
2). Persentase Perkecambahan
Persentase perkecambahan diperoleh dengan cara menjumlah
semua embrio yang berkecambah pada akhir tahap perkecambahan
dengan menggunakan rumus sebagai berikut :
3). Persentase Embrio Stagnan
Embrio stagnan pada tahap perkecambahan ditandai dengan
tidak adanya kemajuan pertumbuhan embrio. Embrio tetap segar tetapi
tidak mati, namun juga tidak tumbuh ataupun berkecambah. Persentase
stagnan dihitung pada akhir tahap perkecambahan dengan
menggunakan rumus sebagai berikut :
(Fitriswari, 2011).
Jumlah embrio yang berkecambah
Persentase perkecambahan = x 100%
Jumlah embrio yang ditanam
Jumlah embrio yang stagnan
Persentase embrio stagnan = x 100%
Jumlah embrio yang ditanam
3.5.2.b. Tahap Pertumbuhan Planlet
Selama tahap pertumbuhan planlet, pengamatan dilakukan dengan
interval waktu 14 hari sekali dengan variabel yang diamati terdiri dari :
1). Pertumbuhan Tunas (cm)
Pengukuran tinggi tunas dilakukan dari pangkal batang sampai
ujung terpanjang dengan menggunakan penggaris.
2). Pertumbuhan Akar (cm)
Pengukuran panjang akar primer dilakukan setelah muncul akar
primer dan diukur pada saat subkultur.
3). Persentase Planlet Keluar Tunas
Perhitungan persentase planlet yang terbentuk tunas dilakukan
setelah embrio terbentuk tonjolan yang merupakan bakal tunas.
Persentase planlet keluar tunas dihitung pada akhir tahap pertumbuhan
planlet dengan menggunakan rumus sebagai berikut :
4). Persentase Planlet Keluar Akar
Perhitungan persentase planlet yang terbentuk akar dilakukan
setelah embrio terbentuk tonjolan yang merupakan bakal akar.
Persentase planlet keluar akar akan dihitung pada akhir tahap
pertumbuhan planlet dengan menggunakan rumus sebagai berikut :
5). Persentase Planlet dengan Tunas dan Akar
Perhitungan persentase planlet yang terbentuk tunas dan akar
dilakukan setelah embrio terbentuk tonjolan yang merupakan bakal
tunas dan bakal akar. Persentase planlet dengan tunas dan akar
Jumlah planlet keluar tunas
Persentase planlet keluar tunas = x 100%
Jumlah planlet yang ditanam
Jumlah planlet keluar akar
Persentase planlet keluar akar = x 100%
dihitung pada akhir tahap pertumbuhan planlet dengan menggunakan
rumus sebagai berikut :
6). Persentase Planlet Browning
Planlet browning pada tahap pertumbuhan planlet ditandai dengan
terjadinya pencoklatan pada planlet yang menyebabkan planlet tidak
berkecambah. Persentase browning dihitung pada akhir tahap
perkecambahan dengan menggunakan rumus sebagai berikut :
7
)
7). Persentase Planlet Stagnan
Planlet stagnan pada tahap pertumbuhan planlet ditandai dengan
tidak adanya kemajuan pertumbuhan planlet. Planlet tetap segar tetapi
tidak mati, namun juga tidak tumbuh ataupun berkecambah. Persentase
stagnan dihitung pada akhir tahap perkecambahan dengan
menggunakan rumus sebagai berikut :
8). Persentase Planlet Mati
Planlet yang mati pada tahap pertumbuhan planlet ditandai
dengan tidak menunjukkan adanya pertumbuhan atau planlet yang mati
disebabkan kontaminasi oleh jamur dan bakteri. Persentase eksplan
mati dihitung pada akhir tahap pertumbuhan planlet dengan
menggunakan rumus sebagai berikut :
Jumlah planlet dengan tunas dan akar
Persentase planlet dengan = x 100%
tunas dan akar Jumlah planlet yang ditanam
Jumlah planlet browning
Persentase planlet browning = x 100%
Jumlah planlet yang ditanam
Jumlah planlet yang stagnan
Persentase planlet stagnan = x 100%
Jumlah planlet yang ditanam
(Fitriswari, 2011).
3.6. Analisis Data
Data yang diperoleh dianalisis dengan menggunakan analisis sidik ragam
RAL. Apabila FHitung ≥ FTabel maka dilanjutkan uji perbandingan rata-rata hasil
dengan Uji Jarak Duncan 5% (UJD 5%).
Jumlah planlet mati
Persentase planlet mati = x 100%
IV. HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Kultur embrio kelapa kopyor (Cocos nucifera L.) dilakukan melalui
beberapa tahapan media, yaitu tahap perkecambahan embrio dan tahap
pertumbuhan planlet. Untuk melakukan tahap tersebut, kultur embrio kelapa
kopyor dilakukan selama 6 (enam) bulan.
4.1.1. Pertumbuhan Embrio Pada Tahap Perkecambahan
Memasuki proses awal pertumbuhan (tahap perkecambahan),
sebanyak 42 embrio kelapa kopyor yang berasal dari daerah Pati, Jawa
Tengah yang kemudian ditanam pada berbagai komposisi media sudah
terlihat membesar dan memanjang setelah 3-7 Kari Setelah Inokulasi (HSI).
Beberapa embrio terlihat sedikit berubah warna dari putih menjadi sedikit
kecoklatan. Hanya embrio yang ditanam pada media cair saja yang
seluruhnya tetap berwarna putih dan pertumbuhan embrionya masih belum
terlihat. Embrio yang ditanam pada media cair sebagian tenggelam dan
sebagian mengambang di permukaan.
Setiap minggunya terjadi penambahan ukuran dan panjang embrio
hingga saatnya embrio berkecambah. Tanda embrio berkecambah adalah
munculnya bakal tunas atau bakal akar. Penambahan panjang, banyak dan
lamanya embrio yang berkecambah ini berbeda disetiap perlakuan. Embrio
yang ditanam pada media cair lebih lama berkecambah daripada embrio yang
ditanam pada media padat. Pada beberapa media padat yang berumur 14
Hari Setelah Inokulasi beberapa embrio telah berkecambah, sedangkan
embrio yang ditanam pada media cair, membutuhkan waktu sekitar 2 (dua)
bulan untuk berkecambah. Selama tahap perkecambahan, kultur diletakkan
pada ruang gelap selama 8 (delapan) minggu. Ruang gelap pada awal masa
inkubasi berfungsi menghambat browning pada embrio. Hingga tahap
perkecambahan berakhir, hanya ada 1 (satu) embrio yang berasal dari media
padat Gandasil D 2 g/l + Air Kelapa 150 ml/l yang mengalami browning
(pencoklatan).
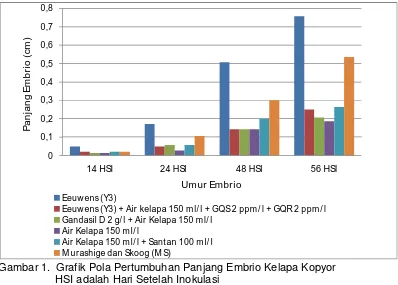
Keberhasilan fase perkecambahan dapat dilihat pada rata-rata panjang
embrio dalam berbagai perlakuan media pada umur 14 HSI, 28 HSI, 42 HSI
dan 56 HSI secara detail dilihat pada Tabel 1 di bawah ini.
Tabel 1. Rata-rata Panjang Embrio pada Berbagai Media Umur 14, 28, 42 dan 56 Hari Setelah Inokulasi (HSI) Transformasi Log (X+1)
Perlakuan
(Media 5). Air Kelapa 150 ml/l + Santan
100 ml/l 0.009 0.024 a 0.076 a 0.098 ab
(Media 6). MS 0.009 0.041 a 0.107 a 0.176 bc
* Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata menurut Duncan 5%
Hasil analisis statistik di atas menunjukkan bahwa terdapat perbedaan
yang nyata terhadap rata-rata panjang embrio dalam berbagai media
perlakuan selama tahap perkecambahan. Laju pertumbuhan terus meningkat
seiring dengan bertambahnya waktu, hal tersebut tergantung pada media
yang digunakan. Dari ke enam media yang diuji hanya ada 2 (dua) media
yang paling efektif pada fase perkecambahan yaitu Media Eeuwens (Y3) dan
Murashige dan Skoog (MS). Embrio yang dikulturkan pada media tersebut
menghasilkan rata-rata panjang embrio cenderung lebih panjang dibanding
dengan perlakuan lainnya dari umur 14 HSI sampai dengan 56 HSI. Namun,
di antara keduanya, yang menunjukkan pertumbuhan embrio yang paling
Gambar 1. Grafik Pola Pertumbuhan Panjang Embrio Kelapa Kopyor HSI adalah Hari Setelah Inokulasi
Setelah embrio mengalami pertumbuhan dengan bertambahnya
panjang dengan ukuran tertentu, pada akhirnya embrio berkecambah.
Masing-masing embrio dalam perlakuan berbagai media menunjukkan
tanggapan perkecambahan yang berbeda-beda. Hal ini dapat dilihat pada
persentase perkecambahan munculnya bakal tunas, akar dan tunas + akar
yang telah dicapai (Tabel 2).
Tabel 2. Rata-rata Presentasi Embrio Kelapa Kopyor yang Berkecambah Menjadi Bakal Tunas, Akar dan Tunas + Akar (Planlet Sempurna)
Tabel 2 di atas merupakan hasil rata-rata persentase embrio yang
berhasil berkecambah pada berbagai perlakuan media. Perlakuan dengan
penggunaan bahan kimia murni yaitu media Eeuwens (Y3) dan Murashige dan
Skoog (MS) memberikan rata-rata tertinggi yaitu 100 % dan 99.99 %.
Sedangkan perlakuan media modifikasi yang memberikan rata-rata tertinggi
adalah media Y3 + Air Kelapa 150 ml/l + GQS 2 ppm/l + GQR 2 ppm/l dan
media Air Kelapa 150 ml/l + Santan 100 ml/l yaitu 85.71 %. Sementara itu,
Perlakuan Gandasil D 2 g/l + Air Kelapa 150 ml/l dan Air Kelapa 150 ml/l
persentase perkecambahan rata-rata 71.43 % dan 42.86 %.
Pada tahap perkecambahan, embrio kelapa kopyor yang berkecambah
dengan sempurna (membentuk tunas dan akar) hanya terdapat pada media
Eeuwens (Y3) sebanyak 6 (enam) planlet dan media Murashige dan Skoog
(MS) sebanyak 1 (satu) planlet. Tidak semua embrio yang ditanam pada
berbagai media dapat tumbuh sempurna, sebagian embrio hanya tumbuh
membentuk tunas saja.
4.1.2. Pertumbuhan Embrio pada Tahap Pertumbuhan Planlet
Setelah melawati masa perkecambahan, embrio kemudian
dipindahkan ke media baru (subkultur) dengan komposisi media perlakuan
yang sama dengan media perlakuan sebelumnya. Lamanya periode untuk
subkultur adalah 2 (dua) bulan sekali. Pada tahap pembentukan planlet,
embrio mengalami pertumbuhan dimana tonjolan yang terbentuk pada tahap
perkecambahan akan berkembang dan tumbuh membentuk tunas dan akar.
Setelah tahap subkultur I, pertumbuhan embrio pada berbagai media
yang diuji menunjukkan respon yang berbeda. Embrio yang telah melalui
masa perkecambahan dipindahkan dalam media baru yang nantinya akan
berkembang membentuk tunas dan akar (planlet sempurna). Namun, pada
keadaan yang sebenarnya terbentuknya planlet pada beberapa media buatan
masih berjalan lambat, karena sebagian besar embrio tidak berhasil
menghasilkan planlet yang sempurna. Hampir keseluruhan perlakuan, embrio
hanya menunjukkan pertumbuhan tunas sedangkan pertumbuhan akar hanya
terlihat pada beberapa perlakuan media, namun akar tersebut hanya terlihat
beberapa mm dan tidak terus berkembang. Planlet yang bertahan hidup
hingga tahap ini umumnya adalah planlet tunas yaitu planlet yang hanya
dilengkapi dengan tunas daun tanpa adanya akar. Selain itu, hampir
sepenuhnya tahap pertumbuhan planlet terjadi secara normal yaitu tidak
mengalami stagnasi dan browning. Planlet yang mengalami keabnormalan
seperti stagnasi tidak terjadi pada seluruh media, namun keabnormalan
seperti browning terjadi pada beberapa planlet yang ditumbuhkan di dalam
media Gandasil D 2 g/l + air kelapa 150 ml/l (Gambar 3).
Gambar 3. Embrio pada Media Gandasil D 2 g/l + Air Kelapa 150 ml/l yang Mengalami Browning Setelah Subkultur I
Pada tahap subkultur II, merupakan tahap perkembangan membentuk
suatu organ tanaman. Pada tahap ini planlet yang dipindah dalam media baru
kan berkembang dari tunas memanjang menjadi daun dan akar semakin
memanjang. Namun, akar yang terlihat beberapa mm saja sampai tahap ini
tidak menunjukkan perubahan (Gambar 4). Hal tersebut terjadi pada seluruh
media padat yang planletnya tumbuh bakal akar.
TUNAS TUNAS
AKAR AKAR
(a) (b)
Gambar 4. Pertumbuhan Akar Planlet Kelapa Kopyor dalam Media Perlakuan Eeuwens (Y3) ; (a.) Akar Planlet Setelah Subkultur I, (b.) Akar Planlet Setelah Subkultur II.
Planlet sempurna tidak terlihat pada seluruh perlakuan. Planlet
sempurna yaitu planlet dengan daun dan akar proporsional. Planlet dalam
Selain kondisi planlet yang tidak sempurna, ada kendala lain yang dapat
terjadi yaitu kontaminasi yang ditandai dengan adanya bakteri dan jamur yang
tumbuh pada media tumbuh ataupun planlet. Ciri media atau planlet yang
terserang bakteri terdapat cairan atau lendir yang berwarna putih seperti susu
sedangkan jamur terdapat benang spora. Pada tahap perkecambahan hingga
penumbuhan planlet tingkat kontaminasi 0%, karena seluruh embrio atau
planlet selamat (tidak terkontaminasi).
Planlet kelapa kopyor yang ditumbuhkan pada modifikasi media Air
Kelapa 150 ml/l + Santan 100 ml/l memiliki bentuk yang berbeda dengan
perlakuan media yang lain. Planlet cenderung berwarna coklat namun planlet
tersebut tidak browning. Selain itu, kulit planlet terlihat sedikit keras seperti
kayu (Gambar 5).
Gambar 5. Planlet Perlakuan media Air Kelapa 150 ml/l + santan 100 ml/l Setelah Subkultur II
Pada perlakuan media Gandasil D 2 g/l + Air Kelapa 150 ml/l tingkat
browning semakin tinggi pada subkultur II. Hal tersebut ditunjukkan dengan
adanya pertambahan planlet yang mencoklat pada tiap minggunya.
Keberhasilan pembentukan tunas kelapa kopyor dapat diketahui
dengan mengukur panjang planlet, jumlah daun dan lebar daun. Namun,
sampai pada tahap ini, tunas mengalami pertumbuhan yang lambat, sehingga
pengukuran jumlah daun dan lebar daun tidak dapat disajikan.
Pada hasil analisis ragam pada parameter panjang tunas yang
berumur 10 sampai 24 MSI (Minggu Setelah Inokulasi) menunjukkan adanya
perbedaan nyata. Perbedaan tersebut dapat dibuktikan baik dengan
pengamatan atau dalam perhitungan statistika. Tidak ada perlakuan
modifikasi media yang hasilnya lebih baik ataupun setara dari perlakuan
kontrol. Media yang hampir setara dengan perlakuan kontrol hanya media
Murashige dan Skoog (MS) (Tabel 3 dan Tabel 4). Pengaruh media terhadap
rata-rata panjang tunas dengan interval pengamatan dilakukan setiap 2 (dua)
minggu sekali.
Tabel 3. Rata-rata Panjang Tunas pada Berbagai Media Perlakuan Umur 10 sampai 16 Minggu Setelah Inokulasi (MSI) Transformasi + 0,5
Perlakuan
(Media 5). Air Kelapa 150 ml/l + Santan
100 ml/l 0.89 0.82 a 0.93 a 0.95 a
(Media 6). Murashige dan Skoog (MS) 1.10 1.31 bc 1.44 bc 1.56 bc
* Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata menurut Duncan 5%
Tabel 4. Rata-rata Panjang Tunas pada Berbagai Media Perlakuan Umur 18 sampai 24 Minggu Setelah Inokulasi (MSI) Transformasi + 0,5
Perlakuan
Gambar 6 menunjukkan bahwa perlakuan kontrol berpengaruh nyata
terhadap pertumbuhan panjang tunas. Hingga akhir pengamatan, perlakuan
kontrol menunjukkan panjang tunas terpanjang yaitu 6.056 cm atau 2.54 cm
setelah transformasi dan tunas terpanjang selanjutnya adalah perlakuan
media MS yaitu 5.7 cm atau 2.45 cm setelah transformasi. Sedangkan media
yang menghasilkan panjang tunas terendah adalah perlakuan media air
kelapa 150 ml/l (media cair) yaitu hanya 0.85 cm.
Gambar 6. Grafik Pola Pertumbuhan Embrio Kelapa Kopyor Terhadap Berbagai Modifikasi Media. MSI adalah Minggu Setelah Inokulasi
Gambar 7. Pertumbuhan Planlet pada Berbagai Perlakuan Modifikasi Media Setelah Subkultur II.
Gambar 7 memperlihatkan pertumbuhan planlet kelapa kopyor pada
perlakuan kontrol dan MS membentuk tunas paling baik. Sedangkan pada
media modifikasi yang pertumbuhan tunasnya paling baik adalah media Y3 +
Air Kelapa 150 ml/l + GQS 2 ppm/l + GQR 2 ppm/l dan pertumbuhan tunas
yang paling lambat adalah media perlakuan Air Kelapa 150 ml/l. Tunas mulai
berklorofil terkecuali media Air Kelapa 150 ml/l, sedangkan akar tidak
berklorofil karena akar masih berupa tonjolan. Pada media Air Kelapa 150 ml/l
(media cair) akar tidak tumbuh.
4.1.3. Pertumbuhan Embrio dan Planlet Browning, Stagnan dan Mati
Tingkat keberhasilan suatu kultur jaringan tidak hanya dilihat dari
tingkat keberhasilan embrio tumbuh sampai menjadi planlet, namun tingkat
keberhasilan juga dilihat dari tidak adanya faktor seperti browning, stagnasi
atau kontaminasi hingga terjadi kematian (Tabel 5).
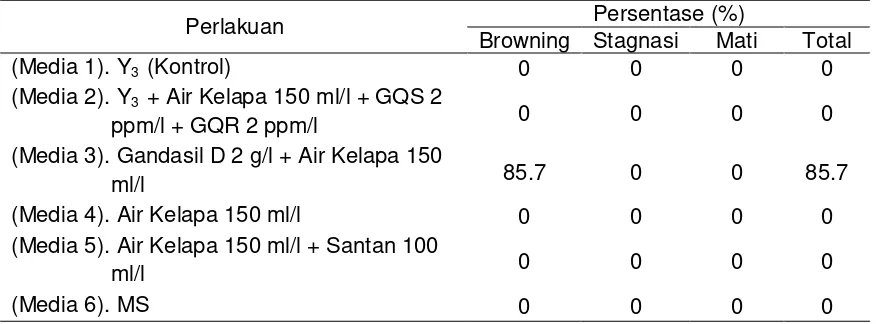
Tabel 5. Persentase Planlet Kelapa Kopyor yang Mengalami Browning, Stagnan dan Mati pada Fase Pertumbuhan Planlet Berbagai Media Modifikasi
Perlakuan Persentase (%)
Browning Stagnasi Mati Total
(Media 1). Y3 (Kontrol) 0 0 0 0
(Media 2). Y3 + Air Kelapa 150 ml/l + GQS 2
ppm/l + GQR 2 ppm/l 0 0 0 0
(Media 3). Gandasil D 2 g/l + Air Kelapa 150
ml/l 85.7 0 0 85.7
(Media 4). Air Kelapa 150 ml/l 0 0 0 0
(Media 5). Air Kelapa 150 ml/l + Santan 100
ml/l 0 0 0 0
(Media 6). MS 0 0 0 0
Tabel 5 menunjukkan bahwa pada media Gandasil D 2 g/l + Air Kelapa
150 ml/l, planlet mengalami browning dengan tingkat paling tinggi yaitu hingga
85.7 %. Sementara itu, pada perlakuan media lainnya tidak terdapat planlet
Gambar 8. Kondisi Planlet yang Mengalami Browning pada Media Modifikasi Gandasil D 2 g/l + Air Kelapa 150 ml/l
4.2. Pembahasan
Keberhasilan dari kultur embrio sangat dipengaruhi oleh media untuk
embrio bertumbuh dan berkembang. Pengujian berbagai media modifikasi pada
tahap perkecambahan menunjukkan hasil yang bervariasi. Tahap
perkecambahan merupakan tahap embrio untuk memulai pertumbuhannya yang
ditandai dengan penambahan ukuran panjang hingga tumbuh tunas, akar
ataupun keduanya.
Hasil penelitian dengan penggunaan berbagai modifikasi media dalam
tahap perkecambahan, terdapat 2 (dua) media yang paling baik, yaitu media Y3
dan MS dimana media tersebut merupakan media yang berasal dari unsur kimia
murni dengan kandungan nutrisi yang lengkap (Tabel 1). Jika dibandingkan
dengan media Y3 yang dimodifikasi yaitu Y3 + Air Kelapa 150 ml/l + GQS 2 ppm/l
+ GQR 2 ppm/l menunjukkan perbedaan yang sangat nyata. Pertumbuhan
embrio yang ditumbuhkan pada media tersebut mampu berkecambah, namun
tidak lebih baik dari Y3 murni. Kandungan air kelapa, kandungan IBA dan NAA
pada GQR dan kandungan BAP pada GQS tidak berpengaruh nyata pada
pertumbuhan embrio. Hal tersebut diduga terjadinya penambahan unsur yang
terlalu berlebih, yang menyebabkan embrio mengalami pertumbuhan yang
lambat. Selain itu, pertumbuhan embrio tersebut tidak menunjukkan adanya