TUMBUH DAN BAHAN ADITIF AIR KELAPA
SKRIPSI
Oleh :
RATRIANA RINDA FITRISWARI NPM : 0625010008
PROGRAM STUDI AGROTEKNOLOGI F AK UL T AS P E R T A NI AN
UNI V E R S I T AS P E M B ANG UNAN NAS I O NAL “ VE T E R A N” J AW A T I M UR
hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul
“PERTUMBUHAN BELAHAN EKSPLAN EMBRIO ZIGOTIK KELAPA
KOPYOR (Cocos nucifera L.) PADA MEDIA KULTUR DENGAN
PENAMBAHAN ZAT PENGATUR TUMBUH DAN BAHAN ADITIF AIR
KELAPA” telah selesai disusun.
Pada dasarnya tujuan dari penyusunan skripsi ini adalah untuk
meningkatkan planlet kelapa kopyor yang berasal dari belahan eksplan embrio
zigotik dengan menambahkan berbagai zat pengatur tumbuh dan bahan aditif air
kelapa yang potensial. Skripsi ini merupakan salah satu syarat untuk memperoleh
gelar Sarjana Pertanian Program Studi Agroteknologi di Fakultas Pertanian
Universitas Pembangunan Nasional “Veteran” Jawa Timur.
Penulis pada kesempatan ini, ingin menyampaikan ucapan terima kasih
yang sebesar-besarnya kepada Dr. Ir. Sukendah, Msc. selaku Dosen Pembimbing
Utama dan Ir. Yonny Koentjoro, MM. selaku Dosen Pembimbing Pendamping
yang telah memberikan saran dan petunjuk serta kesabaran beliau selama
penulisan skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada :
1. Dr. Ir. Ramdan Hidayat, MS. selaku Dekan Fakultas Pertanian UPN
“Veteran” Jawa Timur Surabaya.
2. Ir. Mulyadi, MS. selaku Ketua Program Studi Agroteknologi Fakultas
skripsi ini.
4. Ayahanda dan Ibunda tercinta terima kasih atas dukungan moral dan
material.
5. Teman-teman Agroteknologi angkatan 2006, Sahabat (Inggar, Hedi, dan
Agung) dan khususnya kepada Yunesar terima kasih atas dukungan moral,
nasehat serta kesabaran kalian selalu mengingatkan penulis untuk
menyelesaikan skripsi ini.
Dalam penyusunan skripsi ini, penulis menyadari masih ada kekurangan
dan kelemahan dalam hal penulisan, sehingga penulis mengharapkan saran dan
kritik yang dapat membangun. Penulis berharap skripsi ini dapat bermanfaat bagi
penulis khususnya serta bagi para pembaca.
Surabaya, Desember 2011
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
I... PEND AHULUAN A. ... Latar Belakang ... 1
B. ... Tujuan ... 5
C. ... Rumus an Masalah ... 5
II. ... TINJ A UAN PUSTAKA A. ... Kelapa Kopyor ... 6
B. ... Kultur Embrio ... 8
n Zat Pengatur Tumbuh Auksin dan Sitokinin dalam Kultur
Embrio Kelapa Kopyor ... 10
1.... Auksin ... 11
2.... Sitokin in ... 14
D. ... Perana n Air Kelapa sebagai Bahan Aditif ... 16
E.... Hipote sa ... 20
III. ... BAHA N DAN METODE
A. ... Tempat dan Waktu Penelitian ... 21
B. ... Bahan
dan Alat ... 21
1.... Bahan dan Media ... 21
naan Penelitian ... 24
1.... Sterilis asi Alat ... 24
2.... Pembu atan Media ... 24
3.... Sterilis asi Media ... 25
4.... Sterilis asi Embrio ... 25
5.... Penana man Embrio ... 26
6.... Penum buhan Embrio Kelapa Kopyor ... 26
E... Variab
el Pengamatan ... 27
1.... Penga matan secara Deskriptif... 28
2.... Penga matan secara Kuantitatif ... 28
Penelitian ... 35
1.... Pertum buhan Embrio pada Tahap Perkecambahan ... 35
a.... Percob aan I. Peranan BAP + IAA dan Air Kelapa
pada Pertumbuhan Embrio Kelapa Kopyor
Fase Perkecambahan ... 36
b. ... Percob
aan II. Peranan BAP + 2,4-D dan Air Kelapa pada Pertumbuhan Embrio Kelapa Kopyor
Fase Perkecambahan ... 39
2.... Pertum buhan Embrio pada Tahap Pertumbuhan Planlet ... 42
a... Percob
aan I. Peranan BAP + IAA dan Air Kelapa
pada Pertumbuhan Embrio Kelapa Kopyor Fase
Pertumbuhan Planlet ... 43
b. ... Percob aan II. Peranan BAP + 2,4-D dan Air Kelapa
pada Pertumbuhan Embrio Kelapa Kopyor Fase
Pertumbuhan Planlet ... 46
3.... Pertum buhan Planlet yang Browning dan Abnormal ... 48
buhan Embrio pada Tahap Pertumbuhan Planlet ... 51
a.... Percob aan I. Peranan BAP + IAA dan Air Kelapa
pada Pertumbuhan Embrio Kelapa Kopyor Fase
Pertumbuhan Planlet ... 52
b. ... Percob aan II. Peranan BAP + 2,4-D dan Air Kelapa
pada Pertumbuhan Embrio Kelapa Kopyor Fase
Pertumbuhan Planlet ... 53
3.... Pertum buhan Planlet yang Browning dan Abnormal ... 54
4.... Rangk uman Pembahasan Pertumbuhan Embrio Kelapa
Kopyor mulai Tahap Perkecambahan sampai Tahap
Pertumbuhan ... 55
V. ... KESI MPULAN DAN SARAN
A. ... Kesim pulan ... 59
B. ... Saran ... 60
DAFTAR PUSTAKA ... 61
Nomor Halaman
Judul
1. ... Komposisi Air Buah Kelapa dari Jenis Kelapa Dalam
(West Coast Tall) ... 17
2. ... Analisis Ragam Percobaan yang terdiri dari Satu Faktorial
dengan Rancangan Acak Lengkap (Sastrosupadi, 2000) ... 33
3. ... Rata-rata Panjang Embrio pada Berbagai Media Perlakuan (Percobaan I)
Umur 14 HSI, 28 HSI dan 42 HSI pada Tahap Perkecambahan ... 37
4. Rata-rata persentase Embrio Kelapa Kopyor yang Berkecambah
Menjadi Bakal Tunas dan Akar (Planlet Lengkap) dan Bakal Tunas pada Media yang Mengandung Berbagai Perlakuan
(Percobaan I) ... 38
5. ... Rata-rata Panjang Embrio pada Berbagai Media Perlakuan (Percobaan II)
Umur 14 HSI, 28 HSI dan 42 HSI pada Tahap Perkecambahan .... 40
6. ... Perse ntase Embrio Kelapa Kopyor yang Berkecambah Menjadi Bakal
Tunas dan Akar (Planlet Lengkap) dan Bakal Tunas pada Media yang Mengandung Berbagai Perlakuan (Percobaan II) ... 41
7. ... Rata-Rata Panjang Planlet pada Berbagai Media Perlakuan
(Percobaan I) pada Umur 13 MSI sampai 21 MSI... 43
8. ... Rata-rata Panjang Tunas pada Berbagai Media Perlakuan
(Percobaan I) pada Umur 23 MSI samapai 31 MSI ... 44
Stagnasi, dan Planlet Mati Fase Pertumbuhan Planlet di Berbagai Media Perlakuan (Percobaan II) ... 48
DAFTAR GAMBAR
Nomor Halaman
Judul
1. ... Berb agai Respon Embrio Kelapa Kopyor pada Media Kultur
Tahap Perkecambahan ... 36
2. ... Grafi
k Pola Pertumbuhan Panjang Embrio Kelapa Kopyor pada Umur
14 HSI samapai 42 HSI (Percobaan I) ... 37
3. ... Resp on Pertumbuhan Embrio Kelapa Kopyor pada Media Perlakuan
(Percobaaan I) Fase Perkecambahan ... 40
4. ... Grafi
k Pola Pertumbuhan Panjang Embrio Kelapa Kopyor pada Umur
14 HSI sampai 42 HSI (Percobaan II) ... 42
5. ... Resp on Pertumbuhan Embrio Kelapa Kopyor pada Media Perlakuan
(Percobaaan II) ... 44
6. ... Grafi k Pengaruh Peranan BAP + IAA dan Bahan Aditif Air Kelapa
Terhadap Pola Pertumbuhan Panjan Tunas Planlet
s Regenerasi Kelapa Kopyor dari Embrio yang dibelah Sampai
Menjadi Planlet Sempurna ... 47
9. ... Berb agai Kondisi Planlet Browning, Stagnasi dan Mati Embrio
Abstr ak
I. PENDAHULUAN
A. Latar Belakang
Di Indonesia, kelapa kopyor (Cocos nucifera L.) merupakan komoditi
andalan yang bernilai ekonomi tinggi dan dicirikan dengan daging buah yang
bertekstur remah serta rasa yang gurih pada buah yang muda. Kelapa kopyor tidak
dapat diperbanyak secara konvensional melalui biji. Hal ini disebabkan daging
buahnya yang remah dan tidak melekat lagi pada tempatnya sehingga daging buah
yang berfungsi sebagai cadangan makanan tidak dapat digunakan oleh embrio
untuk berkecambah. Buah kopyor ini diduga berasal dari tanaman kelapa yang
mengalami mutasi genetik secara alamiah (Mashud dan Manaroinsong, 2007).
Peluang terjadinya mutasi alamiah secara umum sangat rendah yaitu
sebesar 10-5 sampai 10-6 per generasi. Hal ini berarti bahwa hanya ada 1 (satu) di
antara 100.000 sampai 1.000.000 peluang terjadinya mutasi alamiah di alam
(Maskromo dan Novarianto, 2007). Disamping itu, kelapa kopyor mutasi tersebut
bersifat heterozigot sehingga dalam satu tandan terdapat buah yang kopyor dan
buah yang normal. Presentase kelapa berbuah kopyor yang diperoleh dari pohon
yang bersifat heterozigot sekitar 1-2 % atau 1-2 buah kelapa berbuah kopyor
dalam satu pohon.
Adanya kondisi tersebut menyebabkan pengembangan produksi buah
kopyor sangat lambat dan terbatas. Dibutuhkan suatu upaya untuk meningkatkan
produksi kelapa berbuah kopyor dengan cara meningkatkan persentase kelapa
sehingga satu pohon dapat menghasilkan 100% buah kopyor. Salah satu alternatif
metode untuk meningkatkan persentase buah kopyor perpohon adalah dengan
menyelamatkan embrio kelapa kopyor dan menanamnya dalam media agar secara
aseptik yang disebut teknik kultur embrio (Sukendah, 2009).
Teknik kultur embrio kelapa kopyor telah lama dilakukan oleh para
peneliti, meskipun demikian perbanyakan kelapa berbuah kopyor melalui kultur
embrio masih mengalami kendala dalam produksi planlet sebagai bibit. Efisiensi
teknik kultur embrio perolehan bibit kelapa kopyor masih rendah yaitu kurang
dari 30% (Mashud, 1999). Diperlukan adanya suatu upaya untuk meningkatkan
jumlah planlet melalui perbaikan-perbaikan proses kultur embrio. Sukendah
(2009) telah mengembangkan metode untuk perbaikan kultur embrio dengan
metode pembelahan embrio zigotik pada meristem apikal. Teknik pembelahan ini
didasari bahwa eksplan embrio yang dibelah berpotensi untuk berkembang dan
dapat ditingkatkan menjadi dua kali sehingga diperoleh dua planlet. Meskipun
demikian teknik pembelahan embrio masih mengalami kendala dalam
pertumbuhan. Hal ini disebabkan karena dengan teknik pembelahan, embrio
mengalami pertumbuhan yang abnormal (browning, stagnasi, dan mati).
Dengan adanya permasalahan tersebut diatas, maka perlu dicari alternatif
lain untuk menunjang dan meningkatkan daya bertahan hidup embrio kelapa
kopyor yang abnormal pertumbuhannya akibat pembelahan. Solusi untuk
mengatasi hal tersebut adalah dengan pemberian zat pengatur tumbuh (ZPT) dan
bahan aditif air kelapa dengan konsentrasi yang potensial untuk pertumbuhan
Pertumbuhan dan morfogenesis tanaman dalam kultur in vitro
dikendalikan oleh keseimbangan dan interaksi antara zat pengatur tumbuh yang
diberikan kedalam media (hormon eksogen) dan hormon endogen. Interaksi dan
perimbangan dalam ZPT yang diberikan dalam media dan yang diproduksi oleh
tanaman secara endogen menentukan arah pertumbuhan suatu kultur. Zat
pengatur tumbuh dibagi menjadi beberapa golongan yaitu auksin, sitokinin,
giberelin dan inhibitor.
Zat pengatur tumbuh yang sering digunakan dalam kultur in vitro adalah
dari golongan auksin dan sitokinin serta giberelin. Auksin merupakan salah satu
golongan fitihormon, baik yang alamiah maupun yang sintetik, berperan dalam
menginduksi pemanjangan sel dan pembelahan sel. Golongan persenyawaan ini juga
mempengaruhi dominansi apikal, penghambatan pucuk aksilar dan adventif, serta
inisiasi pengakaran (Wattimena et al., 1992). Sitokinin merupakan turunan adenin,
berperan dalam mendorong pembelahan sel atau jaringan yang dipergunakan sebagai
eksplan dan merangsang perbanyakan pucuk-pucuk tunas.
Keseimbangan konsentrasi auksin dan sitokinin dapat memacu
pertumbuhan tunas dan akar. Induksi tunas dan akar lateral dari belahan eksplan
embrio zigotik kelapa kopyor selain membutuhkan 6-Benzyl-Aminopurine (BAP),
juga membutuhkan 2,4-Dichlorophenoxy Acetic Acid (2,4-D) (Sukendah, 2009).
Mehta (2000) juga melaporkan bahwa pada tanaman bambu, tunas-tunas adventif
diinduksi oleh pemberian BAP yang dikombinasikan dengan Nephtaleine Acetic
Acid (NAA).
Keberhasilan kultur embrio kelapa kopyor juga dipengaruhi oleh faktor lain
protein, karbohidrat dan mineral ke dalam media kultur yaitu media Y3
(Eeuwens). Penggunaan bahan aditif diharapkan dapat melengkapi dan
meningkatkan ketersediaan nutrisi yang terkandung dan memperbaiki
pertumbuhan embrio kelapa kopyor selama dalam masa kultur.
Air kelapa merupakan salah satu bahan aditif yang umumnya digunakan
dalam kegiatan kultur jaringan. Pemberian air kelapa dimaksudkan untuk
mendorong induksi tunas adventif, karena penambahan air kelapa dapat
meningkatkan pembelahan sel (Steward, 1958; Priyono dan Danimihardja, 1991)
dan mendorong pembentukan organ yang dapat meningkatkan peranan
fitohormon dalam proses embriogenesis somatik maupun organogenesis.
Berdasarkan hasil penelitian Rachmat (2002) bahan aditif yang cocok untuk
ditambahkan ke dalam media kultur adalah air kelapa. Sukendah (2009)
melaporkan embrio kelapa kopyor yang dikulturkan pada media dengan air kelapa
150 ml/l lebih cepat berkecambah, yaitu kurang dari satu bulan (29 hari) dan nyata
berbeda dengan media tanpa bahan aditif. Penggunaan jenis air kelapa pada media
kultur berpengaruh terhadap pertumbuhan embrio kelapa kopyor. Penggunaan
jenis air kelapa normal memiliki vigor tanaman yang lebih baik dibandingkan
dengan air kelapa kopyor. Planlet yang dihasilkan lebih panjang, memiliki daun
yang lebih banyak dan lebar serta daun nampak lebih hijau sehingga kondisi
tersebut memungkinkan untuk diaklimatisasi daripada planlet yang dihasilkan
dengan penggunaan air kelapa kopyor (Kumalasari, 2004).
Oleh sebab itu, penelitian ini difokuskan pada embrio kelapa kopyor sebagai
embrio zigotik sehingga dapat diperoleh jumlah bibit kelapa kopyor dua kali lebih
banyak dan dengan penambahan berbagai konsentrasi zat pengatur tumbuh dan
bahan aditif air kelapa normal pada media tumbuh dengan maksud untuk
meningkatkan daya bertahan hidup embrio zigotik kelapa kopyor yang dibelah.
B. Tujuan
Tujuan dari penelitian ini adalah untuk meningkatkan pertumbuhan planlet
kelapa kopyor yang berasal dari belahan eksplan embrio zigotik dengan
menambahkan berbagai kombinasi zat pengatur tumbuh dan bahan aditif air
kelapa yang potensial.
C. Rumusan Masalah
Berdasarkan latar belakang tersebut diatas, masalah yang timbul antara lain :
1. Apakah ada perbedaan pengaruh antara zat pengatur tumbuh dan bahan
aditif air kelapa dalam pertumbuhan planlet asal embrio utuh dan embrio
yang dibelah?
2. Bagaimana respon pertumbuhan planlet asal embrio yang dibelah pada
berbagai media yang mengandung zat pengatur tumbuh sitokinin;
kombinasi sitokinin dengan auksin; dan kombinasi sitokinin, auksin, bahan
II. TINJ AUAN PUSTAKA
A. Kelapa Kopyor
Secara morfologi, fenotipe pohon kelapa berbuah kopyor sulit dibedakan
dengan kelapa berbuah normal. Berdasarkan pengamatan morfologi belum
ditemukan ciri-ciri lain yang spesifik, selain karakter endosperm yang berbeda
dengan kelapa berbuah normal. Kelapa kopyor merupakan buah kelapa biasa yang
mengalami ketidaknormalan selama pertumbuhannya. Kelapa berbuah kopyor
diduga memiliki genotipe heterozigot atau secara genetis berpeluang tumbuh
menjadi tanaman kelapa kopyor dengan presentase menghasilkan buah kopyor
sekitar 1-10% tergantung pada genotipe tepung sari yang menyerbuki bunga
betina (Sukamto, 2006).
Pola pewarisan sifat kopyor ditentukan oleh peluang terjadinya pertemuan
gen kopyor dalam proses penyerbukan dan pembuahan. Pada tanaman kelapa
kopyor alami, proses pembuahan terjadi antara dua inti sperma yang membawa
gen kopyor (k) dan gen normal (K) haploid, dengan dua sel telur yang juga
membawa gen kopyor (k) dan gen normal (K) haploid, serta dua inti polar yang
membwa gen kopyor berbeda dalam pembuahan. Salah satu inti sperma akan
menyatu dengan sel telur untuk membentuk embrio, sedangkan inti sperma
lainnya akan menyatu dengan inti polar untuk membentuk endosperm. Dengan
pola seperti di atas, pada tandan buah pohon kelapa kopyor akan terdapat tiga tipe
buah berdasarkan genotipenya. Salah satu genotipe pada tipe ketiga, embrio
Embrio kelapa pada ketiga tipe normal dan memiliki kemampuan tumbuh seperti
pada buah kelapa normal, namun pada tipe ketiga karena endospermnya tidak
normal (kopyor) (Santos, 1999).
Menurut Sukamto (2006), perbanyakan tanaman kelapa kopyor dapat
dilakukan dengan 2 cara yaitu secara alami atau secara konvensional dan secara
kultur embrio. Para petani biasanya memperbanyak tanaman kelapa kopyor secara
konvensional yaitu menanam buah kelapa normal yang terpilih sebagai bibit yang
dihasilkan dari pohon kelapa yang memiliki gen kopyor. Embrio kelapa kopyor
tidak dapat dijadikan bibit secara pembiakan alami, karena endosperm yang
merupakan bahan makanan bagi embrio untuk berkecambah mempunyai tekstur
yang tidak normal sehingga akan cepat membusuk dan embrionya tidak dapat
tumbuh sebagaimana embrio pada kelapa normal.
Perbanyakan tanaman kelapa kopyor selama ini dikembangkan melalui
kultur jaringan dengan menanam embrio zigotik kelapa kopyor dalam media agar
secara aseptik yang disebut teknik kultur embrio. Teknik kultur embrio ini
bertujuan untuk menyelamatkan dan menumbuhkan embrio kelapa kopyor yang
disebut embryo rescue. Meskipun demikian, efisiensi dalam teknik kultur embrio
ini masih diperlukan perbaikan-perbaikan proses kultur embrio karena dalam
menghasilkan planlet dan bibit kelapa kopyor masih tergolong rendah (Sukendah,
B. Kultur Embr io
Kultur embrio tanaman merupakan salah satu perbanyakan tanaman secara
in vitro yang menggunakan bahan tanam (eksplan) berupa embrio tanaman yang
dilakukan dalam kondisi aseptik (Setiyono dan Zakaria, 2001). Kultur embrio
dimanfaatkan untuk memperbanyak tanaman yang secara alamiah embrionya
mengalami kegagalan tumbuh (Warisno, 1998). Dengan adanya teknik kultur
embrio pada embrio kelapa kopyor bertujuan untuk mendapatkan tanaman kelapa
kopyor dan mampu berbuah kopyor per pohon. Tanaman kelapa hasil kultur
embrio tersebut memiliki beberapa keunggulan yaitu keturunan yang dibawa
pasti membawa gen yang mengontrol sifat kopyor, presentase buah kopyor yang
dihasilkan tinggi dan kualitas buah kopyor lebih seragam (Novarianto, 1999).
Wahyuni (2000) menginformasikan bahwa perbanyakan kelapa kopyor
secara kultur embrio sangat menguntungkan karena tanaman kelapa merupakan
tanaman berbiji tunggal yang sampai saat ini tidak dapat dikembangbiakan secara
cangkok atau stek. Selain itu hasil kultur embrio dapat menghasilkan kelapa
kopyor cukup tinggi yaitu dapat mencapai 90-100% berupa kelapa kopyor dari
keseluruhan buah kelapa dalam satu pohon.
Embrio zigotik adalah perkembangan embrio lengkap dari penyatuan
gamet jantan dan gamet betina, apabila dikembangkan dalam kultur jaringan
maka akan mengalami perkembangan melalui tahapan oktan, globular, awal hati,
hati, torpedo, dewasa. Embrio yang digunakan dalam kultur embrio, tidak
diharapkan dapat menjaga integritas dan kemampuan tumbuh embrio menjadi
tanaman lengkap (Suwardana, 2010).
Pembiakan kelapa kopyor dengan metode kultur embrio zigotik hanya
menghasilkan sedikit bibit karena satu embrio maksimal hanya menghasilkan satu
tanaman. Perolehan bibit kelapa kopyor asal kultur embrio zigotik yang tidak
banyak mengakibatkan harga bibit kelapa kopyor sangat mahal yang sulit
terjangkau oleh petani. Oleh sebab itu dibutuhkan alternatif metode kultur
jaringan selain kultur embrio untuk meningkatkan jumlah planlet dan bibit kelapa
kopyor (Sukendah, 2009).
1. Kultur Embr io Dibelah
Sukendah (2009) telah melakukan metode perbanyakan kultur embrio
zigotik dengan teknik pembelahan meristem apikal yang mengandung bakal tunas
dan bakal akar dibelah secara longitudinal pada tahap embrio dan kecambah.
Tujuannya adalah memecah titik tumbuh tunas dan akar sehingga dapat
berkembang menjadi individu – individu tunas dan akar yang baru. Dengan teknik
pembelahan eksplan tersebut, jaringan meristematik dan titik tumbuh pada
bagian-bagian belahan embrio zigotik yang didapat terbukti berpotensi untuk berkembang
menjadi tunas dan planlet sehingga dapat diregenerasikan menjadi bibit kelapa
kopyor. Dengan satu kali pembelahan (satu embrio zigotik menjadi dua belahan
eksplan), perolehan planlet dan bibit kelapa kopyor ditingkatkan menjadi dua kali
jika dibandingkan dengan tanpa pembelahan.
Romeida (2007) melaporkan biji manggis yang dibelah dua kemudian
jumlah tunas yang lebih banyak dibandingkan dengan biji yang dipotong lalu
diletakkan dengan cara biji dengan bagian yang luka tidak menempel pada media.
Jaringan kalus yang terbentuk pada percobaan ini sangat berpotensi untuk
berkembang menjadi tunas adventif dimana terbentuk pada minggu kesepuluh dan
jumlahnya terus meningkat setiap minggunya.
2. Kultur Embr io Utuh
Romeida (2007) juga melakukan penelitian pada biji manggis utuh yang
ditanam pada media tanam untuk membandingkan dengan biji manggis yang
dibelah, dengan tujuan mendapatkan respon terbaik pada tipe eksplan biji
manggis. Hasil penelitiannya dari biji manggis utuh yang ditanam pada media
tanam secara in vitro, kurang sempurna dalam hal penyerapan unsur hara sehingga
hanya terbentuk 1-2 tunas yang mampu menembus permukaan biji. Walaupun
jumlah tunas yang terbentuk sedikit tetapi secara visual perkembangan tunas
menjadi planlet sangat cepat dan sangat baik penampilannya baik dari tinggi
tunas, bentuk akar, diameter batang dan lebar daun maupun jumlah daunnya.
C. Per anan Zat Pengatur Tumbuh Auksin dan Sitokinin dalam Kultur
Embr io Kelapa Kopyor
Zat pengatur tumbuh adalah senyawa organik yang bukan hara (nutrisi)
tanaman yang aktif dan dalam jumlah sedikit dapat mendukung, menghambat
serta dapat merubah proses fisiologi tumbuhan. Peranan ZPT sebagai pendukung
maupun penghambat pertumbuhan sangat ditentukan oleh konsentrasinya, suhu,
cahaya, kelembaban udara, cara penggunaan serta pengaruh ZPT bergantung pada
dan perkembangan tumbuhan, pada umumnya keseimbangan konsentrasi dari
beberapa ZPT yang akan mengontrol pertumbuhan dan perkembangan tumbuhan.
Dalam kultur in vitro terdapat 2 golongan ZPT yang sangat penting yaitu auksin
dan sitokinin. Zat pengatur tumbuh ini mempengaruhi pertumbuhan dan
morfogenesis dalam kultur sel, jaringan dan organ. Interaksi dan perimbangan
dalam ZPT yang diberikan dalam media dan yang diproduksi oleh sel secara
endogen menentukan arah suatu kultur (Widyastuti dan Tjokrokusumo, 2007).
1. Auk sin
Auksin merupakan salah satu golongan fitohormon, yang tidak terlepas
dari pertumbuhan dan perkembangan suatu tanaman (Abidin, 1982). Aktifitas
auksin dalam kultur jaringan dikenal mampu berperan menginduksi kalus,
mendorong proses morfogenesis kalus membentuk akar dan tunas, mendorong
proses embriogenesis, dan dapat mempengaruhi kestabilan genetik sel tanaman
(Santoso dan Nursandi, 2003). Zat pengatur tumbuh golongan auksin terdiri dari
Indole-3-Acetic Acid (IAA), 2,4-Dichlorophenoxy Acetic Acid (2,4-D), Indole
Butyric Acid (IBA), Nephtaleine Acetic Acid (NAA).
IAA merupakan auksin yang sifatnya dapat mempercepat pertumbuhan
bibit, pembesaran dan pemanjangan sel, yang berakibat pada perpanjangan
koleoptil dan batang, meningkatkan persentase perkecambahan, dapat
menyebabkan tunas bertambah panjang, merangsang akar dan pembentukan kalus.
IAA pada konsentrasi tinggi biasanya dapat menghambat pertumbuhan akar dan
Kurniawati (2002) melaporkan bahwa dimana pemberian konsentrasi IAA
3 ppm dapat mempercepat 3-5 hari keluarnya tunas sedangkan pemberian
konsentrasi IAA diatas 3 ppm munculnya tunas semakin lambat. Menurut
Mashud, Taulu dan Kaat (1991) hasil penelitian kultur embrio kelapa sawit
menunjukkan bahwa embrio yang ditumbuhkan pada media Murashige and Skoog
(MS) dengan konsentrasi IAA 5 mg/l berhasil membentuk tunas dan akar. dan
akar yang seimbang. Mashud (1998) melaporkan bahwa untuk merangsang
pertumbuhan perkecambhan embrio kelapa pada medium padat MS perlu
penambahan IAA, dari data pengamatan diperoleh hasil bahwa perlakuan IAA
pada konsentrasi 10 ppm menyebabkan tunas dan akar bertambah panjang. Oleh
karena itu, dengan penambahan auksin IAA dapat mendorong perkecambahan dan
meningkatkan laju pertumbuhan kecambah dengan memacu pertumbuhan tunas
Menurut Wattimena (1988) 2,4-D adalah auksin sintetik yang tidak
diproduksi oleh tanaman. Wetherell (1982) menyatakan bahwa 2,4-D merupakan
auksin yang lebih stabil dan lebih kuat dari jenis auksin lainnya karena lambat
diuraikan oleh sel tumbuhan dan stabil pada pemanasan dengan autoklaf. Salah
satu faktor yang mempengaruhi aktivitas auksin sintetik yaitu kemampuan auksin
tersebut berinteraksi dengan hormon tumbuhan lainnya (Wattimena, 1988).
Senyawa 2,4-D diketahui menginduksi perbanyakan sel tetapi menekan
diferensiasi pada tanaman dikotil, tetapi 2,4-D dan 2,4,5-T diketahui bersifat
efektif untuk menginduksi embriogenesis pada tanaman monokotil (Yuwono,
Pembentukan embrio somatik pada medium proliferasi kalus embriogenik
dapat disebabkan oleh zat pengatur tumbuh 2,4-D yang terdapat di dalam media.
Zat pengatur tumbuh jenis auksin 2,4-D dalam konsentrasi rendah digunakan
untuk menginisiasi pembentukan embrio somatik pada tanaman kelapa (Chan et
al., 1999; Fernando & Gamage, 2000) dan kurma (Huong et al., 1999). Pada
penelitian Riyadi et al. (2005) menemukan bahwa penggunaan 2,4-D sebesar 10
mg/L yang dikombinasikan dengan kinetin 0,1 mg/L pada media padat dapat
menginisasi pembentukan embrio somatik sagu sebesar 45%. Sehingga dengan
menggunakan media proliferasi, dapat dilakukan dua tahapan sekaligus yaitu
proliferasi dan diferensiasi kalus embriogenik menjadi embrio somatik.
Ramos et al. (1993) dan Sumaryono dan Tahardi (1993) melaporkan
bahwa variasi konsentrasi auksin menyebabkan induksi embrio somatik kopi
Robusta berbeda antar perlakuan. Perlakuan 2,4-D 4 mg/l + kinetin 0,1 mg/l
menghasilkan induksi embrio somatik paling banyak, yaitu 50% terinduksi selama
dua minggu dan 100% terinduksi dalam waktu empat minggu dari total eksplan
yang dikulturkan.
Golongan auksin lainnya seperti IBA dan NAA juga digunakan untuk
meningkatkan perakaran planlet in vitro khususnya pada komoditi kelapa. Hal ini
dikarenakan beberapa peneliti kelapa berpendapat bahwa akar-akar lateral sangat
penting untuk menunjang penyerapan unsur hara sehingga planlet lebih biasa
bertahan pada kondisi luar pada tahap aklimatisasi.
Pada penelitian Sukendah (2009) untuk merangsang keluarnya akar lateral,
3 mg/l. Pada konsentrasi IBA 2 mg/l menghasilkan jumlah akar lateral nyata lebih
banyak daripada IBA 1 mg/l. Planlet yang mempunyai tunas dan akar yang
berkembang baik, yaitu mempunyai akar primer dan akar lateral, maka persentase
planlet yang berhasil diaklimatisasi mencapai + 75–80%.
Kelapa sawit dikulturkan pada media Woody Plant Medium (WPM) yang
ditambahkan dengan berbagai konsentrasi NAA dan Paklobutrazol (PBZ) dapat
berkecambah dan membentuk akar. Persentase perakaran diperoleh dengan
menggunakan WPM dengan 6 mg/l NAA dan 9 mg/l PBZ sebesar 88%. Tanpa
NAA dan hanya PBZ akar berkembang pendek dan tunggal. Rata-rata dari setiap
kelapa sawit yang telah berkecambah dan membentuk akar, dengan pemberian
konsentrasi NAA dan PBZ yang tinggi dapat meningkatkan pertumbuhan jumlah
akar dan panjang akar. Konsentrasi NAA dan PBZ yang paling efektif
menghasilkan vigor yang kuat dan sehat pada pertumbuhan akar adalah 6 mg/l
NAA dan 9 mg/l PBZ, sebab dengan adanya kombinasi sistem hormon tersebut
dapat diperoleh akar berserat. PBZ dan NAA pada konsentrasi 8 mg/l dan 12 mg/l
menghasilkan akar yang tebal dan kekar tetapi menyebabkan pertumbuhan tunas
tidak baik (Nizam dan Te-chato, 2009).
2. Sitokinin
Sitokinin merupakan hormon tumbuhan turunan adenin dan berfungsi
untuk merangsang pembelahan sel. Sitokinin mempunyai kemampuan mendorong
terjadinya pembelahan sel dan diferensiasi jaringan metosis dalam pembentukan
yang digunakan secara komersial dalam kultur in vitro adalah Benzyl Adenin
(BA), 6-Benzyl Aminopurine (BAP) dan kinetin.
Salah satu jenis hormon dari kelompok sitokinin yang paling banyak
digunakan adalah BAP. Hal ini karena BAP dinilai lebih stabil, tidak mahal dan
lebih efektif dibandingkan kinetin. BAP biasanya digunakan untuk induksi kalus
tetapi yang terpenting adalah BAP dapat menginduksi formasi tunas, pucuk atau
kecambah (Ariana, 2005).
Sitokinin berpengaruh terhadap aspek fisiologis, yaitu mendorong aktivitas
pembelahan sel. Sitokinin mempunyai cincin adenine, yaitu suatu basa purin yang
terdapat pada DNA dan RNA sehingga sitokinin berperan dalam metabolisme
asam nukleat dan sintesa protein (Wattimena, 1987). Menurut Hamid (2001)
bahwa DNA merupakan materi genetik yang berfungsi sebagai tempat (cetakan)
untuk sintesa molekul protein. Sedangkan RNA berperan langsung dalam sintesis
protein, dimana membawa asam amino ke tempat perakitan (ribosom) untuk
menjadi protein.
Sukendah (2009) melaporkan bahwa induksi tunas dari eksplan belahan
embrio yang tumbuh menjadi tunas dan akar dengan presentase 83,33% pada
konsentrasi BAP 2,5 mg/l. Sedangkan induksi tunas dari eksplan belahan
kecambah yang tumbuh menjadi tunas dan akar dengan presentase 100% pada
konsentrasi BAP 5,0-7,5 mg/l.
Moncalean et al. (2004) melaporkan bahwa selama 8 hari masa kultur
Pinus pinea pada media kultur yang ditambahkan BA 4,4 µM, kotiledon Pinus
mampu menginduksi tunas. Selain itu, selama masa inkubasi 12 hari pada BA 4,4
µM mampu mencapai induksi tunas hingga 100% dari kotiledon. Fase ketiga,
yang terjadi setelah 12 hari, meristem berkembang menjadi tunas lengkap yang
didukung dengan adanya fitohormon dari hormon eksogen.
D. Per anan Air Kelapa sebagai Bahan Aditif
Air kelapa merupakan salah satu bahan aditif yang umumnya digunakan
dalam kegiatan kultur jaringan. Pemberian air kelapa dimaksudkan untuk
mendorong induksi tunas adventif, karena penambahan air kelapa dapat
meningkatkan pembelahan sel (Steward, 1958; Priyono dan Danimihardja, 1991)
dan mendorong pembentukan organ yang dapat meningkatkan peranan
fitohormon dalam proses embriogenesis somatik maupun organogenesis.
Air kelapa merupakan endosperma cair yang berfungsi sebagai sumber
nutrisi (selain endosperma padat) bagi perkembangan embrio kelapa. Komposisi
air kelapa mengandung beberapa hormon seperti auksin, sitokinin, dan giberelin.
Air kelapa juga mengandung bahan organik gula dan vitamin; asam amino serta
bahan anorganik seperti fosfat (P), magnesium (Mg), dan kalium (K) (Raghavan,
Tabel 1. Komposisi Air Buah Kelapa Muda dari Jenis Kelapa Dalam (West Coast Tall)
Hasil penelitian yang telah dilakukan oleh Sukendah dan Rachmat (2003)
menunjukkan bahwa dari berbagai bahan aditif yang diuji (sari tauge, dan tomat,
air kelapa, dan ekstrak ragi) hanya air kelapa yang dapat meningkatkan persentase
perkecambahan dan mempercepat pertumbuhan planlet kelapa kopyor. Sukendah
(2009) melaporkan embrio kelapa kopyor yang dikulturkan pada media dengan
air kelapa 150 ml/l lebih cepat berkecambah, yaitu kurang dari satu bulan (29
Konsentrasi air kelapa yang digunakan pada media kultur dapat
mempengaruhi jumlah daun tanaman pisang yang terbentuk. Jumlah daun terus
bertambah sampai pada konsentrasi 150 ml/l air kelapa, tetapi diatas konsentrasi
tersebut jumlah daun tidak bertambah. Selain itu air kelapa juga berpengaruh
terhadap saat munculnya akar. Semakin tinggi konsentrasi yang diberikan
semakin cepat berakar sampai pada konsentrasi 150 ml/l. Pada konsentrasi 150
ml/l akar tumbuh pada umur 38 hari sedangkan pada kontrol berakar pada umur
45 hari (Wardiyati et al., 1993).
Hasil dari penelitian Widiastoeti dan Syafril (1993), menunjukkan bahwa
penambahan air kelapa sebanyak 150 ml/l dalam media padat diperlihatkan hasil
yang paling baik terhadap pertumbuhan anggrek Dendrobium. Penambahan air
kelapa dengan konsentrasi 300 ml/l menunjukkan adanya gejala penghambatan
pertumbuhan planlet, yang diduga karena konsentrasi air kelapa yang
ditambahkan ke dalam media terlampau tinggi sehingga menyebabkan terjadinya
kerusakan pada jaringan tanaman sepertinya pecahnya dinding sel.
Pada proses reproduksi embrio somatik kopi Arabika secara mikro,
penambahan air kelapa dengan konsentrasi 22,5 ml/l dan BAP dengan konsentrasi
2,5 mg/l dapat memacu pertumbuhan embrio (Priyono dan Danimihardja, 1993).
Pada hasil penelitian Priyono dan Danimihardja (1991) mengemukakan bahwa
penambahan air kelapa pada konsentrasi 250 ml/l ke dalam medium kultur
ternyata menghambat pembentukan tunas adventif kopi Arabika, tetapi memacu
pembentukan kalus pada seluruh varietas yang diuji. Hal ini disebabkan karena
Menurut Widiastoeti et al. (1997), air kelapa dari berbagai jenis kelapa
dapat digunakan sebagai campuran media kultur jaringan. Penambahan air kelapa
normal dari kelapa genjah hijau dan kuning memberikan pengaruh yang tidak
nyata terhadap pembentukan panjang dan jumlah daun pada tanaman anggrek
Dendrobium.
Pada penelitian Kumalasari (2003) penambahan air kelapa normal pada
media memberikan pengaruh terhadap panjang planlet yang lebih panjang, jumlah
daun yang dihasilkan lebih banyak, daunnya lebih lebar serta memiliki kecepatan
pertumbuhan tunas yang lebih cepat daripada penambahan air kelapa kopyor.
Meskipun menurut Del Rosario dan De Guzman (1981), air kelapa kopyor
mempunyai aktivitas sitokinin yang yang lebih tinggi daripada aktivitas sitokinin
yang terkandung pada air kelapa normal, namun air kelapa kopyor mempunyai
setengah dari kandungan hemiselulosa yang terdapat pada air kelapa normal,
dimana hemiselulosa merupakan golongan dari karbohidrat.
Hasil penelitian Kumalasari (2003) menyatakan bahwa embrio yang
mendapatkan penambahan air kelapa normal memiliki banyak energi untuk
memacu pertumbuhan jaringannya dengan membentuk planlet yang lebih panjang,
daun yang terbentuk lebih banyak dan lebar, serta kecepatan pertumbuhannya
lebih cepat bila dibandingkan dengan penambahan air kelapa kopyor. Sedangkan
pada media dengan penambahan air kelapa kopyor, meskipun memiliki aktivitas
sitokinin lebih tinggi dan embrio lebih cepat berkecambah dengan membentuk
tunas pada tahap perkecambahan, namun untuk perkembangan tunas selanjutnya
sehingga tunas yang telah terbentuk mengalami pertumbuhan yang sangat lambat,
planlet yang terbentuk lebih pendek serta jumlah daun yang terbentuk lebih sedikit
dan sempit. Jenis air kelapa normal memberikan pertumbuhan tunas dan akar
yang lebih baik daripada kelapa kopyor. Penggunaan jenis air kelapa normal dan
kopyor menghasilkan presentase planlet sempurna yang tidak jauh beda, namun
penggunaan jenis air kelapa normal memiliki vigor tanaman yang lebih bagus
daripada air kelapa kopyor.
E. Hipotesa
1. Diduga ada perbedaan pengaruh antara zat pengatur tumbuh dan bahan
aditif air kelapa dalam pertumbuhan planlet asal embrio utuh dan embrio
yang dibelah
2. Diduga ada perbedaan respon pertumbuhan planlet asal embrio yang
dibelah pada berbagai media yang mengandung zat pengatur tumbuh
sitokinin; kombinasi sitokinin dengan auksin; dan kombinasi sitokinin,
III. BAHAN DAN METODE
A. Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Bioteknologi Program Studi
Agroteknologi Fakultas Pertanian Universitas Pembangunan Nasional “Veteran”
Jawa Timur. Pelaksanaan penelitian dimulai bulan November 2010 sampai
dengan bulan Mei 2011.
B. Bahan dan Alat
1. Bahan Tanaman dan Media
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan bahan
tanam, media dan bahan penunjang lainnya. Bahan tanaman yang digunakan
sebagai sumber eksplan adalah embrio kelapa kopyor jenis genjah. Embrio kelapa
berasal dari buah kelapa kopyor umur 11-12 bulan. Buah kelapa kopyor diambil
dari kebun kelapa petani di daerah Pati, Jawa Tengah.
Bahan media yang digunakan adalah media mengandung senyawa makro
dan mikro Eeuwens (1976) dan vitamin dari Morel dan Wetmore (1951). Media
juga mengandung sukrosa 60 g/l, arang aktif 2,5 g/l dan agar 7,5 g/l. Media
Eeuwens dilengkapi dengan zat pengatur tumbuh dan bahan aditif sebagai sumber
perlakuan. Zat pengatur tumbuh yang digunakan adalah hormon auksin yaitu IAA
dan 2,4-D serta hormon sitokinin yaitu BAP. Sedangkan bahan aditif yang
Bahan penunjang lain adalah bahan sterilisasi. Bahan sterilisasi yang
digunakan adalah aluminium foil, spiritus, alhokol 70% dan alkohol 96%,
betadine dan klorox (mengandung natrium hipoklorit) yang berfungsi untuk
membunuh kuman yang terbawa oleh bahan eksplan dan alat yang digunakan
pada saat penanaman.
2. Alat
Alat-alat yang digunakan dalam penelitian ini adalah Laminar Air Flow
yang berfungsi sebagai tempat penabur eksplan. Autoklaf digunakan untuk
mensterilkan alat-alat gelas, dissecting kit dan media kultur sebelum digunakan.
Timbangan analitik berfungsi untuk menimbang bahan media sampai satuan yang
kecil (milligram). Magnetic hot-stirer digunakan untuk mengaduk, melarutkan
dan memanaskan bahan kimia sehingga bahan kimia dapat larut dengan baik. pH
meter digunakan untuk mengukur derajat keasaman media.
Alat-alat lain yang digunakan selama pelaksanaan kultur embrio adalah
tabung reaksi, erlenmeyer, gelas ukur, gelas piala, petridish, pipet, pengaduk,
C. Metode Penelitian
Penelitian dilakukan dengan melaksanakan 2 rangkaian percobaan
laboratorium, yaitu :
Per cobaan I. Per anan ZPT BAP + IAA dan Air Kelapa pada Per tumbuhan Planlet Kelapa Kopyor Asal Kultur Embr io yang Tidak Dibelah
Penelitian ini merupakan percobaan yang disusun berdasarkan Rancangan
Acak Lengkap (RAL) 1 (satu) faktor dengan 5 perlakuan. Setiap perlakuan
diulang 10 kali. Setiap botol kultur yang mewakili satu unit percobaan diisi
dengan 1 embrio. Perlakuan yang diberikan yaitu :
1) A = Media Eeuwens (kontrol)
2) B = Media Eeuwens + Air Kelapa 150 ml/l
3) C = Media Eeuwens + BAP 2,5 mg/l
4) D = Media Eeuwens + BAP 2,5 mg/l + Air kelapa 150 ml/l
5) E = Media Eeuwens + BAP 2,5 mg/l + IAA 2 mg/l
+ Air Kelapa 150 ml/l
Per cobaan II. Per anan ZPT BAP + 2,4-D dan Air Kelapa pada Per tumbuhan Planlet Kelapa Kopyor Asal Kultur Embr io Dibelah
Penelitian ini merupakan percobaan yang disusun berdasarkan Rancangan
Acak Lengkap (RAL) 1 (satu) faktor dengan 5 perlakuan. Setiap perlakuan
diulang 10 kali. Setiap botol kultur yang mewakili satu unit percobaan diisi
dengan 2 potongan embrio yang berasal dari satu embrio yang sama. Perlakuan
yang diberikan yaitu :
1) F = Media Eeuwens + Air Kelapa 150 ml/l
3) H = Media Eeuwens + 2,4-D 2,5 mg/l
4) I = Media Eeuwens + BAP 5 mg/l + 2,4-D 2,5 mg/l
5) J = Media Eeuwens + BAP 5 mg/l + 2,4-D 2,5 mg/l
+ Air Kelapa 150 ml/l
D. Pelaksanaan Penelitian
1. Ster ilisasi Alat
Alat-alat yang akan digunakan dalam penelitian kultur jaringan
dipersiapkan terlebih dahulu seperti beaker glass, tabung reaksi, gelas ukur,
erlenmeyer, petridish, pinset, pipet, scalpel, corong, spatula dan gunting. Semua
alat-alat disterilkan dengan cara dicuci dengan air sabun hingga bersih kemudian
ditiriskan pada rak sampai kering. Semua alat yang sudah kering dibungkus
dengan kertas coklat kemudian disterilkan di dalam lemari steril atau autoklaf
selama + 1 jam.
2. Pembuatan Media
Media dasar Eeuwens (1976) digunakan untuk proses pertumbuhan planlet
kelapa kopyor yaitu pada tahap perkecambahan, tahap pertumbuhan dan tahap
pendewasaan.
a. Pada tahap perkecambahan, media yang digunakan adalah media padat
Eeuwens yang mengandung sukrosa 60 g/l, arang aktif 2,5 g/l, agar 7,5
g/l. Ke dalam media ditambahkan perlakuan yang diberikan yaitu zat
pengatur tumbuh dan bahan aditif air kelapa sesuai dengan percobaan 1
b. Pada tahap pertumbuhan, media yang digunakan adalah media padat
Eeuwens yang mengandung sukrosa 60 g/l, arang aktif 2,5 g/l, agar 7,5
g/l. Ke dalam media ditambahkan perlakuan yang diberikan yaitu zat
pengatur tumbuh dan bahan aditif air kelapa sesuai dengan percobaan 1
dan percobaan 2. Setiap botol kultur diisi dengan media sebanyak 50 ml.
c. Pada tahap pendewasaan, media yang digunakan adalah media cair
Eeuwens yang mengandung sukrosa 60 g/l dan arang aktif 2,5 g/l. Ke
dalam media ditambahkan perlakuan yang diberikan yaitu zat pengatur
tumbuh dan bahan aditif air kelapa sesuai dengan percobaan 1 dan
percobaan 2. Setiap botol kultur diisi dengan media sebanyak 70 ml.
3. Ster ilisasi Media
Media kemudian disterilisasi menggunakan autoclave. Sterilisasi dilakukan
selama + 30 menit di dalam autoclave dengan suhu 121o C dan tekanan 1,5 atm.
Media yang telah disterilisasi kemudian diletakkan pada rak botol sampai media
akan digunakan.
4. Ster ilisasi Embr io
Embrio diambil dari buah kelapa kopyor umur 11-12 bulan diambil dari
kebun petani di daerah Pati, Jawa Tengah. Buah kelapa kopyor dibelah secara
horizontal dan diambil bagian endosperma yang berisi embrio dengan alat cork
borer (diameter 2 cm). Silinder endosperma yang didalamnya mengandung
embrio dikumpulkan di beaker glass steril. Silinder endosperma selanjutnya
bersih, kemudian disterilisasi menggunakan klorox 20% dengan cara direndam
selama 20 menit dan dibilas dengan aquadest steril sebanyak 3-5 kali.
Sterilisasi silinder endosperma dilakukan kembali di dalam laminar air
flow. Embrio dikeluarkan dari endosperma dan dimasukkan dalam erlenmeyer
250 ml. Embrio kemudian disterilisasi menggunakan alkohol 70% dengan cara
direndam selama 5 menit dan dibilas aquadest steril sebanyak 3 kali. Selanjutnya
embrio disterilisasi lagi menggunakan klorox 10% dan direndam selama 5 menit,
kemudian dibilas aquadest steril 3 kali. Sebelum tahap penanaman, embrio
direndam dalam air steril yang ditetesi dengan betadine 5-8 tetes.
5. Penanaman Embr io
Penanaman embrio dilakukan di dalam laminar air flow. Embrio yang
sudah steril ditanam pada media padat Eeuwens 10 ml yang mengandung sukrosa
60 g/l, arang aktif 2,5 g/l, agar 7,5 g/l. Ke dalam media ditambahkan perlakuan
yang diberikan yaitu zat pengatur tumbuh dan bahan aditif air kelapa sesuai
dengan percobaan 1 dan percobaan 2. dengan pH media 5,8. Satu tabung reaksi
ditanam satu embrio. Tabung reaksi kemudian ditutup dengan aluminium foil dan
diletakkan pada ruang tumbuh selama 6-8 minggu.
6. Penumbuhan Embr io Kelapa Kopyor
Tahap perkecambahan, pada tahap ini embrio kelapa kopyor
dikecambahkan didalam ruang gelap dengan suhu sekitar kurang lebih 200C dan
kelembaban udara 60-70% selama 6-8 minggu pada media padat. Proses
Tahap periode pertumbuhan, embrio yang telah berkecambah dipindahkan
kedalam media padat Eeuwens yang mengandung sukrosa 60 g/l, arang aktif 2,5
g/l, agar 7,5 g/l. Ke dalam media ditambahkan berbagai kombinasi zat pengatur
tumbuh dan bahan aditif air kelapa sesuai pada percobaan 1 dan percobaan 2.
Pemindahan embrio tersebut dilakukan di dalam laminar air flow. Embrio yang
telah berkecambah ditumbuhkan didalam ruang terang dengan suhu 200 C selama
3 bulan sampai menjadi planlet.
Pada tahap pendewasaan planlet, planlet dipindahkan kedalam media cair
Eeuwens yang mengandung sukrosa 60 g/l dan arang aktif 2,5 g/l. Ke dalam
media ditambahkan berbagai kombinasi zat pengatur tumbuh dan bahan aditif air
kelapa sesuai pada percobaan 1 dan percobaan 2. Pemindahan embrio tersebut
dilakukan di dalam laminar air flow. Pemindahan media ini dimaksudkan untuk
mengganti unsur hara yang telah habis pada media sebelumnya. Pada tahap
pendewasaan, planlet diinkubasikan selama 2-3 bulan dalam ruang terang sampai
terbentuk 2-3 helaian daun dan akar.
E. Var iabel Pengamatan
Untuk mengetahui pertumbuhan embrio kelapa kopyor, maka variabel
pengamatan yang digunakan ada 2 cara yaitu secara deskriptif dan secara
1. Pengamatan secar a desk r iptif
Pengamatan secara deskriptif dilakukan dengan mendeskripsikan
morfologis atau visualisasi perubahan dari setiap tahap pertumbuhan embrio
sampai menjadi planlet. Setiap tahapan diambil gambar dengan menggunakan
kamera.
2. Pengamatan secar a kuantitatif
a. Tahap Perkecambahan
Selama tahap perkecambahan, pengamatan dilakukan dengan interval
waktu 14 hari sekali dengan variabel yang diamati pada tahap perkecambahan
terdiri dari :
1) Panjang Embrio
Pengukuran panjang embrio dilakukan dengan menggunakan
penggaris. Panjang embrio mulai dari bagian ujung titik tumbuh tunas dan
akar sampai pada ujung haustorium.
2) Presentase Perkecambahan
Presentase perkecambahan diperoleh dengan cara menjumlah
semua embrio yang berkecambah pada akhir tahap perkecambahan dengan
menggunakan rumus sebagai berikut :
Presentase perkecambahan = Jumlah embrio yang berkecambah
Jumlah embrio yang ditanam
3) Presentase Eksplan Stagnan
Embrio stagnan pada tahap perkecambahan ditandai dengan tidak
mati, namun juga tidak tumbuh ataupun berkecambah. Presentase stagnan
dihitung pada akhir tahap perkecambahan dengan menggunakan rumus :
Presentase embrio stagnan = Jumlah embrio yang stagnan
Jumlah embrio yang ditanam
b. Tahap Pertumbuhan Planlet
Selama tahap pertumbuhan planlet, pengamatan dilakukan dengan interval
waktu 14 hari sekali dengan variabel yang diamati terdiri dari :
1) Pertumbuhan Tunas
Tinggi tunas, pengukuran tinggi tunas dilakukan dari ujung terpanjang
sampai pangkal batang dan dilakukan pada saat subkultur atau pemindahan
planlet.
2) Pertumbuhan Akar
Panjang akar primer, pengukuran panjang akar primer dilakukan
setelah muncul akar primer dan diukur pada saat subkultur.
3) Persentase Planlet Keluar Tunas
Perhitungan persentase planlet yang terbentuk tunas dilakukan setelah
embrio terbentuk tonjolan yang merupakan bakal tunas. Presentase planlet
keluar tunas dihitung pada akhir tahap pertumbuhan planlet dengan
menggunakan rumus :
Presentase planlet keluar tunas = Jumlah planlet keluar tunas
Jumlah planlet yang ditanam
x 100%
4) Persentase Planlet Keluar Akar
Perhitungan persentase planlet yang terbentuk akar dilakukan setelah
embrio terbentuk tonjolan yang merupakan bakal akar. Presentase planlet
keluar akar dihitung pada akhir tahap pertumbuhan planlet dengan
menggunakan rumus :
Presentase planlet keluar akar = Jumlah planlet keluar akar
Jumlah planlet yang ditanam
5) Persentase Planlet dengan Tunas dan Akar
Perhitungan persentase planlet yang terbentuk tunas dan akar
dilakukan setelah embrio terbentuk tonjolan yang merupakan bakal
tunasdan bakal akar. Presentase planlet dengan tunas dan akar dihitung
pada akhir tahap pertumbuhan planlet dengan menggunakan rumus :
Presentase planlet dengan tunas dan akar =
Jumlah planlet yang ditanam
6) Persentase Planlet Browning
Planlet browning pada tahap pertumbuhan planlet ditandai dengan
terjadinya pencoklatan pada planlet yang menyebabkan planlet tidak
berkecambah. Presentase browning dihitung pada akhir tahap
perkecambahan dengan menggunakan rumus :
Presentase Planlet browning = Jumlah planlet yang browning
7) Presentase Planlet Stagnan
Planlet stagnan pada tahap pertumbuhan planlet ditandai dengan tidak
adanya kemajuan pertumbuhan planlet. Planlet tetap segar tetapi tidak
mati, namun juga tidak tumbuh ataupun berkecambah. Presentase stagnan
dihitung pada akhir tahap perkecambahan dengan menggunakan rumus :
Presentase planlet stagnan = Jumlah planlet yang stagnan
Jumlah planlet yang ditanam
8) Persentase Planlet Mati
Planlet yang mati pada tahap pertumbuhan planlet ditandai dengan
tidak menunjukkan adanya pertumbuhan atau planlet yang mati
disebabkan karena kontaminasi jamur dan bakteri. Presentase eksplan mati
dihitung pada akhir tahap pertumbuhan planlet dengan menggunakan
rumus :
Presentase planlet mati = Jumlah planlet yang mati
Jumlah planlet yang ditanam
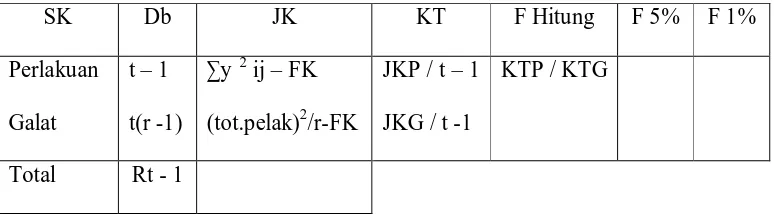
F. Analisis Data
Analisis data yang dilakukan adalah menggunakan Rancangan Acak
Lengkap. Langkah-langkah dalam menganalisis data RAL dengan 5 perlakuan
masing-masing diulang 10 kali ulangan.
Analisis RAL
a. Model percobaan RAL adalah
Yij = µ + τ i + € ij i = 1, 2, ….., 5 (banyaknya perlakuan)
j = 1, 2, …… 10 (banyaknya ulangan)
x 100%
Yij = nilai keberhasilan pertumbuhan embrio ke-j yang memperoleh perlakuan
ke-i.
µ = nilai tengah umum (rata-rata) pertumbuhan planlet
τ = pengaruh perlakuan ke- i terhadap keberhasilan pertumbuhan embrio
εij = pengaruh galat percobaan terhadap keberhasilan pertumbuhan embrio
ke- j yang memperoleh perlakuan ke- i.
b. Asumsi
Asumsi yang dibutuhkan untuk analisis percobaan ini adalah :
• Komponen-komponen µ, τ i, εij bersifat aditif
• Nilai-nilai τ i ( i = 1, 2, ……., 5) tetap, ∑ τ i = 0 ; ε (τ i) = τ i
• Εij timbul secara acak, menyebar secara normal dengan nilai
tengah nol dan ragam τ 2
Apabila asumsi RAL memenuhi syarat maka langsung dapat dilakukan
analisis ragam RAL, jika tidak maka data perlu ditransformasi terlebih
dahulu. Hasil dari data transformasi yang telah memenuhi asumsi RAL dapat
diteruskan dengan analisis ragam, jika tidak maka untuk penarikan
kesimpulan dari data yang ada dapat menggunakan mean atau rata-ratanya.
c. Analisis Ragam
Data yang telah diperoleh akan dianalisis dengan menggunakan analisis
Tabel 2. Analisis Ragam Percobaan yang terdiri dari Satu Faktor dengan RAL
• Kaidah keputusan pengujian adalah :
a. Jika F hitung > F tabel pada taraf 1 % pengaruh perlakuan dikatakan
sangat berbeda nyata ( pada hasil F hitung ditandai dengan 2 tanda **).
b. Jika F hitung > F tabel pada taraf 5 %, pengaruh perlakuan dikatakan
berbeda nyata (pada hasil F hitung ditandai dengan satu tanda*).
c. Jika F hitung < F tabel pada taraf 5 %, pengaruh perlakuan dikatakan
tidak nyata (pada hasil F hitung ditandai dengan tn).
d. Hipotesis
H0 = τ 1 = τ 2 = ………= τ 5 = 0 (berarti konsentrasi zat pengatur tumbuh
dan bahan aditif ada yang memberikan hasil yang sama dengan
media kontrol).
H1 = minimal ada 1 τ I ≠ 0 ( i = 1, 2, …….., 5) artinya minimal ada 1
perlakuan yang memberikan hasil lebih baik dibandingkan dengan
e. Uji BNT
Pengaruh perlakuan diuji dengan uji Fhitung. Apabila nilai Fhitung
lebih besar daripada Ftabel pada taraf 1% perlakuan dianggap berbeda
nyata. Jika nilai Fhitung lebih besar daripada Ftabel pada taraf 5%, perlakuan
dianggap tidak nyata. Untuk pengujian lebih lanjut digunakan uji Beda
IV. HASIL DAN PEMBAHASAN
A. Hasil Penelitian
Kultur embrio kelapa kopyor (Cocos nucifera L.) dilakukan melalui
beberapa tahapan media yaitu tahap perkecambahan embrio dan tahap
pertumbuhan planlet. Untuk melalui kedua tahapan tersebut, kultur embrio kelapa
kopyor dikulturkan selama 6 bulan.
Embrio kelapa kopyor yang ditanam pada media dalam berbagai
kombinasi zat pengatur tumbuh dan bahan aditif air kelapa menunjukkan respon
yang berbeda-beda. Respon embrio kelapa kopyor tampak dari tahapan
pengkulturan yang berhasil dilaluinya dan waktu yang diperlukan untuk tumbuh.
Hal tersebut merupakan indikator dari efektif atau tidaknya kombinasi zat
pengatur tumbuh dan bahan aditif air kelapa dalam meningkatkan pertumbuhan
embrio kelapa kopyor.
1. Per tumbuhan Embr io pada Tahap Perk ecambaha n
Ada berbagai bentuk respon embrio setelah embrio dikulturkan pada
media dengan penambahan kombinasi zat pengatur tumbuh dan bahan aditif air
kelapa, yaitu (1) embrio segera membesar dan berkecambah (Gambar 1.a), (2)
embrio membesar tetapi tidak menunjukkan kemajuan pertumbuhan kearah
perkecambahan, kemungkinan embrio masih dapat berkecambah jika dilakukan
subkultur ke media baru (Gambar 1.b). Respon (3) embrio tidak menunjukkan
Gambar 1. Respon Berbagai Embrio Kelapa Kopyor pada Media Kultur Tahap Perkecambahan (a.) Embrio yang Berkecambah Tumbuh Bakal Tunas dan Akar, (b.) Embrio yang Hanya Membesar tetapi Tidak Menunjukkan Kemajuan Pertumbuhan Kearah Perkecambahan, (c.) Embrio Tidak Viabel
Embrio yang diinokulasi dalam berbagai perlakuan kombinasi ZPT dan
bahan aditif air kelapa mengalami pertumbuhan. Awalnya embrio mengalami
pembesaran sel dan diikuti dengan bertambahnya panjang serta pada akhirnya
embrio berkecambah. Perkecambahan ditandai dengan munculnya tonjolan pada
bagian proksimal embrio yaitu bakal akar primer dan bakal primodium daun.
Selama tahap perkecambahan, kultur diletakkan pada ruang gelap selama 4
– 6 minggu. Ruang gelap pada awal pengkulturan berfungsi menghambat
browning pada media maupun eksplan. Rata-rata embrio kelapa kopyor selama
tahap perkecambahan tidak mengalami browning. Pada tahap perkecambahan,
embrio kelapa kopyor diinokulasi pada 2 set percobaan.
a. Per cobaan I. Per anan BAP + IAA dan Air Kelapa pada Per tumbuhan Embr io Kelapa Kopyor Fase Per kecambahan
Keberhasilan fase perkecambahan adalah terjadinya pertumbuhan embrio
yang ditandai dengan bertambahnya panjang setelah diinokulasi. Rata-rata
panjang embrio dalam berbagai perlakuan ZPT dan bahan aditif air kelapa pada
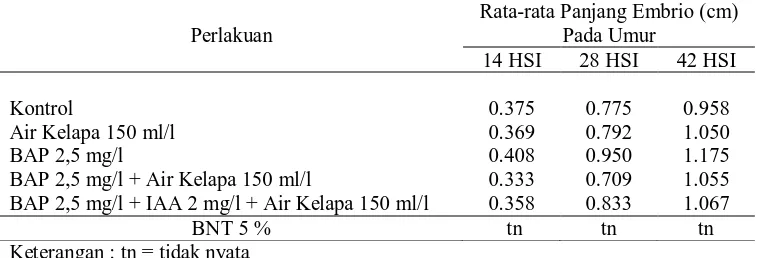
umur 14 HSI, 28 HSI dan 42 HSI secara detail disajikan pada Tabel 3. c
b a
tunas
Tabel 3. Rata-rata Panjang Embrio pada Berbagai Media Perlakuan Umur 14 HSI, 28 HSI, dan 42 HSI pada Tahap Perkecambahan
Perlakuan
Rata-rata Panjang Embrio (cm) Pada Umur
14 HSI 28 HSI 42 HSI
Kontrol 0.375 0.775 0.958
Air Kelapa 150 ml/l 0.369 0.792 1.050
BAP 2,5 mg/l 0.408 0.950 1.175
BAP 2,5 mg/l + Air Kelapa 150 ml/l 0.333 0.709 1.055
BAP 2,5 mg/l + IAA 2 mg/l + Air Kelapa 150 ml/l 0.358 0.833 1.067
BNT 5 % tn tn tn
Keterangan : tn = tidak nyata
Hasil analisis statistik diatas menunjukkan bahwa tidak terdapat perbedaan
yang nyata (p = 0.05) terhadap rata-rata panjang embrio dalam berbagai media
perlakuan selama tahap perkecambahan. Pola pertumbuhan embrio menunjukkan
pola linear dimana laju pertumbuhan terus meningkat seiring dengan
bertambahnya waktu. Meskipun secara statistik tidak berbeda nyata, embrio yang
dikulturkan pada media dengan perlakuan BAP 2,5 mg/l menghasilkan rata-rata
panjang embrio cenderung lebih panjang dibandingkan dengan perlakuan lainnya
pada umur 14 HSI sampai 42 HSI (Gambar 2).
Setelah embrio mengalami pertumbuhan panjang dengan ukuran tertentu,
pada akhirnya embrio berkecambah. Embrio yang dikulturkan pada berbagai
perlakuan ZPT dan bahan aditif air kelapa menunjukkan tanggapan berkecambah
yang berbeda-beda. Hal ini dapat dilihat pada persentase perkecambahan
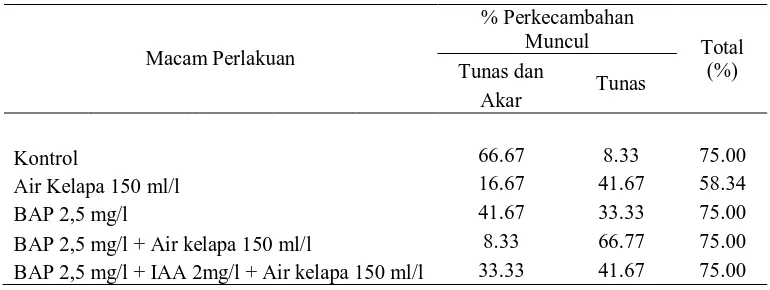
munculnya bakal tunas + akar dan bakal tunas yang telah dicapai (Tabel 4).
Tabel 4. Rata-rata Persentase Embrio Kelapa Kopyor yang Berkecambah Membentuk Bakal Tunas dan Akar (Planlet Lengkap) dan Bakal Tunas pada Media yang Mengandung Berbagai Perlakuan
Macam Perlakuan
Tabel 4 diatas merupakan hasil rata-rata persentase embrio kelapa kopyor
yang berhasil berkecambah dengan persentase 50% - 75% pada berbagai
perlakuan ZPT dan bahan aditif air kelapa. Embrio yang dikulturkan pada
perlakuan kontrol memberikan rata-rata persentase perkecambahan yang sama
dengan perlakuan kombinasi ZPT dan bahan aditif air kelapa yaitu 75%.
Sementara itu, pada perlakuan air kelapa 150 ml/l memberikan rata-rata
persentase perkecambahan lebih rendah yaitu 58,34%.
Pada tahap perkecambahan, embrio kelapa kopyor pada berbagai media
perlakuan berkecambah dengan sempurna yaitu membentuk tunas dan akar
media perlakuan dapat tumbuh sempurna, sebagian embrio hanya tumbuh
membentuk tunas atau akar terlebih dahulu (Gambar 3.a dan 3.b).
Gambar 3. Pertumbuhan Embrio Kelapa Kopyor dalam Media Perlakuan (a.) Kontrol, (b.) Air Kelapa 150 ml/l, (c.) BAP 2,5 mg/l, (d.) BAP 2,5 mg/l + Air Kelapa 150 ml/l, (e.) BAP 2,5 mg/l + IAA 2 mg/l + Air Kelapa 150 ml/l pada Tahap Perkecambahan
b. Per cobaan II. Per anan BAP + 2,4-D dan Air Kelapa pada Per tumbuhan Embr io Kelapa Kopyor Fase Per kecambahan
Keberhasilan fase perkecambahan adalah terjadinya pertumbuhan embrio
yang ditandai dengan bertambahnya panjang setelah diinokulasi. Rata-rata
panjang embrio dalam berbagai perlakuan ZPT dan bahan aditif air kelapa pada
umur 14 HSI, 28 HSI dan 42 HSI secara detail disajikan pada Tabel 5.
a b
d e
c
tunas
akar akar
tunas
tunas
akar
Tabel 5. Rata-rata Panjang Embrio pada Berbagai Media Perlakuan Umur 14 HSI, 28 HSI, dan 42 HSI pada Tahap Perkecambahan
Perlakuan
Rata-rata Panjang Embrio (cm) Pada Umur
14 HSI 28 HSI 42 HSI
Air Kelapa 150 ml/l 0.277 a 0.708 0.950
BAP 5 mg/l 0.283 a 0.782 1.055
2,4-D 2,5 mg/l 0.383 bc 0.717 0.967
BAP 5 mg/l + 2,4-D 2,5 mg/l 0.417 c 0.808 1.050
BAP 5 mg/l + 2,4-D 2,5 mg/l + Air Kelapa 150 ml/l 0.317 ab 0.800 1.136
BNT 5 % 0.075 tn tn
Keterangan : Angka didampingi dengan huruf berbeda sangat nyata pada uji BNT 5 %, tn = tidak nyata
Hasil analisis statistik diatas menunjukkan bahwa terdapat perbedaan yang
sangat nyata (p = 0.01) terhadap rata-rata panjang embrio dalam berbagai
perlakuan dengan hasil lebih baik yaitu BAP 5 mg/l + 2,4-D 2,5 mg/l pada umur
14 HSI. Meskipun hasil analisis statistik menunjukkan tidak terdapat perbedaan
nyata, namun pola pertumbuhan menunjukkan laju yang terus meningkat seiring
dengan bertambahnya waktu. Embrio yang dikulturkan pada perlakuan BAP 5
mg/l + 2,4-D 2,5 mg/l + Air Kelapa 150 ml/l cenderung mengalami peningkatan
panjang dibandingkan dengan perlakuan yang lain pada umur 42 HSI (Gambar 4).
Setelah embrio mengalami pertumbuhan dengan bertambahnya panjang
dengan ukuran tertentu, pada akhirnya embrio berkecambah. Masing-masing
embrio dalam perlakuan berbagai macam ZPT dan bahan aditif air kelapa
menunjukkan tanggapan berkecambah yang berbeda-beda. Hal ini dapat dilihat
pada persentase perkecambahan munculnya bakal tunas + akar dan bakal tunas
yang telah dicapai (Tabel 6).
Tabel 6. Rata-rata Persentase Embrio Kelapa Kopyor yang Berkecambah Menjadi Bakal Tunas dan Akar (Planlet Lengkap) dan Bakal Tunas pada Media
Tabel 6 diatas merupakan hasil rata-rata persentase embrio yang berhasil
berkecambah pada berbagai perlakuan ZPT dan bahan aditif air kelapa. Efektifitas
pemberian berbagai perlakuan ZPT dan bahan aditif air kelapa dapat
meningkatkan persentase perkecambahan yaitu antara 50% - 90%. Perlakuan BAP
5 mg/l + 2,4-D 2,5 mg/l + Air Kelapa 150 ml/l memberikan rata-rata persentase
perkecambahan yang paling tinggi yaitu sebesar 91,67%. Sementara itu, pada
media perlakuan mengandung air kelapa 150 ml/l dan 2,4-D 2,5 mg/l atau BAP 5
mg/l dan BAP 5 mg/l + 2,4-D 2,5 mg/l persentase perkecambahan rata-rata 50% -
Pada tahap perkecambahan, embrio kelapa kopyor berkecambah dengan
sempurna yaitu membentuk tunas dan akar pada berbagai media perlakuan
(Gambar 5). Namun, tidak semua embrio yang dikulturkan pada berbagai
perlakuan dapat tumbuh sempurna yaitu tumbuh membentuk tunas atau akar
terlebih dahulu.
Gambar 5. Pertumbuhan Embrio Kelapa Kopyor dalam Media Perlakuan (a.) Air Kelapa 150 ml/l, (b.) BAP 5 mg/l, (c.) 2,4-D 2,5 mg/l, (d.) BAP 5 mg/l+2,4-D 2,5 mg/l, (e.) BAP 5 mg/l+2,4-D 2,5 mg/l+Air Kelapa 150 ml/l pada Tahap Perkecambahan
2. Per tumbuhan Embr io pada Tahap Per tumbuhan Planlet
Setelah melewati tahap perkecambahan, embrio dipindah ke media baru
dengan komposisi media perlakuan yang sama dengan tahap sebelumnya. Pada
tahap pembentukan planlet, embrio mengalami pertumbuhan dimana tonjolan
yang terbentuk pada tahap perkecambahan akan berkembang dan tumbuh
membentuk tunas dan akar. Pada tahap ini, embrio berkecambah dibelah untuk
a b c
d e
tunas akar
tunas
tunas tunas
tunas akar
memperoleh planlet dua lebih banyak dan ada yang dibiarkan utuh. Guna melihat
pengaruh berbagai macam media perlakuan pada 2 set percobaan terhadap
pertumbuhan embrio fase pertumbuhan planlet akan disajikan sebagai berikut.
a. Per cobaan I. Per anan BAP + IAA dan Air Kelapa pada Per tumbuhan Planlet Kelapa Kopyor Asal Embr io Utuh
Keberhasilan pembentukan tunas kelapa kopyor dapat diketahui dengan
mengukur panjang planlet, jumlah daun dan lebar daun. Namun, sampai tahap
pertumbuhan planlet, tunas mengalami pertumbuhan yang lambat sehingga
pengukuran jumlah daun dan lebar daun tidak dapat disajikan. Hasil analisis
ragam pada parameter panjang tunas pada umur 23 sampai 31 MSI menunjukkan
terdapat perbedaan nyata (disajikan pada tabel lampiran 24 - 33). Pada umur 23
MSI sampai 31 MSI terjadi perbedaan nyata dengan hasil lebih baik pada
perlakuan kontrol. Sementara itu, analisis ragam pada umur 13 MSI sampai 21
MSI menunjukkan tidak berbeda nyata (disajikan pada tabel lampiran 14 - 23).
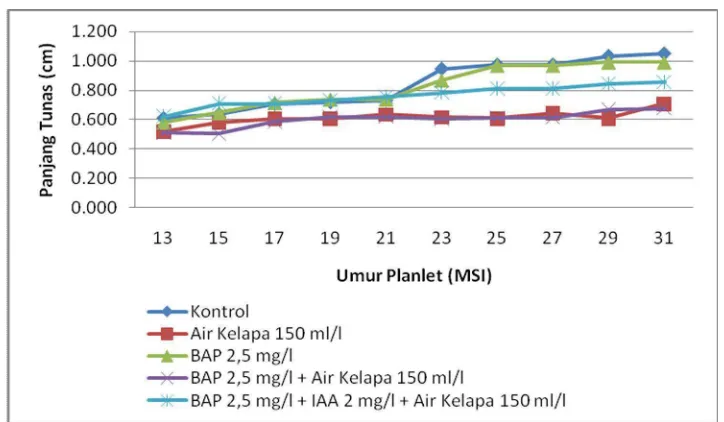
Pengaruh perlakuan terhadap rata-rata panjang tunas dengan interval pengamatan
setiap 2 minggu sekali, secara detail disajikan pada Tabel 7 dan Tabel 8.
Tabel 7. Rata-rata Panjang Tunas pada Berbagai Media Perlakuan Umur 13 - 21 MSI (Minggu Setelah Inokulasi)
Tabel 8. Rata-rata Panjang Tunas pada Berbagai Media Perlakuan umur 23 – 31 MSI (Minggu Setelah Inokulasi)
Perlakuan
Rata-rata Panjang Tunas (cm) Pada Umur
23 MSI 25 MSI 27 MSI 29 MSI 31 MSI
Kontrol 0.946 b 0.975 b 0.975 b 1.033 b 1.050 b
Air Kelapa 150 ml/l 0.617 a 0.609 a 0.645 a 0.609 a 0.710 a
BAP 2,5 mg/l 0.869 a 0.969 ab 0.969 ab 0.992 ab 0.992 ab
BAP 2,5 mg/l + Air Kelapa 150 ml/l 0.607 a 0.615 a 0.615 a 0.669 a 0.677 a
BAP 2,5 mg/l + IAA 2 mg/l + 0.782 a 0.809 a 0.809 a 0.845 a 0.855 a
Air Kelapa 150 ml/l
BNT 5% 0.33 0.32 0.31 0.36 0.36
Keterangan : Angka-angka yang didampingi huruf yang sama menunjukkan berbeda nyata pada uji BNT 5%
Gambar 6 menunjukkan bahwa perlakuan kontrol berpengaruh nyata (p =
0.05) terhadap pertumbuhan panjang tunas. Sampai akhir pengamatan, perlakuan
kontrol memberikan panjang tunas terpanjang yaitu 1,050 cm, diikuti oleh
perlakuan BAP 2,5 mg/l yaitu 0.992 cm. Perlakuan BAP 2,5 mg/l + Air Kelapa
150 ml/l menghasilkan panjan tunas terendah yaitu hanya 0.677 cm.