KUANTITATIF DENGAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Indah Kertawati
NIM : 098114039
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
KUANTITATIF DENGAN METODE DPPH
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat
Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh :
Indah Kertawati
NIM : 098114039
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
“ T a k e d ou bt s a n d m ock er y a s a l ev er a ge t o st r en gt h en ou r w i l l a n d f i gh t w i t h ou r best a bi l i t y . Pr ov e t o p eop l e t h a t a l l
d r ea m s ca n com e t r u e”
“Ja d i k an k er a gu a n d a n ejek an sebaga i ca m bu k u n t u k m em per k u a t t ek a d d a n p er j u an gk a n d en ga n segen ap k em am p u a n y a n g a d a , bu k t i k an sem u a m i m pi d ap a t m en j ad i k en y a t a a n ” . T i da k a d a m i m pi y a n g m u st a hi l , sel am a j a l an u n t u k m en ca p ai n y a m asu k ak a l (A n d r i e W on gso)
" I a m i s t he onl y one cr eat or f or my own s t or y. . . And My God i s my best Edi t or ”
(Sa t z ch y W a n g)
Ka r y a il mia h ini Sa Ya per semba hk a n k epa da : Papa, M ama, Adik, dan keluarga besar saya (Keluarga besar Tjia dan Hoo),
sebagai ungkapan rasa hormat dan bakt i saya.
v
Yang bertandatangan dibawah ini, saya mahasiswa Universitas Sanata
Dharma :
Nama : Indah Kertawati
NIM : 098114039
Demi pengembangan ilmu pengetahuan, saya memberikan kepada
Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul :
“UJI AKTIVITAS ANTIOKSIDAN EKSTRAK ETANOLIK BUNGA
MELINJO (Gnetum gnemon L.) SECARA KUALITATIF DAN
KUANTITATIF DENGAN METODE DPPH”
berserta perangkat yang diperlukan. Dengan demikian, saya memberikan kepada
Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan
dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data,
mendistribusikan secara terbatas, dan mempublikasikan di internet atau media lain
untuk kepentingan akademis tanpa perlu meminta izin maupun memberikan
royalty kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal 9 Juli 2013
Yang menyatakan,
vi
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas
berkat dan penyertaan-Nya sehingga penulis dapat menyelesaikan tugas akhir
yang berjudul “Uji Aktivitas Antioksidan Ekstrak Etanolik Bunga Melinjo (Gnetum gnemon L.) Secara Kualitatif dan Kuantitatif dengan Metode DPPH” dengan baik. Tugas akhir ini disusun untuk memenuhi salah satu syarat yang diwajibkan untuk memperoleh gelar Sarjana Strata 1 Program Studi Ilmu
Farmasi (S.Farm) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam menyelesaikan tugas akhir ini, penulis menyadari telah mendapat
banyak bantuan, bimbingan, dukungan, dan semangat dari berbagai pihak, baik
secara langsung maupun secara tidak langsung. Oleh karena itu, dengan segala
kerendahan hati penulis ingin mengucapkan terima kasih atas segala bantuan yang
telah diberikan kepada :
1. Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Yohanes Dwiatmaka, M.Si., selaku Dosen Pembimbing yang telah
memberikan banyak bantuan dan bimbingan kepada penulis mulai dari
saat penyusunan usulan tugas akhir, saat dilakukan penelitian, hingga
penyelesaian tugas akhir ini.
3. Prof. Dr. C. J. Soegihardjo, Apt., selaku Dosen Penguji yang telah
memberikan kritik dan saran yang membangun dalam penyusunan
vii
memberikan banyak masukan, kritik dan saran dalam penulisan tugas
akhir ini.
5. Segenap laboran Laboratorium Farmakognosi Fitokimia, Laboratorium
Botani Farmasi, Laboratorium Mikrobiologi, Laboratorium Kebun
Tanaman Obat, dan Laboratorium Kimia Analisis Instrummental, atas
segala bantuan selama penulis melakukan penelitian di labotatorium.
6. Segenap Dosen dan karyawan Fakultas Farmasi Universitas Sanata
Dharma.
7. Martina Sipayung, sebagai sahabat dan rekan satu tim yang berjuang
bersama dalam pengerjaan tugas akhir ini.
8. Sartika Laraswati, sebagai adik, motivator, dan orang terpenting bagi
penulis yang selalu mendorong dan memberi semangat sehingga tugas
akhir ini dapat diselesaikan dengan baik.
9. Kakak Wang Mei Hua, sebagai kakak, sahabat, dan motivator terbaik
yang penulis miliki. Terima kasih atas segala dukungan, semangat dan
perhatian yang telah diberikan.
10. Ahn Chil Hyun, sebagai inspirator dan kekuatan terbesar bagi penulis
yang telah memberikan banyak inspirasi, motivasi dan semangat bagi
penulis.
11. Tante Hoo I Ing dan Hoo Kim Lan yang telah banyak memberikan
dukungan materil dan moril selama penulis menempuh pendidikan di
viii
terbaik yang penulis miliki. Terima kasih atas segala dukungan, semangat
dan kebersamaan yang selama ini kita lewati dalam menghadapi suka
duka dikehidupan universitas ini.
13. Semua pihak yang telah memberikan dukungan dan bantuan yang tidak
dapat disebutkan satu-persatu.
Penulis menyadari bahwa dalam penyelesaian tugas akhir ini masih
terdapat banyak kekurangan. Oleh karena itu, dengan segala kerendahan hati
penulis memohon maaf apabila terdapat hal-hal yang kurang berkenan, tidak lupa
Penulis juga mengharapkan kritik dan saran yang membangun.
Akhir kata penulis berharaap tugas akhir ini dapat bermanfaat untuk
berbagai pihak yang membutuhkan dan menjadi sumbangan bagi ilmu
pengetahuan.
Yogyakarta, Juli 2013
Penulis
ix
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini
tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila dikemudian hari ditemukan indikasi plagiarisme dalam naskah ini,
maka saya bersedia menanggung segala sanksi sesuai peraturan
x
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS ... v
KATA PENGANTAR ... vi
PERNYATAAN KEASLIAN KARYA ... ix
DAFTAR ISI ... x
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvii
DAFTAR LAMPIRAN ... xi
INTISARI ... xx
ABSTRACT ... xxi
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 4
C. Keaslian Penelitian ... 4
D. Manfaat Penelitian ... 5
E. Tujuan Penelitian ... 6
xi
1. Keterangan botani ... 7
2. Deskripsi tanaman ... 7
3. Kandungan kimia melinjo ... 8
4. Kegunaan melinjo ... 8
B. Senyawa Fenolik ... 9
C. Antioksidan ... 11
1. Radikal bebas ... 11
2. Definisi antioksidan ... 12
3. Mekanisme antioksidan ... 13
4. Manfaat antioksidan ... 15
5. Metode pengujian aktivitas antioksidan ... 15
a. Kromatografi lapis tipis ... 16
b. Spektrofotometri visibel ... 20
D. Metode 1,1-Dyphenyl-2-Pycrylhydrazyl (DPPH) ... 23
E. Ekstraksi ... 25
F. Skrining fitokimia ... 29
1. Alkaloid ... 29
2. Flavonoid ... 29
3. Saponin ... 30
4. Tanin ... 30
5. Triterpenoid dan steroid ... 31
xii
2. Presisi ... 32
3. Linearitas ... 33
4. Spesifisitas ... 33
H. Landasan Teori ... 34
I. Hipotesis ... 35
BAB III METODOLOGI PENELITIAN ... 36
A. Jenis dan Rancangan Penelitian ... 36
B. Variabel ... 36
C. Definisi Oprasional ... 36
D. Bahan dan Alat Penelitian ... 37
1. Bahan penelitian ... 37
2. Alat penelitian ... 37
E. Tata Cara Penelitian ... 38
1. Determinasi tanaman ... 38
2. Pengumpulan bahan ... 38
3. Pembuatan serbuk simplisia ... 38
4. Pembuatan ekstrak etanolik bunga melinjo ... 39
5. Pembuatan larutan DPPH, pembanding, dan uji ... 39
6. Skrining fitokimia ... 40
7. Uji kualitatif DPPH dengan Kromatografi Lapis Tipis ... 43
8. Uji kuantitatif DPPH dengan spektrofotometri visibel ... 45
xiii
BAB IV HASIL DAN PEMBAHASAN ... 48
A. Hasil Determinasi Tanaman ... 48
B. Hasil Pengumpulan Sampel ... 48
C. Hasil Preparasi Sampel ... 51
1. Pembuatan serbuk simplisia bunga melinjo ... 51
2. Pembuatan ekstrak etanolik bunga melinjo ... 53
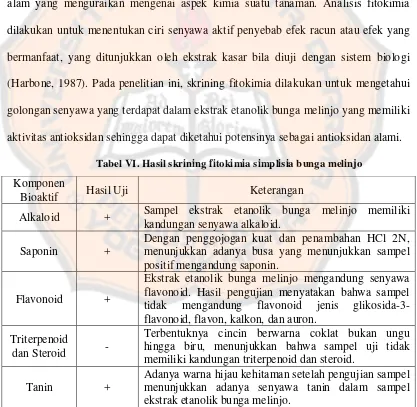
D. Hasil Skrining Fitokimia ... 56
1. Pengujian alkaloid ... 57
2. Pengujian saponin ... 59
3. Pengujian flavonoid ... 61
4. Pengujian triterpenoid dan steroid ... 63
5. Pengujian tanin ... 63
E. Hasil Uji Kualitatif Aktivitas Antioksidan Ekstrak Etanolik Bunga Melinjo ... 68
1. Hasil identifikasi golongan flavonoid ... 70
2. Hasil identifikasi golongan tanin ... 72
F. Hasil Uji Kuantitatif ... 76
1. Uji pendahuluan aktivitas antioksidan ... 76
2. Penentuan Operating Time (OT) ... 77
3. Penentuan panjang gelombang serapan maksimum (λmaks) ... 79
4. Hasil validasi metode analisis pengujian aktivitas antioksidan ... 80
xiv
c. Linearitas ... 86
d. Spesifisitas ... 87
G. Hasil uji aktivitas antioksidan dengan metode DPPH ... 88
BAB V SARAN DAN KESIMPULAN ... 95
A. Saran ... 95
B. Kesimpulan ... 95
DAFTAR PUSTAKA ... 96
LAMPIRAN ... 102
xv
Halaman
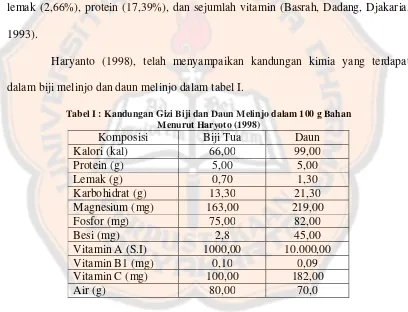
Tabel I. Kandungan gizi biji dan daun melinjo dalam 100 g
bahan (Haryoto, 1998) ... 8
Tabel II. Parameter-parameter aplikasi penotolan sampel yang
direkomendasikan (Adamovies, 1997) ... 18
Tabel III. Tingkat kekuatan antioksidan dengan metode DPPH ... 25
Tabel IV. Kriteria nilai akurasi yang masih dapat diterima
(APVMA 2004) ... 32
Tabel V. Kriteria nilai presisi yang masih dapat diterima
(APVMA 2004) ... 33
Tabel VI. Hasil skrining fitokimia simplisia bunga melinjo ... 56
Tabel VII. Hasil deteksi bercak dengan menggunakan sistim KLT
menggunakan beberapa eluen ... 73
Tabel VIII. Hasil scanning panjang gelombang maksimum DPPH ... 80
Tabel IX. Hasil pengukuran absorbansi seri baku rutin yang sudah
direaksikan dengan radikal DPPH ... 81
Tabel X. Hasil pengukuran absorbansi seri ekstrak etanolik bunga
melinjo yang sudah direaksikan dengan radikal DPPH ... 82
Tabel XI. Hasil % Recovery, SD, dan % CV uji aktivitas
antioksidan rutin ... 84
Tabel XII. Hasil % Recovery, SD, dan % CV uji aktivitas
xvi
dengan metode DPPH ... 91
Tabel XIV. Hasil aktivitas antioksidan ekstrak etanolik bunga
melinjo dengan metode DPPH ... 91
Tabel XV. Hasil perhitungan IC50 rutin dan ekstrak etanolik
bunga melinjo ... 92
Tabel XVI. Tingkat kekuatan antioksidan senyawa uji dengan
xvii
Halaman
Gambar 1. Struktur kimia rutin ... 11
Gambar 2. Perubahan warna larutan pada reaksi radikal DPPH dengan antioksidan (Witt, Lalk, Hager, dan Voigt, 2010) ... 24
Gambar 3. Reaksi uji mayer ... 57
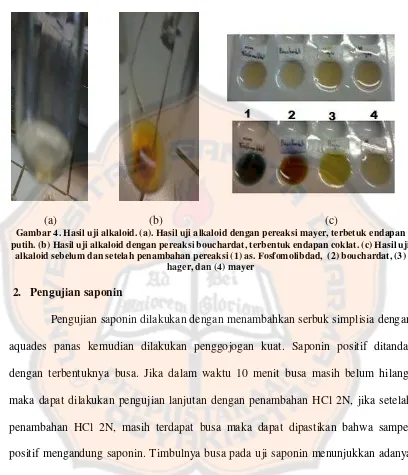
Gambar 4. Hasil uji alkaloid ... 59
Gambar 5. Reaksi hidrolisis saponin dalam air ... 60
Gambar 6. Hasil uji saponin ... 60
Gambar 7. Hasil uji flavonoid ... 62
Gambar 8. Hasil uji triterpenoid dan steroid ... 63
Gambar 9. Hasil uji tanin dengan menggunakan larutan besi (III) amonium sulfat ... 64
Gambar 10. Hasil uji tanin dengan menggunakan FeCl3 1% ... 65
Gambar 11. Hasil uji tanin dengan menggunakan larutan gelatin 1% ... 66
Gambar 12. Hasil uji penggolongan senyawa tanin ... 68
Gambar 13. Kromatogram KLT uji kualitatif antioksidan ... 70
Gambar 14. Kromatogran KLT identifikasi senyawa flavonoid ... 71
Gambar 15. Kromatogram KLT identifikasi senyawa tanin ... 75
Gambar 16. Hasil uji pendahuluan aktivitas antioksidan ... 77
Gambar 17. Grafik hasil penentuan OT rutin ... 78
Gambar 18. Grafik hasil penentuan OT ekstrak etanolik bunga melinjo ... 78
xviii
dengan aktivitas antioksidannya ... 83
Gambar 21. Reaksi terbentuknya warna kuning oleh
senyawa antioksidan ... 90
xix
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman melinjo ... 102
Lampiran 2. Gambar bunga melinjo dari daerah Ambal Kabupaten Kebumen ... 103
Lampiran 3. Perhitungan rendemen ... 103
Lampiran 4. Data penimbangan uji kualitatif aktivitas antioksidan ... 104
Lampiran 5. Data penimbangan pereaksi semprot ... 105
Lampiran 6. Data penimbangan bahan untuk uji antioksidan ... 106
Lampiran 7. Data perhitungan konsentrasi larutan DPPH, larutan uji, dan larutan pembanding ... 107
Lampiran 8. Scanning pengkoreksi ... 119
Lampiran 9. Optimasi metode uji aktivitas antioksidan ... 110
Lampiran 10. Uji aktivitas antioksidan menggunakan radikal DPPH ... 112
Lampiran 11. Perhitungan nilai IC50 ekstrak etanolik bunga melinjo dan rutin ... 113
xx INTISARI
Antioksidan merupakan suatu senyawa yang dapat menetralkan efek buruk dari radikal bebas. Senyawa fenolik dan flavonoid merupakan sumber antioksidan alami yang biasanya terdapat pada tumbuhan. Melinjo merupakan salah satu tumbuhan yang banyak dikonsumsi oleh masyarakat sebagai makanan sehari-hari. Oleh karena itu perlu dilakukan penelitian untuk mengetahui kandungan senyawa aktif yang terdapat dalam bunga melinjo dan melakukan pengujian aktivitas antioksidan untuk mengetahui kemampuan ekstrak etanolik bunga melinjo dalam melawan radikal bebas sebagai antioksidan alami.
Uji pendahuluan dilakukan dengan cara skrining fitokimia, dilakukan untuk mengetahui senyawa aktif yang terdapat dalam sampel bunga melinjo. Pengujian aktivitas antioksidan bunga melinjo (Gnetum gnemon L.) dilakukan secara kualitatif (secara KLT) maupun kuantitatif (menggunakan spektrofotometri visibel) menggunakan radikal 1,1-difenil-2-pikrilhidrazil (DPPH). Prinsip metode ini adalah penurunan intensitas warna atau absorbansi larutan DPPH yang sebanding dengan kenaikan konsentrasi senyawa antioksidan. Hasilnya dinyatakan dengan nilai
Inhibition Concentration 50 (IC50) yang menunjukkan konsentrasi suatu senyawa antioksidan yang menghasilkan penangkapan 50% radikal DPPH. Hasil uji pendahuluan (skrining fitokimia) dalam penelitian ini menunjukkan bahwa sampel bunga melinjo mengandung senyawa saponin, alkaloid, tanin, dan flavonoid yang dapat berpotensi sebagai antioksidan alami. Hasil uji kualitatif dengan menggunakan DPPH menunjukkan bahwa sampel ekstrak etanolik bunga melinjo memiliki aktivitas antioksidan yang ditunjukkan dengan adanya warna kuning pada pelat KLT setelah direaksikan dengan DPPH. Hasil uji kuantitatif dalam penelitian ini menunjukkan bahwa ekstrak etanolik bunga melinjo memiliki aktivitas antioksidan yang lemah dengan IC50 sebesar 257,25 ± 0,35 µg/mL.
xxi ABSTRACT
Antioxidants are compounds that can neutralize the effects of free radicals in human body. Phenolic and flavonoid are antioxidants that are found in plants. Melinjo is a one of plants that the flosses are consumed by people as a daily food. Therefore, it was necessary to investigate the active compounds of Melinjo floss and done some antioxidant activities test to find out the cability of ethanolic extract of melinjo floss as a natural antioxidant to against free radical activity.
The first test that was conducted in the research was the phytochemical screening, the purpose of this test was to find out the active compounds that contained in the melinjo floss extract. Antioxidant activity test of melinjo floss was performed in qualitative (using TLC system) and quantitative (using visible spectrophotometry) assays using 1,1-Diphenyl-2-Picrylhydrazyl (DPPH) radical. The principle of the method is the reduction of color intensity or absorbance of DPPH solution which is proportional to the increasing of the concentration of antioxidant. The result was referred by Inhibition concentration 50 (IC50) level which indicated the concentration of an antioxidant activity that produces 50% arrest of DPPH radical. The result of Phytochemical screening test showed that ethanolic extract of melinjo floss contain of tannin, saponin, alkaloid, and flavonoid. The compounds is potential as an antioxidant. Qualitative assay using DPPH method showed that ethanolic extract of melinjo floss has an antioxidant activity which is indicated by yellow color on TLC plates after sprayed with DPPH solution. The result of quantitative assay showed that ethanolic extract of melinjo floss was had a weak antioxidant activity with IC50 is 257,25 ± 0,35 µg/mL.
1 BAB I
PENGANTAR
A. Latar Belakang
Tanpa disadari, dalam kehidupan sehari-hari tubuh manusia tidak dapat
terbebas dari pengaruh radikal bebas. Secara alami, radikal bebas sudah terbentuk di
dalam tubuh melalui berbagai mekanisme kompleks. Radikal bebas yang terbentuk
ini merupakan hasil sampingan dari proses oksidasi, atau pembakaran sel pada saat
bernafas, olahraga yang berlebihan, peradangan, atau ketika tubuh berhadapan
dengan lingkungan di luar tubuh seperti polusi lingkungan, radiasi matahari, asap
kendaraan bermotor, asap rokok, dan berbagai bentuk polusi lainnya (Syah, 2005).
Radikal bebas merupakan suatu atom atau molekul yang sangat reaktif dan
tidak stabil. Ketidakstabilan ini dapat terjadi karena dalam molekul radikal bebas
terdapat satu atau lebih elektron yang tidak berpasangan pada orbital terluarnya.
Untuk menjadi stabil, elektron-elektron yang tidak berpasangan ini akan berinteraksi
dengan molekul di sekitarnya untuk memperoleh pasangan elektron, reaksi ini
kemudian akan memicu timbulnya berbagai reaksi berantai yang akan mengakibatkan
timbulnya kerusakan jaringan (Elfita, Bahti, dan Dachriyanus, 2006). Radikal bebas
yang terdapat di dalam tubuh diketahui mampu memicu timbulnya berbagai penyakit
degeneratif, seperti kardiovaskuler dan penuaan dini (Palmer dan Kitchin, 2010).
Secara normal, radikal bebas yang ada di dalam tubuh akan dinetralisir oleh
masalah jika kadar radikal bebas terlalu tinggi dan kemampuan antioksidan alami
tubuh tidak memadai untuk menetralisir radikal bebas tersebut. Keadaan ini akan
memicu timbulnya ketidakseimbangan antara kadar radikal bebas dan kadar
antioksidan di dalam tubuh (Harjanto, 2004). Salah satu solusi yang dapat dilakukan
untuk meningkatkan jumlah antioksidan di dalam tubuh adalah dengan memberikan
asupan antioksidan yang berasal dari luar tubuh (eksogen) (Pangkalan, 2008).
Antioksidan merupakan suatu senyawa yang dapat menetralkan efek buruk
dari radikal bebas yang berada di dalam tubuh. Kegunaan utama dari antioksidan
adalah untuk menghentikan atau memutus reaksi berantai dari radikal bebas dengan
cara menyediakan dirinya untuk bereaksi dengan radikal bebas itu sendiri, dengan
demikian dapat dikatakan bahwa antioksidan dapat menyelamatkan sel-sel tubuh dari
kerusakan akibat serangan radikal bebas (Putra dan Verawati, 2011). Berdasarkan
sumbernya terdapat 2 macam antioksidan yaitu antioksidan alami dan antioksidan
sintetik (Dalimarta dan Sudibyo, 1999). Saat ini antioksidan alami yang berasal dari
buah dan sayuran lebih diminati dibandingkan dengan antioksidan sintetik karena
dinilai lebih aman dan memiliki efek samping yang lebih rendah dibandingkan
dengan antioksidan sintetik. Antioksidan sintetik seperti BHT (Butylated Hidroxy
Toluene) dan BHA (Butylated Hidroxy Anisole) telah diragukan keamanannya karena
memiliki efek samping yang dapat menyebabkan kerusakan hati (Rohdiana, 2001;
Sunarni, 2005). Hal inilah yang memicu timbulnya penelitian-penelitian dan
Salah satu sumber antioksidan alami dapat berasal dari tanaman melinjo. Di
dalam biji dan daun tanaman melinjo terdapat kandungan flavonoid, tanin, dan
saponin yang telah diketahui bahwa golongan senyawa tersebut memiliki aktivitas
antioksidan. Dalam kehidupan sehari-hari tanaman melinjo biasanya dikonsumsi
masyarakat sebagai sayuran atau diolah menjadi berbagai produk makanan lain.
Selain dikonsumsi sebagai sayur, tanaman melinjo juga diketahui memiliki beberapa
manfaat dalam bidang pengobatan, diantaranya digunakan sebagai peluruh air
kencing (diuretik), pengobatan untuk penyakit mata, anemia, dan busung lapar
(Hariana, 2008). Karena tanaman melinjo merupakan tamanan yang banyak
dikonsumsi oleh masyarakat sebagai makanan sehari-hari, sehingga diharapkan
konsumsi tanaman melinjo dapat menjadi sumber antioksidan alami bagi masyarakat.
Pengujian antioksidan yang dilakukan dalam penelitian ini menggunakan
prinsip penangkapan radikal bebas dengan metode DPPH
(1,1-difenil-2-pikrilhidrazil) baik secara kualitatif maupun kuantitatif. Bedasarkan metode ini,
pengujian secara kualitatif untuk mengetahui ada tidaknya senyawa antioksidan
dalam suatu senyawa dilakukan dengan menggunakan prinsip Kromatografi Lapis
Tipis (KLT). Teknik kromatografi lapis tipis ini banyak digunakan untuk
mengidentifikasi senyawa-senyawa kimia karena murah, sederhana, serta dapat
menganalisis beberapa komponen secara serempak (Hernani 1999). Uji kuantitatif
yang dilakukan dalam penelitian ini bertujuan untuk melihat kemampuan antioksidan
suatu senyawa yang dinyatakan oleh nilai IC50. IC50 merupakan parameter konsentrasi
karena sederhana, cepat, sensitif, reprodusibel, dan paling sering digunakan pada
pengujian antioksidan ekstrak tanaman (Shivaprasad, Mohan, Kharya, Shiradkar, and
Lakshman, 2005; Savatovic, Cetkovic, Canadanovic-Brunet, and Djilas, 2012).
B. Perumusan Masalah
1. Golongan senyawa apa saja yang terdapat di dalam ekstrak etanolik bunga melinjo
yang teridentifikasi melalui uji skrining fitokimia?
2. Apakah ekstrak etanolik bunga melinjo mengandung senyawa antioksidan yang
teramati melalui uji KLT?
2. Berapakah nilai IC50 ekstrak etanolik bunga melinjo terhitung melalui metode
DPPH?
C. Keaslian Penelitian
Sejauh pengamatan penulis, penelitian mengenai aktivitas antioksidan yang
telah dilakukan dengan menggunakan bahan melinjo antara lain:
Penelitian mengenai aktivitas antioksidan dan antimikroba ekstrak melinjo terhadap
mikroba pembusuk.
Di dalam penelitian tersebut, bagian tanaman melinjo yang digunakan
adalah akar, batang, daun, biji, dan pulp biji yang diekstrak menggunakan pelarut
etanol. Analisis yang dilakukan meliputi uji total fenol dengan metode
Folin-Ciocalteu, aktivitas antioksidan menggunakan metode DPPH dan uji aktivitas
Uji aktivitas antioksidan yang dilakukan pada penelitian ini berbeda dengan
penelitian sebelumnya. Perbedaan terletak pada sampel yang digunakan, yaitu ekstrak
etanolik bunga melinjo. Selain itu, penelitian ini juga menggunakan metode kualitatif
yang tidak dilakukan pada penelitian sebelumnya. Sejauh pengamatan penulis, uji
aktivitas antioksidan ekstrak etanolik bunga melinjo secara kualitatif dan kuantitatif
dengan metode DPPH belum pernah dilakukan.
D. Manfaat Penelitian
1. Manfaat teoretis
Penelitian ini diharapkan dapat memberikan pengetahuan dan bukti ilmiah
mengenai aktivitas antioksidan bunga melinjo dengan menggunakan radikal bebas
DPPH.
2. Manfaat metodologis
Penelitian ini diharapkan dapat memberikan pengetahuan mengenai tatacara
pengujian aktivitas antioksidan bunga melinjo secara kualitatif dan kuantitatif dengan
metode DPPH.
3. Manfaat praktis
Penelitian ini diharapkan dapat memberikan informasi mengenai aktivitas
antioksidan bunga melinjo, dalam penangkapan radikal bebas sehingga dapat
E. Tujuan Penelitian
1. Tujuan umum
Penelitian ini bertujuan untuk mengetahui potensi dan aktivitas antioksidan
ekstrak etanolik bunga melinjo.
2. Tujuan khusus
a. Mengetahui golongan senyawa yang terdapat di dalam ekstrak etanolik bunga
melinjo.
b. Mengetahui golongan senyawa dalam ekstrak etanolik bunga melinjo yang
berperan sebagai antioksidan.
c. Mengetahui aktivitas antioksidan ekstrak etanolik bunga melinjo dengan
7 BAB II
PENELAAHAN PUSTAKA
A.Melinjo
1. Keterangan botani
Melinjo (Gnetum gnemon L.) termasuk dalam famili Gnetaceae (Elevitch,
dan Craig, 2006). Memiliki sinonim : G. gnemon var. sylvistris L., G. acutatum Miq.,
G. gnemon var. ovalifolium (Poir.) Blume, G. vinosum Elmer (Elevitch, dan Craig,
2006).
Nama daerah, diantaranya : Sunda: ki tangkil, mlinjo, sake, tangkil. Jawa:
bagu, eso malinjo, trangkil, witgrintul. Aceh : mulieng. Belitung : manenjo, maninjo.
Makasar : bagu, poko sumba (Hariana, 2008).
Common name : Filipina :bago. Salomon Islands :dae, daefasia, daemalefo.
Inggris :gnetum, joint fir, Spanish joint fir, two leaf. Malaysia :maninjau. Singapura
: melindjo. Fiji : sikau, sukau, sukau buli, sukau motu. Kamboja : voe, khalet
(Elevitch, dan Craig, 2006).
2. Deskripsi tanaman
Pohon melinjo dapat tumbuh hingga 10-15 m. Daun tanaman melinjo
berwarna hijau gelap, mengkilap, halus, tajam pada kedua ujungnya. Berbentuk bulat
panjang, lanset dan bulat telur, memiliki panjang 10-20 cm dan lebar 4-7 cm.
Memiliki bunga jantan dan bunga betina. Buah berwarna kuning atau kuning
cm. Kulit batang berwarna abu-abu dan memiliki akar tunggang yang kuat (Elevitch,
dan Craig, 2006).
3. Kandungan kimia melinjo
Di dalam daun melinjo terdapat kandungan saponin, dan flavonoid,
sedangkan bijinya mengandung tanin, flavonoid, dan saponin (Hariana, 2008).
Kandungan gizi dari buah melinjo tua antara lain terdiri dari karbohidrat (63,23%),
lemak (2,66%), protein (17,39%), dan sejumlah vitamin (Basrah, Dadang, Djakaria,
1993).
Haryanto (1998), telah menyampaikan kandungan kimia yang terdapat
dalam biji melinjo dan daun melinjo dalam tabel I.
Tabel I : Kandungan Gizi Biji dan Daun Melinjo dalam 100 g Bahan Menurut Haryoto (1998)
Magnesium (mg) 163,00 219,00
Fosfor (mg) 75,00 82,00
Hampir seluruh tanaman melinjo dapat dimanfaatkan. Daun muda, bunga,
masyarakat. Semua bahan makanan yang berasal dari tanaman melinjo memiliki
kandungan gizi yang cukup tinggi, selain karbohidrat juga mengandung lemak,
protein, mineral, dan vitamin-vitamin (Sunanta, 1994). Bagian daun muda, buah yang
masih muda, dan bunga dimanfaatkan sebagai bahan sayuran oleh masyarakat. Daun
melinjo yang masih muda sangat baik untuk kesahtan mata karena memiliki
kandungan vitamin A yang sangat tinggi, yakni 10.000 S.I tiap 100 g bahan. Jumlah
tersebut sedikit dibawah kandungan vitamin A pada wortel (12000 S.I) (Haryoto,
1998).
Selain itu, melinjo juga memiliki manfaat dalam bidang pengobatan
tradisional. Kulit buah, buah, biji dan daun melinjo diketahui berkhasiat untuk
meluruhkan air seni, menyembuhkan penyakit pada mata, anemia, dan busung lapar
(Winarto, 2004). Tanaman melinjo juga dipercaya dapat digunakan untuk
meningkatkan daya tahan tubuh dan sebagai antimikroba alami (Anonim, 2010).
B. Senyawa Fenolik
Senyawa fenolik merupakan suatu substansi organik yang terdiri dari
senyawa aromatik yang terikat dengan satu atau lebih substituen hidroksil (OH).
Senyawa induknya adalah fenol, tetapi kebanyakan senyawa fenolik merupakan
polifenol. Sumber senyawa fenolik sangat mudah dijumpai pada berbagai tanaman
tetapi sangat jarang dijumpai pada hewan. Diantara berbagai golongan senyawa
golongan senyawa flavonoid (Mann, Davidson, Hobbs, Banthorpe, dan Harbone,
1994).
Senyawa fenolik merupakan sumber antioksidan alami yang aman
digunakan sehingga dapat berpotensi sebagai antioksidan alami bagi tubuh manusia.
Aktivitas antioksidan dari senyawa fenolik didapatkan dengan cara mereduksi radikal
untuk mencegah terjadinya reaksi samping yang merugikan. Mekanisme kerjanya
yaitu melalui kemampuan gugus fenol menangkap radikal bebas dengan berperan
sebagai donor hidrogen melalui proses transfer elektron, sehingga senyawa fenolik
berubah menjadi radikal fenoksil. Radikal fenoksil ini terstabilkan oleh adanya efek
resonansi (Bruneton, 1999; Marxen, Vanselow, Lippemeier, Hintze, Ruser, dan
Hansen, 2007). Senyawa fenolik dalam tumbuhan dapat berupa fenol sederhana,
antrakuinon, asam fenolat, kumarin, flavonoid, lignin, dan tanin (Harbone, 1987).
Flavonoid merupakan golongan terbanyak dari senyawa fenolik. Hal ini
karena flavonoid mempunyai sejumlah gugus hidroksil yang tak tersulih, atau suatu
gula, flavonoid bersifat polar. Pada umumnya flavonoid larut dalam pelarut polar
seperti etanol, butanol, aseton, dimetilsulfoksida, dimetilformamida, air dan lain-lain
(Markham, 1988).
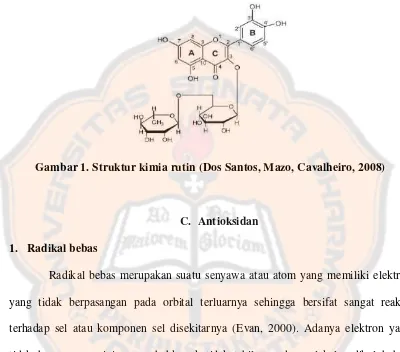
Salah satu senyawa fenolik yang sering diteliti adalah rutin, oleh karena itu
rutin sering digunakan sebagai pembanding dalam pengujian aktivitas antioksidan
bahan alam karena telah banyak diteliti mengenai aktivitas antioksidannya (Armala,
2009; Sunardi, 2007). Rutin (3’,4’,5,7-tetrahidroksiflavon-3β-D-rutinosida) atau
Gugus O-dihidroksi pada cincin B, diasosiasikan dengan aktivitas antioksidan rutin
(Lopez, Martinez, Del-Valle, Ferrit, dan Luque, 2003).
Gambar 1. Struktur kimia rutin (Dos Santos, Mazo, Cavalheiro, 2008)
C. Antioksidan
1. Radikal bebas
Radikal bebas merupakan suatu senyawa atau atom yang memiliki elektron
yang tidak berpasangan pada orbital terluarnya sehingga bersifat sangat reaktif
terhadap sel atau komponen sel disekitarnya (Evan, 2000). Adanya elektron yang
tidak berpasangan ini, menyebabkan ketidakstabilan pada molekul radikal bebas.
Untuk menjadi stabil, radikal bebas yang bersifat sangat reaktif akan menyerang dan
mengikat elektron dari molekul di sekitarnya. Target utama dari radikal bebas adalah
protein, asam lemak tak jenuh, lipoprotein, serta unsur DNA termasuk karbohidrat.
Dari molekul-molekul target tersebut, yang paling rentan terhadap serangan radikal
bebas adalah asam lemak tak jenuh. Senyawa radikal bebas yang terdapat di dalam
dinding sel manjadi rapuh, merusak basa DNA sehingga mengacaukan sistim
genetika, dan berlanjut pada pembentukan sel kanker (Winarsi, 2007).
Berdasarkan jenisnya, terdapat beberapa tipe radikal bebas di dalam tubuh.
Radikal bebas terpenting yang terdapat di dalam tubuh adalah radikal derivat dari
oksigen yang disebut kelompok oksigen reaktif (reactive oxygen species /ROS).
Selain itu juga terdapat radikal bebas yang mengandung karbon (CCL3-) yang berasal
dari oksidasi radikal molekul organik, radikal yang mengandung hidogen dari hasil
penyerangan atom H, radikal yang mengandung sulfur yang diproduksi pada oksidasi
glutation menghasilkan radikal thiyl, dan ditemukan juga radikal yang mengandung
nitrogen (Arief, 2006).
Radikal bebas yang ada di dalam tubuh manusia dapat berasal dari 2 sumber
yaitu endogen dan eksogen. Radikal bebas dari sumber endogen merupakan radikal
bebas yang berasal dari dalam tubuh manusia itu sendiri misalnya melalui proses
autoksidasi (produk dari proses metabolisme aerobik), oksidasi enzimatik, dan
respiratory brust (terminologi yang digunakan untuk menggambarkan proses dimana
sel fagositik menggunakan oksigen dalam jumlah besar selama fagositosis).
Sedangkan radikal bebas yang berasal dari sumber eksogen merupakan radikal bebas
yang berasal dari luar tubuh manusia itu sendiri, misalnya dapat berasal dari
obat-obatan, radiasi, dan asap rokok (Arief, 2006).
2. Antioksidan
Antioksidan merupakan senyawa yang berperan dalam menghambat oksidasi
dalam pertahanan tubuh terhadap penyakit, hal ini disebabkan karena senyawa
antioksidan mampu mencegah pengaruh buruk yang disebabkan oleh radikal bebas
(Percival, 1998). Antioksidan dapat menghambat oksigen reaktif atau nitrogen reaktif
dan juga radikal bebas (Anshory, 2006). Antioksidan juga merupakan senyawa
pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul
yang kecil tetapi mampu menginaktivasi berkembangnya reaksi oksidasi, dengan cara
mencegah terbentuknya radikal. Antioksidan dapat menghambat reaksi oksidasi
dengan mengikat radikal bebas, sehingga kerusakan sel dapat dihambat (Winarsi,
2007). Secara umum, antioksidan dapat didefinisikan sebagai senyawa yang melawan
oksidasi atau menghambat reaksi yang dipicu oleh oksigen atau peroksida (Huang,
Ou, Prior, 2005). Berdasarkan sumbernya terdapat 2 macam antioksidan yaitu
antioksidan alami dan antioksidan sintetik (Dalimarta dan Sudibyo, 1999). Saat ini,
antioksidan alami yang berasal dari buah dan sayuran lebih diminati dibandingkan
dengan antioksidan sintetik yang berasal dari hasil sintesis reaksi kimia. Hal ini
karena antioksidan alami dinilai lebih aman dan memiliki efek samping yang lebih
rendah jika dibandingkan dengan antioksidan sintetik (Rohdiana, 2001; Sunarni,
2005). Beberapa contoh antioksidan sintetik yang telah digunakan secara luas oleh
masyarakat antara lain Butil Hidroksi Anisol (BHA), Butil Hidroksi Toluen (BHT),
propel galat, tert-Butil Hidroksi Quinon (tBHQ) (Fouad, 2005).
3. Mekanisme antioksidan
Secara garis besar, mekanisme kerja antioksiadan dalam menangkal radikal
non-enzimatik. Antioksidan enzimatik secara alami dihasilkan oleh tubuh, sedangkan
antioksidan non-enzimatik diperoleh dari luar tubuh. Antioksidan enzimatik terdiri
dari superoxide dismutase (SOD), katalase, glutathione peroxidase, dan antioksidan
jenis lain seperti retinoid dan albumin (Fouad, 2005).
Secara non-enzimatik, senyawa antioksidan bekerja dengan empat cara yaitu
sebagai berikut :
a. Penangkap radikal bebas, misalnya vitamin C dan vitamin E
b. Pengkelat logam transisi misalnya EDTA
c. Inhibitor enzim oksidatif, misalnya aspirin dan ibuprofen.
d. Kofaktor enzim antioksidan, misalnya selenium sebagai kofaktor glutation
peroksidase (Huang et al.,2005).
Aktivitas senyawa polifenol (flavonoid) sebagai antioksidan meliputi tiga
mekanisme sebagai berikut :
a. Aktivitas penangkapan radikal bebas seperti Reactive Oxygen Species (ROS)
ataupun radikal yang dihasilkan dari peroksidasi lipid dengan proses transfer
elektron melalui atom hidrogen.
b. Mencegah spesies senyawa reaktif produksi katalisis transisi metal seperti reaksi
melalui khelasi metal.
c. Interaksi dengan antioksidan lainnya, seperti lokalisasi dan penggabungan
dengan antioksidan lainnya (Niki dan Noguchi, 2000).
4. Manfaat antioksidan
Kegunaan utama dari antioksidan adalah untuk menghentikan atau
memutuskan reaksi berantai dari radikal bebas dengan cara menyediakan dirinya
untuk bereaksi dengan radikal bebas (Putra dkk, 2011).
Selain itu, antioksidan bermanfaat dalam mencegah kerusakan oksidatif
yang disebabkan oleh radikal bebas dan ROS sehingga mencegah timbulnya berbagai
penyakit seperti penyakit kardiovaskuler, kanker, katarak, penurunan fungsi syaraf,
serta penuaan dini (Mbata, 2010).
5. Metode pengujian aktivitas antioksidan
Terdapat beberapa metode yang dapat digunakan dalam pengujian aktivitas
antioksidan, baik secara kualitatif maupun kuantitatif. Uji kualitatif bertujuan untuk
mengetahui apakah suatu senyawa memiliki aktivitas antioksidan. Uji kualitatif ini
dapat dilakukan dengan metode kromatografi lapis tipis atau kromatografi kertas.
Metode pengujian dengan kromatografi lapis tipis dapat digunakan untuk
memisahkan campuran antioksidan yang kompleks sekalipun.
Uji aktivitas antioksidan juga dapat dilakukan secara kuantitatif, yaitu
dengan menggunakan spektrofotometri. Beberapa metode yang digunakan untuk uji
aktivitas antioksidan secara kuantitatif antara lain : metode conjugated diene, metode
penangkapan radikal hidroksil, metode Ferric Reducing Ability of Plasma (FRAP),
metode Trapping Antioxidant Parameter (TRAP), dan metode DPPH (Shivaprasad,
a. Kromatografi Lapis Tipis. Kromatografi lapis tipis merupakan salah satu
bentuk kromatografi planar. Fase diam pada kromatografi lapis tipis berupa lapisan
yang seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng
kaca, pelat alumunium atau pelat pastik. Fase gerak yang dikenal sebagai pelarut
pengembang akan bergerak sepanjang fase diam karena pengaruh kapiler pada
pengembangan secara menaik (ascending) atau karena pengaruh gravitasi pada
pengembangan secara menurun (descending).
1) Fase diam KLT
Fase diam yang digunakan pada KLT merupakan penjerap berukuran kecil
dengan diameter partikel antara 10-30 µ m. Semakin kecil ukuran rata-rata fase diam,
maka semakin baik kinerja KLT yang dihasilkan, baik dalam hal resolusi dan
efisiensinya. Penyerap yang paling sering digunakan adalah silika dan serbuk
selulosa, sementara mekanisme sorbsi yang utama pada KLT adalah partisi dan
adsorbsi. Lempeng KLT disiapkan dengan melapiskan penjerap ke permukaan
lapisan kaca, gelas, atau alumunium dengan ketebalan 250 µ m (Gandjar, dan
Rohman, 2007).
2) Fase gerak KLT
Fase gerak pada KLT dapat dipilih dari pustaka, tetapi lebih sering dengan
mencoba-coba karena waktu yang diperlukan hanya sebentar. Sifat dan komposisi
kimia fase gerak ditentukan oleh jenis zat yang dipisahkan dan jenis fase diam yang
kompeks dari beberapa pelarut (Touchstone dan Dobbin, 1983). Berikut adalah
beberapa petunjuk dalam memilih dan mengoptimasi fase gerak :
a) Fase gerak harus memiliki kemurnian yang sangat tinggi karena KLT
merupakan teknik yang sensitif.
b) Daya elusi fase gerak harus diatur sedemikian rupa sehingga harga Rf
terletak antara 0,2 - 0,8 untuk memaksimalkan pemisahan.
c) Untuk pemisahan dengan menggunakan fase diam polar seperti silika gel,
polaritas fase gerak akan menentukan kecepatan migrasi solut dan juga
nilai Rf. Penambahan pelarut yang bersifat sedikit polar kedalam pelarut
non polar akan meningkatkan harga Rf secara signifikan.
d) Solut-solut ionik dan solut-solut polar lebih baik digunakan campuran
pelarut sebagai fase geraknya. Penambahan sedikit asam etanoat atau
ammonia masing-masing akan meningkatkan solut-solut yang bersifat
basa dan asam (Gandjar, dan Rohman, 2007).
3) Aplikasi (penotolan) sampel
Pemisahan pada kromatografi lapis tipis akan optimal hanya jika sampel
ditotolkan dengan ukuran bercak yang sekecil dan sesempit mungkin. Jika sampel
yang digunakan terlalu banyak maka akan menurunkan resoluai. Penotolan sampel
yang tidak tepat akan menyebabkan bercak yang menyebar dan puncak ganda.
Berdasarkan pada tujuan analisis, berbagai macam jumlah sampel telah disarankan
Tabel II. Parameter-parameter aplikasi penotolan sampel yang direkomendasikan Menurut Adamovies, (1997)
Tujuan Diameter bercak (mm) Konsentrasi
sampel (%) Banyaknya sampel (µ g)
Untuk memperoleh reprodusibilitas, volume sampel yang ditotolkan paling
sedikit 0,5 µ l. Jika volume sampel yang ditotolkan lebih besar dari 2-10 µ l. maka
penotolan harus dillakukan secara bertahap dengan dilakukan pengeringan antar
totolan (Gandjar, dan Rohman, 2007).
4) Pengembangan
Pengembangan dilakukan ketika sampel telah ditotolkan pada pelat KLT.
Pengembangan sampel dilakukan dalam bejana kromatografi yang telah dijenuhkan
dengan uap fase gerak. Bagian bawah lempeng KLT yang telah ditotoli sampel
dicelupkan ke dalam fase gerak kurang lebih 0,5-1 cm. Tinggi fase gerak harus di
bawah batas totolan sampel. Bejana kromatografi harus tertutup rapat dan sedapat
mungkin volume fase gerak sesedikit mungkin, namun masih bisa mengelusi
lempeng sampai ketinggian yang ditentukan. Untuk penjenuhan fase gerak, biasanya
bejana kromatografi dilapisi dengan kertas saring sebagai indikator. Jika kertas
saring telah basah sepenuhnya maka dapat dikatakan bahwa fase gerak telah jenuh
sepenuhnya. Ada beberapa teknik pengembangan yang terdapat dalam kromatografi
(descending), secara melingkar, maupun secara mendatar (Gandjar, dan Rohman,
2007).
5) Deteksi bercak
Bercak pemisahan pada KLT umumnya merupakan bercak yang tidak
berwarna. Untuk penentuannya dapat dilakukan secara fisika, kimia, maupun biologi.
Deteksi secara kimia dilakukan dengan mereaksikan bercak dengan suatu pereaksi
melalui cara penyemprotan sehingga bercak menjadi jelas. Pereaksi semprot yang
biasanya digunakan dalam kromatografi lapis tipis ini dapat dibedakan menjadi
beberapa kelompok, yaitu :
(a) Senyawa-senyawa yang dapat membentuk warna ketika tereduksi
(kalium peranganat, ferri-sianida, ferri-dipiridil, dan asam
fosfomolibdat),
(b) senyawa yang dapat berikatan dengan senyawa fenol, seperti pereaksi
diazo, magnesium sulfat, aldehid aromatik-anisaldehid, vanillin, dan
pereaksi Gibbs yang akan membentuk indofenol (akan membentuk
garam berwarna dalam kondisi basa),
(c) radikal bebas stabil yang menerima radikal hidrogen dari antioksidan
(1,1-difenil-2-pikrilhidrazil), dan
(d)Senyawa-senyawa yang membentuk senyawa adisi yang berwarna.
Secara fisika dapat dilakukan dengan cara pencacahan radioaktif dan
fluorosensi sinar UV. Secara kimia dapat dilakukan dengan beberapa cara
diantaranya:
(a) Menyemprot lempeng KLT dengan reagen kromogenik yang akan
bereaksi secara kimia dengan seluruh solut yang mengandung gugus
fungsional tertentu sehingga bercak menjadi berwarna.
(b) Mengamati lempeng di bawah sinar UV pada panjang gelombang emisi
254 dan 366 untuk menampakkan solut sebagai bercak yang gelap atau
bercak yang berfluorosensi terang pada dasar yang berfuorosensi
seragam.
(Gandjar, dan Rohman, 2007).
Derajat retensi dinyatakan dengan niai Rf, nilai Rf ini digunakan untuk
menyatakan posisi zat setelah pengembangan. Gugus–gugus yang besar dari
senyawa–senyawa yang susunannya mirip sering kali memiliki harga Rf yang
berdekatan satu dengan yang lainnya. Harga Rf dapat didefinisikan sebagai berikut :
Harga Rf = ( )
( )
(Sastrohamidjojo, 2007)
b. Spektrofotometri visibel. Spektrofotometri visibel merupakan suatu teknik
analisis fisika-kimia yang mengamati tentang interaksi antara atom atau molekul
Suharman, 1995). Menurut Molyneux (2003), absorbansi DPPH terjadi dengan baik
pada cahaya tanpak (visibel), oleh sebab itu digunakan spektrofotometri visibel untuk
pengukuran absorbansinya.
Spektrofotometer UV-Vis ini hanya dapat digunakan untuk mendeteksi
senyawa yang memiliki gugus kromofor. Kromofor adalah gugus fungsional yang
mengabsorbsi radiasi ultraviolet dan cahaya tampak jika gugus ini diikat oleh
senyawa-senyawa bukan pengabsorbsi (auksokrom). Hampir semua kromofor
mempunyai ikatan rangkap terkonjugasi (diena, dienon, benzen, dan lain-lain).
Sedangkan auksokrom adalah gugus-gugus fungsional seperti –OH, -NH2, -NO2, -X,
yaitu gugus yang memiiki elektron tidak berpasangan dan tidak mengabsorbsi UV
jauh (Dirjen POM, 1995).
Suatu kromofor pada senyawa dapat muncul atau memberikan serapan pada
sepektrum serapan UV-Vis jika senyawa tersebut mmiliki panjang geombang
maksimum yang lebih besar dari 190 nm dan daya serap molarnya lebih besar dari
1000 agar konsentrasi yang digunakan tidak terlalu besar. Spektrofotometer yang
sesuai untuk pengukuran di daerah spektrum ultraviolet dan cahaya tampak terdiri
dari suatu sistem optik dengan kemampuan menghasilkan cahaya monokromatik
dengan jangkauan 200-800 nm dan suatu alat yang sesuai untuk menentukan serapan.
Spektrofotometer UV-Vis digunakan untuk analisa kualitatif dan terutama untuk
analisa kuantitatif (Dirjen POM, 1995).
Interaksi antara senyawa-senyawa yang mempunyai gugus kromofor dengan
transisi elektromagnetik dan spektra absorbansi elektromagnetik. Jumlah radisi
elektromagnetik yang diserap akan sebanding dengan jumlah molekul penyerapnya,
sehingga absorbansi dapat digunakan untuk analisis kuantitatif (Fessenden dan
Fessenden, 1995).
Ketetapan analisa oleh spektrofotometer UV-Vis ini dipengaruhi juga oleh
spektrum serapan yang terbentuk. Spektrum serapan adalah suatu penampilan dalam
bentuk grafik dari serapan atau fungsi dari serapan terhadap panjang gelombang atau
fungsi dari panjang gelombang (Dirjen POM, 1995). Pembentukan spektrum serapan
dipengaruhi oleh berbagai faktor yaitu:
1) Jenis pelarut
Pelarut yang digunakan tidak boleh mengabsorbsi cahaya pada daerah panjang
gelombang dimana dilakukan pengukuran sampel. Pelarut yang umum digunakan
adalah air, etanol, metanol, dan n-heksan karena pelarut ini transparan pada daerah
UV.
2) pH larutan
Cara pembuatan pelarut yang tidak sama dari waktu ke waktu dapat
mempengaruhi pengukuran dengan spektrofotometer UV-Vis. Pada senyawa yang
sangat sensitif terhadap pH, perubahan kecil pada pH dapat mempengaruhi
panjang gelombang maksimum atau daya serapnya.
3) Kadar larutan
Jika konsentrasi tinggi akan terjadi polimerasi yang menyebabkan panjang
4) Tebal larutan
Jika digunakan kuvet dengan tebal yang berbeda maka akan memberikan spektrum
serapan yang berbeda.
5) Lebar celah
Makin lebar celah (slit width), maka semakin lebar pula serapan (band width)
dimana cahaya semakin polikromatis sehingga resolusi dan puncak-puncak kurva
tidak sempurna.
D. Metode 1,1-Dyphenyl-2-Pycrylhydrazyl (DPPH)
Metode 1,1-Difenil-2-Pikrilhidrazil (DPPH) merupakan metode yang paling
sering digunakan untuk menguji aktivitas antioksidan tanaman obat (Shivaprasad et
al., 2005). Metode DPPH merupakan metode yang sederhana, cepat, sensitif, dan
reprodusibel untuk pengujian aktivitas antioksidan (Savatovic et al, 2012). Tujuan
dari metode ini adalah untuk mengetahui parameter konsentrasi yang ekuivalen
memberikan 50% efek aktivitas antioksidan (IC50) (Molyneux, 2004)
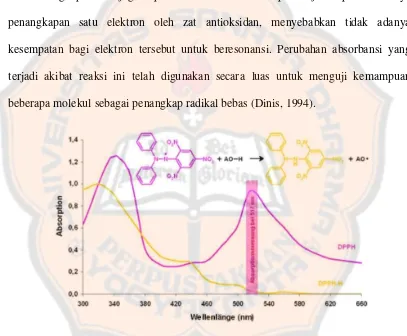
Radikal DPPH merupakan suatu senyawa organik yang mengandung nitrogen tidak stabil dengan absorbansi kuat pada λ max 517 nm dan berwarna ungu
gelap (Molyneuk,2003). Prinsip dari metode DPPH adalah reduksi larutan metanolik
radikal bebas berwarna (DPPH) dengan cara penangkapan radikal bebas (Shivaprasad
et al., 2005). Adanya elektron yang tidak berpasangan dari DPPH memberikan
serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh keberadaan
secara stokiometri sesuai jumlah elektron yang diambil. Keberadaan senyawa
antioksidan dapat mengubah warna larutan DPPH dari ungu menjadi kuning
(Dehpour, Ebrahimzadeh, Fazel, and Mohammad, 2009).
Penurunan intensitas warna yang terjadi disebabkan oleh berkurangnya
ikatan rangkap terkonjugasi pada DPPH. Hal ini dapat terjadi apabila adanya
penangkapan satu elektron oleh zat antioksidan, menyebabkan tidak adanya
kesempatan bagi elektron tersebut untuk beresonansi. Perubahan absorbansi yang
terjadi akibat reaksi ini telah digunakan secara luas untuk menguji kemampuan
beberapa molekul sebagai penangkap radikal bebas (Dinis, 1994).
Gambar 2. Perubahan warna larutan pada reaksi radikal DPPH dengan Antioksidan (Witt, Lalk, Hager, dan Voigt, 2010)
Menurut Arianto cit Armala (2009), tingat kekuatan antioksidan senyawa uji
dengan menggunakan metode DPPH dapat digolongkan berdasarkan nilai IC50
Tabel III. Tingkat Kekuatan Antioksidan dengan Metode DPPH
Intensitas nilai IC50
Sangat Kuat < 50 µg/Ml Kuat 50 -100 µ g/mL Sedang 101 – 150 µg/mL Lemah > 150 µ g/mL
Pengujian antioksidan secara kualitatif dengan metode DPPH dilakukan
secara kromatografi lapis tipis. Zat yang telah terelusi disemprot dengan reagen
DPPH 0,4 mM dalam metanol untuk mendeteksi ada tidaknya senyawa antioksidan
(Masoko and Eloff, 2007).
Berdasarkan beberapa sumber acuan, panjang gelombang yang dapat
digunakan sebagai working wavelength adalah 515-520 nm. Waktu Operating Time
(OT) yang optimal adalah 30 menit, namun pada beberapa substrat yang berbeda
dapat digunakan waktu yang lebih singkat (5 atau 10 menit) (Molyneux, 2004).
E. Ekstraksi
Ekstraksi merupakan suatu proses pemisahan substansi dari campurannya
dengan menggunakan pelarut yang sesuai. Metode ekstraksi yang digunakan dalam
suatu penelitian fitokimia sangat bergantung pada tekstur, kandungan air simplisia,
dan jenis senyawa yang akan diisolasi (Kristanti, Aminah, Tanjung, dan Kurniadi,
2008). Ekstraksi atau penyarian juga dapat didefinisikan sebagai perpindahan massa
aktif yang semula berada dalam sel, ditarik oleh cairan penyari sehingga terjadi
permukaan serbuk simplisia yang bersentuhan dengan cairan penyari, maka proses
ekstraksinya akan semakin baik (Harbone, 1987).
Ekstrak merupakan suatu sediaan kental yang diperoleh dengan cara
mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani dengan
pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan (Dirjen
Pom, 1995). Untuk mendapatkan senyawa aktif dalam suatu tumbuhan, diperlukan
metode ekstraksi yang cepat dan teliti. Pemilihan metode ekstraksi bergantung pada
sumber bahan alam dan senyawa yang akan diisolasi (Harbone, 1987).
Ekstraksi dapat dikelompokan menjadi 2 golongan, yaitu ekstraksi panas dan
ekstraksi dingin. Yang termasuk dalam golongan ekstraksi dingin adalah sebagai
berikut :
1. Maserasi
Prinsip : tercapainya keseimbangan konsentrasi. Maserasi merupakan cara
penyarian yang sederhana, yang dilakukan dengan cara merendam serbuk simplisia
dalam cairan penyari. Saat proses maserasi terjadi, cairan penyari akan menembus
dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan
larut karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan
lingkungan di luar sel, akibatnya larutan yang pekat akan terdesak keluar. Peristiwa
tersebut terjadi secara terus-menerus sehingga terjadi keseimbangan konsentrasi
antara larutan di dalam dan di luar sel. Maserasi umumnya digunakan untuk simplisia
yang tidak keras dan tidak kompak (Depkes RI, 1986). Maserasi kinetik merupakan
sedangkan remasersi dapat didefinisikan sebagai proses pengulangan maserasi
dengan penambahan pelarut setelah dilakukan penyaringan pada maserat yang
pertama, dan seterusnya (Depkes RI, 2000).
2. Perkolasi
Perkolasi merupakan cara penyarian yang dilakukan dengan mengalirkan
cairan penyari melalui serbuk simplisia yang telah terbasahi. Cairan penyari akan
mengalir dari atas ke bawah melalui serbuk kemudian cairan penyari akan melarutkan
zat aktif di dalam sel yang dilalui sampai mencapai keadaan jenuh. Serbuk simplisia
yang akan diperkolasi dibasahi terlebih dahulu dengan cairan penyari kemudian
dimasukkan ke dalam perkolator sambil setiap kali ditekan. Serbuk kemudian ditutup
dengan kertas saring dan kemudian cairan penyari dialirkan hingga di atas lapisan
serbuk masih terdapat cairan penyari. Seteah 24 jam, kran dibuka dan diatur hingga
kecepatan tetesannya 1 ml per menit. Akhir perkolasi ditentukan dengan pemeriksaan
zat secara kualitatif pada perkolat terakhir (Depkes RI, 1986). Proses perkolasi terdiri
atas tahapan pengembangan bahan, tahapan maserasi antara, tahapan perkolasi
sebenarnya (penetesan atau penampungan ekstrak), secara terus-menurus hingga
terbentuk ekstrak atau perkolat (Depkes RI, 2000).
Metode ekstraksi panas diantaranya:
1. Refluks
Merupakan ekstraksi dengan pelarut yang dilakukan pada suhu titik didih zat
selama waktu tertentu dan dalam jumlah pelarut yang relatif konstan dengan adanya
sampai 3-5 kali sehingga dapat termasuk proses ekstraksi yang sempurna (Depkes RI,
2000).
2. Digesti
Digesti merupakan maserasi kinetik (maserasi dengan pengadukan kontinu)
yang dilakukan pada temperatur yang lebih tinggi dari suhu ruangan, yang umumnya
dilakukan pada temperatur 40 – 50°C (Depkes RI, 2000).
3. Infundasi
Metode ekstraksi menggunakan pelarut air pada penangas air mendidih
(bejana infus tercelup dalam penangas air mendidih), pada suhu 96 - 98°C selama 15
– 20 menit (Depkes RI, 2000).
4. Dekoksi
Merupakan teknik ekstraksi yang memiliki prinsip yang sama dengan
infundasi dalam waktu 30 menit (Depkes RI, 2000).
5. Sokletasi
Merupakan ekstraksi dengan pelarut yang selalu baru yang dilakukan dengan
alat khusus sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan
dengan adanya pendingin balik (Depkes RI, 2000).
Dalam pemilihan cairan penyari, seseorang harus mempertimbangkan banyak
faktor, cairan penyari yang baik harus memenuhi kriteria sebagai berikut :
a. Murah dan mudah diperoleh,
b. stabil secara fisika dan kimia,
d. tidak mudah menguap dan tidak mudah terbakar,
e. selektif,
f. tidak mempengaruhi zat yang berkhasiat, dan
diperbolehkan oleh peraturan yang berlaku (Depkes RI, 1986)
F. Skrining fitokimia
Skrining fitokimia merupakan proses pemeriksaan awal yang digunakan
untuk mendeteksi kandungan kimia suatu bahan alam. Pengujian skrining fitokimia
dilakukan dengan metode pereaksi warna dan dilakukan untuk mendeteksi golongan
alkaloid, flavonoid, saponin, tanin, steroid, dan triterpenoid (Mustikasari dan Ariyani,
2010; Susmiati, 2010).
1. Alkaloid
Alkaloid merupakan senyawa kimia tanaman yang terbentuk dari hasil
metabolit sekunder yang terbentuk berdasarkan prinsip pembentukan campuran.
Hampir semua alkaloid di alam memiliki keefektifan biologi tertentu, ada yang sangat
beracun, ada pula yang sangat berguna dalam pengobatan. Misalnya morfin, kuinin,
stiknin, yang merupakan alkaloid dengan efek fisiologis dan psikotik. Alkaloid tidak
memiliki tatanama yang sistematik, oleh karena itu, suatu alkaloid dinyatakan dengan
nama trivia yang berakhiran –in (Lenny, 2006).
2. Flavonoid
Flavonoid merupakan senyawa yang larut air, dapat diekstraksi dengan
karena itu warnanya berubah dengan penambahan basa atau amonia. Flavonoid
mengandung sistim aromatik yang terkonjugasi sehingga akan menunjukkan pita
serapan yang kuat pada sinar UV dan sinar tampak (Harbone, 1987). Flavonoid
merupakan senyawa yang terdiri dari C6-C3-C6. Kegunaan flavonoid bagi tumbuhan
adalah untuk menarik serangga yang membantu proses penyerbukan dan untuk
menarik perhatian binatang yang membantu penyebaran biji. Bagi manusia, flavonoid
dalam dosis kecil bekerja sebagai stimulan pada jantung dan pembuluh darah kapiler
(Sirait, 2007).
Terdapat sekitar sepuluh kelas flavonoid yaitu antosianin, proantosianidin,
flavonol, flavon, glikoflavon, biflavonil, khalkon, auron, flavonon, dan isoflavon.
Senyawa flavonoid dapat diekstraksi dengan etanol 70% dan tetap ada dalam lapisan
air setelah ekstrak ini dikocok dengan eter minyak bumi (Harbone, 1987).
3. Saponin
Saponin merupakan glikosida triterpen dan sterol yang telah terdeteksi dalam
lebih dari 90 suku tumbuhan. Glikosida adalah suatu kompleks antara gula pereduksi
(glikon) dan senyawa bukan gula (aglikon). Adanya saponin dalam tumbuhan
ditunjukkan dengan pembentukan busa yang menetap sewaktu mengekstraksi
tumbuhan atau memekatkan tumbuhan (Harbone, 1987).
4. Tanin
Tanin merupakan senyawa kimia yang terdapat secara luas pada tumbuhan
berpembuluh. Secara kimia terdapat dua jenis utama tanin yaitu tanin terhidrolisis dan
dari kondensasi katekin tunggal (galokatekin) yang membentuk senyawa dimer dan
kemudian oligomer yang lebih tinggi. Tanin terhidrolisis terdiri atas dua kelas, yang
paling sederhana ialah, depsida galoiglukosa. Pada senyawa ini, inti yang berupa
glukosa dikelilingi oleh lima atau lebih gugus ester galoil. Pada jenis yang kedua, inti
molekul berupa senyawa dimer asam galat yaitu asam heksahidroksidifenat, yang
berikatan dengan glukosa. Bila dihidrolisis, elagitanin ini menghasilkan asam elagat
(Harbone, 1987).
5. Terpenoid dan steroid
Terpenoid merupakan suatu senyawa yang tersusun atas isopren
CH2=C(CH3)-CH=CH2. Terpenoid terdiri atas beberapa macam senyawa seperti
monoterpen dan seskuiterpen yang mudah menguap, diterpen yang sukar menguap,
dan triterpen dan sterol yang tidak menguap.
Secara umum senyawa ini larut lemak dan terdapat dalam sitoplasma sel
tumbuhan. Biasanya senyawa ini diekstraksi dengan menggunakan eter dan
kloroform. Steroid merupakan senyawa triterpen yang terdapat dalam bentuk
glikosida. Senyawa ini biasanya diidentifikasi dengan reaksi Lieberman-Bourchad
(asetat anhidrat-H2SO4) yang memberikan warna hijau kehitaman sampai biru
(Harbone, 1987).
G. Validasi Metode Analisis
Validaasi metode analisis merupakan suatu tindakan penilaian yang
membuktikan bahwa parameter tersebut memenuhi persyaratan dalam
penggunaannya (Harmita, 2004). Parameter-parameter yang digunakan dalam
validasi metode analisis antara lain :
1. Akurasi
Akurasi merupakan ukuran yang digunakan untuk menunjukkan adanya
derajat kedekatan antara hasil analisis dengan kadar analit yang sebenarnya. Akurasi
dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan
(Harmita, 2004). Untuk sampel dengan kadar yang kecil, persen perolehan kembali
yang disepakati berkisar antara 90-110%, sementara untuk sampel dengan kadar yang
lebih besar persen perolehan kembali yang disepakati berkisar antara 95-105 %,
persen perolehan kembali yang maih bisa diterima berkisar diantara 80-120 % (Mulja
dan Hanwar, 2003).
Tabel IV. Kriteria Nilai Akurasi yang Masih dapat Diterima Menurut APVMA (2004)
Kadar zat aktif (%) Nilai Recovery yang masih dapat diterima (%)
≥ 10 98-102
1-10 90-110
0,1-1 80-120
≤ 0,1 75-125
2. Presisi
Presisi atau keseksamaan merupakan ukuran yang digunakan untuk
menyatakan derajat kesesuaian antara hasil uji individual, diukur melalui penyebaran
hasil individual dari ratarata jika prosedur diterapkan secara berulang pada sampel
-sampel yang diambil dari campuran yang homogen. Presisi dinyatakan dalam koefisien
Tabel V.Kriteria Nilai Presisi yang Masih dapat Diterima Menurut APVMA (2004)
Kadar Zat Aktif (%) Nilai KV yang masih dapat diterima (%)
>10 < 2
1-10 < 5
0,1-1 < 10
< 0,1 < 20
3. Linearitas
Linearitas dari suatu prosedur analisis merupakan kemampuan dari suatu
prosedur analisis (pada rentang tertentu) untuk mendapatkan hasil uji yang secara
langsung proporsional dengan konsentrasi (jumlah) analit di dalam sampel (Mulja
dan Hanwar, 2003).
Persyaratan data linearitas yang dapat diterima jika memenuhi nilai koefisien
relasi (r) dari hasil analisis sebesar > 0,999 (Mulja dan Suharman, 1995).
4. Spesifisitas
Spesifisitas dalam suatu metode adalah kemampuan metode tersebut yang
hanya mengukur zat tertentu saja secara cermat dan seksama dengan adanya
komponen lain yang mungkin terdapat dalam matriks sampel. Selektivitas metode
ditentukan dengan membandingkan hasil analisis sampel yang mengandung cemaran,
hasil urai, senyawa sejenis, senyawa asing lainnya atau pembawa plasebo dengan
hasil analisis sampel tanpa penambahan bahan-bahan tadi. Penyimpangan hasil
H. Landasan Teori
Radikal bebas merupakan suatu senyawa atau atom yang memiliki elektron
yang tidak berpasangan pada orbital terluarnya sehingga bersifat sangat reaktif. Untuk
menjadi stabil, radikal bebas akan menyerang dan mengikat elektron dari molekul
disekitarnya, sehingga dapat menyebabkan kerusakan oksidatif sel, yang dapat
mengakibatkan terjadinya berbagai macam penyakit seperti kanker dan penuaan dini.
Oleh karena itu, diperlukan suatu senyawa antioksidan yang dapat berperan
untuk menangkal efek buruk dari radikal bebas tersebut. Sumber antioksidan dapat
berasal dari dua macam yaitu antioksidan alami dan antioksidan sintetik. Saat ini
antioksidan alami yang berasal dari buah dan sayuran lebih diminati dibandingkan
dengan antioksidan sintetik karena dinilai lebih aman dan memiliki efek samping
yang lebih rendah dibandingkan dengan antioksidan sintetik.
Bunga melinjo merupakan tamanan yang banyak dikonsumsi oleh
masyarakat sebagai makanan sehari-hari. Di dalam daun dan biji melinjo terdapat
kandungan flavonoid, tanin, dan saponin yang memiliki aktivitas antioksidan. Oleh
karena itu, perlu dilakukan pengujian apakah bunga melinjo memiliki sifat
antioksidan. Pengujian dilakukan dengan metode DPPH secara kualitatif (KLT) dan
kuantitatif (spektrofotometri). Metode DPPH dipilih karena dianggap sederhana,
cepat, sensitif, dan reprodusibel untuk pengujian aktivitas antioksidan. Aktivitas
Adanya elektron yang tidak berpasangan pada molekul DPPH memberikan
serapan kuat pada 517 nm. Ketika elektronnya menjadi berpasangan oleh keberadaan
penangkap radikal bebas, maka absorbansinya menurun secara stokiometri sesuai
jumlah elektron yang diambil. Keberadaan senyawa antioksidan dapat mengubah
warna larutan DPPH dari ungu menjadi kuning.
I. Hipotesis
1. Di dalam bunga melinjo terdapat senyawa metabolit sekunder yang berperan
sebagai antioksidan.
2. Aktivitas antioksidan dari bunga melinjo melalui uji DPPH dalam penangkapan
36 BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini termasuk dalam penelitian eksperimental dengan rancangan
acak lengkap pola searah.
B. Variabel
a. Variabel bebas berupa konsentrasi ekstrak etanolik bunga melinjo.
b. Variabel tergantung berupa aktivitas antioksidan ekstrak etanolik bunga
melinjo.
c. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu
pemanenan, umur tanaman, dan cara panen.
d. Variabel pengacau tidak terkendali berupa cahaya matahari, keadaan tanah,
suhu, kelembaban udara, curah hujan, dan cuaca.
C. Definisi Operasional
a. Ekstrak etanolik bunga melinjo merupakan sari hasil proses maserasi
bunga melinjo dengan pelarut etanol.
b. Persen inhibition concentration (%IC) adalah persen yang
menyatakan kemampuan ekstrak etanolik bunga melinjo untuk menangkap