PENGARUH PEMBERIAN KETOTIFEN TERHADAP
KADAR INTERLEUKIN 6 SERUM DAN SKOR NYERI
PADA OPERASI MASTEKTOMI
TESIS
Disusun Untuk Memenuhi Sebagian Persyaratan Mencapai Derajat Magister Program Studi Magister Kedokteran Keluarga
Minat Utama: Ilmu Biomedik
Oleh
Dedhi Subandriyo S501008013
PROGRAM PASCASARJANA
UNIVERSITAS SEBELAS MARET
i
ii
iv
KATA PENGANTAR
Segala puji syukur ke hadirat Alloh, Tuhan Yang Maha Esa atas petunjuk
dan rahmat yang diberikan, sehingga penulis dapat menyelesaian Tesis dengan
judul ”Pengaruh Pemberian Ketotifen Terhadap Kadar Interleukin 6 Serum
dan Skor Nyeri Pada Operasi Mastektomi”.
Tesis ini dimaksudkan sebagai penelitian yang merupakan salah satu persyaratan untuk mencapai derajat magister, maka pada kesempatan ini penulis ingin mengucapakan terima kasih sebesar-besarnya kepada yang terhormat:
1. Prof. Dr. Ravik Karsidi, Drs, MS selaku Rektor Universitas Sebelas Maret
Surakarta yang telah memberikan kesempatan untuk mengikuti pendidikan
di Universitas Sebelas Maret ini.
2. Prof. Dr. Ir. Ahmad Yunus, MS selaku Direktur Program Pascasarjana
Universitas Sebelas Maret Surakarta yang telah memberikan kesempatan
untuk mengikuti program Magister di Program Pascasarjana Universitas
Sebelas Maret.
3. Prof. Dr. Zainal Arifin Adnan, dr, SpPD-KR FINASIM, selaku Dekan
Fakultas Kedokteran Universitas Sebelas Maret Surakarta yang telah
memberikan kesempatan untuk mengikuti Program Pendidikan Dokter
Spesialis Fakultas kedokteran Universitas Sebelas Maret.
4. Dr. Hari Wujoso, dr. SpF, MM selaku Ketua Program Studi Magister
Kedokteran Keluarga Universitas Sebelas Maret yang telah memberikan
v
kesempatan untuk mengikuti studi Program Magister Kedokteran
Keluarga dan selaku pembimbing metodologis yang dengan kesabarannya
membimbing dan meneliti Tesis ini sehingga menjadi lebih baik.
5. Ari Natali P. dr. MPH. Ph.D. selaku Sekretaris Program Studi Magister
Kedokteran Keluarga Program Pascasarjana Universitas Sebelas Maret
Surakarta yang telah memberikan kesempatan dan bimbingan studi pada
program Magister Kedokteran Keluarga.
6. Sugeng Budi Santosa, dr, SpAn. KMN selaku Kepala SMF Ilmu Anestesi
dan Terapi Intensif FKUNS/RSDM. Terima kasih atas segala bimbingan
dan masukan yang diberikan pada penulis dalam menyelesaikan karya tulis
ini.
7. Mulyo Hadi Sudjito dr, SpAn KNA selaku Ketua Program Studi
Pendidikan Dokter Spesialis Anestesi dan Terapi Intensif FKUNS/RSDM
dan selaku pembimbing substansi , atas kesediaannya meluangkan waktu
dan memberikan masukan dalam penyusunan tesis ini. Terima kasih telah
memberikan bimbingan dan arahan sehingga tesis ini dapat terselesaikan.
8. ”Guru-guruku” yang tidak pernah lelah mengajari, dan memberi
kesempatan penulis untuk menimba ilmu di IK Anestesiologi dan
Intensive Care UNS.
9. Kedua orang tua penulis, Bapak Endi Suwadji dan Ibu Titik Murgiati yang
sangat penulis hormati dan sayangi yang selalu memberi dukungan,
bantuan, perhatian, kasih sayang, dan tidak bosan-bosannya berdoa untuk
penulis agar penulis cepat dapat menyelesaikan pendidikan.
vi
10. Istri tercinta dan tersayang, Nurul Indarti Setyaningrum, yang tak pernah
lelah memberi dukungan, doa, cinta, kasih sayang, pengertian, dan
perhatiannya, serta anak-anaku, Ummu Abdillah Asy Syifa dan
Abdurrohman Afifi yang menjadikan hidup lebih berwarna selama penulis
menjalani pendidikan.
11. Kakak-kakakku yang penulis cintai dan sayangi, yang selalu memberi
dukungan agar penulis dapat menyelesaikan pendidikan.
12. Rekan-rekan residen anestesi yang telah membantu dan mendukung,
terkhusus dr. Frans Kausario dan dr. Arya Windhi yng telah membantu
dalam proses sampling.
13. Semua pihak yang telah membantu dalam penyusunan Tesis ini yang tidak
dapat penulis sebutkan satu persatu.
Penulis menyadari bahwa penelitian ini masih banyak kekurangan, untuk itu kritik
dan saran dari pembaca penulis harapkan sehingga lebih sempurna.
Surakarta, Agustus 2014
Dedhi Subandriyo, dr
vii ABSTRACK
Dedhi Subandriyo, S501008013. 2014. Pengaruh Pemberian Ketotifen Terhadap Kadar Interleukin 6 Serum dan Skor Nyeri Pada Operasi Mastektomi. Pembimbing I: Dr. Hari Wujoso, dr., MM, Sp.F. Pembimbing II: Mulyo Hadi Sudjito, dr., Sp.An, KNA. Anestesiologi dan Terapi Intensif Fakultas Kedokteran, Program Studi Magister Kedokteran Keluarga, Program Pasca Sarjana Universitas Sebelas Maret Surakarta.
Background : Postsurgical chronic pain is the consquence of exaggerate and ongoing inflammation. Inflammatory processes after surgical incision are maintained through the release of inflammatory mediators by resident cell, including mast cell. Ketotifen as a mast cell stabilizer, had been proven inhibits mast cell degranulation, released several media tor, including proinflammatory cytokine interleukin 6..
Purpose : To proof effect of ketotifen in reduce interleukin 6 serum level and pain score in mastectomy procedure.
Methods : This is a clinical study setting withvdouble blind randomized controlled trial. Thirty patients were randomly devided in to two groups. K1, Ketotifen group, fiveteen patients with mastectomy procedure and get oral ketotifen. K2, fiveteen patients and get placebo. Before and on day 3th post operative, the patinets were examinated interleukin 6 serum level and pain score. The alteration il-6 serum level and pain score were analyzed with independent t-test.
Result : There was significant differences (p < 0.05), the alteration il-6 serum level and pain score of the ketotifen treated group (K1) was lower than control group (K1).
Conclusion Ketotifen play a role in preventing post operative pain, however administering oral ketotifen effective control exceed inflammatory response in post operativ which marked with inhibition interleukin 6 product .
Keywords : Ketotifen, interleukin-6, post operative pain.
viii ABSTRAK
Dedhi Subandriyo, S501008013. 2014. Pengaruh Pemberian Ketotifen Terhadap Kadar Interleukin 6 Serum dan Skor Nyeri Pada Operasi Mastektomi. Pembimbing I: Dr. Hari Wujoso, dr., MM, Sp.F. Pembimbing II: Mulyo Hadi Sudjito. dr., Sp.An, KNA. Anestesiologi dan Terapi Intensif Fakultas Kedokteran, Program Studi Magister Kedokteran Keluarga, Program Pasca Sarjana Universitas Sebelas Maret Surakarta.
Latar Belakang : Nyeri kronis pasca bedah merupakan salah satu konskuensi dari
adanya proses inflamasi yang berlebihan. Proses inflamasi pasca bedah diawali dengan pelepasan mediator inflamasi oleh sel residen, dimana salah satunya adalah sel mast. Ketotifen sebagai agent stabilisasi sel mast, telah terbukti mencegah terjadinya degranulasi sel mast yang akan melepaskan berbagai mediator, termasuk sitokin proinflamasi interleukin 6.
Tujuan : Membuktikan pengaruh pemberian ketotifen terhadap penurunan kadar
interleukin 6 serum dan skor nyeri pada operasi mastektomi
Metode : Uji klinik dengan desain double blind randomized controlled trial. 30 pasien yang menjalani operasi mastektomi dibagi menjadi dua kelompok. K1, kelompok ketotifen terdiri dari 15 pasien yang menjalani operasi mastektomi dengan pemberian ketotifen oral perioperatif, dan K2, kelompok kontrol terdiri dari 15 pasien yang menjalani operasi mastektomi yang diberikan plasebo oral. Sebelum operasi dan hari ketiga setelah operasi pasien di periksa kadar interleukin 6 serum dan skor nyeri. Perubahan kadar interleukin 6 dan skor nyeri sebelum dan setelah operasi yang didapat di analisa dengan uji statistik independent t-test.
Hasil : Ada perbedaan yang bermakna (p < 0.05) dari perubahan kadar interleukin
6 dan skor nyeri pada kelompok yang diberi ketotifen yang lebih kecil jika dibandingkan dengan kelompok kontrol.
Kesimpulan : Ketotifen mempunyai peran dalam pencegahan nyeri paska operasi,
dimana ketotifen efektif mengendalikan reaksi inflamasi yang berlebihan paska operasi yang ditandai dengan hambatan produksi interleukin 6.
Kata Kunci : Ketotifen, interleukin-6, nyeri paska operasi.
ix DAFTAR ISI
HALAMAN PENGESAHAN ... i
PERNYATAAN ORISINALITAS DAN PUBLIKASI TESIS ... iii
KATA PENGANTAR ... iv
a. Patofisiologi Inflamasi dan Nyeri ... 7
b. Persepsi Nyeri dan Nosisepsi ... 10
c. Mediator Inflamasi dan Modulasi Nyeri ... 11
x
J. Jadwal Kegiatan dan Organisasi Penelitian ... 63
xi
DAFTAR GAMBAR
Gambar 2.1 Jalur pelepasan dan metobolisme asam arakidonat ... 15
Gambar 2.2 Imunofisiologi nyeri inflamasi ... 16
Gambar 2.3 Biosintesis prostanoid ... 20
Gambar 2.4 Biosintesis leukotriene ... 22
Gambar 2.5 Imunofisiologi pasca cidera saraf tepi ... 24
Gambar 2.6 Respon mediator inflamasi ... 32
Gambar 2.7 Numeric Pain Intensity Scale ... 36
Gambar 2.8 Visual Analogue Scale ... 36
Gambar 2.9 Wong Baker Faces Pain Rating Scale ... 37
Gambar 2.10 Alur Ikatan sitokin dengan nosiseptor ... 38
Gambar 2.11 Asal dan diferensiasi sel mast... 45
Gambar 2.12 Pertumbuhan sel mast dan distribusinya di jaringan ... 46
Gambar 2.13 Aktivasi sistim imun dan sensitisasi nosiseptor ... 47
Gambar 2.14 Respon kanal calcium selama aktivasi sel mast ... 48
Gambar 2.15 Degranulasi sel mast mengeluarkan berbagai mediator kimia .... 51
Gambar2.16 Proses degranulasi yang dimediasi reseptor Fc RI sel mast ... 52
Gambar2.17 Kerangka Teori ... 53
Gambar2.18 Kerangka Konsep ... 54
Gambar 3.1 Alur Penelitian ... 59
Gambar 4.1 Perubahan Kadar IL 6 Kelompok Perlakuan dan Kelompok Kontrol ... 75
Gambar 4.2 Perubahan VAS Kelompok Perlakuan dan Kelompok Kontrol ... 78
xii
DAFTAR TABEL
Tabel 2.1. Perkiraan kejadian nyeri kronis pasca bedah ... 27
Tabel 4.1. Uji Normalitas Data Demografi ... 65
Tabel 4.2 Distribusi Umur, Tinggi Badan dan Berat Badan Responden ... 66
Tabel 4.3 Independen Sample Tes perubahan kadar IL 6 ... 67
Tabel 4.4 Uji Mann Whitney Sample Tes Variabel VAS ... 68
xiii
DAFTAR LAMPIRAN
Lampiran 1 Surat Pernyataan Persetujuan (Informed Consent)
Lampiran 2 Formulir dan Check List Penelitian
Lampiran 3 Hasil Penelitian dan Analisis Statistik
Lampiran 4 Lembar Konsultasi Tesis
Lampiran 5 Ethical clearance
1 BAB I PENDAHULUAN
A. LATAR BELAKANG
Trauma pembedahan akan menghasilkan perubahan biokimia lokal
komplek yang ikut andil dalam suatu proses inflamasi dan nyeri akut pasca
operasi, dan dalam beberapa kasus berlanjut ke nyeri kronik pasca operasi.
Cedera jaringan akan mengakibatkan peningkatan sitokin proinflamasi yang
akan menyebabkan sensitisasi sistim syaraf sentral maupun perifer, yang
mengarah kepada terjadinya hiperalgesia (Buvanendran dan Kroin, 2010).
Anestesi lokal, opioid, maupun cyclooxygenase (COX) inhibitor dapat mengontrol nyeri pasca operasi baik selama ataupun segera setelah
pembedahan. Secara umum penanggulangan nyeri perioperatif dengan
memberikan obat-obat tersebut di atas, dan non steroid anti inflamasi drugs (NSAID) yang bekerja pada jalur cyclooxygenase (COX) inhibitor, baik COX-1 maupun COX-2 paling banyak digunakan, namun pada hambatan pada jalur
lipoxigenase (LOX) belum banyak perhatian padahal leukotrien yang
dihasilkan dari jalur ini memiliki andil yang besar dalam proses inflamasi
bahkan proses inflamasi yang sudah timbul diperberat dengan kehadiran
leukotrien ini akibat kemampuannya sebagai kemotaktik. Kemotaktik adalah
kemampuan mediator kimia yang dapat mengundang sel-sel imunologis
migrasi ke daerah inflamasi seperti netrofil, basofil, makropage dan sel mast
yang mengeluarkan berbagai mediator kimia yang dapat menyebakan
2
inflamasi, nyeri akut bahkan timbulnya nyeri kronis pasca operasi (Smyth &
Fitzgerald, 2012, Baratawidjaja, 2006). Nyeri yang menetap sampai setelah
luka operasi sembuh bisa menjadi suatu masalah. Hal tersebut dikenal sebagai
nyeri kronis pasca bedah, yang berlangsung antara tiga sampai enam bulan
pasca operasi (Kehlet et al., 2006). Disebutkan antara 10 sampai 50% pasien mengalami nyeri kronis pasca bedah, setelah menjalani proses pembedahan
seperti operasi hernia, mastektomi atau lumpektomi, bedah thorak, amputasi
kaki, maupun coronary artery bypass grafting (CABG) (Tillu et al., 2012). Terjadinya inflamasi setelah incisi pembedahan diawali dengan
adanya produksi prostaglandin, prostasiklin dan leukotrien. Leukotrien memicu
datangnya sel-sel lekosit seperti netrofil, basofil dan sel mast yang melepaskan
mediator inflamasi terutama yang diperankan oleh sel mast, sehingga proses
inflamasi yang terjadi bertambah hebat (Smyth & Fitzgerald, 2012). Beberapa
mediator inflamasi yang dilepaskan oleh sel mast, telah diketahui
menghasilkan nosisepsi selama periode pasca operasi (Yasuda et al., 2013). Sel mast yang teraktivasi dapat mengeluarkan histamin, berbagai
macam mediator inflamasi seperti beberapa eichosanoid, proteoglycan,
protease, serta beberapa kemokin dan sitokin proinflamasi seperti tumor necrosing factor-α (TNF-α), interleukin (IL)-6, IL-4, IL-13, dan transforming growth factor-β. TNF-α dan Iδ-6 dari sel mast meningkatkan migrasi lekosit dan memperberat lesi inflamasi. Walaupun memiliki fungsi yang bermanfaat
dalam hal pertahanan diri, sitokin proinflamasi bisa memacu terjadinya kondisi
patologis ketika diproduksi secara berlebihan (Kim et al., 2006).
3
Dijelaskan bahwa nyeri kronik pasca bedah adalah konsekuensi baik
dari proses inflamasi yang berlebihan maupun suatu manifestasi dari nyeri
neuropati yang disebabkan oleh cedera pembedahan pada syaraf perifer (Kehlet
et al., 2006). Kejadian nyeri kronis pasca bedah relatif tinggi, dan hal itulah yang mendorong dipertimbangkannya usaha untuk mengendalikan proses
inflamasi pasca bedah sebagai usaha untuk mengurangi kejadian nyeri kronis
pasca bedah (Buvanendran & Kroin, 2010).
Ketotifen merupakan obat antialergi yang bekerja sebagai antagonis
reseptor histamin, efek lain yang menguntungkan dari obat ini berhubungan
dengan aksinya menghambat pelepasan mediator-mediator pro-inflamasi dari
sel Mast, basofil dan netrofil. Dari penelitian Novianto (2013) telah
membuktikan efektifitas ketotifen dalam mencegah degranulasi sel Mast pada
tikus wistar yang dilakukan insisi pembedahan dan penelitian Apandi (2013)
menyebutkan ketotifen efektif menurunkan pelepasan histamin yang dipicu
oleh pemberian pelumpuh otot Atrakurium. Ketotifen menghambat pelepasan
mediator sel Mast dengan cara kombinasi, memblokade influks Ca++ dari
Extracellular ke Intracellular dan dengan mencegah penurunan cyclic adenosine monophosphate (c-AMP) yang dapat menghambat degranulasi sel Mast. Mekanisme calcium-dependent adalah metode utama degranulasi, meski beberapa mediator pro-fibrotik dari sel Mast juga disekresi lewat mekanisme
Ca+ +- independent (Monument et al., 2012).
Penelitian ini bermaksud menganalisisi pengaruh pemberian
ketotifen dalam mengurangi reaksi inflamasi yang dimediasi oleh interleukin 6
4
yang memiliki peran terjadinya nyeri kronis pasca operasi, sehingga bisa
digunakan sebagai alternatif atau terapi tambahan dalam pencegahan terjadinya
proses inflamasi sehingga dapat mengurangi nyeri pasca operasi. Pengambilan
sampel dilakukan pada pasien dengan operasi mastektomi disebabkan hampir
setiap hari dilakukan di Instalasi Bedah Sentral RS. Dr. Moewardi dan resiko
terjadinya nyeri kronis paska operasi pada pasien ini juga tinggi.
B. RUMUSAN MASALAH
Apakah ada pengaruh pemberian ketotifen terhadap penurunan kadar
interleukin 6 serum dan skor nyeri pada operasi mastektomi?
C. TUJUAN PENELITIAN
Membuktikan pengaruh pemberian ketotifen terhadap penurunan kadar
interleukin 6 serum dan skor nyeri pada operasi mastektomi.
D. MANFAAT PENELITIAN
1. Hasil penelitian ini dapat dijadikan sumbangan teori dalam upaya
menerangkan tentang pengaruh pemberian ketotifen pasca operasi pada
reaksi inflamasi dan nyeri kronis.
2. Apabila penelitian ini terbukti, maka dapat dijadikan sebagai dasar untuk
menjelaskan bahwa hambatan produksi interleukin 6 dengan menggunakan
ketotifen bisa digunakan sebagai pencegahan inflamasi atau nyeri pasca
operasi.
5 BAB II
TINJAUAN PUSTAKA
A. KAJIAN TEORI 1. NYERI
a. Patofisiologi Inflamasi Dan Nyeri
Nyeri merupakan salah satu tanda adanya prosesinflamasi. Inflamasi
adalah respon dari suatu organisme terhadap patogen dan alterasi mekanis
dalam jaringan, berupa rangkaian reaksi yang terjadi pada tempat jaringan
yang mengalami cedera, seperti karena terbakar, luka operasi atau terinfeksi.
Radang atau inflamasi merupakan satu dari respon utama sistem kekebalan
terhadap infeksi dan iritasi. Inflamasi distimulasi oleh faktor kimia
(histamin, bradikinin, serotonin, leukotrien, dan prostaglandin) yang
dilepaskan oleh sel yang berperan sebagai mediator radang di dalam sistem
kekebalan untuk melindungi jaringan sekitar dari penyebaran infeksi
(Murphy at al, 2007)
Perkembangan pengetahuan mengenai mekanisme nyeri telah
membawa kita pada perbaikan penatalaksanaan klinis terhadap nyeri. Di
masa mendatang diharapkan penatalaksanan nyeri dapat langsung menuju
sasaran sesuai proses patofisiologi yang menyebabkan gejala nyeri yang
spesifik (Marsaban et al, 2009).
Inflamasi mempunyai tiga peran penting dalam perlawanan terhadap
infeksi yaitu memungkinkan penambahan molekul dan sel efektor ke lokasi
6
infeksi untuk meningkatkan performa makrofag menyediakan rintangan
untuk mencegah penyebaran infeksi mencetuskan proses perbaikan untuk
jaringan yang rusak (Janeway at al, 2001, Baratawidjaja, 2006, Murphy at
al, 2007).
Respon inflamasi dapat dikenali dari rasa sakit, kulit lebam, demam
dan lainnya, yang disebabkan karena terjadi perubahan pada pembuluh
darah di area infeksi/lesi yaitu pembesaran diameter pembuluh darah,
disertai peningkatan aliran darah di daerah infeksi. Hal ini dapat
menyebabkan kulit tampak lebam kemerahan dan penurunan tekanan darah
terutama pada pembuluh kecil, aktivasi molekul adhesi untuk merekatkan
endotelia dengan pembuluh darah, kombinasi dari turunnya tekanan darah
dan aktivasi molekul adhesi, akan memungkinkan sel darah putih bermigrasi
ke endotelium dan masuk ke dalam jaringan. Proses ini dikenal sebagai
ekstravasasi (Murphy at al, 2007).
Bagian tubuh yang mengalami inflamasi memiliki tanda-tanda
sebagai berikut: tumor atau membengkak, calor atau menghangat, dolor
atau nyeri, rubor atau memerah, functio laesa atau daya pergerakan menurun, dan kemungkinan disfungsi organ atau jaringan (Janeway at al,
2001, Murphy at al, 2007).
Nyeri hampir selalu merupakan manifestasi dari proses patologi
yang sering menjadi keluhan utama yang dirasakan pasien sehingga mencari
pertolongan ke dokter atau praktisi kesehatan lain. Rencana penangan nyeri
itu sendiri harus ditujukan terhadap proses yang mendasari dari timbulnya
7
nyeri tersebut, termasuk dalam usaha mengontrol nyeri yang terjadi. Pasien
biasanya menerima penatalaksanaan nyeri dari dokter umum atau spesialis
setelah diagnosis ditegakkan dan penanganan terhadap proses penyakit yang
mendasari nyeri tersebut mulai dilakukan (Morgan et al., 2006)
Marsaban et al (2009) membedakan beberapa tipe atau jenis nyeri, yaitu pertama nyeri nosiseptif yang disebabkan oleh aktivasi nosiseptor
(reseptor nyeri) sebagai respon terhadap respon yang berbahaya, kedua
adalah nyeri neuropatik yaitu nyeri yang disebabkan oleh sinyal yang
diproses di sistem syaraf perifer atau pusat yang menggambarkan kerusakan
sistim syaraf. Terdapat beberapa hal yang sama pada pola nyeri yaitu pola
distribusi temporal dan spasial, karakteristik nyeri (superfisial dan dalam),
gejala-gejala klinis yang diakibatkannya, dan petunjuk-petunjuk penting
lainnya yang dapat mengarahkan ke suatu diagnosis dan penatalaksanaan.
Nyeri akibat kerusakan jaringan bisa terjadi karena ada kerusakan
jaringan itu sendiri (nyeri nosiseptif), karena adanya reaksi inflamasi
(inflammatory pain), dan bisa juga karena adanya kerusakan jaringan syaraf yang disebut nyeri neuropatik (neuropatic pain). Nyeri pasca bedah adalah suatu nyeri akut yang termasuk nyeri patologik dan terjadi oleh sebab
kerusakan jaringan dan reaksi inflamasi. Sensasi nyeri yang dirasakan pasca
bedah bisa disebabkan oleh karena ada sensitisasi syaraf perifer dan
sensitisasi syaraf sentral. Dari segi perjalanan waktu, nyeri terbagi atas nyeri
akut dan nyeri kronik, dimana nyeri pasca bedah termasuk dalam nyeri akut.
Nyeri akut selalu disebabkan oleh adanya kerusakan jaringan (nosiseptif),
8
sedangkan nyeri kronik tidak selalu disebabkan oleh adanya nosiseptif ini.
Nyeri akut yang tidak ditangani dengan baik bisa berkembang menjadi nyeri
kronik (Lalenoh, 2009)
b. Persepsi Nyeri dan Nosisepsi
Salah satu fungsi saraf yang penting adalah menyediakan informasi
tentang adanya ancaman bahaya atau cedera. Stimulasi suhu (>42oC), kimia
(misalnya pH, produk plasma) atau kerusakan mekanis pada ujung sensorik
perifer akan menimbulkan keluhan secara verbal dan usaha menghindar
pada manusia. Nosiseptor adalah aferen-aferen primer yang berespon
terhadap stimulasi yang berbahaya dan intens. Pertama, stimulasi nyeri
mencetuskan aktivitas pada grup aferen primer di neuron-neuron ganglion
sensorik (nosiseptor). Melalui sistem spinal dan berbagai sistem
intersegmental, informasi tersebut mengakses pusat supraspinal di batang
otak dan talamus. Sistem poyeksi ini mewakili dasar rangsangan somatik
dan visera yang memberikan hasil berupa usaha menarik diri atau keluhan
verbal (Marsaban et al, 2009)
Nosisepsi merupakan istilah yang menunjukkan proses penerimaan
informasi nyeri yang dibawa dari reseptor perifer di kulit dan viseral ke
korteks serebri melalui penyiaran neuron-neuron. Neuron-neuron sensorik
pada akar dorsal ganglia mempunyai ujung tunggal yang bercabang ke
akson-akson perifer dan sentral. Akson perifer mengumpulkan input
sensorik dari reseptor jaringan, sementara akson sentral menyampaikan
9
input sensorik tersebut ke medula spinalis dan batang otak. Akson sensorik
(aferen nosiseptif) tersebar luas di seluruh tubuh (kulit, otot, persendian,
visera, meninges) dan terdiri dari tiga macam serabut saraf (Marsaban et al,
2009)
c. Mediator Inflamasi dan Modulator Nyeri
Kerusakan jaringan seperti misalnya akibat infeksi, inflamasi atau iskemia, akan memicu produksi berbagai mediator yang bekerja langsung melalui ligant-gated ion chennel atau dapat pula melalui reseptor metabotropik yang berkaitan dengan sistem second messenger untuk dapat mengaktifkan dan atau mensensitasi nosiseptor. Sistem ini diatur secara khusus dengan memperhatikan hubungan linier antara intensitas rangsangan, aktivitas pada nosiseptor, besar pengaruh pelepasan transmiter spinal dan aktivitas neuraon yang memproyeksi medula spinalis ke otak (Marsaban et al, 2009).
Jumlah mediator inflamasi dan nyeri semakin bertambah dan tidak hanya terbatas dengan mediator-mediator seperti yang di atas, tetapi juga berbagai sitokin, kemokin dan faktor-faktor pertumbuhan yang harus diperhatikan. Akhir-akhir ini diidentifikasi kepentingan relatif untuk setiap perbedaan mediator dan mekanisme kerja pada saat nyeri. (Marsaban et al, 2009)
Tahap proses terjadinya nyeri sebagai berikut : 1. Transduksi
10
dan prostaglandin. Zat kimia ini terlepas ke dalam cairan ekstraseluler yang melingkupi nosiseptor. Kerusakan membran sel akan melepaskan senyawa
phospholipid yang mengandung asam arakhidonat dan terjadi aktivasi ujung
aferen nosiseptif. Asam arakhidonat atas pengaruh prostaglandin (PG)
endoperoxide synthase akan membentuk cyclic endoperoxide (PGG2 dan
PGH2) akan membentuk mediator inflamasi sekaligus mediator nyeri
tromboksan (TXAβ), prostaglandin (PGEβ, PGβα), prostasiklin (PGIβ).
Terbentuk pula leukotrien (LT) atas pengaruh 5-lipooksigenase. Setelah kerusakan jaringan timbul mediator nyeri atau inflamasi berupa substansi P, PGs, LTs dan bradikinin. Dari sel mast dilepaskan histamin. Kombinasi senyawa ini menimbulkan vasodilatasi lokal dan peningkatan permeabilitas vaskuler lokal sehingga membantu gerakan cairan ekstravasasi ke dalam ruang interstisial jaringan rusak. Proses ini mengawali mekanisme respon inflamasi yang merupakan langkah pertama dalam proses pertahanan jaringan dan reparasi luka. Mediator juga mengaktifkan nosiseptor. PGs dan LTs tidak langsung mengaktifkan melainkan mensensitisasi nosiseptor agar dapat distimuli oleh senyawa lain seperti bradikinin, histamin sehingga terjadi hiperalgesia, yaitu respon stimuli yang meningkat, pada kondisi normal sudah menimbulkan sakit. Pelepasan mediator kimiawi terus menerus dapat menyebabkan stimulasi dan sensitisasi terus menerus pula sehingga terjadi hiperalgesia, alodina dan proses berakhir sesudah terjadi proses penyembuhan. Selanjutnya leukotrien D4 (LTD4) mengaktifkan makrofag dan basofil yang akan menstimuli dan meningkatkan pelepasan eikosanoid, yaitu metabolit yang terlepas akibat terjadinya metabolisme
11
asam arakhidonat. Leukotrien D4 juga melepas substansi P dan secara tidak langsung bekerja pada neuron sensoris dengan menstimuli sel lain untuk melepaskan bahan neuron aktif. Lekosit PMN melepaskan leukotrien B4 (LTB4). Keduanya berperan dalam sensitisasi nosiseptor. Pada inflamasi,
sistem imun akan melepaskan sitokin proinflamasi : interleukin Iδ1 , Iδ6,
TNF, IFN. Sitokin ini dengan cepat akan berinteraksi dengan saraf perifer
melalui mediator. Iδ1 berinteraksi dengan neuron sensoris, mengaktifkan
eikosanoid dalam sel seperti fibroblas dan menyebabkan terlepasnya prostaglandin. Platelet dan sel mast melepas serotonin yang langsung mengaktifkan atau mensensitisasi nosiseptor dan menimbulkan hiperalgesia. Proses transduksi dapat dihambat oleh obat anti inflamasi non steroid (AINS) (Setiabudi, 2005).
2. Transmisi
Impuls akan ditransmisi oleh serabut aferen nosiseptif primer
lewat radiks posterior menuju kornu posterior medula spinalis. Serabut
perifer terdiri dari serabut sensorik, motorik somatik, motorik otonomik.
Serabut aferen primer nosiseptif khusus yang menghantarkan impuls
nosiseptif terdapat di kulit, periosteum, sendi, ligamen, otot dan visera.
Serabut yang menghantarkan impuls nosiseptif hanya serabut A dan C,
yang tidak bermielin atau bermielin halus. Stimulus yang dapat direspon
adalah stimulus mekanik, mekanotermal dan polimodal. Impuls di neuron
aferen primer melewati radiks posterior menuju medula spinalis pada
berbagai tingkat dan membentuk badan sel dalam ganglia radiks
12
gelatinosa (lamina II, III), lamina V dan lamina IV. Impuls ditransmisi ke
neuron sekunder dan masuk ke traktus spinotalamikus lateralis. Kornu
posterior berfungsi sebagai jalur masuk desendens dari otak untuk
melakukan modulasi impuls dari perifer. Impuls selanjutnya disalurkan
ke daerah somatosensorik di korteks serebri. Proses transmisi dapat
dihambat oleh anestetik lokal (Sudrajad, 2006)
3. Modulasi
Impuls setelah mencapai kornu posterior medula spinalis akan
mengalami penyaringan intensitas. Sistem pengendali modulasi ini
adalah sistem gerbang kendali spinal atau the gate control theory of pain.. Apabila impuls melebihi ambang sel transmisi maka akan melewati sistem kendali gerbang spinal dan diteruskan ke pusat
supraspinal di korteks somatosensoris. Substansi yang bekerja sebagai
modulator penghambat nyeri di medula spinalis yaitu dinorfin, enkefalin,
noradrenalin, dopamin, serotonin dan gamma amino butyric acid
(GABA). Sedangkan substansi yang meningkatkan nyeri yaitu substansi
P, adenosin triphosphate (ATP) dan asam amino eksitatori (Sudrajad, 2006)
4. Persepsi
Sel transmisi didalam sistim gerbang spinal kendali nyeri
menerima impuls sensoris yang datang dari perifer. Apabila impuls
melebihi atau sama dengan ambang sel transmisi, impuls nosiseptif
tersebut dapat melewati sistim gerbang kendali dan diteruskan ke
13
pusat supraspinal yang lebih tinggi di korteks somatosensoris, kortek
transisional dan sebagainya. Semua impuls nyeri sensoris perifer serta
sinyal kognitif pada korteks afeksi dan kognisi akan berintergrasi dan
menimbulkan persepsi yang diterima sebagai pengalaman nyeri. Secara
sederhana persepsi adalah hasil integrasi dari apa yang ada pada pusat
kognisi, pusat afeksi dan sistem sensoris diskriminatif yang dirasakan
oleh individu, serta bagaimana cara individu tersebut menghadapinya
(Setiabudi, 2005).
Pada awal fase transduksi yang dipicu adanya mediator inflamasi
yang dihasilkan dari kerusakan jaringan seperti prostaglandin, leukotrien
dan prostasiklin yang merupakan hasil metabolisme dari asam arakidonat
(Gambar 2.1). Semakin besar kerusakan jaringan yang ada semakin besar
pula mediator inflamasi yang dihasilkan dan semakin luas juga proses
inflamasi yang terjadi sehingga akibat yang ditimbulkan yaitu nyeri juga
akan semakin besar dirasakan (Baratawidjaja, 2006; Mansjoer, 2003)
Sindroma nyeri inflamasi dan nyeri neuropati dianggap sesuatu yang
berbeda. Inflamasi merupakan fenomena yang khas, yang melibatkan
kaskade dari sel-sel imun , seperti sel mast, netrofil, makrofag dan
limfosit-T. Sel-sel imun tersebut menghasilkan komponen-komponen sebagai
mediator nyeri. Beberapa tipe sel imun juga berperan penting dalam
patogenesa dan berubahnya karakter proses nosisepti pada nyeri neuropatik
perifer. Walaupun peran dan waktu pemunculan sel-sel tersebut belum jelas
benar, mereka tampak bersamaan pada saat proses inflamasi terjadi. Gambar
14
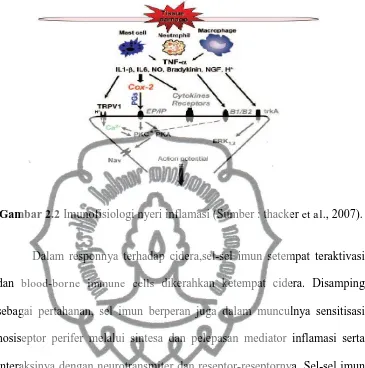
2.2 menjelaskan, pasca cidera sel mast dan makrofag diaktifkan, beberapa
blood-born immune cells termasuk netrofil dilibatkan dalam usaha melakukan aksi algesik baik secara langsung di nosiseptor maupun tidak
langsung dengan melepaskan berbagai mediator imun (Thacker et al., 2007).
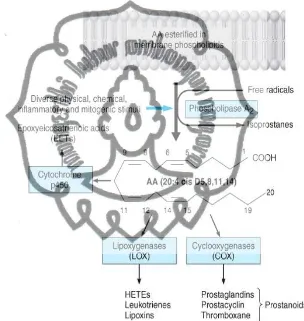
Gambar 2.1 Jalur pelepasan dan metabolisme asam arakidonat
(Sumber: Smyth & Fitgerald, 2012)
15
Gambar 2.2 Imunofisiologi nyeri inflamasi (Sumber : thacker et al., 2007).
Dalam responnya terhadap cidera,sel-sel imun setempat teraktivasi
dan blood-borne immune cells dikerahkan ketempat cidera. Disamping sebagai pertahanan, sel imun berperan juga dalam munculnya sensitisasi
nosiseptor perifer melalui sintesa dan pelepasan mediator inflamasi serta
interaksinya dengan neurotransmiter dan reseptor-reseptornya. Sel-sel imun
,sel glia dan sel saraf membentuk jaringan yang terintegrasi yang
meengkoordinir respon imun dan memodulasi eksitabilitas dari jalur nyeri
(Ren & Dubner, 2010).
Asam arakidonat merupakan prekusor eikosanoid yang paling
penting dan terbanyak, merupakan asam lemak 20-karbon (C20) yang
mengandung emapat ikatan ganda yang dimulai pada posisi omega-6 untuk
menghasilkan asam 5,8,11,1eikosatetraenoat (dinyatakan dengan C20:
4-6). Eikosanoid sendiri adalah hasil produk oksigenasi asam lemak rantai
16
ditemukan bersama prekusornya pada berbagai jenis tumbuhan. Agar
sisntesis eikosanoid dapat terjadi, mula-mula asam arakidonat harus
dilepaskan atau dimobilisasi dari fosfolifid membran oleh satu atau lebih
lipase dari tipe fosfolipase A2 (PLA2) (Gambar 2.1). Setidanya ada tiga
fosfolipase yang memperantarai pelepasan arakidonat dari lipid membran:
PLA2 sitosol, PLA2 sekretori dan PLA2 yang tak bergantung pada kalsium.
Selain itu, arakidonat juga dilepaskan oleh kombinasi fosfolipase C dan
lipase digliserida (Smyth & Fitgerald, 2012)
Setelah terjadinya mobilisasi, asam arakidonat dioksigenasi melalui
empat jalur terpisah: jalur siklooksigenase (COX), lipoksigenase (LOX),
epoksigenase P450 dan isoproston. Sejumlah faktor menentukan jenis
eikosanoid yang disisntesis yaitu spesies, jenis sel dan fenotipe tertentu sel.
(Smyth & Fitgerald, 2012)
a. Jalur siklooksigenase
Dua isozim COX yang unik mengubah asam arakidonat menjadi
endoperoksida prostaglandin. Sintase PGH-1 (COX-1) diekspresikan
secara konstan pada kebanyakan sel tanpa adanya. rangsangan dari luar.
Sebaliknya, sintase PGH-2 (COX-2) dapat dirangsang, ekspresinya
sangat bervariasi bergantung pada stimulus. COX-2 merupakan produk
gen respon dini yang terangsang secara bermakna oleh shear stress, faktor pertumbuhan, promotor tumor dan sitokin. COX-1 menghasilkan
prostanoid unruk perlindungan seperti sitoprotekti epitel lambung,
sedangkan COX-2 merupakan sumber utama prostanoid pada inflamasi
17
dan kanker. Terdapat proses fisiologis dan patofisiologis yang
melibatkan masing-masing enzim secara unik dan ada keadaan lain
ketika keduanya berfungsi secara sinergis. Contohnya, COX-2 epitel
merupakan sumber utama prostasiklin vaskular, sedangkan prostanoid
yang berasal dari COX-2 ginjal penting untuk perkembangan ginjal yang
normal dan pemeliharaan fungsinya. Varian COX-3 telah ditemukan
pada anjing, namun kelihatannya tidak berhubungan secara fungsional
dengan spesies lainnya (Smyth & Fitgerald, 2012, Baratawidjaja, 2006)
Sintase sangat penting karena pada tahap inilah obat antiinflamasi
nonsteroid menimbulkan efek terapeutiknya. Indometasin dan sulindac
bersifat sedikit selektif untuk COX-1. Meklofenamat dan ibuprofen
kira-kira sama kuatnya untuk COX-1 dan COX-2, sedangkan celecoxib,
diklofenak, refecoxib, limiracoxib dan etoricoxib menghambat COX-2
dengan selektivitas yang meningkat. Aspirin mengasetilasi dan
menghambat kedua enzim secara kovalen. Dosis rendah (<100 mg/hari)
menghambat khususnya, namun tidak secara ekslusif untuk COX-1,
sedangkan pada dosis yang lebih tinggi dapat menghambat COX-1 dan
COX-2 (Smyth & Fitgerald, 2012).
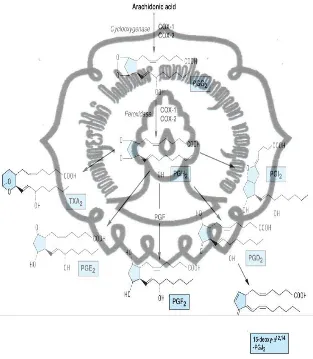
Prostaglandin, tromboksan dan prostasiklin yang secara
keseluruhan disebut sebagai prostanoid dibentuk melalui kerja isomerase
dan sintase. Prostaglandin berbeda satu dengan yang lainnya karena dua
hal: substituen cincin pentana (yang dinyatakan dengan hurup terakhir,
misal, E dan F pada PGE dan PGF) dan jumlah ikatan ganda pada rantai
18
samping (dinyatakan dengan subscript, misal PGE1 dan PGE2.
Prostasiklin (PGI2, epoprostenol) disintesis terutama oleh endotel
vaskular dan merupakan suatu vasodilatator kuat dan inhibitor agregasi
trombosit (Smyth & Fitgerald, 2012).
Gambar 2.3 Biosintesis prostanoid (prostaglandin, tromboksan dan
prostasiklin) (Sumber: Smyth & Fitgerald, 2012)
Tromboksan (TXA2) memiliki efek agregasi trombosit dan
vasokontriksi. Oleh karena itu antagonis TXA2 dan inhibitor sintesisnya
19
penggunaan klinis obat-obat ini (kecuali aspirin) masih harus dipastikan
(Smyth & Fitgerald, 2012).
b. Jalur lipoksigenase
Metabolisme asam arakidonat oleh 5-,12-, dan 15-lipoksigenase
(LOX) menghasilkan produk asam hidroperoksieikosatetraenoat
(HPETE) dan leukotrien (Gambar 2.4). arakidonat yang dimetabolisme
melalui penggabungan molekul oksigen oleh 5-LOX, disertai dengan
protein pengaktivasi 5-LOX (FLAP) kemudian menghasilkan epoksida
leukotrien A4 (LTA4) yang tidak stabil. Zat antara ini dapat berubah
menjadi dihidroksi leukotrien B4 atau berkonjugasi dengan glutation
untuk menghasilkan leukotrien C4 (LTC4) yang mengalami degradasi
bertahap pada gugus gulation oleh peptidase untuk membentuk LTD4
dan LTE4. Ketiga produk ini dikenal sebagai leukotrien sisteinil atau
peptidoleukotrien. Secara neuroendokrin LTC4 dan LTD4 merangsang
sekresi LHRH dan LH (Smyth & Fitgerald, 2012).
LTC4 dan LTD4 merupakan bronkokontriktor yang poten
menyebabkan peningkatan permeabilitas mikrovaskular, eksudasi
plasma dan sekresi mukus di saluran napas dan dikenal sebagai
komponen utama dari substansi bereaksi-lambat anafilaksis (SRS-A)
yang disekresikan pada asma dan anafilaksis. Kedua leukotrien ini juga
yang berperan penting dalam kemampuan mengundang sel-sel inflamasi
bermigrasi ke tempat dimana jaringan atau sel mengalami kerusakan
20
atau inflamasi yang disebut efek kemotaktik (Smyth & Fitgerald, 2012,
Crawley et al, 1995).
LTC4 dan LTD4 efek pada jantung dapat mengurangi kontraktilitas
miokardium dan aliran darah koroner yang menyebabkan depresi
miokardium (Smyth & Fitgerald, 2012).
Gambar 2.4 Biosistesis leukotrien (LT): LTC4, LTD4 dan LTE4 secara
keseluruhan dikenal sebagai leukotrien sisteinil (CysLTs). glutamil
transpeptidase (GT), glutamil leukotrienase (GL) (Sumber: Smyth &
Fitgerald, 2012)
21
Leukotrien diyakini berperan pada patogenesis peradangan terutama
pada penyakit-penyakit kronis seperti asma dan irritable bowel disease
(Madsen et al, 1992). Leukotrien memiliki peran yang sangat besar terhadap
patofisiologi terjadinya penyakit-penyakit inflamasi berat dan pemilihan
obat anti lipoxigenase aktivity merupakan pilihan yang tepat dalam penanganan penyakit inflamasi (Kumaraswamy & Satish 2008).
Leukotrien juga diprediksi memiliki andil terhadap timbulnya nyeri
kronis pasca operasi, ini dikaitkan dengan kemampuan leukotrien sebagai
mediator kemotaktik. Trauma pembedahan menghasilkan pelepasan
berbagai macam mediator inflamasi dari sel mast (seperti prostaglandin,
interleukin 6 dan sitokinnya) dan hal ini dapat mensensitisasi aferen sensoris
dan menyebabkan nyeri. Biasanya proses ini berkurang seiring dengan
penyembuhan luka. Dalam beberapa kasus, dikatakan bahwa proses
inflamasi ini menetap (contohnya proses inflamasi disekitar mesh yang
dipasang pada herniarepair), menyebabkan perubahan plastisitas di medula
spinalis. Mekanisme ini sebenarnya bukan merupakan faktor penyebab pada
kebanyakan pasien dengan nyeri kronis pasca bedah (Niraj & Rowbotham,
2011).
Sindroma nyeri inflamasi dan nyeri neuropati dianggap sesuatu yang
berbeda. Inflamasi merupakan fenomena yang khas, yang melibatkan
kaskade dari sel-sel imun , seperti sel mast, netrofil, makrofag dan
limfosit-T. Sel-sel imun tersebut menghasilkan komponen-komponen sebagai
mediator nyeri. Beberapa tipe sel imun juga berperan penting dalam
22
patogenesa dan berubahnya karakter proses nosisepti pada nyeri neuropatik
perifer. Walaupun peran dan waktu pemunculan sel-sel tersebut belum jelas
benar, mereka tampak bersamaan pada saat proses inflamasi terjadi. Gambar
2.1 menjelaskan, pasca cidera sel mast dan makrofag diaktifkan, beberapa
blood-born immune cells termasuk netrofil dilibatkan dalam usaha melakukan aksi algesik baik secara langsung di nosiseptor maupun tidak
langsung dengan melepaskan berbagai mediator imun (Thacker et al., 2007).
Dalam responnya terhadap cidera,sel-sel imun setempat teraktivasi,
dan blood-borne immune cells dikerahkan ketempat cidera. Disamping sebagai pertahanan, sel imun berperan juga dalam munculnya sensitisasi
nosiseptor perifer melalui sintesa dan pelepasan mediator inflamasi serta
interaksinya dengan neurotransmiter dan reseptor-reseptornya. Sel-sel imun
,sel glia dan sel saraf membentuk jaringan yang terintegrasi yang
mekoordinir respon imun dan memodulasi eksitabilitas dari jalur nyeri (Ren
& Dubner, 2010).
23
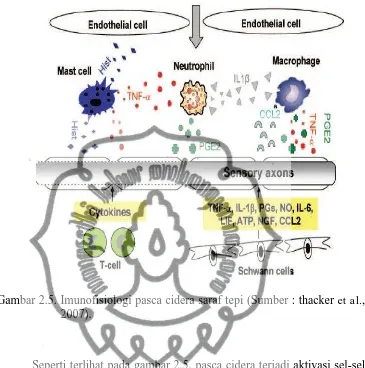
Gambar 2.5. Imunofisiologi pasca cidera saraf tepi (Sumber : thacker et al., 2007).
Seperti terlihat pada gambar 2.5, pasca cidera terjadi aktivasi sel-sel
imun residen, elemen-elemen non neural ( sel Schwann, sel mast, netrofil,
makrofag dan sel T) ikut terlibat serta berproliferasi dan melepaskan TNFα,
IL-1 , Iδ-6, 2, histamin, PGE2 dan NGF yg memicu serta mempertahankan
abnormalitas sensoris pasca cidera (thacker et al., 2007).
Hingga saat ini dikenal ada dua macam nyeri persisten kronis, yaitu
nyeri nosiseptif dan nyeri neuropati. Nyeri nosiseptif berhubungan dengan
proses peradangan akibat cidera jaringan, sedangkan nyeri neurogenik
timbul akibat kerusakan saraf perifer atau saraf sentral. Pada nyeri
24
pada serabut A dan serabut C yang bertanggung jawab terhadap sensitisasi,
penyertaan nosiseptor yang normalnya tidak aktif, aktivasi kanal ionik dan
reseptor membran (Pace et al, 2006).
Selama inflamasi dan neuropati terjadi perubahan fenotipik serabut
ganglion dorsalis yaitu terjadi peningkatan eksitabilitas, perubahan sinyal
sistem imun di SSP, dan modifikasi endokrin sehingga setelah kerusakan
jaringan, nosiseptor menjadi hipereksitabel. Interaksi sel-sel imun dan sel
glia dengan sistem saraf akan merubah sensitivitas nyeri dan memediasi
transisi nyeri akut ke nyeri kronis (Ren & Dubner, 2010).
Nyeri berhubungan dengan segala kerusakan dari permukaan kulit.
Intensitas dan durasi dari nyeri tergantung sifat trauma itu sendiri, proses
penyembuhan, dan faktor dari individu. Pelepasan mediator nyeri
merupakan mekanisme dalam menanggapi nyeri tersebut sehubungan
dengan adanya stimulus perifer tersebut. Berbagai macam mediator nyeri
yang dikeluarkan sangat berguna dalam proses penyembuhan luka selama
beberapa waktu, tetapi dilaporkan bahwa pelepasan mediator nyeri yang
terjadi terus menerus melewati periode inflamasi akan menyebabkan efek
yang kurang baik atau merusak proses penyembuhan luka itu sendiri
(Widgerow & Kalaria, 2012).
25
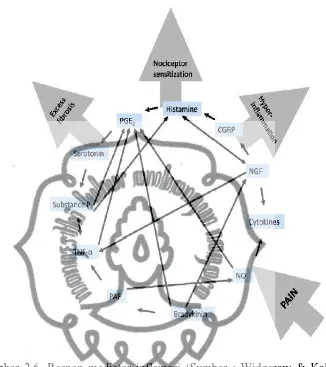
Gambar 2.6. Respon mediator inflamasi (Sumber : Widgerow & Kalaria, 2012).
Pembebasan mediator nyeri yang berlebihan bisa menyebabkan
hipersensitisasi pada nosiseptor, hiperinflamasi seluler, perubahan matrik
ekstraseluler, dan potensial mengakibatkan terjadinya jaringan fibrotik yang
berlebihan. Pada keadaan nyeri kronis bisa jadi disebabkan oleh pelepasan
mediator yang terjadi berlarut-larut (Widgerow & Kalaria, 2012).
26 d. Nyeri Kronis Pasca Bedah
Nyeri kronis pasca bedah adalah nyeri yang menetap setidaknya
selama tiga bulan setelah tindakan bedah berlangsung. Nyeri yang timbul
akibat konsekuensi dari suatu keganasan atau infeksi kronis tidak termasuk
dalam definisi ini. Nyeri kronis pasca bedah bisa terjadi pada operasi besar
seperti amputasi, penggantian sendi, dan lain sebagainya, ataupun
operasi-operasi kecil seperti operasi-operasi hernia dan vasektomi (Akkaya & Ozkan, 2009)
Kebanyakan referensi menyebutkan kurang lebih 80% pasien
mengalami nyeri pasca operasi yang pengobatannya tidak adekuat. Telah
diamati bahwa 50% pasien mungkin menderita nyeri kronis pasca operasi
termasuk depresi ringan dan katastropi akibat nyeri (Harsoor, 2011).
Nyeri kronis pasca bedah terjadi melalui mekanisme kompleks yang
belum jelas. Berbagai mekanisme bertanggung jawab atas sindroma nyeri
yang berbeda, bahkan setelah suatu tindakan operasi yang sama (Akkaya &
Ozkan, 2009).
Saat ini banyak data dari berbagai penelitian mengenai seberapa
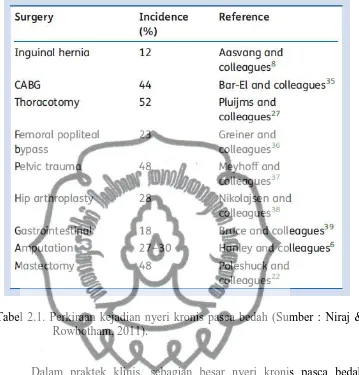
sering kejadian nyeri kronis pasca operasi. Tabel 2.1 menyajikan salah satu
contoh dari penelitian tentang data kejadian nyeri kronis pasca operasi dari
berbagai macam prosedur pembedahan. Tetapi, dari berbagai penelitian,
estimasi seberapa sering kejadian nyeri kronis pasca operasi dari
masing-masing prosedur sangat lebar, sebagai contoh, mastektomi 20-30%,
amputasi 50-85%, histerektomi 30%, bedah jantung 30-55%, hernia
5-35%, dan torakotomi 5-65% (Niraj & Rowbotham, 2011)
27
Nyeri kronis pasca bedah dapat disebabkan oleh inflamasi yang
sedang berlangsung maupun sebagai manifestasi nyeri neuropatik akibat
cedera saraf perifer besar pada saat tindakan bedah. Pada nyeri yang
disebabkan oleh inflamasi terjadi peningkatan kepekaan rasa sakit sebagai
respon terhadap cedera jaringan dan inflamasi. Hal ini terjadi akibat
pelepasan mediator inflamasi, yang kemudian menurunkan ambang
nosiseptor penginervasi jaringan yang mengalami inflamasi tersebut
(sensitisasi perifer). Bila terjadi peningkatan rangsangan (eksitabilitas)
neuron sistem saraf pusat (sensitisasi sentral), nyeri inflamasi dapat timbul
sebagai respon berlebihan terhadap input sensoris biasa. Nyeri neuropatik
merupakan nyeri yang timbul setelah cedera saraf dan sistem transmisi
sensorik di sumsum tulang belakang dan otak (Akkaya & Ozkan, 2009).
28
Tabel 2.1. Perkiraan kejadian nyeri kronis pasca bedah (Sumber : Niraj & Rowbotham, 2011).
Dalam praktek klinis, sebagian besar nyeri kronis pasca bedah
merupakan nyeri neuropatik. Cedera saraf utama yang melewati lokasi
operasi merupakan salah satu prasyarat terjadinya nyeri kronis pasca bedah.
Pada sekelompok kecil pasien, respon peradangan kontinu dapat
memberikan kontribusi terhadap timbulnya nyeri inflamasi persisten,
misalnya nyeri yang terjadi setelah operasi hernia inguinalis mesh.
Berdasarkan temuan elektromiografi setelah dilakukan torakotomi, terdapat
cedera saraf interkostal di sekitar tempat insisi hingga 50-100%. Selain itu,
tingkat kerusakan saraf, yang dinilai berdasarkan adanya perubahan ambang
29
bekas operasi torakotomi, berkorelasi dengan intensitas nyeri kronis
(Akkaya & Ozkan, 2009).
Namun, terdapat penelitian klinis yang bertentangan dengan
penelitian di atas. Maguire et al. dalam Taylan & Derya (2009) melakukan uji elektrofisiologi terhadap pasien yang akan dilakukan torakotomi
sebelum, segera setelah operasi, minggu ke enam pasca operasi dan bulan
ketiga pasca operasi. Mereka tidak menemukan adanya hubungan antara
cedera saraf interkostal dan nyeri kronis. Perlu dilakukan penelitian lebih
lanjut mengenai kontribusi sistem saraf pusat dan perifer untuk mengetahui
pada tingkat mana suatu lesi dapat menimbulkan neyri neuropatik melalui
cedera saraf serta cedera jaringan selain saraf yang rawan menimbulkan
nyeri neuropatik (Akkaya & Ozkan, 2009).
Strategi yang bagus untuk mencegah terjadinya nyeri kronis pasca
bedah adalah dengan dengan mengidentifikasi faktor-faktor yang mungkin
menjadi penyebab meningkatnya kejadian nyeri kronis pasca bedah. Jika ini
bisa dilakukan, maka intervensi yang spesifik bisa kita lakukan. Beberap
faktor yang yang dilaporkan berhubungan dengan terjadinya nyeri kronis
pasca bedah adalah :
a. Nyeri praoperasi
Beratnya nyeri sebelum operasi telah menunjukkan di beberapa
penelitian berhubungan dengan timbulnya yeri kronis pasca bedah. Hal
ini pertama kali dikemukakan sehubungan dengan phantom limb pain
setelah amputasi. Disebutkan juga terdapat hubungan yang kuat pada
30
prosedur pembedahan hernia dan torakotomi (Niraj & Rowbotham,
2011).
Dalam penelitian pada pasien yang menjalani operasi hernia, Page
et al. menemukan bahwa sekitar seperempat dari seluruh jumlah pasien tidak merasakan sakit saat beristirahat sebelum operasi hernia, setengah
jumlah pasien merasakan sakit ringan, dan sisanya merasakan nyeri
ringan sampai sedang saat beristirahat sebelum operasi (Akkaya &
Ozkan, 2009).
b. Cedera syaraf
Lesi pada syaraf perifer juga sering dikaitkan dengan kejadian
nyeri kronis pasca bedah. Hal ini faktor yang paling penting pada
beberapa penelitian pasca torakotomi, dan kejadian kerusakan syaraf
telah memperlihatkan sebagai prediksi yang signifikan setelah hernia
repair. Kerusakan syaraf sering berhubungan dengan tanda klasik dari
nyeri neuropatik (Niraj & Rowbotham, 2011).
c. Proses inflamasi yang menetap
Trauma pembedahan menghasilkan pelepasan dari berbagai macam
mediator inflamasi (seperti prostaglandin, sitokin) dan hal ini dapat
mensensitisasi aferen sensoris dan menyebabkan nyeri. Biasanya proses
ini berkurang seiring dengan penyembuhan luka. Dalam beberapa kasus,
dikatakan bahwa proses inflamasi ini menetap (contohnya proses
inflamasi disekitar mesh yang dipasang pada herniarepair), menyebabkan
perubahan plastisitas di medula spinalis. Mekanisme ini sebenarnya
31
bukan merupakan faktor penyebab pada kebanyakan pasien dengan nyeri
kronis pasca bedah (Niraj & Rowbotham, 2011).
d. Kuatnya nyeri pada awal pasca operasi
Kuatnya nyeri pada awal pasca operasi menjadi hal yang sangat
penting pada beberapa situasi. Efek yang diberikan juga bervariasi
tergantung prosedur yang dijalani. Sebagai contoh, nyeri yang
berlangsung selama 30 hari pasca operasi dilaporkan menjadi prediktor
yang signifikan pada operasi hernia repair, tetapi penelitian lain pada torakotomi hal itu tidak terjadi (Niraj & Rowbotham, 2011).
Banyak penelitian terhadap nyeri kronis pasca bedah
mempublikasikan tentang pentingnya perawatan adekuat nyeri pasca
operasi pada periode akut (Akkaya & Ozkan, 2009).
e. Faktor genetik
Dalam populasi umum, kepekaan terhadap nosiseptif fisiologis dan
nyeri klinis dapat berbeda pada masing-masing individu. Dengan
demikian, dalam generasi yang berbeda serta tingkat pengalaman
merasakan nyeri yang berbeda, masing-masing individu dapat
memperlihatkan respon yang berbeda pula (Akkaya & Ozkan, 2009).
f. Faktor Pembedahan
Beberapa faktor bedah penting yang mungkin berkaitan dengan
terjadinya nyeri kronis pasca bedah, yaitu: durasi operasi, teknik bedah
(laparoskopi vs bedah terbuka), lokasi dan jenis sayatan, pengalaman ahli
bedah, dan tempat di mana intervensi bedah dilakukan. Peters et al.
32
menemukan lebih banyak nyeri kronis yang terjadi setelah operasi lama
yang berlangsung lebih dari 3 jam (Akkaya & Ozkan, 2009).
g. Faktor Psikososial
Terdapat banyak artikel yang berhubungan dengan efek faktor
psikososial pada nyeri pasca operasi akut. Katz et al. menyimpulkan bahwa kecemasan pra operasi adalah faktor risiko dalam terbentuknya
nyeri sampai 30 hari setelah operasi payudara. Insiden nyeri pasca
operasi akut dipengaruhi oleh catastrophization (Keyakinan negatif dan respon berlebihan) (Akkaya & Ozkan, 2009).
e. Proses Penyembuhan Luka
Penyembuhan luka merupakan proses kompleks dan dinamis dari
perbaikan struktur sel dan jaringan. Penyembuhan luka melibatkan
berbagai proses dengan urutan : hemostasis, inflamasi akut, regenerasi sel
parenkim, migrasi dan proliferasi sel parenkim, sintesis protein ECM,
remodeling jaringan ikat dan komponen parenkim, kolagenasi dan
akuisisi kekuatan kekuatan luka (Winarto, 2005)
proses penyembuhan luka secara sederhana dibagi menjadi tiga
fase. Yang pertama adalah fase inflamasi, kemudian diikuti oleh fase
proliferasi,dan diakhiri dengan fase maturasi atau remodeling
(Prasetyono, 2009).
1. Fase Inflamasi
Fase inflamasi terjadi sejak hari pertama terjadinya luka
sampai kira-kira hari kelima pasca trauma. Fase inflamasi dimulai
33
dengan adanya peristiwa hemostasis yang terjadi dalam beberapa jam
setelah trauma, dengan konstriksi pembuluh darah dan pembentukan
formasi jala fibrin, sementara itu terjadilah reaksi inflamasi (Guo &
Dipietro, 2010).
Vasokonstriksi akan diikuti dengan vasodilatasi kapiler,
dengan dihasilkannya serotonin dan histamin oleh sel mast yang
meningkatkan permeabilitas kapiler. Lekosit untuk selanjutnya akan
mengeluarkan sitokin proinflamasi dan faktor pertumbuhan untuk
mengaktifkan proses inflamasi. Fase awal dari proses inflamasi
ditandai dengan perekrutan neutrofil yang mempunyai peran penting
untuk fagositosis dan mensekresi protease untuk membunuh bakteri
serta membantu proses degradasi jaringan nekrotik. Lebih jauh,
neutrofil berfungsi sebagai chemoattractans dari sel-sel yang lain untuk terlibat dalam proses inflamasi (Reinke & Sorg, 2012).
2. Fase Proliferasi
Fase proliferasi terjadi kira-kira hari ketiga sampai hari
kesepuluh pasca trauma. Fokus utama proses penyembuhan pada fase
ini adalah penutupan luka dan perbaikan jaringan vaskuler (Reinke &
Sorg, 2012).
Fase ini ditandai dengan pembentukan jaringan granulasi pada
luka. Jaringan granulasi merupakan kombinasi dari elemen seluler
termasuk fibroblas dan sel inflamasi, bersamaan dengan timbulnya
34
kapiler baru tertanam dalam jaringan longgar ekstraseluler dari matrik
kolagen, fibronektin, dan asam hialuronik (Sudrajad, 2006)
Proses epitelisasi dimulai dari tepi luka oleh sel punca dari
folikel rambut dan kelenjar keringat. Proses ini diaktivasi oleh jalur
sinyal dari sel epitel dan nonepitel pada tepi luka yang melepaskan
beberapa sitokin dan faktor pertumbuhan seperti EGF, KGF, IGF-1,
dan NGF (Reinke & Sorg, 2012).
3. fase maturasi
fase ini berlangsung dari hari ke-7 dan bisa berlangsung lebih
dari satu tahun. Segera setelah matrik ekstraseluler terbentuk maka
dimulailah reorganisasi. Kolagen berkembang cepat menjadi faktor
utama pembentuk matriks. Serabut kolagen pada permulaan
terdistribusi acak membentuk persilangan dan beragregasi menjadi
bundel-bundel fibril yang secara perlahan menyebabkan penyembuhan
jaringan dan meningkatkan kekakuan dan kekuatan ketegangan.
Sesudah lima hari periode jeda, dimana saat ini bersesuaian dengan
pembentukan jaringan granulasi awal dengan matriks sebagian besar
tersusun dari fibronektin dan asam hialuronidase, terjadi peningkatan
cepat dari kekuatan tahanan luka karena fibrogenesis kolagen.
Pencapaian kekuatan tegangan luka berjalan lambat. Sesudah 3
minggu kekuatan penyembuhan luka mencapai 20% dari kekuatan
akhir. Bagaimanapun, kekuatan akhir penyembuhan luka tetap kurang
dibanding dengan kulit yang tidak pernah terluka, dengan kekuatan
35
tahanan maksimal jaringan parut hanya 70 % dari kulit utuh
(Sudrajad, 2006).
Remodeling aktif jaringan parut akan terus berlangsung sampai
satu tahun dan tetap berjalan dengan lambat seumur hidup. Pada proses
remodeling terjadi reduksi secara perlahan pada vaskularisasi dan
selularitas jaringan yang mengalami perbaikan sehingga terbentuk jaringan
parut kolagen yang relatif avaskuler dan aseluler. Pengerutan luka yang
terjadi karena pergerakan ke dalam dari tepi luka juga merupakan faktor
berpengaruh dalam penyembuhan luka dan harus dibedakan dengan
kontraktur (Sudrajad, 2006).
f. Pengukuran Intensitas Nyeri :
1. Verbal Rating Scale : Metode ini menggunakan suatu word list untuk mendeskripsikan nyeri yang dirasakan. Pasien disuruh memilih kata –
kata atau kalimat yang menggambarkan karakteristik nyeri yang
dirasakan dari word list yang ada. Penilaian ini ada beberapa kriteria : - Tidak nyeri (none)
- Nyeri ringan (mild)
- Nyeri sedang (moderat)
- Nyeri berat (severe)
- Nyeri sangat berat ( very severe)
2. Numerical Rating Scale : Metode ini menggunakan angka – angka untuk
menggambarkan range intensitas nyeri dari angka 0-10. “0”
36
menggambarkan tidak ada nyeri. Sedangkan “10” menggambarkan nyeri
hebat. Gambar 2.7 Numeric Pain Intensity Scale
3. Visual analogue Scale : metode ini paling sering digunakan untuk mengukur intensitas nyeri, dengan menggunaan garis sepanjang 10 cm
yang menggambarkan keadaan tidak nyeri sampai nyeri yang sangat
hebat. Pasien menandai angka pada garis yang menggambarkan intensitas
nyeri yang dirasakan. Metode ini tidak dapat digunakan pada anak
dibawah 8 tahun. Gambar 2.8 Visual analogue Scale
4. McGill Pain Questionare : metode ini menggunakan chek list untuk
mendeskripsikan gejala-gejala nyeri ysng dirasakan. Metode ini
menggambarkan nyeri dari berbagai aspek antara lain sensorik, afektif,
dankognitif. Intenitas nyeri digambarkan dengan menggunakan ranking
dari 0-3.
5. Faces Pain Scale : metode ini dengan cara melihat mimic wajah pasien
37
Gambar 2.9. Wong Baker Faces Pain Rating Scale
2. INTERLEUKIN 6
Istilah limfokin pertama kali digunakan pada tahun 1960 untuk
golongan protein yang diproduksi oleh limfosit B dan T yang diaktifkan.
Ternyata sel-sel lain seperti makrofag, eosinofil, sel mast, sel endotel, dan
epitel juga memproduksi sitokin. Oleh karena itu istilah yang lebih tepat
adalah sitokin. Sitokin merupakan protein sistim imun yang mengatur
interaksi antar sel dan memacu reaktivitas imun, baik pada imunitas
nonspesifik maupun spesifik (Baratawidjaja, 2006).
Menurut definisinya sitokin adalah polipeptida yang diproduksi
sebagai respon terhadap mikroba dan antigen lain yang diperantarai dan
mengatur reaksi imunologik dan reaksi inflamasi. Banyak sitokin yang telah
diidentifikasi, baik dari struktur molekul maupun fungsinya. Beberapa
diantaranya merupakan mediator utama yang meningkatkan reaksi
imunologik yang melibatkan makrofag, limfosit, dan sel-sel lainnya, jadi
berfungsi sebagai imunomodulator spesifik maupun non-spesifik. Pada 2nd International Lymphokin Workshop di Swiss tahun 1979, dicapai kesepakatan untuk memberi satu nama generik kepada mediator-mediator
tersebut yang ternyata mempunyai sifat biokimia dan sifat biologik serta
fungsi yang serupa. Nama yang disepakati adalah intrleukin yang berarti
38
adanya komunikasi antar sel leukosit. Hingga sekarang telah ditemukan
beberapa jenis interleukin yaitu IL-1 hingga IL-35, dan berbagai percobaan
telah dilakukan untuk menentukan fungsi masing-masing (Kresno, 2010).
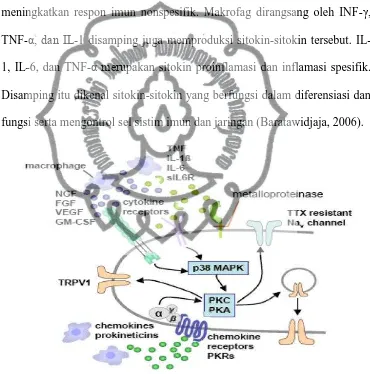
Sitokin proinflamasi diinduksi berbagai sel atas pengaruh mikroba,
trauma atau kerusakan sel penjamu. Sitokin mengawali, mempengaruhi dan
meningkatkan respon imun nonspesifik. Makrofag dirangsang oleh INF- ,
TNF-α, dan Iδ-1 disamping juga memproduksi sitokin-sitokin tersebut.
IL-1, IL-6, dan TNF-α merupakan sitokin proinflamasi dan inflamasi spesifik.
Disamping itu dikenal sitokin-sitokin yang berfungsi dalam diferensiasi dan
fungsi serta mengontrol sel sistim imun dan jaringan (Baratawidjaja, 2006).
Gambar 2.10 Alur ikatan sitokin dengan nosiseptor
Interleukin-6 merupakan sitokin proinflamasi yang berperan dalam
maturasi dan aktivasi neutrofil, maturasi makrofag, serta deferensiasi dari
limfosit-T sitotoksik dan sel NK. IL-6 adalah salah satu mediator yang
paling awal dan penting dalam induksi dan mengontrol sintesa protein fase
39
akut pada trauma, infeksi, pembedahan, dan luka bakar. Setelah terjadi
cedera, konsentrasi plasma IL-6 bisa dideteksi dalam 60 menit dengan
konsentrasi puncak antara 4 sampai 6 jam, dan dapat bertahan sampai 10
hari. IL-6 dipertimbangkan sebagai marker yang sangat relevan dari derajat
kerusakan jaringan dalam prosedur pembedahan yang berhubungan dengan
morbiditas pasca operasi (Oliveira et al., 2011).
3. KETOTIFEN
Ketotifen merupakan derivat dari benzocycloheptathiophene yang
mempunyai efek anti histamin dan anti anafilaktik. Hal itu ditunjukkan
dengan kemampuan ketotifen dalam mengeblok pelepasan mediator dari sel
mast peritonium tikus secara in vitro. Ketotifen mencegah terjadinya
pelepasan histamin dan leukotrien dari basofil dan jaringan paru, untuk
menjadi antagonis histamin pada reseptor H1, untuk menghambat ambilan
kalsium, untuk memblok reaksi anafilaktik kulit pasif, dan untuk mencegah
asma baik yang disebabkan oleh obat atau yang disebabkan oleh alergen.
Beberapa penelitian tentang ketotifen menunjukkan efek yang yang
bermanfaat dalam terapi asma (Sayeed, 2011).
Ketotifen fumarat merupakan obat antihistamin dan antialergi yang
telah diketahui menghambat degranulasi sel mast melalui mekanisme
calcium-dependent, dan memblok histamin secara non kompetitif pada
reseptor H1. Ketotifen telah disetujui oleh FDA sebagai terapi tambahan
pada dewasa dan anak diatas 15 tahun dengan asma, dan baru-baru ini FDA
40
mengijinkan ketotifen dipakai sebagai terapi alergi pada mata (Monument et al., 2012).
a. Struktur Kimia
Ketotifen memiliki nama bangun yaitu
4-(1-metilpiperidin-ylidene)- 4,9-dihidro-10H-benzo [4,5] siklopenta [1,2-b] tiofen-10-satu
hydrogen (E)-butadiana. Formula molekul dari ketotifen adalah
C23H23NO5S, dan memiliki berat molekul 425,49742 (Serna, 2006).
b. Mekanisme Kerja
Infiltrasi dan degranulasi sel mast memiliki peran dalam proses
inflamasi. Degranulasi sel mast akan melepaskan berbagai macam
mediator inflamasi seperti sitokin, endothelin, growth factor dan enzim
proteolitik. Sehubungan dengan antagonis resptor histamin, beberapa
efeknya kemungkinan berhubungan dengan inhibisi terhadap pelepasan
sel mast dan derivat netrofil mediator inflamasi. Pada banyak penelitian
dan kondisi klinis, ketotifen tercatat mampu mengurangi degranulasi sel
mast dan mengurangi pelepasan histamin, protease sel mast,
myeloperoxidase leukotriens, PAF dan bermacam-macam prostaglandin.
Ketotifen juga menghambat agregasi polimorfonuklear dan migrasi serta
mengurangi respon inflamasi. Hal ini secara langsung akan mengurangi
fungsi eosinofil dan viabilitasnya (Khurana et al., 2011).
Ketotifen melakukan blokade secara non kompetitif terhadap
ikatan histamin 1 dengan reseptornya dan menghambat degranulasi sel
mast yang diperantarai oleh kalsium. Ketotifen merupakan agen
41
stabilisator sel mast yang mencegah degranulasi sel mast dengan cara
mencegah influk transmembran dari ion kalsium. Ketotifen dapat
memblokade pelepasan mediator oleh sel mast tikus secara in vitro.
(Khurana et al., 2011). Ketotifen juga memblok konsentrasi cyclyc-AMP (c-AMP) yang diperlukan pada saat akhir degranulasi vesikel (Monument
et al., 2010)
Ketotifen menghambat produksi sitokin dari sel TH2. NO adalah
modulator sel Mast yang menginduksi aksi pro-inflamasi. Sel Mast juga
berperan pada kerusakan ginjal melalui aktivasi lokal sistem
renin-angitensin dalam nefrophati IgA. Sekresi sitokin dari sel Mast dan sel
Th2 seperti TGF-B yang memfasilitasi produksi IgA. Disini ada
peningkatan IL-4,5,6 yang merupakan sitokin dari sel TH2 dan sel Mast.
Produksi IgA intestinal yang berlebihan diketahui sebagai salah satu
penyebab nefrophati IgA. Ketotifen mengaktivasi distribusi NOS di
lapisan luar korteks dan glomerulus dan menyebabkan penurunan
resistensi pembuluh darah renal (Young-Sun et al., 2009).
c. Farmakokinetik
Ketotifen diabsorbsi dengan baik setelah pemberian secara oral,
mencapai kadar puncak dalam plasma dalam 2-4 jam setelah pemberian.
Namun demikian, belum ada informasi yang cukup mengenai absorbsi
dari ketotifen sediaan tablet lepas lambat. Karena adanya efek first-pass metabolism, bioavailabilitas obat ini hanya 50%. Kadar puncak dalam plasma setelah dosis oral multipel sebesar 1mg, 2 kali sehari adalah 1.92