POTENSI ALANG-ALANG (Imperata cylindrica (L.) Beauv.) DALAM PRODUKSI ETANOL MENGGUNAKAN BAKTERI Zymomonas mobilis
Sevy Dwi Kartikasari1*, Ir. Sri Nurhatika M.P1, dan Dr. Anton Muhibuddin, S.P, M.P2 Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam,
Institut Teknologi Sepuluh Nopember (ITS) Jl. Arief Rahman Hakim, Surabaya 60111
Abstrak
Salah satu sumber selulosa yang potensial untuk dijadikan bahan baku pembuatan etanol adalah alang-alang (Imperata cylindrica (L.) Beauv.). Pada umumnya, produksi etanol dari alang-alang menggunakan yeast Saccharomyces cerevisiae. Penelitian ini menggunakan bakteri Zymomonas mobilis yang memiliki kemampuan memproduksi etanol dengan hasil lebih tinggi dan cepat. Penelitian dilakukan pada bulan November 2012 sampai Mei 2013 di laboratorium Jurusan Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, ITS. Penelitian bertujuan untuk mengetahui potensi alang-alang (I. cylindrica (L) Beauv.) dalam produksi etanol menggunakan bakteri Zymomonas mobilis pada konsentrasi inokulum dan waktu fermentasi yang optimum. Penelitian dilakukan melalui tiga langkah utama yaitu pretreatment substrat, hidrolisis enzimatik selulosa menjadi glukosa oleh Penicillium sp., dan fermentasi etanol oleh Z. mobilis. Kompleks lignoselulosa alang-alang dilakukan pretreatment secara mekanik, fisik, dan kimia meliputi pengeringan selama 12 jam, pemotongan, penggilingan, dan perendaman dalam larutan NaOH 2% dan pemanasan pada suhu 121°C selama 1 jam. Selulosa hasil pretreatment dihidrolisis oleh enzim selulase yang disekresikan oleh kapang Penicillium sp., glukosa yang dihasilkan kemudian difermentasikan secara anaerob oleh Z. mobilis. Fermentasi dilakukan menggunakan berbagai perlakuan konsentrasi inokulum (0, 5, 10, dan 15%) dan lama fermentasi (0, 3, 5, 7, dan 9 days) serta dianalisa menggunakan uji Analysis of Varians (ANOVA). Masing-masing perlakuan dilakuan 2 kali pengulangan, sehingga diperoleh 40 unit percobaan, dengan parameter yang diamati adalah kadar etanol. Hasil penelitian menunjukkan bahwa alang-alang (I. cylindrica (L.) Beauv.) berpotensi untuk dijadikan sebagai bahan baku produksi etanol dengan konsentrasi etanol tertinggi diperoleh dari interaksi antara konsentrasi inokulum 10% dan waktu fermentasi oleh Z. mobilis selama 7 hari yaitu sebesar 9,02 % (v/v). Oleh karena itu, alang-alang dapat menjadi sumber alternatif lain dalam produksi etanol.
Kata kunci : alang-alang, etanol, Imperata cylindrica, selulosa, Zymomonas mobilis. Abstract
One of the potential source of cellulose used as a feedstock in ethanol production is congongrass (I. cylindrica (L.) Beauv.). Many researches used yeast Saccharomyces cerevisiae to ferment glucose to ethanol from congongrass. This research used a bacterium, Zymomonas mobilis, that has potency to produce ethanol higher and faster. The research was held on November 2012 until May 2013 in laboratories of Biology Department, Mathematic and Science Faculty, Sepuluh Nopember Institute of Technology. The research was aimed to determine the potency of congongrass (I. cylindrica (L) Beauv.) in ethanol production using Zymomonas mobilis with various treatments of optimum inoculum size and fermentation duration. The research was conducted in three main steps in this ethanol cellulose production: substrate pretreatment, cellulose to glucose enzymatic hydrolysis conversion by Penicillium sp., and ethanol fermentation by Z. mobilis. Lignocellulose complex of congongrass was pretreated using mechanic, physic, and chemistry pretreatment including, drying for 12 hours, cutting, grinding, and addition of NaOH solvent followed by heating at 121°C for 1 hour. Cellulose from pretreatment step was hydrolized by cellulase enzyme secreted by Penicillium sp., and glucose from this step was fermented by Z. mobilis. Fermentation was carried out by various treatments of inoculum size (0, 5, 10, dan 15%) and fermentation duration (0, 3, 5, 7, dan 9 days) and analized using ANOVA test. Each of treatment was done for two repeatings, so there were 40 unit trials. Result showed that congongrass (I. cylindrica (L.) Beauv.) has a potency to be used as a feedstock in ethanol production with optimum ethanol content 9,02 % (v/v) was obtained from interaction between 10% inoculum size and during 7 days of fermentation using Z. mobilis. It is clear that congongrass can be an alternative source in ethanol production.
Key words: congongrass, ethanol, Imperata cylindrica, cellulose, Zymomonas mobilis.
1*
Corresponding author phone : 085648423560
1
Alamat sekarang : Jurusan Biologi, FMIPA, ITS
2
1. PENDAHULUAN
Alang-alang (Imperata cylindrica (L.) Beauv) merupakan tumbuhan rumput menahun yang tersebar hampir di seluruh belahan bumi dan dianggap sebagai gulma pada lahan pertanian. Menurut Garrity et al. (1997), di wilayah Asia Tenggara dapat dijumpai sekitar 35 juta ha, dan sekitar 8,5 juta ha tersebar di Indonesia. Sejauh ini, alang-alang dimanfaatkan sebagai bahan baku obat-obatan, bahan baku kertas, pupuk, selebihnya dipotong dan dibuang karena menghambat pertumbuhan tanaman utama. Dilihat dari kandungan kimianya, gulma tersebut mengandung bahan lignoselulosa yang cukup tinggi, yang terdiri dari selulosa, hemiselulosa, dan lignin. Komposisi kandungan kimia tersebut antara lain α-selulosa 40,22%, holoselulosa 59,62%, hemiselulosa (pentosan) 18,40%, dan lignin 31,29% (Sutiya et al., 2012). Kandungan selulosa yang lebih dari 40% ini berpotensi sebagai bahan baku untuk energi terbarukan, yaitu bioetanol.
Selulosa ditemukan terikat kuat dengan hemiselulosa dan dilapisi oleh lignin membentuk kompleks lignoselulosa sehingga untuk membebaskan ikatan tersebut diperlukan tahapan awal yang penting yaitu pretreatment. Setelah perlakuan awal, selulosa dari alang-alang akan diubah menjadi glukosa dengan hidrolisis enzim. Hidrolisis enzim ini memanfaatkan kapang penghasil enzim selulase, Penicillium sp. kode T1.2, koleksi Laboratorium Mikrobiologi dan Bioteknologi, Biologi, ITS. Penggunaan kapang ini berdasarkan pada kemampuannya menghasilkan endoglukanase, eksoglukanase dan β-glukosidase dalam jumlah yang tinggi (Liu et al., 2007; Long et al., 2009).
Glukosa yang diperoleh selanjutnya dilakukan proses fermentasi oleh bakteri Zymomonas mobilis. Pemilihan bakteri fermentatif ini berdasarkan pada beberapa keunggulan yang dimiliki antara lain mampu tumbuh dan mengkonsumsi gula dengan cepat menggunakan jalur Entner-Doudoroff (ED) (sekitar 1µmol glukosa per menit per mg protein sel), toleran terhadap konsentrasi substrat tinggi hingga 30% glukosa (Zaldivar et al. 2001), toleran terhadap suhu tinggi hingga 40°C (Garrity, 2005), toleran terhadap kadar etanol tinggi hingga 16% v/v (Zaldivar et al. 2001), dan mampu memproduksi etanol hingga 13% w/v (Rogers et al. 1982).
Berdasarkan penelitian sebelumnya, produksi etanol dengan bahan baku alang-alang kebanyakan menggunakan yeast Saccharomyces cerevisiae, dalam suatu penelitian dihasilkan etanol optimum 4,59% (v/v) selama 24 jam (Purnaning, 2010) dan 0,73% (v/v) selama 72 hari
(Sari, 2008). Sementara itu Zymomonas mobilis hanya membutuhkan waktu 24 jam untuk menghasilkan etanol dengan menggunakan bahan baku ubi jalar (Zhang et al., 2010 dalam Sulfahri et al., 2011). Oleh karena itu, penulis akan melakukan penelitian untuk mengetahui potensi dari alang-alang (Imperata cylindrica (L) Beauv.) sebagai bahan baku dalam produksi etanol menggunakan bakteri Zymomonas mobilis pada konsentrasi inokulum dan waktu fermentasi yang optimum.
2. METODOLOGI
Penelitian dilakukan pada bulan November 2012 sampai Mei 2013 di Laboratorium Botani, Laboratorium Mikrobiologi dan Bioteknologi, Laboratorium Mikologi, Laboratorium Zoologi, Jurusan Biologi, Institut Teknologi Sepuluh Nopember, serta Laboratorium Mikrobiologi, Kimia Farmasi, Universitas Airlangga dan Laboratorium Penelitian, Farmasi, Universitas Surabaya.
2.1 Persiapan Bahan dan Perlakuan Awal (Pretreatment)
Batang dan daun alang-alang diambil di daerah kampus ITS. Perlakuan awal pada alang-alang dilakukan secara mekanik, fisik, dan kimia. Secara fisik dan mekanik, alang-alang dikeringkan di bawah sinar matahari selama 12 jam. Alang-alang yang telah dikeringkan kemudian dipotong-potong dengan ukuran 2 cm, digiling dengan alat penggiling dan diayak hingga diperoleh alang-alang berukuran 40 mesh, dan kemudian disimpan di tempat kering. Untuk pretreatment secara kimia, alang-alang direndam di dalam NaOH 2% (wt) dengan perbandingan 1:10 (w/v) pada suhu ruang selama 24 jam, kemudian dilakukan pemanasan menggunakan autoklaf dengan suhu 121ºC selama 1 jam. Setelah itu, dicuci dengan air kran hingga pH netral dan dikeringkan menggunakan oven pada suhu 65ºC hingga diperoleh berat konstan (Ashary, 2011; Lin and Lee, 2011; Pasha et al., 2012).
2.2 Persiapan Kapang Penicillium sp. kode T1.2 dan Proses Hidrolisis Enzimatik
Isolat kapang Penicillium sp. kode T1.2 dari kultur stok diremajakan ke dalam tabung reaksi berisi medium PDA miring yang baru dan diinkubasi selama 7 hari pada suhu ruang. Sebanyak 10 ml aquades steril dituangkan ke dalam biakan Penicillium sp. kode T1.2 usia 7 hari, dikocok menggunakan jarum ose agar spora terlepas ke dalam fase cair. Kemudian disiapkan sebanyak 1% (b/v) substrat alang-alang dalam erlenmeyer 100 ml berisi medium Andreoti.
Medium yang telah berisi substrat alang-alang dilakukan pengaturan pH 5, ditutup dengan sumbat kapas, disterilisasi pada 121°C selama 15 menit dalam autoklaf. Suspensi spora dipindahkan ke dalam medium dengan konsentrasi 10% (b/v) dan diinkubasi dalam suhu ruang secara aseptis di atas shaker selama 13 hari dengan kecepatan 120 rpm. Setelah itu, hasil hidrolisis dilakukan sentrifugasi dengan kecepatan 4000 rpm selama 16 menit, dan filtrat disaring menggunakan kertas saring halus. Supernatan hasil sentrifugasi diambil 1 ml untuk dilakukan analisis gula reduksi (Alfiah dan Kuswytasari, 2012; Gunam et al, 2010). Selanjutnya hasil hidrolisis disebut hidrolisat. 2.3 Pembuatan Kultur Stok dan Kultur Kerja
Isolat Zymomonas mobilis disubkultur dalam tabung reaksi yang berisi medium NA (Nutrien Agar) miring dan diinkubasi pada suhu 30oC selama 24 jam. Untuk memperkaya jumlah sel, maka medium ditambahkan 20 g/L glukosa, 10 g/L yeast extract, 1 g/L (NH4)2SO4, 1 g/L K2HPO4, 0,5 g/L MgSO4.7H2O (Struch et al., 1990).
2.4 Kurva Pertumbuhan
Zymomonas mobilis diambil 1 ose dan diinokulasikan ke dalam erlenmeyer 50 ml ekstrak alang-alang steril yang telah diatur pH menjadi 4 dengan penambahan larutan HCl 30%. Kemudian diinkubasi dalam inkubator pada suhu 30 °C selama 24 jam (Aktivasi I). Sebanyak 1 ml dari aktivasi 1 (10 %) dipipet dan diinokulasi kembali ke dalam erlenmeyer 50 ml yang berisi 9 ml ekstrak, diinkubasi dalam inkubator pada suhu 30 °C selama 24 jam (Aktivasi II). Sebanyak 5 ml dari aktivasi II (10%) dipipet dan diinokulasi kembali ke dalam erlenmeyer 100 ml yang berisi 45 ml ekstrak, diinkubasi dalam inkubator pada suhu 30°C selama 24 jam yang disebut sebagai kultur fermentasi (Cazetta et al., 2007; Zhang et al., 2010 dalam Sulfahri et al., 2011).
Dilakukan pengenceran dari 10-1 sampai dengan 10-9. Medium kultur diambil 1 ml dan dimasukkan ke dalam tabung reaksi yang berisi 9 ml aquades steril. Tabung reaksi yang berisi campuran tersebut divortex dengan vortex mixer, dipipet sebanyak 1 ml dan dimasukkan ke dalam tabung reaksi berikutnya. Perlakuan diulangi sampai pengenceran ke 10-9. Kurva pertumbuhan dibuat dengan mengukur absorbansi kultur Zymomonas mobilis diukur dengan panjang gelombang 600 nm dengan interval tiap 1 jam sekali selama 24 jam. Dibuat grafik kurva pertumbuhan dari nilai absorbansi dan waktu fermentasi (Obire, 2005).
2.5 Pembuatan Starter
Isolat Zymomonas mobilis masing-masing diambil 1 ose dan diinokulasi ke dalam erlenmeyer 50 ml yang berisi masing-masing 5 ml ekstrak alang-alang yang telah diatur pH menjadi 4 dengan penambahan larutan HCl 30%. Kemudian diinkubasi dalam inkubator pada suhu 30 °C selama 24 jam (Aktivasi I). Sebanyak 1 ml dari aktivasi 1 (10 ml) dipipet dan diinokulasi kembali ke dalam erlenmeyer 50 ml yang berisi 9 ml ekstrak, diinkubasi dalam inkubator pada suhu 30°C selama 24 jam (Aktivasi II). Sebanyak 5 ml dari aktivasi II (10%) dipipet dan diinokulasi kembali ke dalam erlenmeyer 100 ml yang berisi 45 ml ekstrak, diinkubasi dalam inkubator pada suhu 30°C sampai jam dimana fase log Zymomonas mobilis terjadi (sesuai kurva pertumbuhan) (Aktivasi III) (Cazetta et al., 2007; Zhang et al., 2010 dalam Sulfahri et al., 2011). 2.6 Proses Fermentasi
Sebanyak 50 mL hidrolisat dimasukkan ke dalam botol fermentor 100 mL dan disterilisasi menggunakan autoklaf selama 15 menit pada suhu 121ºC. Kemudian ditambahkan starter Zymomonas mobilis dengan konsentrasi sesuai dengan rancangan penelitian (0, 5, 10, dan 15%), dan diamati kadar etanol untuk 0, 3, 5, 7, dan 9 hari pada suhu kamar hingga kadar etanol menurun. Fermentasi dilakukan secara anaerob dengan teknik Hungate yaitu mengalirkan gas nitrogen selama 5 menit ke fermentor serta ditutup rapat dengan penutup karet kedap udara. Hasil fermentasi kemudian dilakukan pasteurisasi pada suhu ± 80ºC selama 10 menit, untuk selanjutnya dilakukan pengukuran kadar etanolnya (Sunarto, 2012).
2.7 Pengukuran Kadar Etanol
Tabung distilasi dan labu gondok 250 ml dipersiapkan, selanjutnya 50 ml cairan sampel hasil fermentasi menggunakan labu ukur 50 ml, dan dimasukkan ke dalam tabung destilasi. Dididihkan dengan hati-hati untuk menghindari buih yang berlebihan, destilasi campuran alkohol dan air sampel dapat dikumpulkan tepat 50 ml distilat (Purwanto, 2004).
Sementara dilakukan destilasi, piknometer dikalibrasi. Piknometer diisi aquades destilasi dan ditutup. Piknometer dan akuades ditimbang, berat yang didapat adalah W2. Kemudian piknometer dikosongkan, akuades yang tersisa diabsorbsi dengan aseton. Tabung piknometer dikeringkan dengan oven. Piknometer yang telah kering ditimbang, berat yang didapatkan adalah W1. Berat akuades (W) dihitung dengan cara W2-W1 (Purwanto, 2004).
Distilat dipindahkan ke dalam gelas beker kering. Distilat diaduk supaya homogen sebelum diisikan ke piknometer. Piknometer kering diisi dengan distilat, permukaan luar piknometer dikeringkan dan ditimbang. Hasil yang didapat adalah W3. Berat distilat adalah W3-W1=L. Berat air (L) dihitung dengan “specific gravity” atau spg= L/W. Nilai spg ditentukan menggunakan tabel AOAC (Analysis of Association of Official Analitical Chemists) dan selanjutnya persentase etanol dihitung (Purwanto, 2004).
2.8 Analisis Gula Reduksi
Analisis gula reduksi menggunakan metode Nelson Somogyi (Sudarmadji et al., 1984 dalam Dewi et al., 2005). Sampel 1 mL ditambah akuades sampai volume akhir 10 mL. Campuran diambil 1 mL dan ditambah 9 mL akuades. Sampel diambil 1 mL dan dicampur 1 mL larutan Nelson (campuran Nelson A&B; 25:1 v/v), kemudian dipanaskan pada suhu 100°C selama 20 menit. Sampel didinginkan sampai mencapai suhu kamar. Sampel ditambah 1 mL larutan arsenomolybdat dan 7 mL akuades kemudian digojok. Campuran tersebut dimasukkan kuvet dan diukur penyerapan cahaya tampak (visible) pada panjang gelombang 520 nm. Nilai absorbansi yang diperoleh dikurangi nilai absorbansi blanko sehingga diperoleh nilai absorbansi sampel. Nilai absorbansi sampel dikonversi ke kadar gula reduksi (mg/mL) berdasar persamaan regresi larutan standar.
2.9 Analisis Data
Data yang diperoleh dianalisis dengan
Analysis of Variance (ANOVA) untuk
mengetahui pengaruh perbedaan penambahan konsentrasi inokulum Zymomonas mobilis terhadap kadar etanol yang dihasilkan dengan hipotesa :
Ho: Tidak ada pengaruh antara perbedaan penambahan konsentrasi inokulum Zymomonas mobilis dengan lama waktu fermentasi terhadap presentase (%) etanol yang dihasilkan.
H1: Ada pengaruh antara perbedaan penambahan konsentrasi inokulum Zymomonas mobilis dengan lama waktu fermentasi terhadap presentase (%) etanol yang dihasilkan.
Jika H1 diterima maka dilanjutkan dengan uji Tukey pada taraf kepercayaan 95% (α=0,05) untuk mengetahui perbedaan nyata antara kombinasi perlakuan konsentrasi inokulum Zymomonas mobilis dan lama waktu fermentasi (Walpole, 1992).
3. HASIL DAN PEMBAHASAN
Produksi etanol umumnya menggunakan bahan baku yang berasal dari gula, pati, selulosa, maupun hemiselulosa. Alang-alang (Imperata cylindrica (L) Beauv.) memiliki potensi yang besar sebagai bahan baku dikarenakan mengandung salah satu atau kedua komponen tersebut di atas. Penelitian ini bertujuan untuk mengetahui potensi alang-alang (I. cylindrica (L) Beauv.) dalam produksi etanol menggunakan bakteri Zymomonas mobilis pada konsentrasi inokulum dan rentang waktu fermentasi yang optimum. Produksi etanol dilakukan dalam beberapa tahap, diantaranya pretreatment, hidrolisis menggunakan kapang Penicillium sp., fermentasi menggunakan bakteri Z. mobilis pada konsentrasi inokulum dan rentang waktu fermentasi tertentu, dan distilasi. Etanol yang diperoleh dari proses distilasi diukur kadarnya sehingga dapat diperoleh kadar etanol dari interaksi antar perlakuan yang optimum.
3.1 Potensi Alang-alang dalam Produksi Etanol dan Hasil Pretreatment
Alang-alang memiliki kandungan lignoselulosa yang tinggi yang berikatan kuat diantaranya selulosa, hemiselulosa, dan lignin. Menurut Sutiya et al. (2012), kandungan kimia alang-alang antara lain α-selulosa 40,22%, holoselulosa 59,62%, hemiselulosa (pentosan) 18,40%, dan lignin 31,29%. α-selulosa merupakan selulosa murni, suatu polimer polisakarida yang terdiri dari unit-unit monomer glukosa. Unit monomer glukosa ini kemudian dapat difermentasikan oleh mikroorganisme menjadi etanol. Kandungan selulosa dalam alang-alang menjadi potensi besar untuk dimanfaatkan menjadi bahan baku dalam pembuatan etanol. Potensi tersebut dinyatakan dengan seberapa besar kadar etanol yang dihasilkan dari hasil perombakan selulosa menjadi etanol dalam beberapa tahapan, yaitu pretreatment, hidrolisis, fermentasi, dan distilasi.
Lignin dalam ikatan lignoselulosa alang-alang dapat menjadi penghambat untuk proses hidrolisis dan fermentasi, sehingga diperlukan satu tahapan penting yaitu perlakuan awal (pretreatment). Perlakuan awal dilakukan secara mekanik, fisik, dan kimiawi. Batang dan daun alang-alang dikeringkan di bawah sinar matahari selama 12 jam. Pengeringan ini akan menguapkan kadar air di dalam alang-alang sehingga diperoleh berat kering yang mengandung serat-serat lignoselulosa kompleks. Alang-alang kering kemudian dipotong-potong menjadi ukuran 1-2 cm untuk memudahkan penggilingan menjadi serbuk. Penggilingan dilakukan menggunakan
blender, berfungsi untuk memperkecil ukuran substrat. Substrat yang lolos dari ayakan 40 mesh adalah substrat yang digunakan dikarenakan dengan ukuran yang kecil maka akan memperbesar kontak enzim ke dalam substrat selama proses hidrolisis. Menurut Sun dan Cheng (2002), ukuran bahan baku akan mempengaruhi porositas, sehingga dapat memaksimalkan kontak antara bahan baku dengan enzim. Semakin kecil ukuran substrat, maka akan mempermudah terdegradasinya lignin sehingga selulosa dan hemiselulosa akan terhidrolisa secara optimal.
Proses pretreatment gabungan antara fisik dan kimiawi dilakukan dengan merendam serbuk alang-alang berukuran 40 mesh ke dalam larutan NaOH 2% dengan komposisi 1:10 (b/v) selama 24 jam. Penggunaan larutan alkali, NaOH 2%, berdasarkan penelitian Ashary (2011) yang menghasilkan kadar selulosa yang tinggi sebesar 61,70% dengan lignin yang tersisa sebesar 3,39%. Pretreatment menggunakan alkali lebih efektif dalam menghilangkan lignin dan pembentukan inhibitornya yang rendah dengan cara menyebabkan degradasi ikatan ester dan glikosidik, berakibat pada perubahan lignin secara struktural, pembengkakan selulosa, dekristalisasi sebagian selulosa dan pelarutan sebagian hemiselulosa (Brodeur et al., 2011). Komposisi 1:10 merupakan komposisi yang seimbang dan efisien antara substrat dan larutan. Setelah 24 jam dan pemanasan pada suhu 121°C selama 1 jam, larutan NaOH menjadi berwarna hitam dan substrat menjadi kekuningan. Hal tersebut disebabkan oleh reaksi antara larutan NaOH dengan lignin dalam substrat yang dikatalis dengan pemanasan. Larutan NaOH merupakan basa kuat yang memiliki gugus hidroksil (-OH) pada ikatannya (Campbell et al., 2004). Menurut Safaria et al. (2013), gugus hidroksil dari NaOH memutuskan ikatan-ikatan dari struktur dasar lignin sedangkan ion Na+ akan berikatan dengan lignin membentuk natrium fenolat. Garam fenolat ini bersifat mudah larut sehingga lignin yang terlarut ditandai dengan warna hitam pada larutan yang disebut lindi hitam (black liquor).
Pada penelitian ini, 100 tanaman dengan berat 1 kg diubah menjadi 500 g berat kering, dan setelah perlakuan NaOH, 500 g substrat kering diperoleh berat basah substrat 216,47 g. Berat basah setelah perlakuan NaOH diasumsikan mengandung selulosa, sehingga dalam penelitian ini 1 kg alang-alang bisa mengandung 433 g selulosa. Menurut Karimi et al. (2006) sebanyak 390 g selulosa secara teori dapat dikonversi menjadi 220 g atau 283 ml etanol. Maka secara teori, 433 g selulosa alang-alang dalam penelitian ini dapat dikonversi menjadi 244,2 g atau 314,2 ml. Apabila diproduksi sebanyak 100 ton alang-alang per tahunnya, bisa diperoleh etanol sebesar 31,4 juta liter per tahunnya.
3.2 Proses Hidrolisis Enzim Menggunakan Kapang Penicillium sp. Kode T1.2
Sebelum diperoleh hasil akhir etanol, selulosa terlebih dahulu dikonversi menjadi glukosa dalam proses hidrolisis. Proses hidrolisis dilakukan secara enzimatis menggunakan enzim yang diperoleh dari kapang Penicillium sp. kode T1.2 koleksi Laboratorium Mikrobiologi dan Bioteknologi, Biologi, ITS. Astutik et al. (2011), telah menguji aktivitas enzim dari kapang Penicillium sp. kode T1.2 dan memperoleh hasil aktivitas enzim selulase sebesar 16,47 IU/ml dan aktivitas enzim xilanase sebesar 4,67 IU/ml. Aktivitas enzim selulase yang cukup besar tersebut menunjukkan bahwa enzim mampu mengkatalis degradasi selulosa menjadi glukosa per menitnya dengan cepat, sehingga digunakan kapang tersebut.
Lama proses hidrolisis yang dilakukan pada penelitian ini berdasarkan penelitian Alfiah dan Kuswytasari (2012), yang menggunakan waktu 13 hari untuk hidrolisis menggunakan kapang Penicillium sp. kode T1.2. Kapang merupakan organisme heterotrof yang menyerap nutrisi dalam bentuk molekul sederhana yang telah dirombak menggunakan enzim selulase yang disekresikannya. Proses penyerapan ini dilakukan oleh hifa yang membentuk kumpulan miselium. Pertumbuhan miselium menunjukkan bahwa kapang telah aktif melakukan perombakan selulosa menjadi glukosa. Secara visual, miselium kapang tampak membungkus substrat alang-alang dan membentuk gumpalan-gumpalan kecil dalam medium.
Tabel 1. Hasil pretreatment alang-alang.
Berat kering awal (g) Berat kering setelah perlakuan NaOH (g) Hasil Etanol (ml) Penelitian 1000 390 283 Karimi et al, 2006. 1000 433 314,2 Penelitian ini.
Tabel 2. Hasil pengujian kadar gula reduksi awal.
Kadar gula reduksi awal
Hidrolisis dengan penambahan kapang Hidrolisis tanpa penambahan kapang (kontrol) 10,37 % 2,14 %
Berdasarkan tabel 2 di atas, pengujian kadar gula reduksi menunjukkan hasil yang berbeda antara kadar gula reduksi hasil hidrolisis dengan penambahan kapang sebesar 10,37%, dan tanpa penambahan kapang (kontrol) sebesar 2,14%. Hasil tersebut menunjukkan bahwa telah terjadi hidrolisis dengan melibatkan kerjasama tiga komponen enzim yaitu enzim endoglukanase, eksoglukanase, dan β-glukosidase sehingga dihasilkan hasil akhir gula. Menurut Gunam et al., (2010), endoglukanase mengkatalis pemutusan ikatan β-1,4-glikosidik pada selulosa menjadi selulosa rantai pendek (selodekstrin), eksoglukanase kemudian memutus ikatan β-1,4-glikosidik pada selodekstrin menjadi selobiosa, dan β-glukosidase memutus ikatan β-1,4-glikosidik pada selobiosa menjadi glukosa.
3.3 Penentuan Umur Starter Zymomonas mobilis
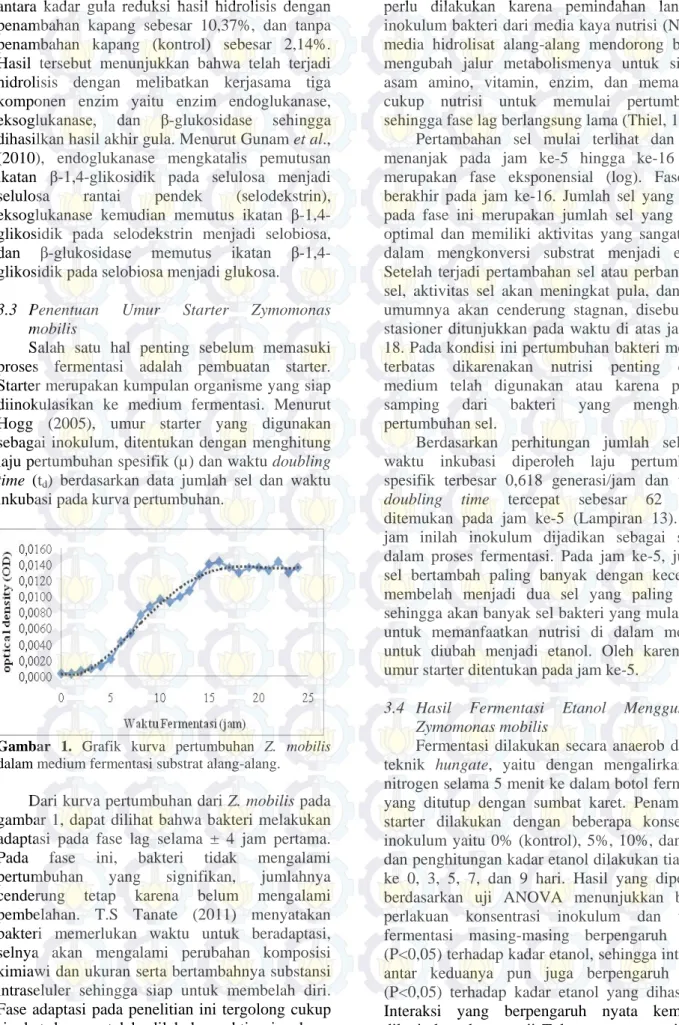
Salah satu hal penting sebelum memasuki proses fermentasi adalah pembuatan starter. Starter merupakan kumpulan organisme yang siap diinokulasikan ke medium fermentasi. Menurut Hogg (2005), umur starter yang digunakan sebagai inokulum, ditentukan dengan menghitung laju pertumbuhan spesifik (µ) dan waktu doubling time (td) berdasarkan data jumlah sel dan waktu inkubasi pada kurva pertumbuhan.
Gambar 1. Grafik kurva pertumbuhan Z. mobilis
dalam medium fermentasi substrat alang-alang.
Dari kurva pertumbuhan dari Z. mobilis pada gambar 1, dapat dilihat bahwa bakteri melakukan adaptasi pada fase lag selama ± 4 jam pertama. Pada fase ini, bakteri tidak mengalami pertumbuhan yang signifikan, jumlahnya cenderung tetap karena belum mengalami pembelahan. T.S Tanate (2011) menyatakan bakteri memerlukan waktu untuk beradaptasi, selnya akan mengalami perubahan komposisi kimiawi dan ukuran serta bertambahnya substansi intraseluler sehingga siap untuk membelah diri. Fase adaptasi pada penelitian ini tergolong cukup singkat karena telah dilakukan aktivasi selama
2x24 jam sebelumnya dari starter 5 ml ke 10 ml dan ke 50 ml dalam media yang sama. Aktivasi ini perlu dilakukan karena pemindahan langsung inokulum bakteri dari media kaya nutrisi (NA) ke media hidrolisat alang-alang mendorong bakteri mengubah jalur metabolismenya untuk sintesis asam amino, vitamin, enzim, dan memastikan cukup nutrisi untuk memulai pertumbuhan, sehingga fase lag berlangsung lama (Thiel, 1999).
Pertambahan sel mulai terlihat dan terus menanjak pada jam ke-5 hingga ke-16 yang merupakan fase eksponensial (log). Fase log berakhir pada jam ke-16. Jumlah sel yang hidup pada fase ini merupakan jumlah sel yang hidup optimal dan memiliki aktivitas yang sangat aktif dalam mengkonversi substrat menjadi etanol. Setelah terjadi pertambahan sel atau perbanyakan sel, aktivitas sel akan meningkat pula, dan pada umumnya akan cenderung stagnan, disebut fase stasioner ditunjukkan pada waktu di atas jam ke-18. Pada kondisi ini pertumbuhan bakteri menjadi terbatas dikarenakan nutrisi penting dalam medium telah digunakan atau karena produk samping dari bakteri yang menghambat pertumbuhan sel.
Berdasarkan perhitungan jumlah sel dan waktu inkubasi diperoleh laju pertumbuhan spesifik terbesar 0,618 generasi/jam dan waktu doubling time tercepat sebesar 62 menit ditemukan pada jam ke-5 (Lampiran 13). Pada jam inilah inokulum dijadikan sebagai starter dalam proses fermentasi. Pada jam ke-5, jumlah sel bertambah paling banyak dengan kecepatan membelah menjadi dua sel yang paling cepat sehingga akan banyak sel bakteri yang mulai aktif untuk memanfaatkan nutrisi di dalam medium untuk diubah menjadi etanol. Oleh karena itu, umur starter ditentukan pada jam ke-5.
3.4 Hasil Fermentasi Etanol Menggunakan Zymomonas mobilis
Fermentasi dilakukan secara anaerob dengan teknik hungate, yaitu dengan mengalirkan gas nitrogen selama 5 menit ke dalam botol fermentor yang ditutup dengan sumbat karet. Penambahan starter dilakukan dengan beberapa konsentrasi inokulum yaitu 0% (kontrol), 5%, 10%, dan 15% dan penghitungan kadar etanol dilakukan tiap hari ke 0, 3, 5, 7, dan 9 hari. Hasil yang diperoleh berdasarkan uji ANOVA menunjukkan bahwa perlakuan konsentrasi inokulum dan waktu fermentasi masing-masing berpengaruh nyata (P<0,05) terhadap kadar etanol, sehingga interaksi antar keduanya pun juga berpengaruh nyata (P<0,05) terhadap kadar etanol yang dihasilkan. Interaksi yang berpengaruh nyata kemudian dilanjutkan dengan uji Tukey yang menunjukkan
adanya perbedaan nyata antara hasil kadar etanol.dari interaksi satu dengan yang lainnya
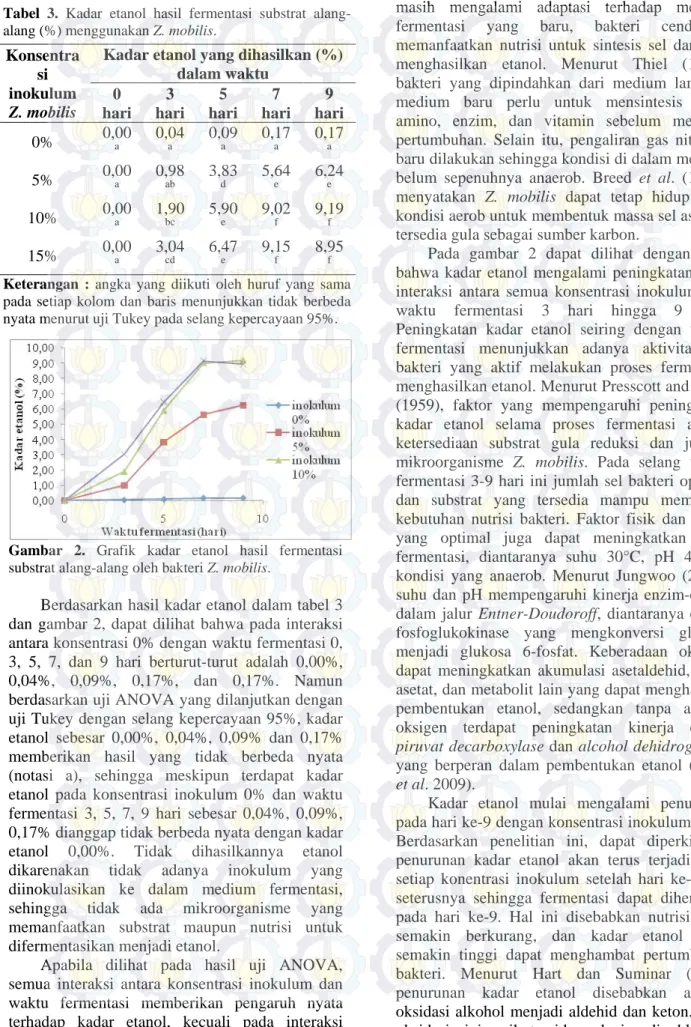
Gambar 2. Grafik kadar etanol hasil fermentasi
substrat alang-alang oleh bakteri Z. mobilis.
Berdasarkan hasil kadar etanol dalam tabel 3 dan gambar 2, dapat dilihat bahwa pada interaksi antara konsentrasi 0% dengan waktu fermentasi 0, 3, 5, 7, dan 9 hari berturut-turut adalah 0,00%, 0,04%, 0,09%, 0,17%, dan 0,17%. Namun berdasarkan uji ANOVA yang dilanjutkan dengan uji Tukey dengan selang kepercayaan 95%, kadar etanol sebesar 0,00%, 0,04%, 0,09% dan 0,17% memberikan hasil yang tidak berbeda nyata (notasi a), sehingga meskipun terdapat kadar etanol pada konsentrasi inokulum 0% dan waktu fermentasi 3, 5, 7, 9 hari sebesar 0,04%, 0,09%, 0,17% dianggap tidak berbeda nyata dengan kadar etanol 0,00%. Tidak dihasilkannya etanol dikarenakan tidak adanya inokulum yang diinokulasikan ke dalam medium fermentasi, sehingga tidak ada mikroorganisme yang memanfaatkan substrat maupun nutrisi untuk difermentasikan menjadi etanol.
Apabila dilihat pada hasil uji ANOVA, semua interaksi antara konsentrasi inokulum dan waktu fermentasi memberikan pengaruh nyata terhadap kadar etanol, kecuali pada interaksi antara semua konsentrasi inokulum dengan waktu
fermentasi 0 hari tidak terdapat etanol pada medium fermentasi. Hal ini diduga karena bakteri masih mengalami adaptasi terhadap medium fermentasi yang baru, bakteri cenderung memanfaatkan nutrisi untuk sintesis sel daripada menghasilkan etanol. Menurut Thiel (1999), bakteri yang dipindahkan dari medium lama ke medium baru perlu untuk mensintesis asam amino, enzim, dan vitamin sebelum memulai pertumbuhan. Selain itu, pengaliran gas nitrogen baru dilakukan sehingga kondisi di dalam medium belum sepenuhnya anaerob. Breed et al. (1957), menyatakan Z. mobilis dapat tetap hidup pada kondisi aerob untuk membentuk massa sel asalkan tersedia gula sebagai sumber karbon.
Pada gambar 2 dapat dilihat dengan jelas bahwa kadar etanol mengalami peningkatan pada interaksi antara semua konsentrasi inokulum dan waktu fermentasi 3 hari hingga 9 hari. Peningkatan kadar etanol seiring dengan waktu fermentasi menunjukkan adanya aktivitas sel bakteri yang aktif melakukan proses fermentasi menghasilkan etanol. Menurut Presscott and Dunn (1959), faktor yang mempengaruhi peningkatan kadar etanol selama proses fermentasi adalah ketersediaan substrat gula reduksi dan jumlah mikroorganisme Z. mobilis. Pada selang waktu fermentasi 3-9 hari ini jumlah sel bakteri optimal dan substrat yang tersedia mampu memenuhi kebutuhan nutrisi bakteri. Faktor fisik dan kimia yang optimal juga dapat meningkatkan hasil fermentasi, diantaranya suhu 30°C, pH 4, dan kondisi yang anaerob. Menurut Jungwoo (2011), suhu dan pH mempengaruhi kinerja enzim-enzim dalam jalur Entner-Doudoroff, diantaranya enzim fosfoglukokinase yang mengkonversi glukosa menjadi glukosa 6-fosfat. Keberadaan oksigen dapat meningkatkan akumulasi asetaldehid, asam asetat, dan metabolit lain yang dapat menghambat pembentukan etanol, sedangkan tanpa adanya oksigen terdapat peningkatan kinerja enzim piruvat decarboxylase dan alcohol dehidrogenase yang berperan dalam pembentukan etanol (Yang et al. 2009).
Kadar etanol mulai mengalami penurunan pada hari ke-9 dengan konsentrasi inokulum 15%. Berdasarkan penelitian ini, dapat diperkirakan penurunan kadar etanol akan terus terjadi pada setiap konentrasi inokulum setelah hari ke-9 dan seterusnya sehingga fermentasi dapat dihentikan pada hari ke-9. Hal ini disebabkan nutrisi yang semakin berkurang, dan kadar etanol yang semakin tinggi dapat menghambat pertumbuhan bakteri. Menurut Hart dan Suminar (1983) penurunan kadar etanol disebabkan adanya oksidasi alkohol menjadi aldehid dan keton. Pada oksidasi ini, nikotamida adenin dinukleotida
Tabel 3. Kadar etanol hasil fermentasi substrat
alang-alang (%) menggunakan Z. mobilis.
Konsentra si inokulum Z. mobilis
Kadar etanol yang dihasilkan (%) dalam waktu 0 hari 3 hari 5 hari 7 hari 9 hari 0% 0,00 a 0,04 a 0,09 a 0,17 a 0,17 a 5% 0,00 a 0,98 ab 3,83 d 5,64 e 6,24 e 10% 0,00 a 1,90 bc 5,90 e 9,02 f 9,19 f 15% 0,00 a 3,04 cd 6,47 e 9,15 f 8,95 f
Keterangan : angka yang diikuti oleh huruf yang sama
pada setiap kolom dan baris menunjukkan tidak berbeda nyata menurut uji Tukey pada selang kepercayaan 95%.
(NAD) yang merupakan oksidator memicu enzim mengoksidasi alkohol menjadi senyawa-senyawa karbonil dan NAD tereduksi menjadi NADH. Etanol dapat dioksidasi menjadi asetaldehid yang bisa menghambat pertumbuhan Z. mobilis.
Kadar etanol tertinggi 9,19% diperoleh pada konsentrasi inokulum 10% dan waktu fermentasi 9 hari. Namun berdasarkan uji ANOVA yang dilanjutkan dengan uji Tukey dengan selang kepercayaan 95%, hasil tersebut tidak berbeda nyata dengan kadar etanol pada konsentrasi inokulum 10% dan waktu fermentasi 7 hari sebesar 9,02%, serta pada konsentrasi inokulum 15% dan waktu fermentasi 7 hari (notasi f). Konsentrasi inokulum 10% lebih baik digunakan dalam proses fermentasi dibandingkan dengan konsentrasi 15%. Hal ini dikarenakan semakin banyak inokulum yang ditambahkan pada medium, akan menyebabkan padatnya populasi di dalam medium, dan memicu kompetisi sel dalam memanfaatkan nutrisi. Waktu fermentasi 7 hari lebih baik dibandingkan 9 hari. Hal ini dikarenakan semakin lama waktu fermentasi maka semakin banyak pula etanol yang terbentuk, konsentrasi etanol yang tinggi dapat menyebabkan pH medium semakin rendah. Azizah et al. (2012) menyatakan bahwa alkohol bersifat asam sehingga menyebabkan pH substrat semakin rendah. pH yang rendah akan mempengaruhi aktivitas dan viabilitas Z. mobilis. Oleh karena itu, pada penelitian ini dapat disimpulkan bahwa interaksi antar perlakuan yang optimum dalam memproduksi etanol adalah pada konsentrasi inokulum 10% dan waktu fermentasi 7 hari, dengan kadar etanol sebesar 9,02%.
3.5 Hubungan Kadar Etanol dengan Kadar Gula Reduksi
Gula reduksi merupakan golongan gula yang dapat mereduksi senyawa-senyawa penerima elektron, atau gula yang dapat dioksidasi oleh agen pengoksidasi karena agen pengoksidasi berkurang dalam reaksi (Lehninger, 1982). Konsentrasi gula reduksi di dalam medium fermentasi menentukan jumlah pembentukan etanol oleh bakteri Z. mobilis. Pengukuran gula reduksi pada penelitian ini dilakukan menggunakan metode Semogyi-Nelson. Kadar gula reduksi yang terukur selama proses fermentasi adalah kadar gula reduksi sisa yang tidak dimanfaatkan oleh Z. mobilis.
Berdasarkan tabel 4, dapat diketahui bahwa secara umum terjadi penurunan kadar gula reduksi selama proses fermentasi. Hal ini disebabkan pada proses fermentasi terjadi konversi gula reduksi menjadi etanol dan karbondioksida. Besarnya
konversi yang terjadi dari rata-rata gula reduksi awal dan akhir diperoleh berkisar antara 16-36%.
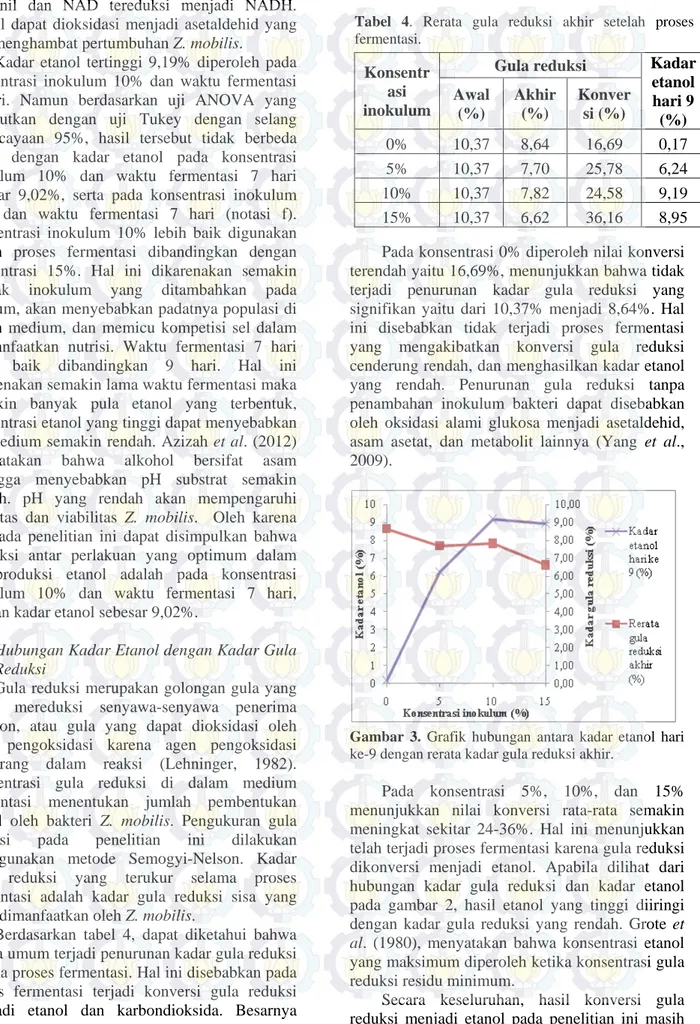
Pada konsentrasi 0% diperoleh nilai konversi terendah yaitu 16,69%, menunjukkan bahwa tidak terjadi penurunan kadar gula reduksi yang signifikan yaitu dari 10,37% menjadi 8,64%. Hal ini disebabkan tidak terjadi proses fermentasi yang mengakibatkan konversi gula reduksi cenderung rendah, dan menghasilkan kadar etanol yang rendah. Penurunan gula reduksi tanpa penambahan inokulum bakteri dapat disebabkan oleh oksidasi alami glukosa menjadi asetaldehid, asam asetat, dan metabolit lainnya (Yang et al., 2009).
Gambar 3. Grafik hubungan antara kadar etanol hari
ke-9 dengan rerata kadar gula reduksi akhir.
Pada konsentrasi 5%, 10%, dan 15% menunjukkan nilai konversi rata-rata semakin meningkat sekitar 24-36%. Hal ini menunjukkan telah terjadi proses fermentasi karena gula reduksi dikonversi menjadi etanol. Apabila dilihat dari hubungan kadar gula reduksi dan kadar etanol pada gambar 2, hasil etanol yang tinggi diiringi dengan kadar gula reduksi yang rendah. Grote et al. (1980), menyatakan bahwa konsentrasi etanol yang maksimum diperoleh ketika konsentrasi gula reduksi residu minimum.
Secara keseluruhan, hasil konversi gula reduksi menjadi etanol pada penelitian ini masih rendah jika dibandingkan dengan penelitian yang
Tabel 4. Rerata gula reduksi akhir setelah proses
fermentasi.
Konsentr asi inokulum
Gula reduksi Kadar etanol hari 9 (%) Awal (%) Akhir (%) Konver si (%) 0% 10,37 8,64 16,69 0,17 5% 10,37 7,70 25,78 6,24 10% 10,37 7,82 24,58 9,19 15% 10,37 6,62 36,16 8,95
dilakukan oleh Sulfahri et al. (2012), konversi gula reduksi mencapai 80%. Hal ini menunjukkan bahwa belum semua substrat gula reduksi dikonversi menjadi etanol oleh Zymomonas mobilis. Berbagai faktor dapat mempengaruhi terjadinya hal tersebut, salah satunya dipengaruhi oleh hasil hidrolisis yang dikatalis oleh enzim selulase dari kapang Penicillium sp. yang belum semuanya terkonversi menjadi glukosa, dimana diduga masih terdapat selulosa rantai pendek (selodekstrin) atau selobiosa di dalam medium. Kebanyakan sistem selulase yang dihasilkan oleh jamur selulotik, jumlah b-glukosidasenya lebih rendah dari yang dibutuhkan untuk hidrolisis selulosa menjadi glukosa secara efisien, sehingga produk utama hidrolisisnya bukan glukosa melainkan selobiosa (Juhasz et al., 2003). Selodekstrin dan selobiosa tidak dapat dikonversi secara langsung oleh Zymomonas mobilis. Hal ini dikarenakan Z. mobilis murni tanpa modifikasi memiliki rentang pemanfaatan sumber karbon yang sempit, terbatas pada substrat glukosa, fruktosa, dan sukrosa (Garrity, 2005). Oleh karena itu, konversi gula reduksi menjadi etanol cenderung rendah.
4. KESIMPULAN
Kesimpulan yang diperoleh dari penelitian ini adalah Alang-alang (Imperata cylindrica (L) Beauv.) berpotensi sebagai bahan baku dalam pembuatan etanol yang difermentasi kan oleh bakteri Zymomonas mobilis. Potensi tersebut ditunjukkan dengan hasil kadar etanol optimum sebesar 9,02% pada konsentrasi inokulum 10% dan waktu fermentasi 7 hari.
DAFTAR PUSTAKA
Alfiah, Irma dan N.D Kuswytasari. 2012. Produksi Enzim Selulase oleh Penicillium sp. pada Suhu, pH, dan Limbah Pertanian yang Berbeda. Paper. Jurusan Biologi, FMIPA, ITS. Surabaya.
Ashary, Choirul. 2011. Produksi Enzim Selulase dan Hidrolisis Enzimatik pada Jerami Padi dengan Menggunakan Buffer Sitrat. Tugas Akhir. Teknik Kimia, FTI, ITS. Surabaya. Astutik, Rahayu P, N.D Kuswytasari, dan Maya S.
2011. Uji Aktivitas Enzim Selulase dan Xilanase Isolat Kapang Tanah Wonorejo Surabaya. Paper. Jurusan Biologi, FMIPA, ITS. Surabaya.
Azizah, N., A.N. Al--‐Baarri, dan S. Mulyani. 2012. Pengaruh Lama Fermentasi terhadap
Kadar Alkohol, pH, dan Produksi Gas pada Proses Fermentasi Bioetanol dari Whey dengan Substitusi Kulit Nanas. Jurnal Aplikasi Teknologi Pangan, Vol.1 No. 2, 2012.
Breed, R.S., E.G.D Murray, and Nathan R. Smith. 1957. Bergey’s Manual of Determinative Bacteriology, Seventh Edition. The Williams and Wilkins Company. USA.
Brodeur, G., Elizabeth Y., Kimberly B., John C., K. B. Ramachandran, and Subramanian R. 2011. Chemical and Physicochemical Pretreatment of Lignocellulosic. Biomass: A Review. Enzyme Research, Volume 2011, 17 pages.
Campbell, Neil A., J. B Reece, and L.G Mitchell. 2004. Biologi, Edisi Kelima, Jilid I. Penerbit Erlangga. Jakarta.
Cazetta M.L, Celligoi M.A.P.C, Buzato J.B, and Scarmino I.S. 2007. Fermentation of Molasses by Zymomonas mobilis: Effect of Temperature and Sugar Concentration on Ethanol Production. Journal Bioresource and Technology. Vol. 98, No. 2824-2828. Dewi, Chandra., Tjahjadi P, dan Artini P. 2005.
Produksi Gula Reduksi oleh Rhizopus oryzae dari Substrat Bekatul. Bioteknologi 2 (1): 21-26, Mei 2005, ISSN: 0216-6887. Garrity, D.P., Soekadi M., Van N., M. D. la Cruz,
Pathak P., Gunasena H., Van S., Huijun G. and Majid N., 1997. The Imperata Grasslands of TropicalAsia: Area, Distribution, and Typology. Agroforestry Systems 36: 3-29.
Garrity, M.G. 2005. Bergey’s Manual of Systematic Bacteriology. Departement of Microbiology and Molecular Genetics, Machigan State University. USA.
Grote,W., K.J.Lee and P. L.Rogers. 1980. Continuous Ethanol Production by Immobilized Cells of Zymomonas Mobilis. Biotechnology Letters, vol 11, hal 481-486. Gunam, Ida B., Ketut B., I. M. Yoga S. 2010.
Pengaruh Perlakuan Delignifikasi dengan Larutan NaOH dan Konsentrasi Substrat Jerami Padi terhadap Produksi Enzim Selulase dari Aspergillus Niger Nrrl A-Ii, 264. Jurnal Biologi XIV (1) : 55 – 61.
Hart, A. dan A. Suminar, 1983. Kimia Organik Suatu Kuliah Singkat. Penerbit Erlangga. Jakarta.
Herera, S. 2006. Produksi Etanol dari Bahan Alam Terbarukan. http://www.ifpri.org. [1 Oktober 2012].
Hogg, S. 2005. Essential Microbiology. John Wiley & Sons, Ltd. England.
Juhasz, T., K. Kozma, Z. Szengyel, K. Reczey. 2003. Production of b-Glucosidase in Mixed Culture of Aspergillus niger BKMF1305 and Trichoderma reesei RUT C30. Food Technol. Biotechnol. 41 (1), pp. 49–53, 2003.
Jungwoo, Yang. 2011. Enhanced Bioethanol Production by Zymomonas mobilis in Response to the Quorum Sensing Molecules AI-2. Thesis. Durham University.
Karimi, K., G. Emtiazi, dan M.J. Taherzadeh. 2006. Ethanol Production from Dilute-Acid Pretreated Rice Straw by Simultaneous Saccharification and Fermentation with Mucor indicus, Rhizopus oryzae, and Saccharomyces cerevisiae. Enzyme and Microbial Technology 40 (2006) 138–144. Lehninger. 1982. Dasar-Dasar Biokimia Jilid 1.
Jakarta. Erlangga.
Lin, Yu Sheng, and W. Lee. 2011. Simultaneus Saccharification and Fermentation of Alkali-Preteated Cogongrass for Bioethanol Production. BioResources 6(3), 2744-2756. Liu, Ian and Jichu Yang. 2007. Cellulase
Production By Trichoderma Koningii AS3.4262 In Solid-State Fermentation Using Lignocellulosic Waste From The Vinegar Industry. Food Technol. Biotechnol. 45 (4) 420–425.
Long Chuannan, Yueqin Ou, Ping Guo, Yuntao Li, Jingjing Cui, Minnan Long dan Zhong Hu. 2009. Cellulase Production by Solid State Fermentation Using Bagasse With Penicillium decumbens L-06. Annals of Microbiology. 59; 517-523.
Obire, O. 2005. Activity of Zymomonas mobilis Species in Palm-sap Obtained from Three Areas in Edo State, Nigeria. Journal of
Application Science and Environment. Mgt. Vol. 9 (1), NO. 25-30.
Pasha, Chand, B.C Sekhar, B.Srinivas, K. Balakrishna, and N. Hanumalal. 2012. Sequential Cellulase Production, Saccharification and Ethanol Fermentation Using Rice Straw. Journal of Scientific and Industrial Research, Vol. 71, September 2012, pp.616-620.
Presscott, M.C. and C.G. Dunn. 1959. Industrial Microbiology. London: McGrawHill Book. Purnaning, Arry Setya. 2010. Alang-alang
(Imperata cylindrica (L.) Raueschel) as a cellulose substrates in bioethanol production. Thesis. Biotechnology,School of Life Sciences and Technology-ITB. Bandung.
Purwanto. 2004. Aktivitas Fermentasi Alkoholik Cairan Buah. Jurnal Universitas Widya Mandala Madiun. No.1 thn XXXII.
Rogers, P.L., Lee, K.J., Skotnicki, M.L. and Tribe, D.E. 1982. Ethanol production by Zymomonas mobilis. Advances in Biochemical Engineering, vol. 23, p. 37-84. Safaria S, Nora I., dan T.A Zaharah. 2013.
Efektivitas Campuran Enzim Selulase dari Aspergillus Niger dan Trichoderma Reesei dalam Menghidrolisis Substrat Sabut Kelapa. JKK, tahun 2013, volume 2 (1), halaman 46-51.
Sari, Iris M., Noverita, dan Yulneriwarni. 2008. Pemanfaatan Jerami Padi dan Alang-Alang dalam Fermentasi Etanol Menggunakan Kapang Trichoderma Viride dan Khamir Saccharomycess Cerevisiae. Vis vitalis, Vol. 01 No. 2, tahun 2008.
Shofiyanto, M. E. 2008. Hidrolisis Tongkol Jagung oleh Bakteri Selulolitik untuk Produksi Bioetanol dalam Kultur Campuran. Skripsi. ITB. Bandung.
Struch T., Neuss B., B. Mayer S., and Sahm H. 1991. Osmotic Adjustment of Zymomonas mobilis to concentrated glucose solution. Journal Application of Microbiology and Biotechnology.
Sudarmadji, S., B. Haryono, dan Suhardi. 1984. Prosedur Analisa untuk Bahan Makanan dan Pertanian. Liberty. Yogyakarta.
Sulfahri, Sri Nurhatika, dan Tutik N. 2011. Aerobic and Anaerobic Processes of Spirogyra Extract Using Different Doses of Zymomonas mobilis. J. Appl. Environ. Biol. Sci., 1(10)420-425, 2011.
Sun, Y., Cheng, J., 2002. Hydrolysis of Lignocellulosic Materials for Ethanol Production: A Review. Bioresource Technol., 83, 1-11.
Sunarto, Eko. 2012. Fermentasi Selulosa Batang Jagung (Zea mays L.) oleh Zymomonas mobilis dengan Penggunaan Enzim Selulase Melalui Metode Separate Enzymatic Hidrolysis and Fermentation (SHF). Tugas Akhir. Jurusan Biologi, FMIPA, Institut Teknologi Sepuluh Nopember. Surabaya. Sutiya, Budi, Wiwin T.I, Adi R., dan Sunardi.
Kandungan Kimia dan Sifat Serat Alang-Alang (Imperata Cylindrica) sebagai Gambaran Bahan Baku Pulp dan Kertas. Bioscientiae Volume 9, Nomor 1, Januari 2012, Halaman 8-19.
Tanate, T.S. 2011. Pembuatan Etanol Menggunakan Zymomonas mobilis pada Kondisi Steril dan Nonsteril dengan Memanfaatkan Limbah Padat Pabrik Rokok Kretek sebagai Substrat. Thesis. Kimia, FMIPA, ITS. Surabaya.
Thiel, Teresa. 1999. Introduction to Bacteria. Class Module. Departement of Biology. University of Missouri.
Yang, S., Timothy J.T., Nancy L.E., Sue L.C., Stanton L.M., Brian H.D., Anthony V.P., Miguel R., and Steven D.B. 2009. Transcriptomic and Metabolomic Profiling of Zymomonas mobilis during Aerobic and Anaerobic Fermentations. Journal of Bioedical Central genomics, Vol. 10, No.34. Zaldivar J, Nielsen J and Olsson L. 2001. Fuel Ethanol Production from Lignocellulose: a Challenge for Metabolic Engineering and Process Integration. Appl Microbiol Biotechnol, 56, 17-34.
Zhang, K. and Feng, H. 2010. Fermentation Potentials of Zymomonas mobilis and its
Aplication in Ethanol Production from Low-cost Raw Sweet Potato. African Journal of Biotechnology. Vol. 9 (37), No. 6122-6128.