6
TINJAUAN PUSTAKA
2.1 Congo Red
Congo Red merupakan bahan kimia yang memiliki potensi berbahaya
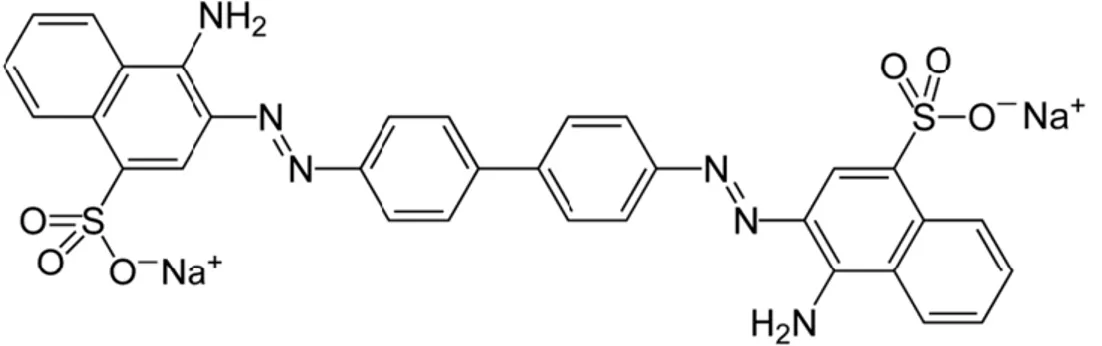
terhadap kesehatan tubuh manusia, diantaranya bila tertelan dapat mengakibatkan rasa mual pada lambung, muntah, dan diare. Bahan ini juga bila terkena mata dan teradsorpsi pada kulit dapat menyebabkan iritasi, dapat mengakibatkan kerusakan sistem pernapasan, menyebabkan kanker serta menyebabkan gangguan reproduksi dan janin. Congo red dengan rumus C32H22N6Na2O6S2 dan mempunyai berat molekul 696,66 g/molpertama kali disintesis pada tahun 1883 oleh Paul Botiger yang bekerja di Bayer Company di Elberfeld, German. Congo red merupakan zat warna yang larut dalam air dan etanol. Congo red adalah garam sodium dari benzidinediazo-bis-l-naphthylamine-4-sulfonic acid. Congo red dapat digunakan sebagai noda atau pewarna dan indikator redoks (Prahl, 2002). Rumus struktur congo red dapat dilihat pada Gambar 2.1.
Congo Red berbentuk bubuk berwarna merah kecoklatan. Sementara, di
dalam air akan berwarna merah kekuningan. Jika dilarutkan dalam etanol akan berwarna orange. Panjang gelombang maksimumnya adalah 491 nm. Berdasarkan rumus di atas terlihat bahwa congo red mempunyai inti benzena yang merupakan gugus kromofor dan substituen –N=N-, menyebabkan congo red ini dapat diukur dengan spektrofotometer UV-Vis. Senyawa yang memiliki gugus –N=N- merupakan senyawa azo dan merupakan zat warna reaktif (Cristian, 2007).
2.2 Fotokatalisis
Fotokatalisis merupakan suatu proses kombinasi reaksi fotokimia yang memerlukan unsur cahaya (foton) dan katalis untuk mempercepat terjadinya transformasi kimia. Dalam proses ini, katalis lebih khas disebut fotokatalis yang memiliki kemampuan untuk menyerap foton dan umumnya dimiliki oleh bahan-bahan semikonduktor (Linsebigler et al., 1995). Fotokatalisis merupakan salah satu metode AOPs (Advanced Oxidation Processes) yang dikarakterisasi dari pembentukan radikal bebas yang sangat aktif terutama radikal hidroksil (.OH)
(Malato et al., 2003). Proses fotokatalisis banyak diaplikasikan untuk penghilangan atau pendegradasian polutan cair menjadi senyawa yang lebih ramah lingkungan, misalnya untuk pengolahan limbah zat warna.
Fotokatalisis dibagi menjadi dua macam, antara lain fotokatalisis homogen yaitu suatu proses fotokatalisis dengan bantuan zat pengoksidasi seperti ozon dan hidrogen peroksida. Sementara itu, fotokatalisis heterogen merupakan suatu teknologi yang didasarkan pada radiasi fotokatalis semikonduktor dengan bantuan sinar UV seperti TiO2 (titanium dioksida), ZnO (seng oksida), dan CdS (kadmium sulfida) (Linsebigler et al., 1995). Penyinaran UV dalam reaksi fotokatalisis
menyebabkan elektron (e) pada semikonduktor tereksitasi dari pita valensi ke pita konduksi. Elektron yang berpindah ke pita konduksi meninggalkan lubang positif (hole atau h+) pada pita valensi (Attia et al., 2008).
2.3 ZnO (Seng Oksida)
Seng oksida merupakan salah satu persenyawaan dari logam Zn yang tergolong senyawa oksida. Secara umum, seng (Zn) merupakan jenis logam yang tahan terhadap serangan udara dan air pada temperatur ruang, namun pada suhu tinggi logam seng (Zn) dapat bereaksi dengan oksigen di udara menghasilkan oksida dalam bentuk ZnO. Reaksi yang terjadi adalah sebagai berikut :
2 Zn + O2 2 ZnO
Seng oksida (ZnO) merupakan senyawa kimia yang memiliki massa molar 81,38 g/mol, dengan Zn = 80,34 % dan O = 19,66%. ZnO biasanya berupa bubuk putih yang digunakan sebagai aditif dalam membuat banyak produk termasuk plastik, keramik, kaca, semen, dan karet. Sebagian besar ZnO merupakan semikonduktor tipe-n yang mempunyai lebar celah pita energi (bandgap energy) antara 3,2 eV sampai 3,3 eV (Polley et al, 1999). ZnO mempunyai tipe struktur kristal wurtzite hexagonal. Simetrinya heksagonal dikarenakan ZnO memiliki 12 ion oksigen (O2-) yang berada di tiap sudut atas dan bawah membentuk suatu prisma heksagonal. Setiap ion Zn2+ maupun O2- merupakan pusat tetrahedral dari keempat ion tetangganya (Anthony, 1984), seperti yang terlihat pada Gambar 2.2
Gambar 2.2 Struktur wurtzite dari kristal ZnO (Housecroft, 2005) 2.4 Fotokatalis ZnO-Arang Aktif
Dalam mendegradasi suatu senyawa, fotokatalis ZnO yang merupakan semikonduktor memiliki kemampuan yang bagus dalam proses fotodegradasi limbah zat warna (Hussen, 2007). Selain itu, ZnO merupakan fotokatalis yang paling aktif dan memiliki keunggulan seperti band gap (energi celah) yang lebar yaitu 3,17 eV (Ali and Siew, 2006; Attia, 2008). Kemampuan adsorpsi yang rendah dari fotokatalisis ZnO menjadi salah satu kelemahannya. ZnO yang dikombinasikan dengan adsorben arang aktif merupakan salah satu alternatif untuk meningkatkan kemampuan adsorpsi bahan fotokatalis. Arang aktif adalah arang yang mempunyai daya serap yang tinggi terhadap warna, bau, zat-zat beracun, dan zat kimia lainnya. Penggunaan arang aktif pada umumnya digunakan sebagai bahan penyerap zat warna dalam larutan. Arang aktif merupakan zat padat yang berpori dengan luas permukaan yang luas antara 300-2000 m2g-1. Hal ini menyebabkan arang aktif mempunyai kemampuan mengadsorpsi yang tinggi terhadap zat yang berada dalam suatu larutan (Natanael, 1987).
Menurut penelitian yang dilakukan oleh Darajat dkk (2007) penggunaan ZnO sebagai fotokatalis dalam proses degradasi zat warna mengakibatkan terjadinya peningkatan energi dan efisiensi waktu hingga mencapai empat kali
lipat dibandingkan dengan hasil yang diperoleh dengan menggunakan penyinaran UV. Selain itu, menurut Liu (2002) perbedaan kemampuan fotokatalis ZnO dibandingkan fotokatalis lainnya seperti TiO2 menunjukkan bahwa ZnO lebih efektif dari pada TiO2 dalam mendegradasi zat warna. Fotokatalis ZnO yang dikombinasikan dengan arang aktif mampu memberikan luas area yang besar sehingga polutan dapat teradsorpsi dengan baik (Cao et al., 2008).
2.5 Mekanisme Fotodegradasi Congo Red
Fotodegradasi merupakan suatu proses peruraian senyawa (senyawa organik) dengan memanfaatkan empat komponen utama dalam reaksinya, yaitu energi foton (sumber cahaya), senyawa target, oksigen, dan fotokatalis. Sumber cahaya yang digunakan berasal dari sinar UV dengan panjang gelombang 365 nm (Tafer et al., 2008; Qourzal et al., 2009). Congo red adalah senyawa target dalam larutan berair, gas O2 yang berasal dari oksigen sebagai penangkap elektron dan fotokatalis yang digunakan merupakan bahan semikonduktor salah satunya adalah ZnO (Ali and Siew, 2008).
Prinsip fotodegradasi adalah loncatan elektron yang berpindah dari pita valensi ke pita konduksi pada logam semikonduktor jika dikenai suatu energi. Loncatan elektron ini menyebabkan timbulnya lubang elektron (hole) yang dapat berinteraksi dengan pelarut air membentuk radikal (.OH) yang merupakan
oksidator kuat. Proses fotodegradsi zat warna congo red dilakukan dalam ruang gelap agar berjalan optimal dengan dilakukan pengadukan menggunakan
magnetic stirrer selama proses penyinaran (Wijaya et al., 2006).
Oksidasi ion OH- dari H
2O diawali dari proses fotodegradasi dengan membentuk radikal setelah suatu semikonduktor ZnO menyerap cahaya
membentuk hole. Mekanisme reaksinya adalah sebagai berikut (Lachheb et al., 2002) : ZnO + hυ h+ vb + ecb- (ecb-) + O2 .O2 -h+vb + OH- .OH .OH + senyawa organik CO 2 + H2O (produk)
Persamaan reaksi fotodegradasi congo red dapat dituliskan sebagai berikut (Lachheb et al., 2002) Congo Red : C32H22N6Na2O6S22- + 91 2 O2 32CO2 + 6NO3 - + 2SO 42- + 8H+ + 7H2O 2.6 Metode Sol-Gel
Proses sol-gel dapat didefinisikan sebagai proses pembentukan senyawa anorganik melalui reaksi kimia dalam larutan pada suhu rendah, dimana dalam proses tersebut terjadi perubahan fasa dari suspensi koloid (sol) membentuk fasa cair kontinyu (gel) (Fernandez, 2012). Metode sol-gel merupakan metode yang paling banyak dilakukan karena memiliki beberapa keunggulan, antara lain prosesnya dapat berlangsung pada temperatur rendah, relatif mudah dan murah, menghasilkan produk dengan kemurnian dan kehomogenan yang tinggi jika parameternya divariasikan, serta dapat diaplikasikan dalam segala kondisi (Zawrah et al., 2009).
Proses sol-gel memiliki beberapa tahapan reaksi antara lain reaksi hidrolisis yaitu suatu proses dimana terjadi reaksi antara senyawa awal (prekursor) yang dibutuhkan untuk mendapatkan senyawa yang diinginkan dengan air sehingga membentuk intermediet. Proses kondensasi merupakan proses transisi
dari sol menjadi gel dengan melibatkan reaksi ligan hidroksil yang menghasilkan polimer dengan ikatan M-O-M.
Setelah reaksi hidrolisis dan kondensasi, dilanjutkan dengan proses pematangan gel yang lebih dikenal dengan proses aging. Pada proses ini terjadi pembentukan jaringan gel yang lebih kaku, kuat, dan menyusut di dalam larutan. Tahap terakhir yaitu proses pengeringan agar larutan dan cairan yang tidak diinginkan menguap. Hal ini dilakukan untuk mendapatkan struktur sol-gel yang memiliki luas permukaan yang tinggi (Fernandez, 2012).
2.7 Kinetika Fotodegradasi
Kinetika pada proses fotodegradasi menunjukkan bentuk matematika dari hasil percobaan yang dilakukan. Model kinetika yang digunakan pada proses fotodegradasi adalah reaksi orde 1, dimana suatu reaksi yang lajunya berbanding langsung dengan konsentrasi reaktan (Dogra and Dogra, 1984).
-
𝑑[𝐶]𝑑𝑡 = k[C] yang pada integrasi memberikan
ln [C] = ln [C]0 – kt atau [C] = [C]0 e-kt atau k =1 𝑡 ln [𝐶]0 [𝐶] Keterangan :
[C]0 = konsentrasi zat warna pada saat awal (t = 0)
k = tetapan laju fotodegradasi t = waktu
Gambar 2.3 Grafik kinetika laju reaksi orde 1
Untuk reaksi orde 1, plot ln [C] (atau log [C]) terhadap t merupakan suatu garis lurus. Intersep pada grafik memberikan konsentrasi pada t = 0 dan nilai tetapan laju fotodegradasi (k) merupakan slope yang diberikan oleh grafik (Dogra and Dogra, 1984).
2.8 FT-IR
Spektrofotometer FT-IR merupakan salah satu alat yang dapat digunakan untuk identifikasi senyawa, khususnya senyawa organik baik secara kualitatif maupun kuantitatif. Analisis dilakukan dengan melihat bentuk spektrumnya yaitu melihat puncak-puncak spesifik yang menunjukkan jenis gugus fungsional yang dimiliki oleh senyawa tersebut. Sementara analisis kuantitatif dapat dilakukan dengan menggunakan senyawa standar yang dibuat spektrumnya pada berbagai variasi konsentrasi.
Mekanisme pada alat spektrofotometer FT-IR terjadi apabila sinar yang datang dari sumber sinar akan diteruskan dan akan dipecah oleh pemecah sinar
Slope = - k
waktu
ln
menjadi dua bagian yang saling tegak lurus. Sinar ini kemudian dipantulkan oleh dua cermin yaitu cermin diam dan cermin bergerak. Dari pemecah sinar, sebagian sinar akan diarahkan menuju cuplikan dan sebagian menuju sumber. Gerakan cermin yang maju mundur akan menyebabkan sinar yang sampai pada detektor akan berfluktuasi (Tahid, 1994).
Hubungan antara intensitas radiasi IR yang diterima detektor terhadap perbedaan lintasan optis disebut sebagai interferogram. Sistem optik dari Spektroskopi infra merah yang didasarkan atas bekerjanya interferometer disebut sebagai sistem optik Fourier Transform Infra Red.
2.9 X-Ray Diffraction
X-Ray Diffraction (X-RD) digunakan untuk analisis komposisi fasa atau senyawa pada material dan juga karakterisasi kristal. Prinsip dasar X-RD adalah mendifraksi cahaya yang melalui celah kristal. Sampel berupa serbuk padatan kristalin yang memiliki ukuran kecil dengan diameter butiran kristalnya sekitar 10-7 – 10-4 m ditempatkan pada suatu plat kaca. Sinar-X diperoleh dari elektron yang keluar dari filamen panas dalam keadaan vakum pada tegangan tinggi, dengan kecepatan tinggi menumbuk permukaan logam, biasanya tembaga (Cu) (Warren, 1969). Data X-RD dapat digunakan untuk menentukan ukuran suatu kristal berdasarkan persamaan Scherrer yaitu :
D = 0,9 𝜆
𝛽 𝑐𝑜𝑠𝜃 ………... (Oxtoby, 1993)
Dimana : D = ukuran kristal rata-rata ZnO (nm)
λ = panjang gelombang sinar X yang digunakan (Ȃ) 𝞫 = nilai FWHM dikonversi ke satuan rad
Full-Width at Half Maximum (FWHM) merupakan parameter yang biasa digunakan untuk menghitung lebar puncak difraksi. Jika puncak difraksinya semakin lebar maka semakin kecil ukuran kristalnya. Lebar puncak difraksi tersebut memberikan informasi tentang ukuran kristal berdasarkan persamaan
Scherrer.
2.10 Spektofotometri UV-Vis (Ultraviolet-Visible)
Spektrofotometri UV-Vis merupakan salah satu metode instrumen untuk mempelajari serapan atau emisi radiasi elektromagnetik sebagai fungsi dari panjang gelombang tertentu dengan molekul senyawa atau atom dari suatu zat kimia. Metode spektrofotometri dapat digunakan untuk analisis secara kualitatif dan kuantitatif. Dibandingkan dengan teknik spektroskopi yang lain, spektroskopi UV-Vis yang paling banyak digunakan dalam analisis senyawa biologis. Dari spektrum absorpsi dapat diketahui panjang gelombang dengan absorbans maksimum dari suatu unsur atau senyawa. Larutan sampel diabsorpsi oleh sumber radiasi elektromagnetik dan jumlah yang diabsorpsi sebanding dengan konsentrasi larutan sampel (Mulja dan Syahrani, 1990).
Spektrofotometri UV-Vis memiliki dua daerah pengukuran dan panjang gelombang yang berbeda yaitu daerah radiasi ultraviolet pada panjang gelombang 220-380 nm dan daerah radiasi sinar tampak (visible) pada panjang gelombang 380-780 nm (Muhammad., dan Achmad., 1990). Informasi yang dapat diperoleh dari spektra UV-Vis adalah adanya gugus berikatan rangkap atau terkonjugasi yang mengadsorpsi radiasi elektromagnetik di daerah UV-Vis.
Spektrum UV-Vis disebut juga spektrum elektronik, karena terjadi sebagai hasil interaksi cahaya UV-Vis terhadap molekul yang mengakibatkan molekul
tersebut mengalami transisi elektronik. Dalam metode spektrofotometri UV-Vis, berlaku hukum dasar yaitu hukum Lambert-Beer yang menyatakan bahwa absorbansi berbanding langsung dengan tebal medium dan konsentrasi larutan. Secara matematis hukum Lambert-Beer dapat dituliskan sebagai berikut: (Henry
et al., 2002)
Log I0/It = A Atau A = ɛ b c
Dimana, I0 = intensitas cahaya datang (joule/m2s), It = intensitas cahaya yang diteruskan (joule/m2s), ɛ = absorpsivitas molar (L.cm-1mol-1), b = tebal kuvet (cm), c = konsentrasi larutan (mol L-1), dan A = absorbansi. Jika konsentrasi dinyatakan dalam g/L, maka :
A = a b c Dimana, a = absorpsivitas (L.g-1 cm-1)