PEMANFAATAN MEMBRAN UNTUK
PROSES KONVERSI ENZIMATIK TAPIOKA
Ahli Utama:
Dr. I G. Wenten
INSTITUT TEKNOLOGI BANDUNG – PT. RAYASUGARINDO
2003
ii
DAFTAR ISI
DAFTAR ISI ... ii
DAFTAR GAMBAR ... iii
DAFTAR TABEL ... iv
Executive Summary ... 1
1. Pendahuluan ... 1
2. Pati Tapioka ... 3
3. Enzim-Enzim dalam Hidrolisis Pati ... 4
4. Kinetika Hidrolisis Pati Secara Enzimatik ... 5
5. Konsep Bioreaktor Membran Enzimatik ... 8
6. Bioreaktor Membran Enzimatik untuk Hidrolisis Pati ... 9
7. Polarisasi Konsentrasi dan Fouling Membran ... 12
8. Proses Hilir Hidrolisat Pati ... 15
iii
DAFTAR GAMBAR
Gambar 1. Diagram alir proses produksi glukosa secara konvensional ... 2
Gambar 2. Ilustrasi skematik bioreaktor membran enzimatik dengan modul hollow fiber ... 9
Gambar 3. Konfigurasi bioreaktor membran hollow fiber dengan enzim terimobilisasi ... 11
Gambar 4. Representasi skematis berbagai tahanan perpindahan massa dalam proses ultrafiltrasi ... 13
iv
DAFTAR TABEL
Tabel 1. Kandungan amilosa dan ukuran granula untuk beberapa jenis pati [7] ... 3
Tabel 2. Karakteristik gelatinisasi beberapa jenis pati [8] ... 4
Tabel 3. Komposisi tepung tapioka [9] ... 4
Tabel 4. Enzim-enzim untuk hidrolisis pati [5] ... 5
1
Executive Summary
Industri pati dan produk turunannya mempunyai peranan yang sangat vital khususnya dalam sektor pangan. Dalam hidrolisis pati secara enzimatis, ikatan-ikatan glukosida dari amilosa dan amilopektin diputus sehingga dihasilkan glukosa, maltosa, atau oligosakarida. Produk akhir yang akan dihasilkan bergantung pada jenis enzim yang digunakan. Hidrolisis pati pada umumnya dilakukan secara curah pada reaktor konvensional yang menemui banyak kendala. Bioreaktor membran enzimatik (BME) merupakan teknologi alternatif yang menjanjikan pada proses konversi enzimatik tapioka. Pada prinsipnya, BME mengkombinasikan perpindahan massa secara selektif melalui membran dengan reaksi-reaksi enzimatik. BME memiliki beberapa keunggulan jika dibandingkan dengan teknologi konvensional. Sistem BME mampu menjaga enzim tetap dalam sistem reaksi selama masa aktifnya, tetapi juga dapat menghasilkan kualitas produk hidrolisis yang lebih baik dibandingkan dengan proses curah konvensional. Dengan demikian, BME ini diharapkan dapat memberikan sedikitnya empat keuntungan, yaitu (i) kebutuhan energi pada proses pemekatan lebih sedikit, (ii) pemanfaatan enzim secara maksimal, (iii) waktu reaksi hidrolisis lebih singkat, dan (iv) beban pemurnian produk lebih ringan. Semua keuntungan tersebut dapat mereduksi biaya produksi secara keseluruhan.
1.
Pendahuluan
Industri pati dan produk turunannya mempunyai peranan yang sangat vital khususnya dalam sektor pangan. Pati merupakan cadangan karbohidrat pada tumbuhan, berbentuk granula dengan ukuran dan karakteristik fisik yang spesifik untuk setiap spesies tumbuhan. Setiap negara mempunyai sumber pati yang berbeda satu sama lain, bergantung pada iklim negara masing-masing. Di Amerika Serikat, pati diproduksi dari jagung; di Eropa diproduksi dari jagung dan kentang; di Jepang diproduksi dari ubi jalar; sedangkan di negara-negara tropis seperti Indonesia, Thailand, Vietnam, dan Brazil diproduksi dari ubi kayu. Ubi kayu merupakan salah satu tanaman tropis dengan potensi hasil yang tinggi [1].
Dibandingkan dengan pati jagung atau kentang, pati ubi kayu memiliki beberapa keunggulan antara lain kandungan pati lebih tinggi (>90%, basis kering), kandungan protein dan mineral lebih rendah [2], temperatur gelatinisasi lebih rendah, dan kelarutan amilosa lebih tinggi [3]. Sifat-sifat tersebut sangat penting terutama dalam kaitannya dengan proses hidrolisis.
Hidrolisis pati dapat dilakukan dengan proses asam atau enzimatik. Proses hidrolisis asam pada temperatur 140–160oC dan pH 1,8–2,0 banyak digunakan pada masa lampau. Namun, kebanyakan industri yang ada saat ini menggunakan proses enzimatik karena beberapa pertimbangan berikut: (a) operasi dapat dilakukan pada pH dan temperatur yang tidak ekstrim; (b) limbah cair yang dihasilkan relatif lebih sedikit; (c) pengendalian proses lebih mudah; (d) konversi lebih tinggi. Untuk proses enzimatik, produk yang dihasilkan bergantung pada jenis enzim yang digunakan. Salah satu produk hidrolisis pati komersial adalah glukosa, yang dihasilkan dengan menggunakan enzim -amilase dan glukoamilase. Di pasaran, glukosa dijual sebagai sirup glukosa atau kristal dekstrosa monohidrat (DMH). Glukosa banyak digunakan antara lain untuk pemanis dalam industri makanan dan minuman, bahan baku untuk produksi fruktosa, karamel, sorbitol, industri farmasi, dan media fermentasi [2].
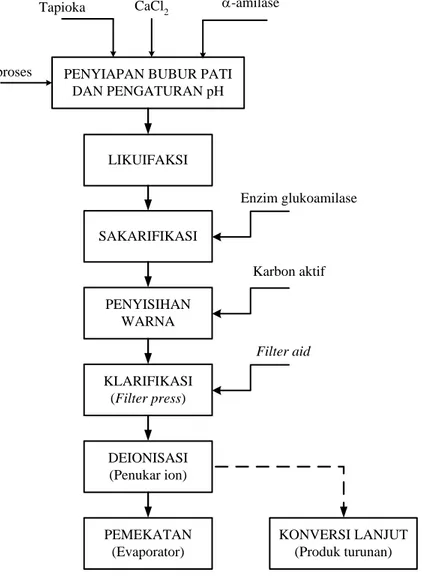
Diagram alir proses konvensional untuk produksi glukosa dapat dilihat pada Gambar 1. Secara umum, konversi pati menjadi glukosa melibatkan tiga tahap proses, yaitu likuifaksi, sakarifikasi, dan proses hilir (terdiri dari penyisihan warna, penyisihan padatan tersuspensi, penyisihan abu, dan pemekatan). Karena prosesnya masih dilakukan dalam reaktor curah konvensional, permasalahan mendasar yang timbul antara lain: (1) beban evaporasi sangat
2
tinggi karena konsentrasi pati hanya sekitar 30% berat, (2) start up dan shutdown proses produksi berulang-ulang, (3) enzim hanya sekali pakai, dan (4) produktivitas rendah karena waktu tinggal reaksi selama 72 jam. Untuk operasi curah seperti ini, sekitar 10–15% dari total biaya produksi digunakan untuk penyediaan enzim.
PENYIAPAN BUBUR PATI DAN PENGATURAN pH Air proses Enzim -amilase LIKUIFAKSI SAKARIFIKASI Enzim glukoamilase CaCl2 Tapioka PENYISIHAN WARNA Karbon aktif KLARIFIKASI (Filter press) DEIONISASI (Penukar ion) PEMEKATAN (Evaporator) Filter aid KONVERSI LANJUT (Produk turunan)
Gambar 1. Diagram alir proses produksi glukosa secara konvensional
Melihat fakta di atas, perlu adanya pengembangan skema proses hidrolisis pati menjadi glukosa pada konsentrasi tinggi yang tidak disertai oleh penurunan tingkat konversi seperti yang terjadi dalam reaktor curah konvensional. Untuk menghindari waktu reaksi yang terlalu lama, hidrolisis pati pada konsentrasi tinggi harus disertai oleh peningkatan konsentrasi enzim. Oleh karena itu, daur ulang enzim menjadi sangat penting. Pilihan yang paling rasional adalah bioreaktor membran enzimatik (BME) karena sistem ini tidak hanya mampu menjaga enzim tetap berada dalam sistem reaksi selama masa aktifnya, tetapi juga dapat menghasilkan kualitas produk hidrolisis yang lebih baik. Dengan demikian, BME ini diharapkan dapat memberikan sedikitnya empat keuntungan, yaitu (i) kebutuhan energi lebih sedikit, (ii) pemanfaatan enzim maksimal, (iii) waktu reaksi hidrolisis lebih singkat, dan (iv) beban pemurnian produk lebih ringan. Semua keuntungan ini pada akhirnya akan mereduksi biaya produksi.
Seperti halnya proses-proses membran yang lain, persoalan utama yang membatasi kinerja BME untuk aplikasi ini adalah polarisasi konsentrasi dan fouling membran. Polarisasi
3
konsentrasi merupakan akumulasi solut (zat terlarut) atau partikel secara reversibel pada permukaan membran. Sebaliknya, fouling adalah perubahan membran secara irreversibel yang disebabkan oleh interaksi fisik dan/atau kimia spesifik antara membran dan berbagai komponen yang ada dalam aliran proses [4]. Berdasarkan pertimbangan desain dan operasional, modul
hollow fiber dipandang sebagai alternatif yang paling atraktif untuk reaksi-reaksi enzimatik
dibandingkan dengan modul plate and frame atau spiral wound. Modul hollow fiber mempunyai rasio luas permukaan terhadap volume sangat tinggi. Selain itu, pengendalian polarisasi konsentrasi dan fouling membran dengan cara-cara hidrodinamika, seperti kecepatan aliran tinggi, backwashing (menggunakan air) atau backflushing (menggunakan cairan hasil filtrasi), lebih mudah dilakukan.
2.
Pati Tapioka
Pati merupakan cadangan karbohidrat pada tumbuhan, berbentuk granula (butiran) dengan ukuran dan karakteristik fisik yang spesifik untuk setiap spesies tumbuhan. Perbedaan yang paling utama antara setiap jenis pati adalah perbandingan komposisi amilosa terhadap amilopektin. Seperti ditunjukkan pada Tabel 1, pati tapioka mempunyai kandungan amilosa paling rendah yaitu sekitar 17%. Pustaka lain menampilkan bahwa pati jagung yang berasal dari waxy maize hanya mengandung sekitar 2% amilosa tetapi yang berasal dari amylomaize mengandung sekitar 80% amilosa [5]. Amilosa terbentuk dari ikatan -1,4 glukosida dengan berat molekul sekitar 250.000 g/mol, sedangkan amilopektin terbentuk dari ikatan -1,4 glukosida dan -1,4 glukosida dengan berat molekul sekitar 50 sampai 500 juta g/mol [6]. Meskipun memiliki struktur ikatan yang berbeda, amilosa maupun amilopektin sama-sama tersusun dari monomer-monomer glukosa.
Tabel 1. Kandungan amilosa dan ukuran granula untuk beberapa jenis pati [7]
Sumber pati Kandungan amilosa (%) Rentang ukuran granula (µm) Ukuran rata-rata (µm) Ubi kayu 17 3–30 14 Jagung amilosa tinggi 70 4–40 6 Jagung 28 5–25 14 Gandum 26 3–35 7 dan 20 Ubi jalar 18 4–40 19 Ararut 21 9–40 23 Sagu 26 15–50 33 Kentang 26 10–100 36
Granula pati mempunyai kapasitas penjerapan air dingin yang terbatas secara
reversibel, tetapi hidrasi lanjut dimungkinkan dengan peningkatan temperatur. Proses
pembengkakan (swelling) molekul pati secara irreversibel karena masuknya molekul air ke dalam struktur molekulnya disebut dengan gelatinisasi. Seperti ditunjukkan pada Tabel 2, rentang temperatur gelatinisasi bervariasi untuk setiap jenis pati. Temperatur gelatinisasi pati tapioka adalah 58,5–70oC [8]. Perlu ditekankan bahwa proses hidrolisis berlangsung jauh lebih cepat jika dilakukan pada temperatur di atas temperatur gelatinisasinya. Oleh karena itu, tahapan gelatinisasi ini sangat menentukan keberhasilan hidrolisis pati secara enzimatik. Selain temperatur, rasio air dan pati minimum harus terpenuhi untuk memperoleh gelatinisasi yang sempurna. Amilosa dan amilopektin mempunyai struktur gel yang sama, yaitu double helix.
4
Pati tapioka yang ada di pasaran umumnya masih mengandung sejumlah komponen nonkarbohidrat dalam jumlah minor. Komponen-komponen minor tersebut, yang sering dipandang sebagai pengotor, berasal dari ubi kayu dan kadang-kadang juga berasal dari bahan kimia yang digunakan dalam proses produksinya. Dalam kaitannya dengan hidrolisis pati tapioka secara enzimatik, keberadaan komponen-komponen minor ini tidak diinginkan terutama lemak dan protein karena dapat mengganggu proses.
Tabel 2. Karakteristik gelatinisasi beberapa jenis pati [8] Jenis pati Rentang temperatur
gelatinisasi (oC) Swelling power pada temperatur 95 oC Kelarutan (%) pada temperatur 95 oC Tapioka 58,5 70 71 48 Jagung amilosa tinggi – 6 12 Jagung 62–72 24 25 Gandum 52–63 21 41 Ubi jalar – 46 18 Ararut – 54 28 Sagu – 97 39 Kentang 56–66 > 1000 82
Komponen-komponen minor yang umum terdapat dalam pati tapioka ditunjukkan pada Tabel 3. Seperti terlihat pada tabel tersebut, komponen-komponen minor tersebut kurang dari 1%, yang akan menjadi padatan tersuspensi (mud) dalam hidrolisat hasil hidrolisis. Meskipun jumlahnya relatif sedikit, mud ini merupakan beban utama dalam tahap klarifikasi.
Tabel 3. Komposisi tepung tapioka [9]
Komponen % (berat) Air Protein Lemak Serat Abu 12,27 0,11 0,07 0,12 0,25
3.
Enzim-Enzim dalam Hidrolisis Pati
Pemecahan ikatan antar monomer dari molekul pati dapat menggunakan katalis asam atau enzim. Dibandingkan dengan proses asam, proses enzimatik tidak membutuhkan material peralatan yang spesifik (tahan korosi dan tekanan), tidak menimbulkan peningkatan warna dan kandungan garam yang drastis, memerlukan energi lebih sedikit, reaksi samping lebih sedikit, menghasilkan konversi lebih tinggi, dan proses relatif lebih mudah dikendalikan. Oleh karena itu, hampir semua industri yang memproduksi maltodekstrin, maltosa atau glukosa dari pati saat ini menggunakan proses enzimatik.
Enzim-enzim yang mampu mengkatalisis proses hidrolisis dapat diperoleh dari tumbuhan, hewan, dan mikroorganisme. Enzim-enzim ini dapat dikelompokkan menurut pola aksinya, yaitu -amilase, -amilase, glukoamilase, pullulanase, dan sebagainya. Perlu diperhatikan bahwa nomenklatur enzim yang digunakan secara komersial untuk hidrolisis pati agak membingungkan karena EC number (penamaan enzim menurut komisi enzim) yang sama
5
kadang-kadang digunakan untuk enzim-enzim yang mempunyai aktivitas katalitik berbeda (Tabel 4). Sebagai contoh, -amilase hanya memiliki EC number 3.2.1.1 meskipun enzim ini dapat dikelompokkan sebagai amilase likuifaksi atau amilase sakarifikasi.
Produk-produk yang akan terbentuk dalam hidrolisis pati bermacam-macam seperti glukosa, maltose, maltotriosa, oligosakarida linier, dan lainnya [10]. Dijelaskan bahwa mekanisme pemutusan ikatan glukosida yang terjadi bergantung pada jenis enzim yang digunakan. Meskipun glukosa dapat dihasilkan dengan hanya menggunakan -amilase atau glukoamilase, kombinasi antara kedua enzim ini akan lebih menguntungkan secara ekonomis.
Pada tahap likuifaksi, pati terhidrolisis parsial menjadi -limit-dekstrin (maltodekstrin) oleh
-amilase termofilik. Karena likuifaksi dilakukan pada temperatur 90–110oC, pemutusan ikatan -1,4 glukosida berlangsung sangat cepat. Selain menurunkan viskositas larutan secara drastis, tahap likuifaksi ini akan meningkatkan jumlah molekul substrat untuk glukoamilase yang akan mengkonversi maltodekstrin menjadi glukosa. Dengan demikian, laju pembentukan glukosa dalam tahap sakarifikasi juga meningkat.
Tabel 4. Enzim-enzim untuk hidrolisis pati [5]
Enzim EC number Sumber Aksi
-amilase 3.2.1.1
Bacillus amyloliquefaciens
Hanya ikatan -1,4-glukosida yang diputus menjadi -limit-dekstrin dan dominan terdiri dari maltosa (DP2), DP3, DP6, dan DP7
B. licheniformis
Hanya ikatan -1,4-glukosida yang diputus menjadi -limit-dekstrin dan dominan terdiri dari maltosa (DP2), DP3, DP4, dan DP5
Aspergillus oryzae, A. niger
Hanya ikatan -1,4-glukosida yang diputus menjadi -limit-dekstrin dan dominan terdiri dari maltosa (DP2) dan DP3
-amilase
sakarifikasi 3.2.1.1
B. subtilis (amylosacchariticus)
Hanya ikatan -1,4-glukosida yang diputus menjadi -limit-dekstrin dan dominan terdiri dari maltosa (DP2), DP3, DP4, dan glukosa (bisa mencapai 50%)
-amilase 3.2.1.2 Malted barley
Hanya ikatan -1,4 glukosida dari ujung nonpereduksi yang diputus menjadi -limit-dekstrin dan -maltosa
Glukoamilase 3.2.1.3 A. niger Memutus ikatan -1,4 dan -1,6 glukosida dari ujung nonpereduksi, menjadi -glukosa Pullulanase 3.2.1.4 B. acidopullulyticus Hanya ikatan -1,6 yang diputus, menghasilkan
maltodekstrin rantai lurus
4.
Kinetika Hidrolisis Pati Secara Enzimatik
Pemecahan rantai ikatan molekul pati secara enzimatik melibatkan dua tipe enzim: (a) endoenzim, yang memecah satu molekul substrat secara acak menjadi dua molekul yang lebih kecil, dan (b) eksoenzim, yang memutus monomer atau dimer dari ujung nonpereduksi molekul substrat [11]. Karena mekanisme reaksi yang terjadi sangat berbeda, pendekatan yang dilakukan dalam perumusan model kinetika untuk kedua jenis enzim tersebut juga berbeda. Penyederhanaan perlu dilakukan karena berat molekul pati atau konsentrasi molarnya tidak dapat diketahui secara pasti. Untuk merumuskan model kinetika hidrolisis pati menjadi glukosa yang sederhana dan praktis, Kusunoki dkk [12] menggunakan asumsi-asumsi berikut: (i) pati terdiri dari molekul-molekul dengan berat molekul rata-rata;
(ii) skema reaksi diberikan dengan mekanisme berikut;
G E S ES E S n k 1 n k k 1 n 2 1 1
6 EG
E
G
(iii) konsentrasi mol total substrat konstan sampai reaksi berhenti dan berat molekul rata-rata menurun sebanding dengan fraksi substrat yang belum terkonversi;
(iv) besarnya Vm dan Km berubah secara linear seiring dengan penurunan berat molekul pati. Laju pembentukan glukosa dapat dinyatakan dengan model Michaelis-Menten
) K / ] G [ 1 ( K ] S [ ] S [ V dt ] G [ d ' i ' m 0 0 ' m (1)
atau dalam berat
) K / G 1 ( K S 1 , 1 / S V dt 1 , 1 / dG dt dS i m m (2)
dalam hubungan ini, G adalah konsentrasi glukosa, S0 adalah konsentrasi pati awal, Vm’ atau Vm adalah laju maksimum, Km’ atau Km adalah konstanta Michaelis-Menten, Ki’ atau Ki adalah konstanta disosiasi kompleks enzim-glukosa, dan t adalah waktu. Model kinetika ini dikembangkan lebih lanjut oleh Fuji dan Kawamura [11] untuk kasus yang melibatkan sinergi
-amilase dan glukoamilase. Model ini dirumuskan berdasarkan asumsi-asumsi berikut: (i) aktivitas -amilase dan glukoamilase terhadap setiap molekul substrat adalah sama jika
berat molekul substrat melebihi nilai tertentu;
(ii) jika reaksi yang dikatalisis oleh -amilase berlangsung, konsentrasi substrat untuk glukoamilase meningkat;
(iii) pengaruh -amilase dapat diabaikan setelah mencapai kondisi dimana berat molekul substrat relatif kecil;
(iv) setelah kondisi ini, asumsi (i) tidak berlaku, dan nilai parameter persamaan kinetika reaksi berubah seiring dengan penurunan berat molekul substrat;
(v) setelah kondisi ini, konsentrasi mol total substrat konstan sampai reaksi berhenti; (vi) laju pembentukan dekstrosa (glukosa) dihambat oleh inhibisi produk;
(vii) semua kinetika reaksi dinyatakan dengan model Michaelis-Menten.
Ekspresi-ekspresi matematis yang diperoleh dari asumsi-asumsi di atas adalah sebagai berikut: 0 1 m 0 1 m S K S V dt dS (3) ) K / G 1 ( K S S V dt dG i 20 m 20 m (4) ) K / G 1 ( K S S V dt dG i 2 m 1 1 2 m (5) 0 S G (6) )] 4 , 0 ( A 1 [ V Vm2 m20 (7) )] 4 , 0 ( B 1 [ K Km2 m20 (8)
dalam hubungan ini, adalah tingkat konversi (fraksi pati yang telah terkonversi) dan adalah ukuran penurunan berat molekul pati. Pada model yang diusulkan oleh Fuji dan Kawamura [6], Km1 (konstanta Michaelis-Menten) dan Vm1 (laju reaksi maksimum) adalah untuk -amilase, sedangkan Km20 atau Km2 dan Vm20 atau Vm2 adalah untuk glukoamilase. Persamaan (II.5) digunakan jika < 0,4.
7
Dalam hidrolisis pati oleh glukoamilase, secara paralel maltosa dan isomaltosa akan terbentuk dari kondensasi dua molekul glukosa dan mengakibatkan penurunan tingkat perolehan glukosa. Dalam aplikasi di industri selama ini, aktivitas enzim dihilangkan dengan pemanasan cepat ketika konsentrasi glukosa sudah mencapai harga maksimum. Berdasarkan fakta ini, Shiraishi dkk [13] mengusulkan model skema reaksi berikut:
E G S E S E S 2 n k 1 n 1 k 1 k 1 n (n = 1, 2, 3, …) (9) GE E G 3 k 3 k (10) GEG G GE 4 k 4 k (11) I E EI GEG 6 k 6 k 5 k 5 k (12) M E EM GEG 8 k 8 k 7 k 7 k (13)
Dalam hal ini, E, S, G, M, dan I masing-masing menyatakan enzim, substrat (pati), dekstrosa (glukosa), maltosa, dan isomaltosa. Dengan mekanisme reaksi seperti di atas dapat dirumuskan model kinetika berikut:
H 1 , 1 K / S V dt dS RS S S (14) H 05 , 1 K / ) I K G ( V dt dI R GI I 2 I I (15) H 05 , 1 K / ) M K G ( V dt dM R GM M 2 M M (16) ) R R ( 05 , 1 ) R ( 1 , 1 RG S M I (17) M I 4 3 2 3 S K M K I K K G K G K S 1 H (18) 2 e e I 4 3 5 I GI G I V K K V K K (19) 2 e e M 4 3 7 M GM G M V K K V K K (20) VS = k1E, V5 = k5E, V7 = k7E, VM = k-7E, VI = k-5E, KS = k-1/k1, K3 = k-3/k3, K4 = k-4/k4, KI = k-6/k6, KM = k-8/k8. Parameter kinetika dalam persamaan (II.14) berubah secara linear sebagai fungsi dari fraksi berat substrat yang belum terkonversi, sebagai berikut:
VS = VS0 dan KS = KS0 untuk S/S0 ≥ 0,7 (21) VS = VS0 [1 – p(0,7 – S/S0)] dan KS = KS0 [1 + q(0,7 – S/S0)] S/S0 < 0,7 (22)
VS = VM dan KS = KM untuk S/S0 = 0 (23) Jadi, p dan q pada persamaan (II.22) dapat diperoleh dari persamaan berikut:
7 , 0 V / V 1 p M S0 dan 7 , 0 1 K / K q M S0 (24)
Seperti telah disampaikan sebelumnya bahwa keberadaan komponen minor seperti protein dan lemak akan berpengaruh terhadap hidrolisis pati. Wansuksri dkk [14] melakukan studi tentang pengaruh protein terhadap hidrolisis pati beras menjadi glukosa. Selama likuifaksi pati dengan
8
-amilase, penyisihan protein mengakibatkan penurunan laju hidrolisis awal. -amilase ini juga memiliki afinitas lebih tinggi untuk substrat yang mengandung jumlah protein lebih banyak. Sebaliknya, keberadaan protein pati beras menghasilkan pengaruh negatif terhadap aktivitas enzim glukoamilase. Hasil ini menunjukkan bahwa protein yang ada dalam pati dapat berfungsi sebagai aktivator atau inhibitor dalam hidrolisis pati, bergantung pada tipe enzimnya.
5.
Konsep Bioreaktor Membran Enzimatik
Dalam kebanyakan reaksi enzimatik, curah atau kontinu, pemisahan enzim dan/atau substrat dari campuran produk reaksi memegang peranan yang sangat penting untuk mencapai produktivitas maksimum. Di lain pihak, pemisahan enzim dapat menjadi tidak efisien jika menggunakan teknik-teknik konvensional seperti sentrifugasi, pengendapan secara kimia, atau evaporasi vakum. Secara umum, pemanfaatan bioreaktor membran untuk proses enzimatik memiliki beberapa keunggulan seperti (i) pemanfaatan enzim lebih optimal; (ii) tahap pemurnian produk menjadi lebih sederhana; (iii) kemurnian produk menjadi lebih tinggi dan tidak fluktuatif, dan (iv) waktu reaksi menjadi lebih singkat karena konsentrasi enzim tinggi. Dengan digunakannya bioreaktor membran pada proses ini maka biaya produksi dapat dihemat [15].
Aplikasi bioreaktor membran untuk proses-proses enzimatik dapat dibedakan menjadi dua, yaitu (a) unit membran merupakan bagian integral dari bioreaktor tangki teraduk, dan (b) unit membran merupakan matriks imobilisasi enzim. Pada bioreaktor membran tipe (a), reaksi hampir seluruhnya terjadi dalam bioreaktor tangki teraduk dan hanya sebagian kecil terjadi dalam unit membrannya. Unit membran lebih berfungsi sebagai unit pemisahan produk, enzim dan/atau substrat. Pada bioreaktor membran tipe (b), unit membran berfungsi sebagai reaktor dan separator sekaligus, yang memungkinkan pemisahan enzim, substrat, dan produk secara simultan. Parameter yang paling menentukan dalam pemilihan antara kedua konfigurasi tersebut adalah karakteristik substrat.
Imobilisasi enzim menggunakan matriks membran dapat dilakukan melalui cara-cara berikut: (i) pembentukan lapisan gel enzim dinamik, (ii) segregasi enzim pada buluh, cangkang, atau pori-pori membran, atau (iii) pengikatan enzim secara kimia pada permukaan membran. Kelebihan penggunaan membran hollow fiber dibandingkan dengan matriks-matriks imobilisasi yang lain adalah dapat diregenerasi setelah enzim tidak aktif dan memungkinkan pemisahan produk secara seketika. Imobilisasi enzim dalam buluh membran
hollow fiber pertama kali diusulkan oleh Rony [16]. Investigasi lebih lanjut tentang kinerja
bioreaktor membran seperti ini dilakukan oleh Chang dkk [17], Chang dan Chung [18], Shao dkk [19]. Bioreaktor membran hollow fiber dengan konfigurasi yang berbeda dikembangkan oleh Waterland dkk [20]. Enzim yang terimobilisasi dalam struktur porous membran hollow
fiber terpisahkan dari substrat yang mengalir melalui buluh hollow fiber oleh lapisan selektif
membran. Lapisan selektif ini tidak dapat dilewati oleh enzim, tetapi substrat dan produk sangat mudah berdifusi melalui lapisan ini. Kedua konfigurasi tersebut dibatasi oleh tahanan perpindahan massa, yang menjadikannya kurang kompetitif untuk aplikasi skala industri. Kelemahan ini mendorong Breslau [21] untuk mengembangkan bioreaktor membran hollow
fiber dengan mode operasi backflush. Kinerja bioreaktor ini disimulasi lebih lanjut oleh
Fabiani dkk [22] dan Shi dkk [22]. Mode operasi backflush dengan tekanan relatif tinggi dapat mengakibatkan penumpukan enzim pada permukaan membran sehingga enzim tersebut tidak terdistribusi secara homogen.
Untuk hidrolisis pati, konfigurasi BME yang menggunakan unit membran hollow fiber sebagai bagian integral dari reaktor tangki ideal kontinu (continuous stirred tank reactor, CSTR) tampaknya lebih menguntungkan. Keunggulan sistem ini adalah reaksi berlangsung dalam fasa homogen, tidak terjadi hambatan difusi, aktivitas enzim tetap tinggi, dan dapat
9
digunakan untuk kasus multi enzim. Ilustrasi skematik BME mode resirkulasi dengan modul
hollow fiber disajikan pada Gambar 2. Persoalan utama yang sering muncul adalah adanya
peristiwa polarisasi konsentrasi dan fouling membran yang dapat mengakibatkan penurunan kecepatan filtrasi secara drastis. Oleh karena itu, pengendalian polarisasi konsentrasi dan
fouling membran akan sangat menentukan kinerja BME.
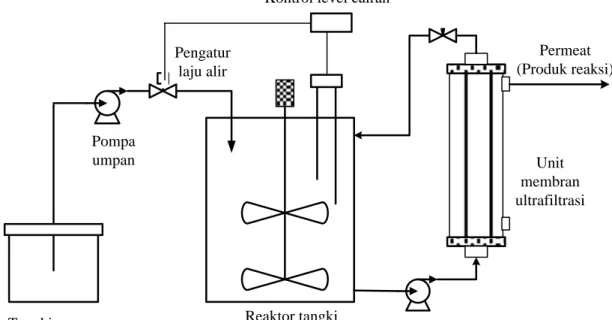
Tangki umpan Unit membran ultrafiltrasi Reaktor tangki ideal kontinu Permeat (Produk reaksi) Kontrol level cairan
Pompa umpan Pompa sirkulasi Pengatur laju alir
Gambar 2. Ilustrasi skematik bioreaktor membran enzimatik dengan modul hollow fiber
6.
Bioreaktor Membran Enzimatik untuk Hidrolisis Pati
Fakta menunjukkan bahwa peningkatan kontribusi teknologi membran untuk pengembangan berbagai sektor industri sangat signifikan selama dua dekade belakangan ini. Dalam aplikasinya, membran dapat digunakan tidak hanya untuk pemisahan molekular suatu campuran tetapi juga untuk melakukan proses reaksi sehingga menarik perhatian para ilmuwan dan praktisi industri. Pemanfaatan teknologi membran dalam proses enzimatik sering disebut sebagai bioreaktor membran enzimatik (BME). Pada prinsipnya, BME mengkombinasikan perpindahan massa secara selektif melalui membran dengan reaksi-reaksi enzimatik. Beberapa keuntungan yang dapat diperoleh dari penggunaan BME dibandingkan dengan bioreaktor konvensional antara lain: (a) variasi rancangan proses lebih leluasa; (b) biaya penyediaan enzim lebih hemat; (c) produktivitas bioreaktor lebih tinggi; (d) pembentukan produk samping dapat diminimasi; dan (e) dimensi reaktor lebih mampat [23].
BME dapat dioperasikan baik secara dead-end stirred cell atau recycle configuration [24]. Berdasarkan fungsi membrannya, bioreaktor membran untuk proses-proses enzimatik dapat dibedakan menjadi dua tipe, yaitu (a) unit membran merupakan bagian integral dari bioreaktor, dan (b) unit membran merupakan matriks imobilisasi enzim. Pada bioreaktor membran tipe (a), reaksi hampir seluruhnya terjadi dalam bioreaktor dan hanya sebagian kecil terjadi dalam unit membrannya. Unit membran lebih berfungsi sebagai unit pemisahan produk, sedangkan enzim dan/atau substrat tetap dalam sistem reaksi. Pada bioreaktor membran tipe (b), unit membran berfungsi sebagai reaktor dan separator sekaligus yang memungkinkan pemisahan enzim, substrat, dan produk secara in situ. Imobilisasi enzim menggunakan matriks membran dapat dilakukan melalui: (i) pembentukan lapisan gel enzim dinamik, (ii) segregasi
10
enzim pada buluh, cangkang, atau pori-pori membran, atau (iii) pengikatan enzim secara kimia pada permukaan membran. Ilustrasi skematik beberapa konfigurasi bioreaktor membran dengan enzim terimobilisasi ditampilkan pada Gambar 3.
Bioreaktor membran enzimatik dengan “recycle configuration” lebih banyak diarahkan untuk aplikasi yang melibatkan suspensi atau makromolekul, seperti hidrolisis protein [25, 26], regenerasi ATP [27], produksi asam aspartat [28], dan hidrolisis pati [29-31]. Sementara itu, bioreaktor membran dengan enzim terimobilisasi lebih banyak diaplikasikan untuk reaksi dua fasa [32-34] atau kasus dimana substrat dan produk memiliki ukuran yang hampir sama [35].
Khusus untuk hidrolisis pati, studi kinerja bioreaktor membran sudah dimulai sejak tahun 1970-an. Closset dkk [29] melakukan hidrolisis pati dengan -amilase menggunakan sebuah reaktor membran tubular. Hidrolisis dilakukan pada tekanan operasi dan laju alir tertentu dengan memvariasikan konsentrasi pati dan enzim. Hasil yang diperoleh menunjukkan bahwa konsentrasi enzim memberikan efek sangat kecil terhadap fluks. Namun, kinerja reaktor membran tubular tersebut lebih tinggi daripada reaktor dinding pejal untuk kondisi hidrolisis yang sama. Bahkan setelah 52 jam operasi, ketika laju penurunan kinerja reaktor membran relatif kecil, kinerja reaktor membran ini masih sekitar 40% lebih tinggi dibandingkan dengan reaktor dinding pejal. Sayangnya, reaktor membran ini tidak mencapai kondisi tunak karena pembentukan -limit dextrins (produk akhir dari hidrolisis pati dengan -amilase) dan penggumpalan pati. Selain itu, komponen-komponen seperti lemak dan protein yang berasal dari pati juga sangat berperan terhadap penurunan kinerja reaktor membran ini.
Menggunakan reaktor membran tubular serupa, Tachauer dkk [30] melakukan hidrolisis pati menjadi maltosa dengan enzim campuran antara -amilase dan -amilase. Untuk dapat membandingkannya dengan kinerja reaktor dinding pejal, digunakan parameter rasio kinerja yang didefinisikan sebagai:
pejal dinding reaktor untuk kinerja indeks membran reaktor untuk kinerja indeks kinerja Rasio (25)
Berbeda dengan hasil yang dilaporkan oleh Closset dkk [29], peningkatan konsentrasi enzim akan meningkatkan fluks terutama pada awal operasi. Pengaruh konsentrasi enzim terhadap fluks yang signifikan ini dipercaya akibat dari pemutusan molekul-molekul pati secara acak dan cepat oleh enzim campuran antara -amilase dan -amilase. Jika hanya menggunakan
-amilase, pemutusan ikatan rantai molekul pati terjadi dari ujung ke ujung. Juga dikemukakan secara tegas bahwa meskipun menurun terhadap waktu, laju permeasi akan mencapai konstan dalam waktu yang lebih lama. Fenomenanya mungkin akan sangat berbeda jika pati untuk substrat masih banyak mengandung lemak, protein, dan komponen-komponen minor lainnya. Dalam kasus ini juga diperoleh bahwa kinerja reaktor membran lebih baik dibandingkan dengan reaktor dinding pejal.
Dengan enzim glukoamilase, produk akhir hidrolisis adalah glukosa. Madgavkar dkk [31] juga mempelajari kinerja reaktor membran tubular untuk hidrolisis pati. Madgavkar dkk mengharapkan bahwa penggunaan enzim glukoamilase dapat meminimasi pembentukan lapisan gel di permukaan membran. Ditunjukkan bahwa glukoamilase benar-benar mereduksi pembentukan lapisan gel dan memberikan kinerja reaktor membran lebih tinggi dan lebih stabil daripada hasil-hasil yang telah dilaporkan oleh beberapa peneliti sebelumnya.
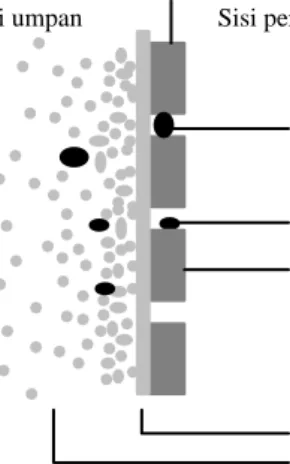
Darnoko dkk [36] telah mempelajari hidrolisis tapioka secara enzimatik dalam sistem
stirred-cell enzyme membrane reactor. Secara umum diperoleh bahwa kinerja bioreaktor
11 d Cbulk Cdinding Cpermeat C X lapisan gel J Membran Aliran substrat Molekul jembatan aktif Dinding hollow fiber Enzim Buluh hollow fiber
(a) Pembentukan lapisan gel enzim (b) Pengikatan enzim melalui dinamik pada
permukaan membran molekul jembatan aktif
Produk reaksi larutan enzim Substrat masuk
Membran hollow fiber
(c) Segregasi enzim pada buluh membran hollow fiber
Membran
Enzim Substrat Produk
(d) Segregasi enzim pada pori-pori membran hollow fiber
Gambar 3. Konfigurasi bioreaktor membran hollow fiber dengan enzim terimobilisasi Sims dan Cheryan [37] mengembangkan proses hidrolisis kontinu untuk sakarifikasi pati jagung dalam bioreaktor membran enzimatik. Berdasarkan studi distribusi waktu tinggal, ditunjukkan bahwa bioreaktor membran ini dapat dimodelkan sebagai reaktor tangki ideal kontinu. Mereka juga mendapatkan bahwa konstanta Michaelis-Menten (Km) untuk bioreaktor membran enzimatik adalah 2-7 kali lebih besar daripada reaktor curah. Sementara itu, konstanta laju reaksi (k2) untuk kedua reaktor tersebut hampir sama. Meskipun hasil ini menunjukkan bahwa kecepatan geser (shear rate) di dinding membran tidak mengakibatkan deaktivasi enzim, namun denaturasi enzim bisa saja terjadi jika kecepatan aliran terlalu tinggi.
Ulibarri dan Hall [38] menggunakan sebuah bioreaktor membran enzimatik dengan modul hollow fiber untuk hidrolisis pati singkong yang diparut. Mereka menunjukkan bahwa proses dapat dilakukan sampai konsentrasi substrat 8% dengan konversi lebih dari 94%.
12
Berdasarkan analisis statistik, didapatkan bahwa waktu tinggal, rasio konsentrasi enzim dan substrat, dan konsentrasi substrat merupakan variabel proses yang paling berpengaruh.
Hasil kajian literatur di atas jelas menunjukkan bahwa hidrolisis pati lebih cenderung menggunakan enzim terlarut dibandingkan dengan enzim terimobilisasi. Hal ini terutama disebabkan oleh karakteristik dari larutan pati yang sangat kental dengan kemampuan berdifusi sangat rendah. Hasil-hasil studi literatur tersebut juga menunjukkan bahwa produk akhir dari hidrolisis pati sangat mempengaruhi kinerja BME. Maltodekstrin (15 – 25 DE) dapat membentuk lapisan gel di permukaan membran. Selain itu, keberadaan pengotor pati berupa lemak, protein dan serat dapat meyebabkan terjadinya fouling membran. Namun tidak satu pun studi di atas menjelaskan bagaimana mekanisme dan kontribusi fouling pada BME untuk hidrolisis pati tapioka pada konsentrasi tinggi.
7.
Polarisasi Konsentrasi dan Fouling Membran
Salah satu faktor yang membatasi penggunaan ultrafiltrasi dalam berbagai aplikasi adalah fouling membran. Fouling adalah perubahan membran secara irreversibel yang disebabkan oleh interaksi fisik dan/atau kimia spesifik antara membran dan berbagai komponen yang ada dalam aliran proses [4]. Fouling membran umumnya dicirikan oleh penurunan fluks permeat dan perubahan selektivitas membran. Fluks permeat jauh lebih rendah dibandingkan dengan fluks air murni juga dapat disebabkan oleh perubahan karakteristik membran, perubahan karakteristik larutan umpan, dan polarisasi konsentrasi [39].
Perubahan karakteristik membran dapat terjadi sebagai akibat dari kompaksi atau degradasi kimia. Jika proses ultrafiltrasi dijalankan pada tekanan hidrostatik kurang dari 5 bar maka kemungkinan membran mengalami kompaksi sangat kecil. Dengan struktur mekanik membran yang terus semakin baik, fenomena kompaksi ini biasanya tidak perlu dikhawatirkan. Di lain pihak, degradasi kimia dapat terjadi jika pH, temperatur, dan faktor-faktor lingkungan lainnya tidak sesuai dengan material membran yang digunakan. Pencucian membran pada kondisi ekstrim, yang sering dilakukan untuk aplikasi pengolahan makanan dan biologis, dapat menurunkan usia pakai membran secara signifikan. Membran selulosa asetat adalah contoh membran dengan karakteristik fluks dan rejeksi yang baik, mudah dipabrikasi, tetapi cukup rentan terhadap degradasi kimia.
Dalam proses ultrafiltrasi, perpindahan pelarut melalui membran biasanya dipandang sebagai fenomena aliran viskos yang dinyatakan dengan persamaan Hagen-Poiseulle:
L P 8 r J 2 p (26)
Dalam persamaan ini, J adalah fluks permeat, adalah porositas, rp adalah jari-jari pori, adalah viskositas, adalah tortuositas pori, P adalah beda tekanan antara dua sisi membran, dan L adalah tebal membran. Persamaan ini jelas menunjukkan bahwa peningkatan viskositas akan mengakibatkan fluks permeat lebih rendah daripada fluks air murni. Selain viskositas, peningkatan densitas dan penurunan difusivitas solut juga akan menyebabkan fluks permeat lebih rendah daripada fluks air murni.
Karena membran retentif terhadap solut atau partikel dalam umpan maka terjadi akumulasi solut atau partikel pada permukaan membran. Fenomena ini disebut sebagai polarisasi konsentrasi, yaitu peningkatan konsentrasi solut secara lokal di permukaan membran. Pengaruh polarisasi konsentrasi ini bersifat reversibel karena dapat direduksi dengan penurunan tekanan lintas membran, pengurangan konsentrasi umpan atau peningkatan kecepatan aliran (turbulensi). Akumulasi solut atau partikel pada permukaan membran tersebut dapat mempengaruhi fluks dalam dua cara yang berbeda. Pertama, solut/partikel terakumulasi menimbulkan perbedaan tekanan osmosis yang menggerakkan aliran fluida balik dari sisi
13
permeat ke sisi umpan. Pengaruh ini akan sangat jelas terlihat untuk kasus yang melibatkan solut kecil karena cenderung mempunyai tekanan osmosis yang besar. Kedua, solut/partikel terakumulasi dapat memberikan tahanan hidraulik tambahan terhadap perpindahan massa melalui membran.
Di lain pihak, penurunan fluks karena fouling membran dapat ditimbulkan oleh mekanisme adsorpsi solut atau partikel, pembentukan lapisan gel, dan penyumbatan pori-pori membran. Semua faktor-faktor ini menimbulkan tahanan hidraulik tambahan terhadap perpindahan massa melalui membran. Mekanisme fouling dan kontribusinya terhadap kinerja membran sangat spesifik untuk setiap kasus. Tingkat fouling membran dipengaruhi oleh parameter morfologi membran (ukuran pori, distribusi ukuran pori, bentuk pori, porositas, bentuk permukaan lapisan selektif, dan tebal membran), sifat-sifat fisiko-kimia (sifat adsorpsi dan rapat muatan), dan hidrodinamika sistem (kecepatan aliran, tekanan operasi, konfigurasi modul, dan mode operasi).
Gambar 4 menyajikan ilustrasi skematik berbagai jenis tahanan hidraulik yang dapat terjadi dalam proses ultrafiltrasi. Fluks konvektif melalui membran dapat dituliskan sebagai:
total x tahanan viskositas dorong gaya fluks (27)
Berbagai tahanan seperti ditunjukkan pada Gambar 4 mempunyai tingkat kontribusi yang berbeda-beda terhadap tahanan total, RT. Dalam kasus yang ideal, misalnya filtrasi air murni, hanya tahanan membran Rm yang terlibat dalam proses sehingga RT = Rm. Seperti ditunjukkan pada Gambar 6, kenaikan konsentrasi ke arah permukaan membran menimbulkan tahanan polarisasi konsentrasi, Rcp. Konsentrasi solut yang terakumulasi mungkin menjadi sangat tinggi sehingga terbentuk lapisan gel yang menimbulkan tahanan lapisan gel, Rg. Ini akan terjadi terutama jika larutan umpan mengandung makromolekul seperti protein, polisakarida, atau koloid. Pada membran berpori, juga sangat mungkin terjadi penetrasi solut ke dalam pori-pori membran dan menimbulkan tahanan penyumbatan pori, Rp. Satu jenis tahanan yang lain adalah akibat dari fenomena adsorpsi, Ra, baik yang terjadi pada permukaan membran maupun pada permukaan pori.
Berbagai jenis tahanan
Rp : penyumbatan pori Ra : adsorpsi
Rm : membran
Rg : pembentukan lapisan gel Rcp : polarisasi konsentrasi Rcp Rm Rg Ra Rp Membran
Sisi umpan Sisi permeat
Gambar 4. Representasi skematis berbagai tahanan perpindahan massa dalam proses ultrafiltrasi
Perlu ditegaskan bahwa polarisasi konsentrasi dan fouling membran merupakan fenomena yang saling terkait. Sejak proses filtrasi dimulai, baik polarisasi konsentrasi dan
fouling membran terjadi secara bersamaan dan akan berperan terhadap penurunan fluks
14
mengandung makromolekul terlarut seperti protein dan partikel tersuspensi dimulai dengan adsorpsi makromolekul (periode 1), deposisi partikel (periode 2 dan 3), sublayers
rearrangement (periode 4), dan pengaruh viskositas larutan (periode 5). Dijelaskan bahwa
penurunan fluks permeat karena adsorpsi jauh lebih rendah dibandingkan karena deposisi partikel pada permukaan membran. Fluks permeat akan menjadi sangat rendah ketika viskositas larutan meningkat akibat akumulasi partikel di permukaan membran.
Beberapa studi khusus tentang mekanisme fouling oleh protein juga telah banyak dilakukan, seperti fouling oleh bovine serum albumin (BSA) pada membran polietersulfon 0,16
m [41], alumina oksida 0,22 m [42], alumina 0,2 m [43], single cell protein [44] dan fouling oleh -laktaglobulin pada membran polyvinylidenefluoride [45]. Kesimpulan yang berbeda
satu sama lain menunjukkan bahwa mekanisme fouling yang terjadi selama proses filtrasi dan tingkat kontribusinya terhadap penurunan fluks permeat bergantung pada material dan struktur pori membran, hidrodinamika aliran dalam modul membran, karakteristik larutan umpan, dan kondisi operasi. Sebagai contoh, adsorpsi protein menjadi tidak dominan pada membran yang lebih hidrofilik karena hanya membentuk adsorpsi satu lapis.
Fenomena penurunan fluks yang memberikan pengaruh negatif terhadap nilai keekonomian operasi UF merupakan tantangan yang paling serius. Keberadaan fouling menyebabkan membran harus dicuci secara periodik untuk menghilangkan komponen penyebab fouling dari permukaan maupun struktur membran. Frekuensi pencucian merupakan faktor ekonomi penting karena memberikan pengaruh terhadap usia membran [46]. Pencucian dan sanitasi membran juga diperlukan untuk beberapa alasan seperti persyaratan untuk industry makanan dan bioteknologi, reduksi mikroba untuk mencegah kontaminasi produk, dan optimalisasi proses. Ada beberapa strategi untuk mengendalikan fouling, yaitu: membuat atau perlakuan khusus terhadap membran, memodifikasi atau pengolahan air umpan, mengatur kondisi operasi, dan pencucian [47, 48].
Pencucian merupakan salah satu metode yang sering digunakan untuk menghilangkan foulant dari permukaan membran. Metode pencucian membran dapat dibedakan ke dalam empat golongan, yaitu pencucian hidraulik, pencucian mekanis, pencucian kimiawi, dan pencucian elektris. Pemilihan metode pencucian bergantung pada konfigurasi modul, tipe membran, ketahanan kimia, dan jenis foulant. Pencucian hidraulik meliputi backflushing,
pressurize-depressurize tekanan, dan perubahan aliran pada frekuensi tertentu. Pada metode backflushing,
arah aliran permeat dibalik secara periodik. Pada motode tersebut, produk dialirkan dari sisi permeat menuju sisi umpan. Metode tersebut mereduksi waktu operasi efektif juga menyebabkan kehilangan permeat ke larutan umpan. Hal ini menyebabkan backflush dalam aplikasi industri sangat terbatas sehingga diperlukan optimalisasi. Optimalisasi proses
backflush dilakukan terhadap durasi dan interval backflush. Peningkatan laju produk setelah
dilakukan backflush semata-mata merupakan fungsi tekanan backflush dan interval antara dua
backflush. Belakangan ini, waktu interval backflush telah dikurangi hingga hitungan detik yang
menandakan pula tahanan cake tetap rendah karena tidak sempat membentuk lapisan.
Teknik backflush terbaru dengan frekuensi tinggi dan waktu yang sangat singkat juga telah dikembangkan. Dengan waktu bakcflush yang sangat singkat (0,06 detik) dan interval maksimum 5 detik (disarankan 1-3 detik) didapatkan hasil yang sangat baik [49, 50]. Karena waktu backflush efektif yang sangat singkat dan tekanan backflush yang relative tinggi (1 bar di atas tekanan umpan) metode ini disebut sebagai “backshock”. Kehilangan permeat selama
backshock menjadi sangat rendah dan hampir tidak mempengaruhi aliran permeat. Teknik
backshock yang dikombinasikan dengan struktur memban asimetrik terbalik memungkinkan
filtrasi pada kecepatan crossflow yang sangat rendah dan fluks permeat yang sangat stabil.
15
memungkinkan filtrasi dengan fluks yang sangat stabil [50]. Dengan metode tersebut, permasalahan fouling pada proses klarifikasi larutan tersuspensi dapat diatasi [51-53].
Metode lainnya yaitu pencucian mekanis, hanya dapat diterapkan pada sistem modul tubular seperti dengan metode ultrasonik. Adapun pencucian kimiawi merupakan metode yang paling penting untuk mereduksi fouling menggunakan bahan kimia yang dapat digunakan secara terpisah maupun terkombinasi. Konsentrasi bahan kimia dan waktu pencucian juga merupakan hal yang penting karena berkaitan dengan ketahanan membran terhadap bahan kimia. Pencucian secara elektrik merupakan metode pencucian yang sangat khusus. Dengan mengaplikasikan arus listrik melewati membran, partikel-partikel atau molekul-molekul bermuatan akan bermigrasi sesuai dengan arah arus listrik. Pencucian elektrik dapat dilakukan tanpa mengganggu proses yang sedang berjalan dimana arus listrik dihidupkan hanya pada interval-interval waktu tertentu [54].
Selain pencucian, fouling juga dapat dikendalikan dengan mengoperasikan membran di bawah fluks kritisnya [55]. Dengan metode seperti ini, penumpukan foulant dipermukaan membran dapat dihindari. Selain itu, membran dapat dioperasikan dengan fluks yang stabil.
8.
Proses Hilir Hidrolisat Pati
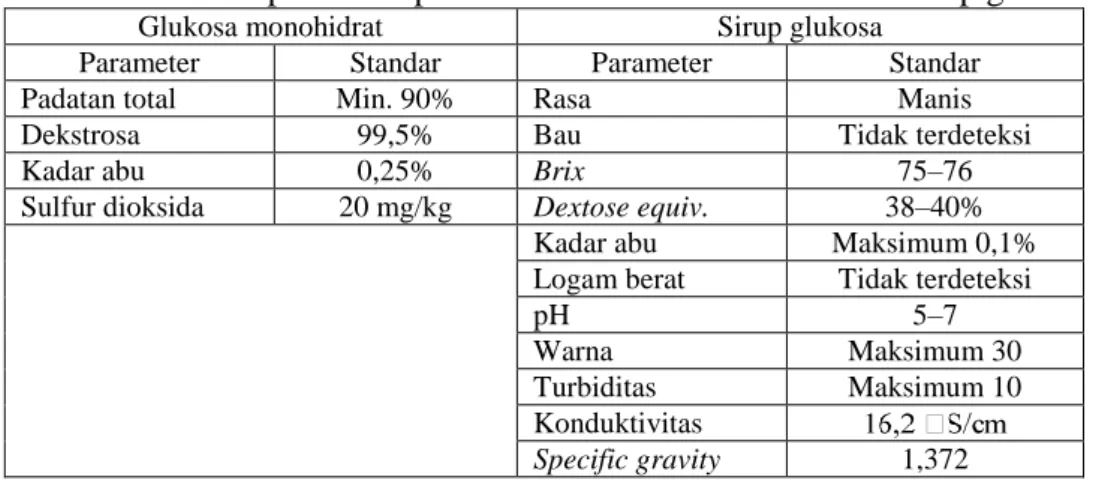
Hidrolisat pati yang dihasilkan dari reaktor sakarifikasi perlu dimurnikan lebih lanjut sampai memenuhi spesifikasi yang dipersyaratkan. Spesifikasi produk yang berlaku sangat bervariasi, bergantung pada kebutuhan setiap konsumen. Sebagai contoh, pada Tabel 5 ditunjukkan spesifikasi sirup glukosa dan dekstrosa monohidrat. Pada intinya, proses hilir hidrolisat pati dimaksudkan untuk penghilangan padatan tersuspensi (kekeruhan), penghilangan warna, penghilangan pengotor anorganik, dan pemekatan.
Tabel 5. Spesifikasi produk dekstrosa monohidrat dan sirup glukosa
Glukosa monohidrat Sirup glukosa
Parameter Standar Parameter Standar
Padatan total Min. 90% Rasa Manis
Dekstrosa 99,5% Bau Tidak terdeteksi
Kadar abu 0,25% Brix 75–76
Sulfur dioksida 20 mg/kg Dextose equiv. 38–40% Kadar abu Maksimum 0,1% Logam berat Tidak terdeteksi
pH 5–7
Warna Maksimum 30
Turbiditas Maksimum 10 Konduktivitas
Specific gravity 1,372
Padatan tersuspensi berasal dari tapioka itu sendiri, yang pada umumnya terdiri dari lemak, protein, dan serat. Karena tidak terkonversi selama proses hidrolisis, semua komponen pengotor ini tetap sebagai padatan tersuspensi (sering disebut sebagai mud). Seberapa banyak jumlah pengotor ini bergantung pada jenis dan proses produksi patinya. Karena ukurannya sangat kecil, penghilangan mud ini tidak dapat dilakukan dengan proses filtrasi biasa. Teknologi untuk penyisihan padatan tersuspensi yang banyak digunakan selama ini adalah
rotary vacuum filter press (RVFP) atau pressure leaf filter dengan menggunakan diatomite
(diatomaceous earth) sebagai filter aid [56]. Kedua teknologi ini membutuhkan banyak filter
aid dan menghasilkan limbah padat.
Hidrolisat yang sudah bebas dari padatan tersuspensi masih berwarna kuning kecoklatan. Warna ini berasal dari larutan enzim dan sebagian muncul selama proses hidrolisis. Sejumlah metode penyisihan warna dan ion dari larutan gula telah dipatenkan [57-59]. Pada
16
prinsipnya, kebanyakan metode yang diusulkan dalam paten tersebut berbasis pada penggunaan material seperti resin penukar anion, resin penukar kation, dan karbon aktif atau berdasarkan pemisahan molekular pada tekanan tinggi. Meskipun metode yang diusulkan oleh Othmer [59] mampu memisahkan pengotor dari larutan gula, metode ini tampaknya tidak populer untuk skala industri. Belakangan ini teknologi nanofiltrasi [60] dipandang sebagai teknologi ramah lingkungan, namun teknologi ini membutuhkan tekanan relatif tinggi karena tekanan osmosis larutan gula relatif tinggi. Oleh karena itu, teknologi yang paling banyak digunakan untuk penyisihan warna dan ion dari larutan gula selama ini adalah kombinasi karbon aktif dan resin penukar ion. Karena memiliki kapasitas pertukaran ion sangat terbatas, resin penukar ion harus diregenerasi dengan larutan asam dan basa pekat secara periodik. Regenerasi resin umumnya dilakukan setiap 6 jam sekali. Kelemahannya adalah kurang praktis, membutuhkan banyak bahan kimia dan menghasilkan banyak limbah cair.
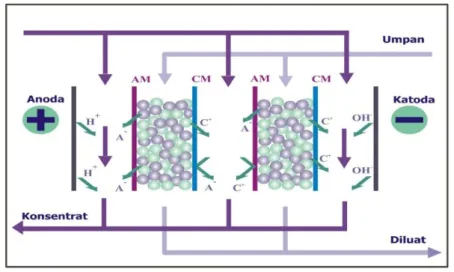
Elektrodeionisasi (EDI), yang sering juga disebut sebagai deionisasi kontinu (CDI) atau
superconductive electrodialysis (SCED), adalah proses pemisahan komponen ionik bergaya
dorong beda potensial listrik yang merupakan sinergi antara proses elektrodialisis dan proses pertukaran ion. Proses ini dapat beroperasi secara kontinu tanpa membutuhkan regenerasi kimia. Berdasarkan sudut pandang ini, EDI jauh lebih unggul dibandingkan dengan kolom penukar ion konvensional. Skematik dari salah satu konfigurasi proses EDI ditunjukkan pada Gambar 5.
Sebuah stack EDI terdiri dari kompartemen diluat, kompartemen konsentrat, dan kompartemen elektroda. Kompartemen diluat dan konsentrat dipisahkan oleh membran penukar kation (CM) dan membran penukar anion (AM) yang disusun secara bergantian. Untuk aplikasi tertentu, kompartemen diluat dan konsentrat hanya dipisahkan oleh membran penukar kation atau membran penukar anion. Membran penukar kation hanya bisa dilewati oleh kation (C+ atau H+) , sebaliknya membran penukar anion hanya bisa dilewati oleh anion (A- atau OH -). Kompartemen diluat dijejali dengan campuran resin penukar ion. Keberadaan resin penukar ion ini akan mengakomodasi perpindahan arus listrik dan meningkatkan perpindahan komponen ionik dari ruah larutan menuju membran penukar ion sehingga efisiensinya lebih tinggi daripada elektrodialisis [61] akibat dari (a) penurunan tahanan elektrik stack, (b) pembangkitan vortex dalam aliran larutan oleh butiran resin penukar ion, dan (c) peningkatan luas permukaan perpindahan massa. Keberadaan resin penukar ion tersebut memungkinkan EDI untuk menghasilkan air dengan kemurnian tinggi [62] dan mengolah larutan dengan konduktivitas rendah. Karena konsentrasi ion meningkat pada kompartemen konsentrat dan berkurang pada kompartemen diluat maka proses ini dapat digunakan untuk tujuan pemurnian atau pemekatan.
17
Sejak pertama kali dikomersialkan oleh Millipore pada tahun 1987 dengan nama dagang Ionpure CDI [63], aplikasi teknologi ini terutama digunakan untuk produksi air ultramurni untuk memenuhi kebutuhan industri farmasi, semikonduktor, power (pembangkit tenaga listrik), dan industri optik kualitas tinggi [64]. Karena keberhasilannya mengatasi tantangan seperti biaya pabrikasi, scale-up, dan preparasi membran penukar ion, sistem EDI telah mulai diarahkan untuk daur ulang air dan pengutipan logam, pemanenan asam sitrat dari kaldu fermentasi [64]. Selain itu, ukuran stack EDI komersial yang ada saat ini sangat bervariasi sehingga dapat disesuaikan dengan kapasitas yang diinginkan.
DAFTAR PUSTAKA
1. Cock, J.H., Cassava: new potential for a neglected crop. 1985: Westview Press.
2. Patil, S., Starch Properties, Modification, and Applications in Foods. Part 1. Eur. Food Drink Rev, 1991: p. 72-84.
3. Bruijn, G.d. and Fresco, L., The importance of cassava in world food production. Netherlands Journal of Agricultural Science, 1989. 37(1): p. 21-34.
4. Zeman, L.J. and Zydney, A.L., Microfiltration and ultrafiltration: principles and
applications. 1996: M. Dekker.
5. Anonim. The use of enzymes in starch hydrolysis.
http://www.sbu.ac.uk/biology/enztech/starch.html.
6. Anonim. Types of macromolecules.
http://trc.ucdavis.edu/srdungan/fst100a/15polysacc/sld001.htm. 7. Anonim. Starch. http://www.starch.dk/isi/starch/starch.htm.
8. Leach, H.W., Gelatinization of starch. Starch: Chemistry and Technology, ed. By Whistler RL And Paschall Eugene F., Academic Press, New York and London, 1965: p. 289-307. 9. Pongsawatmanit, R., Thanasukarn, P., and Ikeda, S., Effect of sucrose on RVA viscosity
parameters, water activity and freezable water fraction of cassava starch suspensions.
Science Asia, 2002. 28(2): p. 129-134.
10. Horvathova, V., Janecek, S., and Sturdik, E., Amylolytic enzymes: their specificities,
origins and properties. BIOLOGIA-BRATISLAVA-, 2000. 55(6): p. 605-616.
11. Fujii, M. and Kawamura, Y., Synergistic action of α‐amylase and glucoamylase on
hydrolysis of starch. Biotechnology and bioengineering, 1985. 27(3): p. 260-265.
12. Kusunoki, K., Kawakami, K., Shiraishi, F., Kato, K., and Kai, M., A kinetic expression for
hydrolysis of soluble starch by glucoamylase. Biotechnology and bioengineering, 1982.
24(2): p. 347-354.
13. Shiraishi, F., Kawakami, K., and Kusunoki, K., Kinetics of condensation of glucose into
maltose and isomaltose in hydrolysis of starch by glucoamylase. Biotechnology and
bioengineering, 1985. 27(4): p. 498-502.
14. Wansukri, R., Chotineeranat, S., Piyachomkwan, K., and Sriroth, K., Protein in rice flour
and its effect on rice starch hydrolysis, in 5th Asia-Pacific Biochemical Engineering Conference 1999 and 11th Annual Meeting of the Thai Society for Biotechnology. 1999:
Thailand.
15. Wenten, I.G., Teknologi membran dalam pengembangan agroindustri: Produksi bersih
dalam industri tapioka, in Seminar Nasional BK Teknik Pertanian dan BK Kimia, PII.
2002: Jakarta.
16. Rony, P.R., Multiphase catalysis. II. Hollow fiber catalysts. Biotechnology and Bioengineering, 1971. 13(3): p. 431-447.
18
17. Chang, H.N., Kyung, Y.S., and Chung, B.H., Glucose oxidation in a dual hollow fiber
bioreactor with a silicone tube oxygenator. Biotechnology and bioengineering, 1987.
29(5): p. 552-557.
18. Chung, B.H. and Chang, H.N., Aerobic fungal cell immobilization in a dual hollow‐fiber
bioreactor: Continuous production of a citric acid. Biotechnology and bioengineering,
1988. 32(2): p. 205-212.
19. Shao, X., Fend, Y., Hu, S., and Govind, R., Pectin degradation in a spiral membrane
reactor. Membrane Reactor Technology, 1989(268): p. 85-92.
20. Waterland, L.R., Michaels, A.S., and Robertson, C.R., A theoretical model for enzymatic
catalysis using asymmetric hollow fiber membranes. AIChE Journal, 1974. 20(1): p.
50-59.
21. Breslau, B.R. Catalytic process utilizing hollow fiber membranes. U. S. Patent, No. 4,226,026. 1981
22. Fabiani, C., Giubileo, G., Pizzichini, M., and Violante, V., Steady state modelling of a
hollow fiber enzymatic reactor. Biotechnology and bioengineering, 1987. 30(3): p.
458-461.
23. Drioli, E., Iorio, G., and Catapano, G., Enzyme membrane reactors and membrane
fermentors, in Handbook of Industrial Membrane Technology, M.C. Porter, Editor. 1990,
Noyes: Park Ridge, NJ. p. 401-481.
24. Cheryan, M. and Mehaia, M.A., Membrane bioreactor, in Membrane Separations in
Biotechnology, W.C. McGregor, Editor. 1986, Marcel Dekker: New York. p. 225-301.
25. Deeslie, W.D. and Cheryan, M., A CSTR‐hollow fiber system for continuous hydrolysis of
proteins. Performance and kinetics. Biotechnology and Bioengineering, 1981. 23(10): p.
2257-2271.
26. Deeslie, W.D. and Cheryan, M., A CSTR‐hollow‐fiber system for continuous hydrolysis of
proteins. Factors affecting long‐term stability of the reactor. Biotechnology and
bioengineering, 1982. 24(1): p. 69-82.
27. Berke, W., Schüz, H.J., Wandrey, C., Morr, M., Denda, G., and Kula, M.R., Continuous
regeneration of ATP in enzyme membrane reactor for enzymatic syntheses. Biotechnology
and bioengineering, 1988. 32(2): p. 130-139.
28. Lee, C. and Hong, J., Membrane reactor coupled with electrophoresis for enzymatic
production of aspartic acid. Biotechnology and bioengineering, 1988. 32(5): p. 647-654.
29. Closset, G., Cobb, J., and Shah, Y., Study of performance of a tubular membrane reactor
for an enzyme catalyzed reaction. Biotechnology and Bioengineering, 1974. 16(3): p.
345-360.
30. Tachauer, E., Cobb, J., and Shah, Y., Hydrolysis of starch by a mixture of enzymes in a
membrane reactor. Biotechnology and bioengineering, 1974. 16(4): p. 545-550.
31. Madgavkar, A., Shah, Y., and Cobb, J., Hydrolysis of starch in a membrane reactor. Biotechnology and bioengineering, 1977. 19(11): p. 1719-1726.
32. Hoq, M.M., Yamane, T., Shimizu, S., Funada, T., and Ishida, S., Continuous hydrolysis of
olive oil by lipase in microporous hydrophobic membrane bioreactor. Journal of the
American Oil Chemists Society, 1985. 62(6): p. 1016-1021.
33. Pronk, W., Kerkhof, P., Van Helden, C., and Riet, K.v.T., The hydrolysis of triglycerides
by immobilized lipase in a hydrophiiic membrane reactor. Biotechnology and
bioengineering, 1988. 32(4): p. 512-518.
34. Goto, M., Goto, M., Nakashio, F., Yoshizuka, K., and Inoue, K., Hydrolysis of triolein by
lipase in a hollow fiber reactor. Journal of membrane science, 1992. 74(3): p. 207-214.
35. Wenten, I. and Widiasa, I., Enzymatic hollow fiber membrane bioreactor for penicilin
19
36. Darnoko, D., Cheryan, M., and Artz, W., Saccharification of cassava starch in an
ultrafiltration reactor. Enzyme and microbial technology, 1989. 11(3): p. 154-159.
37. Sims, K.A. and Cheryan, M., Hydrolysis of liquefied corn starch in a membrane reactor. Biotechnology and bioengineering, 1992. 39(9): p. 960-967.
38. Lopez-Ulibarri, R. and Hall, G., Saccharification of cassava flour starch in a hollow-fiber
membrane reactor. Enzyme and Microbial Technology, 1997. 21(6): p. 398-404.
39. Cheryan, M., Ultrafiltration and microfiltration handbook. 1998, Lancaster: CRC press. 40. Nagata, N., Herouvis, K.J., Dziewulski, D.M., and Belfort, G., Cross‐flow membrane
microfiltration of a bacteriol fermentation broth. Biotechnology and bioengineering,
1989. 34(4): p. 447-466.
41. Opong, W.S. and Zydney, A.L., Hydraulic permeability of protein layers deposited during
ultrafiltration. Journal of colloid and interface science, 1991. 142(1): p. 41-60.
42. Bowen, W.R. and Gan, Q., Properties of microfiltration membranes: flux loss during
constant pressure permeation of bovine serum albumin. Biotechnology and
bioengineering, 1991. 38(7): p. 688-696.
43. Clark, W., Bansal, A., Sontakke, M., and Ma, Y., Protein adsorption and fouling in
ceramic ultrafiltration membranes. Journal of membrane Science, 1991. 55(1): p. 21-38.
44. Wenten, I.G. and Jonsson, G.E. Fouling studies during membrane filtration of single-cell
protein suspension. in International Congress on Membranes and Membrane Processes.
1996.
45. Persson, K.M., Capannelli, G., Bottino, A., and Träg, G., Porosity and protein adsorption
of four polymeric microfiltration membranes. Journal of membrane science, 1993. 76(1):
p. 61-71.
46. Wenten, I.G., Taylour, J., Skou, F., Rasmussen, A., and Jonsson, G. Membrane cleaning
after beer clarification. in Fouling and Cleaning in Food Processing, European Commission. 1996. Jesus College, Cambridge.
47. Fane, A.G. and Fell, C.J.D., A review of fouling and fouling control in ultrafiltration. Desalination, 1987. 62: p. 117-136.
48. Matthiasson, E. and Sivik, B., Concentration polarization and fouling. Desalination, 1980. 35: p. 59-103.
49. Wenten, I., Koenhen, D., Roesink, H., Rasmussen, A., and Jonsson, G., The Backshock
Process: A novel backflush technique in microfiltration. Proceedings of Engineering of
Membrane Processes, II Environmental Applications, Ciocco, Italy, 1994.
50. Wenten, I.G., Mechanisms and control of fouling in crossflow microfiltration. Filtration & separation, 1995. 32(3): p. 252-253.
51. Jonsson, G. and Wenten, I.G. Control of concentration polarization, fouling and protein
transmission of microfiltration processes within the agro-based industry. in Proceedings of the ASEAN-EC Workshop on Membrane Technology in Agro-Based Industry, Kuala-Lumpur, Malaysia. 1994.
52. Wenten, I.G., Application of crossflow membrane filtration for processing industrial
suspensions. 1994, The Technical University of Denmark.
53. Wenten, G., Koenhen, D.M., Roesink, H.D.W., Rasmussen, A., and Jonsson, G. Method
for the removal of components causing turbidity, from a fluid, by means of microfiltration.
US Patent No. US5560828 A. 1996
54. Mulder, M., Basic Principles of Membrane Technology. 2nd ed. 1996, Netherlands: Kluwer Academic Publisher.
55. Chen, V., Fane, A.G., Madaeni, S., and Wenten, I.G., Particle deposition during
membrane filtration of colloids: transition between concentration polarization and cake formation. Journal of Membrane Science, 1997. 125(1): p. 109-122.
20
56. Singh, N. and Cheryan, M., Process design and economic analysis of a ceramic membrane
system for microfiltration of corn starch hydrolysate. Journal of Food Engineering, 1998.
38(1): p. 57-67.
57. Walon, R.G.P. Process of refining enzymatically produced levulose syrups. U.S. Patent, No. 4,040,861. 1977
58. Farag, S.A. and Norman, L.W. Process for decolorizing solutions with peroxide. U.S. Patent, No. 4,076,552. 1978
59. Othmer, D.F. Solvent refining of sugar. U.S. Patent, No. 4,116,712. 1978
60. Donovan, M. and Hlavacek, M. Process for purification of low grade sugar syrups using
nanofiltration. U.S. Patent, No. 6,406,546. 2002
61. Iurash, C., Nikonenko, V., Pismenskaya, N., Zabolotsky, V., and Volodina, E.,
Dependence of salt and water ion fluxes through ion-exchange membranes under electrodialysis on the ion-exchange bed composition. Desalination, 1999. 124(1): p.
105-113.
62. Ervan, Y. and Wenten, I.G., Study on the influence of applied voltage and feed
concentration on the performance of electrodeionization. Songklanakarin J. Sci. Technol,
2002. 24: p. 955-963.
63. Ganzi, G.C., Wood, J.H., and Griffin, C.S., Water purification and recycling using the
CDI process. Environmental Progress, 1992. 11(1): p. 49-53.
64. Wenten, I.G., Recent development in membrane science and its industrial applications. J Sci Technol Membrane Sci Technol, 2002. 24(Suppl): p. 1010-1024.
![Tabel 1. Kandungan amilosa dan ukuran granula untuk beberapa jenis pati [7]](https://thumb-ap.123doks.com/thumbv2/123dok/4574163.3330132/7.892.162.728.669.905/tabel-kandungan-amilosa-ukuran-granula-untuk-jenis-pati.webp)
![Tabel 2. Karakteristik gelatinisasi beberapa jenis pati [8]](https://thumb-ap.123doks.com/thumbv2/123dok/4574163.3330132/8.892.128.700.273.553/tabel-karakteristik-gelatinisasi-beberapa-jenis-pati.webp)
![Tabel 4. Enzim-enzim untuk hidrolisis pati [5]](https://thumb-ap.123doks.com/thumbv2/123dok/4574163.3330132/9.892.116.785.415.830/tabel-enzim-enzim-untuk-hidrolisis-pati.webp)
![Gambar 3. Konfigurasi bioreaktor membran hollow fiber dengan enzim terimobilisasi Sims dan Cheryan [37] mengembangkan proses hidrolisis kontinu untuk sakarifikasi pati jagung dalam bioreaktor membran enzimatik](https://thumb-ap.123doks.com/thumbv2/123dok/4574163.3330132/15.892.100.685.101.1159/konfigurasi-bioreaktor-terimobilisasi-mengembangkan-hidrolisis-sakarifikasi-bioreaktor-enzimatik.webp)