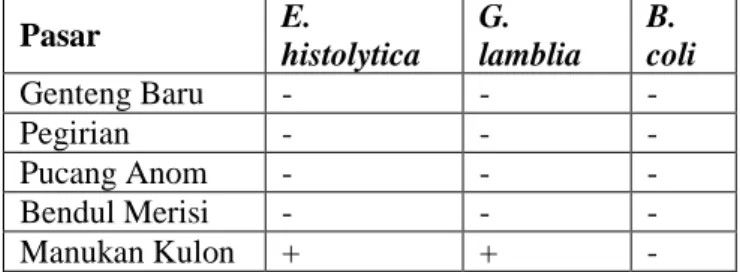
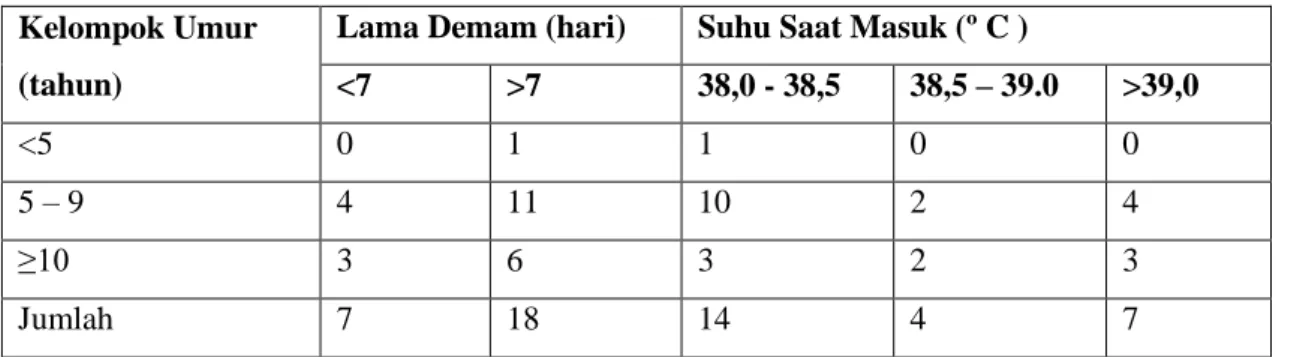
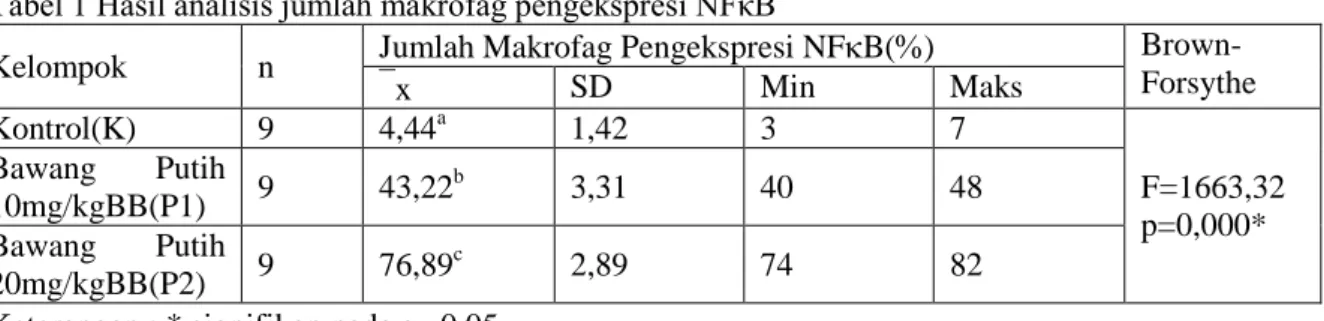
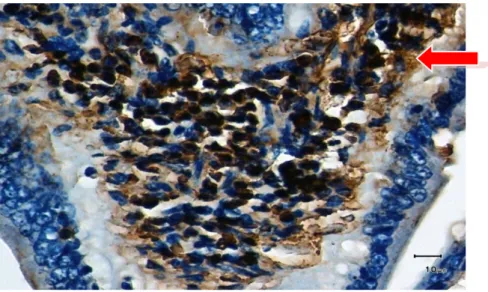
1
CHOLERA
Asih Rahayu
Dosen Fakultas Kedokteran Universitas Wijaya Kusuma Surabaya
Abstrak :Cholera adalah penyakit infeksi saluran usus yang bersifat akut dan disebabkan oleh bakteri Vibrio cholerae, suatu bakteri Gram negatif berbentuk batang pendek yang pada awal isolasi terlihat sebagai bentuk koma sehingga Robert Koch sempat memberi nama bakteri tersebut sebagai Komabacillus. Vibrio cholerae tidak bersifat invasif , melainkan tetap tinggal pada permukaan sel epithel usus halus, berkembang biak dan mengeluarkan exotoxin berupa enteroxin yang disebut choleragen. Penularan cholera umumnya melalui makanan atau minuman yang tercemar. Feces penderita merupakan sumber infeksi utama. Cholera dapat menyebar dengan cepat di tempat - tempat yang tidak mempunyai penanganan pembuangan kotoran/sewage dan sumber air yang tidak memadai. Selain Serogrup O1 yang terdiri dari biotype el tor dan biotype cholerae
saat ini telah ditemukan serogrup O139 yang secara fisiologis maupun biokimiawi mirip dengan Serogrup O1
biotype el tor. Manifestasi klinis yang khas pada cholera adalah terjadinya diare yang mirip air cucian beras (rice water stools).
Kata kunci : Cholera, Vibrio cholerae, choleragen, rice water stools
CHOLERA
Asih Rahayu
Lecturer Faculty of Medicine, University of Wijaya Kusuma Surabaya
Abstract:Cholera is an acute disease in the intestinal tract caused by Vibrio cholerae bacteria, a short, gram negative rods bacteria that initially appears in a coma shape and thus Robert Koch called it Komabacillus. Vibrio Cholerae is not invasive, but it stay at the epithelial cell surface of the small intestine, multiplying and producing exotoxin in a form of enteroxin, called choleragen. Cholera's infection is commonly through the contaminated food and water. Feces of the patient is its main source of infection. Cholera can spread fastly in places with unproper sewages and water sources. Besides the O1 Serogroup that contain biotype el tor dan
biotype cholerae, the new serogrup O139 has found recently. The serogroup O139 is similar to the serogroup
O1 biotype el tor, in physiologically and biochemically. The specific clinical manifestasion of cholerae is the
diarrhea symptoms that looks like a rice water stools.
Keyword: Cholera, Vibrio cholerae, Choleragen, Rice water stools
PENDAHULUAN :
Cholera adalah penyakit infeksi saluran usus yang bersifat akut dan disebabkan oleh bakteri Vibrio cholerae. Bakteri ini masuk kedalam tubuh host secara per oral umumnya melalui makanan atau minuman yang tercemar.
Cholera dapat menular sebagai penyakit yang bersifat epidemik. Meskipun sudah banyak penelitian berskala besar dilakukan, namun penyakit ini tetap menjadi suatu tantangan bagi dunia kesehatan. Dalam situasi adanya wabah / epidemi, feces penderita merupakan sumber infeksi. Cholera dapat menyebar dengan cepat di tempat - tempat yang tidak mempunyai penanganan pembuangan kotoran/sewage dan sumber air yang tidak memadai.
Pada tahun 2010 ini dunia dikejutkan dengan adanya wabah cholera yang terjadi di Haiti semenjak bulan oktober 2010. Sampai 30 nopember 2010 angka resmi korban jiwa
akibat Cholera di Haiti mencapai 1.721 orang. Ini merupakan musibah kedua bagi Haiti setelah terjadinya musibah gempa bumi 12 Januari 2010. Wabah ini berpusat di wilayah Lower Artibonite, di utara ibu kota Port-au-Prince. Di kota ini, 750 orang tewas akibat cholera, sedangkan di ibu kota Haiti, Port-au-Prince, sebanyak 162 orang meninggal akibat kolera. Kasus itu juga dilaporkan di daerah Dataran Tinggi Tengah (Central Plateau). Rumah sakit setempat penuh dengan penderita diare akut, dengan para korban meninggal disebabkan dehidrasi cepat, yang terkadang hanya dalam tempo beberapa jam, namun WHO dan PBB belum mengkonfirmasikan bahwa cholera sebagai penyebab kematian-kematian itu, sementara mereka menunggu hasil-hasil akhir uji laboratorium atas sampel-sampel yang diambil dari korban yang tewas dan sakit. Sebelumnya, Dirjen Departemen Kesehatan Haiti, Dr. Gabriel Thimote dan Menteri
2 Kesehatan Alex Larsen mengatakan, uji
pendahuluan mengindikasikan cholera. Di Hinche , bagian tengah Haiti, pengunjuk rasa melemparkan batu ke arah tentara Nepal yang telah jadi sasaran desas-desus yang beredar luas bahwa mereka membawa bakteri penyebab cholera ke Haiti. Misionaris PBB di Haiti, yang membantu negara miskin Karibia itu melakukan pembangunan kembali setelah gempa yang memporakporandakan negeri tersebut pada 12 Januari, telah membantah desas-desus bahwa kakus yang berada di dekat sungai di kamp pasukan pemelihara perdamaian PBB dari Nepal adalah penyebab wabah kolera. Pusat Pencegahan dan Pemantauan Penyakit AS (CDC) telah menyatakan pemeriksaan DNA memperlihatkan rangkaian cholera di Haiti berkaitan erat dengan rangkaian dari Asia Selatan,tetapi CDC belum menunjuk kepada sumber tersebut atau mengaitkannya secara langsung dengan tentara Nepal, yang dikatakan PBB telah diperiksa negatif mengenai penyakit itu. 6,7,8,9
ETIOLOGI :
Cholera pada manusia disebabkan oleh bakteri Vibrio cholerae. Bakteri ini merupakan salah satu spesies dari genus Vibrio yang merupakan famili Vibrionaceae. Genus Vibrio terdiri lebih dari 30 spesies yang biasanya ditemukan pada lingkungan perairan. Vibrio yang pathogen terhadap manusia adalah Vibrio cholerae, Vibrio parahaemolyticus dan Vibrio vulnificus. Hampir semua genus Vibrio menghasilkan enzim Oxydase dan memberikan hasil uji Indol yang positif. Genus Vibrio terdiri dari non-halophilic yang tidak memerlukan garam dalam pertumbuhannya, diantaranya adalah Vibrio cholerae dan halophilic yang memerlukan garam dalam pertumbuhannya , diantaranya adalah Vibrio parahaemolyticus dan Vibrio vulnificus.3
Vibrio cholerae merupakan bakteri Gram negatif berbentuk batang pendek dengan ukuran sekitar 0,5 µm x 1,5-3 µm. Bakteri ini tampak berbentuk seperti tanda koma pada awal isolasi, oleh karena itu Robert Koch sempat memberi nama bakteri tersebut sebagai Komabacillus.5
Pada biakan tua, bakteri ini akan tampak berbentuk batang lurus mirip dengan bakteri enterik Gram negatif . Vibrio cholera bersifat motil, aktif bergerak dengan
menggunakan flagella tunggal yang terletak di salah satu ujungnya.1,5,11
Vibrio cholerae merupakan bakteri fakultatif anaerob yang mempunyai suhu optimum pertumbuhan sekitar 18°C - 37°C. Sistim metabolismenya adalah respiratif maupun fermentatif. Bakteri ini tumbuh baik pada media sederhana yang mengandung sumber karbohidrat , bahan- bahan anorganik nitrogen, sulfur, phosphor dan berbagai macam mineral. Tingkat keasaman /pH optimum untuk pertumbuhannya adalah 7,0 tetapi bakteri ini toleran pada pH alkalis sampai 9,0 . Olleh karena itu pH alkalis ini dijadikan dasar untuk membuat media isolasi Vibrio cholerae. Pada tingkat keasaman /pH acid ≤6,0 bakteri ini akan mati. Sebagai media seletif untuk bakteri ini adalah TTGA/Tellurite Taurocholate Gelatin Agar atau TCBS/Thiosulfate Citrate Bile Sucrose Agar. Vibrio cholerae umumnya memfermentasi sucrosa dan manosa tetapi tidak memfermentasi arabinosa. 1,5
Antigen penting untuk serologic typing terhadap Vibrio cholerae adalah antigen O atau Somatic antigen. Hingga saat ini tercatat lebih dari 130 serogrup O. Serogrup O1 terdiri dari biotype el tor dan
cholerae yang menyebabkan classic epidemic cholerae. Biotype el tor berbeda dengan biotype cholera/classic karena kemampuannya menghasilkan hemolisin dan kepekaannya terhadap polymixin B, el tor menghasilkan hemolisin dan resisten terhadap polymixin B sedanghan cholerae/classic tidak menghasilkan hemolisin serta sensitif terhadap polymixin B. Kedua biotype tersebut secara serologis terdiri dari serotype Ogawa, Inaba dan Hikojima. Serogrup non O1 menyebabkan diare yang lebih ringan pada manusia. Semua strain Vibrio cholerae mempunyai antigen H/flagellar yang sama. 1,3,5
Antigen O dari Vibrio cholerae
merupakan bagian dari
LPS/lipopolysacharide , yaitu komponen dari dinding selnya.
EPIDEMIOLOGI:
Biotype el tor maupun biotype cholerae keduanya dapat menyebabkan wabah pada manusia. Semenjak tahun 1817 telah tercatat 7 pandemi dan sampai pandemi ke 7 dimana sudah ditemukan pengobatan yang cukup efektif, masih saja menimbulkan
3 tingkat kematian yang tinggi. Pada tahun
1947 di Mesir terjadi epidemi yang menewaskan 22.000 diantara 33.000 penderitanya. Di Amerika Serikat terjadi kematian 150.000 orang akibat cholera pada pandemi ke dua pada tahun 1832-1849, selanjutnya pada pandemi tahun 1866 terjadi kematian 50.000 orang. Pada pandemi ke lima dan ke enam tercatat disebabkan oleh biotype cholerae sedangkan pada pandemi ke tujuh tercatat disebabkan oleh biotype el tor. Sejak 1982 di Bangladesh terjadi peningkatan hasil isolasi dari biotype cholerae. 5
Pada tahun 1973 biotype cholerae/classic tercatat di Bangladesh dan menyebar ke Indonesia, Timur Jauh dan Afrika . Pada tahun 1991 mencapai Amerika Selatan yaitu Peru yang merupakan terjadinya epidemi pertama pada abad duapuluh . Sampai dengan Desember 1993 terjadi epidemi di seluruh wilayah Amerika latin kecuali Uruguay dengan jumlah kematian 7000 dari 820.000 kasus. Semenjak 1993 kasus penyakit ini di Barat menurun dan saat ini kasus ini kebanyakan terjadi di Afrika dan Asia.3
Infeksi cholera umumnya ditularkan melalui kontaminasi bakteri Vibrio cholerae pada air atau makanan misalnya makanan yang tidak dimasak atau buah – buahan. Sebagai sumber kontaminasi bakteri ini adalah feces dari penderita atau feces dari carrier, selain itu kontaminasi dapat terjadi secara alamiah melalui sumber air mengingat bahwa bakteri ini adalah bakteri yang mempunyai habitat di perairan. Cholera secara karakteristik merupakan penyakit pada masyarakat yang bermasalah dengan standar kesehatan lingkungan yang tidak memadai, pemakaian sumber air bersama misalnya tandon air, sungai atau dengan kata lain fasilitas mandi, cuci dan kakus bersama.
Pada tahun 1992 terjadi kasus cholera di Madras , India dan pada pertengahan Januari 1993 isolat yang serupa ditemukan di Bangladesh dan secara cepat meluas ke arah utara mengikuti arah aliran sungai serta menimbulkan pandemi baru. Pada tahun 2002 diperkirakan terjadi 30.000 kasus di Dhaka, Bangladesh. Strain baru ini ternyata tidak mengaglutinasi semua antisera dalam serogrup O dan hanya dapat diuji dengan serogrup baru yaitu O139 Bengal,
tetapi secara fisiologis maupun biokimiawi lebih menyerupai Vibrio cholerae O1 el tor.
Strain Vibrio cholerae O139 ini dapat
ditemukan bersama-sama dengan amoeba, copepoda dan zooplankton yang mungkin bertindak sebagai reservoir bakteri ini.3 PATOGENESA DAN MANIFESTASI KLINIS :
Faktor penentu patogenitas dari Vibrio cholerae adalah kemampuannya memproduksi enterotoxin dan kemampuan motilitasnya. Enterotoxin yang dihasilkan merupakan exotoxin yang disebut sebagai Cholera Toxin /CT atau Choleragen. 1,3,5,10,11
Menurut Greenwood, faktor penentu patogenitas Vibrio cholerae selain kemampuan membentuk toksin adalah adanya ekspresi dari “toxin-co-regulated pili”.3
Choleragen adalah toxin protein oligometrik. Toxin ini tersusun dari 1 Sub Unit A dengan BM 27.200 D yang terdiri dari 2 fragmen A1 dan A2 yang terikat bersama oleh ikatan disulfide serta 5 Sub Unit B dengan BM masing – masing 11.200D. 3,10
Untuk dapat menimbulkan cholera, sedikitnya harus ada minimal 108 – 1010 bakteri Vibrio cholerae yang menginfeksi, hal ini berbeda dengan salmonellosis atau shigellosis yang dosis infektifnya 102 -105.
1,10
Bakteri penyebab cholera ini bukan bakteri yang infeksinya bersifat invasif. Vibrio cholerae tidak mencapai peredaran darah sehingga tidak menimbulkan bakteriemia melainkan tetap tinggal pada permukaan sel epithel usus halus, berkembang biak dan mengeluarkan toxin choleragen, enzim mucinase serta endotoxin.
Bila sel epithel usus halus terpapar choleragen maka Sub Unit B akan melekat pada gangliosit GM1 pada membrane sel
epithel usus halus, perlekatan ini dibantu oleh adanya hemaglutinin, lipopolisakharida serta pili. Selanjutnya Sub Unit A akan melewati membrane sel epithel usus halus dengan cara menghidolisis ikatan disulfide sehingga Sub Unit A1 terpisah dengan Sub Unit A2. Sub Unit A1 mempunyai aktifitas transferase ribose-ADP dan merangsang pemindahan ribose-ADP dari NAD ke protein pengikat GTP yang mengendalikan aktifitas adenilat siklase. Ribosilasi ADP dari protein pengikat GTP akan menghambat reaksi penghentian GTP dan menyebabkan berhentinya kenaikan dalam aktifitas adenilat siklase, akibatnya
4 terjadi kenaikan cAMP intraseluler ,
menimbulkan sekresi cairan isotonis dari sel epithel usus ke dalam lumen usus halus.10
Choleragen tidak memblokade atau mencegah reabsorbsi natrium dan air oleh usus halus atau colon, tetapi pada kasus cholera yang akut sekresi air dan ion dari sel mukosa usus halus melebihi kemampuan colon mengasorbsi yang hilang.
Masa inkubasi cholera variatif mulai dari beberapa jam hingga 5 hari, umumnya 2-3 hari. Diperkirakan selama hasil pemeriksaan feces masih positif, maka penderita tersebut masih berpotensi sebagai sumber penularan dan akan berlangsung hingga beberapa hari setelah dinyatakan sembuh, bahkan status sebagai carrier berlangsung hingga beberapa bulan kemudian.2
Secara klinis yang pertamakali dirasakan oleh penderita adalah rasa penuh di abdomen , hilangnya nafsu makan , telapak tangan serta kaki terasa dingin. Berikutnya secara tiba – tiba mual, muntah dan diare hebat. Feces yang cair yang mula – mula berwarna coklat kemudian berubah menjadi pucat berisi sedikit lendir yang secara klasik diistilahkan sebagai “rice water stools” / air cucian beras. Diare ini dapat mencapai 24 liter per hari. 1,2,3,5,10,11
DIAGNOSA LABORATORIS :
Diagnosa ditegakkan dengan mengisolasi Vibrio cholerae dari serogrup O1
atau O139 dari feces penderita. Bila fasilitas
laboratorium tidak tersedia, medium transport misalnya Cary-Blair dapat digunakan untuk membawa atau menyimpan specimen yang berupa rectal swab/ apus dubur penderita.3
Diagnosa klinis presumptif secara cepat dapat dilakukan dengan pemeriksaan mikroskopis memakai dark-field microscope untuk melihat gerakan dari bakteri yang khas seperti bintang jatuh /”shooting stars” .Untuk keperluan epidemiologis diagnosa presumptif dibuat berdasarkan adanya kenaikan titer antitoksin dan antibody spesifik yang bermakna. Di daerah non-endemis, bakteri yang diisolasi dari kasus yang dicurigai sebaiknya dikonfirmasikan dengan pemeriksaan biokimiawi dan pemeriksaan serologis yang tepat serta dilakukan uji kemampuannya untuk menghasilkan choleragen. Pada saat terjadi wabah, sekali
telah dilakukan konfirmasi laboratorium dan uji sensitivitas antibiotika, maka terhadap semua kasus yang lain tidak perlu lagi dilakukan uji laboratorium. 3
Mula – mula specimen yang berupa feces penderita diinokulasi pada APW / Alkaline Pepton Water, pada media ini nantinya Vibrio cholerae akan tumbuh secara cepat dan terakumulasi di bagian permukaan media setelah diinkubasi selama 3-6 jam. Selanjutnya inokulum diinokulasi pada media TCBS, pada medium ini Vibrio cholerae akan tumbuh sebagai koloni yang berwarna kuning dan memfermentasi sucrose. Selanjutnya dilakukan uji oxydase dan aglutinasi.1,3,5
PENGOBATAN :
Pada dasarnya ada 3 macam cara pengobatan terhadap penderita Cholera yaitu terapi rehidrasi yang agresif, pemberian antibiotika yang tepat serta pengobatan untuk komplikasi bila ada.
Rehidrasi dapat dilakukan per oral maupun intra vena tergantung kebutuhan dan hal ini ditujukan untuk memperbaiki kekurangan cairan dan elektrolit pada penderita. Untuk memperbaiki dehidrasi, acidosis dan hipokalemia pada penderita dengan dehidrasi ringan hingga sedang cukup diberikan larutan rehidrasi secara per oral/oralit yang mengandung glukosa 20g/l atau sukrosa 40g/l atau air tajin 50g/l, NaCl 3½ g/l, KCl 1½ g/l, dan trisodium sitrat dihidrat 2.9 g/l atau NaHCO3 2½g/l. Oralit formula baru yang disahkan WHO Expert Committee pada Juni 2002 mengandung glukosa 75mmol/l, NaCl 75 mmol/l, KCL 20 mmol/l, trisodium sitrat dihidrat 10mmol/l dengan total osmolaritas 245mOsm/l. Cairan ini diberikan lebih dari 4-6 jam agar jumlah cairan yang diberikan dapat mengganti cairan yang diperkirakan hilang yaitu 5% dari Berat Badan untuk dehidrasi ringan dan 7% Berat Badan untuk dehidrasi sedang. Pada penderita dengan kehilangan cairan yang berlangsung terus dapat diberikan cairan rehidrasi per oral selama lebih dari 4 jam sebanyak 1½ kali dari volume cairan diare yang hilang.2
Penderita yang mengalami shock sebaiknya diberikan rehidrasi cepat secara intravena dengan larutan multielektrolit seimbang yang mengandung kira-kira 130mEq/l Na+, 25-48 mEq/l bikarbonat,
5 asetat atau ion laktat, dan 10-15mEq/l K+.
Larutan yang bermanfaat antara lain Ringer’s lactate. Larutan pengobatan diare dari WHO yang terdiri dari 4g NaCl, 1g KCl, 6½g Natrium Asetat dan 8g glukosa/l, atau larutan Dacca yang terdiri dari 5g NaCl, 4g NaHCO3
, dan 1g KCl/l dapat dibuat di tempat pada keadaan darurat.2
Antibiotika yang tepat dapat memperpendek lamanya diare, mengurangi volume larutan rehidrasi dan memperpendek ekskresi bakteri melalui feces. Antibiotika Tetrasiklin 500 mg 4 x per hari pada usia dewasa atau 12,5 mg /kg Berat Badan 4x per hari selama 3 hari . Dengan adanya strain yang resisten maka perlu informasi tentang sensitivitas dari strain local terhadap beberapa antibitiotika terlebih dahulu. Sebagai obat alternatif dapat diberikan Trimethoprim 320mg dan 1600 sulfamethoxazol 2 x per hari untuk dewasa atau Trimethoprim 8mg/kg Berat Badan dan 40mg/kg Berat Badan sehari dibagi dalam 2 dosis untuk anak anak selama 3 hari. Selain itu dapat dipakai Furazolidon, erytromisin atau siprofloksasin.2
PENCEGAHAN:
Secara primer pencegahan terhadap cholera adalah dengan cara perbaikan hygiene pribadi dan masyarakat yang ditunjang dengan penyediaan sistim pembuangan kotoran / feces yang memenuhi syarat serta penyediaan air bersih yang memadai. Penderita harus secepatnya mendapatkan pengobatan dan benda – benda yang tercemar muntahan atau tinja penderita harus didisinfeksi.
Pemberian imunisasi aktif dengan vaksin mati whole cell per enteral kurang bermanfaat untuk penanggulangan wabah ataupun kontak, karena vaksin ini hanya memberikan perlindungan parsial sekitar 50% dalam jangka waktu yang pendek sekitar 3-6 bulan di daerah endemis tinggi dan tidak memberikan perlindungan terhadap infeksi asimptomatik, oleh karena itu pemberian imunisasi ini tidak direkomendasikan. Dua macam vaksin oral yaitu CVD103-HgR atau SSV1 sedang dipertimbangkan untuk digunakan dalam upaya pemberantasan cholera sebagai upaya tambahan terutama dalam situasi darurat
seperti pada bencana alam di kalangan pengungsi. Uji lapangan berskala besar telah dilakukan di Mozambique pada tahun 2003-2004. 2,3
DAFTAR PUSTAKA
1. Brooks GF dkk. 1996. Mikrobiologi Kedokteran.Edisi 20. EGC. hal 256-258
2. Chin J.2006. Manual Pemberantasan Penyakit Menular. Edisi 17. Infomedika. hal 118-129.
3. Greenwood D et al. 2007. Medical Microbiology. 17thEd. Churchill Livingstone. hal 309-312.
4. Harian Analisa. 2010. Angka Resmi Korban Jiwa Kolera di Haiti Naik, Capai 1.721 Orang. 2 /12/ 2010. 5. Joklik WK et al. 1996. Zinsser
Microbiology. 20th Ed. Appleton & Lange. hal 566-570.
6. KOMPAS.com. 2010. Tentara PBB Penyebar Kolera di Haiti ?. 16/11/2010.
7. Liputan6.com. 2010. Protes Wabah Kolera Menyebar ke Port-au-Prince. 20/11/2010.
8. Liputan6.com.2010. Wabah Kolera Serang Anak – anak.28/11/2010. 9. MEDIA INDONESIA.Com. 2010.
Korban Tewas Akibat Kolera di Haiti 1.721 orang. 30/11/2010.
10. Shulman ST dkk. 1994. Dasar Biologis & Klinis Penyakit Infeksi. Edisi 4. Gadjah Mada University Press. hal 17,27,299, 307-311. 11. Tortora GJ et al. 20o9.
Microbiology.10thEd. Pearson International Edition. 716-717.
6
FAKTOR-FAKTOR YANG MEMPENGRUHI KEJADIAN
KECACINGAN YANG DISEBABKAN OLEH SOIL-TRANSMITTED HELMINTH
DI INDONESIA
Bagus Uda Palgunadi
Dosen Fakultas Kedokteran Universitas Wijaya Kusuma Surabaya
Abstrak: Soil –Transmitted Helminth adalah nematoda usus yang di dalam penularannya atau siklus hidupnya melalui tanah. Nematoda usus yang tergolong dalam Soil-Transmitted Helminth adalah cacing gelang Ascaris lumbricoides, cacing cambuk Trichuris trichiura, Strongyloides stercoralis serta Cacing tambang (Necator americanus dan Ancylostoma dudenale). Penyakit kecacingan umumnya masih kurang mendapat perhatian dari masyarakat maupun tenaga kesehatan sebab dipandang tidak menimbulkan wabah maupun kematian. Kejadian penyakit kecacingan khususnya yang disebabkan oleh Soil-Transmitted Heminth di Indonesia masih cukup tinggi. Kondisi lingkungan , sosio-ekonomi , perilaku, usia serta tingkat pendidikan penderita merupakan factor-faktor yang berpengaruh terhadap kejadian infeksi Soil-Transmitted Helminth.
Kata Kunci :Kecacingan, Soil-Transmitted Helminth, Nematoda usus, Ascaris lumbricoides, Cacing tambang, Necator americanus, Ancylostoma duodenale, Trichuris trichiura, Strongyloides stercoralis
FACTORS THAT AFFECT HELMINTHIASIS CASE CAUSED BY
SOIL-TRANSMITTED HELMINTHS IN INDONESIA
Bagus Uda Palgunadi
Lecturer Faculty of Medicine, University of Wijaya Kusuma Surabaya
Abstract :Soil-transmitted helminth is a intestinal nematodes that its infection or its lifecycle is through the soil. Intestinal nematodes that classified as the soil-transmitted helminth is roundworm Ascaris lumbricoides, whipeworm Trichuris trichiura, Stronglyloides stercoralis also hookworm Necator americanus and
Ancylostoma duodenale. Helminthiasis is usually ignored by the society or medics, because it doesn't cause a serious epidemic or deaths. In Indonesia, helminthiasis cases caused by Soil-Transmitted Helminths is still high. These infection cases is affected by some factors such as environmental condition, social-economic, daily habits, age and educational level.
Keywords: Helminthiasis, Soil- Transmitted Helminth, Ascaris lumricoides, Hookworm, Necator americanus, Ancylostoma duodenale, Trichuris trichiura, Strongyloides stercoralis.
PENDAHULUAN:
Penyakit kecacingan masih sering dijumpai di seluruh wilayah Indonesia. Penyakit yang disebabkan oleh infeksi cacing ini tergolong penyakit yang kurang mendapat perhatian, sebab masih sering dianggap sebagai penyakit yang tidak menimbulkan wabah maupun kematian. Walaupun demikian, penyakit kecacingan sebenarnya cukup membuat penderitanya mengalami kerugian, sebab secara perlahan adanya infestasi cacing di dalam tubuh penderita akan menyebabkan gangguan pada kesehatan mulai yang ringan, sedang sampai berat yang ditunjukkan sebagai manifestasi klinis diantaranya berkurangnya nafsu makan, rasa tidak enak di perut, gatal – gatal, alergi, anemia, kekurangan gizi , pneumonitis, syndrome Loeffler dan lain – lain.
Terjadinya penyakit kecacingan seringkali dihubungkan dengan kondisi lingkungan penderita , sosio-ekonomi penderita serta tingkat pendidikan penderita.
Salah satu penyakit kecacingan yang masih banyak terjadi pada penduduk di Indonesia adalah yang disebabkan golongan Soil-Transmitted Helminth yaitu golongan nematode usus yang dalam penularannya atau dalam siklus hidupnya melalui media tanah. Dalam hal ini berarti bahwa proses pematangan parasit dari bentuk non infektif menjadi bentuk yang infektif terjadi di tanah. Menurut Faust , Soil-Transmitted helminth adalah nematoda usus yang perkembangan embrionya pada tanah. (Faust EC et al,1976)
Cacing yang tergolong dalam Soil-Transmitted Helminth adalah Ascaris lumbricoides, Trichuris trichiura,
7 Strongyloides stercoralis serta cacing
tambang yaitu Necator americanus dan Ancylostoma duodenale. Di Indonesia infeksi oleh Soil-Transmitted Helminth ini paling banyak disebabkan oleh Ascaris lumbricoides, Trichuris trichiura , Necator americanus.
Masalah penyakit kecacingan di Indonesia sangat erat kaitannya dengan iklim dan kebersihan diri perorangan, rumah maupun lingkungan sekitarnya serta kepadatan penduduk yang tinggi. Pada saat musim hujan, udara yang lembab, rumah yang berlantai tanah, pengetahuan sanitasi kesehatan yang rendah merupakan faktor penyebab tingginya kejadian penyakit kecacingan.
Cara yang paling tepat untuk menanggulangi dan memberantas parasit adalah dengan cara memutus lingkaran hidup cacing, pengobatan masal secara periodik, perbaikan kesehatan lingkungan, penyuluhan kesehatan masyarakat dan menghindarkan pencemaran tanah oleh feces penderita. ETIOLOGI
Penyakit kecacingan pada usus manusia sering disebut sebagai cacing usus, sebagian besar penularan cacing usus ini terjadi melalui tanah. Oleh karena itu digolongkan dalam kelompok cacing yang ditularkan melalui tanah atau Soil-Transmitted Helminths. Yang termasuk dalam kelompok Soil-Transmitted Helminth adalah nematoda usus Ascaris lumbricoides, Trichuris trichiura, Strongyloides stercoralis dan Cacing tambang (Ancylostoma duodenale dan Necator americanus)
Ascaris lumbricoides:
Di Indonesia cacing ini dikenal sebagai cacing gelang. Predileksi cacing dewasanya terdapat di dalam lumen usus halus manusia, tetapi kadang-kadang dijumpai mengembara ke bagian usus lainnya. Penularan dapat terjadi melalui beberapa cara , yaitu masuknya telur infektif melalui makanan dan minuman yang tercemar dan melalui tangan yang kotor atau terhirup bersama debu udara yang tercemar telur infektifnya.
Bila telur infektif yang berukuran 75 x 40-50 mikron tertelan oleh manusia, maka di bagian atas dari usus halus, dinding telur akan pecah dan larva akan keluar dari telur. Kemudian larva akan menembus dinding usus halus, mamasuki vena porta dan
bersama aliran darah menuju jantung kanan untuk selanjutnya menuju sirkulasi paru. Di dalam paru-paru larva tumbuh dan berganti kulit sebanyak 2 kali, kemudian menembus dinding kapiler menuju alveoli. Dari alveoli larva menuju bronchi, trachea, larynx, pharynx kemudian dibatukkan dan tertelan masuk ke oesophagus, selanjutnya turun ke lambung dan akhirnya menjadi dewasa di usus halus. Cacing dewasa betina berukuran 22 – 35 cm dan lebih besar dibandingkan cacing jantan yang berukuran 10 – 31cm.(Neva A and Brown HW, 1994 ; Markell EK et al, 1992 ; Soedarto, 2008)
Ancylostoma duodenale dan Necator
americanus :
Cacing ini dikenal dengan nama cacing tambang. Predileksi cacing dewasanya di mucosa usus halus, terutama di mucosa duodenum dan jejenum manusia. Kedua species cacing ini melekatkan diri pada membrane mucosa usus halus dengan menggunakan gigi kitin atau gigi pemotong dan menghisap darah dari luka gigitannya. (Neva A and Brown HW.1994 ; Markell EK et al, 1992)
Manusia merupakan hospes satu-satunya bagi kedua cacing ini. Telur kedua species cacing ini sulit dibedakan satu dengan yang lain, perbedaan hanya sedikit dalam hal ukurannya, yaitu Necator americanus berukuran 64 x 36 mikron, sedangkan Ancylostoma duodenale berukuran 56 x 36 mikron. Telur ini keluar bersama feses penderita, setelah 1-2 hari akan menetas menjadi larva rabditiform. Setelah mengalami pergantian kulit 2 kali, larva rabditiform berubah menjadi larva filariform dengan ukuran 500 – 700 mikron, larva filariform ini adalah larva infektif untuk manusia. Larva infektif masuk ke dalam hospes melalui folikel rambut, pori-pori atau melalui kulit yang utuh. Kemudian larva masuk ke dalam saluran limfe atau vena kecil, masuk kealiran darah menuju jantung dan paru, menembus kapiler masuk ke alveoli. Selanjutnya larva mengadakan migrasi ke bronchi, trachea, larynx, pharynx dan akhirnya tertelan masuk oesophagus. Di oesophagus terjadi pergantian kulit yang ketiga kalinya dan mulai terbentuk rongga mulut sementara yang memungkinkan larva ini mengambil makanan. Dari oesophagus larva mencapai usus halus dan berganti kulit untuk yang keempat kalinya, kemudian
8 tumbuh menjadi cacing dewasa yang
berukuran panjang 9-13mm untuk betina dan 5-11mm untuk jantan dengan bursa copulatrix di ujung posteriornya . (Neva A, 1994 ; Markell EK, 1992 ; Soedarto, 2008).
Trichuris trichiura:
Cacing ini disebut juga sebagai cacing cambuk yang mempunyai ciri-ciri berupa, bagian anterior seperti cambuk dan agak meruncing, 3/5 bagian tubuhnya dilalui oesophagus yang sempit. Bagian posterior lebih tebal, 2/5 bagian dari tubuhnya berisi usus dan organ reproduksi. Cacing jantang berukuran 30 – 45 mm, sedangkan cacing betina berukuran 35 – 50 mm. bagian posterior cacing jantan berbentuk melingkar dengan satu spikulum dan sarung yang retraktil, sedangkan bagian posterior cacing betina berbemtuk bulat dan tumpul. Predileksi cacing ini pada mucosa cecum manusia. ( Neva A and Brown HW, 1994)
Telurnya berukuran 50 x 23 mikron dan berbentuk seperti tempayan dengan 2 kutub yang jernih dan menonjol serta kulit luarnya berwarna kekuning-kuningan. Manusia tertular karena tertelannya telur infektif dari cacing ini. Di dalam usus, dinding telur akan pecah dan larva cacing keluar menuju bagian proksimal dari usus halus, kemudian larva menembus vili-vili usus halus dan menetap selama 3-10 hari. Selanjutnya larva turun ke bawah menuju cecum dan menjadi dewasa di sana. ( Neva A and Brown HW, 1994 : Markell EK et al, 1992 ; Soedarto, 2008)
Strongyloides stercoralis
Cacing ini disebut juga dengan cacing benang. Predileksi cacing dewasanya pada mucosa usus halus terutama duodenum dan jejunum manusia. Cacing dewasa betina mempunyai ukuran 2 x 0,04 mm, tidak berwarna dan berbentuk seperti benang halus. Cacing ini mempunyai ruang mulut dan oesophagus yang panjang.
Telur cacing ini berukuran 54 x 32 mikron, berbentuk lonjong mirip cacing tambang, mempunyai dinding tipis dan transparan. Telur diletakkan di dalam mucosa usus, kemudian menetas menjadi larva rabditiform yang mempunyai ukuran 200 – 250 mikron. Kemudian larva rabditiform menembus sel epithel dan masuk ke dalam lumen usus. Terdapat 3 kemungkinan yang dapat terjadi selanjutnya yaitu :
Pertama yang disebut sebagai autoinfeksi yaitu larva rabditiform dalam usus halus berubah menjadi larva filariform. Larva filariform ini kemudian menembus mukosa usus masuk ke dalam peredaran darah vena menuju jantung kanan sampai ke paru-paru, menembus kapiler menuju alveoli, kemudian migrasi ke bronchi, larynx, pharynx dan tertelan masuk oesophagus menuju usus halus dan menjadi dewasa. Kemungkinan kedua, yaitu larva rabditiform keluar bersama feses penderita. Di tanah, larva rabditiform setelah 2-3 hari berubah menjadi larva filariform yang merupakan larva infektif. Manusia tertular akibat masuknya larva infektif melalui kulit, masuk ke dalam peredaran vena menuju jantung kanan sampai ke paru-paru, kemudian menembus kapiler menuju alveoli, dan mengalami migrasi ke bronchus, larynx, pharynx , tertelan masuk oesophagus menuju usus halus dan menjadi dewasa. Kemungkinan ke tiga yaitu larva rabditiform keluar bersama feses penderita, ditanah berubah menjadi larva filariform kemudian berubah menjadi cacing dewasa jantan dan betina yang hidup bebas. Setelah kopulasi, cacing betina yang hidup bebas menghasilkan telur yang kemudian menetas menjadi larva rabditiform dan selanjutnya menjadi larva filariform yang infektif. Kemudian larva filariform akan menembus kulit hospes dan sesudah melalui tahap migrasi paru larva akan menjadi dewasa dalam usus halus. ( Neva A and Brown HW, 1994 ; Markell et al, 1992; Soedarto, 2008).
EPIDEMIOLOGI
Infeksi oleh nematode usus biasanya berkaitan dengan jeleknya hygiene. Infeksi ini selalu ada terutama di daerah tropis dan subtropis. Serangan cacing dalam jumlah sedikit biasanya asimptomatis tetapi infeksi yang berat dapat menimbulkan masalah yang serius terutama pada anak – anak yang biasanya diikuti oleh terhambatnya perkembangan anak. ( Greenwood D, 2007 ; Brooks GF,2006)
Ascariasis merupakan penyakit endemic di daerah tropis dan subtropis tetapi secara sporadis dapat terjadi di seluruh dunia. Penduduk pedesaan dengan kondisi sanitasi yang buruk mempunyai resiko yang tinggi terhadap infeksi cacing ini. Orang dewasa biasa terinfeksi karena makan sayur mentah yang terkontaminasi oleh telur cacing ini baik
9 dari feces penderita maupun dari tanah yang
tercemar feces penderita, sedangkan pada anak – anak biasa terinfeksi dengan jalan tangan ke mulut ( hand to mouth) atau karena kebiasaan mengulum benda – benda atau mainan yang terkontaminasi telur cacing ini. Pemakaian sepatu dan sistim pembuangan feces yang memenuhi syarat menurunkan tingkat infeksi cacing tambang. ( Joklik WK,1992)
Menurut WHO (1985) yang dikutip oleh Onggowaluyo, infeksi parasit yang penting di dunia ada sepuluh yaitu
Ascarislumbricoides, hookworm,
Plasmodium, Trichuris trichiura, Amoeba, Filaria, Schistosoma sp., Giardia lamblia, Trypanosoma sp dan Leishmania sp. Dgn jumlah penderita cacing tambang 700.000.000, schistosomiasis 180.000.000, semua parasit usus 1.800.000.000 serta malaria 25.000.000. (Onggowaluyo JS, 2001) Di Indonesia angka nasional prevalensi kecacingan pada tahun 1987 sebesar 78,6%. Data prevalensi penyakit kecacingan di Indonesia pada tahun 2002 sampai 2006 secara berurutan adalah sebesar 33,3% ; 33,0% ; 46,8% ; 28,4% dan 32,6%, sedangkan prevalensi infeksi cacing tambang secara berturutan pada tahun 2002 – 2006 sebesar 2,4% ; 0,6% ; 5,1% ; 1,6% dan 1,0%. ( Depkes RI, 2006)
Kejadian infeksi kecacingan pada anak berhubungan negatif signifikan dengan perilaku sehat, dengan demikian berarti bahwa pengertian berperilaku hidup sehat akan menurunkan insidensi kecacingan pada anak.(Aria G, 2004)
Ascaris lumbricoides merupakan parasit yang penting baik di daerah iklim dingin maupun iklim panas, tetapi cacing ini lebih umum ditemukan di daerah beriklim panas dengan kelembaban yang tinggi dan paling banyak ditemukan di tempat-tempat dengan sanitasi yang jelek. Ascariasis ditemukan pada semua umur, tetapi lebih sering ditemukan pada anak-anak usia 5 samapi 10 tahun. Di Indonesia kejadian ascariasis frekuensinya antara 60 % sampai 80 %. (Onggowaluyo JS, 2001)
Insiden kecacingan akibat cacing tambang cukup tinggi di Indonesia, kasus penyakit ini banyak ditemukan di daerah pedesaan, khususnya pada pekerja di daerah perkebunan yang kontak langsung dengan tanah. Penyebaran infeksi cacing tambang ini
berhubungan erat dengan kebiasaan Buang Air Besar di tanah. Kondisi tanah yang gembur , berpasir dan temperature sekitar 23 - 32°C merupakan tempat yang paling sesuai untuk pertumbuhan larvanya. (Onggowaluyo JS, 2001)
Daerah penyebaran dari Trichuris trichiura, sama dengan Ascaris lumbricoides, sehingga kedua cacing ini sering di temukan bersama-sama dalam 1 hospes. Di Indonesia, Frekuensinya tinggi, terutama didaearah-daerah pedesaan, antara 30% - 90%. Terutama ditemukan pada anak-anak. Faktor terpenting dalam penyebaran trichuriasis adalah kontaminasi tanah oleh feses penderita, yang akan berkembang dengan baik pada tanah liat, lembab dan teduh. (Onggowaluyo JS, 2001)
PATOGENESA DAN MANIFESTASI KLINIS
Gejala klinik pada ascariasis dapat ditimbulkan oleh cacing dewasa maupun larva, cacing dewasa tinggal diantara lipatan mukosa usus halus dan dapat menimbulkan iritasi sehingga dapat menimbulkan rasa tidak enak di perut, mual serta sakit perut yang tidak nyata. Kadang-kadang cacing dewasa terbawa kearah mulut karena regurgitasi dan dimuntahkan, sehingga keluar melalui mulut atau hidung. Atau dapat masuk ke tuba eustachii. Dinding usus dapat ditembus oleh cacing dewasa sehingga menyebabkan peritonitis. Cacing dalam jumlah yang banyak akan menyebabkan sumbatan pada lumen usus serta toxin yang dihasilkannya akan menimbulkan manifestasi keracunan misalnya, oedema muka, uticaria dan nafsu makan menurun. Migrasi larva ke paru dapat menimbulkan eosinofili dan alergi berupa urticaria, gejala infiltrasi paru, sembab pada bibir serta sindroma Lofflers. Larva yang migrasi ke organ lain dapat menimbulkan endophthalmitis, meningitis dan encephalitis. Pada anak-anak sering kali terlihat gejala perut buncit, pucat , lesu, rambut jarang dan berwarna merah serta kurus akibat defisiensi gizi dan anemia. (Joklik WK, 1992 ; Natadisastra D dan Agoes R, 2009 ; Neva A and Brown HW, 1994)
Gejala infeksi cacing tambang dapat disebabkan oleh larva maupun cacing dewasa. Pada saat larva menembus kulit terbentuk maculopapula dan erithema yang sering disertai rasa gatal (ground itch).
10 Migrasi larva ke paru dapat menimbulkan
bronchitis atau pneumonitis. Cacing dewasa yang melekat dan melukai mukosa usus akan menimbulkan perasaan tidak enak di perut, mual dan diare. Seekor cacing dewasa mengisap darah 0,2 – 0,3 ml/hari, sehinnga dapat menimbulkan anemia progresif, hypokromik, mikrositer, type efisiensi besi. Biasanya gejala klinik timbul setelah tampak adanya anemi, pada infeksi berat, haemoglobin dapat turun hingga 2 gr %, sesak nafas, lemah dan pusing kepala. Kelemahan jantung dapat terjadi karena perubahan pada jantung yang berupa hypertropi, bising katub serta nadi cepat. Infeksi pada anak dapat
Menimbulkan keterbelakangan fisik dan mental. Infeksi Ancylostoma duodenale lebih berat dari pada infeksi oleh Necator americanus. (Joklik WK, 1992 ; Natadisastra D dan Agoes R, 2009 ; Neva A and Brown HW, 1994)
Strongylidiasis ringan biasanya tidak menimbulkan gejala, pada infeksi sedang cacing dewasa betina yang bersarang dalam mukosa duodenum menyebabkan perasaan terbakar, menusuk-nusuk di daerah epigastrium, disertai rasa mual , muntah, diare bergantian dengan konstipasi. Pada infeksi berat dan kronis mengakibatkan berat badan turun, anemi, disentri menahun serta demam ringan yang disebabkan infeksi bakteri sekunder pada lesi usus. Kematian dapat terjadi akibat bersarangnya cacing betina di hampir seluruh epithel usus, meliputi daerah lambung sampai ke daerah colon bagian distal yang disertai infeksi sekunder bakteri. (Natadisastra D dan Agoes R, 2009)
Autoinfeksi mungkin merupakan mekanisme dari terjadinya infeksi jangka panjang yang menetap dan bertahun-tahun. Parasit dan hospesnyan berada dalam status keseimbangan sehingga tidak terjadi kerusakan yang berarti. Jika oleh karena sesuatu hal, keseimbangan ini terganggu dan keadaan imunitas penderita menurun, maka infeksinya akan meluas dan meningkatkan produksi larva dan larvanya dapat ditemukan pada setiap jaringan tubuh. Keadaan ini disebut dengan sindroma hiperinfeksi. (Gracia, 1977)
Trichuriasis paling sering menyerang anak usia 1 – 5 tahun, infeksi ringan biasanya tanpa gejala. Pada infeksi berat, cacing
tersebar ke seluruh colon dan rectum kadang-kadang terlihat pada mucosa rectum yang prolaps. Infeksi kronis dan sangat berat menunjukkan gejala-gejala anemia berat, Hb rendah sekali dapat mencapai 3 gr%, karena seekor cacing setiap hari menghisap darah 0,005 cc, diare dengan feses sedikit dan mengandung sedikit darah, sakit perut, mual, muntah serta berat badan menurun, kadang-kadang disertai prolapsus recti. (Joklik WK, 1992 ; Natadisastra D dan Agoes R, 2009 ; Neva A and Brown HW, 1994)
FAKTOR-FAKTOR YANG MEMPENGARUHI :
Sampai saat ini kejadian penyakit kecacingan akibat infeksi nematode usus golongan Soil-Transmitted helminth masih cukup tinggi. Hal ini dapat terjadi karena berbagai faktor yang menunjang.
Perilaku Buang Air Besar tidak pada jamban menyebabkan terjadinya pencemaran tanah oleh telur cacing cacing tambang sehingga meningkatkan resiko terinfeksi terutama pada orang atau anak – anak yang tidak memakai alas kaki. Hasil penelitian menunjukkan bahwa anak yang tinggal pada lingkungan rumah dengan tanah halaman terkontaminasi telur cacing tambang memiliki resiko terinfeksi larva cacing tambang sebesar 13,0 kali lebih besar dibanding anak yang tinggal pada lingkungan rumah tanpa kontaminasi telur cacing tambang. (Sumanto D,2010)
Menurut penelitian yang pernah dilakukan oleh penulis didapatkan taksiran tingkat prevalensi infeksi cacing usus yang ditularkan melalui tanah di LPA Lakarsantri Surabaya sebesar 83,3%. Tingginya angka infeksi ini menunjukkan bahwa terdapat factor-faktor yang sangat menunjang, salah satunya adalah pencemaran tanah oleh telu atau larva cacing golongan soil-transmitted helminth. Dari hasil penelitian diketahui bahwa taksiran tingkat prevalensi pencemaran tanah adalah sebesar 93,3%. Hali ini menunjukkan refleksi dari perilaku buang air besar disembarang tempat yang ternyata sesuai dengan pengamatan dan hasil wawancara dilapangan bahwa dari 90 responden yang merupakan pemukim di LPA, 100% melakukan buang air besar dihalaman tempat tinggalnya atau lahan LPA. (Palgunadi BU, 1998)
11 Anak yang tinggal dalam keluarga
yang memiliki kebiasaan defekasi di kebun dan tempat lain halaman rumah, beresiko terinfeksi cacing tambang 4,3 kali lebih besar disbanding anak yang tinggal dengan keluarga yang memiliki kebiasaan defekasi di jamban. (Sumanto D, 2010)
Sanitasi rumah merupakan faktor resiko kejadian infeksi cacing tambang, anak yang tinggal dalam rumah dengan sanitasi yang buruk beresiko sebesar 3,5 kali lebih besar terinfeksi cacing tambang dibandingkan dengan anak yang tinggal dalam rumah dengan sanitasi yang baik. (Sumanto D, 2010)
Hasil penelitian terhadap pemukim di LPA menunjukkan terjadi infeksi cacing tambang sebesar 70%. Tingginya angka tersebut kemungkinan disebabkan oleh prilaku seringkali tidak memakai alas kaki. Hal ini terbukti dari hasil pengamatan dan wawancara di lapangan terhadap 90 responden, 76,7% mempunyai prilaku seringkali tidak memakai alas kaki. (Palgunadi BU, 1998)
Anak yang mempunyai kebiasaan tidak memakai alas kaki beresiko terinfeksi cacing tambang 3,29 kali lebih besar dibanding anak yang mempunyai kebiasan memakai alas kaki dalam aktifitasnya sehari-hari.(Sumanto D, 2010)
Anak yang mepunyai kebiasaan bermain dalam waktu yang lama di tanah, beresiko terinfeksi cacing tambang 5,2 kali lebih besar disbanding anak yang hanya sebentar bermain di tanah dalam sehari. (Sumanto D, 2010)
Penelitian yang dilakukan terhadap pemukim di LPA Lakarsantri Surabaya menunjukkan taksiran tingkat prevalensi ascariasis dan trichuriasis masing-masing sebesar 33,3% dan 8,8% relative lebih rendah dibandingkan dengan infeksi cacing tambang sebesar 70 %, hal ini disebabkan karena dari 90 responden pemukim LPA sebanyak 64,4% mempunyai kebiasaan mencuci tangan sebelum makan dan 86,7%
tidak menyukai makan sayur mentah. (Palgunadi BU, 1998)
Faktor iklim misalnya temperatur, kelembaban, curah hujan, mungkin merupakan faktor penting prevalensi infeksi Soil-Transmitted Helminth di Bali. Tingkat pendidikan yang rendah, hygiene pribadi dan lingkungan yang buruk , sosio ekonomi yang
rendah dan perilaku juga merupakan faktor lain yang berpengaruh. (Wijana DP and Sitisna P, 2000)
Di Negara kaya dan maju banyak penyakit parasit yang dapat diberantas, sebaliknya pada Negara miskin dan terbelakang memperlihatkan prevalensi parasit yang lebih tinggi. (Onggowaluyo JS,2001)
KESIMPULAN
Dari kajian diatas, faktor-faktor yang dapat mempengaruhi kejadian infeksi oleh cacing Soil-Transmitted Helminth di Indonesia adalah :
1. Faktor iklim : Indonesia merupakan daerah beriklim tropis dengan kelembaban yang tinggi serta suhu yang menunjang perkembangan biakan larva maupun telur cacing. 2. Tingkat pendidikan : Penduduk
Indonesia sebagian besar masih tinggal di desa-desa dengan tingkat pendidikan yang rendah, sehingga pengertian terhadap kebersian pribadi dan kesehatan pribadi serta lingkungan sangatlah rendah, misalnya kebiasaan buang besar di sembarang tempat (ditanah), tidak menggunakan alas kaki dalam kegiatan sehari-hari di luar rumah dan sering sekali tidak mencuci tangan sebelum makan.
3. Sosio-ekonomi : sebagian besar masyarakat Indonesia, berpenghasilan rendah, hal ini menyebabkan ketidak mampuan masyarakat untuk menyediakan sanitasi perorangan maupun lingkungan.
DAFTAR PUSTAKA
Aria G, 2004. Hubungan Perilaku Sehat dan Sanitasi Lingkungan dengan Infeksi Cacing yang Ditularkan Melalui Tanah di Nagari Kumanis Kabupaten Sawahlunto Sijunjung.UGM.
Brooks GF dkk. 1996. Mikrobiologi Kedoktran. Edisi 20. EGC. Hal. 670-678. Departemen Kesehatan RI. 2006. Profil Kesehatan Indonesia.
12 Elmi, dkk. 2004. Status Gizi dan Infestasi
Cacing Usus pada Anak Sekolah Dasar. Bagian Ilmu Kesehatan Anak FK Universitas Sumatera Utara.
Faust Ec et al.1976. Craig and Faust Clinical Parasitology.9thedition. Philadelphia.Lea & Febiger.
Garcia LS and Bruckner DA. 1997. Diagnostic Medical Parasitology. 3rd edition. ASM Press.
Ginting SA. 2003. Hubungan Antara Status Sosial Ekonomi dengan Kejadian Kecacingan Pada anak Sekolah Dasar di Desa Suka Kecamatan Tiga Panah Kabupaten Karo Sumatera Utara. USU Digital Library.
Greenwood D et al. 2007. Medical Microbiology. 17th edition. Churchill Livingstone. pp. 634-636.
Joklik WK et al. 1992. Zinsser Microbiology. 20th edition. Appleton and Lange. pp. 1186-1202.
Markell EK et al. 1992. Medical Parasitologi. 7th edition. W.B. Saunders Company. pp. 261-286.
Natadisastra D dan Agoes R. 2009. Parasit Kedokteran di Tinjau dari Organ Tubung yang Diserang. EGC. Hal. 69-86.
Neva A and Brown HW. 1994. Basic Clinical Parasitology. 6 th edition. Prentice-Hall Intenational Inc. pp. 113-151.
Onggowaluyo JS. 2001. Parasitologi Medik I (Helmintologi) : Pendekatan Aspek Indentifikasi, Diagnosis dan Klinik. EGC. Hal. 11-31.
Palgunadi BU. 1998. Pencemaran Tanah Oleh Telur Cacing Usus Dalam Hubungannya dengan Kejadian Infeksi Cacing Usus. Tesis. Program Pasca Sarjana Unuversitas Airlangga.
Soedarto. 2008. Parasitologi Klinik. Airlangga University Press. Hal. 71-96. Sumanto D. 2010. Faktor Risiko Infeksi Cacing Tambang pada Anak Sekolah (Studi
Kasus Kontrol di Desa Rejosari, Karangawen, Demak. Tesis.Program Studi Magister Epidemiologi Pasca Sarjana Universitas Diponegoro.
Widjana DP and Sutisna P. 2000. Prevalence Of Soil-Transmtted Helminth Infection In The Rural Pupulation Of Bali, Indonesia. Southeast Asian J Trop Med Public Health vol. 31 No. 3 September 2000.
13
PATOGENESIS INFEKSI VIRUS DENGUE
oleh
Evisina Hanafiati Frans
Dosen Fakultas Kedokteran Universitas Wijaya Kusuma Surabaya
Email:evisinafrans@yahoo.com
ABSTRAK
Demam Dengue adalah penyakit disebabkan virus yang ditularkan oleh nyamuk.Penyakit ini menjadi endemik dan berpotensi menyebar ke seluruh dunia termasuk di Indonesia. Dengue virus sebagai penyebab infeksi virus dengue memiliki variasi tampilan klinis mulai dari demam ringan (demam dengue) hingga manifestasi perdarahan yang fatal, hingga sindroma shock dengue (DSS). Pemahaman mengenai patogenesis virus dihalangi oleh terbatasnya model in vitro dan in vivo. Terdapat beberapa teori yang didukung oleh data epidemiologik dan laboratoris, namun teori tersebut tidaklah bersifat eksklusif.
Kata kunci: Dengue, patogenesis, infeksi heterolog sekunder, antibodi perangkat tambahan tergantung, virulensi virus, mediator
PATHOGENESIS OF DENGUE VIRUS INFECTION
by
Evisina Hanafiati Frans
Lecturer Faculty of Medicine, University of Wijaya Kusuma Surabaya
Email: evisinafrans@yahoo.com
ABSTRACT
Dengue is the most widespread mosquito-borne human viral disease. The disease is now an endemic and make potentially outbreaks in all around the world, included in Indonesia. Dengue viruses cause Dengue infection, which ranges from mild febrile illness (Dengue Fever, DF) to fatal hemorrhagic manifestation (Dengue Hemorrhagic Fever, DHF), leading to shock syndrome (Dengue Shock Syndrome, DSS). The understanding of dengue virus pathogenesis has been hamppered by the lack of in vitro and in vivo models of disease.There are several theories that are supported by epidemiological and laboratory evidence, but are not mutually exclusive. Secondary heterologous infection theory, antibody dependent enhancement theory, virus virulence theory and mediator theory are frequently cited to explain the basis of DHF/DSS.
Keywords: Dengue, pathogenesis, Secondary heterologous infection, antibody dependent enhancement, virus virulence, mediator
PENDAHULUAN
Indonesia merupakan negara endemi Dengue dengan kasus tertinggi di Asia Tenggara. Pada 2006 Indonesia melaporkan 57% dari kasus Dengue dan hampir 80% kematian dengue dalam daerah Asia Tenggara (1132 kematian dari jumlah 1558 kematian dalam wilayah regional). Di Indonesia infeksi virus Dengue selalu dijumpai sepanjang tahun di beberapa kota besar di Indonesia, seperti Jakarta, Surabaya, Medan dan Bandung. Perbedaan pola klinis kejadian infeksi Dengue ditemukan setiap tahun. Perubahan musim secara global, pola perilaku hidup bersih dan dinamika populasi masyarakat (adanya perang dunia, perkembangan kota yang pesat setelah perang dan dan mudahnya transportasi) berpengaruh terhadap kejadian penyakit infeksi virus Dengue.
World Health Organization memperkirakan terjadi 50 juta kasus infeksi Dengue di seluruh dunia setiap tahun. Di Indonesia kasus pertama dengan pemeriksaan serologis dibuktikan pada tahun 1969 di Surabaya. Angka kematian karena infeksi virus Dengue menurun secara drastis dari 41,3% ditahun 1968 menjadi kurang dari 3% ditahun 1991, namun Sindroma Syok Dengue masih merupakan kegawatan yang sulit diatasi. Morbiditas dan mortalitas karena DBD/DSS yang dilaporkan berbagai negara bervariasi disebabkan beberapa faktor, antara lain status umur penduduk, kepadatan vektor, tingkat penyebaran virus dengue, prevalensi serotipe virus dengue dan keadaan meteorologis.
Infeksi virus dengue pada manusia mengakibatkan spektrum manifestasi klinis yang bervariasi mulai dari tanpa gejala
14 (asimtomatik), demam ringan yang tidak
spesifik (mild undifferentiated febrile illness), demam dengue, demam berdarah dengue (DBD), dan dengue shock syndrome.
Terdapat berbagai teori yang terkait dengan patofisiologi infeksi virus Dengue seperti hipotesis (ADE), teori virulensi virus yang mendasarkan pola perbedaan serotipe virus dengue 1, 2, 3, dan Den-4. Teori antigen-antibodi, yang mendasarkan kenyataan bahwa pada penderita DBD terjadi penurunan aktifitas sistem komplemen yang ditandai dengan penurunan dari kadar C3,C4,dan C5.Teori mediator, dimana makrofag yang terinfeksi virus Dengue akan melepaskan mediator-mediator seperti interferon, IL-1, IL-6, IL-12, TNF dan lain-lain. Diperkirakan berbagai mediator tersebut bertanggung jawab atas terjadinya syok septik, demam dan peningkatan permeabilitas kapiler. Teori Th1/Th2 pada infeksi memperkirakan adanya faktor genetik merupakan perkembangan teori yang menarik.
Tetapi berbagai teori tersebut masih belum mampu menjelaskan imunopatogenesis infeksi virus Dengue ataupun membedakan dengan jelas kelompok klinis mana yang akan terjadi pada penderita, Demam Dengue, atau Demam Berdarah Dengue atau bahkan yang lebih fatal yaitu Sindroma Syok Dengue. Ini disebabkan kurangnya model invitro dan invivo penyakit infeksi virus dengue.
ETIOLOGI: VIRUS DENGUE
Virus Dengue termasuk dalam kelompok B arthropode-borne virus (arbovirus) dan sekarang dikenal dengan genus flavivirus, famili Flaviviridae. Di Indonesia sekarang telah dapat diisolasi 4 serotipe yang berbeda namun memiliki hubungan genetik satu dengan yang lain, yaitu DEN-1, DEN-2, DEN-3 dan DEN-4. Ternyata DEN-2 dan DEN-3 merupakan serotipe yang paling banyak sebagai penyebab. Nimmanitya (1975) di Thailand melaporkan bahwa serotipe DEN-2 yang dominan.sedangkan di Indonesia paling banyak adalah DEN-3, walaupun akhir-akhir ini ada kecenderungan didominasi oleh virus DEN-2.
Penelitian epidemiologik yang dilakukan oleh Aryati 2005, Fedik 2007 menemukan bahwa virus Den-2 adalah
serotipe yang dominan di Surabaya. Studi epidemiologi (Yamanaka et al) tahun 2009 dan 2010 pada penderita Demam Dengue (DD) dan Demam Berdarah Dengue (DBD) ditemukan virus D1 genotype IV yang menunjukkan manifestasi klinik yang berat
Infeksi dengan salah satu serotipe akan menimbulkan antibodi seumur hidup terhadap serotipe yang bersangkutan tetapi tidak ada perlindungan terhadap serotipe yang lain. Disamping itu urutan infeksi serotipe merupakan suatu faktor risiko karena lebih dari 20% urutan infeksi virus DEN-1 yang disusul DEN-2 mengakibatkan renjatan, sedangkan faktor risiko terjadinya renjatan untuk urutan virus DEN-3 yang diikuti oleh DEN-2 adalah 2%.
Virus Dengue seperti famili Flavivirus lainnya memiliki satu untaian genom RNA (single-stranded positive-sense genome) disusun didalam satu unit protein yang dikelilingi diding icosahedral yang tertutup oleh selubung lemak.Genome virus Dengue terdiri dari 11-kb + RNA yang berkode dan terdiri dari 3 stuktur Capsid (C) Membran (M) Envelope (E) protein dan 7 protein non struktural (NS1, NS2A, NS2B, NS3, NS4, NS4B, dan NS5).
Di dalam tubuh manusia, virus bekembangbiak dalam sistem retikuloendothelial dengan target utama adalah APC (Antigen Presenting Cells) dimana pada umumnya berupa monosit atau makrofag jaringan seperti sel Kupfer di sinusoid hepar.
VEKTOR PENULARAN VIRUS
DENGUE
Virus-virus Dengue ditularkan oleh nyamuk-nyamuk dari famili Stegomya, yaitu Aedes aegypti, Aedes albopticus, Aedes scuttelaris, Aedes polynesiensis dan Aedes niveus. Di Indonesia Aedes aegypti dan Aedes albopticus merupakan vektor utama. Keempat virus telah ditemukan dari Aedes aegypti yang terinfeksi. Spesies ini dapat berperan sebagai tempat penyimpanan dan replikasi virus.
PATOFISIOLOGI DEMAM DENGUE Perbedaan klinis antara Demam Dengue dan Demam Berdarah Dengue disebabkan oleh mekanisme patofisiologi yang berbeda. Adanya renjatan pada Demam Berdarah Dengue disebabkan karena
15 kebocoran plasma (plasma leakage) yang
diduga karena proses imunologi. Hal ini tidak didapati pada Demam Dengue.
Virus Dengue yang masuk kedalam tubuh akan beredar dalam sirkulasi darah dan akan ditangkap oleh makrofag (Antigen Presenting Cell). Viremia akan terjadi sejak 2 hari sebelum timbul gejala hingga setelah lima hari terjadinya demam.
Antigen yang menempel pada makrofag akan mengaktifasi sel T- Helper dan menarik makrofag lainnya untuk menangkap lebih banyak virus. Sedangkan sel Helper akan mengaktifasi sel T-Sitotoksik yang akan melisis makrofag. Telah dikenali tiga jenis antibodi yaitu antibodi netralisasi, antibodi hemagglutinasi, antibodi fiksasi komplemen.
Proses ini akan diikuti dengan dilepaskannya mediator-mediator yang merangsang terjadinya gejala sistemik seperti demam, nyeri sendi, nyeri otot, dan gejala lainnya. Juga bisa terjadi aggregasi trombosit yang menyebabkan trombositopenia ringan.
Demam tinggi (hiperthermia) merupakan manifestasi klinik yang utama pada penderita infeksi virus dengue sebagai respon fisiologis terhadap mediator yang muncul.
Sel penjamu yang muncul dan beredar dalam sirkulasi merangsang terjadinya panas. Faktor panas yang dimunculkan adalah jenis-jenis sitokin yang memicu panas seperti TNF-α, IL-1, IL-6, dan sebaliknya sitokon yang meredam panas adalah TGF-β, dan IL-10.
Beredarnya virus di dalam plasma bisa merupakan partikel virus yang bebas atau berada dalam sel platelet, limfosit, monosit, tetapi tidak di dalam eritrosit. Banyaknya partikel virus yang merupakan kompleks imun yang terkait dengan sel ini menyebabkan viremia pada infeksi virus Dengue sukar dibersihkan.
Antibodi yang dihasilkan pada infeksi virus dengue merupakan non netralisasi antibodi yang dipelajari dari hasil studi menggunakan stok kulit virus C6/C36, viro sel nyamuk dan preparat virus yang asli.
Respon innate immune terhadap infeksi virus Dengue meliputi dua komponen yang berperan penting di periode sebelum gejala infeksi yaitu antibodi IgM dan platelet. Antibodi alami IgM dibuat oleh CD5 + B sel, bersifat tidak spesifik dan memiliki struktur
molekul mutimerix. Molekul hexamer IgM berjumlah lebih sedikit dibandingkan molekul pentameric IgM namun hexamer IgM lebih efisien dalam mengaktivasi komplemen.Antigen Dengue dapat dideteksi di lebih dari 50% “Complex Circulating Imun”. Kompleks imun IgM tersebut selalu ditemukan di dalam dinding darah dibawah kulit atau di bercak merah kulit penderita dengue. Oleh karenanya dalam penentuan virus dengue level IgM merupakan hal yang spesifik.
PATOFOSIOLOGI DBD
Pada DBD dan DSS peningkatan akut permeabilitas vaskuler merupakan patofisiologi primer.Hal ini akan mengarah ke kebocoran plasma ke dalam ruang ekstravaskuler, sehingga menimbulkan hemokonsentrasi dan penurunan tekanan darah. Pada kasus-kasus berat volume plasma menurun lebih dari 20% meliputi efusi pleura, hemokonsentrasi dan hipoproteinemia. Lesi destruktif vaskuler yang nyata tidak terjadi.
Terdapat tiga faktor yang menyebabakan perubahan hemostasis pada DBD dan DSS yaitu: perubahan vaskuler, trombositopenia dan kelainan koagulasi. Hampir semua penderita dengue mengalami peningkatan fragilitas vaskuler dan trombositopeni, serta koagulogram yang abnormal.
Infeksi virus dengue mengakibatkan muncul respon imun humoral dan seluler, antara lain anti netralisasi, anti hemaglutinin, anti komplemen. Antibodi yang muncul pada umumnya adalah IgG dan IgM, mulai muncul pada infeksi primer, dan pada infeksi sekunder kadarnya telah meningkat.
Pada hari kelima demam dapat ditemukan antibodi dalam darah, meningkat pada minggu pertama hingga minggu ketiga dan menghilang setelah 60-90 hari.pada infeksi primer antibodi IgG meningkat pada hari ke-14 demam sedangkan pada infeksi sekunder kadar IgG meningkat pada hari kedua. Karenanya diagnosis infeksi primer ditegakkan dengan mendeteksi antibodi IgM setelah hari kelima sakit, sedangkan pada infeksi sekunder diagnosis dapat ditegakkan lebih dini.
Pada infeksi primer antibodi netralisasi mengenali protein E dan monoclonal antibodi terhadap NS1, Pre M
16 dan NS3 dari virus dengue sehingga terjadi
aktifitas netralisasi atau aktifasi komplemen sehingga sel yang terinfeksi virus menjadi lisis. Proses ini melenyapkan banyak virus dan penderita sembuh dengan memiliki kekebalan terhadap serotipe virus yang sama.
Apabila penderita terinfeksi kedua kalinya dengan virus dengue serotipe yang berbeda, maka virus dengue tersebut akan berperan sebagai super antigen setelah difagosit oleh makrofag atau monosit. Makrofag ini akan menampilkan Antigen Presenting Cell (APC). Antigen ini membawa muatan polipeptida spesifik yang berasal dari Major Histocompatibility Complex (MHC II).
Antigen yang bermuatan peptida MHC II akan berikatan dengan CD4+ (TH-1 dan TH-2) dengan perantaraan T Cell Receptor (TCR) sebagai reaksi terhadap infeksi.Kemudian limfosit TH-1 akan mengeluarkan substansi imunomodulator yaitu INFγ, IL-2, dan Colony Stimulating Factor (CSF). IFNγ akan merangsang makrofag untuk mengeluarkan IL-1 dan TNFα.Interleukin-1 (IL-1) memiliki efek pada sel endotel, membentuk prostaglandin, dan merangsang ekspresi intercelluler adhasion molecule 1 (ICAM 1).
Colony Stimulating Factor (CSF) akan merangsang neutrophil, oleh pengaruh ICAM 1 Neutrophil yang telah terangsang oleh CSF akan beradhesi dengan sel endothel dan mengeluarkan lisosim yang mambuat dinding endothel lisis dan endothel terbuka. Neutrophil juga membawa superoksid yang akan mempengaruhi oksigenasi pada mitokondria dan siklus GMPs, sehingga endothel menjadi nekrosis dan mengakibatkan terjadi gangguaan vaskuler.
Antigen yang bermuatan MHC I akan diekspresikan di permukaan virus sehingga dikenali oleh limfosit T CD8+ yang bersifat sitolitik sehingga menhancurkan semua sel yang mengandung virus dan akhirnya disekresikan IFNγ dan TNFα. PATOGENESIS
Virus Dengue yang ditularkan oleh nyamuk Aedes menyerang organ RES seperti sel kupfer di sinusoid hepar, endotel pembuluh darah, nodus limfaticus, sumsum tulang serta paru-paru. Dalam peredaran darah virus akan difagosit oleh monosit.
Setelah genom virus masuk ke dalam sel maka dengan bantuan organel-organel sel genom virus akan memulai membentuk komponen-komponen strukturalnya.setelah berkembang biak di dalam sitoplasma sel maka virus akan dilepaskan dari sel.
Diagnosis pasti dengan uji serologis pada infeksi virus dengue sulit dilakukan karena semua flavivirus memiliki epitope pada selubung protein yang menghasilkan “cross reaction” atau reaksi silang.
Infeksi oleh satu serotipe virus DEN menimbulkan imunitas protektif terhadap serotipe tersebut, tetapi tidak ada “cross protektif” terhadap serotipe virus yang lain.
Virion dari virus DEN ekstraseluler terdiri dari protein C (capsid), M (membran) dan E (envelope). Virus intraseluler terdiri dari protein pre-membran atau pre-M.Glikoprotein E merupakan epitope penting karena: mampu membangkitkan antibodi spesifik untuk proses netralisasi, mempunyai aktifitas hemaglutinin, berperan dalam proses absorbsi pada permukaan sel, (reseptor binding), mempunyai fungsi fisiologis antara lain untuk fusi membran dan perakitan virion. Secara in vitro antibodi terhadap virus DEN mempunyai 4 fungsi fisiologis: netralisasi virus, sitolisis komplemen, Antibodi Dependent Cell-mediated Cytotoxicity (ADCC) dan Antibodi Dependent Enhancement.
Secara invivo antibodi terhadap virus DEN berperan dalam 2 hal yaitu:
a. Antbodi netralisasi memiliki serotipe spesifik yang dapat mencegah infeksi infeksi virus.
b. Antibodi non netralising memiliki peran cross-reaktif dan dapat meningkatkan infeksi yang berperan dalam patogenesis DBD dan DSS Perubahan patofidiologis dalam DBD dan DSS dapat dijelaskan oleh 2 teori yaitu hipotesis infeksi sekunder (teori secondary heterologous infection) dan hipotesis antibody dependent enhancement (ADE). Teori infeksi sekunder menjelaskan bahwa apabila seseorang mendapatkan infeksi primer dengan satu jenis virus, maka akan terdapat kekebalan terhadap infeksi virus jenis tersebut untuk jangka waktu yang lama.
Pada infeksi primer virus dengue antibodi yang terbentuk dapat menetralisir virus yang sama (homologous). Namun jika
17 orang tersebut mendapat infeksi sekunder
dengan jenis virus yang lain, maka virus tersebut tidak dapat dinetralisasi dan terjadi infeksi berat. Hal ini disebabkan terbentuknya kompleks yang infeksius antara antibodi heterologous yang telah dihasilkan dengan virus dengue yang berbeda.
Selanjutnya ikatan antara kompleks virus-antibodi (IgG) dengan reseptor Fc gama pada sel akan menimbulkan peningkatan infeksi virus DEN. Kompleks antibodi meliputi sel makrofag yang beredar dan antibodi tersebut akan bersifat opsonisasi dan internalisasi sehingga makrofag akan mudah terinfeksi sehingga akan memproduksi IL-1, IL-6 dan TNF α dan juga “Platelet Activating Factor”
Selanjutnya dengan peranan TNFα akan terjadi kebocoran dinding pembuluh darah, merembesnya plasma ke jaringan tubuh karena endothel yang rusak, hal ini dapat berakhir dengan syok.
Proses ini juga menyertakan komplemen yang bersifat vasoaktif dan prokoagulan sehingga menimbulkan kebosoranplasma dan perdarahan yang dapat mengakibatkan syok hipovolemik.
Pada bayi dan anak-anak berusia dibawah 2 tahun yang lahir dari ibu dengan riwayat pernah terinfeksi virus DEN, maka dalam tubuh anak tersebut telah terjadi “Non Neutralizing Antibodies” sehingga sudah terjadi proses “Enhancing” yang akan memacu makrofag sehingga mengeluarkan IL-6 dan TNF α juga PAF. Bahan-bahan mediator tersebut akan mempengaruhi sel-sel endotel pembuluh darah dan sistem hemostatik yang akan mengakibatkan kebocoran plasma dan perdarahan.
Pada teori kedua (ADE) , terdapat 3 hal yang berkontribusi terhadap terjadinya DBD dan DSS yaitu antibodies enhance infection, T-cells enhance infection, serta limfosit T dan monosit. Teori ini menyatakan bahwa jika terdapat antibodi spesifik terhadap jenis virus tertentu, maka antibodi tersebut dapat mencegah penyakit, tetapi sebaliknya apabila antibodi yang terdapat dalam tubuh tidak dapat menetralisir penyakit, maka justru dapat menimbulkan penyakit yang berat.
Disamping kedua teori tersebut, masih ada teori-teori lain yang berusaha menjelaskan patofisiolog DBD, diantarnya adalah teori virus yang mendasarkan pada
perbedaan keempat serotipe virus Dengue yang ditemukan berbeda antara satu daerah dengan yang lainnya. Sedangkan teori antigen-antibodi mendasarkan pada kenyataan bahwa terjadi penurunan aktifitas sistem komplemen yang ditandai dengan penurunan C3, C4, dan C5. teori juga didukung dengan adanya pengaruh kompleks imun pada penderita DBD terhadap aktifitas komponen sistem imun.
Penelitian oleh Azaredo El dkk, 2001 membuktikan bahwa patogenesis DBD/DSS umumnya disebabkan oleh disregulasi respon imunologik. Monosit/makrofag yang terinfeksi virus Dengue akan mensekresi monokin yang berperan dalam patogenesis dan gambaran klinis DBD/DSS.
Penelitian invitro oleh Ho LJ dkk 2001 menyebutkan bahwa Dendritic Cell yang terinfeksi virus dengue dapat mengekspresi antigen HLA B7-1, B7-2, HLA-DR, CD11b dan CD83.Dendritic Cell yang terinfeksi virus dengue ini sanggup memproduksi TNF-α dan IFN-γ namun tidak mensekresi IL-6 dan IL-2. Oberholzer dkk, 2002 menjelaskan bahwa IL-10 dapat menekan proliferasi sel T.
Pada infeksi fase akut terjadi penurunan populasi limfosit CD2+, CD4+, dan CD8+. Demikian pula juga didapati penurunan respon prroliferatif dari sel-sel mononuklear. Di dalam plasma pasien DBD/DSS terjadi peningkatan konsentrasi IFN-γ, TNF-α dan IL-10. peningkatan TNF-α berhubungan dengan manifestasi perdarahan sedangkan IL-10 berhubungan dengan penurunan trombosit. Sehingga dapat disimpulkan bahwa terjadi penekanan jumlah dan fungsi limfosit T, sedangkan sitokin proinflamasi TNF-α berperan penting dalam keparahan dan patogenesis DBD/DSS, dan meningkatnya IL-10 akan menurunkan fungsi limfosit T dan trombosit.
Lei HY dkk, 2001 menyatakan bahwa infeksi virus dengue akan mempengaruhi sistem imun tubuh berupa perubahan rasio CD4/CD8, overproduksi dari sitokin dan dapat menginfeksi sel-sel endothel dan hepatosit yang akan menyebabkan terjadinya apoptosis dan disfungsi dari sel-sel tersebut. Demikian pula sistem koagulasi dan fibrinolisis yang ikut teraktivasi. Kerusakan trombosit akibat dari reaksi silang otoantibodi anti-trombosit, karena overproduksi IL-6 yang berperan