Disusun Oleh :
Disusun Oleh :
Aulia
Aulia Mutiara Mutiara Aminullah Aminullah 24140310282414031028 Roni
Roni Kusumah Kusumah 24140310542414031054 Andi
Andi M M Fathurrahman Fathurrahman 24140310532414031053 Asisten :
Asisten : Abdi
Abdi Ismail Ismail 24121000272412100027
PROGRAM STUDI D3 METROLOGI DAN
PROGRAM STUDI D3 METROLOGI DAN
INSTRUMENTASI
INSTRUMENTASI
JURUSAN TEKNIK FISIKA
JURUSAN TEKNIK FISIKA
FAKULTAS TEKNOLOGI INDUSTRI
FAKULTAS TEKNOLOGI INDUSTRI
INSTITUT TEKNOLOGI SEPULUH NOPEMBER
INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA
SURABAYA
2015
ii
Disusun Oleh :
Disusun Oleh :
Aulia
Aulia Mutiara Mutiara Aminullah Aminullah 24140310282414031028 Roni
Roni Kusumah Kusumah 24140310542414031054 Andi
Andi M M Fathurrahman Fathurrahman 24140310532414031053
Asisten : Asisten : Abdi
Abdi Ismail Ismail 24121000272412100027
PROGRAM STUDI D3 METROLOGI DAN PROGRAM STUDI D3 METROLOGI DAN INSTRUMENTASI
INSTRUMENTASI
JURUSAN TEKNIK FISIKA JURUSAN TEKNIK FISIKA
FAKULTAS TEKNOLOGI INDUSTRI FAKULTAS TEKNOLOGI INDUSTRI
INSTITUT TEKNOLOGI SEPULUH NOPEMBER INSTITUT TEKNOLOGI SEPULUH NOPEMBER SURABAYA
SURABAYA 2015
ii ii
ABSTRAK ABSTRAK
Dalam proses termodinamika terdapat beberapa perubahan Dalam proses termodinamika terdapat beberapa perubahan suatu proses seperti proses pemanasan, pendinginan, penambahan suatu proses seperti proses pemanasan, pendinginan, penambahan dan pengurangan air di udara. Dari beberapa peruabahan tersut dan pengurangan air di udara. Dari beberapa peruabahan tersut kita dapat mengambil salah satu contoh ilustrasi pada instrumen kita dapat mengambil salah satu contoh ilustrasi pada instrumen AC Laboratory
AC Laboratory Unit PA Unit PA Hilton A575Hilton A575. Termodinamika merupakan. Termodinamika merupakan suatu
suatu bidang bidang ilmu ilmu pengetahuan yang pengetahuan yang berurusan berurusan dengan dengan kalor,kalor, kerja dan sifat substansi yang berkaitan dengan kerja atau kalor. kerja dan sifat substansi yang berkaitan dengan kerja atau kalor. Tujuan dalam praktikum ini yaitu untuk menganalisis Tujuan dalam praktikum ini yaitu untuk menganalisis kesetimbangan massa-energi pada proses termodinamika kesetimbangan massa-energi pada proses termodinamika (pemanasan) di dalam volume atur dan juga menentuka laju kalor (pemanasan) di dalam volume atur dan juga menentuka laju kalor yang dilepaskan oleh heating coil pada AC unit.Dengan metode yang dilepaskan oleh heating coil pada AC unit.Dengan metode menganalisa temperatur pada daya listrik sebesar 0,5kW dan 1kW menganalisa temperatur pada daya listrik sebesar 0,5kW dan 1kW dengan kecepatan fan yang berbeda. Berdasarkan hasil dari dengan kecepatan fan yang berbeda. Berdasarkan hasil dari perhitunga
perhitungan dan analisa didapatkan nilai kalor pada percobaan inin dan analisa didapatkan nilai kalor pada percobaan ini sebesar 0,76 kJ pada saat daya 0,5kW dan 1,9 pada saat daya sebesar 0,76 kJ pada saat daya 0,5kW dan 1,9 pada saat daya sebesar 1kW.
sebesar 1kW.
Kata kunci : Termodinamika, kesetimbangan massa- energy, laju Kata kunci : Termodinamika, kesetimbangan massa- energy, laju
kalor kalor
iii iii
in a process such as process heating, cooling , addition and in a process such as process heating, cooling , addition and subtraction
subtraction in in the the air air . . Tersut Tersut of of some some changes changes we we can can take take oneone example illustration on the instrument AC Laboratory Unit PA example illustration on the instrument AC Laboratory Unit PA Hilton A57
Hilton A575 . 5 . Thermodynamics is Thermodynamics is a science a science that dthat deals with eals with heat ,heat , work and the nature of the substance related to work or heat . The work and the nature of the substance related to work or heat . The goal
goal in in this this lab lab is is to to analyze analyze the the mass-energy mass-energy balance balance in in thethe process
process thermodynamics thermodynamics ( ( heating heating ) ) in in the the volume volume set set , , and and alsoalso determining the rate of heat given off by the heating coil on the determining the rate of heat given off by the heating coil on the AC
AC unit.Dengan unit.Dengan method method of of analyzing analyzing the the temperature temperature of of thethe electric power of 0,5kW and 1kW with speed different fan . Based electric power of 0,5kW and 1kW with speed different fan . Based on the results of the calculation and analysis obtained in this on the results of the calculation and analysis obtained in this experiment the calorific value of 0.76 kJ when power 0,5kW and experiment the calorific value of 0.76 kJ when power 0,5kW and 1,9 when the power of 1kW.
1,9 when the power of 1kW. Keywords : thermodynamics ,
Keywords : thermodynamics , equilibrium mass- energy , heatequilibrium mass- energy , heat rate
iv
KATA PENGANTAR
Puji Syukur kami panjatkan kepada Tuhan Yang Maha Esa atas limpahan rahmat, hidayah dan karunia-Nya sehingga kami dari praktikan dari kelompok-1 dapat menyelesaikan Laporan Resmi Praktikum Termodinamika P-1 yang membahas mengenai volume atur.
Kami juga menyampaikan terima kasih kepada pihak-pihak yang telah membantu saya dalam menyelesaikan penyusunan laporan ini. Kami sadar dalam penyusunan laporan ini masih banyak terdapat kekurangan , oleh karena itu dengan kerendahan
hati, kami meminta maaf kepada para pembaca dan berharap agar pembaca berkenan hati untuk memberikan kritik dan saran untuk
melakukan perbaikan penyusunan laporan kedepannya.
Semoga laporan ini dapat menambah pengetahuan bagi pembaca dan bermanfaat bagi kita semua.
Surabaya, 30 November 2015
v ABSTRAK ... ii ABSTRACT ... iii KATA PENGANTAR ... iv DAFTAR ISI ... v DAFTAR GAMBAR ... vi
DAFTAR TABEL ... vii
BAB I. PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Rumusan Masalah ... 1
1.3 Tujuan Percobaan ... 1
1.4 Sistematika Laporan ... 2
BAB II. DASAR TEORI ... 3
2.1 Dasar Termodinamika ... 3
2.2 Hukum Pertama Termodinamika ... 7
2.3 Kesetimbangan Termodinamika ... 15
2.4 Analisa Volume Atur Pada Keadaan Tunak ... 17
2.5 Air Conditoning ... 19
BAB III. METODOLOGI PRAKTIKUM ... 23
3.1 Peralatan Percobaan ... 23
3.2 Prosedur Percobaan ... 23
BAB IV. DATA ANALISA DAN PEMBAHASAN ... 25
4.1 Analisa Data ... 25 4.2 Pembahasan ... 25 Bab V. PENUTUP ... 29 5.1 Kesimpulan ... 29 5.2 Saran ... 29 DAFTAR PUSTAKA LAMPIRAN
vi
DAFTAR GAMBAR
Gambar 2.1 Sistem Termodinamika ... 5
Gambar 2.2 Grafik proses isothermal ... 13
Gambar 2.3 Grafik proses adiabatik ... 14
Gambar 2.4 Grafik isokhorik ... 14
vii
Tabel 4.1 Data Percobaan Praktikum 1 ... 25 Tabel 4.2 Data Hasil Enthalpy dan Kalor ... 25
1
BAB I
PENDAHULUAN 1.1 Latar Belakang
Dalam proses termodinamika terdapat beberapa perubahan suatu proses seperti proses pemanasan, pendinginan, penambahan dan pengurangan air di udara. Dari beberapa peruabahan tersut kita dapat mengambil salah satu contoh ilustrasi pada instrumen AC Laboratory Unit PA Hilton A575.
Air Conditioning Laboratory Unit ini merupakan simulator pengkondisian udara yang dilengkapi dengan berbagai proses- proses psikometrik seperti proses pemanasan (heating), pendinginan (cooling), penambahan dan pengurangan kandungan
air di udara (humidifying – dehumidifying).
Pada praktikum ini dapat diambil contoh untuk mengatur perubahan massa dan energi dari perubahan suhu udara yang dihasilkan oleh refrigeran dan dapat dianalisa sesuai pengaturan volume atau set point yang telah ditentukan dari analisa juga dapat menentukan kalor yang dilepas oleh AC tadi.
1.2 Rumusan Masalah
Adapun yang menjadi rumusan masalah pada praktikum ini adalah :
1. Bagaimana cara menganalisis kesetimbangan massa-energi pada proses termodinamika (pemanasan) didalam volume atur ?
2. Bagaimana cara menentukan laju kalor yang dilepaskan oleh heating coil pada duct AC unit beserta efisiensinya ? 1.3 Tujuan
Adapun tujuan dari praktikum ini adalah :
1. Menganalisis kesetimbangan massa-energi pada proses termodinamika (pemanasan) didalam volume atur
2. Menentukan laju kalor yang dilepaskan oleh heating coil pada duct AC unit beserta efisiensinya.
1.4 Sistematika Laporan
Adapun sistematika pada laporan praktikum ini terdiri dari 5 bab, yaitu :
BAB I Pendahuluan
Pada bab ini berisi tentang latar belakang, rumusan masalah, tujuan percobaan, dan sistematika laporan.
BAB II Dasar Teori
Pada bab ini membahas tentang dasar teori yang dapat menunjang pembuatan laporan praktikum.
BAB III Metodologi Percobaan
Pada bab ini berisi tentang alat dan bahan yang digunakan serta prosedur percobaan.
BAB IV Analisa Data dan Pembahasan
Pada bab ini berisi tentang analisa data beserta pembahasan. BAB V Kesimpulan dan Saran
3
BAB II
DASAR TEORI
2.1 Dasar Termodinamika.
Termodinamika merupakan suatu bidang ilmu pengetahuan tentang/ yang berurusan dengan kalor, kerja dan sifat substansi yang berkaitan dengan kerja atau kalor. Seperti halnya pengetahuan /ilmu-ilmu dasar, termodinamika berbasiskan pengalaman/eksperimental yang kemudian diformulasikan dalam beberapa hukum dasar, seperti yang kita ketahui antara lain hukum termodinamika pertama, kedua dan ketiga.[2]
2.1.1 Siklus termodinamika
Siklus termodinamika merupakan suatu urutan proses yang berawal dan berakhir pada keadaan yang sama. Pada akhir siklus, semua sifat akan memiliki nilai yang sama dengan kondisi awal. Dengan demikian maka dalam suatu siklus sistem tidak akan mengalami perubahan netto. Contohnya uap yang bersirkulasi dalam suatu sistem pembangkit tenaga listrik membentuk sebuah siklus.
Pada suatu keadaan tertentu,
setiap sifat memiliki nilai tertentu yang dapat ditentukan
tanpa perlu mengetahui bagaimana sistem dapat mencapai
keadaan tersebut. Dengan demikian perubahan nilai suatu
sifat pada sistem akan berpindah dari suatu keadaan ke
keadaan lain sangat ditentukan oleh keadaan awal dan
akhir serta tidak dipengaruhi oleh langkah perubahan yang
terjadi. Perubahan tidak dipengaruhi oleh sejarah dan
rincian proses. Sebaliknya apabila nilai suatu besaran tidak
dipengaruhi oleh proses antara dua keadaan, maka
besaran tersebut merupakan perubahan sifat.
2.1.2 Properti dan Proses
Properti dari suatu bahan adalah jumlah kuantitatif yang dapat diukur atau dihitung untuk mengetahui kondisi keadaan tertentu pada bahan. Properti ini misalnya massa, tekanan, temperatur, volume, entalpi, dan entropi Proses adalah sebuah
hal perlakuan yang terjadi untuk mengubah properti. Pada termodinamika proses biasanya melibatkan transfer energi seperti : pemanasan, pendinginan, penekanan (kompresi), pengembangan (ekspansi), pengadukan, atau pemompaan.
Proses-proses yang mungkin digunakan untuk merubah properti adalah : tekanan konstan (isobar), volume konstan (isovolum), temperatur konstan (isotermal), adiabatic (tidak ada aliran panas), isentalpi (entalpi tetap), dan isentropi (entropi tetap). Proses termodinamika biasanya digambarkan dalam sistem koordinat dua properti , yaitu P-V diagram, P-v diagram, atau T-S diagram.
2.1.3 Volume spesifik
Volume spesifik (v) adalah jumlah volume dalam
satu kilogram massa suatu zat (m
3/kg) dan merupakan
kebalikan dari densitas ρ = 1/v dengan satuan SI yaitu
kg/m
32.1.4 Tekanan
Tekanan adalah gaya normal (F) tegak lurus yang
diberikan oleh suatu fluida persatuan luas benda (A) yang
terkena gaya tersebut.
p = F/A
Tekanan sebenarnya atau aktual pada suatu posisi tertentu
disebut dengan tekanan absolut sedangkan tekanan yang
dibaca oleh suatu alat ukur disebut dengan tekanan
gage atau tekanan
vakum. Hubungan antara tekanan
absolut, tekanan atmosfer, tekanan gauge,
dan tekanan vakum .2.1.5 Temperatur
Temperatur adalah ukuran panas-dinginnya dari suatu zat. Panas-dinginnya suatu zat berkaitan dengan energi termal yang terkandung dalam zat tersebut. Makin besar energi termalnya,
5
makin besar temperaturnya. Sehingga, temperatur dari suatu benda menyatakan keadaan termal benda tersebut dan
kemampuan benda
untuk bertukar energi dengan benda
lain yang bersentuhan dengan benda tersebut. Benda
yang bersuhu tinggi akan memberikan energinya kepada
benda yang bersuhu rendah. Satuan untuk temperatur
adalah Celcius (C) dan dapat diukur dengan menggunakan
termometer. Temperatur absolut (T) adalah derajat diatas
temperatur nol absolut yang dinyatakan dengan satuan
Kelvin (K).
T = t°C+273
Konversi satuan pada temperatur
°F = 32 + (9/5 . °C)
°R = 9/5 . °K
2.1.6. Fase
Fase ( phase) menggambarkan sejumlah materi yang homogen dalam komposisi kimia maupun struktur fisiknya. Homogenitas dalam struktur fisik berarti bahwa materi tersebut seluruhnya berada dalam kondisi padat, cair, uap atau gas
.
[1]2.17 Sistem Termodinamika
Terdapat dua jenis sistem termodinamika, yaitu sistem tertutup dan sistem terbuka. yang digambarkan sebagai berikut.
1. Sistem tertutup
Dalam sistem tertutup massa dari sistem yang dianalisis tetap dan tidak ada massa keluar dari sistem atau masuk kedalam sistem,tetapi volumenya bisa berubah. Yang dapat keluar masuk sistem tertutup adalah energi dalam bentuk panas atau kerja. Atau dengan kata lain sistem tertutup berisi materi yang sama, dimana perpindahan massa melalui batas sistem tidak dimungkinkan. Pada sistem tertutup yang melintasi garis batas (boundary layer ) hanyalah aliran kalor dan kerja saja, sedangkan pada sistem terbuka, fluida kerja juga melintasi batas dari sistem. Dalam analisis termodinamika pada sistem tertutup biasanya digunakan massa atur (control mass) dan pada siklur terbuka digunakan volume atur (control volume).Perubahan keadaan pada substansi kerja (fluida kerja), menunjukkan proses termodinamika. Proses termodinamika pada sistem tertutup disebut proses tanpa aliran (non-flow Processes) Contoh sistem tertutup adalah suatu balon udara yang dipanaskan, dimana massa udara didalam balon tetap, tetapi volumenya berubah, dan energi panas masuk kedalam massa udara didalam balon.
2. Sistem Terbuka
Dalam sistem terbuka, energi dan masa dapat keluar sistem atau masuk kedalam sistem melewati batas sistem. Sebagian besar mesin-mesin konversi energi adalah sistem terbuka. persamaan pokok yang berlaku adalah hukum termodinamika pertama.
Untuk proses sistem terbuka, atau disebut proses dengan aliran ( flow-processes
)’, ketentuan pokok
yang berlaku adalah persamaan energi aliran mantap ( steady flow energy equation).Sistem mesin motor bakar adalah ruang didalam silinder mesin, dimana campuran bahan bahan bakar dan udara masuk kedalam silinder, dan gas buang keluar sistem7
melalui knalpot. Turbin gas, turbin uap, pesawat jet dan lain-lain adalah merupakan sistem termodinamika terbuka, karena secara simultan ada energi dan massa keluar-masuk sistem tersebut. 3. Sistem Terisolasi
Tidak ada pertukaran massa dan energi sistem dengan lingkungan. Atau dengan kata lain sistem tidak terpengaruh sama sekali oleh lingkungan. Misalnya: Tabung gas yang terisolasi. Perhatikan perbedaan penggunaan istilah tertutup dan terisolasi yang berbeda dengan pengertian keseharian. Dari definisi tentang sistem di atas, maka klasifikasi dalam ketiga kelompok diatas bergantung pada sistem dan dinding pembatasnya. Tingkat keadaan termodinamika suatu sistem pada suatu saat tertentu dinyatakan dengan sifat-sifat termodinamikanya, baik sifat intensif ataupun sifat eksensif. Sifat intensif dari suatu sistem tidak bergantung pada ukuran sistem, sebagai contoh adalah tekanan temperatur. Sifat ekstensif tergantung dari ukuran sistem, contohnya adalah volume V, energi dalam U, entalpi H, entropi S, dan lain sebagainya. Sifat ekstensif dapat diubah menjadi seolah-olah bersifat intensif dengan cara membaginya dengan ukuran sistem tersebut (biasanya massa), sehingga dikenal dengan volume spesifik v, entalpi h, entropi s, energi dalam u, dan lain sebagainya. Kalor yang ditambahkan kedalam sistem dinyatakan dengan Q dan berharga positif, dan kerja yang dilakukan oleh sistem juga positif dinyatakan dengan W. Harga spesifiknya per satuan massa fluida kerja disebut dengan q dan w.[2]
2.2 Hukum Pertama Termodinamika
Hukum termodinamika pertama berbunyi “Energi tidak dapat diciptakan dan dimusnahkan tetapi dapat dikonversi dari suatu bentu ke bentuk yang lain”. Hukum pertama adalah prinsip
perpindahan energi. Menurut hukum pertama, energi di dalam suatu benda dapat ditingkatkan dengan cara menambahkan kalor ke benda atau dengan melakukan usaha pada benda. Hukum pertama tidak membatasi arah perpindahan kalor yang dapat
terjadi.
Berdasarkan hukum kekekalan energi maka Hukum I Termodinamika dirumuskan:
Yaitu : U = Q + W Dengan : U = U2-U1
Jadi, hukum pertama termodinamika adalah prinsip kekekalan energi yang diaplikasikan pada kalor, usaha, & energi dalam. Hukum I termodinamika menyatakan bahwa kalor yang terlibat diubah menjadi perubahan energi dalam & usaha.
Proses :
Reversible dan tidak reversible. Proses reversible:
H2O(l) H2O(g)
1 atm, 1000C fasa cair dan uap berada dalam kesetimbangan.
Kalor dan Kerja
Kalor (q): energi yang dipindahkan melalui batas-batas sistem sebagai akibat langsung dari perbedaan suhu antara sistem dan lingkungannya.
q: positif jika kalor masuk sistem
q: negatif jika kalor keluar dari sistem.
Kerja (W): energi dan bukan kalor yang dipertukarkan antara sistem dengan lingkungannya pada suatu perubahan keadaan.
W positif bila lingkungan melakukan kerja terhadap sistem, misalnya proses pemampatan gas.W negatif bila sistem
9
melakukan kerja terhadap lingkungan, misalnya proses pemuaian gas terhadap atmosfer.
Luas penampang penghisap : A
Tekanan luar : Pl
Jarak : dx
Kerja = gaya * jarak dW = - Pl * A * dx dW = - Pl * dV
dV = perubahan volum yang terjadi pada proses tanda (-) karena kerja dilakukan oleh gas.
V2
W = -
∫ P
l dV V1Pl = 0 : gas memuai terhadap vakum W = 0 proses ekspansi bebas
Pl tetap gas memuai pada tekanan atmosfir yang tetap. V2
W = -
∫ P
l dV = - Pl (V2–
V1) V1W = - Pl
ΔV
Proses pemuaian reversibel : Pl = P
–
dPV2 V2 V2
W = -
∫ (P –
dP) dV = -∫ P dV + ∫ dP dV
V1 V1 V1
V2
Wrev = -
∫ P dV
P = tekanan gas.
V1V2
Wrev = -
∫ nRT (dV/V) =
-nRT ln (V2/V1) V1Energi dalam dan perubahan energi dalam.
ΔU = U
2–
U1Hukum pertama Termodinamika. dU = dq + dW
2 2 2
∫ dU = ∫ dq + ∫ dW (dW =
-Pl dV)1 1 1
U2
–
U1= ΔU = q + W.
Untuk proses yang berjalan pada Volume tetap, maka harga ΔU
= qvEnthalpi dan Perubahan Enthalpi
Reaksi kimia berjalan pada tekanan sistem yang tetap dan sama dengan tekanan luar.
dU = dq - P dV U2
–
U1 = q p - P (V2–
V1) U2–
U1 = q p - PV2 + PV1 U2–
U1 = q p - P2V2 + P1V1 (U2 + P2V2) = (U1 + P1V1) + q p H = U + PV H : fungsi keadaan. H2–
H1 = q p ΔH = q
p Kapasitas kalor.11 C =
dT
dq
U = f (T, V)dU = (∂U/∂V)
TdV + (∂U/∂T)
V dT dU = dq–
P dV dq = dU + P dVdq = (∂U/∂V)
TdV + (∂U/∂T)
V dT + P dVdq = (∂U/∂T)
VdT + (P + (∂U/∂V)
T) dV Proses pada volum tetap :dqv
= (∂U/∂T)
V dTCV = (dqv
/ dT) = (∂U/∂T)
VCV: kapasitas panas pada volum tetap. Proses pada volume tetap:
T2
ΔU = ∫ C
v dT T1H = f (P, T)
dH = (∂H/∂P)
TdP + (∂H/∂T)
P dT Proses pada tekanan tetap :dq p
= (∂H/∂T)
P dT CP = dT dqP= (∂H/∂T)
P T2ΔH = ∫ C
PdT T1Penggunaan Hukum Termodinamika I : Ekspansi Reversibel Isotermal gas ideal.
Wrev = -
∫ RT
V dV = - RT ln 1 2 V V(per mol gas) P1V1 = P2V2 W = RT ln 1 2 P P n mol : W = nRT ln 1 2 P P
ΔH dan ΔU = 0 pada proses isotermal
W = -qEkspansi Reversibel Adiabatis Gas Ideal Adiabatis q = 0 dU = dW = - P dV dU = CV dT CV dT = - P dV = - RT (dV/V) CV (dT/T) = - R (dV/V) CV ln 1 2 T T = - R ln 1 2 V V V P C C =
γ
ln 1 2 T T = -V V P C C -C ln 1 2 V V = - (γ
- 1) ln 1 2 V V (γ
- 1) 1 2T
T
= ( 2 1V
V
)13
2.2.1 Penerapan Hukum I Termodinamika pada Proses Termodinamika
Hukum pertama termodinamika dilakukan dalam empat proses, yaitu:
1. Proses Isotermal
Dalam proses ini, suhu sistem dijaga agar selalu konstan. Suhu gas ideal berbanding lurus dengan energi dalam gas ideal dan tekanan sistem berubah penjadi (tekanan sistem berkurang).
Gambar 2.2 Grafik proses isotermal 2. Proses Adiabatik
Dalam proses adibiatik, tidak ada kalor yang ditambahkan pada sistem atau meninggalkan sistem (Q = O). Proses adibiatik bisa terjadi pada sistem tertutup yang terisolasi dengan baik. Untuk sistem tertutup yang terisolasi dengan baik, biasanya tidak ada kalor yang dengan seenaknya mengalir kedalam sistem atau meninggalkan sistem. Proses adibiatik juga bisa terjadi pada sistem tertutup yang tidak terisolasi. Proses dilakukan dengan sangat cepat sehingga kalor tidak sempat mengalir menuju sistem atau meninggalkan sistem.
Gambar 2.3 Grafik proses adiabatik 3. Proses Isokhorik
Dalam prose isokhorik, volume sistem dijaga agar selalu konstan. Karena volume sistem selalu konstan, maka sistem tidak bisa melakukan kerja pada lingkungan. Demikian juga sebaliknya, lingkungan tidak bisa melakukan kerja pada sistem.
Gambar 2.4 Grafik isokhorik 4. Proses Isobarik
Dalam proses isobarik, tekanan sistem dijaga agar selalu konstan. Karena yang konstan adalah tekanan maka perubahan energi dalam (U) ,kalor (Q), dan kerja (W) pada proses isobarik tidak ada dan bernilai
15
nol. Dengan demikian, persamaan hukum pertama termodinamika tetep utuh seperti semula.
Gambar 2.5 Grafik isobarik [3] 2.3 Kesetimbangan Termodinamika
Suatu benda dikatakan berada dalam keadaan kesetimbangan termodinamik bila nilai dari besaran-besaran keadaan makroskopiknya tidak lagi berubah dalam jangka waktu yang cukup lama. Termodinamika hanya akan meninjau besaran- besaran keadaan setelah sistem berada dalam kesetim-bangan termodinamik. Bahkan besaran-besaran termodinamika hanya terdefinisi dalam keadaan kesetimbangan termodinamik. Termodinamika tidak meninjau proses bagaimana suatu sistem berubah mencapai kondisi kesetimbangan termodinamiknya,
karena itu tidak ada variabel waktudalam relasi-relasi termodinamika.Kondisi kesetimbangan termodinamika jelas adalah suatu yang sangat jauh dari realita, karena bagaimanapun suatu benda tidak akan dapat lepas dari interaksinya dengan lingkungan, sehingga tidak mungkin nilai besaran-besaran makroskopiknya benar-benar tidak berubah. Tetapi kon- disi mendekati kesetimbangan termodinamika sudah cukup untuk dapat diterapkannya relasi-relasi termodinamika. Sebagai contoh hukum radiasi benda hitam dapat diterapkan pada matahari ataupun bintang walaupun mereka tidak benar-benar dalam
keadaan kesetimbangan termodinamik. Sehingga dengan menganalisa spektrum gelombang elektromagnetik yang dipancarkan matahari ataupun bintang, dapat diduga besar temperatur permukaannya.
2.3.1 Kesetimbangan Termal
Dua benda dikatakan berada dalam keadaan kesetimbangantermal bila dalam kondisi adanya kemungkinan interaksi antara partikel kedua sistem, tidak ada lagi total perpindahan energi panas antara keduanya (tidak tampak lagi perubahan keadaan makro pada kedua benda). Bila benda A berada dalam kesetimbangan termal dengan benda B, serta benda B berada dalam kesetimbangan termal dengan benda C, maka benda A akan berada dalam kesetimbangan termal dengan benda
C. Relasi kesetimbang termal adalah suatu relasi ekuivalensi, sehingga seseorang dapat mengelompokkan benda-benda yang berada dalam keadaan setimbang termal dan memberi parameter
yang menunjukkan hal itu. Fakta empiris ini dikenal sebagai hukum termodinamika ke nol. Benda-benda yang berada dalam keadaan kesetimbangan termal satu sama lain, dide_nisikan memiliki temperatur yang sama. Dua benda yang berada dalam keadaan kesetimbangan termal akan memiliki temperatur yang sama. Jadi hukum termodinamika ke-nol ini tidak lain adalah pernyataan tentang adanya besaran temperatur. Besaran
temperatur ini adalah besaran intensif, karena nilainya tidak bergantung pada jumlah partikel. Konsep temperatur hanya berlaku untuk sistem makroskopik. Tidak ada artinya mende_nisikan temperatur untuk sebuah partikel.Walaupun sebuah benda tidak secara keseluruhan berada dalam kesetimbangan termal, bagian-bagian dari benda tersebut mungkin berada dalam keadaan kesetimbangan termal lokal. Maka pada bagian-bagian benda tersebut dapat dide_nisikan temperature.
17
Sebelum mende_nisikan kesetimbangan mekanik, perlu didenisikan terlebih dahulu besaran tekanan p. Bila ditinjau suatu bagian dari sistem yang dibatasi dengan suatu dinding pembatas
(tidak harus berupa dinding sesungguhnya, dapat hanya berupa dinding andaian). Pada dinding tersebut secara umum akan ada gaya dari sistem (atau bagian sistem) yang bekerja ke bagian di sebelah luar dinding. Gaya tersebut secara umum dapat diuraikan menjadi komponen yang sejajar dan yang tegak lurus permukaan dinding. Karena komponen gaya yang tegak lurus permukaan diberikanoleh sistem yang terdiri dari banyak partikel, maka nilainya secara umum sebanding dengan luas permukaan dinding. Tekanan tidak lain adalah konstanta kesebandingan antara gaya tegak lurus dinding dan elemen luas permukaan, sehingga untuk elemen gaya dF dan elemen luas permukaan.
dF = pdA; p =
Bila antara sistem dan lingkungan terdapat kesetimbangan sedemikian sehingga tidak terjadi perubahan (makroskopis) volume sistem dan lingkungan, maka dikatakan bahwa sistem dan lingkungan berada dalam keadaan kesetimbangan mekanik. Dalam kondisi kesetimbangan mekanik, sistem dan lingkungan akan memiliki nilai tekanan p yang sama.
2.3.4 Kesetimbangan Jumlah Partikel
Bila antara sistem dan lingkungan dapat terjadi pertukaran partikel, maka jumlah partikel dalam sistem tidak tetap. Tetapi bila jumlah partikel yang keluar dari sistem dan yang masuk ke
dalam sistem secara rerata sama, maka terdapat kesetimbangan jumlah partikel antara sistem dan lingkungan. Ketika itu antara
sistem dan lingkungan dikatakan memiliki nilai potensial kimia yang sama.[4]
2.4 Analisis Volume Atur Pada Keadaan Tunak
Bentuk keadaan tunak dari neraca laju massa dan energy dikembangkan dan diaplikasikan untuk berbagai kasus dari bidang rekayasa .Bentuk keadaaan tunak yang diperoleh tidak
berlaku untuk kondisi transien saat menghidupkan awal dan mematikan operasi[eralatan ,tetapi hanya berlaku untuk kondisi saat operasi yang tunak.situasi semacam ini umum ditemui dalam bidang teknik.
2.4.1 Bentuk Keadaan unak Neraca Laju Massa dan Energi Pada volume atur dalam keadaan tunak,kondisi massa yang berada dlam volume atur dan pda adaerah batasnya,tidak berubah menurut waktu. Laju aliran massa serta laju perpindahan energy oleh kalor dan kerja juga konstan terhadap waktu. Penumpukan massa di dalam volume atur tidak dapat terjadi sehingga dmcv /dt = 0dan neraca laju massa ,Persamaan ,berbentuk sebagai berikut
Lebih lanjut ,pada keadaan tunak dEcv/dt = 0,maka persamaan bisa ditulis sebagai
Persamaan berikut menyatakan bahwa pada keadaan tunak,laju massa total memasuki volume atur adalah sama dengan laju massa total keluar volume atur. Serupa dengan hal ini persamaan satunya menyatakan bahwa total laju energy yang dipindahkan ke dalam volume atur adalah sama dengan total laju energy yang dipindahkan keluar dari volume atur.
Banyak aplikasi penting berupa volume atur dengan satu sisi masuk dan satu sisi keluar pada keadaan tunak. Neraca laju
19
massa dan energi diharuskan untuk dipakai dalam kasus khusus ini . Neraca laju massa berubah secara sederhana menjadi ṁ1 = ṁ2 .Jadi laju aliran massa pada sisi keluar ,2 ,harus sama dengan pada sisi masuk .1. Laju aliran massa yang umum ,dinyatakan secara sederhana sebagai ṁ. Berikutnya,dengan mengaplikasikan neraca laju energy dan dengan menghubungkannya dengan laju aliran massa maka hasilnya adalah
Bentuk entalpi ,energi kinetic dan energy potensial semuanya muncul didalam persamaan berikut sebagai perbedaan antara nilai pada sisi masuk dengan nilai pada sisi keluar. Hal ini menggambarkan bahwa dasar acuan yang digunakan untuk menentukan nilai dari entalpi spesifik,kecepatan,dan letak ketinggian dihilangkan ,sehingga diperoleh persamaan yang sama untuk sisi masuk dan sisi keluar . Dalam persamaan berikut ,perbandngan Qcv /m dan W cv / ṁ adalah laju perpindahan energy prrsatuan massa yang mengalir melalui volume atur.
Bentuk keadaan tunak dari neraca laju energi yang telah dibahas sebelumnya,hanya berhubungan dengan besaran perpindahan energi yang dievaluasi pada batas dari colume atur. Tidak terdapat rincian sifat di alam volume atur yang dibutuhkan ,ataupun bisa itentukan oleh persamaan ini.penggunaan satuan yang mana pada setiap bentuk didalam persamaan diperlukan ketika mengaplikasikan segala bentuk dari neraca laju energy .sebagai contoh ,setiap bentuk dalam persamaan beriut harus mempunyai satuan kJ/kg atau Btu/lb .[5]
2.5 Air Conditoning
Air Conditioning (AC) atau alat pengkondisi udara merupakan modifikasi pengembangan dari teknologi mesin
pendingin. Alat ini dipakai bertujuan untuk memberikan udara yang sejuk dan menyediakan uap air yang dibutuhkan bagi tubuh. Untuk negara beriklim tropis yang terdiri dari musim hujan dan musim panas, pada saat musim panas suhu ruangan tinggi sehingga penghuni tidak nyaman. Di lingkungan tempat kerja, AC juga dimanfaatkan sebagai salah satu cara dalam upaya peningkatan produktivitas kerja. Karena dalam beberapa hal manusia membutuhkan lingkungan udara yang nyaman untuk dapat bekerja secara optimal. Tingkat kenyamanan suatu ruang juga ditentukan oleh temperatur, kelembapan, sirkulasi dan
tingkat kebersihan udara.Untuk dapat menghasilkan udara dengan kondisi yang diinginkan, maka peralatan yang dipasang harus mempunyai kapasitas yang sesuai dengan beban pendinginan yang dimiliki ruangan tersebut.Untuk itu diperlukan survey dan menentukan besarnya beban pendinginan.Secara garis besar beban pendinginan terbagi atas dua kelompok,yaitu beban pendinginan sensibel dan beban pendinginan laten. Beban pendinginan sensibel adalah beban panas yang dipengaruhi oleh perbedaan suhu, seperti beban panas yang lewat kontruksi bangunan, peralatan elektronik, lampu, dll. Sedangkan beban pendinginan laten adalah beban yang dipengaruhi oleh adanya perbedaan kelembaban udara.Di dalam ruang Pengajaran Umun, untuk merencanakan penggunaan Air Conditioning (AC) perubahan pembebanan terjadi pada peralatan yang menghasilkan
kalor seperti: lampu, komputer. Selain itu faktor manusia dan kecepatan udara yang masuk ke dalam ruangan juga mempengaruhi perubahan pembebanan, yang nilai bebannya dapat berubah-ubah baik secara acak maupun teratur.
2.5.1 Jenis-Jenis Air Conditoning 1. AC Split
Pada AC jenis split komponen AC dibagi menjadi dua unit yaitu unit indoor yang terdiri dari filter udara, evaporator dan evaporator blower, ekspansion valve dan controll unit, serta unit outdoor yang terdiri dari kompresor, kondenser, kondenser blower dan refrigeran
21
filter. Selanjutnya antara unit indoor dengan unit outdoor dihubungkan dengan 2 buah saluran refrigerant, satu buah untuk menghubungkan evaporator dengan kompresor dan satu buah untuk menghubungkan refrigeran filter dengan ekspansion valve serta kabel power untuk memasok arus listrik untuk kompresor dan kondenser blower.AC Split cocok untuk ruangan yang membutuhkan ketenangan, seperti ruang tidur, ruang kerja atau perpustakaan.
Kelebihan AC Split :
a. Bisa dipasang pada ruangan yang tidak berhubungan dengan udara luar,
b. Suara di dalam ruangan tidak berisik. Kekurangan AC Split :
a. Pemasangan pertama maupun pembongkaran apabila akan dipindahkan membutuhkan tenaga yang terlatih. b. Pemeliharaan / perawatan membutuhkan peralatan
khusus dan tenaga yang terlatih. c. Harganya lebih mahal.
2. AC Window
Pada AC jenis window, semua komponen AC seperti filter udara, evaporator, blower, kompresor, kondenser, refrigerant filter, ekspansion valve dan controll unit terpasang pada satu base plate, kemudian base plate beserta semua komponen AC tersebut dimasukkan kedalam kotak plat sehingga menjadi satu unit yang kompak. Biasanya dipilih karena pertimbangan keterbatasan ruangan, seperti pada rumah susun.
Kelebihan AC window :
a. Pemasangan pertama maupun pembongkaran kembali apabila akan dipindahkan mudah dilaksanakan.
b. Pemeliharaan / perawatan mudah dilaksanakan. c. Harga murah.
Kekurangan AC window :
a. Karena semua komponen AC terpasang pada base plate yang posisinya dekat dengan ruangan yang
b. didinginkan, maka cederung menimbulkan suara berisik (terutama akibat suara dari kompresor).
b. Tidak semua ruangan dapat dipasang AC window, karena AC window harus dipasang dengan cara bagian kondenser menghadap ketempat terbuka supaya udara panas dapat dibuang ke alam bebas.
3. AC Sentral
Pada AC jenis ini udara dari ruangan didinginkan pada cooling plant di luar ruangan tersebut, kemudian udara yang telah dingin dialirkan kembali kedalam ruangan tersebut. Biasanya cocok untuk dipasang di sebuah gedung bertingkat (berlantai banyak), seperti di hotel atau mall.
Kelebihan AC sentral :
a. Suara di dalam ruangan tidak berisik sama sekali Estetika ruangan terjaga, karena tidak ada unit indoor. Kekurangan AC sentral :
a. Perencanaan, instalasi, operasi dan pemeliharaan membutuhkan tenaga yang betul-betul terlatih.
b. Apabila terjadi kerusakan pada waktu beroperasi, maka dampaknya dirasakan pada seluruh ruangan. c. Pengaturan temperatur udara hanya dapat dilakukan
pada sentral cooling plant.
d. Biaya investasi awal serta biaya operasi dan pemeliharaan tinggi.
4. Standing AC
Jenis AC ini cocok dipergunakan untuk kegiatan-kegiatan situasional dan mobil karena fungsinya yang mudah dipindahkan, seperti seminar, pengajian outdoor dsb.[6]
23
BAB III
METODOLOGI PERCOBAAN 3.1 Peralatan dan Percobaan
Adapun pralatan dan percobaan yang di gunakan dalam praktikum kali ini adalah :
a. AC Split 1 set
b. Termometer Dry dan wet bulb c. Tabel termodinamika
d. Diagram Psikometrik (sea level) 3.2 Prosedur Praktikum
Adapun prosedur yang harus dilaksanakan padapercobaan kali ini adalah :
a. Disiapkan peralatan dan operasikan perangkaat AC split sesuai dengan petunjuk operasional
b. Heater pada duct AC lab unit diaktifkan sebesar 0,5kW dengan kecepatan putar fan sentrifugas 30 knop putar
c. Tunggu sampai stedi selama 3 menit, catat temperatur pada T1 (DB & WB)dan T2(DB & WB) (posisi T1
dan T2 ditentukan asisten)
d. Kecepatan putar fan diubah menjadi 35 knop putar dan 40 knop putar dan langkah pada poin ke-3 diulangi kembali. e. Langkah-langkah poin ke-3 dan ke-4 diulangi kembali
dengan mengubah heater pada duct AC lab unit menjadi 1kW
f. Laporan sementara disusun seperti pada forum pengambilan data dengan persetujuan asisten
Tabel 3.1 Tabel pengambilan data
Daya Heater Kecepata n Putar fan M
’ 1
TB1D T1W B T2D B T2W B 30 1. 0,5 kW 35 40 30 2. 1,0 kW 35 4025
BAB IV
ANALISA PERCOBAAN DAN PEMBAHASAN 4.1 Analisis percobaan
Berikut merupakan hasil analisa percobaan praktikum termodinamika P-1 :
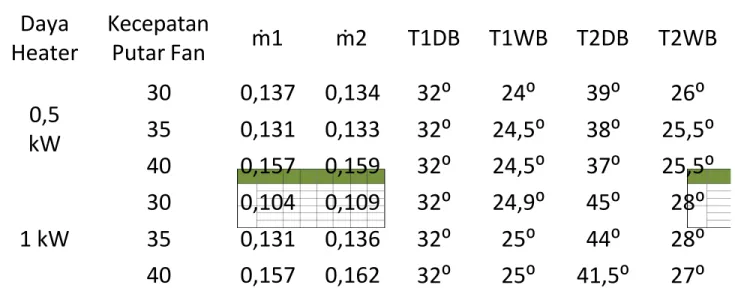
Tabel 4.1 Data Percobaan Praktikum 1
Daya Heater Kecepatan Putar Fan ṁ1 ṁ2 T1DB T1WB T2DB T2WB 0,5 kW 30 0,137 0,134 32⁰ 24⁰ 39⁰ 26⁰ 35 0,131 0,133 32⁰ 24,5⁰ 38⁰ 25,5⁰ 40 0,157 0,159 32⁰ 24,5⁰ 37⁰ 25,5⁰ 1 kW 30 0,104 0,109 32⁰ 24,9⁰ 45⁰ 28⁰ 35 0,131 0,136 32⁰ 25⁰ 44⁰ 28⁰ 40 0,157 0,162 32⁰ 25⁰ 41,5⁰ 27⁰
Tabel 4.2 Hasil Perhitungan Nilai Kalor dan Enthalpy
Daya Heater Kecepatan Putar Fan Enthalpy 1 (h1) Enthalpy 2 (h2) Kalor (Q) Kalor Rata-Rata (Q') 0,5 kW 30 73,127 80,41 0,76 0,73 35 74,214 78,141 0,67 40 74,214 78,188 0,78 1 kW 30 75,649 89,259 1,86 1,9 35 76,4 89,276 2,14 40 76,4 84,617 1,71 4.2 Pembahasan
Berikut merupakan pembahasan dari hasil analisis diatas adalah :
4.2.1 Aulia Mutiara Aminullah
Pada Praktikum Termodinamika P1 yang dilaksanakan di laboratorium Energi ,Jurusan Teknik Fisika Fakultas Teknologi Industri Institut Teknologi Sepuluh Nopember. Pada percobaan praktikum pertama praktikan dari kelompok 1 berjalan dengan lancar. Pertama-tama praktikan memulai praktikum ini dengan memaparkan tujuan praktikum ini dan prosedur percobaan yang akan dilakukan. Setelah itu praktikan melakukan percobaan menggunakan alat percobaan yang menunjang adanya percobaan ini yaitu AC unit. Setelah mengaktifkan alat tersebut dengan daya sebesar 0,5 Kw dengan kecepatan 30knop,35konp,40knop praktikan menunggu selama 3 menit kemudian dilanjutkan dengan mengamati temperature TDB dan TWB. Setelah selesai kemudian dilanjutkan dengan percobaan yang kedua dengan mengganti daya sebesar 1 Kw dan mengulangi langkah berikut sama dengan sebelumnya. Setelah didapatkan data
sebagai berikut kemudian praktikan menganalisa entalpi dan ṁ untuk menemukan nilai kalor pada percobaan tersebut. Pada percobaan ini kami menganalisa kesetimbangan massa dan energi yang terjadi pada volume atur pada keadaan tunak/ steady sate. Jadi aliran massa yang pada sisi keluar ,2, harus semua dengan pada sisi masuk ,1, ṁ1 = ṁ2 namun pada hasil analisa data yang didapat tidak sesuai dengan persamaan tersebut karena massa jenis yang didapat berbeda- beda. Hal ini juga mempengaruhi hasil kalor atau perpindahan panas. Seharusnya nilai kalor yang didapat lebih kecil dari daya yang sudah tertera pada AC unit namun dari hasil analisis diatas percobaan ini didapat kalor yang lebih besar. Ada beberapa hal yang menyebakan hal tersebut
terjadi pada percobaan ini salah satunya yaitu coil yang terdapat didalam AC unit ini sudah tidak layak (berkarat).
27
Sehingga panas yang ditimbulkan lebih besar. Kemudian besaran fisis yang memepengaruhi dalam percobaan ini yaitu perubahan iklim suatu daerah merupakan faktor yang sangat penting, karena dapat mempengaruhi kinerja (efisiensi) dan konsumsi listrik pada sistem tata udara. Kenaikan temperatur udara luar atau lingkungan akan menambah beban panas yang harus ditanggulangi oleh sistem tata udara. kenaikan temperatur udara luar/lingkungan berpengaruh besar terhadap kinerja secara keseluruhan. Salah satu contoh aplikasi yang sesuai dengan percobaan ini adalah nosel dan diffuser. Nosel dan diffuser merupakan peralatan lintasan aliran dengan luas penampang pada keduaa ujung yang berbeda. Pada aliran gas berkecepatan tinggi terbentuk dari bagian konvergen yang dikiuti dengan bagian divergen. Kerja pada alat tersebut adalah kerja aliran dimana massa masuk dan massa keluar volume atur. Perpindahan kalor terhadap sekeliling per satuan aliran massa melewati nosel dan diffuser sering kali kecil dibanding dengan perubahan entalpi dan energy kinetic sehingga dapat dihilangkan.
4.2.2 Roni Kusumah
Dari Praktikum Termodinamika P1 ini dilaksanakan Pada percobaan praktikum pertama menggunakan AC unit PA Hilton Setelah mengaktifkan alat tersebut dengan daya sebesar 0,5 Kw dengan kecepatan 30knop,35konp,40knop praktikan menunggu selama 3 menit kemudian dilanjutkan
dengan mengamati temperature TDB dan TWB. 4.2.3 Andi M Fathurrahman
Dalam prsktikum termodinamika pertam saya terdapat kesalahan yang terjadi yaitu wet bulb yang kering, dan alat yang digunakan untuk praktikum adalah AC Unit , dengan tujuan mengetahui suhu panas yang terjadi sebelum dan
sesudah coil dengan cara kerja mengaktifkan alat dan menyetel daya 0,5 Kw dengan kecepatan yang berbeda
–
beda yaitu 30, 35, 40 knop yang di diamkan selama 3 menitdan termometer dry bulb dan wet bulb di catat temperaturnya, pada percobaan kedua daya yang digunakan sebesar 1 kW dan mengulangi langkah langkah yang sama dengan sebelumnya.Setelah di dapatkan data dari kedua percobaan dicarilah entalpi dan ṁ untuk menemukan nilai kalor pada percobaan tersebut. Dan dapat di lahat dari data bahwa volume atur dalam keadaan steady state, intinya data yang didapat tak sesuai dengan persamaan sayang ada dikarenakan kalor yang di dapat lebih besaryang seharusnya nilai kalor yang di dapat seharusnya lebih kecil dari daya yang telah tertera pada AC unit.
29
BAB V PENUTUP 5.1 Kesimpulan
Adapun beberapa kesimpulan yang dapat dimbil dari percobaan ini yaitu :
1. Proses Termodinamis pada volume atur untuk sistem tertutup keadaan aliran steady. Pada keadaan steady kesetimbangan massa dan energi tidak bergantung pada waktu, sehingga massa dan energi pada sistem konstan. 2. Laju kalor yang dilepaskan oleh heating coil pada duct
AC unit lebih besar yaitu pada keadaan daya 0,5 kW sebesar 0,73 kJ dan pada daya 1 kW didapatkan kalor sebesar 1,9 kJ. Sehingga tidak sesuai dengan ketentuan sebenernya. Hal ini karena dipengaruhi oleh keadaan coil pada AC unit kurang memenuhi standart.
5.2 Saran
1. Saran untuk pembaca
Saran untuk pembaca terkadang hasil percobaan tidaklah selalu tepat dengan rumus atau teori yang ada karena saat percobaan masih sering menjumpai eror di komponen
yang terdapat didalam alat percobaan 2. Saran untuk praktikum kedepannya
a. Sebaiknya praktikan lebih banyak belajar lagi sebelum percobaan dimulai agar dapat melakukan percobaan lebih baik lagi serta dapat menjawab pertanyaan dari asisten dengan baik.
b. Sebaiknya praktikan lebih banyak mencari referensi dari sumber lain dan tidak hanya mengacu pada modul saja karena dengan mencari referensi yang lainnya dapat menambah wawasan praktikan.
c. Sebaiknya peralatan yang digunakan dalam percobaan selanjutnya lebih diperbaharui lagi karena pada percobaan saat ini peralatan yang digunakan masih kurang layak, salah satunya adalah coil yang terdapat didalam duct AC unit.
DAFTAR PUSTAKA [1] http://lib.ui.ac.id/file?file=digital/20308383-S42508-Sistem%20termodinamika.pdf [2]http://reocities.com/CollegePark/Dorm/1421/kuliah/Dasar_Refr igerasi/B2-Termodinamika_dan_Perpindahan_Panas.pdf [3]http://s3.amazonaws.com/academia.edu.documents/32474136/ Makalah_K.Fis_Kelompok_5.docx?AWSAccessKeyId=AKIAJ5 6TQJRTWSMTNPEA&Expires=1448561844&Signature=Ya1Cd HiKwCj%2FqhbihAGLLQ78xGw%3D&response-content-disposition=attachment%3B%20filename%3DMakalah_K_Fis_K elompok_5.docx [4]http://mirza.staff.ugm.ac.id/termo/TERMODINAMIKA.pdf [5]https://books.google.co.id/books?id=2jok6e5598wC&pg=PA15 6&lpg=PA156&dq=analisis+volume+atur&source=bl&ots=Xio-neHSNY&sig=6DRKQgtrEa7FWTPrXq9n3d63V1w&hl=en&sa =X&ved=0ahUKEwiEnYmjqLLJAhXQBI4KHRU8CPEQ6AEIL DAC#v=onepage&q=analisis%20volume%20atur&f=false [6]http://eprints.undip.ac.id/41112/3/BAB_II.pdf



![Gambar 2.5 Grafik isobarik [3]](https://thumb-ap.123doks.com/thumbv2/123dok/4164954.2837034/24.1167.347.744.328.716/gambar-grafik-isobarik.webp)