TINJAUAN PUSTAKA
Orangutan (Pongo pygmaeus wurmbii) TaksonomiMenurut Groves (2001) orangutan dapat dibedakan menjadi dua jenis yaitu orangutan sumatera dan orangutan kalimantan, perbedaan kedua jenis orangutan tersebut dilihat dari perbedaan morfologi dan genetika. Menurut taksonomi orangutan termasuk dalam kingdom Animalia, phylum Chordata, kelas Mammalia, ordo Primata, family Pongidae, Genus Pongo, termasuk jenis Pongo pygmaeus. Menurut Warren et al. (2001); Arora et al. (2010) orangutan
kalimantan dibagi kembali menjadi tiga anak jenis berdasarkan perbedaan genetika. Tiga anak jenis orangutan Kalimantan juga menempati daerah persebaran yang berbeda yaitu Pongo pygmaeus pygmaeus (Kalimantan Barat dan
Serawak), Pongo pygmaeus wurmbii (Kalimantan Tengah dan Kalimantan Barat)
dan Pongo pygmaeus morio (Kalimantan Timur dan Sabah).
Morfologi
Orangutan merupakan jenis kera besar yang hampir seluruhnya ditutupi oleh rambut kecuali bagian wajah, telapak tangan dan telapak kaki. Menurut Napier & Napier (1967); MacKinnon (1974); van Schaik et al. 2009 orangutan
mempunyai memiliki warna rambut jingga sampai merah kecokelatan sesuai dengan pertambahan umur. Rambut pada orangutan kalimantan berwarna kecokelatan dan akan berkembang menjadi cokelat gelap sesuai pertambahan umur. Umumnya bentuk rambut pada orangutan keras, kaku dan lebih rapuh dengan ujung rambut pecah, untuk membedakan individu yang telah dewasa dapat dilihat rambut pada bagian tangan dan punggung yang lebih panjang dan berwarna gelap (Gambar 1).
Bentuk muka orangutan kalimantan lebih bulat, selain itu orangutan jantan dewasa pada bagian pipi dapat mengalami pelebaran karena adanya penebalan otot yang disebut dengan bantalan pipi (cheek pad). Pada orangutan jantan dan
betina terdapat kantong suara pada bagian leher yang berguna untuk mengeluarkan seruan panjang (long call), namun kantong suara pada orangutan
betina ini belum diketahui fungsinya (Galdikas 1985; Setia et al. 2009). Menurut
Galdikas (1985) orangutan betina mengeluarkan seruan yang hampir sama dengan seruan panjang yang biasa dikeluarkan jantan dewasa, tetapi tanpa jeritan yang bergelombang. Seruan ini pernah dilakukan oleh betina dewasa pada waktu berselisih dengan anak yang sedang dalam proses penyapihan dan seruan dapat terdengar dari jarak sejauh 400 m. Ukuran tubuh jantan dewasa berbantalan pipi (flanged) dua kali lebih besar dari pada betina yaitu dengan berat tubuh jantan
berkisar antara 50-90 kg, sedangkan berat tubuh orangutan betina berkisar 30-50 kg.
Pada orangutan betina dewasa selama masa subur tidak terlihat perubahan fisik yang nyata, tetapi memasuki masa kebuntingan dapat diketahui dengan terlihatnya pembengkakan yang kecil tetapi jelas seperti memutihnya daerah perineal serta diikuti semakin besarnya puting susu dan diakhiri semakin besarnya daerah perut (Schurmann 1982). Di Tanjung Puting setiap individu betina yang
akan melahirkan menunjukkan pembengkakan bagian perineal yang sedikit demi sedikitnya pada saat beberapa bulan sebelum kelahiran (Galdikas 1985).
a. b.
c.
Gambar 1 : Morfologi orangutan (Pongo pygmaeus wurmbii) a) Flanged male,
b)betina dewasa dan anak, c) betina dewasa bunting (pembengkakan perineal, perut dan puting susu) (Mardianah 2009).
Distribusi dan Status Konservasi
Orangutan banyak ditemukan di areal hutan hujan tropis yang merupakan habiat utama orangutan yaitu mulai dari dataran rendah, rawa gambut hingga hutan pegunungan. Kepadatan yang terbesar ditemukan pada tipe habitat hutan dataran rendah sekitar areal sungai dan hutan rawa gambut. Di Kalimantan orangutan dapat ditemukan pada ketinggian 500 m dpl, sedangkan orangutan sumatera dilaporkan dapat mencapai hutan pegunungan dengan ketinggian 1.000-1.500 m dpl (Soehartono 2007; Arora et al. 2010). Faktor ketinggian
menggambarkan ketersediaan pakan. Keberadaan buah-buahan berdaging semakin menurun tajam pada tempat yang lebih tinggi, selain itu suhu yang dingin dan curah hujan yang tinggi merupakan suatu tekanan bagi orangutan untuk bertahan hidup.
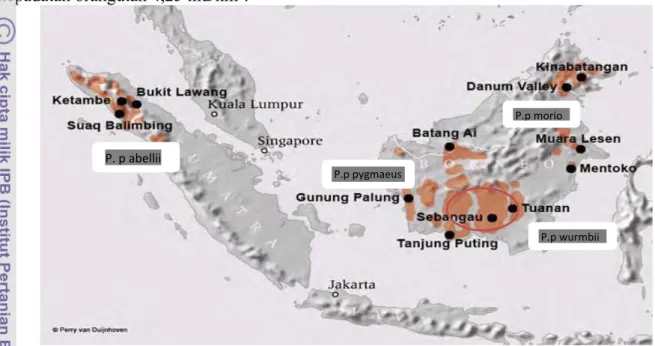
Orangutan di Kalimantan dapat ditemukan di hutan hujan primer mulai dari rawa dataran rendah dan hutan rawa di Sabah, bagian barat daya Serawak, Kalimantan Timur, serta bagian barat daya Kalimantan antara Sungai Kapuas dan Sungai Barito (Gambar 2). Jumlah populasi orangutan yang semakin berkurang dari tahun ke tahun menyebabkan orangutan dijadikan sebagai salah satu satwa dengan kategori ‘flagship species’ yang menjadi suatu simbol untuk
meningkatkan kesadaran konservasi. Kelestarian orangutan juga menjamin kelestarian hutan yang menjadi habitatnya dan kelestarian mahluk hidup lainnya.
Orangutan di Indonesia berdasarkan surat keputusan Menteri Kehutanan No. 522/kpts-II/1997 merupakan jenis satwa yang dilindungi penuh dan dilarang untuk ditangkap, dibunuh, dipelihara, dan diperdagangkan baik dalam keadaan hidup maupun mati. Orangutan juga dilindungi hukum internasional, berdasarkan IUCN, orangutan kalimantan termasuk satwa yang terancam punah (endangered)
(Soehartono et al. 2007). Menurut van Schaik (2005) jumlah populasi orangutan
kalimantan di areal SPOT dengan luas area sebesar 2.730 km2 memiliki rata-rata kepadatan orangutan 4,25 ind/km2.
Gambar 2 : Persebaran orangutan di Kalimanatan dan Sumatera, serta Stasiun Penelitian Orangutan Tuanan(van Schaik et al. 2005)
Biologi dan Siklus Menstruasi
Orangutan memiliki siklus bereproduksi, dimulai dari masa pubertas atau dewasa kelamin, siklus menstruasi dan masa subur. Menurut hasil penelitian sebelumnya menyatakan bahwa tingkat reproduksi pada orangutan sangat rendah. Menurut Wich et al. (2009); Knott et al. (2009) orangutan betina liar yang berada
di Kalimantan memasuki masa pubertas atau mampu memiliki keturunan pertama kali pada umur 14-16 tahun dengan jarak kelahiran inter birth interval (IBI) 6-8
tahun, sedangkan orangutan jantan pada umur 10 tahun mulai terlihat sifat-sifat reproduksi sekunder dan mulai melakukan perilaku reproduksi (Delgado & van Schaik 2000; Knott et al. 2009). Orangutan memiliki tingkat reproduksi yang
rendah dengan lama kebuntingan 8-9 bulan dan setiap kelahiran orangutan hanya melahirkan satu anak. Selama masa hidupnya orangutan betina hanya mampu melahirkan 3-5 anak dan anak mulai tidak menyusu pada umur 5-6 tahun, kemudian anak akan hidup mandiri atau lepas dari pengawasan induk setelah berumur 7–15 tahun untuk anak jantan dan umur 7-12 tahun untuk anak betina (Wich et al. 2009; Knott et al. 2009). Orangutan yang memasuki masa pubertas
ditandai dengan melakukan proses pemilihan pasangan.
Orangutan yang berada di dalam pemeliharaan atau captive (kebun
binatang ataupun rehabilitasi) memasuki masa pubertas dan mampu mempunyai keturunan pertamakali jauh lebih muda dibandingkan orangutan liar, disebabkan
P.p pygmaeus
P.p wurmbii P.p morio
faktor habitat dan pemenuhan nutrisi yang tercukupi (van Schaik 2006). Orangutan jantan yang berada di captive akan memasuki masa pubertas pada
umur kurang lebih 8-9 tahun, sedangkan orangutan betina akan memasuki masa pubertas pada umur 6 tahun dengan jarak kelahiran inter birth interval (IBI) 5-6
tahun (Delgado & van Schaik 2000; Wich et al. 2009; Knott et al. 2009).
Sama seperti jenis kera lainya orangutan juga mengalami siklus mestruasi (Gamabr 3). Menurut Maple (1980) dan Dixson (1998) siklus menstruasi pada orangutan kurang lebih 26-37 hari dengan lama waktu menstruasi 3-4 hari sama dengan jenis kera besar lainnya, tetapi lebih atau kurang tergantung dari mekanisme hormonal yang mempengaruhi siklus menstruasi (Dunbar 1988; Dixson 1998). Pada primata regenerasi penghancuran endometrium dengan pendarahan kurang lebih dua minggu setelah ovulasi (Singer 2000; Nelson 2005).
Menstruasi terjadi setelah proses ovulasi dimana terbentuk korpus luteum menyebabkan peningkatan hormon progresteron sehingga terjadi penebalan pada dinding endometrium, apabila tidak terjadi kebuntingan atau fertilisasi maka korpus luteum akan mengalami regresi sekitar 4 hari sebelum menstruasi dan diikuti oleh proses pendarahan. Pada akhir mestruasi semua lapisan endometrium terlepas kecuali lapisan dalam (Nelson 2005).
Pada orangutan berakhirnya siklus menstruasi akan diikuti dengan masa subur/fertil adalah masa pematangan sel telur sampai dengan pelepasan sel telur menuju tuba falopii (ovulasi). Perubahan perilaku orangutan betina yang sedang subur ditandai dengan meningkat ketanggapan (reseptivitas) atau kesediaan seks
(proreseptivitas) terhadap kehadiran individu jantan (Galdikas 1985; Atmoko et
al. 2009). Lama masa fertil/subur pada orangutan antara 2-3 hari satu hari setelah proses ovulasi. Ovulasi diperkirakan terjadi pada pertengahan siklus menstruasi, yaitu antara hari ke 11-13 (Disxon 1998; Nelson 2005).
Gambar 3 : Siklus menstruasi pada primata (Nelson 2005).
Interaksi Sosial Orangutan
Interaksi sosial dilakukan sebagai suatu usaha individu untuk menjaga kelangsungan hidup dan mencapai sukses dalam bereproduksi, di dalam hubungan interaksi antar individu orangutan terjadi suatu tanggapan dari dua atau lebih
satuan individu orangutan di lokasi yang sama < 50 m (Dunbar 1988; van Schaik 2006). Interaksi sosial dimulai saat suatu individu melakukan perjumpaan antara dua atau lebih individu orangutan yang salah satu atau kedua-duanya saling melihat, mengacuhkan, saling menyerang dan bermain. Beberapa aktifitas sosial yang teramati diantaranya adalah menelisik atau mengutui, perilaku berpasangan (consortship), kopulasi, dan mengasuh anak. Interaksi sosial dapat terjadi hampir
pada setiap individu orangutan kecuali pada sesama jantan dewasa sangat jarang teramati (Galdikas 1985; van Schaik 2006). Berikut adalah aktifitas sosial dan interaksi sosial yang terjadi pada orangutan meliputi:
1. Aktifitas sosial a. Pemilihan pasangan
Perilaku reproduksi pada orangutan dimulai dari proses pemilihan pasangan, saat satu individu memasuki dewasa kelamin ditunjukan dengan perubahan perilaku. Orangutan betina remaja yang telah memasuki dewasa kelamin akan menunjukan ketertarikannya pada individu jantan yaitu memamerkan organ genital atau sampai mendorong dirinya (van Schaik 2006). Menurut Galdikas (1985); van Schaik (2006) orangutan jantan dewasa yang memasuki dewasa kelamin juga menunjukan perubahan perilaku, yaitu mulai mendekati individu betina dan mengikuti individu betina pada jarak tertentu (consortship).
Faktor penting yang harus diperhatikan dalam proses pemilihan pasangan pada orangutan adalah status sosial dan umur (Dixson 1998; Atmoko et al. 2009;
Knott et al. 2009). Pada saat proses pemilihan pasangan individu betina lebih
memilih berpasangan dan kopulasi dengan individu jantan dewasa berpipi. Manfaat yang didapatkan oleh individu betina tersebut diantaranya adalah manfaat genetik, dimana anak akan mendapatkan gen-gen terbaik yang berasal dari individu jantan (van Schaik & van Hooff 1996; van Schaik 2006; Atmoko et al.
2009b). Strategi yang dilakukan oleh individu jantan dewasa berpipi untuk mendapatkan individu betina salah satunya dengan cara mengeluarkan long call
yang berfungsi untuk menarik perhatian individu betina yang berada di sekitarnya, sedangkan jantan dewasa tidak berpipi cenderung berjalan jauh memperluas daerah jelajah untuk bertemu dengan betina yang siap kawin (Delgado & van Schaik 2000; Atmoko et al. 2009a; Setia et al. 2009). Betina reproduktif biasanya
akan memberikan respon positif setelah mendegar long call. Hal ini terlihat dari
perubahan perilaku betina tersebut, yaitu mendekati long call namun pada betina
yang sedang membawa anak cenderung memberikan respon menghindari long call (Galdikas 1985; Atmoko et al. 2009a).
Menurut Galdikas (1985) dan Atmoko et al. (2009b) sikap penolakan
dalam hubungan berpasangan yang dilakukan orangutan betina merupakan usaha betina untuk mengurangi usaha kopulasi jantan. Hal ini karena akan mempengaruhi aktifitas betina seperti makan, berjelajah dan menyusui bayi. Pada saat terjadi hubungan seksual antara jantan dewasa dengan betina dewasa yang mempunyai anak, sering terlihat perlawanan yang dilakukan anak terhadap jantan yang ingin melakukan hubungan seksual dengan induknya (Galdikas 1985; Atmoko et al. 2009b).
b. Hubungan berpasangan (consortship)
Orangutan betina yang memasuki masa subur terlihat lebih sering bersama individu jantan yang disebut hubungan berpasangan (consortship) yaitu hubungan
kebersamaan antara individu jantan dan betina yang berlangsung beberapa hari hingga beberapa minggu, selama proses ini terjadi akan diselingi dengan beberapa kali kopulasi (Galdikas 1985; Atmoko et.al 2000). Hubungan berpasangan
tergantung dari masa estrus individu betina, hubungan ini sangat penting untuk menentukan keberhasilan kopulasi karena akan terjadi peningkatan frekuensi kopulasi (Atmoko et al. 2009b; Setia et al. 2009). Orangutan jantan dewasa selalu
kembali ke betina pasangannya pada waktu betina siap kawin kembali untuk memastikan kebuntingan dan keturunanya (Schurmann 1982; Galdikas 1985; Atmoko et al. 2009b). Hubungan berpasangan yang terjadi antara jantan dan
betina tidak hanya terjadi pada satu individu yang sama tetapi dilakukan dengan beberapa individu yang berbeda.
c. Kopulasi
Perilaku kopulasi terjadi peningkatan setelah berakhirnya siklus menstruasi dan diikuti dengan masa subur/fertile. Orangutan betina yang sedang memasuki masa estrus akan menunjukan ketanggapan atau kesediaan seks terhadap jantan. Ketanggapan seks (reseptivitas) ialah kesediaan betina untuk
melakukan kopulasi sedangkan kesediaan seks (proseptivitas) ialah semua
perilaku yang dilakukan betina untuk memulai interaksi seks (Galdikas 1985). Perilaku orangutan betina yang sedang birahi sama dengan jenis monyet atau kera lainnya yaitu berinteraksi dengan individu jantan untuk memamerkan atau memperlihatkan organ genitalnya di depan individu jantan yang diharapkan (Rijksen 1978; Galdikas 1985; Fox 2002; van Schaik 2006). Selain itu melekatkan organ genitalnya ke organ genital jantan dan membuat gerakan menusuk-nusuk (intromisi). Berdasarkan hasil penelitian Fox (2002) bentuk kopulasi dibedakan
dalam dua golongan, yaitu: suka sama suka dan pemaksaan. Sementara itu Shurmann dan van Hoof (1986); Fox (2002) menambahkan dengan memasukan bentuk kopulasi setengah kerjasama.
c.1. Suka sama suka (betina aktif)
Kopulasi suka sama suka atau aktif adalah kopulasi yang ditandai dengan adanya inisiatif kedua individu mengadakan kopulasi dan lebih sering terjadi dalam hubungan berpasangan (consortship). Menurut Fox (2002), kopulasi suka
sama suka atau aktif adalah kopulasi yang dimulai dari inisiatif individu betina untuk mengawali terjadinya proses kopulasi sedangkan individu jantan bersifat melayani individu betina. Bentuk kopulasi ini lebih sering terjadi di dalam proses hubungan berpasangan (consorthsip).
c.2. Pemaksaan (pemerkosaan)
Kopulasi pemaksaan adalah ditandai dengan adanya perlawanan yang dilakukan individu betina terhadap usaha individu jantan (Fox 2002). Menurut MacKinnon (1974); Galdikas (1984); Fox (2002), pemaksaan terjadi apabila individu jantan berusaha mencoba kopulasi dengan individu betina namun betina berusaha menolak bahkan melakukan perlawanan terhadap usaha jantan tersebut. Perlawanan tersebut bervariasi dalam intensitas maupun lamanya, dari pergulatan yang pendek sambil menjerit, mendorong dan memukul jantan sampai perkelahian keras. Intensitas waktu perlawanan yang dilakukan betina sepanjang waktu kopulasi meneriakkan gerutuan dan mengigit jantan kapan saja ada berkesempatan.
c.3. Kopulasi setengah kerjasama (betina pasif)
Menurut Fox (2002) kopulasi setengah kerjasama ini ditandai dengan pasifnya individu betina terhadap usaha individu jantan, namun tidak ada perlawanan yang ditunjukan individu betina terdapat usaha individu jantan. adanya inisiatif jantan, sedangkan betina tidak mengiginkan terjadinya proses kopulasi namun tidak ada perlawanan yang dilakukan oleh betina atas tindakan yang dilakukan jantan. Menurut Fox (2002), inisiatif yang dilakukan dalam memulai kopulasi setengah kerjasama biasanya jantan lebih mengarahkan posisi kopulasi betina. Kopulasi setengah kerjasama ini banyak terjadi antara individu jantan dewasa tidak berpipi dengan betina dewasa atau betina remaja (Fox, 2002). 2. Hubungan antar individu lain
Bentuk hubungan antar individu orangutan yang sesama jenis kelamin terlihat dalam bentuk agresi, agonistik dan pengelompokan sosial, sedangkan hubungan sosial antar individu orangutan yang berbeda jenis kelamin bertujuan melakukan hubungan sosial reproduksi. Agresi adalah bentuk pamer kemarahan dengan cara menyerang atau pengejaran. Agonistik merupakan bentuk sikap tindak ketidak senangan akan kehadiran individu lain. Kedua peristiwa tersebut terjadi karena perebutan daerah kekuasaan dan perebutan individu betina yang tanggap dan sedia seks (estrus) (van Schaik & van Hooff 1996; Delgado & van Schaik 2000; Atmoko et al. 2009a). Hubungan antar individu kelamin sejenis
dapat terjadi pada:
a. Hubungan betina dengan betina
Bentuk interaksi sosial yang terlihat pada sesama individu betina diantaranya adalah agresi, agonistik dan pengelompokan sosial. Tingkat persaingan antara individu betina dewasa dapat dilihat dari kedekatan kekerabatan suatu individu, perbedaan umur individu betina dan banyaknya jantan dewasa yang bersedia kawin dengan betina tersebut. Berdasarkan kekerabatanya maka dibedakan menjadi dua kelompok yaitu:
a.1. Hubungan betina yang tidak berkerabat
Interaksi antar individu betina dengan kekerabatan yang jauh yaitu interaksi sosial agresi dan agonistik. Kedua peristiwa tersebut terjadi disebabkan adanya usaha perebutan daerah kekuasaan dan sumber pakan yang ada (van Schaik & van Hooff 1996; Delgado & van Schaik 2000; Singleton et al. 2009).
Individu betina remaja lebih cenderung menghindar diri dari kehadiran betina dewasa, baik yang sedang membawa anak maupun betina dewasa yang tidak bawa anak. Perbedaan status pada individu betina di satu tempat yang sama menimbulkan rasa takut untuk melakukan perjumpaan (Galdikas 1985; van Schaik & van Hooff 1996; Setia et al. 2009). Secara fisiologis interaksi sosial yang
terjadi antar sesama jenis kelamin dapat menyebabkan peningkatan kadar hormon stres suatu individu (Smith & French 1997; Nelson 2005).
a.2. Hubungan betina yang berkerabat
Interaksi hubungan sosial antar individu betina yang memiliki kekerabatan dekat akan terlihat hubungan kerjasama yang baik. Mereka dapat bergerak bersama-sama mencari makan dengan tingkat persaingan yang rendah (van Schaik 2006; Singleton et al. 2009). Hubungan interaksi antara anak orangutan yang
memasuki masa remaja dengan induknya terkadang masih sering terlihat karena anak masih membayangi induk betina pada jarak tertentu dan mulai berani mendekati individu betina lainnya.
b. Hubungan antar individu betina dengan individu jantan
Hubungan antar individu betina dengan individu jantan bersifat sosial reproduksi dimana tujuannya adalah mencapai sukses bereproduksi. Individu betina merupakan penentu pengambil keputusan dalam usaha sukses reproduksi. Perbedaan status sosial pada individu jantan merupakan pertimbangan individu betina dalam pengambil keputusan. Individu betina lebih memilih berpasangan dengan individu jantan dominan untuk mendapatkan keuntungan dari individu jantan pasangannya diantaranya adalah askes mendapat makanan dan perlindungan dari individu lain. Hubungan antar individu betina dengan individu jantan dimulai dari proses pemilihan pasangan, hubungan berpasangan dan berakhir pada proses kopulasi.
c. Hubungan sosial ibu dan anak
Hubungan sosial ini merupakan hubungan sosial yang konsisten setelah pengelompokan berpasangan (Rodman & Mitani, 1987; Galdikas, 1984). Proses pembelajar dan bermain bersama terjadi di dalam hubungan tersebut (Singleton et al. 2009). Menurut Atmoko (1991); Fox (2002) hubungan kopulasi yang terjadi
pada individu betina yang membawa anak, sering telihat perlawanan yang dilakukan oleh individu anak terhadap usaha individu jantan yang ingin melakukan hubungan kopulasi dengan induknya. Perlawanan ini ternyata lebih efektif, karena jantan dewasa merasa terganggu
Konsep Stres
Menurut Smith dan French (1997); Nelson (2005) stres merupakan keadaan biologis, emosional dan tingkah laku yang tidak spesifik, tetapi dapat mengganggu ataupun mengancam keselamatan. Gejala stres terlihat sebagai gangguan psikologis, emosi maupun kegelisahan (Smith & French 1997). Berdasarkan perbedaan waktu stres dapat dibagi menjadi tiga yaitu stres jangka pendek ditandai dengan terjadi peningkatan denyut jantung, ketegangan otot dan perpendek pernafasan; stres jangka panjang dengan gejala berkurangnya nafsu makan, gangguan pencernaan, kulit serta penurunan libido; stres internal dengan gejala yang muncul ketakutan, ketidak mampuan berkonsentrasi. Penyebab stres (stresor) berasal dari situasi lingkungan, rangsangan atau kejadian yang mampu
menganggu dan mengancam keselamatan makhluk hidup (Guyton & Hall 1996). Stres merupakan respon hasil interaksi hewan atau manusia dengan lingkungannya yang menyebabkan jiwa selalu berada dalam posisi siap untuk melawan (fight) atau lari (Smith & French 1997; Fowler 1999). Smith dan French
(1997); Nelson (2005) menyatakan beberapa sumber stres terjadi karena perubahan kehidupan, perkelahian, tekanan lingkungan dan ketegangan merupakan sumber utama timbunya stres. Menurut Fowler (1999) akibat stres yang berlangsung lama berimplikasi pada penurunan dari sistem imun, sistem syaraf, dan sistem endokrin di dalam tubuh. Respon endokrin terhadap stres muncul pada saat impuls syaraf simpatik menstimulir kelenjar adrenal. Kelenjar endokrin melepaskan katekolamin (adrenalin dan noradrenalin) ke dalam aliran darah. Kemudian hipotalamus menstimulir hipofisa anterior untuk melepaskan ACTH sehingga terjadi peningkatan glukokortikoid yang membatu peningkatan suplai energi terutama pada saat keadaan bahaya atau terancam (Guyton & Hall 1996; Nelson 2005).
Biosintesis Hormon Steroid
Berdasarkan organ targetnya hormon steroid terbagi menjadi dua sub kelompok yaitu hormon seksual (progestrin dan estrogen) dan homon adrenal. Pada kolesterol struktur kerangka C-27 berasal dari Acetyl-CoA yang telah mengalami serangkaian proses yaitu diawali dengan pembentukan asetat menjadi mevalonat dengan bantuan enzim HMG-CoA reduktase yang kemudian diubah menjadi squalane dan dilanjutkan dengan lanosterol. Selanjutnya, lanosterol diubah menjadi kolesterol sebagai produk dengan mengambil tiga gugus karbon. Kolesterol banyak terdapat di membran sel yang merupakan salah satu komponen terpenting bagi kelangsungan hidup sel, selain itu kolesterol juga sebagai prekursor hormon steroid (Litwack &Schmidt 2002; Steimer 2003).
Biosintesis hormon steroid dimulai dari pengubahan kolesterol menjadi pregnenolon. Pengaturan biosintesis hormon steroid disebabkan oleh peningkatan cAMP intraseluler atau Ca2+ melalui inositol trifosfat. Rangsangan pada cAMP dapat bersifat akut atau kronis (beberapa jam sampai hari). Rangsangan dimulai sejak pengiriman kolesterol ke dalam inner mitokondria dengan perantara
steroidogenic acute regulatory (StAR), sedangkan rangsangan kronis terjadi pada
saat pengubahan kolesterol menjadi pregnanolon (Gambar 4). Pada keadaan tersebut proses konversi berlangsung di dalam mitokondria dengan bantuan enzim
side chain cleavage (SCC), NADPH, oksigen dan sitokrom P450 sesuai
kebutuhan. Fungsi Ca2+ pada proses ini adalah sebagai peningkat enzim SCC (Litwack &Schmidt 2002).
Gambar 4. Mekanisme kerja hormon steroid pada target (Steimer 2003)
Reseptor hormon steroid terletak di dalam sitoplasma sel, berbeda pada hormon protein yang berada di dinding sel. Tahap pertama hormon masuk ke dalam sel secara difusi dan segera berikatan dengan reseptor protein spesifik di dalam sitoplasma. Reseptor hormon steroid secara inaktif dipelihara dalam suatu
heat shock protein 90 (HSP 90). Apabila terjadi ikatan antara hormon dan
reseptor, maka HSP 90 menjadi aktif dan segera melepaskan diri. Selanjutnya ikatan hormon dan reseptor segera menuju ke nucleus (Gambar 4). Pada saat di
dalam nukleus terjadi ikatan kompleks antara hormon dan reseptor yang mempengaruhi koaktivator dan faktor transkripsi secara menyeluruh untuk menghasilkan kompleks transkripsional aktif yang kemudian akan meningkatkan ekspresi target gen dan menimbulkan efek hormon steroid (West 1991; Kuiper et al. 1998).
Biositesis Glukokortikoid
Hormon glukokortikoid merupakan hormon steroid yang disintesis dari kolesterol dan diproduksi oleh kelenjar adrenalis bagian korteks. Hormon disekresikan oleh organ endokrin yang diatur oleh hipotamus dan syaraf pusat. Korteks adrenal mensintesis molekul steroid yang dibagi menjadi tiga kelompok hormon yaitu glukokortikoid, mineralkortikoid dan androgen dengan zona atau lapisan penghasil yang berbeda-beda. Glukokortikoid berfungsi mengatur metabolisme karbohidrat, mineralokortikoid berfungsi mengatur kadar cairan (natrium dan kalium) di dalam tubuh dan androgen yang fungsinya hampir sama dengan hormon steroid yang dihasilkan oleh gonad jantan. Korteks adrenal terdiri dari 3 bagian utama yaitu zona glomerulosa, zona fasciculata, dan zona reticularis (Guyton 1996; Nelson 2005).
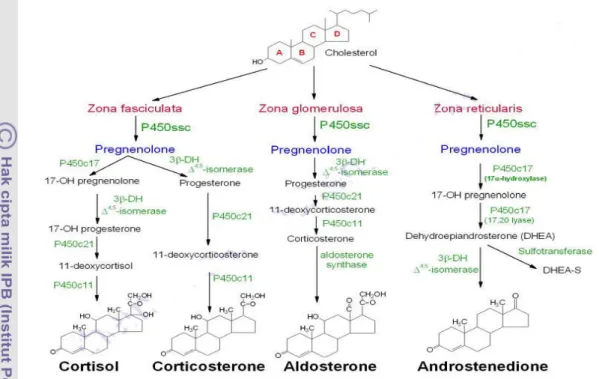
Menurut Martin dan Crump (2003); King (2009) pada setiap zona di korteks adrenal memiliki kesamaan dimana jalur utama yang dilewati untuk proses sintesis yaitu kolesterol diubah menjadi pregnenolon yang dibantu oleh enzim sitokrom P450 (CYP). Produk akhir yang dihasilkan oleh hormon steroid tergantung pada enzim yang berada di dalam sel masing-masing zona (Gambar 5). Kolesterol yang akan diubah menjadi pregnenolon di dalam korteks adrenal harus diangkut ke dalam mitokondria di mana CYP11A1. Proses transportasi dibantu oleh protein regulator akut steroidogenik (StAR).
Menurut King (2009) konversi prenenolone untuk progesteron memerlukan dua kegiatan enzim HSD3B2: dehidrogenase 3β-hidroksisteroid dan Δ4,5-isomerase. Zona glomerulosa membutuhkan enzim P450c17 yang mengubah pregnenolon dan progesteron untuk C17 analog dihidroksilasi. Dengan demikian, jalur glukokortikoid (deoxycortisol dan kortisol) dan androgen (dehydroepiandosterone (DHEA) dan androstenedione) di simpan di dalam sel. Zona glomerulosa mengandung enzim yang bertanggung jawab untuk mengkonversi corticosterone untuk aldosteron. Pregnenolone yang dihasilkan di zona fasciculate akan diubah menjadi dua produk yang dibantu oleh dua enzim yang berbeda yaitu 17-OH pregnenolone dibantu enzim P450c17 dan progresteron dibantu enzim 3β-DH∆45-isomer. Progresteron kemudian mengalami biositesa menjadi 11-deoxycorticosterone dibantu dengan enzim P450c21 yang kemudian dikonversikan menjadi corticosterone (Martin & Crump 2003).
Menurut Martin dan Crump (2003); King (2009) pada 17-OH pregnenolone diubah lebih dahulu menjadi 17-OH progresteron kemudian dilanjutkan menjadi 11-deoxycortison yang dibantu dengan kerja enzim. Selanjutnya, 11-deoxycortison akan dikonversikan menjadi cortisol. Pada zona reticularis, pregnenolone yang telah dihasilkan akan diubah menjadi 17-OH pregnenolone yang selanjutnya akan diubah menjadi Dehydroepiandrosterone (DHEA) proses ini dibantu oleh enzin P450c17 (17αhydroxylase dan 17,20 lyase).
Enzim 3β-DH∆45-isomer membantu proses konversi Dehydroepiandrosterone menjadi Adrostenedione.
Gambar 5 : Biosintesis perubahan kolesterol menjadi hormon steroid di korteks adrenal (Martin & Crump 2003; King 2009).
Sekresi Hormon Glukokortikoid
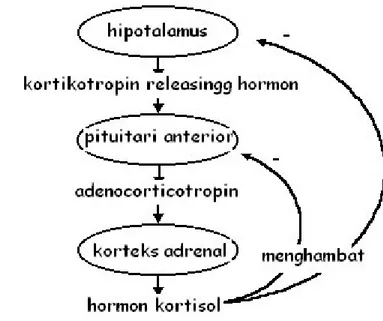
Hormon adalah senyawa yang yang secara normal dikeluarkan oleh kelenjar endokrin atau jaringan tubuh dan dilepaskan ke pembuluh darah menuju jaringan sasaran, berinteraksi secara selektif dengan reseptor khas dan menunjukkan efek biologis. Smith dan French (1997); Nelson (2005) menyatakan bahwa respon stres dipengaruhi oleh sistem endokrin di dalam hipotalamus dan kelenjar hipofisis. Tubuh mempunyai kemampuan fisiologis untuk beradaptasi terhadap kondisi stres. Respon neuroendokrin terhadap stres terjadi pada saat implus syaraf simpatik dari hipotalamus menstimulir kelenjar endokrin segera melepaskan katekolamin (epinepbrin/adrenalin dan noradrenalin) ke dalam aliran darah. Sekresi adreno corticotropic hormone (ACTH) diatur secara umpan balik
oleh steroid yang beredar (Gambar 6). Hormon stres bebas berada di dalam darah dan memiliki umpan balik negatif terhadap pelepasan corticotrophin releasing hormone (CRH) dari hipotalamus terhadap kortikotrof hipofisis (Gambar 6).
Penurunan CRH melalui vena-vena portal hipofisis ke hipofisis anterior akan meningkatkan sekresi ACTH. Respon CRH terhadap umpan balik negatif mengikuti irama diurnal, sehingga pada pagi hari ACTH dan hormon stres dalam jumlah yang lebih besar dan lebih kecil pada malam hari, namun dalam keadan stres baik fisik maupun psikis seperti nyeri, ketakutan, operasi, infeksi, latihan fisik, trauma, hipoglikemia atau tumor otak dan obat-obatan seperti kortikosteroid, hipnotik, irama kadar hormon dapat berubah (Ganong 1983; Guyton 1991; Ackerman 1996).
Gambar 6: Sekresi hormon glukokortikoid (Nelson 2005).
Menurut Nelson (2005) menyatakan bahwa hormon steroid pada korteks adrenal dan medulla berperan dalam suatu respon fisiologi terhadap keadaan darurat. Indikator stres dapat dilihat dari peningkatan kadar hormon stres yang terjadi pada pagi hari dan mencapai titik terendah pada malam hari. Beredarnya hormon stres dalam darah kurang lebih 10% dan sisahnya akan berikatan di dalam trancortin maupun albumin yang kemudian akan dihancurkan dalam beberapa jam setelah berada di dalam organ target. Steroid adrenal akan didegradasi di dalam hati dan dikonjugasikan dalam bentuk glukoronida dan sulfat, 25% dari jumlah tersebut akan dieksresikan ke dalam empedu sampai dikeluarkan memalalui feses ataupun urine. Hormon yang telah terkonjugasi mempunyai sifat yang tidak aktif (inaktivasi).
Metabolisme dan Ekskresi Hormon Glukokortikoid
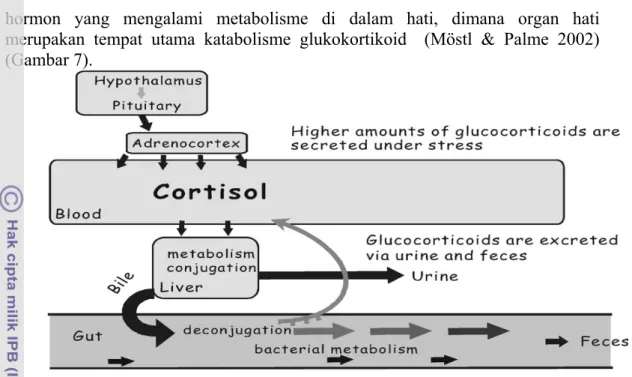
Hormon yang telah di sekresikan akan beredar ke seluruh tubuh melalui aliran darah karena hormon tidak memiliki saluran khusus dan secara lemah berikatan dengan protein. Pada waktu tertentu hormon akan dipecah menjadi senyawa tidak aktif dan selanjutnya dieksresikan dari dalam tubuh dalam bersama feses dan urin (Möstl & Palme 2002). Hormon yang tidak terikat di dalam jaringan juga akan diubah di dalam hati sebelum dieksresikan melalui usus dan ginjal (Guyton & Hall 1996).
Pendeteksi suatu hormon dapat dilakukan melalui plasma/serum, feses, urin ataupun saliva (Brook & Marshall 1996; Möstl & Palme 2002). Konsentrasi hormon dengan menggunakan saliva memiliki pola yang sama dengan konsentrasi hormon dengan menggunakan plasma, namun konsentrasi saliva lebih kecil dibandingkan plasma (Denhard 2004). Berdasarkan manipulasi terhadap hewan, pengambilan sampel dikelompokan menjadi invansif (plasma/serum darah, air
susu dan saliva) maupun non-invansif (feses dan urine) (Möstl & Palme 2002;
hormon yang mengalami metabolisme di dalam hati, dimana organ hati merupakan tempat utama katabolisme glukokortikoid (Möstl & Palme 2002) (Gambar 7).
Gambar 7. Metabolisme glukokortikoid di dalam tubuh (Möstl & Palme 2002). Pemilihan sampel secara non-invansif ataupun invansif dalam deteksi hormon biasanya dikaitan dengan tujuan penelitian karena masing-masing sampel mempunyai kelebihan dan kekurangan. Pada satwa liar pengkoleksi darah dengan intensitas yang demikian tinggi akan menimbulkan traumatik, sehingga profil hormon yang terdeteksi akan berubah dari sifat alaminya akibat stres yang sangat tinggi. Pada proses koleksi metode invansif (sampel darah) seringkali hewan harus di tangkap, dibius atau dikandangkan pada ukuran yang sempit. Resiko kematian menjadi semakin tinggi, terutama dengan adanya pembiusan selain itu dapat menyebabkan stres yang tinggi pada hewan tersebut. Pada satwa liar untuk mendapatkan hasil profil hormon yang akurat sebaiknya pengkoleksian sampel dilakukan dengan cara non-invansif, dengan menjadikan satwa liar tidak stres yang akan menganggu pola pelepasan hormon (Schwarzenberger 2007; Thanos et al. 2008) .
Keuntungan menggunakan metode non-invansif yaitu tidak perlu
dilakukan anastesi sehingga menggurangi kejadian stres pada saat penangkapan maupun anastesi dan hewan tidak merasa tertekan ataupun terancam sehingga hasil yang didapatkan menjadi lebih akurat (Heistermann et al. 2001; Hua et al.
2004; Schwarzenberger 2007). Kerugian menggunakan metode non-invansif (feses) adalah sampel feses harus diambil secara keseluruhan karena kandungan metabolit hormon pada bagian luar dan dalam berbeda.
Permasalahan dalam pengembangan metode non-invasif adalah
bahwa hormon yang berada dalam darah akan diekresikan dalam feses atau urine akibat dari proses metabolisme tubuh, menjadi suatu bentuk metabolit yang berbeda (Schwarzenberger et al. 1996). Pada tahapan awal peneliti harus
melakukan pemahaman tentang metabolit hormon yang akan dianalisa di dalam feses ataupun urine. Selain itu, perlu diketahui juga perbedaan pola antara hormon yang dilepaskan dalam darah, feses atau urine.
Kadar glukokortikoid yang berada di urine maupun feses setiap spesies berbeda-beda dan waktu yang dibutuhkan setiap hormon yang dieksresikan melalui urine ataupun feses membutuhkan waktu yang berbeda pula pada setiap spesies (Möstl & Palme 2002; Schwarzenberger 2007; Thanos et al. 2008). Salah
satu hormon glukokortikoid yang telah diuji yaitu kadar hormon kortisol yang ditemukan di dalam feses pada masing-masing spesies memerlukan waktu yang berbeda disebabkan perbedaan metabolisme masing-masing jenis, misalnya pada
Macaca fasicularis kadar kortisol dapat terdeteksi pada 22 jam, Chimpanzee 26
jam (Hua et al. 2004; Heistermann et al. 2001).
Menurut Marty (2009) kadar hormon stres pada orangutan liar dapat dideteksi 48 jam kemudian setelah terjadinya interaksi sosial, namun jika dideteksi lebih dari 50 jam ke atas kadar hormon stres yang terdeksi di dalam feses akan menurun. Hal ini juga sesuai dengan hasil penelitian Weingrill et al.
(2008) yang menyatakan bahwa kadar hormon stres pada orangutan di captive dapat dideteksi melalui feses setelah 48 jam. Metabolit hormon glukokortikoid yang dideteksi sebagai indikator stres pada orangutan adalah 11β- hydroxyetiocholanolone.
DAFTAR PUSTAKA Ackerman U. 1996. Human Physiology. Mosby, St Louis.
Atmoko SSU, Mitra ST, Goossens B, James SS, Knott CD, Bernard M, van Schaik CP, van Noordwijk MA. 2009 a. Orangutan Matting Behavior and Strategi, eds. Orangutans: Geographic Variation in Behavior Ecology and Conservation. Oxford University Press. US.
Atmoko SSU, Singleton I, van Noordwijk MA, van Schaik CP, Mitra ST. 2009 b. Male-male Relationships in Orangutan. eds. Orangutans: Geographic Variation in Behavior Ecology and Conservation. Oxford University Press. US.
Atmoko SSU. 2000. Bimaturism in Orangutan Males: Reproductive and Ecological Strategies. (Thesis). Faculty Biology Utrecht University. The Nederlands.
Atmoko SSU. Perilaku Seksual Orangutan (Pongo pygmaeus abelii, Lesson
1827). 1991. Betina Dewasa di Pusat Penelitian Ketambe Aceh Tenggara. (Skripsi). Sarjana Biologi Fakultas Biologi Universitas Nasional. Jakarta. Arora N, Natera A, van Schaik CP, Erik P. Willemsa, van Noordwijka MA,
Goossensb B, Morfa N, Bastiand M, Knottd C, Morrogh-Bernardf H, Kuzeg N, Kanamorih T, Pamungkasi J, Perwitasari-Farajallahi D, Verschoorj E, Warrenk K, Krützena M. 2010. Effects of Pleistocene glaciations and rivers on the population structure of Bornean orangutans (Pongo pygmaeus). University of Zurich. Switzerland.
Brook CGD, and Marshall NJ. 1996. Essential Endocrinology, 3th Edition. Blackwell Science. John Street, London.
Delgado RAJR , van Schaik, CP. 2000. The Behavioral Ecology and Conservation The Orangutan (Pongo pymaeus): A Tale of Two Island. Evolutionary
Antrophology 20: 201-218.
Denhard M. 2004. Sample Collection, Handling, Storage and Preparation. Institute for Zoo and Wildlife Research, Berlin. Germany.
Dixson AF. 1998. Primate Sexsuality Comparative Studies of the Prosimians, Monkeys, Apes. and Humans Beings. Oxford Universty Press. US.
Dunbar RIM. 1988. Primate Social System: Study Behavior Adaptation. Dept. Zoology Universitas Liverpool, Croom Helm.Itd.
Fox EA. 2002. Female Tactics to Reduce Sexsual Harassment in The Sumatera Orangutan (Pongo pymaeus abelii). Behavior Ecologi Socio Biologi.
Springer 52: 93-101.
Fowler ME. 1999. Zoo and Wild Animal Medicine 4th ed. Philadelphia: W.B. Saunders Company. Vol. 34-35.
Galdikas BMF. 1985. Adult Male Sociality and Reproductive Tactic Among Orangutan at Tanjung Puting. American Journal of Primatology. 45; 9-24.
Ganong WF. 1983. Fisiologi Kedokteran Edisi 10. EGC. Jakarta.
Groves CP. 2001. Primate Taxsonomi Smithsonian Institution Press. Washington and London. US.
Guyton AC, Hall JE. 1996. Textbook of Medical Physiology, 9th ed. Saunders Company, Philadelphia, Pennsylvania. US.
Hau J, Abelson KS, Carlsson HE, Royo F. 2004. Stress-Assassed by Quantification of Non-invansif Stress Markers. University of Copenhagen & State Hospital and Uppsala University.
Heistermann M, Uhrigshardt J, Husung A, Kaumanns W, Hodges JK. 2001. Measurement of fecal steroid Metabilites in the lion-tail Macaque (Macaca silenus): a Non-invansif Tool for Assessing Female Ovarian Function. Primate report. American Journal of Primatology. 59:27-42.
Knott CD, Thompson ME, Wich SA. 2009. The Ecology of Female Reproduction in Wild Orangutan. eds. Orangutans: Geographic Variation in Behavior Ecology and Conservation. Oxford University Press. US.17: 171-188.
King MW and Marchesini S. 2004. Steroid Hormones and Reseptors, (Internet). http://www.med.unibs.it/-marchesi/sterhorm.html (4 November 2012).
Kuiper GJM, Carlquist M, Gustaffson JA. 1998. Estrogen Is a male and female Hormones. Science and Medicine.10: 36-45.
Litwack G, Schmidt TJ. 2002. Biochemistery of Hormones II: Steroid Hormones in: G. Litwack and TJ. Schmidt. Textbook of Biochemistery and Clinical Correlations 5th ed. John Wiley and Sons. Pp 959-988.
MacKinnon JR. 1974. The Behaviour and Ecology of Wild Orangutan (Pongo pygmaeus). Animal Behaviour. 22: 3-74.
Maple TL. 1980. Orangutan Behavior. Primate Behavior and Development Series van Nostrand Reinhold Company.US.
Martin PA, Crump MH. 2003. The Adrenal Gland. In: Pineda MH, Dooley MP, editor. Veterinary Endocrinology and Reproduction. 5th Ed. US: Lowa State Press. Pp 165-200.
Marty P. 2009. Behavioural endocrinology of male Bornean orangutans (Pongo pygmaeus wurmbii). (Thesis). Anthropological Institute and Museum
University of Zürich.
Meijaard E, Rijksen, HR, Kartikasari SN. 2001. Di Ambang Kepunahan, Kondisi Orangutan Liar di Awal Abad ke-21. Gibbon Foundation Indonesia. Jakarta. Möstl E, Palme R. 2002. Hormones as Indicators of Stress. Domestic Animal
Endocrinology 23:67–74.
Napier JR and Napier PHA. 1967. Hand Book of Living Primates. Academic Press. US.
Nelson R. 2005 An Introduction to Behavioral Endocrinology. Third Edition. The Ohio State Univesity. Sinauer Associates, Inc Publishers Sunderland, Massachusetts.
Rijksen HD. 1978. A Field Study on Sumatra Orangutans (Pongo pygmaeus abelii, Lesson 1827) Ecology Behaivior and Conservation. (Disseration)
Argricultur University Wageningen.
Rodman CG, Mitani JC. 1987. Orangutans Sexual Dimorpisme in A Solitary Spesies in Primate Societies. The University of Chicago Press.
Schwarzenberger F, Mostl E, Palme R, Bamberg E. 1996. Faecal Steroid Analysis for non invansive Monitoring of Reproductive Status in Farm, Wild and Zoo Animals. Animal Reproduction Scince. 42: 515-526.
Setia TM, Delgado R, Atmoko SSU, Singleton I, van Schaik CP. 2009. Social Organization and Male-Female Relationships. eds. Orangutans: Geographic Variation in Behavior Ecology and Conservation. Oxford University Press. US.
Singleton I, Knott CD, Morrogh-Bernard C, Wich SA, van Schaik CP. 2009. Ranging Behavior of Orangutan Female and Social Organization, eds Orangutans: Behavioral Ecology and Conservation. Oxford University Press. US.
Smith TE, French JA. 1997. Psychosocial Stress and Urinary Cortisol Excretion in Marmoset Monkeys (Callithrix kuhli), Physiology Behavior 62(2): 225-232.
Schurmann CL, Van Hooff JARAM. 1986. Reproduktive Strategies of the Orangutan. New data and a reconsideration of existing sosiosexsual model. International Journal of Primatology. 7: 265-287.
Schurmann CL. 1982. Courtship and Mating Behavior of Wild Orangutan in Sumatera dalam Primate Behavior and Sociobiology, A. B. Chiarelli dan R. S. Corruccini, Springer Verlag, Berlin Heidelberg.
Soehartono T, Soesilo HD., Andayani N, Atmoko SSU, Sihite J, Saleh C, Sutrisno A. 2007. Strategi dan Rencana Aksi Konservasi Orangutan Indonesia. Direktorat Jenderal Perlindungan Hutan dan Konservasi Alam, Departemen Kehutanan. Jakarta.
Steimer. 2003. Steroid Hormone Metabolism. (Internet).
http://www.gfmer.ch/books/reproductive health/steroid hormone metabolism (6 September 2012)
Supriatna J. Wahyono EH. 2000. Panduan Lapangan Primata Indonesia. Yayasan Obor Indonesia. Jakarta.
Thanos PKA, Cavigelli SA, Michaelides M, Olvet. M, Patel U, Diep MN, Volkow ND. 2008. Non-Invasive Method for Detecting the Metabolic Stress Response in Rodents: Characterization and Disruption of the Circadian Corticosterone Rhythm. University Park, PA, US. 58: 219-228.
van Schaik CP, van Hooff JARAM. 1996. Toward an Understanding of The Orangutan’s Social System in McGrew, WC, Marchout, LF, and Nishida T, eds. Grear Ape Societies. University Press, Canbreidge, pp 3-15.
van Schaik CP. 2006. Diantara Orangutan. Kera Merah Dan Kebangkitannya Kebudayaan Manusia. Yayasan Penyelamatan Orangutan Bormeo (BOS), Jakarta.
Warren KS, Verschoor EJ, Langenhuijzen S, Heriyanto, Swan RA, Vigilant L, Jonathan L. Heeney. 2001. Speciation and Intrasubspecific Variation of Bornean Orangutans, Pongo pygmaeus pygmaeus. The Society for Molecular Biology and Evolution Evol. 18:472–480.
Wich SA, Meijaard E, Marshall AJ, Husson S, Ancrenaz M, Lacy RC, van Schaik CP, Sugardjito J, Simorangkir T, Traylor-Holzer K, Galdikas BMF, Doughty M, Supriatna J, Dennis R, Gumal M, Singleton I. 2008. The Status of The Orangutan: an Overview of This Current Distribution. Oxford University Press. US.
Wich SA, Vries de Han, Ancrenaz M, Perkins L, Shumaker RW, Suzuki A, and van Schaik CP. 2009. Orangutan Life History Variation. eds. Orangutans: Geographic Variation in Behavior Ecology and Conservation. Oxford University Press. US.
Weingrill T, Willems EP, Zimmermann, Steinmetz H, Heistermann M. 2011. Spesies-Specific Patterns In fecal Glukokortikoid and Androgen Levels Zoo
Living Orangutan (Pongo spp.). American Journal of primatology. 172:
446-457.
West JB. 1991. Best and Taylor’s, Physiological Basis of Medical Partice, 12th Edition. Williams and Wilkins, Pp 225-231.