PENDAHULUAN
Latar Belakang
Indonesia memiliki sumber daya alam dengan keragaman genetik yang melimpah. Salah satu diantaranya adalah ternak kambing lokal Indonesia yang telah beradaptasi dengan kondisi geografis setempat. Kambing di Indonesia merupakan ternak ruminansia kecil dengan jumlah paling tinggi di Asia Tenggara (Sodiq & Taufik 2003).
Beberapa kambing lokal Indonesia seperti kambing Kacang, Samosir dan Muara memiliki keunggulan karena bersifat prolifik (Gambar 1). Kambing Kacang merupakan kambing asli Indonesia. Kambing Kacang merupakan kambing penghasil daging dengan rata-rata litter size 1.56–1.98 anak per kelahiran (Hoda 2008). Kambing Kacang memiliki ukuran tubuh sedang dengan corak warna yang sangat beragam mulai dari putih, hitam, coklat ataupun kombinasi dari ketiga warna tersebut. Kambing Samosir dipelihara oleh penduduk di Pulau Samosir, Kabupaten Toba Samosir dan sering digunakan sebagai bahan upacara persembahan salah satu aliran kepercayaan (Parmalim). Kambing Samosir memiliki ciri khas berupa warna bulu dominan putih dengan ukuran tubuh sedang. Adapun kambing Muara telah lama beradaptasi di Kecamatan Muara Kabupaten Tapanuli Utara dengan kondisi topografi yang bergunung-gunung. Ciri khas Kambing Muara adalah ukuran tubuhnya paling besar diantara kambing Kacang maupun kambing Samosir. Kambing Muara memiliki corak warna yang bervariasi seperti pada kambing Kacang.
Sifat prolifik yaitu kemampuan mempunyai anak lebih dari satu dalam satu kali kelahiran. Sifat prolifik pada ternak ruminansia dapat dibedakan menjadi dua kelompok, yaitu monozigot dan multizigot. Kelompok monozigot mengovulasikan satu oosit, kemudian embrio muda yang terbentuk membelah menjadi dua atau lebih embrio yang mampu hidup. Kelompok ini akan menghasilkan anak kembar identik. Kelompok multizigot mengovulasikan lebih dari satu oosit dalam suatu waktu. Apabila ada beberapa oosit yang berhasil dibuahi maka ternak akan melahirkan lebih dari satu anak dalam satu kali periode kelahiran.
Gambar 1 Penampilan Tiga Kambing Lokal Indonesia.
Salah satu tahapan penting dalam sistem reproduksi adalah proses pematangan folikel hingga siap untuk diovulasikan yang dikenal dengan oogenesis. Folikel adalah oosit yang dilapisi oleh dua jenis sel somatik, yaitu sel granulosa dan sel theka. Tahap perkembangan folikel meliputi primordial, primer, sekunder, awal tersier (antral atau Graafian), akhir tersier dan pre ovulasi.
Rangkaian proses oogenesis melibatkan beragam sinyal baik berupa hormon maupun faktor. Hormon merupakan sinyal molekul yang dihasilkan oleh sel endokrin dan didistribusikan melalui aliran darah menuju sel target atau ke seluruh tubuh. Beberapa hormon yang berperan dalam proses oogenesis antara lain Follicle Stimulating Hormone (FSH), estrogen, luteinizing Hormone (LH) dan progesteron. Hormon FSH berfungsi untuk merangsang pertumbuhan sel-sel folikel di sekeliling ovum. Folikel primordial akan tumbuh menjadi folikel de Graaf. Folikel de Graaf akan menghasilkan hormon estrogen yang berfungsi merangsang kelenjar hipofisis untuk mensekresikan hormon LH. Hormon LH akan merangsang terjadinya ovulasi. Sisa folikel dari proses ovulasi akan membentuk korpus luteum yang selanjutnya menghasilkan progesteron. Hormon
progesteron berperan dalam menghambat kelenjar hipofisis untuk mensekresikan FSH dan LH.
Faktor merupakan suatu sinyal molekular yang dihasilkan oleh suatu sel untuk merangsang kerja dari sel lain di sekitarnya. Faktor diedarkan melalui difusi cairan matriks ekstra selular. Faktor dikelompokkan sebagai sinyal parakrin. Salah satu contoh sinyal parakrin yang berperan dalam proses oogenesis adalah anggota super famili Transforming Growth Factor β (TGF β), diantaranya Bone
Morphogenetic Protein Receptor 1B (BMPR1B) dan Bone Morphogenetic Protein 15 (BMP15). BMP15 merupakan suatu faktor pertumbuhan yang berfungsi dalam
mengatur proliferasi dan diferensiasi sel granulosa di awal perkembangan folikel (Otsuka et al. 2000). BMPR1B merupakan reseptor bagi beberapa faktor BMP termasuk BMP15 (ten Dijke et al. 2003).
Sifat prolifik dikendalikan oleh gen-gen yang dikelompokkan sebagai gen kesuburan (fecundity genes) (Davis 2004). Gen BMPR1B atau activin-like kinase
6 (ALK 6) dikenal sebagai FecB. Gen BMPR1B terletak pada kromosom 6 yang
diekspresikan oleh sel oosit dan sel granulosa. Mutasi substitusi A746G atau pada tingkat asam amino mutasi Q249R pada FecB akan meningkatkan laju ovulasi rata-rata 1.5 dan rataan litter size 1.0 pada heterozigot carrier. Mutasi yang sama pada homozigot carrier akan meningkatkan laju ovulasi rata-rata 3.0 dengan rataan litter size 1.5 (Mulsant et al. 2001; Souza et al. 2001; Wilson et al. 2001; Davis 2005).
Gen BMP15 atau GDF9B dikenal sebagai FecX terletak di kromosom X
dan diekspresikan oleh sel oosit. Mutasi pada gen BMP15 pertama kali dilaporkan oleh Galloway et al. (2000). Mutasi pada FecX berkorelasi dengan peningkatan laju ovulasi dan litter size pada genotip heterozigot carrier, sedangkan pada genotip homozigot carrier dapat menyebabkan sifat steril. Ada enam alel mutan yang sudah diketahui pada gen BMP15 yaitu FecXI (Inverdale), FecXH (Hanna),
FecXB (Belclare), FecXG (Galway), FecXL (Lacaune) dan FecXR (Rasa Aragonesa) (Galloway et al. 2000; Hanrahan et al. 2004; Bodin et al. 2007; Martinez-Royo et
al. 2008). Mutasi substitusi Q239Ter pada gen BMP15 yang berkorelasi dengan
sifat prolifik adalah FecXG. Situs mutan tersebut ternyata bisa dikenali sebagai situs restriksi enzim HinfI. Dengan begitu, deteksi dini terhadap sifat prolifik
kemudian dikembangkan oleh Hanrahan et al. (2004) pada domba menggunakan teknik PCR-RFLP (Polymerase Chain Reaction Restriction Fragment Length
Polymorphism).
Metode PCR-RFLP merupakan metode untuk mendeteksi ada tidaknya mutasi pada situs pemotongan yang khas suatu enzim restriksi. Pada beberapa populasi ternak, PCR-RFLP terbukti sebagai metode deteksi mutasi substitusi yang cepat dan akurat. Pemanfaatan teknik PCR-RFLP dapat digunakan untuk meningkatkan produktivitas hewan ternak melalui skrining dan pendeteksian hasil persilangan (Pardhesi et al. 2005). Apabila mutasi substitusi tidak terjadi pada situs pemotongan suatu enzim restriksi, maka metode pendeteksiannya bisa dilakukan dengan metode SSCP (Single Strand Conformation Polymorphism) ataupun perunutan nukleotida (DNA sequencing). Metode sekuensing DNA lebih akurat dalam mendeteksi kejadian mutasi tetapi relatif mahal dan membutuhkan waktu yang lama.
Tujuan penelitian
Penelitian ini bertujuan untuk mengidentifikasi keragaman gen fekunditas (BMPR1B dan BMP15) pada tiga kambing lokal Indonesia, yaitu kambing Kacang, Samosir dan Muara dengan menggunakan metode PCR-RFLP dan sekuensing.
Manfaat Penelitian
Penelitian ini dapat dimanfaatkan sebagai informasi awal tentang keragaman genetik gen fekunditas (BMPR1B dan BMP15) pada tiga kambing lokal Indonesia yaitu kambing Kacang, Samosir dan Muara. Hasil yang diharapkan adalah apabila metode deteksi cepat PCR-RFLP ditemukan berkorelasi dengan sifat prolifik, maka hasilnya dapat digunakan sebagai metode deteksi dini sifat prolifik.
GEN FEKUNDITAS (BMPR1B DAN BMP15) PADA
TIGA KAMBING LOKAL INDONESIA
PENDAHULUAN
Sifat prolifik adalah kemampuan untuk melahirkan lebih dari satu anak sekaligus dalam satu kali periode kelahiran. Sifat prolifik dikendalikan oleh gen-gen yang dikelompokkan sebagai gen-gen kesuburan (fecundity gen-genes). Ada tiga jenis gen Fec yang sudah diidentifikasi pada ruminansia kecil, yaitu Bone
Morphogenetic Protein Receptor type 1B (BMPR1B), Growth Differentiation Factor 9 (GDF9) dan Bone Morphogenetic Protein 15 (BMP15) (Galloway et al.
2000; Souza et al. 2001; Hanrahan et al. 2004).
Gen BMPR1B atau activin-like kinase 6 (ALK 6) dikenal sebagai FecB. Gen BMPR1B terletak pada kromosom 6 yang diekspresikan oleh sel oosit dan sel-sel granulosa. Mutasi pada FecB terjadi karena substitusi A746G pada cDNA yang menyebabkan substitusi asam amino Q249R (Mulsant et al. 2001; Souza et
al. 2001; Wilson et al. 2001). Mutan heterozigot carrier akan mengalami
peningkatan laju ovulasi rata-rata 1.5 dengan rataan litter size 1.0. Sedangkan mutan homozigot carrier akan mengalami peningkatan yang lebih tinggi yaitu laju ovulasinya rata-rata 3.0 dengan rataan litter size 1.5 (Davis 2005).
Gen BMP15 atau FecX terletak di kromosom X dan diekspresikan oleh sel oosit. Anggota super famili Transforming Growth Factor β (TGF β) ini disebut BMP15 karena secara struktural dapat dikelompokkan ke dalam anggota BMP (Dube et al. 1998). Selain itu, BMP15 juga dikenal sebagai GDF9B karena kemiripannya dengan GDF9 (Laitinen et al. 1999). Mutasi pada FecX berkorelasi dengan peningkatan laju ovulasi dan litter size pada genotip heterozigot carrier, sedangkan pada genotip homozigot carrier dapat menyebabkan sifat steril. Ada lima alel akibat mutasi titik (single substitution) pada FecX yang telah ditemukan, yaitu FecXI (Inverdale), FecXH (Hanna), FecXB (Belclare), FecXG (Galway) dan
FecXL (Lacaune) (Galloway et al. 2000; Hanrahan et al. 2004; Bodin et al. 2007). Selain itu, ada satu alel yang disebabkan oleh mutasi delesi 17 pb yang disebut
FecXR (Rasa Aragonesa) (Martinez-Royo et al. 2008).
Metode PCR-RFLP (Polymerase Chain Reaction Restriction Fragment
dalam skala massal. Metode PCR-RFLP memanfaatkan adanya situs pemotongan yang khas dari suatu enzim restriksi untuk mendeteksi terjadinya mutasi pada suatu fragmen DNA. Metode sekuensing DNA menghasilkan data yang lebih akurat karena berdasarkan perunutan nukleotida. Metode sekuensing relatif mahal dan membutuhkan waktu yang lama.
Tujuan penelitian ini adalah untuk mengidentifikasi keragaman genetik gen fekunditas (BMPR1B dan BMP15). Populasi ternak yang diteliti adalah tiga kambing lokal Indonesia meliputi kambing Samosir, kambing Muara dan kambing Kacang dengan metode PCR-RFLP dan sekuensing.
BAHAN DAN METODE Waktu dan Tempat
Penelitian ini dilaksanakan mulai bulan Mei 2010 sampai dengan Januari 2011 di Laboratorium bagian Fungsi Hayati dan Perilaku Hewan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Pengambilan Sampel Darah Kambing
Sampel darah kambing Kacang yang digunakan adalah koleksi Loka Penelitian Kambing Potong Sei Putih, Sumatera Utara. Berdasarkan catatan yang tersedia, dari total 25 ekor kambing, 14 ekor bersifat prolifik atau setidaknya pernah melahirkan anak lebih dari satu per kelahiran, sedangkan 11 ekor yang lain selalu beranak tunggal (Tabel 1). Kambing Samosir diambil dari peternakan rakyat di Kabupaten Samosir (60 ekor) dan Kambing Muara di peternakan rakyat di Kabupaten Tapanuli Utara, Provinsi Sumatera Utara (35 ekor). Pembagian sifat prolifik atau tidaknya didasarkan pada wawancara terhadap pemilik kambing.
Sampel darah diambil dari vena jugularis menggunakan jarum venoject yang dihubungkan dengan tabung vakum sekitar 2 ml dari setiap ekor kambing. Darah yang diperoleh langsung diawetkan dalam alkohol absolut 2x volume darah.
Tabel 1 Jumlah sampel darah kambing
Jenis Kambing Prolifik Non Prolifik + Unknown Jumlah
Kacang 14 11 25
Samosir 24 36 60
Muara 9 26 35
Total 47 73 120
Prolifik: jumlah anak 2-5, Non prolifik: jumlah anak 1, unknown: tidak diketahui
Ekstraksi DNA
Ekstraksi genom DNA dilakukan menggunakan Genomic DNA Mini Kit
for Fresh Blood (GeneAid) yang dimodifikasi untuk sampel darah yang diawetkan
dalam alkohol. Modifikasi yang dilakukan bertujuan untuk menghilangkan alkohol sebelum dilakukan proses ekstraksi DNA. Sampel darah dalam alkohol sebanyak 1mL disentrifugasi 2000 g selama 5 menit. Endapan sel dicuci dengan menambahkan akuades steril hingga volume total 1.5 mL dan didiamkan selama 20 menit. Pencucian ini dilakukan sebanyak dua kali. Sel-sel darah yang telah bersih dari alkohol disuspensikan dengan bufer pelisis 100 µL, kemudian ditambahkan enzim Proteinase K 0.01-0.5 µg/mL dan diinkubasi pada suhu 60 0C selama 30 menit. Pemisahan bahan organik non-DNA dan pemurnian molekul DNA dilakukan sesuai dengan prosedur dari Genomic DNA Mini Kit.
Amplifikasi Gen BMPR1B dan BMP15
Ruas ekson 8 gen BMPR1B dan ekson 2 gen BMP15 diamplifikasi dengan mesin TaKaRa Thermal Cycler dalam reaksi PCR 12 µL. Komposisi pereaksi terdiri atas sampel DNA sekitar 10 ng, primer forward dan reverse masing-masing 0.5 µL 25 mM, dan KAPA Taq Ready Mix DNA polymerase 6 µL (KAPATaq DNA polymerase 0.05 U/µL, bufer polimerase dengan Mg2+.25 mM dan setiap dNTP masing-masing 0.4 mM). Kondisi PCR, yaitu predenaturasi 94 0C selama 5 menit, (denaturasi 94 0C selama 60 detik, penempelan primer 58 0C selama 90 detik, pemanjangan 72 0C 90 detik) sebanyak 30 siklus, pemanjangan akhir pada
suhu 72 0C selama 10 menit, dan penyimpanan dilakukan pada suhu 4 0C. Amplikon dimigrasikan pada elektroforesis gel poliakrilamida 6% dengan
menggunakan penanda DNA Ladder 100 pb (Generay Biotech), kemudian dilanjutkan dengan pewarnaan perak (Byun et al. 2009).
Primer yang digunakan untuk mengamplifikasi ruas ekson 8 dari gen
BMPR1B adalah primer forward AF84 5’-GTCGCTATGGGGAAGTTTGGATG
dan primer reverse AF85 5’-GATGTTTTCATGCCTCATCAACACGGTC yang akan menghasilkan produk PCR sebesar 137 pb (Wilson et al. 2001). Primer yang digunakan untuk mengamplifikasi ruas ekson 2 gen BMP15 adalah primer
forward AF86 5’-CTTCTTGTTACTGTATTTCAATGAGAC dan primer reverse
AF87 5’-GATGCAATACTGCCTGCTTG yang akan menghasilkan produk PCR sebesar 135 pb (Hanrahan et al. 2004).
Analisis Gen BMPR1B dan BMP15 Menggunakan PCR-RFLP dan Sekuensing
Amplikon gen BMPR1B dipotong dengan enzim AvaII (G/GACC) (Boehringer Mannheim, GmbH-Germany). Sebanyak 3 µL amplikon direaksikan dengan enzim restriksi AvaII 7.5 U pada suhu 37 0C yang diinapkan semalaman. Amplikon yang tidak terpotong disebut dengan tipe liar. Hewan tipe liar tidak memiliki situs pemotongan sehingga panjang fragmen DNAnya tetap 137 pb. Amplikon yang terpotong akan memiliki panjang fragmen DNA 109 pb dan 28 pb disebut mutan homozigot carrier. Amplikon yang terpotong dan memiliki tiga jenis fragmen DNA yaitu 137 pb, 109 pb dan 28 pb disebut mutan heterozigot
carrier.
Amplikon gen BMP15 dipotong dengan enzim Hinf I (G/ACT) (Boehringer Mannheim, GmbH-Germany). Amplikon sebanyak 3 µL ditambah enzim HinfI 7.5 U. Suspensi diinkubasi semalam pada suhu 37 0C. Amplikon yang terpotong menjadi dua fragmen DNA masing-masing 110 pb dan 25 pb disebut dengan hewan tipe liar. Amplikon yang tidak terpotong mempunyai panjang fragmen DNA 135 pb disebut mutan FecXG .
Hasil PCR-RFLP kemudian diverifikasi dengan metode sekuensing. Seluruh amplikon gen BMPR1B dicampur menjadi satu. Hal ini juga dilakukan pada semua amplikon gen BMP15. Campuran amplikon dibagi menjadi dua kelompok besar yaitu A (gen BMPR1B) dan B (gen BMP15). Sekuensing
dilakukan pada campuran amplikon A dan B menggunakan primer yang sama dengan amplifikasi awal.
HASIL
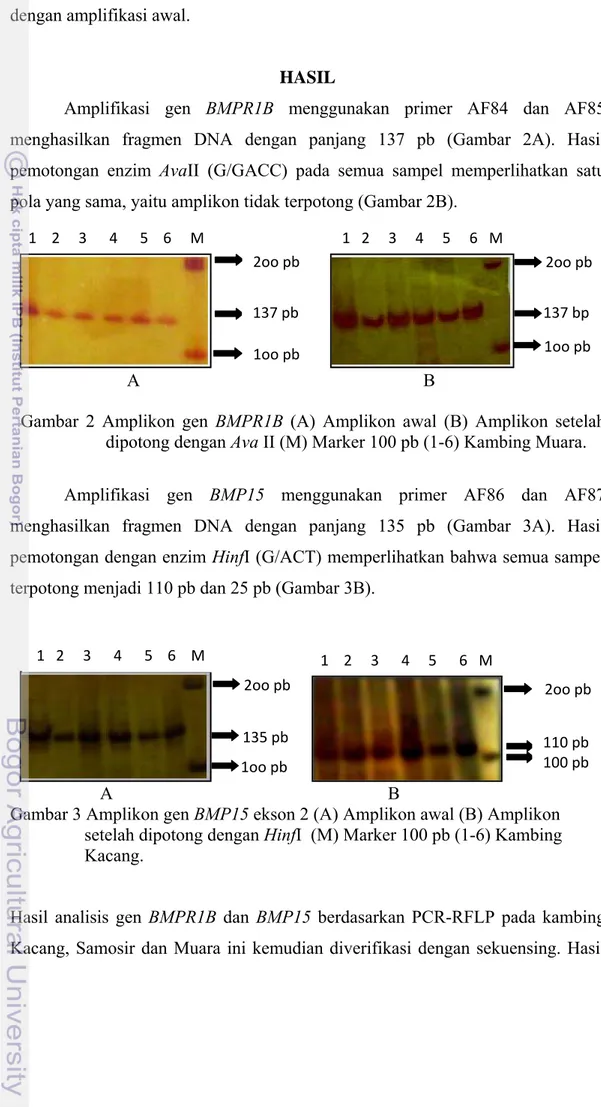
Amplifikasi gen BMPR1B menggunakan primer AF84 dan AF85
menghasilkan fragmen DNA dengan panjang 137 pb (Gambar 2A). Hasil pemotongan enzim AvaII (G/GACC) pada semua sampel memperlihatkan satu pola yang sama, yaitu amplikon tidak terpotong (Gambar 2B).
A B
Gambar 2 Amplikon gen BMPR1B (A) Amplikon awal (B) Amplikon setelah dipotong dengan Ava II (M) Marker 100 pb (1-6) Kambing Muara.
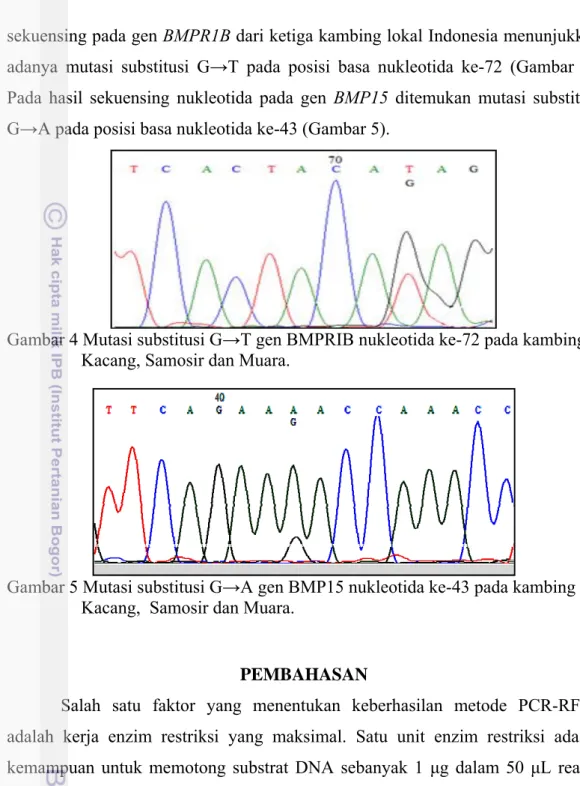
Amplifikasi gen BMP15 menggunakan primer AF86 dan AF87 menghasilkan fragmen DNA dengan panjang 135 pb (Gambar 3A). Hasil pemotongan dengan enzim HinfI (G/ACT) memperlihatkan bahwa semua sampel terpotong menjadi 110 pb dan 25 pb (Gambar 3B).
A B
Gambar 3 Amplikon gen BMP15 ekson 2 (A) Amplikon awal (B) Amplikon setelah dipotong dengan HinfI (M) Marker 100 pb (1-6) Kambing Kacang.
Hasil analisis gen BMPR1B dan BMP15 berdasarkan PCR-RFLP pada kambing Kacang, Samosir dan Muara ini kemudian diverifikasi dengan sekuensing. Hasil
1oo pb 135 pb 2oo pb 1 2 3 4 5 6 M 2oo pb 110 pb 100 pb 1 2 3 4 5 6 M 2oo pb 137 bp 1oo pb 2oo pb 137 pb 1oo pb 1 2 3 4 5 6 M 1 2 3 4 5 6 M
sekuensing pada gen BMPR1B dari ketiga kambing lokal Indonesia menunjukkan adanya mutasi substitusi G→T pada posisi basa nukleotida ke-72 (Gambar 4). Pada hasil sekuensing nukleotida pada gen BMP15 ditemukan mutasi substitusi G→A pada posisi basa nukleotida ke-43 (Gambar 5).
Gambar 4 Mutasi substitusi G→T gen BMPRIB nukleotida ke-72 pada kambing Kacang, Samosir dan Muara.
Gambar 5 Mutasi substitusi G→A gen BMP15 nukleotida ke-43 pada kambing Kacang, Samosir dan Muara.
PEMBAHASAN
Salah satu faktor yang menentukan keberhasilan metode PCR-RFLP adalah kerja enzim restriksi yang maksimal. Satu unit enzim restriksi adalah kemampuan untuk memotong substrat DNA sebanyak 1 μg dalam 50 μL reaksi selama 60 menit. Pada penelitian ini, PCR-RFLP dilakukan dengan menggunakan enzim restriksi yang cukup tinggi yaitu 7.5 U dan waktu yang cukup lama yaitu diinkubasi selama semalam. Hal ini untuk menjamin bahwa semua amplikon dapat terpotong dengan sempurna. Oleh karena itu, kondisi amplikon gen
BMPR1B yang tidak terpotong bukan disebabkan enzim restriksi tidak bekerja
dengan baik, tetapi disebabkan amplikon tidak memiliki situs pemotongan enzim
Hasil PCR-RFLP gen BMPR1B dan BMP15 pada kambing Kacang, Samosir dan Muara menyimpulkan bahwa ketiga kambing lokal Indonesia merupakan tipe liar. Ternak dengan genotip tipe liar bersifat non prolifik (Wilson
et al. 2001; Hanrahan et al. 2004). Hal ini berlawanan dengan fakta bahwa
beberapa sampel yang diperoleh di lapangan dari ketiga kambing lokal Indonesia ini bersifat prolifik. Oleh karena itu, metode PCR-RFLP terhadap gen BMPR1B dan BMP15 tidak dapat digunakan sebagai alat untuk mendeteksi sifat prolifik pada ketiga kambing lokal Indonesia. Selain pada kambing Indonesia, metode PCR-RFLP juga tidak bisa digunakan untuk mendeteksi sifat prolifik berdasarkan gen BMPR1B dan BMP15 kambing lokal Iran (Deldar-Tajangookeh et al. 2009), enam jenis kambing China, yaitu Boer, persilangan Boer x Huanghuai (BH), Huanghuai, Haimen, Nubi dan Matou (Hua et al. 2008). Selain pada kambing, metode deteksi sifat prolifik menggunakan metode PCR-RFLP yang dikembangkan oleh (Davis et al. 2002; Hanrahan et al. 2004), ternyata tidak bisa bekerja dengan baik pada domba Sangsari Iran (Kasiriyan et al. 2009), 19 domba prolifik dari berbagai negara (Davis et al. 2006), domba Shal (Ghaffari et al. 2009), lima jenis domba Mesir, yaitu Rahmani, Ossimi, Awassi, Barki dan persilangan Awassi x Barki (EL-Hanafy & El-Saadani 2009), dan lima jenis domba Mediterania dan Afrika Utara, yaitu Barbarine, Queue Fine de L’ Quest (Tunisia), Noire de Thibar (Tunisia/Perancis), Sicilo-Sarde (Italia) dan D’man (Maroko) (Vacca et al. 2010). Selain itu, Chu et al. (2010) mengungkapkan bahwa polimorfisme gen BMPR1B pada kambing Jining Grey tidak berkorelasi dengan sifat prolifik. Polley et al. (2009) menyatakan bahwa pada kambing Black Bengal India, gen BMP15 adalah monomorfik, sedangkan polimorfisme pada gen
BMPR1B ditemukan berkorelasi dengan sifat prolifik.
Beberapa kejadian yang paralel dengan hasil PCR-RFLP gen BMPR1B dan BMP15 yang monomorfik pada tiga kambing lokal Indonesia menunjukkan bahwa SNP (single nucleotide polymorphisme) yang dijadikan dasar untuk membuat metode PCR-RFLP hanya berlaku pada satu bangsa ternak saja. Hal ini berarti analisis korelasi yang telah dibuat (Davis et al. 2002; Hanrahan et al. 2004) hanya berlaku untuk satu bangsa ternak saja. Walaupun begitu, penetapan sifat prolifik dalam penelitian ini adalah berbasis jumlah anak yang dilahirkan. Adapun
gen BMP1RB dan BMP15 bekerja pada sel granulosa (Dube et al.1998; Mulsant et
al. 2001) sehingga ada peluang kambing Kacang, Samosir dan Muara memiliki
lebih dari satu oosit yang diovulasikan.
SIMPULAN
Hasil PCR-RFLP gen BMPR1B dan BMP15 pada kambing Kacang, Samosir dan Muara menunjukkan bahwa semua sampel merupakan tipe liar. Hasil sekuensing pada kambing Kacang, Samosir dan Muara menunjukkan mutasi substitusi G72T pada gen BMPR1B dan mutasi substitusi G43A pada gen BMP15. Kedua mutasi ini tidak berkaitan dengan situs restriksi pada enzim AvaII dan
POLIMORFISME GEN BMP15 PADA KAMBING KACANG,
SAMOSIR DAN MUARA
PENDAHULUAN
Super famili Transforming Growth Factor β (TGF β) merupakan suatu faktor pertumbuhan berupa molekul protein yang berfungsi sebagai sinyal ekstra seluler. Super famili TGF β terdiri dari TGF β 1,2,3 , Anti Mullerian Hormone
(AMH), 2 Inhibin (A dan B), 3 Aktivin (A,B, dan AB), sekitar 20 macam Bone
Morphogenetic Protein (BMP1 – BMP20) dan setidaknya 9 Growth Differentiation
Factors (GDF1-GDF9) (Dirangkum oleh Knight dan Glister 2006).
Gen Bone Morphogenetic Protein 15 (BMP15) atau FecX terletak di kromosom X yang ekuivalen dengan Xp11.2-p11.4 pada manusia dan diekspresikan hanya pada sel oosit (Galloway et al. 2000). BMP15 berfungsi dalam mengatur proliferasi dan diferensiasi sel granulosa di awal perkembangan folikel (Otsuka et al. 2000). Mutasi pada gen BMP15 dapat meningkatkan laju ovulasi dan litter size pada mutan heterozigot carrier dan menyebabkan sifat steril pada mutan homozigot carrier. Ada enam alel mutan pada Fec X yang telah ditemukan yaitu lima alel berupa mutasi titik yaitu Fec XI (Inverdale), Fec XH (Hanna), Fec XB (Belclare), Fec XG (Galway) dan Fec XL (Lacaune) (Galloway et
al. 2000; Hanrahan et al. 2004; Bodin et al. 2007) dan satu alel berupa mutasi
delesi 17 pb yaitu Fec XR (Rasa Aragonesa) (Martinez-Royo et al. 2008). Mutasi substitusi pada Fec XI, Fec XL dan Fec XB menyebabkan adanya perubahan asam amino non conserve berturut-turut pada posisi 31, 53 dan 99 pada proprotein
BMP15. Mutasi substitusi Fec XH dan Fec XG menyebabkan stop kodon prematur berturut-turut pada posisi 291 dan 239 dari proprotein BMP15. Adapun mutasi delesi (Fec XR) mengubah kerangka pembacaan kodon mRNA yang menyebabkan stop kodon prematur pada posisi 208 dari proprotein BMP15.
Metode sekuensing merupakan pengembangan teknik yang berkaitan dengan DNA. Metode ini menghasilkan informasi yang lebih akurat karena berdasarkan pada perunutan nukleotida dari suatu fragmen DNA. Penelitian ini bertujuan untuk mengidentifikasi keragaman genetik gen BMP15 pada tiga kambing lokal Indonesia yaitu kambing Kacang, Samosir dan Muara.