BAB III
METODE PENELITIAN
3.1 Waktu dan Tempat
1. Waktu
Penelitian dilaksanakan sekitar dua bulan yaitu mulai dari Bulan
April 2015 sampai Bulan Mei 2015.
2. Tempat
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan,
Laboratorium Terpadu, Universitas Muhammadiyah Purwokerto.
3.2 Materi Penelitian
1. Bahan yang akan digunakan yaitu aquades, agar, sukrosa, Natrium
Hipoklorit (NaOCL), alkohol 70%, detergent halus, rimpang kencur, daun
kencur, akar kencur.
2. Alat yang akan digunakan yaitu Laminar Air Flow cabinet (LAF), botol
kultur, timbangan analitis, skalpel, pinset, pH meter, lampu spirtus, gelas
ukur, pengaduk, otoklaf, lemari es, microwave, karet, plastik penutup
3.3 Metode Pelaksanaan
1. Rancangan percobaan
Penelitian ini menggunakan metode Survey dengan 6 perlakuan.
Perlakuan eksplan daun menggunakan sterilan natrium hipoklorit 5% dan
alkohol 70% (E1S1). Perlakuan eksplan daun menggunakan sterilan
natrium hipoklorit 10% dan alkohol 70% (E1S2). Perlakuan eksplan akar
menggunakan sterilan natrium hipoklorit 5% dan alkohol 70% (E2S1).
Perlakuan eksplan akar menggunakan sterilan natrium hipoklorit 10% dan
alkohol 70% (E2S2). Perlakuan eksplan rimpang menggunakan sterilan
natrium hipoklorit 5% dan alkohol 70% (E3S1). Perlakuan eksplan
rimpang menggunakan sterilan natrium hipoklorit 10% dan alkohol 70%
(E3S2). Pada masing-masing perlakuan terdapat 5 sampel sehingga
diperoleh 30 unit perlakuan.
3.4 Pelaksanaan Penelitian
1. Pembuatan larutan stok
Pembuatan larutan stok bertujuan agar waktu kerja yang dilakukan
lebih efektif dan efisien dalam pembuatan larutan medium MS yang akan
digunakan dalam penelitian ini. Adapun prosedur pembuatan larutan stok
yang akan digunakan dalam pembuatan medium MS adalah terlebih
dahulu menimbang bahan yang dibutuhkan sesuai tabel kebutuhan unsur
untuk larutan medium MS. Penimbangan bahan dilakukan dengan
kelipatan kebutuhan larutan medium MS yang nantinya akan digunakan
Adapun prosedur pembuatan larutan stok adalah sebagai berikut :
a. Larutan stok A, merupakan larutan hara makro, dibuat 100 kali
dilarutkan dalam 1000 ml aquades
b. Larutan stok B, merupakan larutan hara makro, dibuat 1000 kali
dilarutkan dalam 100 ml aquades
c. Larutan stok C, merupakan campuran FeSO4.7H20 dan Na-EDTA
dibuat 100 kali dan dilarutkan ke dalam 200 ml aquades
d. Larutan stok D, merupakan larutan vitamin kecuali mio-inositol,
dibuat 100 kali dalam 200 ml aquades
e. Larutan stok E, merupakan larutan mio-inositol, dibuat 100 kali
dalam 100 ml aquades
2. Pembuatan Medium MS
Prosedur pembuatan medium MS yang akan digunakan dalam
penelitian ini adalah sebagai berikut :
Semua bahan dimasukkan ke dalam labu erlenmeyer , meliputi:
a. Aquades sebanyak 500 ml terlebih dahulu dimasukkan ke gelas piala
1000 ml.
b. Menambahkan larutan stok A 100 ml; stok B o,5 ml; stok C 0.5 ml;
stok D 0,5 ml; stok E 1 ml; stok F 0.5 ml, vitamin, mio-inositol,
sukrosa dan agar.
c. Menambahkan air sampai volume 1000 ml.
d. Mengatur pH larutan dengan PH meter, dengan kebutuhan pH sekitar
dinaikkan dengan KOH 1N dengan cara ditetesi sampai mencapai pH
yang diinginkan.
e. Memasukkan magnetic strirrer ke daalam gelas beker, kemudian
hotplate dinyalakan, dan ditunggu hingga larutan yang dibuat menjadi
homogen.
f. Menuang larutan medium ke botol kultur sebanyak 15 ml/botol.
g. Menutup botol kultur yang telah diisi medium dasar MS dengan
aluminium foil dan memberikan label sesuai perlakuan.
h. Melakukan sterilisasi basah menggunakan autoklaf dengan
memasukkan botol-botol tersebut ke dalam autoklaf dan disterilisasi
dengan suhu 121o C dengan tekanan 1,5 psi selama 20-30 menit.
i. Menyimpan media yang sudah disterilisasi di dalam ruang
penyimpanan media yang steril ber-AC (suhu 24-26o C) selama 3 hari
sebelum digunakan untuk memastikan bahwa media yang telah dibuat
tersebut tidak terkontaminasi dan dapat digunakan dalam penelitian.
3. Sumber dan sterilisasi Eksplan
Bahan yang akan digunakan sebagai eksplan adalah daun, akar dan
irisan rimpang. Rimpang ditumbuhkan pada media steril sampai tumbuh
daun dan akar. Penyediaan eksplan dilakukan dengan cara mengambil
potongan akar dari rimpang yang tumbuh, irisan melintang rimpang dan
irisan daun dengan ukuran 0,5 x 0,5 cm dari daun yang sudah terpilih dan
disterilisasikan. Sterilisasi dilakukan sesuai perlakuan.
Sterilisasi bahan tanaman dimulai dengan pencucian dan
mengalir . Pencucian dapat dilakukan dengan penyikatan menggunakan
detergent halus. Terkadang bahan yang sudah bersih dibiarkan di bwah air
mengalir selama 30 menit. Hal ini dilakukan untuk memecah koloni
kontaminan yang masih menempel dipermukaan agar koloni tersebut lebih
peka terhadap bahan-bahan sterilisasi. Juga untuk mengurangi dan
menghilangkan senyawa fenol, terutama pada tanaman yang kandungan
fenoliknya tinggi.
Bahan yang sudah bersih dikecilkan sampai ukuran tertentu.
Ukuran ini harus lebih besar dari ukuran eksplan yang direncanakan.
Bahan kemudian direndam dalam larutan sterilan sesuai perlakuan yang
dirancang. Eksplan daun, akar dan rimpang direndam dengan larutan
Natrium hipoklorit (NaOCL) dengan konsentrasi 5 % pada gelas beker
yang berbeda setiap eksplan, setelah 5 menit di cuci sebentar dengan
aqudes steril lalu direndam dengan larutan alkohol 70% selama 1 menit.
Begitu pula dengan konsentrasi larutan 10%. Setelah waktu perendaman
tercapai, bahan dicuci bersih dan ditiriskan, kemudian dibawa masuk ke
dalam laminar dan siap di tanaman pada media kultur.
3.5 Variabel yang Diamati
Pengamatan dilakukan setelah eksplan ditanam selama 30 hari.
Pengamatan meliputi :
1. Identifikasi sumber kontaminan: mengamati sumber kontaminan (bakteri
atau jamur) yang menyebabkan terjadinya kontaminasi pada
2. Tingkat kontaminasi : diamati kategori tingkat kontaminasi pada
masing-masing perlakuan (ringan : apabila koloni masih berbentuk lendir semi
transparan, sedang; apabila koloni sudah berlendir putih tebal, berat:
apabila koloni sudah menutupi seluruh permukaan eksplan bahkan
menutupi permukaan media)
3. Persentase kontaminasi : dihitung jumlah eksplan yang terkontaminasi
dengan mengamati jumlah eksplan yang terserang kontaminan (jamur dan
bakteri) sejak pertama eksplan ditanam.
4. Hari pertama kontaminasi : mengamati hari keberapa pertama kali eksplan
terkena kontaminasi.
3.6 Analisa Data
Penelitian ini menggunakan analisa deskriptif kualitatif dengan
bantuan tabel, diagram, dan rumus. Rumus yang digunakan adalah sebagai
berikut :
1. Menghitung persentase kontaminasi :
BAB IV
HASIL DAN PEMBAHASAN
4.1Persentase Kontaminasi
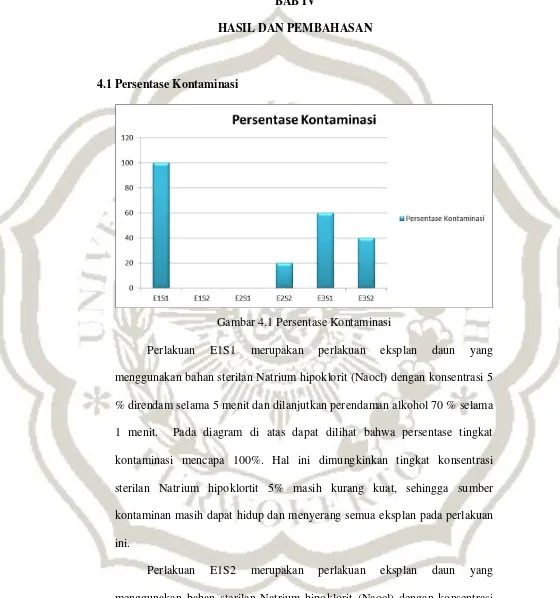
Gambar 4.1 Persentase Kontaminasi
Perlakuan E1S1 merupakan perlakuan eksplan daun yang
menggunakan bahan sterilan Natrium hipoklorit (Naocl) dengan konsentrasi 5
% direndam selama 5 menit dan dilanjutkan perendaman alkohol 70 % selama
1 menit. Pada diagram di atas dapat dilihat bahwa persentase tingkat
kontaminasi mencapa 100%. Hal ini dimungkinkan tingkat konsentrasi
sterilan Natrium hipoklortit 5% masih kurang kuat, sehingga sumber
kontaminan masih dapat hidup dan menyerang semua eksplan pada perlakuan
ini.
Perlakuan E1S2 merupakan perlakuan eksplan daun yang
menggunakan bahan sterilan Natrium hipoklorit (Naocl) dengan konsentrasi
selama 1 menit. Pada diagram di atas dapat dilihat bahwa persentase tingkat
kontaminasi adalah 0%. Hal ini dimungkinkan tingkat konsentrasi sterilan
Natrium hipoklortit 10% sudah cukup kuat sehingga dapat menghalangi
kontaminan untuk menyerang eksplan maupun media.
Konsentrasi dan lama perendaman bayclin atau natrium hipoklorit
(Naocl) menurut Darmono (2003) sebanyak 1-10% selama 5-30 menit,
menurut Hendaryono dan Wijayani (1994) 5-10% selama 5-10 menit. Dari
kisaran waktu perendaman dan konsentrasi sterilan yang masih berlaku untuk
semua jenis tanaman tersebut, diketahui bahwa untuk tanaman kencur dengan
eksplan daun, kadar konsentrasi yang baik adalah 10% dengan waktu
perendaman yang sama yaitu 5 menit.
Perlakuan E2S1 merupakan eksplan akar yang menggunakan bahan
sterilan Natrium hipoklorit (Naocl) dengan konsentrasi 5 % direndam selama
5 menit dan dilanjutkan perendaman alkohol 70 % selama 1 menit. Pada
diagram di atas dapat dilihat bahwa persentase tingkat kontaminasi adalah 0%.
Hal ini dimungkinkan tingkat konsentrasi sterilan Natrium hipoklortit 5%
pada eksplan akar sudah cukup kuat sehingga dapat menghalangi kontaminan
untuk menyerang eksplan maupun media. Perlakuan E2S2 merupakan
perlakuan eksplan akar yang menggunakan bahan sterilan Natrium hipoklorit
(Naocl) dengan konsentrasi 10 % direndam selama 5 menit dan dilanjutkan
perendaman alkohol 70 % selama 1 menit. Pada diagram di atas dapat dilihat
bahwa persentase tingkat kontaminasi mencapai 20%.
Pada perlakuan E1S1 konsentrasi sterilan adalah 5% kemudian pada
konsentrasi sterilan dinaikkan maka terjadi penurunan kontaminasi karena
sifat sterilan natrium hipokloroit yang menghilangkan kontaminan dengan
cara mengeluarkan cairan sel kontaminan melalui osmosis, sehingga semakin
tinggi konsentrasi sterilan maka cairan natrium hipoklorit akan semakin pekat
dan akan lebih kuat menarik keluar cairan sel kontaminan.Namun pada
perlakuan E2S1 dengan kadar sterilan 5% ketika konsentrasi sterilan
dinaikkan menjadi 10% pada perlakuan E2S2 justru mengalami kontaminasi,
padahal pada konsentrasi sterilan 5% sama sekali tidak mengalami
kontaminasi. Hal ini karena sumber kontaminan pada perlakuan E2S2 diduga
merupakan kontaminan internal, atau sumber kontaminasi yang sudah masuk
ke dalam sel eksplan, sedangkan proses sterilisasi yang dilakukan merupakan
sterilisasi permukaan sehingga tidak mencapai bagian dalam dari eksplan.
Kontaminan internal mungkin saja terdapat dalam suatu jaringan
tanaman, karena sebagian besar tumbuhan bersimbiosis dengan makhluk
hidup lain seperti bakteri maupun jamur. Mikroba yang hidup didalam
jaringan atau sel tumbuhan biasa disebut mikroba endofit atau endofitik.
Bakteri dapat bersifat endofitik hidup secara epifit di dalam sel atau ruang
antar sel tanaman (Nagy dkk, 1995). Mikroba endofit dapat ditemukan
hampir di semua tumbuhan di muka bumi ini, dan merupakan mikroba yang
tumbuh di dalam jaringan tumbuhan. Mikroba endofit dapat diisolasi dari
akar, batang dan daun suatu tumbuhan. Bakteri dan fungi adalah jenis mikroba
yang umum ditemukan sebagai mikroba endofit, akan tetapi yang banyak
inangnya dapat berbentuk simbiosis mutualisma sampai hubungan yang
patogenik (Strobel, 1996).
Eksplan akar pada penelitian ini berasal dari tempat tumbuh yang sama
sehingga kemungkinan besar ketika salah satu akar mengandung mikroba
endofit maka eksplan akar lainnya juga kemungkinan mengandung mikroba
endofit juga. Namun dari hasil penelitian hanya sedikit bagian akar yang
diduga mengandung mikroba endofit dilihat dari kontaminasi yang terjadi. Hal
ini diduga akar kencur mengandung senyawa tertentu yang juga merupakan
antibiotik sehingga dapat mengendalikan kontaminan.
Senyawa sesquiterpen dalam minyak atsiri kunyit merupakan turunan
dari senyawa terpen seperti alkohol yang bersifat bakterisida dengan merusak
struktur tersier protein bakteri atau denaturasi protein (Tarwiyah, 2001).
Kencur juga mempunyai turunan senyawa derivat monoterpen teroksigenasi
(misalnya borneol 0,03% dan kamfer hidrat 0,83%); serta monoterpen
hidrokarbon (misalnya kamfen 0,04% dan terpinolen 0,02%) (Sukari dkk,
2008).
Kurkumin pada kunyit adalah suatu senyawa fenolik. Turunan fenol ini
akan berinteraksi dengan dinding sel bakteri, selanjutnya terabsorbsi dan
penetrasi ke dalam sel bakteri, sehingga menyebabkan presipitasi dan
denaturasi protein, akibatnya akan melisiskan membran sel bakteri. Kencur
juga mempunyai kandungan fenol. Rimpang kencur mengandung antara lain
saponin, flavonoid, fenol serta minyak atsiri (Syamsuhidayat dan Johnny,
Senyawa antibiotik pada kencur diduga dapat menghalangi kontaminan
dari kencur itu sendiri. Studi terhadap 20 serbuk obat herbal campuran
menunjukkan bahwa spesies jamur kontaminan yang dominan adalah
Aspergillus. Selain Aspergillus juga diisolasi jamur lain seperti Paecilomyces,
Eurotium, Monascus, Acremonium, Penicillium, Cladosporium,
Scopulariopsis, Phialophora dan Fonseceae. Ekstrak dari obat herbal tersebut
ternyata mampu menghambat produksi aflatoksin dari Aspergillusparasiticus.
Semua ekstrak mengurangi produksi aflatoxin B1 dan aflatoxin G1 sebanyak
62–97%. Hal ini menunjukkanbahwa serbuk obat herbal campuran
mengandung kontaminan jamur yang lebih rendah, mungkin karena
kandungan senyawa aktif dalam serbuk obat herbal campuran tersebut
menghambat pertumbuhan jamur dan juga produksi aflatoksin (Fuat dkk,
2009).
Perlakuan E3S1 merupakan perlakuan eksplan rimpang yang
menggunakan bahan sterilan Natrium hipoklorit (Naocl) dengan konsentrasi 5
% direndam selama 5 menit dan dilanjutkan perendaman alkohol 70 % selama
1 menit. Pada diagram di atas dapat dilihat bahwa persentase tingkat
kontaminasi mencapai 60%. Hal ini dimungkinkan tingkat konsentrasi sterilan
Natrium hipoklortit 5% masih kurang kuat, sehingga sumber kontaminan
masih dapat hidup dan menyerang semua eksplan maupun media pada
perlakuan ini.
Perlakuan E3S2 merupakan perlakuan eksplan rimpang yang
menggunakan bahan sterilan Natrium hipoklorit (Naocl) dengan konsentrasi
selama 1 menit. Pada diagram di atas dapat dilihat bahwa persentase tingkat
kontaminasi mencapai 40%. Hal ini dimungkinkan tingkat konsentrasi sterilan
Natrium hipoklortit 10% belum cukup kuat menghalangi sumber kontaminan
untuk menyerang eksplan maupun media sehingga kontaminasi masih terjadi
namunkadar konsentrasi 10% lebih disarankan dibandingkan tingkat
konsentrasi 5% karena terdapat penurunan persentase kontaminasi.
Dari diagram diatas dapat dilihat bahwa menggunakan waktu
perendaman yang sama dengan tingkat konsentrasi yang berbeda
menghasilkan tingkat kontaminasi yang juga berbeda pada tiap eksplan yang
digunakan. Tingkat konsentrasi sterilan natrium hipoklorit (Naocl) 5%
menimbulkan efek yang berbeda pada tiga eksplan yang digunakan. Pada
eksplan daun kontaminasi yang terjadi mencapai 100%, pada eksplan akar
tidak terjadi kontaminasi atau tingkat kontaminasi 0%, sedang pada eksplan
rimpanng kontaminasi mencapai 60%. Tingkat konsentrasi sterilan natrium
hipoklorit (Naocl) 10% juga menimbulkan efek yang berbeda pada tiga
eksplan yang digunakan. Eksplan daun tidak mengalami kontaminasi atau
tingkat kontaminasi 0%, pada eksplan akar kontaminasi mencapai 20%,
sedangkan pada eksplan rimpang kontaminasi mencapai 40%.
Kombinasi beberapa tingkat konsentrasi bahan sterilan dan jenis
eksplan menghasilkan perpaduan yang menarik. Pada eksplan daun
konsentrasi sterilan yang baik adalah 10%. Untuk eksplan akar, konsentrasi
5% dan 10% bisa dikatakan sama baik, karena pada kedua tingkat konsentrasi
konsentrasi sterilan 5% lebih disarankan karena dengan tingkat konsentrasi
sterilan yang lebih sedikit tetapi sudah efektif untuk mengatasi kontaminan
eksternal. Sedang untuk eskplan rimpang, tingkat konsentrasi sterilan yang
baik adalah 10%. Terdapat dua eksplan yang persentase kontaminasinya 0%
atau dapat dikatakan bebas kontaminasi 100% yaitu eksplan daun dengan
konsentrasi sterilan 10% dan eskplan akar dengan konsentrasi sterilan 5%
.Eksplan yang tingkat kontaminasinya mencapai 0% dapat dianjurkan untuk
dilanjutkan pada tahap selanjutnya pada kultur jaringan. Pada tingkat
selanjutnya eksplan mana yang paling baik apakah eksplan daun atau akar,
tergantung pada perlakuan selanjutnya misalkan zat pengatur tumbuh yang
diberikan atau faktor penentu lainnya.
4.2Rerata Waktu Pertama Kontaminasi Muncul
Hasil pengamatan waktu pertama kontaminasi muncul menunjukkan
bahwa rerata waktu pertama kontaminasi muncul menunjukkan variasi waktu
yang beragam. Dalam pengamatan ini asal kontaminasi berpengaruh terhadap
waktu yang dibutuhkan sampai sumber kontaminasi muncul dalam media.
pertama. Data hasil pengamatan waktu pertama kontaminasi muncul dapat
dilihat pada tabel 4.1.
Tabel 4.1 Rerata waktu Pertama kontaminasi muncul (hari setelah inokulasi)
Perlakuan Rerata waktu pertama kontaminasi
E1S1 4,4
E1S2 -
E2S1 -
E2S2 18
E3S1 4,3
Dari data Tabel 4.1. Terlihat bahwa waktu pertama kontaminasi muncul
dari masing-masing perlakuan sterilisasi menunjukkan perlakuan E1S1
(Eksplan daun dengan Naocl 5% selama 5’ + alkohol 70 % selama 1’) rerata
waktu kontaminasi muncul adalah 4,4 hari setelah inokulasi (HSI). Perlakuan
E2S2( Eksplan akar dengan Naocl 10% selama 5’ + alkohol 70 % selama 1’)
mengalami kontaminasi dengan rerata waktu pertama kontaminasi adalah 18
HSI.
E3S1( Eksplan rimpang dengan Naocl 5% selama 5’ + alkohol 70 %
selama 1’) mengalami kontaminasi dengan rerata waktu pertama kontaminasi
adalah 4,3 HSI. E3S2( Eksplan rimpang dengan Naocl 5% selama 5’ +
alkohol 70 % selama 1’) mengalami kontaminasi dengan rerata waktu
pertama kontaminasi adalah 10,5 HSI.
Perbedaan waktu pertama terjadi kontaminasi diduga terkait dengan
jenis kontaminasi internal atau eksternal. Kontaminasi internal berarti sumber
kontaminasi berasal dari dalam jaringan atau sel eksplan, sehingga bisa lolos
dari sterilisasi permukaan yang dilakukan dan sumber kontaminan ini bisa
keluar lalu menyerang eksplan.
4.3Sumber kontaminasi
Kultur dapat terinfeksi satu atau lebih mikrobia seperti bakteri, fungi
berfilamen, yeast, virus dan fitoplasma. Kontaminasi merupakan masalah
serius yang menghambat keberhasilan untuk mendapatkan kultur aseptik (
penelitian ini menunjukkan bahwa sumber kontaminan disebabkan oleh jamur
maupun bakteri. Sumber kontaminan yang menyerang dapat dilihat pada tabel
4.2 berikut ini :
Tabel 4.2 Sumber Kontaminasi
PERLAKUAN
KONTAMINAN (%)
JAMUR BAKTERI JAMUR DAN
BAKTERI
E1S1 √ - -
E1S2 - - -
E2S1 - - -
E2S2 - √ -
E3S1 √ √ √
E3S2 √ - -
Dari tabel di atas dapat terlihat kontaminan yang bersumber dari jamur
menyerang beberapa perlakuan yang diteliti. Pada eksplan E1S1 ( Eksplan
daun dengan Naocl 5% selama 5’ + alkohol 70 % selama 1’) yang mengalami
kontaminasi 100%, sumber dari kontaminannya semua adalah jamur. Pada
perlakuan E3S1( Eksplan rimpang dengan Naocl 5% selama 5’ + alkohol 70
% selama 1’) yang mengalami kontaminasi 60%, semua sumber
kontaminasinya adalah jamur. Pada perlakuan E3S2 ( Eksplan rimpang
dengan Naocl 10% selama 5’ + alkohol 70 % selama 1’) yang mengalami
kontaminasi 40% sumber dari kontaminannya semua adalah jamur. Menurut
Wudianto (2002) jamur/cendawan pada umumnya berbentuk seperti benang
halus yang tidak bisa dilihat dengan mata telanjang. Namun, kumpulan dari
benang halus ini yang disebut miselium bisa dilihat dengan jelas.
Kematian eksplan akibat kontaminasi jamur umumnya terjadi karena
pertumbuhan cendawan yang lebih cepat daripada pertumbuhan eksplan
dan dapat menginvasi (menutupi) eksplan. Pada eksplan daun terdapat banyak
kontaminan jamur diduga karena daun mengalami kontak langsung dengan
udara, sedang udara adalah sumber banyak spora jamur.
Adanya dominasi cendawan dalam botol kultur mengakibatkan eksplan
yang ditanam tidak memiliki ruang tumbuh yang cukup sehingga
pertumbuhannya menjadi terhambat dan akhirnya berujung pada kematian
eksplan. Berdasarkan hasil pengamatan yang telah dilakukan eksplan yang
mengalami kontaminasi karena jamur dapat diketahui bahwa terdapat warna
jamur yang berbeda. Menurut Wudianto (2002) warna miselium
bermacam-macam yaitu ada yang berwarna putih, cokelat, hitam, merah dan lain
sebagainya. Warna miselium jamur yang menyerang dapat dilihat pada tabel 3
berikut :
Tabel 4.3 Warna Miselium Jamur
Perlakuan Warna miselium jamur
E1S1 Hitam
E1S2 -
E2S1 -
E2S2 -
E3S1 Merah muda
E3S2 Hitam
a. Kontaminan jamur dengan b. Kontaminan jamur dengan
hifa hitam hifa putih dan merah muda
Jamur yang berwarna hitam diduga adalah mucor atau Rhizopus,
keduanya belum bisa dibedakan. Menurut Susilowati (2001) :
Klasifikasi Mucor
Divisi : Amastigomycota
Subdivisi : Zygomucotina
Kelas : Zygomycetes
Ordo : Mucorales
Familia : Mucoraceae
Genus : Mucor
Ciri morfologi koloni : hifa seperti benang putih; bagian tertentu
tampaksporangium dan sporangiofor berupa
titik-titik hitam seperti jarum pentul. Ciri mikroskopis:
hifa tanpasekat, terdapat sporangium dan
sporangiospora.
Klasifikasi Rhizopus
Divisi : Amastigomycota
Subdivisi : Zygomycotina
Kelas : Zygomycetes
Ordo : Mucorales
Familia : Mucoraceae
Genus : Rhizopus
Ciri morfologi koloni : hifa seperti benang berwarna putih sampai
kelabuhitam; bagian tertentu tampak sporangium
jarum pentul. Ciri mikroskopis: hifa tanpa sekat,
terdapat rizoid dan sporangiospora.
Dilaporkan rhizopus kerap menyerang beberapa tanaman herbal.
Pengujian terhadap produk herbal yang sering digunakan oleh penderita AIDS
yang diperoleh dari pasar lokal,supermarket jaringan dan penderitaAIDS di
Missouri, AS menunjukkanadanya kontaminasi Staphylococcusauricularis,
Enterococcus casseliflavus,Enterobacter agglomerans, E.intermedius,
Klebsiella pneumoniae,Sphingomonas aucimobilis, kapangRhodotorula
mucilaginosa, serta jamurAspergillus nige (dan spesies Aspergillus spp. yang
lain) dan Rhizopus spp (Kineman dkk, 2002). Studi terhadap 91
sampeltanaman obat di Brazil menemukanadanya kontaminan jamur dari
generaAspergillus, Penicillium, Alternaria,Chaetomium, Cladosporium,
Mucor, Paellomyces, Phoma, Rhyzopus danTrichoderma (Bugno dkk, 2006).
Kontaminan tidak hanya bersumber dari jamur tetapi juga dari bakteri.
Kontaminan bakteri dapat bersifat inisial, laten, maupun introduksi. Inisial bila
kontaminan dari eksplan yang kurang sempurna dalam proses sterilisasi, laten
bila kontaminana tidak menunjukkan sifat patogenik in-situ namun
berkembang pada media kultur, introduksi bila kontaminan berasal dari
lingkungan laboratorium akibat penanganan sterilisasi alat dan ruangan yang
kurang baik (Wolf, 2007).
Pada eksplan E2S2 ( Eksplan akar dengan Naocl 10% selama 5’ +
alkohol 70 % selama 1’) yang mengalami kontaminasi 20%, sumber
kontaminannya adalah bakteri. Pada perlakuan E3S1( Eksplan rimpang
kontaminasi 60%, sumber kontaminasinya sebagian adalah bakteri. Menurut
Darmono (2003) kontaminasi bakteri yang menyerang eksplan umumnya
ditandai dengan keluarnya cairan warna putih keruh seperti susu dan berbau
busuk. Sandra (2002) juga menyebutkan kontaminsi oleh bakteri
menyebabkan pembusukan, biasanya ditandai dengan keluarnya lendir dan
bau busuk.
Kontaminan bakteri yang sering dijumpai pada kultur in vitro adalah
Agrobacterium, Bacillus, Corynebacterium, Enterobacter, Lactobacillus,
Pseudomonas, Staphylococcus, dan Xanthomonas (Wolf, 2007). Bila sumber
kontaminan dari berbagai macam tanah diuji di media agar maka akan
terbentuk koloni bakteri yang sangat bervariasi yaitu : 5-60% Arthrobacter,
7-67% Bacillus, 3-15% Pseudomonas, lebih dari 20% Agrobacterium, 2-12%
Alcaligans dan 2-10% Flavobacterium, sedangkan kurang dari 5% dari koloni
sel Corynobacterium, Micrococcus, Staphylococcus, Xanthomonas,
Mycobacterium dan Sarcina (Alexander, 1979).
Pada kultur in vitro karakteristik koloni bakteri dapat diamati langsung
, diantaranya dikenali dengan adanya lendir berwarna putih, coklat, merah
muda atau kuning (Wolf, 2007). Ciri bakteri menurut Cantika (2006) :
Pseudomonas sp. : Berlendir bening hingga putih susu.
Planococcus citreus : Sangat putih, ujung koloni tidak beraturan.
Pseudomonas putida : Lendir putih, media berubah warna menjadi pink
hingga merah.
Pseudomonas sp. merupakan bakteri yang dapat berkembang biak
secara bebas di lingkungan alam, bakteri gram negatif, berbentuk batang dan
dapat bersifat patogen terhadap manusia, hewan dan tanaman. Pseudomonas
solanacearum merupakan species yang menjadi patogen banyak tanaman
(Holt dkk, 1994). Pseudomonas solanacearum adalah bakteri penyebab
penyakit layu pada tanaman heliconia (Sewake dan Uchida, 1995). Genus
Pseudomonas hidup di tanah dan membutuhkan energi dari luar. Jumlah genus
ini di dalam tanah tergantung banyaknya substrat yang ditambahkan untuk
energinya (Rao, 1994). Pseudomonas sp. masuk ke jaringan tanaman pada
proses pemeliharaan tanaman. Bakteri dapat menyebar melalui tanah yang
digunakan sebagai media tanam.
Planococcus citreus adalah bakteri gram positif berbentuk bulat atau
kokus yang berhabitat di lautan yang sangat toleran dengan kondisi garam
yang tinggi dan tidak bersifat patogen terhadap tanaman (Holt dkk, 1994).
Apabila bakteri hidup dalam suatu organisme hidup dapat bersifat patogen
karena organisme tersebut dapat menjadi sumber makanannya (Pelczar dan
Chan, 1986). Eksplan yang terkontaminasi Planococcus citreus mengalami
perubahan warna menjadi coklat dan seperti menyusut. Menurut Rodriguez
(1988) Planococcus sp. dapat ditemukan pada tanah yang hiper salin,
barang-barang yang mengandung garam tinggi dan makanan laut makarel.
Penyebarannya ke dalam tanaman dapat melalui sumber air yang digunakan
Pseudomonas putida di dalam tanah bersifat menguntungkan untuk
pertumbuhan tanaman. Pseudomonas putida berkembang biak di dalam akar
dan rizosfer, meningkatkan penyediaan nutrisi, mengeliminasi
mikroorganisme patogen dan memproduksi metabolit untuk pertumbuhan
tanaman (Vancura, 1989). Meskipun bakteri ini bersifat menguntungkan,
namun responnya dapat berbeda pada kultur in vitro karena eksplan yang
terkontaminasi bakteri ini tetap saja mengalami kematian. Beberapa strain dari
Pseudomonas putida memproduksi senyawa yang berbahaya untuk tanaman.
Perbedaan kontaminasi eksplan yang disebabkan oleh Pseudomonas
putida dengan Pseudomonas sp adalah bakteri tersebut memproduksi zat
warnaatau pigmen yang dapat merubah warna media yang awalnya bening
menjadi pink hingga merah darah. Margalith (1992) menyatakan bahwa
bakteri dapat menghasilkan zat warna dengan mereduksi senyawa NO3 atau
memiliki pigmen dalam tubuhnya. Menurut Holt dkk. (1994) Pseudomonas
putida memilki pigmen flourescent secara alami dalam tubuhnya.
Kurthia Gibsonii adalah bakteri gram positif berbentuk batang yang
hidup pada kotoran hewan dan makanan yang berbahan baku daging. Bakteri
ini tidak bersifat patogen (Holt dkk, 1994). Penyebarannya dapat melalui
pupuk organik yang terdapat pada media tanam atau air yang sudah tercemari
bakteri ini. Pada awalnya bakteri ini tidak menyebabkan perubahan apapun
terhadap eksplan, namun bakteri ini sangat cepat berkembang hingga
menutupi permukaan media dan eksplan menjadi tergenang. Keadaan ini
menyebabkan eksplan tidak dapat bertahan dan berkembang lagi dan akhirnya
a. Kontaminan bakteri dengan b. Kontaminan bakteri dengan
lendir putih kekuningan lendir merah muda
Gambar 4.3. Sumber kontaminan bakteri
Setelah diidentifikasi maka diduga bakteri yang menyerang pada
penelitian ini dapat dilihat pada tabel 4 berikut :
Tabel 4.4. Jenis bakteri
Perlakuan Jenis bakteri
E1S1 -
E1S2 -
E2S1 -
E2S2 Pseudomonas putida
E3S1 Pseudomonas sp
E3S2 -
Pseudomonas dilaporkan terdapat pada tanaman herbasius temulawak.
Hasil penelitian menunjukan bahwa sebanyak 4 isolat bakteri endofit berhasil
diisolasi dari rimpang temulawak , yaitu spesies Actinomyces viscosus dan
Pseudomonas stutzeri dari Batu, Actinomces viscosus dan Bacillus brevis dari
Purwodadi pada temulawak (Imawati, 2015). Dalam praktek laboratorium,
glukosa secara luas digunakan sebagai sumber karbon organik, tetapi berbagai
senyawa lain juga dapat digunakan secara khusus atau sumber karbon tertentu
menggunakan lebih dari 100 senyawa organik yang berbeda sebagai
satu-satunya sumber karbon dan energi.
Pada penelitian ini dalam satu botol kultur bisa terdapat satu sumber
kontaminan bisa juga terdiri dari beberapa sumber kontaminan. Seringkali
bakteri-bakteri tersebut berasosiasi dengan spora atau miselia fungi (Wolf,
2007). E3S1( Eksplan rimpang dengan Naocl 5% selama 5’ + alkohol 70 %
selama 1’) yang mengalami kontaminasi 60%, sebagian sumber
kontaminasinya adalah jamur dan bakteri sekaligus dalam satu botol kultur.
Setelah dilakukan identifikasi diketahui jamur yang menyerang adalah jamur
dengan warna miselium merah muda dan bakteri yang menyerang diduga
adalah Pseudomonas putida. Pada eksplan akar dan rimpang sumber
kontaminasi bervariasi berupa bakteri dan jamur. Hal diduga karena tanah
merupakan tempat hidup bakteri dan jamur tertentu, selain itu diduga terdapat