3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian dilaksanakan mulai bulan Februari 2011 sampai dengan Juni 2011. Sampel lamun (Syringodium isoetifolium) diambil dari kawasan Taman Nasional Kepulauan Seribu (TNKS). Proses preparasi sampel dan perhitungan rendemen dilakukan di Laboratorium Karakteristik Bahan Baku. Analisis proksimat (kadar air, abu, lemak, protein dan abu tidak larut asam) dilakukan di Laboratorium Mikrobiologi Hasil Perairan. Analisis serat pangan dilakukan di Laboratorium Teknologi Pangan, Fakultas Teknologi Pertanian. Proses ekstraksi dilakukan di Laboratorium Biokimia Hasil Perairan. Proses maserasi dilakukan di Laboratorium Bioteknologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Proses evaporasi dilakukan di Laboratorium Mikromedik Terpadu, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Uji total fenol dan fitokimia dilakukan di Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Uji aktivitas antioksidan dilakukan di Laboratorium Uji Biofarmaka (LUB) IPB.
3.2 Bahan dan Alat
Bahan utama yang digunakan pada penelitian ini adalah lamun
Syringodium isoetifolium. Bahan pembantu yang digunakan untuk analisis proksimat antara lain air, aquades, pelarut lemak (n-heksana), kjeltab jenis selenium, larutan H2SO4 pekat, NaOH 40%, H3BO3 2%, bromcherosol
green-methyl red berwarna merah muda, HCl 0,1 N, HgO, H2O2 dan AgNO3. Bahan-bahan untuk uji serat makanan (dietary fibre) adalah etanol, akuades, aseton,
buffer phospat, NaH2PO4 anhidrat, enzim thermamyl, HCl, pepsin, NaOH, dan pankreatin. Bahan-bahan yang digunakan untuk ekstraksi adalah metanol, etil asetat dan n-heksana. Bahan yang digunakan untuk uji aktivitas antioksidan meliputi ekstrak kasar metanol, etil asetat, n-heksana, kristal 1,1-difenil-2 -pikrilhidrazil (DPPH) dan antioksidan sintetik BHT (Butylated Hydroxytoluena) sebagai pembanding. Bahan-bahan untuk uji total fenol adalah etanol, akuades,
Na2CO3 5%, reagen Folin-Ciocalteau 50%, dan asam galat. Bahan-bahan yang dibutuhkan untuk uji fitokimia meliputi pereaksi Wagner, pereaksi Meyer, pereaksi Dragendroff (uji alkaloid), kloroform, anhidra asetat, asam sulfat pekat (uji steroid), serbuk magnesium, amil alkohol (uji flavonoid), air panas, larutan HCl 2 N (uji saponin) dan etanol 70%, larutan FeCl3 5% (uji fenol hidrokuinon).
Alat-alat yang digunakan untuk pengambilan sampel antara lain cangkul, pipa paralon, kotak, dan plastik. Alat-alat yang digunakan untuk proses preparasi, uji proksimat dan serat pangan meliputi baskom, timbangan digital, pisau, sudip, cawan porselen, gegep, desikator, oven, kompor listrik, alumunium foil, tanur pengabuan, kertas saring Whatman 42, kapas bebas lemak, labu lemak, kondensator, tabung soxhlet, penangas air, labu kjeldahl, destilator, labu Erlenmeyer, buret, pipet volumetri. Alat-alat yang digunakan untuk proses ekstraksi meliputi gelas ukur, pipet volumetrik, erlenmeyer, corong kaca, botol vial, gelas piala, alumunium foil, orbital shaker dan rotary vacuum evaporator. Alat-alat yang digunakan untuk uji total fenol, fitokimia dan aktivitas antioksidan meliputi microplate, elisa reader, multipipette, micropipette dan spektrofotometer UV-Visible (UV-Vis).
3.3 Tahapan Penelitian
Penelitian ini terdiri dari beberapa tahapan, yaitu tahap pengambilan dan preparasi sampel, analisis proksimat (kadar air, kadar lemak, kadar protein, kadar karbohidrat dan kadar abu), kadar abu tak larut asam, uji serat pangan (dietary
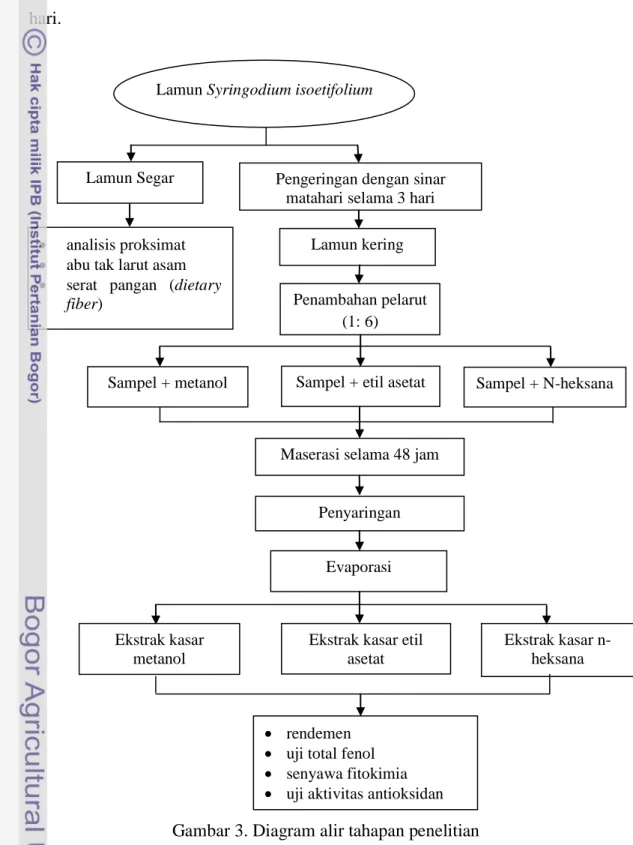
fiber), tahap pembuatan ekstrak kasar sampel, total fenol, aktivitas antioksidan, dan uji fitokimia. Tahapan penelitian ini dapat dilihat pada Gambar 3.
3.3.1 Pengambilan dan preparasi sampel
Pengambilan sampel lamun (Syringodium isoetifolium) dilakukan pada tanggal 19 Februari 2011, di Pulau Pramuka, Taman Nasional Kepulauan Seribu. Pengambilan sampel dilakukan dengan mengambil lamun jenis Syringodium isoetifolium dari habitatnya dengan menggunakan cangkul dan pipa paralon. Lamun tersebut kemudian dimasukkan dalam wadah berisi air laut perairan tempat hidupnya. Hal ini bertujuan untuk menjaga kelangsungan hidup lamun selama proses transportasi ke laboratorium Karakteristik Bahan Baku, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan,
Institut Pertanian Bogor. Lamun kemudian dibersihkan dari pasir dan kotoran-kotoran yang menempel dengan menggunakan air laut. Setelah bersih, lamun yang segar digunakan untuk uji proksimat, abu tidak larut asam dan serat pangan (dietary fiber), sedangkan untuk uji total fenol, aktivitas antioksidan dan fitokimia menggunakan lamun yang sudah dikeringkan dengan sinar matahari selama tiga hari.
Gambar 3. Diagram alir tahapan penelitian Evaporasi
Ekstrak kasar metanol
Ekstrak kasar etil asetat
Ekstrak kasar n-heksana
rendemen uji total fenol senyawa fitokimia uji aktivitas antioksidan Lamun Segar
analisis proksimat abu tak larut asam serat pangan (dietary
fiber)
Lamun kering Lamun Syringodium isoetifolium
Pengeringan dengan sinar matahari selama 3 hari
Penambahan pelarut (1: 6)
Sampel + metanol Sampel + etil asetat Sampel + N-heksana
Maserasi selama 48 jam
3.3.2 Analisis proksimat (AOAC 2005) dan abu tidak larut asam (BSN 2000) Analisis proksimat merupakan suatu analisis yang dilakukan untuk memprediksi komposisi kimia suatu bahan, termasuk di dalamnya analisis kadar air, abu, lemak, protein dan karbohidrat.
1) Analisis kadar air (AOAC 2005)
Analisis kadar air dilakukan mengacu pada AOAC 2005. Cawan porselen dikeringkan dalam oven selama 30 menit, lalu didinginkan dalam desikator selama 15 menit. Selanjutnya sampel ditimbang sebanyak 5 g dalam cawan dan dikeringkan dalam oven pada suhu 100 oC dalam tekanan tidak lebih dari 10 mmHg selama 5 jam atau sampai beratnya konstan. Cawan beserta isinya kemudian didinginkan dalam desikator dan ditimbang. Perhitungan kadar air dapat dilihat sebagai berikut :
Keterangan :
A = berat cawan kosong (gram)
B = berat cawan + sampel awal (gram) C = berat cawan + sampel kering (gram)
2) Analisis kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu 105 oC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu 600 oC selama 1 jam, kemudian ditimbang hingga didapatkan berat yang konstan. Kadar abu ditentukan dengan rumus:
Keterangan : A = Berat cawan porselen kosong (gram) B = Berat cawan dengan sampel (gram)
3) Analisis kadar protein (AOAC 1980)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahap yaitu destruksi, destilasi, dan titrasi. Pengukuran kadar protein dilakukan dengan metode mikro Kjeldahl. Sampel ditimbang sebanyak 0.25 gram, kemudian dimasukkan ke dalam labu Kjeldahl 100 ml, lalu ditambahkan 0.25 gram selenium dan 3 ml H2SO4 pekat. Contoh didestruksi pada suhu 410 oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu Kjeldahl ditambahkan 50 ml akuades dan 20 ml NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100 oC. Hasil destilasi ditampung dalam labu Erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 40 ml dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Lalu destilat dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh. Dengan metode ini diperoleh kadar nitrogen total yang dihitung. Kadar protein dihitung dengan rumus sebagai berikut:
Keterangan : Faktor konversi alat = 2,5
Kadar protein (%) = %N x faktor konversi (6,25)
4) Analisis kadar lemak (AOAC 2005)
Contoh seberat 5 gram (W1) dimasukkan ke dalam kertas saring pada kedua ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan dengan tabung soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung soxhlet dan disiram dengan pelarut lemak (benzena). Kemudian dilakukan refluks selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu
105 oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3).
Perhitungan kadar lemak :
Keterangan :
W1 = Berat sampel (gram)
W2 = Berat labu lemak kosong (gram) W3 = Berat labu lemak dengan lemak (gram)
5) Analisis Abu kadar abu tidak larut asam menurut SNI-01-3836-2000 (BSN 2000)
Abu bekas pengukuran kadar abu total dilarutkan dengan penambahan 25ml HCl 10%. Larutan tersebut kemudian dipanaskan selama 5 menit dan larutan disaring dengan kertas saring bebas abu. Larutan yang sudah disaring tersebut kemudian dicuci dengan air suling sampai bebas klorida. Kertas saring lalu dikeringkan dengan oven dan setelah kering kertas saring dimasukkan di dalam cawan porselin yang sudah diketahui berat tetapnya. Cawan porselen berisi kertas saring tersebut kemudian dibakar dan diabukan dalam tanur listrik pada suhu 600 ⁰C. Setelah dilakukan pengabuan sampel didinginkan di dalam desikator dan kemudian ditimbang beratnya. Kadar abu tidak larut asam dengan rumus:
3.3.3Analisis Serat Pangan (dietary fiber) (Asp et al. 1983)
Analisis serat pangan dilakukan mengacu pada metode multi enzim (Asp
et al. 1983). Serat pangan terdiri atas serat makanan larut dan serat makanan tak larut. Analisis serat pangan diawali dengan menghaluskan sampel kemudian dihomogenkan dan diliofilisasi. Sampel yang akan digunakan adalah sampel dalam keadaan tanpa lemak dan air. Oleh karena itu, dilakukan ekstraksi lemak dan pengeringan. Sampel tanpa lemak dan air ditimbang sebanyak 1 gram lalu ditambahkan 25 ml buffer phospat dan 0,1 ml enzim thermamil. Selanjutnya sampel dipanaskan pada suhu 80 oC selama 15 menit. Setelah dipanaskan, sampel didinginkan dan dilakukan pengaturan pH menjadi 1,5 dengan menggunakan HCl
4N lalu dilakukan penambahan 1 ml suspensi pepsin dan sampel diinkubasi dalam suhu 37 oC selama 2 jam. Selanjutnya dilakukan pengaturan pH menjadi 6,8 dengan menggunakan NaOH 4N. Setelah dilakukan pengaturan pH, sampel ditambahkan suspensi pankreatin dan diinkubasi dalam suhu 37 oC selama 2 jam kemudian dilakukan pengaturan pH kembali dengan menggunakan HCl 4N hingga diperoleh larutan sampel dengan pH 4,5.
1) Analisis serat pangan tidak larut air (SPTL)
Analisis serat pangan tidak larut air dilakukan dengan menyaring larutan sampel pH 4,5 dengan kertas saring Whatman 40 hingga diperoleh filtrat dan residu. Residu yang diperoleh dibilas dengan akuades dan dicuci dengan 50 ml etanol 78%. Selanjutnya dilakukan pencucian kembali dengan menggunakan aseton lalu dipanaskan dalam oven dengan suhu 105 oC selama 3 jam. Setelah dioven. sampel didinginkan dan ditimbang kemudian diarangkan dan ditanur dalam suhu 550 oC. Selanjutnya sampel didinginkan dan ditimbang lalu dilakukan perhitungan dengan rumus berikut.
Keterangan :
A = Berat sampel
B = Berat kertas saring kosong
C = Berat kertas saring + residu setelah dioven D = Berat cawan porselen kosong
E = Cawan porselen + abu setelah ditanur 2) Analisis serat pangan larut air (SPL)
Analisis serat pangan larut air dilakukan dengan penambahan 400-500 ml etanol 95% pada filtrat yang diperoleh dari analisis serat pangan tak larut. Selanjutnya sampel dipanaskan hingga 60 oC dalam waterbath kemudian didiamkan selama 1 jam. Sampel disaring dengan kertas saring Whatman 40 hingga diperoleh residu dan filtrat. Residu yang diperoleh kemudian dibilas dengan akuades dan dicuci dengan 50 ml etanol 78% lalu dicuci kembali dengan aseton. Selanjutnya sampel dipanaskan dalam oven dengan suhu 105 oC selama 3 jam. Sampel didinginkan dan ditimbang kemudian diarangkan dan ditanur dalam suhu 550 oC. Sampel yang telah dingin selanjutnya ditimbang dan dilakukan perhitungan dengan rumus berikut.
Keterangan :
A = Berat sampel
F = Berat kertas saring kosong
G = Berat kertas saring + residu setelah dioven H = Berat cawan porselen kosong
I = Cawan porselen + abu setelah ditanur 3.3.4 Ekstraksi bahan aktif (Andayani et al. 2008)
Ekstraksi yang digunakan dalam penelitian ini menggunakan metode yang digunakan oleh Andayani et al. 2008 yang dimodifikasi. Ekstraksi dilakukan untuk menghasilkan ekstrak kasar lamun dengan menggunakan pelarut. Komponen antioksidan pada lamun diperoleh melalui ekstraksi tunggal dengan menggunakan tiga macam pelarut berdasarkan tingkat kepolarannya yaitu metanol (polar), etil asetat (semipolar) dan n-heksana (nonpolar). Lamun yang telah dikeringkan kemudian dihaluskan dengan menggunakan blender sehingga diperoleh tekstur yang halus.
Ekstraksi bahan aktif dilakukan dengan melarutkan sampel tersebut ke dalam pelarut. Lamun yang telah dihaluskan kemudian ditimbang sebanyak 20 g dan ditambahkan pelarut sebanyak 120 ml. Setelah itu, sampel dimaserasi yaitu ekstraksi dengan mengaduk sampel dalam pelarut selama 48 jam menggunakan
orbital shaker pada suhu ruang. Tahap selanjutnya adalah filtrasi. Tahap filtrasi adalah menyaring sampel hasil ekstraksi dengan menggunakan kertas saring whatman 42. Filtrat yang diperoleh kemudian ditampung ke dalam botol. Setelah diperoleh ekstrak hasil penyaringan, pelarut dari setiap ekstrak diuapkan dengan menggunakan vacuum rotary evaporator pada suhu 40 oC hingga ekstrak menjadi pasta. Ekstrak kasar yang diperoleh kemudian dilakukan uji aktivitas antioksidan dengan metode DPPH, analisis fitokimia dan uji total fenol.
3.3.5 Uji Kandungan Total Fenol (Ramamoorthy dan Bono 2007)
Uji kandungan total fenol dilakukan untuk mengetahui jumlah fenol yang terdapat pada sampel. Metode yang dipakai mengacu pada metode penelitian Ramamoorthy dan Bono (2007). Ekstrak kasar dengan berat sekitar 5 - 10 mg ditimbang lalu diilarutkan dengan 2 ml etanol 95%. Kemudian larutan ditambahkan 5 ml akuades dan 0,5 ml reagen Folin-Ciocalteau 50% (v/v).
Campuran didiamkan selama 5 menit dan ditambahkan 1 ml Na2CO3 5% (b/v). Campuran dihomogenkan lalu diinkubasi dalam kondisi gelap selama satu jam. Serapan yang dihasilkan diukur dengan spektrofotometer UV-Visible pada panjang gelombang 725 nm. Asam galat digunakan sebagai standar dengan konsentrasi 5, 10, 15, 25, dan 50 mg/l. Kandungan total fenol diinterpretasikan sebagai milligram ekivalen asam galat (GAE = Galic Acid Equivalent) per 100 g sampel (mg GAE/100 g sampel).
3.3.6 Uji senyawa fitokimia (Harborne 1987)
Uji fitokimia dilakukan untuk mengetahui ada tidaknya komponen-komponen bioaktif yang terdapat pada ekstrak kasar lamun yang memiliki aktivitas antioksidan tertinggi. Uji fitokimia yang dilakukan pada lamun
Syringodium isoetifolium hanya uji metabolit sekunder yang meliputi uji alkaloid, uji steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon dan uji tannin. 1) Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Pereaksi Meyer dibuat dengan cara menambahkan 1 ml HgCl2 dengan 0,5 gram KI lalu dilarutkan dan diencerkan dengan akuades menjadi 100 ml
dengan labu takar. Pereaksi ini tidak berwarna. Pereaksi Wagner dibuat dengan cara 10 ml akuades dipipet kemudian ditambahkan 2,5 gram iodin dan 2 gram kalium iodida lalu dilarutkan dan diencerkan dengan akuades menjadi 200 ml dalam labu takar. Pereaksi ini berwarna coklat. Pereaksi Dragendorff dibuat dengan cara 0,8 gram bismut subnitrat ditambahkan dengan 10 ml asam asetat dan 40 ml air. Larutan ini dicampur dengan larutan yang dibuat dari 8 gram kalium iodida dalam 20 ml air. Sebelum digunakan, 1 volume campuran ini diencerkan dengan 2,3 volume campuran 20 ml asam asetat glasial dan 100 ml air. Pereaksi ini berwarna jingga.
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi yang kering. Kemudian ke dalamnya ditambahkan 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat. Terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau menunjukkan reaksi positif.
3) Flavonoid
Sejumlah sampel ditambahkan serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 ml alkohol kemudian campuran dikocok. Terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid. 4) Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
5) Fenol hidrokuinon (pereaksi FeCl3)
Sebanyak 1 gram sampel diekstrak dengan 20 ml etanol 70%. Larutan yang dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3 5%. Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan.
6) Tanin
Sejumlah sampel kemudian ditambahkan pereaksi FeCl3. Terbentuknya warna merah tua menunjukkan terdapat komponen tanin di dalam bahan.
3.3.7 Uji aktivitas antioksidan dengan Metode DPPH (Salazar-Aranda et al. 2009)
Ekstrak kasar lamun dari hasil ekstraksi tunggal menggunakan pelarut metanol (polar), etil asetat (semipolar) dan n-heksana (nonpolar) dilarutkan dalam etanol dengan konsentrasi yang berbeda. Pelarut metanol dan etil asetat dilarutkan dalam etanol dengan konsentrasi 31,25, 62,5, 125, 250, 500 dan 1000 ppm. Pelarut n-heksana dilarutkan dalam etanol dengan konsentrasi 650, 700, 750, 800, 850 dan 900 ppm. Antioksidan sintetik BHT digunakan sebagai pembanding dan kontrol positif. BHT dibuat dengan cara dilarutkan dalam pelarut etanol dengan konsentrasi 0,24; 0,48; 0,97; 1,95; 3,90; 7,81 dan 15,625 ppm. Larutan DPPH yang akan digunakan, dibuat dengan melarutkan kristal DPPH dalam pelarut etanol dengan konsentrasi 1 mM.
Uji aktivitas antioksidan dilakukan berdasarkan kemampuan sampel yang digunakan dalam mereduksi radikal bebas stabil DPPH. Sebanyak 1 mg ekstrak kasar dan BHT sebagai kontrol positif ditimbang lalu ditambahkan etanol dengan perbandingan 1:1000. Selanjutnya 1,3 mg DPPH diencerkan dengan 25 ml etanol. 1 µl etanol diisikan ke dalam microplate yang telah disiapkan. Setelah itu, dilakukan pengisian ekstrak dengan beberapa konsentrasi dan penambahan larutan DPPH. Campuran dihomogenkan dan diinkubasi pada suhu 37 oC selama 30 menit. Serapan yang dihasilkan diukur dengan spektrofotometer UV-Visible pada panjang gelombang 517 nm.
Persentase penghambatan aktivitas radikal bebas diperoleh dari nilai absorbansi sampel. Persamaan regresi diperoleh dari hubungan antara konsentrasi sampel dan presentase pengahambatan aktivitas radikal bebas. Nilai konsentrasi penghambatan aktivitas radikal bebas sebanyak 50% (IC50) dihitung dengan menggunakan persamaan regresi. Nilai IC50 diperoleh dengan memasukkan Y=50 serta nilai A dan B yang telah diketahui. Nilai x sebagai IC50 dapat dihitung dengan persamaan :
y = A + B Ln(x)
Keterangan : y = persen inhibisi A = slope
B = intercept
x = konsentrasi sampel (mg/l)
3.4 Rancangan Percobaan dan Analisis Data
Perlakuan pada penelitian ini adalah penggunaan jenis pelarut yaitu polar (metanol), semipolar (etil asetat) dan nonpolar (n-heksana). Semua perlakuan dilakukan sebanyak dua kali ulangan. Hipotesis rancangan acak lengkap (RAL) terhadap rendemen, total fenol dan aktivitas antioksidan ekstrak adalah sebagai berikut:
H0 : jenis pelarut tidak berpengaruh nyata terhadap nilai rendemen, total fenol dan aktivitas antioksidan (αi = 0)
H1 : jenis pelarut berpengaruh nyata terhadap nilai rendemen, total fenol dan aktivitas antioksidan (α ≠ 0)
Model rancangan yang digunakan untuk menganalisis data rendemen hasil ekstrak, total fenol dan aktivitas antioksidan adalah rancangan acak lengkap (RAL) dengan model sebagai berikut :
Yij = μ + αi + εij
Keterangan :
Yij = hasil pengamatan rendemen ekstrak, uji total fenol, aktivitas antioksidan dan jenis pelarut (i) pada ulangan ke-j
µ = rataan umum
αi = pengaruh jenis pelarut
εij = sisaan akibat jenis pelarut taraf ke-i pada ulangan ke-j
Analisis ragam digunakan untuk menganalisis data. Uji lanjut Duncan digunakan jika analisis ragam menunjukkan hasil berbeda nyata.
Keterangan :
Sy = Significant range
KTS = kuadran tengah sisa r = ulangan
qa’ = significant studentized range