Larry Brown Tom Holme
Bab 8
Molekul dan Material
Tujuan bab
• Menjelaskan struktur grafit dan intan dan menjelaskan
bagaimana sifat masing-masing zat muncul dari strukturnya
• Menjelaskan susunan atom dalam kisi kristal kubus dan menghitung efisiensi pengepakan
• Menggunakan teori pita untuk menjelaskan ikatan dalam padatan
• Menggambar diagram pita logam, isolator, dan semikonduktor (termasuk material tipe-n dan tipe-p)
• Mengidentifikasi material sebagai logam, isolator, atau semikonduktor dari diagram pita-nya
• Menjelaskan bagaimana sifat listrik logam, isolator, dan
semikonduktor terkait dengan ikatan kimianya
• Identifikasi jenis-jenis gaya antarmolekul zat
• Menjelaskan hubungan antara gaya antarmolekul dan sifat- sifat seperti titik didih dan tekanan uap
• Menjelaskan pertumbuhan polimer melalui reaksi adisi dan reaksi kondensasi dan memprediksi proses polimerisasi
mana yang mungkin penting dari suatu monomer
• Menjelaskan hubungan antara sifat polimer dan struktur
molekul
Struktur karbon
• Ada tiga bentuk unsur karbon: grafit, intan, dan fulleren (ditemukan pada 1985 dalam bentuk C60)
Struktur grafit
(pensil, pelumas, dan bahan komposit)
Struktur intan
(mata bor dan perhiasan)
Struktur fulleren C60 (aplikasi masih
dieksplorasi)
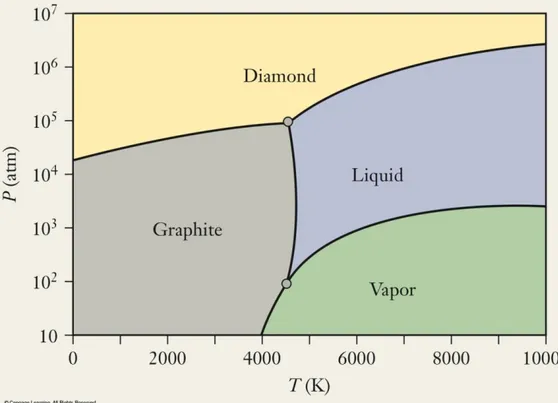
Diagram fase karbon
• Diagram fase memetakan keadaan atau fase
senyawa atau unsur yang paling stabil pada
kombinasi tekanan dan suhu
• Keadaan atau fase
suatu senyawa dapat
dimanipulasi dengan
mengubah suhu dan
tekanan senyawa
Tabung nano karbon
• Tabung nano karbon
adalah jenis fulleren yang memiliki sifat luar biasa
• Kekuatan tarik lebih tinggi dari keuatan baja
• Tabung nano karbon tumbuh bersama unsur logam terlingkup di dalamnya (kabel yang selebar satu molekul)
• Baru-baru ini ditemukan berbagai bentuk tabung nano karbon
Diagram fasa
Diagram fase air Diagram fase karbondioksida
Padatan
• Dua jenis padatan
• Padatan kristal: Atom atau molekul tersusun teratur dan berulang
• Padatan amorf: Atom atau molekul tersusun acak
• Efisiensi pengepakan dalam padatan kristal adalah
persentase ruang yang terisi
Pengepakan kristal
• Dua cara untuk memaksimalkan efisiensi pengemasan
• Lapisan kedua atom ditumpuk di atas lapisan pertama atom untuk memberikan efisiensi pengepakan 74%
• Struktur disebut pengepakan rapat heksagonal atau hcp jika lapisan ketiga dapat ditumpuk langsung di atas atom pada lapisan pertama
• Struktur disebut pengemasan rapat kubus atau ccp jika
lapisan ketiga ditumpuk langsung di atas lubang di lapisan pertama
Kristal kubus
• Sel satuan adalah kumpulan atom terkecil yang menampilkan semua fitur struktur kristal
• Tiga jenis sel satuan kubus:
• kubus sederhana (sc) yang mengandung delapan atom sudut,
• kubus berpusat badan (bcc) yang mengandung satu atom tambahan di dalamnya,
• dan kubik berpusat muka (fcc) dengan tambahan enam atom di sepanjang muka
1 atom 2 atom 4 atom
Hitungan efisiensi pengemasan
• Tentukan jumlah atom per sel satuan: fcc 4, bcc 2, dan sc 1
• Hitung volume total atom
• Hitung volume total sel satuan
• Hitung efisiensi pengemasan
• Buktikan efisiensi pengepakan fcc 74%, bcc 68%, dan sc 52,4%
fcc bcc sc
Bilangan koordinasi
• Bilangan koordinasi adalah jumlah atom yang berbatasan langsung dengan atom target
• Bilangan koordinasi sc 6
• Bilangan koordinasi bcc 8
• Bilangan koordinasi fcc 12
fcc bcc sc
Kisi kristal unsur
Padatan karbon
• Sifat-sifat zat padat terkait dengan struktur kristalnya
• Setiap atom karbon dalam intan berikatan secara kovalen dengan empat atom tetangganya (tetrahedral)
• Intan adalah bahan yang sangat keras
• Atom karbon dalam grafit terikat secara kovalen menjadi lembaran datar (heksagonal)
• Lembar grafit dapat meluncur melewati satu sama lain (lunak)
Ikatan logam
• Beberapa sifat logam dapat dijelaskan melalui ikatannya
• Mudah dibentuk
• Elastis
• Konduktor panas dan listrik yang baik
• Ikatan logam tidak dapat dijelaskan melalui ikatan ion atau kovalen
• Perbedaan keelektronegatifan dari unsur ke unsur sangat kecil (tidak membentuk ikatan ion)
• Subkulit terluar logam tidak terisi (tidak membentuk ikatan kovalen)
• Model lautan elektron merupakan penjelasan kualitatif paling sederhana dari ikatan logam
• Elektron valensi didelokalisasi dan bergerak bebas di seluruh padatan
• Model ini menjelaskan sifat kelenturan, elastisitas, dan konduktivitas pada logam
Model ikatan logam
• Ketika gaya diterapkan pada logam, inti bermuatan positif merespons stres, mendeformasi logam
• Aliran elektron bebasmempertahankan ikatan selama proses
berlangsung
Teori pita
• Teori pita adalah model kuantitatif ikatan pada padatan
• Fungsi gelombang elektron valensi berinteraksi satu sama lain
• Orbital molekul ikatan dihasilkan dari interferensi konstruktif
• Orbital molekul anti ikatan dihasilkan dari interferensi destruktif
• Jumlah orbital molekul yang terbentuk sama dengan jumlah orbital atom yang terlibat
• Untuk tiap orbital molekul ikatan terbentuk, satu orbital molekul anti ikatan juga terbentuk
• Untuk jumlah atom ikatan yang ganjil, orbital molekul anti ikatan terbentuk
• Orbital molekul yang terbentuk adalah milik seluruh set atom
• Energi orbital molekul terkait dengan energi orbital atom asal
• Orbital molekul ikatan memiliki energi lebih rendah
Model pita ikatan logam
• Ketika jumlah atom
meningkat, jumlah orbital molekul ikatan dan anti ikatan juga meningkat
• Jarak energi antara orbital molekul
menurun
• Untuk jumlah atom besar, tingkat energi bergabung untuk
membentuk pita
energi
Daya hantar berdasar tepri pita
• Elektron mengisi pita energi terendah terlebih dahulu
• Perbedaan energi antara pita yang terisi dan pita yang kosong menentukan sifat listrik material
• Pita yang terisielektron valensi disebut pita valensi
• Pita kosong di atas pita valensi disebut pita konduksi
• Perbedaan energi antara pita valensi dan konduksi disebut celah pita
• Arus mengalir ketika elektron bergerak dari pita valensi ke
pita konduksi
Konduktor, isolator, dan semikonduktor
• Konduktor memiliki celah pita kecil (perlu sedikit energi untuk memindahkan elektron ke pita konduksi)
• Isolator memiliki celah pita besar (perlu energi besar energi diperlukan untuk memindahkan elektron ke pita konduksi)
• Semikonduktor memiliki celah pita antara konduktor dan
isolator
Semikonduktor
• Konduktivitas listrik semikonduktor dapat dimodifikasi melalui
doping (penguat)• Doping melibatkan penambahan jumlah unsur yang dikontrol dengan hati-hati ke dalam semikonduktor
• Semikonduktor tipe-n disiapkan dengan doping dengan unsur kaya elektron valensi, yang “negatif”, misalnya fosfor
• Elektron valensi ekstra donor mengisi tepat di bawah pita konduksi
• Perlu sedikit energi untuk memindahkan elektron tingkat donor ke pita konduksi
• Semikonduktor tipe-p dibuat dengan doping dengan elemen miskin valensi elektron, yang “positif”, misalnya aluminium
• Kekosongan elektron valensi akseptor tepat di atas pita valensi
• Perluk sedikit energi untuk memindahkan elektron pita valensi ke akseptor
• Kekosongan dalam pita valensi disebut sebagai lubang
Semikonduktor tipe n
• Pembentukan silikon tipe-n
• Doping dengan fosfor menambah elektron valensi ekstra
• Elektron ekstra donor mengisi pita yang terletak dekat dengan pita konduksi
Semikonduktor tipe p
• Pembentukan silikon tipe-p
• Umumnya aluminium yang kurang dari empat elektron valensi
• Akseptor terletak di atas pita valensi
Penghubung p-n
• Penghubung p-n dapat dibuat dari material tipe-p dan tipe-n
• Aliran elektron melintasi penghubung mudah diatur dengan memberikan
tegangan
• Arus mengalir melintasi persimpangan saat kutub negatif baterai terhubung ke material tipe-n
• Arus tidak mengalir
melintasi persimpangan saat kutub negatif
terhubung ke material tipe- p
• Penting dalam elektronik
keadaan-padat Penghubung p-n bertindak sebagai sakelar sederhana
Gaya antarmolekul
• Gaya antarmolekul lemah dibandingkan dengan ikatan kovalen
• Banyaknya gaya antarmolekul membuat gaya antarmolekul merupakan faktor utama dalam menentukan sifat material
• Gaya antarmolekul adalah gaya tarik menarik dan gaya tolak menolak
• Gaya antarmolekul lemah dibandingkan dengan kekuatan ikatan
• Gaya antarmolekul menentukan struktur dan sifat fase
• Prinsip minimalisasi energi juga berlaku di sini
• Jenis gaya antar molekul:
• Gaya dispersi (gaya London)
• Gaya dipol-dipol
• Interaksi van der Waals
• Ikatan hidrogen
• Gaya antarmolekul menyatukan lembaran grafit
Gaya dispersi (gaya London)
• Gaya dispersi (gaya London) terjadi pada semua molekul
• Mereka merujuk pada gaya dipol – dipol terinduksi dipol
• Dipol instan terjadi ketika fluktuasi densitas elektron untuk atom atau molekul menghasilkan dipol
• Dipol instan berumur pendek dan terus-menerus terbentuk dan menghilang
• Dipol terinduksi dibuat ketika medan listrik eksternal memaksa pembentukan dipol
• Gaya London sangat lemah
• Jumlah gaya London sebanyak bilangan Avogadro menghasilkan energi yang signifikan
• Gaya London menahan banyak cairan dan padatan secara
Gaya London
Kekuatan gaya London
• Kekuatan gaya London diperkirakan dari kepolaran molekul
• Kepolaran adalah ukuran seberapa rentan kerapatan elektron suatu molekul terhadap gangguan oleh medan listrik eksternal
• Molekul besar lebih mudah dipolarisasi daripada molekul yang lebih kecil dan mengalami gaya London yang lebih kuat
• Gaya dipol-dipol adalah gaya tarik menarik dan tolak menolak molekul dengan dipol permanen
• Muatan di kutub dari dipol adalah fraksi muatan pada elektron, sehingga gaya ini lebih lemah dari ikatan kimia
• Molekul dengan dipol yang lebih besar memiliki gaya dipol-dipol yang lebih kuat
• Gaya dipol-dipol biasanya lebih kuat dari gaya London
Gaya dipol-dipol
Ikatan hidrogen
• Ikatan hidrogen adalah kasus khusus gaya dipol-dipol
• Ikatan hidrogen sangat kuat dibandingkan dengan gaya dipol- dipol
• Ikatan hidrogen hanya terjadi dalam senyawa yang
mengandung hidrogen, yang secara kovalen berikatan dengan
unsur yang sangat elektronegatif F, O, atau N
Contoh soal
• Jenis gaya antarmolekul mana yang diperlukan untuk mengubah setiap cairan berikut menjadi gas?
• CH
4• CH
3F
• CH
3OH
Cairan
• Cairan juga merupakan fase materi
• Partikel dalam fase terkondensasi berada dalam kontak konstan
• Setiap partikel dalam padatan bergetar di sekitar posisi tetap
• Setiap partikel dalam cairan bebas bergerak secara konstan sehubungan dengan partikel lain
• Tekanan uap adalah tekanan fase gas suatu zat dalam kesetimbangan dinamis dengan cairan
• Tekanan uap adalah sifat khas suatu zat pada suhu tertentu
• Ada distribusi energi kinetik untuk cairan pada suhu tertentu
• Molekul cair di permukaan cairan dengan energi kinetik yang cukup berubah menjadi fase gas
• Tekanan uap meningkat seiring suhu
• Cairan dengan gaya antarmolekul kuat memiliki tekanan uap yang lebih rendah
• Cairan dengan tekanan uap tinggi digambarkan sebagai mudah
Tekanan uap
Kesetimbangan dinamis
Tekanan uap rendah, Gaya antarmolekul tinggi
Tekanan uap tinggi
Gaya antarmolekul rendah
Titik didih
• Titik didih normal suatu cairan adalah suhu di mana tekanan
uapnya sama dengan satu tekanan atmosfer (1 atm)
• Semakin kuat gaya antarmolekul dalam cairan, semakin rendah
tekanan uap dan semakin tinggi titik didih
Tegangan permukaan
• Tegangan permukaan adalah respons cairan terhadap
ketidakseimbangan pada permukaan (menjelaskan mengapa cairan berbentuk bulat)
• Bentuk bulat memiliki volume terbesar dengan jumlah luas permukaan paling sedikit
• Interaksi antara cairan dan permukaan benda padat:
• Gaya kohesi adalah interaksi cair-cair
• Gaya adesi adalah interaksi cair-padat
• Kekuatan relatif dari kedua kekuatan menentukan bentuk meniskus cairan
• Gaya adesi kuat dan gaya kohesi lebih lemah menghasilkan meniskus cekung
• Gaya adesi lemah dan kekuatan kohesi lebih kuat menghasilkan meniskus cembung
Surface Tension
(continued 3)• The concave meniscus for water results from stronger adhesive forces
• The convex meniscus for mercury, shown in the figure, results from
stronger cohesive forces
Polimer
• Polimer adalah molekul raksasa yang dibangun dengan merangkai molekul yang lebih kecil secara berurutan yang disebut monomer
• Sifat fisik polimer dapat diatur dengan memodifikasi monomer yang digunakan, jenis reaksi, dan katalis yang digunakan
• Monomer yang mengandung satu atau lebih ikatan rangkap menjalani reaksi adisi radikal bebas untuk membentuk polimer
• Polimerisasi terjadi melalui tahap inisiasi, propagasi, dan terminasi
• Inisiasi (pemulaian): produksi radikal bebas, spesies dengan elektron yang tidak berpasangan
• Propagasi (perpanjangan): radikal bebas menyerang ikatan
rangkap monomer untuk memutuskan ikatan rangkap, menyisakan ikatan tunggal dan radikal bebas baru
• Radikal bebas baru ini merambat sendiri dengan bereaksi dengan lebih banyak monomer
• Terminasi (pengakhiran): radikal bebas bereaksi dengan radikal bebas lain.
• Berlangsung acak sehingga tidak semua rantai polimer memiliki panjang yang sama
Reaksi polimerisasi
Inisiasi
Propagasi
Terminasi
Derajat polimerisasi
• Derajat polimerisasi merupakan jumlah rata-rata unit berulang dalam suatu polimer
• Sifat polimer dapat diatur
• Pilih monomer yang tepat
• Ubah derajat polimerisasi
• Kontrol tautan dari monomer
• Contoh: menggubah polietilen (PE) menjadi polipropilen (PP)
• Ganti monomer dari etilen menjadi prolilen (gugus hidrogen dari etilen diganti dengan gusus metil atau –CH
3)
• Gugus metil menempel pada tulang punggung karbon PP
• Sifat polimer dapat diatur
• Pilih monomer yang tepat
• Ubah derajat polimerisasi
• Kontrol tautan dari monomer
• Contoh: menggubah polietilen (PE) menjadi polipropilen (PP)
• Ganti monomer dari etilen menjadi prolilen (gugus hidrogen dari etilen diganti dengan gusus metil atau –CH
3)
• Gugus metil menempel pada tulang punggung karbon PP menghasilkan sifat polimer berbeda dari PE
• Aditif ditambahkan ke polimer untuk mengubah sifat polimer
• Pigmen untuk memberi warna
• Plasticizer untuk meningkatkan fleksibilitas A
• Zat antistatik, pengisi, penghambat api, dan penstabil cahaya
dan panas
Jenis polimer
• Isotaktik: Semua gugus metil tersusun pada sisi yang sama pada rantai polimer
• Sindiotaktik: Gugus metil tersusun bergantian secara sistematis pada satu sisi rantai polimer ke sisi yang lain
• Ataktik: Grup metil tersusun acak di sepanjang rantai polimer
Polimer kondensasi
• Polimer
kondensasi
terbentuk ketika gugus fungsi pada monomer bereaksi
dengan
monomer lain
menghasilkan
air atau molekul
kecil lainnya
Contoh soal
• Monomer atau pasangan monomer berikut dapat mengalami reaksi polimerisasi kondensasi. Gambarlah struktur yang
menunjukkan unit berulang dan hubungan di masing-masing
polimer yang dihasilkan
Kopolimer
• Kopolimer: polimer yang dibuat lebih dari satu jenis monomer contoh nilon dan dakron
• Urutan monomer berdampak pada sifat-sifat polimer
Kopolimer selang-seling adalah
monomer yang tersusun seri selang- seling
Kopolimer blok adalah daerah
monomer tunggal diulang, diselingi dengan daerah lain monomer berbeda diulang
Kopolimer acak adalah monomer berbeda tersusun acak
Kopolimer cangkok adalah monomer polimer bercabang pada tulang
belakang polimer yang berbeda
Sifat fisik polimer
• Polimer termoplastik meleleh atau berubah bentuk saat pemanasan
• Polimer termoset mempertahankan bentuk dan kekuatannya
saat dipanaskan
Temuan material baru
• Materi baru diciptakan melalui pendekatan sistematis dan keberuntungan
• Fulleren ditemukan sebagai hasil yang tidak biasa dari percobaan dengan gugus atom kecil
• Superkonduktivitas suhu tinggi ditemukan menggunakan metode sintesis panas-dan-kocok
• Polimer konduktor dapat dirancang dengan tulang punggung polimer ikatan tunggal dan rangkap selang-seling
Sistem mekanik listrik mikro (MEMS)
• Ukuran berkisar dari beberapa mikron hingga beberapa milimeter
• Perangkat seperti mikrosensor, mikroaktuator, dan akselerometer yang
Micro-Electrical Mechanical Systems or MEMS
• Sistem mekanik listrik mikro (MEMS)
• Ukuran berkisar dari beberapa mikron hingga beberapa milimeter
• Perangkat seperti mikrosensor, mikroaktuator, dan akselerometer yang ditemukan di ponsel pintar modern dibuat menggunakan prosedur ini