1. Diagram Fasa dalam Sistem Logam
Diagram ini banyak digunakan oleh para insinyur dan peneliti untuk memahami dan memperkirakan banyak aspek perilaku dari material.
Informasi yang didapatkan dari diagram fasa:
1. Menunjukkan fasa yang ada pada komposisi dan temperatur yang berbeda dalam kondisi pendinginan lambat.
2. Menunjukkan kesetimbangan pemadatan dari suatu elemen (atau campuran/compound) dalam unsur lain.
3. Menunjukkan temperatur dari suatu paduan yang didinginkan dalam kondisi kesetimbangan mulai membeku dan menginformasikan interval suhu saat pembekuan terjadi.
4. Menunjukkan suhu dari suatu fasa yang berbeda mulai mencair.
DDiiaaggrraammffaassaakkeesseettiimmbbaannggaannddiiddaappaattkkaannddeennggaannkkoonnddiissiippeennddiinnggiinnaannyyaannggllaammbbaatt..
1.1 Diagram Fasa dari Unsur Murni
Air bila didinginkan dalam suatu kesetimbangan, fasa padat (ice) dan cair berada bersama-sama dengan batas fasa adalah permukaan dari es.
Saat dipanaskan, cairan menguap, saat mendidih uap air dan cairan bersama dalam kondisi kesetimbangan dengan batas fasa adalah permukaan air.
Gambar 1.1 Perkiraan diagram fasa kesetimbangan tekanan dan suhu untuk air murni.
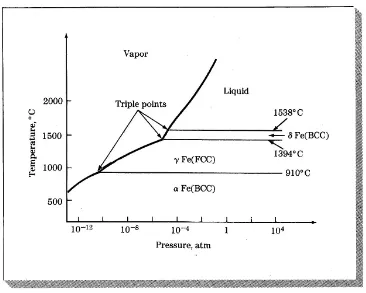
Contoh lain pada diagram kesetimbangan fasa tekanan – temperatur untuk besi murni (pure iron, Fe)
Gambar 1.2 Perkiraan diagram fasa kesetimbangan tekanan dan suhu untuk besi murni
Triple point 1 terdiri atas : liquid, vapor, δFe Triple point 2 terdiri atas : vapor, δFe dan γFe Triple point 3 terdiri atas : vapor, γFe dan αFe
760 torr=760 mmHg =
1 atm = 1 bar=105 Pa=
1 kg/cm2
1.2 Hukum Fasa Gibbs (Gibbs Phase Rule)
J.W. Gibbs (1839-1903) menurunkan suatu persamaan yang mampu menghitung jumlah fasa yang ada dalam kesetimbangan pada suatu sistem yang ditentukan/dipilih.
P + F = C + 2
dengan : P : jumlah fasa yang ada pada sistem terpilih
F : derajat kebebasan (jumlah variable (tekanan, suhu, komposisi) yayanngg dadappaatt d
diiuubbaahh bbeebbaass ttaannppaa mmeenngguubbaahh jjuummllaahh ffaassaa ddaallaamm kkeesseettiimmbbaannggaann.
C : jumlah komponen dalam sistem (suatu elemen, campuran atau larutan/cairan)
Contoh:
a. Untuk air pada Gambar 1.1, pada titik triple jumlah fasa = 3 = P (phase) Jumlah komponen = air saja = 1 = C (Component)
P + F = C + 2 3 + F = 1 + 2
F = 0 (dengan derajat kebebasan nol)
Karena tidak ada variable (suhu maupun tekanan) yang dapat diubah dan 3 fasa tetap ada di titik itu, maka titik triple ini disebut invariant point (titik tetap/tak berubah=invariant)
b. Pada garis batas cair dan padat P=2, C=1 maka F= C+2 – P = 1 + 2 – 2 = 1, terdapat satu variable dapat diubah bebas dan mampu mempertahankan dua fasa yang ada dalam sistem. Yang mana bila tekanan tertentu ditentukan hanya akan ada satu temperatur yang mana fasa padat dan cair ada bersamaan.
c. Bila ada titik dimana saja yang ada dalam satu fasa, maka: P = 1, C = 1 P + F = C + 2
F = 1 + 2 – 2 = 2 (dua derajat kebebasan)
Artinya dua variable suhu dan tekanan dapat bervariasi/diubah-ubah secara bebas dan sistem tetap berada dalam satu fasa.
!
Kebanyakan diagram fasa binary( dua unsur) yang digunakan dalam ilmu material adalah diagram temperatur – komposisi dalam kondisi tekanan konstan biasanya 1 atm = 105 Pa = 760 torr = 760 mm Hg. Untuk kondisi ini berlaku P + F = C + 1Untuk terjadi sistem isomorphous, biasanya sistem tersebut memenuhi satu atau lebih kondisi sebagai berikut : (berdasarkan Kaidah Daya larut padat Hume – Rohtery (1899-1968) :
1. Struktur kristal dari setiap elemen dari campuran pada harus sama.
2. Perbedaan atom dari setiap dua elemen tidak boleh berbeda lebih dari 15%
3. Elemen seharusnya tidak membentuk persenyawaan/campuran satu sama lain. Dalam arti lain, tidak boleh ada perbedaan besar dalam elektromagnetivitas dari dua elemen. 4. Elemen seharusnya memiliki elektron valensi yang sama.
Contoh :
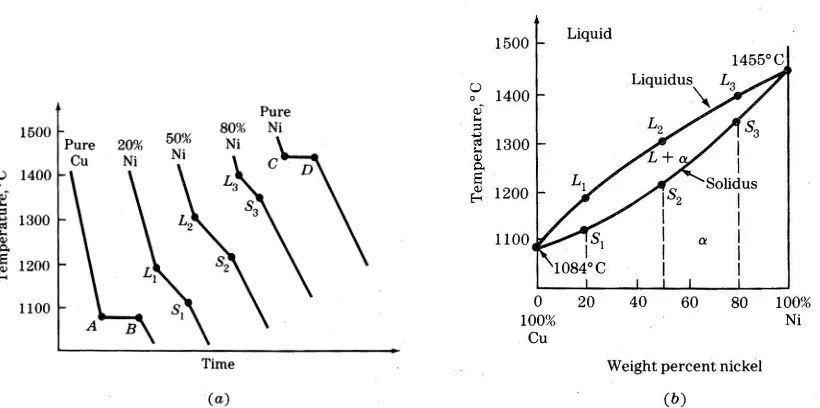
Diagram fasa dua komponen 19 Cu – 28 Ni, ditentukan untuk pendinginan lambat atau kondisi kesetimbangan pada tekanan atmosfir.
Gambar 1.3 Diagram fasa nikel-tembaga. Tembaga dan nikel memiliki kemampuan larut cair total dan kemampuan larut padatan total. Tembaga nikel larutan padat mencair pada suhu interval di atas suhu yang ditentukan pada logam murni
1.4 Kaidah Tuas (The Lever Rule)
Digunakan untuk mengetahui prosentasi berat dari fasa yang ada dalam daerah dua fasa pada diagram fasa kesetimbangan dua komponen.
Misalnya ditanyakan berapa berat fraksi dari fasa pada suhu T dan fraksi berat B, wo
berdasarkan kaidah tuas/timbangan/pengungkit pada diagram fasa di bawah ini.
Fraksi berat fasa cair (X l) + fraksi berat fasa padat (Xs) = 1
X l + Xs = 1
X l = 1 ---- Xs
X s = 1 ---- Xl
m
maassssaaBBddaallaammdduuaaffaassaa==mmaassssaaBBddaallaammffaassaaccaaiirr ++mmaassssaaBBddaallaammffaassaappaaddaat t
(1g)(1) (%wo/100) = (1g) (Xl) (%wl /100) + (1g)(Xs)(%ws/100)
Jadi wo = Xl w + Xs ws
Xl = 1 – Xs
wo = (1 – Xs ) w + Xs ws
= w –Xs w Xs ws
Xs ws – Xs w wo – w
Fraksi berat dari fasa padat = Xs = (wo – w (ws – w Xl = 1 – Xs
Fraksi berat dari fasa cair = Xl = [(ws – w (ws – w ] – [(wo – w (ws – w
= (ws – w (ws – w
l
Contoh: Pada diagram fasa Cu-No di suhu 1300°C.
Berapakah % berat Cu dalam fasa cair & padat pada temperatur 1300°C untuk 47% wt Cu dan 53% wt% Ni.
Dengan menggambar garis pada diagram maka didapatkan wo = 53% Ni ; w 45% Ni dan ws = 58% Ni
Xl = (ws – w (ws – w ( 58 – 53 )/ (58 – 45 ) = 5/13 = 0.38
% berat dari fasa cair = 38%
% berat dari fasa cair = 1 - Xl = 1- 38%= 62%
1.5 Diagram fasa tiga komponen (Ternary Phase Diagram)
Cara mencari komposisi dalam diagram fasa ternary
Berdasarkan gambar di atas maka untuk posisi x komposisinya adalah 40% berat unsur A, 40% berat unsur B, 20% berat unsur C.
Sedangkan untuk posisi y memiliki komposisi sebagai berikut: 20% berat unsur A, 30% berat unsur B, 50% berat unsur C.
Bagaimana dengan komposisi untuk posisi z ?
Bagaimana dengan komposisi untuk posisi U dan T ?
z
U