BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini akan dilaksanakan pada Bulan Maret 2015 sampai dengan Februari 2016. Penanaman benih dilakukan di Desa Tanjung Sari, pada koordinat 03°33’33,6° LU dan 098°38’23,5” BT pada ketinggian ± 58 mdpl, Medan. Analisis marka RAPD dan SSR dilakukan di Laboratorium Terpadu, Fakultas Kedokteran, Universitas Sumatera Utara, Medan.
Bahan dan Alat Penelitian
Materi yang digunakan dalam penelitian ini adalah daun muda berusia tiga Minggu Setelah Tanam (MST) yang berasal dari benih kelapa sawit DxP Unggul Socfindo (L). Bahan-bahan yang digunakan dalam penelitian ini antara lain nitrogen cair, buffer CTAB, buffer TAE, buffer TE, buffer TBE, chloroform
isoamilakohol (KIAA) dengan perbandingan 24 : 1, NaCl, NaOH, Na-EDTA,
HCl, isopropanol dingin, β-mercaptoetanol, agaros (promega V3121), primer
oligonukleotida, Master mix (promega M7122), Ladderinvitrogen ukuran 100 bp
dan Marker bench top 1 kb DNA Ladder, lima primer SSR dan lima primer
RAPD.
Alat-alat yang digunakan dalam penelitian ini antara lain tisu, timbangan digital, hot plate (biosan), mortar, centrifuge (Eppendorf 5415), vortex, freezer,
PCR tube 0.2 ml dan 1.5 ml, mikropipet ukuran 1-50 µl, 100-500 µl, pinset, sarung tangan karet, tips pipet (putih, kuning dan biru), autoclave, kamera, water
chamber) pengaduk magnetik, alat-alat gelas (gelas ukur, gelas beker, erlemeyer),
elektroforesis (Power PAC 3000, biorad), PCR (Thermal cycler) applied
biosystem, Gel Doc (UV cambridge), hand seal, pirex, masker dan alat tulis.
Isolasi DNA
Isolasi DNA dilakukan terhadap daun benih kelapa sawit yang masih muda (3 MST). Prosedur isolasi DNA dimodifikasi dari metode CTAB oleh Orozco-Castilo (1994) dengan modifikasi pada polynillpolypirrolidone (PVPP)
dan 2-merkaptoethanol (Toruan-Mathius et al. 1997), (Asmono et al. 2000).
Tahapan isolasi dilakukan dengan cara membuang tulang daun lalu dicuci dan dikeringkan dengan tisu. Sebanyak 0.1-2.0 g daun digerus menggunakan mortar sambil ditambahkan nitrogen cair dan penambahan PVPP dibagian terakhir. Setelah halus, sampel dimasukkan ke dalam sentrifus yang berisi 1 ml buffer ekstraksi CTAB dan β-mercaptoentanol 10 µl kemudian diaduk menggunakan
vortex hingga homogendan diinkubasi dalam waterbath selama 30 menit pada suhu 65ºC. Setiap 10 menit sekali dibolak balik dengan perlahan-lahan. Setelah itu, diinkubasi pada suhu ruang selama 4-5 menit, kemudian ditambahkan 1 ml kloroform : isoamilalkohol (24 :1).
untuk mengendapkan pellet DNA. Setelah itu, disentrifius pada kecepatan 13.000 rpm pada suhu 4ºC selama 10 menit. Selanjutnya, supernatan dihomogenkan dengan/ memobolak-balik tabung, lalu disimpan dalam lemari es (4ºC) selama 30 menit, kemudian disentrifius lagi dengan kecepatan 13.000 rpm pada suhu 4ºC selama 10 menit. Supernatan yang diperoleh dibuang kemudian pelet dikering-anginkan. Pelet yang sudah kering dilarutkan dengan buffer TE sebanyak 100 µl, kemudian dispin manual hingga homogen.
Selanjutnya, ditambahkan dengan etanol absolut dingin, lalu dibolak – balik hingga homogen. Lalu, dinkubasi dalam freezer (-20ºC) selama 30 menit kemudian disentrifius lagi dengan kecepatan 13.000 rpm pada suhu 4ºC selama 10 menit. Supernatan dibuang sedangkan pelet dicuci menggunakan etanol absolut dan dikeringanginkan. Pelet DNA yang sudah kering dilarutkan dengan 100 µl buffer TE, kemudian simpan DNA dalam freezer (-20ºC).
Uji Kualitas DNA
Gel agaros dibuat dari 1.6 g agaros dan 80 ml larutan TAE 1x, kemudian dipanaskan hingga larut dengan menggunakan hot plate dan didinginkan pada suhu kamar hingga hangat. Selanjutnya, ditambahkan 0.5 µl EtBr dan dituang ke dalam cetakan gel elektroforesis yang telah dipasang sisir (cetakan sumur) hingga gel memadat. Gel yang sudah padat dipindahkan ke dalam bak elektroforesis. Sampel yang akan dielekstroforesis dicampur dengan loading dye dengan
perbandingan 5:1 (DNA : loading dye). Setelah dicampur maka diinjeksi kedalam
dialiri tegangan listrik 75 volt selama 60 menit. Hasil elektroforesis diamati dengan bantuan lampu UV dalam transilluminator dan didokumentasikan dengan menggunakan gel documentation.
Uji Kuantitas DNA
Pengujian kuantitas DNA dilakukan dengan metode nanophotometer pada panjang gelombang (λ) 260 dan 280 nm dengan menggunakan stok DNA hasil
isolasi dan pemurnian. DNA mempunyai kemurnian tinggi jika ratio nilai absorbansi pada panjang gelombang 260 nm dan 280 nm berkisar antara 1,8 – 2,0 (Sambrook et al. 1989).
Amplifikasi PCR- Marka Simple Sekuens Repeats (SSR)
Pembuatan master mix PCR dilakukan dalam tabung mikro dengan
komposisi untuk satu kali reaksi dengan total volume 25 µl antara lain Go Taq
PCR 12.5 µl, nuclease free water 8.5 µl, primer forward 1 µl, primer reverse 1 µl
dan DNA sampel 2 µl. Proses amplifikasi dilakukan menggunakan mesin PCR berdasarkan penelitian Putri (2010). Program amplifikasi terdiri atas siklus
predenaturasi 4 menit pada suhu 94ºC, diikuti 35 siklus denaturasi 94ºC, selama
30 detik, tahapan anneling 52ºC selama 1 menit 15 detik, extension 72ºC selama 1
menit 30 detik, dan post extension pada 72ºC selama 8 menit dan kondisi akhir
PCR 40
Elektroforesis hasil amplifikasi dengan marka SSR dilakukan pada gel agarose 4%. Gel dibuat dengan melarutkan 3.2 g agarose pada 80 ml buffer TBE 1x, kemudian dipanaskan hingga larut dengan menggunakan hot plate dan
didinginkan pada suhu kamar hingga hangat. Selanjutnya, ditambahkan 1.5 µl EtBr dan dituang ke dalam cetakan gel elektroforesis yang telah dipasang sisir (cetakan sumur) hingga gel memadat. Gel yang sudah padat dipindahkan ke dalam bak elektroforesis, kemudian tuang TBE 1x ke dalam bak elektroforesis. Marker yang telah dicampur dengan loading dye diinjeksi ke dalam sumur gel agarose
menggunakan pipet mikro. Setelah semua sampel selesai dinjeksi dengan bantuan lampu UV dalam transilluminator dan didokumuntasikan menggunakan gel
documentation.
Amplifikasi PCR-Marka Random Amplfied Polymorphic DNA (RAPD)
Pembuatan master mix PCR dilakukan dalam tabung mikro dengan
komposisi untuk satu kali reaksi dengan total volume 25 µl antara lain Go Taq
PCR 12.5 µl, nuclease free water 9.5 µl, primer 1 µl dan DNA sampel 2 µl.
Proses amplifikasi dilakukan menggunakan mesin PCR. Program running PCR
berdasarkan pada penelitian Setiyo (2001) yang terdiri atas 45 siklus dengan reaksi predenaturasi 940C selama 2 menit, denaturasi 940C selama 1 menit,
annealing 360C selama 1 menit, extension 720C selama 2 menit, post extension
720C selama 10 menit dan kondisi akhir PCR 40
Elektroforesis hasil amplifikasi dengan marka RAPD dilakukan dengan melarutkan gel agarose 2%. Gel dibuat dengan melarutkan 1.6 g agarose pada 80 ml buffer TAE 1x, kemudian dipanaskan hingga larut dengan menggunakan hot plate dan didinginkan pada suhu kamar hingga hangat. Selanjutnya, ditambahkan 1.5 µl EtBr dan dituang ke dalam cetakan gel elektroforesis yang telah dipasang sisir (cetakan sumur) hingga gel memadat. Gel yang sudah padat dipindahkan ke
dalam bak elektroforesis, kemudian tuang TAE 1x ke dalam bak elektroforesis. Marker yang telah dicampur dengan loading dye diinjeksi ke dalam sumur gel
agaros menggunakan pipet mikro. Setelah semua sampel selesai dinjeksi dengan bantuan lampu UV dalam transilluminator dan di dokumuntasikan menggunakan
gel documentation.
Analisis Data
Analisis data dilakukan berdasarkan atas data skoring hasil gel agarose. Data molekuler yang dianalisis diubah ke dalam bentuk data biner berdasarkan ada dan tidaknya pita hasil amplifikasi.Jika terdapat pita hasil amplifikasi diberi kode 1, sedangkan jika tidak ada diberi kode 0.Nilai polymorphic information
content (PIC) untuk marka SSR dihitung dengan menggunakan software Power
Marker 3.25 (Liu, 2005). Botsein et al. (1980) mengklasifikasikan nilai PIC
menjadi 3 kelas yaitu : PIC > 0.5:sangat informatif ; 0.25 > PIC < 0.5: sedang PIC < 0.25 : rendah. Sedangkan perhitungan PIC pada RAPD dihitung dengan menggunakan Excel 2007. Polymorphic Information Content (PIC) untuk
beberapa marker dihitung dengan menggunakan rumus: PICi = 2fi (1-fi
PIC
)
i
f
= Polymorphic Information Content (PIC) pada marker
i
(1-f
= frekuensi dari pita primer yang muncul
i
Nilai PIC untuk dominan marker seperti RAPD memiliki nilai maksimum yaitu 0.5 untuk f
) = frekuensi dari pita yang tidak muncul
i = 0.5 (Ma et al. 2013). Sedangkan untuk melihat persentase pita
x 100
Matriks jarak atau ketidaksamaan genetik untuk semua kombinasi pasangan individu dapat dianalisis dengan dua tipe analisis deskriptif dari keragaman : (1) Principal Coordinates Analysis (PCoA), suatu jenis analisis
faktorial pada tabel ketidaksamaan untuk mendapatkan group origin utama dan (ii) Neighbour-Joining Tree (NJtree) berdasarkan Saitou dan Nei (1978) untuk
memperoleh gambaran dari kekerabatan diantara individu-individu. Perhitungan dan analisis deskriptif ini menggunakan software DARwin Softwere Versi 6
(Perreira dan Jacquemoud-Collet, 2014).
Untuk menghitung jumlah alel efektif per lokus (Na), observed
heterozigosity (Ho) dan expected heterozigosity (He) digunakan Gen Alex ver.
HASIL DAN PEMBAHASAN
Hasil
Uji Kualitas DNA Kelapa Sawit Varietas DxP Unggul Socfindo
Uji kualitas DNA dilakukan untuk mengetahui tingkat keberhasilan ekstraksi DNA. Keberhasilan ekstraksi DNA ditunjukkan oleh adanya pita pada hasil dokumentasi elektroforesis gel. Melalui metode elektroforesis maka DNA yang bermuatan negatif akan bergerak kearah muatan positif. Pemisahan tersebut dilakukan berdasarkan perbedaan ukuran berat molekul dan muatan listrik. Magdeldin (2012) menyatakan pada teknik elektroforesis, larutan penyangga yang mengandung makro-molekul ditempatkan dalam suatu wadah tertutup dan dialiri arus listrik sehingga DNA akan bergerak ke kutub positif.
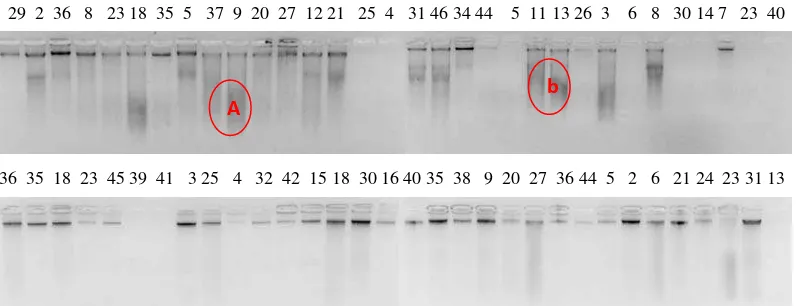
Pemberian arus listrik dapat menyebabkan terjadinya perpindahan aliran listrik elektron dengan kecepatan yang berbeda bergantung pada berat molekul DNA yang dilihat berdasarkan pita yang terbentuk pada gel agarose. Pratiwi (2001) menyatakan kecepatan migrasi dari makromolekul diukur dengan jalan melihat terjadinya pemisahan dari molekul ditunjukkan adanya pita yang terbentuk di dalam pelarut. Pita yang baik akan menunjukkan hasil dokumentasi pita yang terang dan tidak menunjukkan adanya kontaminan. Uji kualitas DNA berdasarkan uji gel agarose hasil elektroforesispada 39 sampel tanaman kelapa sawit dapat dilihat pada Gambar 2.
pita sedangkan sisanya menunjukkan keberadaan pita DNA. Keberhasilan proses ekstraksi DNA yang dilakukan pada penelitian ini mencapai 83,38%.
Gambar 1. Profil uji kualitas DNA kelapa sawit dengan menggunakan agarose Keterangan : A dan B Menunjukkan adanya smear
Pada Gambar 1. terlihat kondisi smear hasil ekstraksi yang ditunjukkan
oleh notasi A dan B yang disebabkan oleh keberadaan kontaminan, kontaminan tersebut dapat berupa polisakarida, protein dan lipid, juga dapat disebabkan oleh proses ekstraksi yang belum maksimal. Smear juga bisa merupakan sisa
larutan-larutan yang terbawa selama isolasi, Mulyani et al. (2011) menyatakan bahwa
smear bisa merupakan sisa dari larutan-larutan yang terbawa selama proses isolasi
atau juga dapat berupa DNA yang terdegradasi pada proses isolasi. Zat pengotor hasil ekstraksi tersebut merupakan senyawa polisakarida dan metabolit sekunder. Keberadaan senyawa tersebut dapat menjadi faktor yang menghambat keberhasilan proses ekstraksi DNA (Maftuchah dan Zainuddin, 2013) .
Untuk mendegradasi senyawa tersebut maka digunakan buffer CTAB, larutan ini berfungsi untuk mengurangi adanya kontaminan karena CTAB merupakan senyawa kationik yang melisis membran sel sehingga mampu 36 35 18 23 45 39 41 3 25 4 32 42 15 18 30 16 40 35 38 9 20 27 36 44 5 2 6 21 24 23 31 13 29 2 36 8 23 18 35 5 37 9 20 27 12 21 25 4 31 46 34 44 5 11 13 26 3 6 8 30 14 7 23 40
A
mengendapkan polisakarida serta senyawa fenolik. CTAB merupakan detergen yang berguna untuk melarutkan membran plasma sel (Chawla, 2003).
Uji Kuantitas DNA Kelapa Sawit Varietas DxP Unggul Socfindo
Hasil uji kuantitas dengan menggunakan nanofotometer menunjukkan pendekatan terhadap konsentrasi DNA yang telah diekstraksi dari tanaman sampel. Dari 39 sampel tanaman yang diuji dengan proses elektroforesis gel, hanya 30 sampel tanaman yang akan di uji kuantitasnya. Hal ini dilihat berdasarkan tingkat kejelasan hasil uji kualitas dengan menggunakan agarose. Jika hasil uji kualitas menunjukkan keberadaan pita yang jelas, sampel tersebut layak untuk diuji kuantitas. Hasil uji kuantitas pada 30 sampel tanaman kelapa sawit pada penelitian ini dapat dilihat pada Lampiran 7.
Konsentrasi DNA maksimal yang dihasilkan dari 30 sampel tanaman yang diuji adalah sebesar 2269 µg/µl, sedangkan paling kecil adalah sebesar 0.196 µg/µl. Semakin tinggi konsentrasi yang dihasilkan maka semakin tinggi konsentrasi DNA yang terkandung pada hasil ekstraksi. Pengukuran kemurnnian DNA yang dihasilkan berdasarkan rasio Å260/Å280.
Fatchiyah (2011) menjelaskan bahwa DNA menyerap cahaya UV optimum pada panjang gelombang 260 nm, akan tetapi kontaminan, protein atau fenol menyerap cahaya pada 280 nm dengan adanya perbedaan penyerapan cahaya UV akan dapat diketahui tingkat kemurnian DNA berdasarkan nilai absorbansi 260 nm dibagi dengan nilai absorbansi 280 (Å260/Å280).
Rasio λ260/λ280 dari hasil ekstraksi DNA pada penelitian ini maksimal
λ260/λ280 tersebut merupakan indikator yang dapat dijadikan sebagai bahan
pertimbangan bagaimana tingkat kemurnian DNA hasil ekstrasi. Sambrook et al.
(1989) menyebutkan nilai absorbansi DNA pada rasio panjang gelombang 260 nm dan 280 nm berkisar antara 1.8 sampai dengan 2.0. Hasil penelitian ini menunjukkan bahwa hanya ada 3 sampel yang merujuk pada indikator yang ditetapkan oleh Sambrook et al. (1989) yaitu pada sampel No.11, No.47 dan
No.45.
Penapisan Marka SSR dan RAPD
Penapisan terhadap 5 marka SSR dan 5 marka RAPD dilakukan untuk memilih primer yang akan digunakan untuk pengujian terhadap 30 sampel tanaman kelapa sawit. Berdasarkan hasil pengujian dengan menggunakan elektroforesis gel diperoleh hasil bahwa dari 12 primer SSR hanya ada 5 marka yang akan dilanjutkan untuk tahapan penelitian selanjutnya demikian juga dengan primer RAPD.
marka SSR yang terpilih terdiri atas primer FR0465, FR304, FR391, FR0350 dan FR3693.
Proses pemilihan primer sangat penting untuk dilakukan. Surahman et al.
(2007) menyatakan bahwa pemilihan primer merupakan hal yang sangat mempengaruhi keberhasilan proses amplifikasi DNA target. Jika primer yang digunakan tidak sesuai dengansekuens nukleotida target, maka tidak akan terjadi proses penggandaan oleh enzim taq-polimerase dengan kata lain amplifikasi tidak
dapat terjadi jika primer yang digunakan tidak komplementer dengan susunan nukleotida target.
Penyebab lain yang dapat mengakibatkan tidak adanya amplifikasi pada produk PCR adalah perlakuan pada suhu anneling. Suhu anneling yang tidak sesuai dengan primer yang digunakan menyebabkan tidak terjadinya proses penempalan primer. Suryanto (2003) menyatakan bahwa suhu sangat berpengaruh terhadap keberhasilan proses amplifikasi DNA. Faktor lain yang dapat menyebabkan terjadinya kegagalan pada saat proses amplifikasi yaitu tingkat kemurniaan DNA. Berdasarkan hasil uji kualitas DNA pada penelitian ini (Gambar 2) memperlihatkan masih menunjukkan adanya kontaminan sehingga hal ini dapat mempengaruhi tingkat kemurniaan DNA. Weishing et al. (2005)
Visualisasi Hasil Elektroforesis PCR Primer SSR
Primer SSR merupakan salah satu jenis marka molekuler yang dapat mengidentifikasi keberadaan alel pada suatu genom tanaman. Marka SSR dapat mengidentifikasi keberadaan fragmen yang berukuran relatif kecil. Pada penelitian ini telah diuji 5 primer SSR. Hasil pengujian terhadap 5 marka tersebut dapat dilihat pada Gambar 3-7.
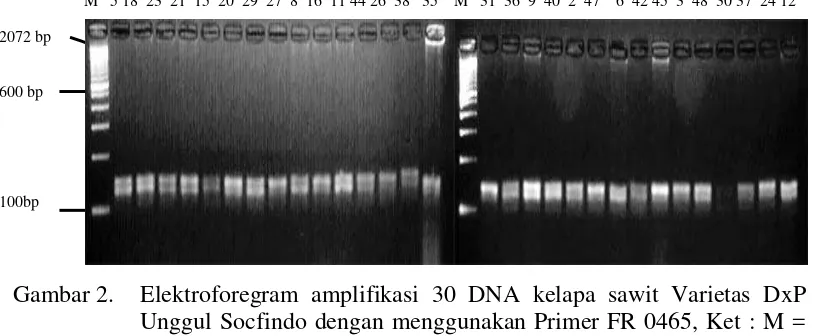
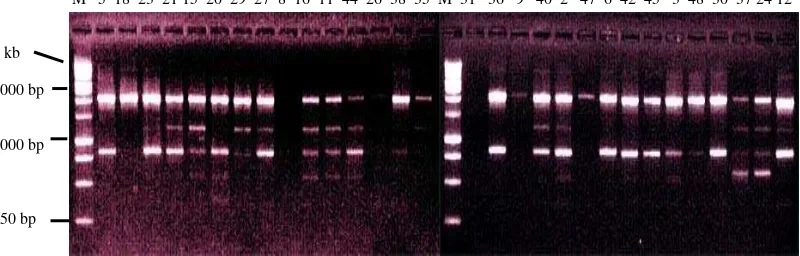
Primer FR0465 mampu menunjukkan amplifikasi pada 30 DNA tanaman yang diuji. Pola pita bersifat heterozigot, jumlah pita sebanyak dua dan ukuran pita sekitar 175 bp dan 212 bp. Visualisasi pada primer FR 0465 dapat dilihat pada Gambar 2.
Gambar 2. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer FR 0465, Ket : M =
Marker Ladder 100 bp
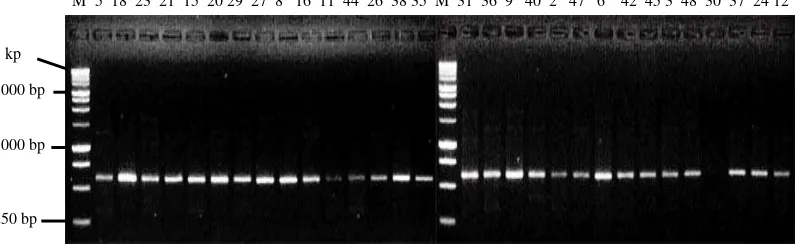
Primer FR 304 mampu menunjukkan amplifikasi pada 30 DNA tanaman yang diuji. Pola pita bersifat homozigot dengan ukuran pita sekitar 120 bp. Visualisasi pada primer FR 304 dapat dilihat pada Gambar 3.
M 5 18 23 21 15 20 29 27 8 16 11 44 26 38 35 M 31 36 9 40 2 47 6 42 45 3 48 30 37 24 12
2072 bp
600 bp
Gambar 3. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer FR 304, Keterangan: M = Marker Ladder 100 bp
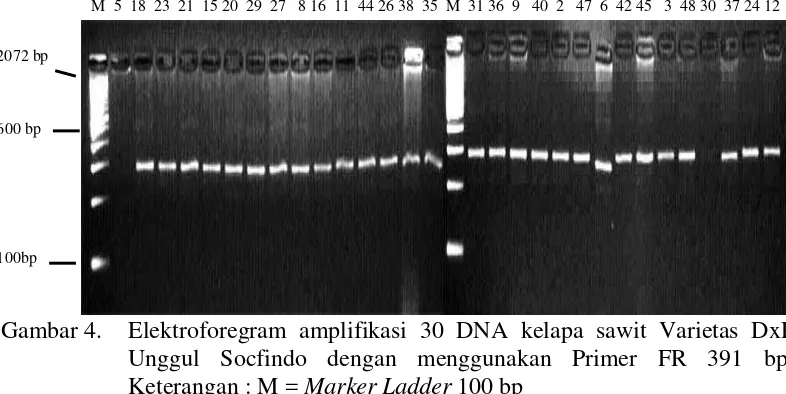
Primer FR 391 mampu menunjukkan amplifikasi pada 30 DNA tanaman yang diuji. Pola pita bersifat homozigot, jumlah pita sebanyak dua dan ukuran pita sekitar 278 bp dan 308 bp. Visualisasi pada primer FR 391 dapat dilihat pada Gambar 4.
Gambar 4. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer FR 391 bp, Keterangan : M = Marker Ladder 100 bp
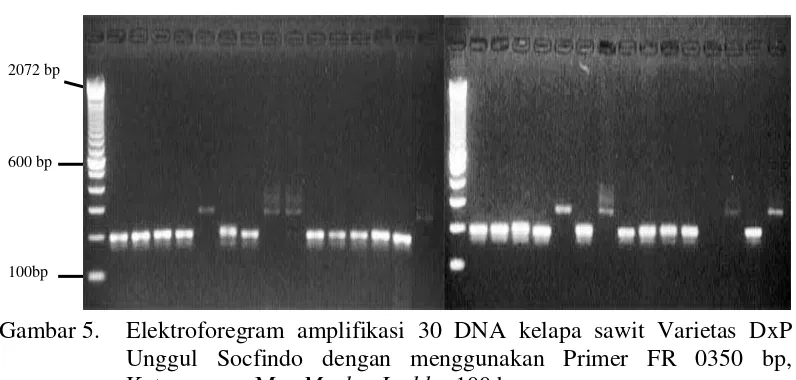
Primer FR 0350 mampu menunjukkan amplifikasi pada 29 DNA tanaman yang diuji hanya DNA No.30 yang tidak teramplifikasi. Pola pita bersifat hetorozigot, jumlah pita sebanyak empat, dan ukuran pita sekitar 168 bp, 197 bp, 275 bp dan 354 bp. Visualisasi pada primer FR 0350 dapat dilihat pada Gambar 5.
M 5 18 23 21 15 20 29 27 8 16 11 44 26 38 35 M 31 36 9 40 2 47 6 42 45 3 48 30 37 24 12 2072 bp
600 bp
100bp
2072 bp
600 bp
100bp
Gambar 5. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer FR 0350 bp, Keterangan : M = Marker Ladder 100 bp
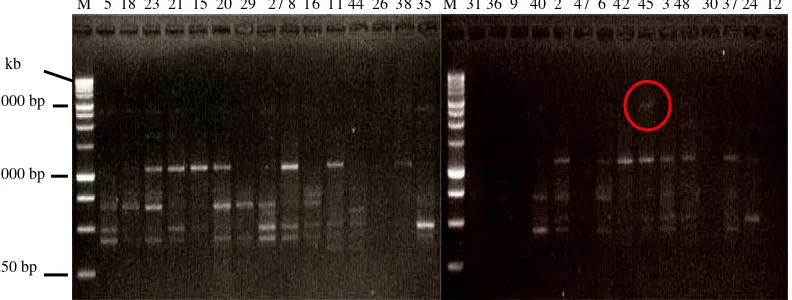
Primer FR 3693 mampu menunjukkan amplifikasi pada 29 DNA tanaman yang diuji hanya DNA No. 30 yang tidak teramplifikasi. Pola pita bersifat heterozigot, jumlah pita sebanyak dua, dan ukuran pita sekitar 289 bp dan 496 bp. Visualisasi pada primer FR 3693 dapat dilihat pada Gambar 6.
Gambar 6. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer FR 3693 bp, Keterangan : M = Marker Ladder 100 bp; lingkaran merah
menunjukkan adanya unik band pada 496 bp.
SSR merupakan salah satu penanda molekuler yang didasarkan pada DNA ruas berulang yang dapat menunjukkan adanya variasi. Treuren (2000) menyatakan bahwa SSR merupakan salah satu penanda yang dapat menunjukkan
2072 bp
600 bp
100bp
2072 bp
600 bp
100bp
M 5 18 23 21 15 20 29 27 8 16 11 44 26 38 35 M 31 36 9 40 2 47 6 42 45 3 48 30 37 24 12
karakterisasi genetik yang akurat didasarkan pada urutan DNA pendek yang tiap unit ulangannya terdiri atas satu atau beberapa nukleotida.
Ada banyak faktor yang dapat mempengaruhi keberhasilan marka SSR, diantaranya adalah pemilihan jenis primer. Oleh sebab itu, penapisan dan optimasi sebelum diaplikasikan perlu untuk dilakukan. Asep (2010) menjelaskan bahwa sebelum dilakukan aplikasi marka SSR perlu dilakukan penapisan dan optimasi karena setiap tanaman mempunyai karakteristik spesifik yang berbeda satu sama lain. Marka SSR merupakan marka yang terkenal dalam studi genetik dan pemuliaan, kelebihan marka SSR merupakan marka yang menunjukkan adanya multi alelik dan dapat menunjukkan adanya heterozigositas. Donata (2010) menjelaskan bahwa SSR dapat menunjukkan kandungan informasi yang tinggi, bersifat kodominan, relatif sederhana dan kuantitas DNA yang dibutuhkan lebih sedikit. Primer yang menunjukkan adanya heterozigositas yaitu pada primer FR0465 dan primer FR0350.
Keragaman marka SSR tersebut ditunjukkan oleh ukuran pita yang teramplifikasi pada hasil gel dokumentasi. Berdasarkan hasil penelitian ini, ukuran marka SSR berkisar antara 120 bp sampai dengan 496 bp. Ukuran pita yang ditunjukkan oleh SSR menunjukkan adanya perbedaan ukuran pita dan keberadaan pita tersebut bermanfaat untuk identifikasi adanya perbedaan secara genetik. Amrital (2006) menjelaskan bahwa mikrosatelit sangat bermanfaat untuk identifikasi keragaman genetik.
FR0465 dan FR0350 sedangkan pola homozigot ditunjukkan oleh primer FR304, FR391, dan FR3693. Primer-primer ini dapat dijadikan sebagai marka atau penanda yang menunjukkan adanya perbedaan alel heterozigot atau alel homozigot untuk kelapa sawit DxP Unggul Socfindo. Ilbi (2003) menyatakan bahwa SSR merupakan salah satu penanda atau marka molekuler berbasis DNA yang memiliki kelebihan dalam hal sensitivitas untuk mengidentifikasi spesies yang berbeda serta dapat membedakan individu berkerabat dekat.
Visualisasi Hasil Elektroforesis PCR Primer RAPD
Primer RAPD merupakan salah satu penanda pada bidang genetika, marka ini dapat mendeteksi adanya tingkat polimorfisme pada suatu genom. RAPD sering digunakan karena penggunaannya yang relatif mudah dan ekonomis dalam mengidentifikasi tingkat polimorfisme. Hasil elektroforesis pada primer RAPD dapat dilihat pada Gambar 7-11. Primer OPC-12 menunjukkan pola pita yang berjumlah 1 pita dengan ukuran pita sekitar 591 bp. Persentase pita polimorfik sebesar 100% dan persentase monomorfis sebesar 0%. Visualisasi pada primer OPC-12 dapat dilihat pada Gambar 7.
Gambar 7. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer OPC-12, Keterangan : M = Marker Ladder 1 kb.
1 kp
3000 bp
1000 bp
250 bp
Primer OPH-12 menunjukkan pola pita yang berjumlah 4 pita dengan ukuran pita berkisar antara 573 bp – 2153 bp. Persentase pita polimorfik sebesar 100% dan persentase monomorfis sebesar 0%. Visualisasi pada primer OPH-12 dapat dilihat pada Gambar 8.
Gambar 8. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer OPH-12, Keterangan : M = Marker Ladder 1 kb
Primer OPC-07 menunjukkan pola pita yang berjumlah 3 pita dengan ukuran pita berkisar antara 455 bp – 807 bp. Persentase pita polimorfik sebesar 100% dan persentase monomorfis sebesar 0%. Visualisasi pada primer OPC-07 dapat dilihat pada Gambar 9.
Gambar 9. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer OPC-07, Keterangan : M = 1 kb
1 kb
3000 bp
1000 bp
250 bp
1 kb
3000 bp
1000 bp
250 bp
M 5 18 23 21 15 20 29 27 8 16 11 44 26 38 35 M 31 36 9 40 2 47 6 42 45 3 48 30 37 24 12
Primer OPI-20 menunjukkan pola pita yang berjumlah 5 pita dengan ukuran pita berkisar antara 439 bp – 3053 bp. Persentase pita polimorfik sebesar 100% dan persentase monomorfis sebesar 0%. Visualisasi pada primer OPI-20 dapat dilihat pada Gambar 10.
Gambar 10. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo dengan menggunakan Primer OPI-20, Keterangan :M = Marker Ladder 1 kb; lingkaran merah menunjukkan unik band
pada 3054 bp.
Primer OPD-16 menunjukkan pola pita yang berjumlah 4 pita dengan ukuran pita berkisar antara 274 bp – 1810 bp. Persentase pita polimorfik sebesar 100% dan persentase monomorfis sebesar 0%. Visualisasi pada primer OPD-16dapat dilihat pada Gambar 11.
Gambar 11. Elektroforegram amplifikasi 30 DNA kelapa sawit Varietas DxP
Unggul Socfindo dengan menggunakan Primer OPD-16, Keterangan : M = Marker Ladder 1 kb
1 kb
3000 bp
1000 bp
250 bp
1 kb
3000 bp
1000 bp
250 bp
M 5 18 23 21 15 20 29 27 8 16 11 44 26 38 35 M 31 36 9 40 2 47 6 42 45 3 48 30 37 24 12
Marka RAPD merupakan salah satu marka molekuler yang bersifat dominan, primer yang dijadikan sebagai penanda akan menempel pada sekuens DNA secara random sehingga dapat menunjukkan adanya keragaman ditingkat DNA. Surahman et al. (2007) menjelaskan bahwa primer RAPD bersifat tunggal
yang memiliki rangkaian nukleotida yang bersifat random sehingga dapat dimanfaatkan untuk mendeteksi polimorfisme DNA. Pramudi et al. (2007) juga
menjelaskan bahwa RAPD dapat digunakan untuk analisis keragaman genetik. Kelebihan dari marka RAPD untuk mendeteksi adanya keragaman yaitu lebih mudah dalam aplikasinya serta lebih efisien dalam hal teknis pengerjaannya. Gunereen et al. (2010) menyebutkan bahwa kelebihan penggunaan marka RAPD
adalah lebih mudah dalam aplikasi, lebih cepat dan lebih murah. Jika dibandingkan dengan primer SSR maka kelebihan dari marka RAPD adalah lebih efisien dalam penggunaan waktu pada saat proses elektroforesis. Waktu yang dibutuhkan dengan menggunakan marka SSR sekitar tiga setengah jam sampai empat jam sedangkan proses elektroforesis pada RAPD hanya membutuhkan waktu sekitar satu jam.
konsentrasi DNA yang terlalu kecil sering menghasilkan pita DNA amplifikasi yang redup atau tidak jelas.
Deteksi keberadaan keragaman DNA berdasarkan marka RAPD tersebut ditunjukkan oleh keberadaan pita-pita yang terlihat pada gel dokumentasi. Pita-pita tersebut menunjukkan adanya keberagaman. Berdasarkan hasil pengujian diperoleh hasil bahwa ukuran pita yang teramplifikasi pada primer yang diuji mulai dari 211 bp sampai dengan 2153 bp. Keberadaan pita yang teramplifikasi menunjukkan fragmen-fragmen yang bersifat dominan. Zulfahmi (2013) menjelaskan bahwa RAPD merupakan marka yang bersifat dominan. Fragmen DNA yang telah dihasilkan tidak dapat membedakan antara genotipe homozigot dominan dan heterozigot.
Ketidakmampuan primer RAPD dalam membedakan antara genotipe homozigot dominan dan heterozigot merupakan salah satu kekurangan dari marka RAPD jika dibandingkan dengan marka SSR. Donata (2010) menyatakan bahwa marka SSR bersifat kodominan selanjutnya Weising et al. (2005) menjelaskan
bahwa salah satu kelemahan dari marka RAPD adalah sangat sensitif terhadap perubahan kondisi reaksi dan marka RAPD hanya dapat membedakan genotipe yang bersifat homozigot dominan.
Profil Kuantitatif Hasil Elektroforesis Marka SSR pada Kelapa Sawit Varietas DxP Unggul Socfindo
perhitungan profil kuantitatif hasil elektroforesis marka SSR dapat dilihat pada Tabel 2.
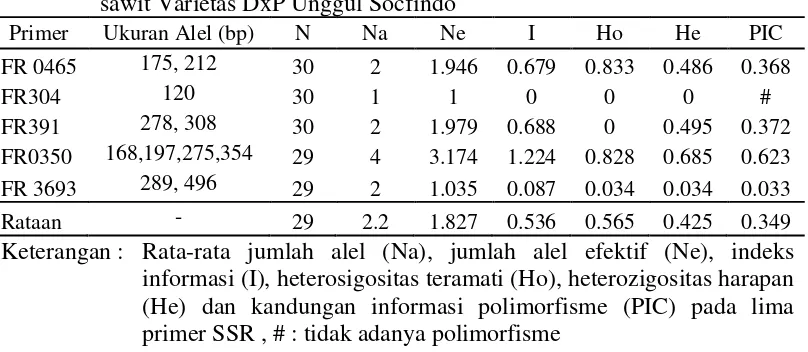
Tabel 2. Profil hasil elektroforesis marka SSR pada amplifikasi 30 DNA kelapa sawit Varietas DxP Unggul Socfindo
Primer Ukuran Alel (bp) N Na Ne I Ho He PIC
FR 0465 175, 212 30 2 1.946 0.679 0.833 0.486 0.368
FR304 120 30 1 1 0 0 0 #
FR391 278, 308 30 2 1.979 0.688 0 0.495 0.372
FR0350 168,197,275,354 29 4 3.174 1.224 0.828 0.685 0.623
FR 3693 289, 496 29 2 1.035 0.087 0.034 0.034 0.033
Rataan - 29 2.2 1.827 0.536 0.565 0.425 0.349
Keterangan : Rata-rata jumlah alel (Na), jumlah alel efektif (Ne), indeks informasi (I), heterosigositas teramati (Ho), heterozigositas harapan (He) dan kandungan informasi polimorfisme (PIC) pada lima primer SSR , # : tidak adanya polimorfisme
Pada Tabel 2. diperoleh hasil bahwa rataan nilai jumlah alel sebesar 2.200; rataan jumlah alel efektif sebesar 1.827; rataan indeks informasi sebesar 0.536; rataan hetrozigositas teramati sebesar 0.565; rataan heterozigositas harapan sebesar 0.425 dan rataan PIC adalah sebesar 0.349.
Profil Kuantitatif Hasil Elektroforesis Marka RAPD pada Kelapa Sawit Varietas DxP Unggul Socfindo
Tabel 3. Jumlah fragmen DNA dan tingkat keinformatifan primer RAPD
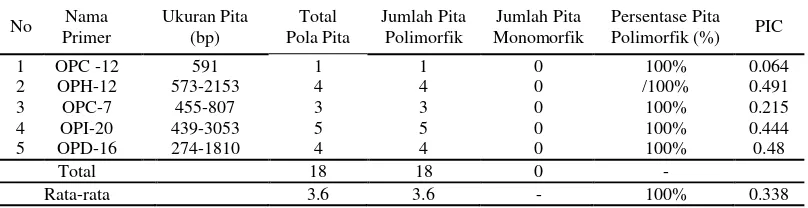
No Primer Nama Ukuran Pita (bp) Pola Pita Total Jumlah Pita Polimorfik Monomorfik Jumlah Pita Persentase Pita Polimorfik (%) PIC
1 OPC -12 591 1 1 0 100% 0.064 2 OPH-12 573-2153 4 4 0 /100% 0.491 3 OPC-7 455-807 3 3 0 100% 0.215 4 OPI-20 439-3053 5 5 0 100% 0.444 5 OPD-16 274-1810 4 4 0 100% 0.48
Total 18 18 0 -
Rata-rata 3.6 3.6 - 100% 0.338
Pada Tabel 3. diperoleh hasil bahwa ukuran pita terkecil adalah sebesar 274 bp sedangkan terbesar 3053 bp, rataan jumlah pita polimorfik sebesar 3.6, tidak terdapat pita yang monomorfik, persentase pita polimorfik 100% dan rataan PIC adalah sebesar 0.347.
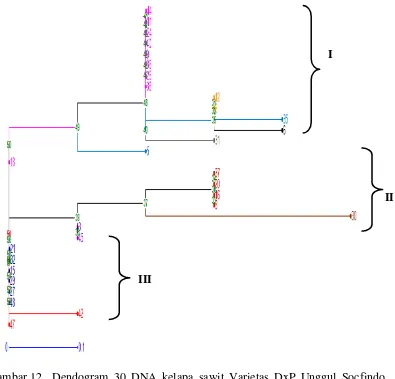
Gambar 12. Dendogram 30 DNA kelapa sawit Varietas DxP Unggul Socfindo yang dianalisis berdasarkan matrix dissimilarity simple matching
berdasarkan marka SSR
Kluster I berjumlah 15 individu yang terdiri atas individu No.44, No.11, No.24, No.40, No.9, No.36, No.26, No.38, No.12,No.2, No.35, No.6 ,No.31, No.5 dan No.18, kluster II berjumlah 7 individu yang terdiri atas individu No.37, No.30, No.16, No.8, No.20, No.30, No.3 dan No.45 dan kluster III berjumlah 8 individu yang terdiri atas No.21, No.32, No.15, No.29, No.27, No.48, No.42 dan No.47.
I
II
Matriks jarak ketidaksamaan genetik marka SSR menunjukkan bahwa jarak ketidaksamaan generik pada tanaman kelapa sawit yang diuji berkisar antara 0.000 sampai dengan 0.900 (Lampiran 11). Jarak ketidaksamaan genetik tertinggi terdapat pada indvidu No. 30 dan individu No.6 sebesar 0.900 sedangkan jarak ketidaksamaan genetik rendah terdapat hampir pada semua individu yang diuji 0.000.
Marka SSR merupakan marka genetik yang salah satu kelebihannya bersifat kodominan (Putri, 2010; Zulhermana, 2009; Donata, 2010). Material genetik yang digunakan pada penelitian ini merupakan benih hasil persilangan DxP sehingga alel yang dibentuk merupakan alel kodominan. Berdasarkan hal tersebut maka dapat diketahui bahwa jika jarak ketidaksamaan genetik tetua yang digunakan untuk persilangan juga berjauhan dan demikian sebaliknya.
Berdasarkan Lampiran 11. dapat diketahui bahwa terdapat perbedaan genetik antara satu individu dengan individu lainnya. Hal ini membuktikan bahwa tetua yang digunakan untuk persilangan varietas DxP Unggul Socfindo berbeda sehingga menghasilkan jarak genetik yang beragam. Jarak genetik yang bernilai 0.8 sampai dengan 0.9 dijumpai pada individu No.30 dan Individu No. 35, inidivdu No. 30 dan individu No. 31, inidividu No.30 dan inidvidu No. 2, individu No.30 dan No.6, individu No.12 dan No.30.
tersebut akan dapat melihat bagaimana kluster yang dihasilkan oleh primer RAPD. Dendogram yang dibentuk marka RAPD dapat dilihat pada Gambar 13.
Gambar 13. Dendogram 30 DNA kelapa sawit Varietas DxP Unggul Socfindo yang dianalisis berdasarkan matrix dissimilarity simple
matchingberdasarkan marka RAPD
Pada matriks jarak ketidaksamaan secara grafik diperlihatkan melalui dendogram (Gambar 13), 30 sampel tanaman sawit menunjukkan pemisahan genotipe ke dalam 3 kluster utama. Kluster I berjumlah 13 individu yang terdiri
II
III
atas individu No.9, No.26, No.45, No.31, No.18, No.42, No.20, No.32, No.6, No.27, No.5, No.47, dan No.29, kluster II berjumlah 12 individu yang terdiri atas individu No.24, No.16, No.38, No.30, No.48, No.3, No.12, No.36, No.2, No.40, No.37 dan No.35 dan kluster III berjumlah 5 individu e yang terdiri atas individu No.44, No.11, No.15, No.8 dan No.21.
Matriks jarak ketidaksamaan genetik marka RAPD menunjukkan bahwa jarak ketidaksamaan generik pada tanaman kelapa sawit yang diuji berkisar
antara 0.000 sampai dengan 1.265 (Lampiran 12). Jarak ketidaksamaan genetik tertinggi terdapat pada indvidu No. 30 dan individu No.9 sebesar 1.265
sedangkan jarak ketidaksamaan genetik rendah terdapat pada individu No. 24 dan individu No.11.
Marka RAPD merupakan penanda molekuler yang dapat menunjukkan adanya keragaman genetik. Marka RAPD telah secara luas digunakan untuk penelitian diversitas genetik (Guneeren et al. 2010). Berdasarkan Lampiran 12.
Profil Radial Neighbour-Joining Tree (NJtree) Marka SSR Kelapa Sawit Varietas DxP Unggul Socfindo
Profil radial NJtree berguna untuk pengelompokkan dari genotipe yang
diuji berdasarkan marka yang digunakan.Berdasarkan profil radial tersebut dapat dilihat bagaimana kecenderungan pengelompokan terhadap 30 sampel tanman kelapa sawit Varietas DxP Unggul Socfindo. Pengelompokkan NJtree pada
penelitian ini berdasarkan jarak ketidaksamaan dengan menggunakan marka SSR. Berdasarkan pengelompokkan NJtree tersebut dapat diketahui bahwa
tanaman kelapa sawit yang berasal dari varietas yang sama telah dapat dibedakan. Perbedaan berdasarkan grup tersebut akan menunjukkan bagaimana tingkat keragaman genetik. Genotipe-genotipe yang berada pada grup yang samamemiliki tingkat kekerabatan yang lebih dekat sedangkan genotipe-genotipe yang terletak pada grup yang berbeda menunjukkan ketidakmiripan yang lebih jauh.
Gambar 14. Profil Radial Neighbour-Joining Tree (NJtree) dari 30 DNA kelapa
sawit Varietas DxP UnggulSocfindo yang dianalisis berdasarkan yang dianalisis berdasarkan matrix dissimilarity simple
matchingdengan Menggunakan Marka SSR
Berdasarkan hasil analisis matrix dissimilarity simple matching
didapatkan hasil profil radial yang dianalisis dikelompokkan kedalam tiga grup utama. Berdasarkan Gambar 14. dapat diketahui bahwa pola pita yang hampir sama diantara sampel yang diuji membuat profil radial menjadi sangat rapat.
Profil Radial Neighbour-Joining Tree (NJtree) Marka RAPD Kelapa Sawit Varietas DxP Unggul Socfindo
Profil Radial Neighbour-Joining Tree (NJtree) dari 30 DNA Kelapa
Sawit Varietas DxP Unggul Socfindo dengan menggunakan marka RAPD yang dianalisis berdasarkan matrix dissimilarity simple matching dikelompokkan
I
II
kedalam tiga grup utama yang mana grup I dibagi kedalam dua sub grup, grup dua dan grup tiga. Profil radial Neighbour-Joining Tree (NJtree) yang dibentuk pada
marka RAPD dapat dilihat pada Gambar 15.
Gambar 15. Profil Radial Neighbour-Joining Tree (NJtree) dari 30 DNA kelapa sawit
Varietas DxP Socfindo La Mêyang dianalisis berdasarkan yang dianalisis
berdasarkan matrix dissimilarity simple matching dengan Menggunakan
Marka RAPD
Pengolompokan genotipe yang dihasilkan oleh marka RAPD dan SSR menunjukkan bahwa primer yang telah digunakan dapat menunjukkan adanya perbedaan antara individu yang diuji yang dikelompokkan kedalam 3 grup utama.Terdapat perbedaan inividu hasil NJtree pada RAPD dan SSR, hal ini
IA
IB
IIA IIB
II I
membedakan individu berdasarkan sifat dominan sedangkan SSR membedakan individu berdasarkan sifat kodominan.
Berkaitan dengan hal ini maka pengelompokan tersebut sangat berguna, sebagai langkah awal untuk proses pemuliaan tanaman. Proses pemuliaan tanaman akan jauh lebih efektif dilakukan jika berasal dari grup yang berbeda. Acquaah (2007) menjelaskan bahwa semakin jauh jarak genetik maka proses persilangan yang akan dilakukan juga akan semakin mudah. Proses persilangan sendiri terkait dengan sifat fenotip yang dikendalikan oleh alel-alel tertentu. Irawan (2008) menjelaskan bahwa sifat fenotip dikendalikan oleh gen tertentu yang mengontrol suatu sifat. Sifat tersebut bersifat dominan, resesif, kodominan dan adanya interaksi gen. Alel yang ekspresinya dapat menutupi alel lain bersifat dominan sedangkan yang ditutupi disebut dengan resesif.
Analisis faktorial Principal Coordinates Analysis (PCoA) Marka SSR Kelapa Sawit Varietas DxP Unggul Socfindo
Analisis faktorial PCoA menunjukkan bahwa aksis 1 dan aksis 2 mampu menjelaskan nilai keragaman molekuler pada lima primer SSR yang digunakan pada 30 DNA kelapa sawit var DxP Unggul Socfindo sebesar 62.43%. Hasil analisis Principal Coordinates Analysis (PCoA) yang dibentuk pada marka SSR
Gambar 16. Analisis faktorial Principal Coordinates Analysis (PCoA) aksis 1
(horizontal) dan aksis 2 (vertikal) yang dianalisis berdasarkan
matrix dissimilarity simple matchingdengan menggunakan Marka
SSR
Analisis faktorial Principal Coordinates Analysis (PCoA) Marka RAPD Kelapa Sawit Varietas DxP Unggul Socfindo
Analisis faktorial PCoA menunjukkan bahwa aksis 1 dan aksis 2 mampu menjelaskan nilai keragaman molekuler pada lima primer RAPD yang digunakan pada 30 DNA kelapa sawit var DxP Unggul Socfindo sebesar 42.59%. Hasil analisis Principal Coordinates Analysis (PCoA) yang dibentuk pada marka RAPD
dapat dilihat pada Gambar 17.
Gambar 17. Analisis faktorial Principal Coordinates Analysis (PCoA) aksis 1
(horizontal) dan aksis 2 (vertikal) yang dianalisis berdasarkan
matrixdissimilarity simple matching dengan Menggunakan Lima
Marka RAPD
Upaya perbaikan tanaman akan lebih efektif dilakukan dengan melihat keragaman genetiknya. Oleh sebab itu, keragaman merupakan modal utama dalam proses pemuliaan tanaman. Widiastuti et al. (2013) menjelaskan bahwa upaya
perbaikan sifat tanamansalah satunya adalah dengan meningkatkan keragaman genetik.Seperti telah diketahui, modal dasar pemulian tanaman adalah adanya keragaman yang luas. Dengan adanya variabilitas yang luas, proses seleksi dapat dilakukan secara efektif karena akan memberikan peluang yang lebih besar untuk diperoleh karakter-karakter yang diinginkan.
Pembahasan
Identifikasi keragaman genetik kelapa sawit (E. guineensis) Varietas DxP Socfindo Unggul berdasarkan marka RAPD dan SSR
Identifikasi keragaman genetik meupakan salah satu upaya dalam proses pemuliaan tanaman. Selama ini upaya tersebut dilakukan dengan cara melakukan pengamatan morfologi. Pengamatan morfologi memiliki beberapa kekurangan yaitu data yang diperoleh sangat dipengaruhi faktor lingkungan, untuk mengatasi permasalahan perlu dilakukan pengamatan molekuler. Pengamatan molekuler akan menunjukkan data yang relatif lebih stabil dan tidak dipengaruhi faktor lingkungan. Dua lembang et al. (2010) menyatakan identifikasi molekuler akan
memberikan hasil yang lebih efektif dan akurat dibandingkan dengan pengamatan morfologi.
pada kedua marka tersebut adalah marka SSR bersifat heterozigot atau kodominan sedangkan marka RAPD bersifat dominan. Donata (2010) menyatakan bahwa marka SSR merupakan salah satu marka yang bersifat heterozigot, selanjutnya Zulfahmi (2013) menyatakan RAPD merupakan salah satu marka molekuler yang bersifat dominan.
Untuk mengamati adanya keragaman genetik dapat dilakukan dengan mengamati jumlah alel dan rataan alel, semakin tinggi jumlah alel teramati semakin menunjukkan adanya keragaman genetik pada genom yang diamati. Primer-primer SSR yang digunakan telah dapat menunjukkan adanya perbedaan jumlah alel. Berdasarkan hasil penelitian ini menunjukkan bahwa jumlah alel yang dihasilkan pada masing-masing primer SSR mulai dari satu alel sampai dengan empat alel. Perbedaan jumlah alel tersebut dapat menunjukkan adanya perbedaan genetik pada masing-masing individu. Hartati et al. (2010) menyatakan
bahwa perbedaan jumlah alel dalam suatu lokus dapat menunjukkan adanya keragaman.
Jika dibandingkan dengan rataan alel origin central tanaman kelapa sawit
(2007) menjelaskan bahwa keberadaan jumlah alel pada populasi liar menunjukkan penurunan yang disebabkan oleh adanya proses seleksi, selanjutnya Mangoendidjojo (2003) menyatakan bahwa jika suatu genotipe secara terus menerus mengalami penyerbukan dan pembuahan sendiri akan tampak bahwa proporsi homozigot akan bertambah sedangkan proporsi heterozigot akan menurun.
Ne menunjukkan jumlah alel efektif yang didapatkan dari masing-masing DNA tanaman, nilai ini merupakan kebalikan dari nilai homozigositas. Semakin tinggi nilai Ne, maka semakin banyak jumlah individu yang bersifat heterozigot. Jumlah alel efektif tertinggi terdapat pada primer FR0350 sedangkan terendah terdapat pada primer FR046, rataan alel efektif untuk primer SSR adalah 1.831. Penelitian terkait dengan jumlah alel yang telah dilakukan oleh penelitian-penelitian sebelumnya dengan menggunakan varietas komersial menunjukan tidak adanya perbedaan. Hal ini ditunjukkan oleh penelitian Nida (2014) yang memperoleh jumlah rataan alel sebesar 2.80; Maizura et al. (2009) memperoleh
sebesar 1,90 dan Allou et al. (2008) memperoleh sebesar 1.75.
keragaman. Surahman et al. (2007) yang menyatakan bahwa primer RAPD
bersifat tunggal yang memiliki rangkaian nukleotida yang bersifat random sehingga dapat dimanfaatkan untuk mendeteksi keberadaan polimorfisme DNA pada suatu genom.
Indikator lain yang dapat dijadikan untuk melihat adanya keragaman genetik tanaman pada Varietas DxP Unggul Socfindo adalah berdasarkan nilai heterozigositas teramati (Ho) dan heterozigositas harapan (He), semakin tinggi nilai heterozigositas semakin tinggi keragaman genetiknya. Berdasarkan hasil penelitian ini, secara umum dapat dilihat bahwa nilai heterozigositas termati (Ho) lebih tinggi dibandingkan dengan nilai heterozigositas harapan (He).
Identifikasi genetik terhadap individu kelapa sawit yang berasal dari origin
center-nya akan menunjukkan nilai Ho lebih rendah dibandingkan dengan nilai
He. Hal ini dibuktikan oleh Zulkifli et al. (2007) yang mengamati E.guineensis
di sebelas negara sumber plasma nutfah kelapa sawit diperoleh rataan Ho sebesar 0.398 dan He sebesar 0.503, selajutnya Putri (2010) melihat pada origin kelapa sawit yaitu Avros, Nigeria, Ekona, Ghana, Yangambi, Lá Mê menunjukkan nilai rataan Ho sebesar 0.401 dan He 0.503, hal yang sama juga dijumpai pada Noorhiza et al. (2012) mengamati pada beberapa daerah penghasil kelapa sawit
Akan tetapi, nilai Ho akan lebih tinggi dibandingkan dengan nilai He jika identifikasi genetik tersebut dilakukan pada varietas komersial atau pada individu kelapa sawit yang berasal hasil persilangan atau telah melalui tahapan pemuliaan sehingga telah terjadi tekanan akibat seleksi. Hasil penelitian ini menunjukkan nilai rataan Ho (0.565) lebih tinggi jika dibandingkan dengan nilai rataan He (0.425). Hal yang sama juga terdapat pada Nida (2014) yang menunjukkan nilai rataan Ho sebesar 0.826 dan He sebesar 0.576, Nida et al. (2014) menunjukkan
nilai rataan Ho sebesar 0.8575 dan He sebesar 0.615.
Berdasarkan primer SSR digunakan pada penelitian ini diperoleh hasil bahwa rataan PIC pada primer SSR sebesar 0.349, nilai PIC tertinggi pada primer SSR adalah pada primer FR0350 dengan nilai PIC sebesar 0.623 sehingga primer FR0350 dikategorikan termasuk primer yang sangat informatif sedangkan nilai PIC terendah teridentifikasi pada primer FR304. Nilai PIC menunjukkan tingkat keinformatifan primer untuk menunjukkan adanya keragaman genetik pada suatu individu. Secara umum nilai PIC pada keseluruhan primer SSR yang digunakan termasuk kelas sedang (0.25 > PIC < 0.5). Penentuan kriteria PIC tersebut berdasarkan Botesin et al. (1980). Yu et al. (2009) mengatakan bahwa standar
marker bisa digunakan untuk analisis keragaman genetik adalah setiap lokus harus mempunyai besar sama dari 4 alel dengan PIC lebih dari 0.7 sedangkan Billotte et
al. (2001) menyatakan bahwa marka SSR umumnya menunjukkan nilai PIC di
FR0350 yang menunjukkan nilai PIC sebesar 0,623 dan jumlah alel teramati sebesar empat alel.
Identifikasi keragaman genetik pada tanaman kelapa sawit dengan menggunakan primer RAPD menunjukkan hasil bahwa rataan PIC sebesar 0.338 dengan nilai PIC tertinggi pada primer OPH-12 dengan nilai PIC sebesar 0.491 sedangkan terendah pada primer OPC-12 dengan nilai PIC sebesar 0.064. Ma et
al. (2013) menyatakan bahwa nilai PIC untuk dominan marker seperti RAPD
memiliki nilai maksimum 0.5. Berdasarkan kriteria PIC Ma et al. (2013) dapat
diketahui bahwa primer RAPD yang digunakan pada penelitian ini telah mampu menunjukkan adanya keragaman genetik pada tanaman kelapa sawit Varietas DxP Unggul Socfindo. Primer yang dapat digunakan untuk menunjukkan adanya keragaman karena mendekati nilai PIC sebesar 0.5 teridentifikasi pada primer OPH-12(PIC =0.491), OPI-20 (PIC=0.444) dan OPD-6 (PIC=0.480).
Berdasarkan hasil analisis PCoA dengan menggunakan marka RAPD menunjukkan nilai keragaman molekuler sebesar 42.59% yang terbagi dalam tiga grup utama. Grup pertama terdiri atas dua subgroup, grup kedua satu grup dan grup ketiga terdiri atas dua grup sedangkan berdasarkan marka SSR nilai keragaman molekuler sebesar 62.04% yang terbagi kedalam tiga grup utama. Berdasarkan hal tersebut dapat diketahui bahwa nilai keragaman molekuler pada marka SSR lebih tinggi dibandingkan dengan nilai keragaman molekuler pada marka RAPD.
Berdasarkan hasil analisis molekuler dengan menggunakan marka penanda genetik telah teridentifikasi keberadaan genotipe yang memiliki karakter genetik yang berbeda dengan genotipe-genotipe lainnya. Genotipe No.30 tersebut menunjukkan sebaran yang jauh berbeda jika dibandingkan dengan genotipe yang lain. Hal ini menunjukkan bahwa terdapat perbedaan karakter pada genotipe ini jika dibandingkan dengan varietas DxP Unggul lainnya.
Perbedaan tersebut dapat terjadi karena disebabkan oleh beberapa kemungkinan. Kemungkinan pertama bahwa benih tersebut bukan benih varietas DxP unggul Socfindo, tetapi bisa saja berasal dari benih lain yang tercampur pada saat proses pengemasan atau kesalahan dalam pembuatan label. Penggunaan marka molekuler dapat mendeteksi kesalahan pada saat pemberian label, hal ini dibuktikan oleh Hack et al. (2012) yang mendeteksi telah terjadi kesalahan
Kemungkinan kedua dapat disebabkan oleh terjadinya kesalahan pada saat penyerbukan sehingga menghasilkan benih yang berbeda. Pada saat melakukan proses penyerbukan bisa saja pohon yang hendak diserbuki menggunakan serbuk sari yang berbeda atau bisa jadi disebabkan karena penyungkup terbuka sehingga serbuk sari yang berasal dari tanaman lain terbawa oleh angin, atau bisa juga disebabkan oleh serangga yang menyusp ke penyungkup sehingga tanpa sengaja serbuk sari yang berasal dari varietas lain terbawa oleh serangga tersebut. Widhiono (2015) menjelaskan bahwa sarana atau agensia dalam proses penyerbukan terdiri atas faktor fisik (angin dan air) dan faktor hayati (serangga, burung, kelelawar). Jumlah polen yang digunakan pada saat penyerbukan juga dapat mempengaruhi proses keberhasilan pada saat penyerbukan. Yunita et al.
(2015) bahwa faktor-faktor yang mempengaruhi keberhasilan persilangan selain self-incompatibility adalah intensitas pollinasi (jumlah polen yang diinfestasikan) dan cuaca pada saat penyerbukan.
oleh adanya mekanisme mutasi, perpasangan alel secara bebas dan adanya migrasi gen dari satu tempat ke tempat lain. Selain hal tersebut dapat juga dapat disebabkan oleh ketidakstabilan genetik yang diakibatkan oleh adanya kerusakan DNA yang menyebabkan perubahan dalam struktur dasar dan fungsi rantai DNA. Corvianindya dan Aurkari (2001) menyebutkan bahwa ketidakstabilan genetik dapat terjadi pada tingkat kromosom dan nukleotida sehingga menyebabkan terjadinya kerusakan DNA (DNA damage) sehingga meningkatkan kecepatan
mutasi yang mengubah strktur dasar dan fungsi rantai DNA.
Jarak genetik individu No.30 memiliki perbedaan yang cukup jauh dibandingkan dengan genotipe-genotipe lainnaya. Hal tersebut dapat dijadikan sebagai materi genetik untuk menambah kekayaan plasma nutfah kelapa sawit dan sebagai bahan informasi untuk perencanaan strategi pemuliaan tanaman kelapa sawit selanjutnya. Hal ini dijelaskan oleh Putri (2010) yang menjelaskan bahwa dari segi konservasi plasma nutfah, pola sebaran distribusi alel-alel, keberadaan alel spesidik dan distribusi variasi genetik dapat digunakan sebagai kriteria genetik untuk melindungi genotipe-genotipe yang berbeda dalam gen bank dan dapat digunakan sebaai penegetahuan yang ekstensif tentang material pemuliaan.
Identifikasi primer yang dapat dijadikan sebagai marker hasil fingerprinting kelapa sawit (E. guineensis) Varietas DxP Unggul Socfindo berdasarkan marka RAPD dan SSR
untuk Varietas DxP Unggul Socfindo adalah primer FR304 (120 bp). Keberadaan primer yang dapat dijadikan sebagai marker genetik untuk Varietas DxP Unggul Socfindo juga diperoleh pada primer RAPD yaitu pada OPC-12 (591 bp). Primer tersebut dapat dijadikan sebagai primer yang menunjukkan keberadaan genetik Varietas DxP Unggul Socfindo sehingga dapat dijadikan sebagai primer untuk mendeteksi Varietas DxP Unggul Socfindo.
FR304 dan OPC-12 bersifat monomorfik menunjukkan bahwa primer tersebut menunjukkan kesamaan molekuler. Primer yang bersifat monomorfik dapat dijadikan sebagai primer yang berfungsi untuk mengidentifikasi adanya benih tercampur. Hal ini sesuai dengan penelitian Mulsanti et al. (2013) yang
menyatakan bahwa identifikasi kebenaran suatu genotipe tanaman menggunakan marka yang tidak terpaut merupakan salah satu metode yang dapat digunakan untuk menguji kemurnian benih hibrida.
Primer yang dapat dijadikan sebagai marka genetik untuk suatu individu adalah primer tersebut bersifat monomorfik. Penelitian terkait dengan keberadaan primer SSR yang bersifat monomorfik juga ditemukan pada penelitian yang dilakukan oleh Emad dan Soon (2014) tentang penggunaan marka mikrosatelit pada tanaman kelapa sawit. Hasil penelitian Emad dan Soon (2014) menyimpulkan bahwa marka SSR monomorfik dapat digunakan untuk mendeteksi adanya illegitimate palms sehingga marker SSR yang bersifat monomorfik dapat
Identifikasi pita spesifik pada kelapa sawit (E. guineensis) Varietas DxP Unggul Socfindo berdasarkan marka RAPD dan SSR
Berdasarkan hasil pengujian pada marka RAPD dan SSR diketahui bahwa pita spesifik teridentifikasi untuk marka SSR pada primer FR3693. Kespesifikan primer tersebut ditunjukkan dengan keberhasilan marka F3693 untuk menunjukkan pita unik atau berbeda dengan individu lain pada individu No.42 sedangkan pada marka RAPD primer OPI-20 yaitu pada individu No.45.
Keberadaan pita-pita unik tersebut dapat dijadikan sebagai marker pada individu-individu DNA tanaman yang diuji. Penelitian terkait dengan keberadaan pita unik tersebut perlu terus dilakukan untuk mengidentifikasikan fragmen DNA yang menjadi penciri pada suatu individu. Putri (2010) menyatakan bahwa alel spesifik dapat dimanfaatkan untuk menduga suatu gen tertentu yang berperan terhadap suatu karakter, meskipun hal ini tidak terlepas dari kebutuhan analisis dan strategi yang digunakan untuk meyakinkan bahwa alel tersebut benar-benar unik.
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan hasil penelitian, dapat ditarik beberapa kesimpulan antara lain sebagai berikut :
1. Keragaman genetik kelapa sawit (E.guineensis) DxP Unggul Socfindo
berdasarkan kandungan informasi polimorfisme (PIC) pada marka RAPD sebesar 0.349 dan marka SSR sebesar 0.338.
2. Primer SSR yang dapat dijadikan sebagai marker fingerprinting kelapa sawit
(E.guineensis) Varietas DxP Unggul Socfindo adalah pada primer
FR-304 (120 bp), sedangkan primer RAPD yang dapat dijadikan sebagai marker untuk Kelapa Sawit Varietas DxP Unggul Socfindo adalah primer OPC-12 (591 bp).
3. Keberadaan pita spesifik kelapa sawit (E.guineensis) Varietas DxP Unggul
Socfindo marka SSR teridentifikasi pada primer FR-3693 (496 bp) sedangkan marka RAPD teridentifikasi pada primer OPI-20 (3053 bp).
Saran