BAB II
A.
OVERVIEW OF METABOLISM
Fungsi kehidupan meliputi aspek molekul dan biologinya, senyawa molekul yang ada fungsinya bagi kehidupan. Aktifitas sederhana antara lain bergerak, respirasi dan metabolisme, reproduksi dari tumbuh dan berkembangbiak dan gradien/mahluk hidup semisolid.
Mahluk hidup semisolid dimaksud ada perbedaan/gardien yang mempengaruhi kehidupan yaitu suhu dari lingkungan, perbedaan Konsentrasi (ikan tidak secair ikan) dan perbedaan konsentrasi listrik/potensial antara luar dan dalam sel karena perbedaan ion yaitu dalam dunia medis dapat digunkan untuk memantau hidup atau tidak (mati merupakan ion luar dan dalam sel tidak ada perbedaan).
Biomolekul terdiri atas molekul khusus berperan sebagai penggerak antara lain molekul : organik dan anorganik di bagi berdasarkan molekul :
1. Makromolekul > 10.000 dalton, dapat dilihat dengan mata dan mikroskop elektron yaitu proteasom : molekul-molekul raksasa saling bergandengan sehingga bisa dilihat dengan mata
2. Mikromolekul < 10.000 dalton
3. Elektrolit yang dapat terionisasi (yang bermuatan listrik) misalnya NaCl
Peran makromolekul adalah membentuk struktur (bentuk/sporty) morfologi tertentu. Informasi/penyimpan informasi genetika (DNA dan RNA) yaitu karbohidrat, protein dan Lipid. Regulator/efektor dalam berbagai senyawa protein yaitu enzim, antibodi. Cadangan yaitu amilum, glikogen. Fungsi nukleotida sebagai penyusun RNA dan DNA. Caraka (kurir/mesenger) yang membawa pesan dan pengikat energi yaitu Senyawa Energi Tinggi (ATP).
Peran mikromolekul antara lain monosakarida sakarida yang tidak dapat diuraikan lagi/gula sederhana sebagai sumber energi, lemak sebagai sumber energi dalam bentuk asam lemak (triasilgliserol), steroid, lemak lain sebagai struktur dan caraka, prostaglandin (leukotrin, tromboxan, vitamin, fosfotidil). Amina yaitu asam amino (pembentuk protein atau non-protein), amina sebagai caraka (asetilkolin, adrenalin, Nor-adrenalin, histamin, epinefrin). Nukleotida sebagai penyimpan energi, pertukran energi (ATP), caraka intrasel (cAMP/cGMP) serta ekskreta dibuang di luar sel (urea, asam urat).
Peran elektrolit adalah mempertahankan kondisi pH dan tekanan osmotik dan memberi suasana tepat bagi makromolekul dalam menjalankan fungsinya.
Fungsi dasar makromolekul yaitu lokomosi (gerak), reproduksi dan gradien. Makromolekul penting antara lain protein, asam Nukleat (DNA dan RNA), polisakarida, lemak dan makromolekul lain berupa plastik dan silikon.
Lokomosi/gerak berfungsi membentuk struktur baik yang didukung maupun mekanisme gerak tersebut, mendukung struktur menjadi organ, memindahkan struktur/posisi yang memerlukan ATP. Mampu mengeluarkan energi dan bahan-bahan yang bersifat energetik.
Makromolekul memenuhi syarat lokomosi, alasan yaitu berstruktur secara kimia sama/dasar sama, mempunyai morfologi satu sama lain ex. Untuk pembentuk, penyokong, motor berbeda satu sama lain dan syarat ini dipenuhi terutama oleh protein.
Peranan dalam reproduksi yaitu pembentuk suatu unit kehidupan baru/ lain dari yang lama, syarat :
1. Mempunyai kelengkapan hidup yang sama/identik dari kelengkapan hidup yang lama untuk efisiensi
2. Harus ada ketepatan informasi tentang susunan kelengkapan hidup tadi (anomali): peristiwa tidak adanya kelengkapan hisdup dan mutasi : pada tingkat sel
3. Informasi tersebut harus terekam dan tersimpan/terlindungi dan menjaga informasi
Syarat ini dipenuhi oleh Asam nukleat yaitu gen-gen satuan informasi asam nukleat melakukan ekspresi gen, bila informasi tersebut dibuka kodon memberi makna. Informasi tersebut harus di baca dan diekskusi/dilaksanakan dalam keadaan tertentu dalam hal ini memerlukan peleksana sebagai efektor ( yang bertindak adalah protein). Reproduksi memerlukan asam nukleat sebagai perekam dan menjaga serta memerlukan protein guna membaca dan efektor.
Dogma Central yang dikemukakan oleh Krick yaitu alur informasi 1 arah antara
RNA - DNA – Protein. Protein /peptida prebiotik mampu memperbanyak diri :
1. Sendiri (tetapi tingkat mutasi tinggi) bila kelengkapan dasar bermutasi menyebabkan tingkat kekeliruan tinggi (priom)
2. Protein tubuh sendiri yang berubah bentuk, baikprotein, tubuh juga merembet ke molekul lain
Virus yaitu partikel asam nukleat yang dibungkus protein prebiotik dan hidup pada mahluk hidup
Kelestarian biomolekul berfungsi rekam dan fungsi efektor tidak dapat dicampur, untuk meminjam kelestarian biomolekul (elemen unit hidup), harus dilaksanakan oleh 2 makromolekul berbeda dimana Asa ukleat ta pa protei lu puh, protei ta pa asa
ukleat uta dan Pe usata perhatia pada DNA Dog a ce tral” ditentang ketika ditemukan Virus RNA
Gradien yaitu kondisi intrasel dan ekstrasel tidak sama : sel hidup dan sel mati dapat dibuktikan pewarnaan, terwarnai eosin pada membran sel pecah (Biotripous)
dengan syarat pH, suhu,kadar. Hal ini menjadi fenomena fisik bioelktrik terpenuhi. Perbedaan potensil listrik di luar dan di dalam sel ada yang harus membatasi intrasel dan ekstrsel, karenanya ada lingkungan yang bersifat aquatik (diisi oleh air) terlapisi lipid/lemak. Lipid secara fisik pasif tidak tercampur dengan air menyebabkan gardien suhu akan hilang.
Melawan Hk Termodinamika II, entropi meningkat dan pada jangka waktu tertentu, untuk mempertahankan persyaratan sbb :
1. Struktur bekerja aktif (salah satu struktur), perlu energi (mengekstraksi energi dari bahan yang mengandung energi banyak)
2. Struktur sel harus bekerja secara mekanis, hubungan dengan metabolisme, dalam metabolisme memerlukan enzim-substratdan protein mekanis pompa/gerbang Pelaksana gradien
Lipid membatasi fisik
Protein menjalankan/mempertahankan sel aktif/hidup
Polisakarida sumber energi
Dalam gradien : ada makromolekul dan molekul-molekul benar-benar menjalankan fungsi kehidupan karena ada dimana-mana harus ada protein
Ruang lingkup metabolisme meliputi koordinasi berbagai reaksi kimia (berkaitan dengan mahluk hidup), dibandingkan pabrik pupuk hanya membentuk suatu senyawa yaitu urea (CO2 dan NH3) memerlukan tangki besar ( tidak memerlukan koordinasi tetapi
suhu dan kondisinya harus dibuat). Terjadi pengaturan jalur reaksi pada kecepatan yang tidak sama. Lokasi sel tidak disembarang tempat (lokalisasi didukung struktur khusus dan fungsi metabolisme). Jalur yang menonjol berhubungan dengan fungsi dan diferensiasi sel, perangkat genetik kultur sel hati : oleh albumin (tidak berwarna) dan kultur sumsum tulang oleh Hb (merah)
Jumlah jenis reaksi sama dimana jumlah reaksi sangat banyak. Reaksi berlansung cepat, cukup dan sangat cepat pada suhu rendah. Reaksi berlangsung sangat spesifik. Korelasi fungsional berbagai reaksi dengan mempertimbangkan reaksi yang lain sehingga terdapat aktivitas kimia satu sama lain.
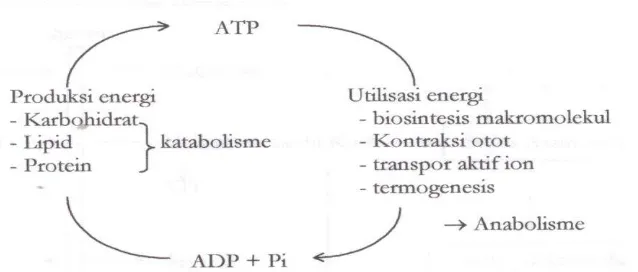
Tujuan reaksi kimia yaitu memperoleh energi untuk berbagai proses, memperoleh bahan baku untuk proses oksidasi, reparasi (perbaikan) dan sintetis dan membuang bahan-bahan yang tidak berfungsi ke luar sel.
Syarat metabolisme berjalan yaitu metabolit umum yang dapat dipakai menjadi molekul besar (bahan baku) pada 2 reaksi. Reaksi tiap senyawa berjalan berdasarkan urutan tertentu. Ada jalur-jalur metabolisme dan mengharuskan jalur mengambil lokasi tertentu (tidak disembarang tempat) dan struktur organisasi sel (organel sel). Pengendalian tingkat enzim dan caraka (mesenger) merupakan senyawa metabolisme antara.
Metabolisme umum merupakan transaksi molekuler berupa asetil KoA, AT, dan NADH/NADPH. Pengatur metabolism melalui molekul enzim, inhibitor dan lingkungan ekstrim.
B. REAKSI REDOKS DAN BIOENERGITIKA
Bioenergitika suatu upaya guna menghasilkan energi untuk menghasilkan kerja yang merupakan salah satu ciri dari sifat mahluk hidup membutuhkan kombinasi antara system atau tubuh dengan lingkungan (universe). Definisi bioenergitika atau termodinamika biokimia yaitu Ilmu yang mempelajari perubahan energi yang menyertai reaksi biokimia atau terjadi pelepasan energi selama sistem reaksi bergerak dari tingkat energi lebih tinggi ke tingkat energi yang lebih rendah
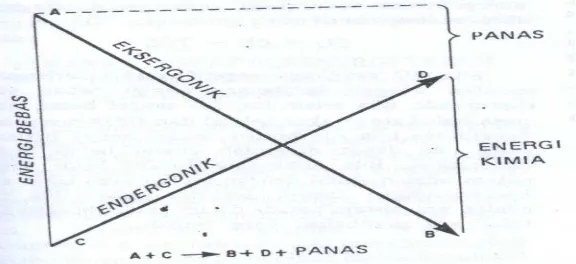
Gambar 2B.1 Coupling eksergonik dan endergonik
Pada Hk Termodinamika I yaitu prinsip konservasi energy, bila terjadi Suatu proses jumlah energi (energi total sistem dan lingkungan) adalah konstan. Tidak ada energi yang hilang/diciptakan. Hk Termodinamika II dimana entropi dari suatu sistem dan lingkungan (entropi) selalu bertambah meningkat sehingga dicapai keseimbangan entropi akan mencapai maksimum pada suhu (T) dan tekanan (P) tertentu. Diketahui energi Bebas (G) dimana H merupakan energi potensial suatu sistem, yang harus diubah menjadi energi bebas menimbulkan kerja. Sehingga G = H – T S, G (-) bersifat spontan exergonik,
G (0) terjadi keseimbangan dan G (+) bersifat tidak spontan/input dari lingkungan.
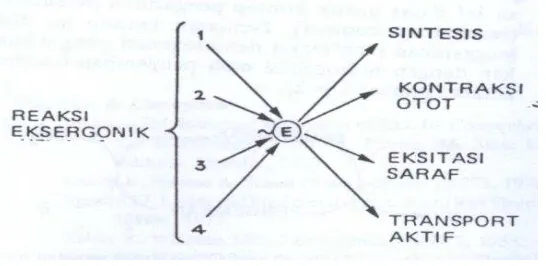
Lingkungan terdapat input energy, selanjutnya dapat dipergunakan untuk aktifitas hidup, gerak mekanik transpor aktif molekul, ion biosentesis makromolekul dan transduksi sinyal.
Gambar 2B.3 Transduksi energi
Energi sel atau mahluk hidup diperoleh melalui reaksi redoks, transfer elektron dari donor (substrat), ke aseptor CO2 atau molekul lain yang energi rendah. Reaksi Redoks
AH2 + B BH2 + A meliputi oksidasi terjadi bila kehilangan electron, mendapat oksigen, dan ehilangan hydrogen. Sebaliknya reduksi terjadi bila mendapatkan electron, kehilangan oksigen, dan mendapatkan hydrogen.
Energi Potensial, AH2 + B BH2 + A, G = - nF E dimana n = e , F : Faraday 96,406 joule/volt, E = perubahan redoks potensial. Redoks potensial reaktan E (AH2/A) = x volt, Redoks potensial produk E (BH2/B) = y volt dan E = (y –x) volt.
Tabel 2B.1 Standar Energi Bebas
Carier electron dapat berupa nukleotida piridin dan flavin, yaitu koenzim NADH/NADPH menjadi NAD, FADH2 menjadi FAD, serta kadang membutuhkan Kompleks
dengan Mo2+ dan Mn2+.
Gambar 2B.6. Glikolisis–Pemindahan Energi
Gambar 2C.7 Siklus Fosfat & Perubahan Nukleotida Adenin oleh Pirofosfatase anorganik
Gambar 2B.9 Anabolisme katabolisme berkaitan dengan produksi Energi
C. ENZIM
Struktur dan Sifat Enzim
Enzyme, erasal dari ahasa Yu a i, a g erarti yang berada di dalam sel .
Merupakan suatu katalisator biologis. Hakikat kimia enzim adalah protein, sehingga segala ciri dan sifat protein berlaku bagi enzim. Diantaranya, enzim hanya disintesis oleh dan di
dala sel, e erluka suhu da pH terte tu, juga e gala i tur o er dala si tesis
dan degragasi. Lebih dari separuh jumlah protein yang ada didalam sel secara biologis tergolong didalam enzim.
Dixon dan Webb mendefinisikan enzim sebagai suatu protein yang bersifat katalis, disebabkan oleh kemampuannya untuk mengaktifkan senyawa lain secara spesifik, yaitu sifat spesifik terhadap gugus, ikatan, dan isomer.
Gambar 2C.1 Peranan enzim dalam reaksi kimia
Substrat (S), bahan yang akan mengalami reaksi kimia menjadi bentuk lain. Produk (P), bahan hasil reaksi yang terbentuk.
Tanpa enzim
S P (reaksi spontan) Dengan enzim
S+E ES E + P
Enzim dan Katalis non-enzim
Tabel 2C.1 Karakteristik katalis enzim dan non enzim
Katalis enzim Katalis non enzim Sifat kimia Protein Ion anorganik/logam Tempat kerja Sel/lingkungan biotik Reaktor kimia
Suhu Sesuai suhu sel Tinggi > 1000 C
Keasaman Netral Asam/basa Laju reaksi sangat tinggi Rendah-sedang Spesifisitas Spesifik-sangat spesifik Tdk spesifik
Distribusi Enzim
Enzim tersebar tidak secara difus, tidak terbaur rata, tetapi terpusat atau terkelompok di dalam sel. Hal ini disebabkan enzim memiliki fungsi yang berbeda-beda didalam setiap organel-organel sel. Sebagai contoh, enzim yang berada di dalam nucleus, berperanan dalam proses genetik (replikasi, transkripsi). Didalam mitokondria, enzim membantu reaksi oksidasi sel dalam menghasilkan energi. Ribosom, berperanan dalam sintesis protein. Lisosom, berfungsi untuk membantu proses hidrolisis bahan-bahan yang tidak diperlukan sel. Sitoplasma, terdapat enzim glikolisis Didalam membran sel, terdapat enzim untuk mengatur keluar masuknya zat makanan.
Metode Penelitian Enzim
Dengan menggunakan tehnik sitokimia, enzim yang terkandung di dalam suatu sel dapat dideteksi dengan diberi pewarnaan khusus, tidak semua bagian sel akan terwarnai, sebagai contoh, deteksi enzim fosfatase pada sel leukosit, akan membuat daerah lisosom, yang mengandung enzim tersebut dari leukosit terwarnai biru. Tehnik ini membantu kita mengetahui keberadaan atau distribusi dari suatu enzim dalam sel.
Enzim Intra dan Ekstra Sel
Pada umumnya, enzim berada dan menjalankan fungsinya di dalam sel, namun enzim juga dapat bekerja di luar sel atau ekstra sel, diantaranya adalah enzim-enzim yang bekerja pada saluran pencernaan, yang bertugas mengubah makanan yg merupakan makromolekul menjadi bentuk yang lebih sederhana, dan larut air sehingga dapat menembus membran sel. Contoh lain enzim yang bekerja ekstra sel adalah komplemen, suatu protein yang berperan dalam sistem antibodi. Walaupun demikian, namun proses sintesis suatu enzim dilakukan oleh sel dan terjadi di dalam sel. Enzim hanya akan disintesis oleh sel jika sel tersebut memiliki gen yang mengkode enzim tersebut.
Penamaan Enzim
Pada mulanya penamaan enzim tidak memiliki tata cara tertentu. Dengan semakin banyaknya jenis enzim yang ditemukan tata nama mulai dirasakan perlu. Penggunaan akhiran -ase dalam nama enzim terhadap akar kata, akan menunjukkan ciri khas enzim. Dasar nama yang digunakan adalah :
Berdasarkan substrat, misalnya enzim yang berhubungan dengan penggunaan glukosa sebagai substrat, dinamai sebagai glukase.
Berdasarkan jenis ikatan kimia substrat yag diolah oleh enzim. Sebagai contoh, jika ikatan kimia yang diolah adalah ikatan peptide, nama enzim yang bersangkutan ialah peptidase.
Berdasarkan jenis reaksi yang dikatalisis oleh enzim. Misalnya enzim yang mengkatalisis reaksi pemindahan gugus dinamai transferase.
Klasifikasi dan Tata Nama Sistem International Union of Biochemistry (IUB)
Pada tahun 1955, International Union of Biochemistry (IUB) bekerja sama dengan International Union of Pure and Applied Chemistry (IUPAC) membentuk suatu komisi pakar yang ditugasi untuk menangani masalah klasifikasi dan tata nama enzim ini. Pada
Enzim-enzim kelas ini mengkatalisis reaksi oksidasi-reduktasi antara sutau substrat dengan suatu senyawa lain. Yang dipindahkan adalah gugus H, sebagai contoh : NAD+
oksidoreduktase (alkohol dehidrogenase), bekerja terhadap gugus CH-OH sebagai donor elektron dimana NAD+ adalah penerima elektron.
Sred + Aoks Soks + Ared
alkohol + NAD+ aldehid/keton + NADH + H+
Enzim ini mengkatalisis pemindahan atau transfer suatu gugus yang bukan H antara suatu substrat dengan suatu senyawa penerima gugus. Jika gugus tersebut adalah H, dengan sendirinya enzim tersebut tergolong dalam kelas 1, oksidoreduktase. Contohnya, D-heksosa-6 fosfotransferase (heksokinase). Substratnya adalah ATP dan senyawa hidroksil penerima fosfat adalah heksosa. SG adalah substrat yang mengandung gugus G yang akan dipindahkan, A adalah penerima gugus G.
SG + A S + AG
heksosa + ATP heksosa-6-fosfat + ADP 3. Hidrolase
Enzim yang tergolong kelas ketiga ini mengkatalisis reaksi-reaksi hidrolisis, yaitu reaksi pemutusan ikatan kovalen dengan memecah 1 molekul air dan memasukkan fragmen air ini ke 2 radikal pecahan substrat, sehingga terbentuk 2 senyawa produk yang lebih kecil, contohnya adalah peptidase dan fosfatase, Persamaan reaksi umumnya sebagai berikut:
A – B (+ HOH) A – H + B – OH 4. Liase
Enzim kelas ini bekerja mengkatalisis reaksi yang bukan mengeluarkan suatu gugus dari suatu substrat, dengan cara bukan hidrolisis dan meninggalkan ikatan rangkap pada produk. Yaitu pada proses pemecahan karbon-karbon, karbon-sulfur dan karbon-nitrogen, contohnya, dekarboksilase, aldolase, deaminase. Reaksi umum yang dikatalisis oleh enzim ini adalah sebagai berikut:
AC – CB C=C + A – B 5. Isomerase
Sesuai dengan namanya, enzim kelas ini mengkatalisis reaksi pembentukan isomer, baik isomer optik, geometrik maupun isomer posisi. Contohnya, rasemase mengkatalisis isomer optik dari L-alanin menjadi D-alanin.
6. Ligase atau Sintetase
Inilah satu-satunya kelompok enzim yang kerjanya menghasilkan molekul yang lebih besar dari molekul substrat awal. Oleh karena itu enzim kelas 6 ini mengkatalisis reaksi sintetesis. Reaksi sintesis ini terjadi dengan mengikatkan (ligasi) suatu gugus ke suatu substrat. Diantaranya mengkatalisis pembentukkan ikatan antara karbon-karbon, karbon dengan sulfur, karbon dengan nitrogen dan karbon dengan oksigen. Contohnya enzim sintetase dan karboksilase. Persamaan reaksi umumnya sebagai berikut:
S + A SA
ATP : D-hexoxe phosphotransferase (heksokinase)
Kelas 2 : transferase
Sub-kelas 7 : transferfosfat
Sub sub kelas 1 : alkohol sebagai akseptorfosfat
Nama khusus 1 : heksokinase
Kofaktor, Koenzim, Apoenzim dan Proenzim
1. Kofaktor
Logam yang diperlukan oleh enzim tertentu agar dapat aktif, ikatannya tidak erat, contohnya Mg2+, Ca2+, K+, Na+. berbeda dengan Metaloenzim, yaitu, enzim yang
mengandung logam, dimana sifat logamnya tidak dapat dipisahkan dari struktur enzim, tidak dapat dihilangkan, tidak dapat dipurifikasi, contohnya, Zn, Cu, Se, Mo, Fe
Umumnya adalah keluarga vitamin B
Vitamin atau senyawa lain yg berperan sbg koenzim :
Vit C, terlibat dlm aktivitas enzim hidrolase pd prs hidrosilasi asam amino lisin dan prolin, pbtk hormon steroid
Vit K diperlukan utk prs karboksilasi protein faktor penggumpal darah.
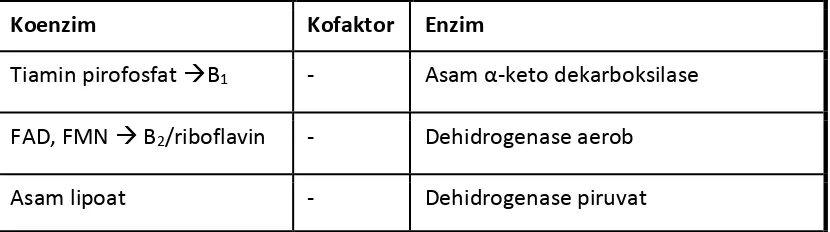
KoQ (Q) atau ubikinon, ptg pd prs sintesis ATP Tabel 2C.2 Jenis koenzim, kofaktor dan enzim
Koenzim Kofaktor Enzim
Tiamin pirofosfat B1 - Asam α-keto dekarboksilase
FAD, FMN B2/riboflavin - Dehidrogenase aerob
Ko enzim A (Ko A) - Transasilase Biotin - Karboksilase
Piridoksalfosfat B6 - Transaminase, dekarboksilase asam
amino
NAD, NADP niasin - Dehidrogenase anaerob Asam tetra hidro folat - Transformilase, transmetilase Metilkobalamin B12 - Transmetilase, isomerase
- Ca Enzim pengumpal drh - Co Dipeptidase
- Cu Enzim2 oksidase
- Fe Enzim2 oksidoreduktase - Mg Fosfatase, kinase
- Mn Aminopeptidase, arginase - Mo Xantin oksidase
- K Piruvat kinase - Na Sukrase
- Se Glutation peroksidase 3. Zimogen/Proenzim
Gambar 2C.2 Autokatalisis
Gambar 2C.3 Autokatalisis pada enzim pencernaan
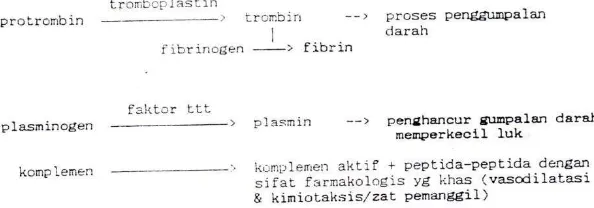
Gambar 2C.4 Autokatalisis pada enzim penggumpalan darah
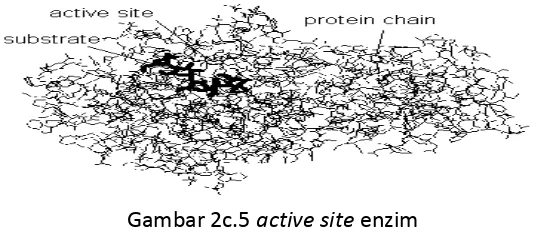
Tempat Aktif Enzim
Gambar 2c.5 active site enzim
Tempat aktif enzim dibentuk oleh residu asam amino yang mempunyai 2 fungsi :
Menarik dan mengorientasikan substrat kepada gugus spesifik pada molekul enzim, yaitu gugus kontak.
Ikut membentuk ikatan sementara dengan molekul substrat, yang selanjutnya terjadi polarisasi dan terjadi regangan pada ikatan di dalam molekul substrat, sehingga mudah dipecah, yaitu gugus katalitik .
Gambar 2C. 6 Kompleks enzim-substrst
Model Interaksi Enzim-substrat
Lock and Key ( Model Fisher)
Teori lock and key Fischer ku i da a ak ku i e era gka ada a
Gambar 2C.7 Teori Lock and Key
Adaptasi Benturan atau Induced fit (Model Koshland)
Teori induced-fit Koshland e per aiki teori Fischer bahwa ada senyawa yg berbeda bentuk molekulnya dengan substrat namun dapat berikatan dengan enzim walaupun tidak membenuk produk. Berarti enzim bersifat fleksibel.
Gambar 2C.8 Teori induced fit Interaksi Alosterik (Model Monod, Wyman dan Changeux)
Berasal dari bahasa Yunani, allos erarti a g lai , da stereos erarti te pat atau rua g . Gagasa dari Mo od, W a da Cha geu i i adalah ah a aktifitas
enzimatik di situs katalitik dapat dipengaruhi oleh interaksi antara bagian lain dari molekul enzim dengan suatu senyawa yang sama sekali tidak menyerupai substrat.
Pada modulator negatif, induksi akan mengubah konfirmasi tempat regulasi kebentuk lain sehingga akan mempengaruhi tempat aktif untuk tidak dapat mengikat substrat. Contoh efektor positif adalah ATP yang membantu dalam penggabungan asam aspartat dengan karbamilfosfat dengan enzimnya aspartat transkarbamilase. Sedangkan untuk efektor negatifnya adalah CTP (sitosin trifosfat).
Gambar 2C.8 Interaksi alosterik
Pada enzim tertentu, tempat alosteriknya dapat mengikat efektor positif dan negatif. Kedua efektor tersebut berkompetisi memperebutkan tempat alosterik yang sama atau dapat pula terikat pada tempat terpisah. Enzim alosterik yang mempunyai satu modulator disebut monovalen, sedangkan yang lebih dari satu disebut polivalen.
Gambar 2C.9 Modulator positif dan negatif
Penghambatan Kerja Enzim
Gambar 2C.11 Produk menghambat aktivitas enzim. Inhibisi kompetitif
i hi itor e pere utka site a ti e .
Gambar 2C.10 Inhibitor Kompetitif Inhibitor non Kompetitif
Gambar 2C.11 Inhibitor non-kompetitif
Inhibitor Unkompetitif
Inhibitor berikatan dengan enzim di luar site active atau inhibitor tidak menghalangi pembentukan kompleks ES, tetapi menghalangi pembentukan produk.
Gambar 2C.11 Inhibitor unkompetitif
Beberapa Faktor Yang Mempengaruhi Kerja Enzim
Hubungan antara Laju Reaksi dengan Konsentrasi Enzim
Semakin besar konsentrasi enzim, semakin banyak pula produk yang terbentuk tiap waktu. Dengan bertambahnya waktu, pada tiap konsentrasi enzim pertambahan jumlah produk akan menunjukkan defleksi, tidak lagi berbanding lurus. Hal ini disebabkan jumlah substrat makin berkurang hingga habis, sehingga dengan sendirinya olahan produk enzim akan berkurang.
V
Gambar 2C.12 Hubungan Ph dengan Reaksi Enzimatik
Gambar 2C. 12 Hubungan Suhu dengan Reaksi Enzimatik
D.
PERAN ORGANEL SEL DALAM METABOLISME
Gambar 2D. 1 Struktur sel
Nukleus
Nukleus merupakan organel yang paling mencolok dalam sel eukariotik
erdia eter 5 ų da e pu ai selu u g ukleus a g erupa ila er lipid
protein. Nukleus mwmpunyai pori-pori yang berguna mengatur keluar masuk makromolekul dan partikel. Lapisan dalam selubung dilapisi oleh lamina nukleus berfungsi mempertahankan bentuk nukleus.
Nukleus mengandung materi gen yang disebut kromatin yang pada saat siap membelah akan menebal dan memadat yang disebut kromosom. Terdapat pula nukleolus merupakan tempat sintesis ribosom. Jumlah nukleolus dapat 2 atau lebih tergantung spesies. Nukleus merupakan tempat mengontrol berlangsungnya sintesis protein.
Ribosom
Ribosom merupakan tempat membuat protein. Ribosom terdiri dari ribosom bebas dan ribosom terikat. Ribosom bebas bila tersuspensi dalam sitosol sedangkan ribosom terikat bila berlekatan dengan membran retikulum endoplamik. Ribosom bebas mensuplai protein untuk kebutuhan sitosol dan ribosom bebas memenuhi kebutuhan protein di membran, organel dan ke luar sel.
Retikulum Endoplasmik
Retikulum endoplasmik merupakan labirin membran meliputi separuh dari total membran sel eukariottik. Endoplasmik artinya di dalam sitoplasma dan retikulum
metabolisme (Lipid, Karbohidrat, hormon dan detoksikasi). RE kasar berfungsi mensekresi protein yang dihasilkan oleh ribosom.
Aparatus Golgi
Aparatus golgi merupakan kantung membran pipih (sisterna) seperti tumpukan roti, berfungsi sebagai gudang, tempat menyortir dan mengirim produk-produk RE sekaligus memproduksi dan menyempurnakan produk secara bertahap sebelum dipindahkan ke bagian sel yang membutuhkan.
Lisosom
Lisosom merupakan tempat sel mencerna makromolekul dengan cara menghidrolisis protein, polisakarida, lemak dan asam nukleat dalam lingkungan asam (pH 5). Lisosom mempertahankan asam dengan memompakan ion hidrogen dalam sitosol ke dalam lumen lisosom. Beberapa organisme berupa vakuola dalam hal ini dapat mencerna organisme lain dan partikel yang lebih kecil yang disebut fagositosis. Biasanya fagositosis ini bergabung dengan lisosom. Sebagian sel menusia juga melakukan fagositosis (makrofaga) yaitu sel yang membantu mempertahankan tubuh dengan merusak bakteri atau penyerang lainnya. Lisosom mengandung enzim-enzim hidrolitik selain mencerna berfungsi pula mendaur ulang kandungan molekuler organel.
Mitokondria
Mitokondria merupakan organel yang mengubah energi menjadi bentuk yang dapat digunakan sel untuk bekerja. Mitokondria sebagai tempat respirasi seluler, proses katalitik yang menghasilkan ATP dengan mengekstraksi energi dari gula, lemak dan bahan bakar lain dengan bantuan oksigen.
Sel umumnya memiliki ratusan atau lebih mitokondria. Mitokondria mempunyai membran bilayer dimana membran dalamnya berlekuk-lekuk yang disebut krista.
Peroksisom
Peroksisom mengandung enzim yang mentransfer hidrogen dari berbagai substrat ke oksigen dan menghasilkan hidrogen peroksida (H2O2), dengan oksigen tersebut dapat memecah asam lemak sebagai bahan bakar untuk respirasi seluler. H2O2 yang beracun di dalam peroksisom dapat dinetralisir menjadi air dengan enzim peroksidase.
Sitoskleton