METODE
Lokasi dan Waktu
Penelitian dilakukan di Laboratorium Pengolahan Susu, Laboratorium Mikrobiologi Hasil Ternak bagian Teknologi Hasil Ternak Fakultas Peternakan IPB dan Laboratorium Mikrobiologi Fakultas Kedokteran UI. Penelitian dilakukan pada bulan Pebruari - September 2011.
Materi
Bahan-bahan yang digunakan pada penelitian ini adalah susu sapi skim untuk media pertumbuhan kultur starter. Susu kuda segar untuk adaptasi kultur campuran dan pembuatan koumiss berasal dari peternakan kuda perah Cikampak. Kultur bakteri asam laktat Lb. acidophilus Y-01, Lc. lactis ssp. lactis D-01 dan khamir Sc. cereviceae merupakan koleksi Laboratorium Mikrobiologi Teknologi Hasil Ternak Fakultas Peternakan Institut Pertanian Bogor. Kultur bakteri patogen S. Typhimurium ATCC 14028 dan M. tuberculosis H37RV merupakan koleksi Laboratorium Mikrobiologi Fakultas Kedokteran Universitas Indonesia.
Media tumbuh yang digunakan adalah de Man’s Rogosa Sharpe Broth (MRSB) untuk Lb. acidophilus, Lc. lactis ssp. lactis dan de Man’s Rogosa Sharpe Agar (MRSA) untuk pengujian bakteri asam laktat; Nutrien Broth (NB) dan Potato Dextrose Agar (PDA) sebagai media tumbuh Sc. cereviceae; Plate Count Agar (PCA) untuk penghitungan jumlah mikroorganisme; Violet Red Bile Agar (VRBA) untuk pengujian koliform; media tumbuh Lowenstein Jensen untuk M. tuberculosis H37RV; media Nutrien Agar (NA) untuk S. Typhimurium ATCC 14028 dan Mueller
Hinton Agar (MHA) sebagai media konfrontasi produk koumiss terhadap S. Typhimurium ATCC 14028. Bahan kimia yang digunakan adalah NaCl fisiologis
0,85%; alkohol 70%, safranin, kristal violet, asam alkohol, methylen blue, karbol fuchsin dan spiritus.
Alat-alat yang digunakan untuk penumbuhan, perbanyakan dan pembuatan media tumbuh kultur starter dan bakteri patogen adalah tabung reaksi, rak tabung reaksi, inkubator, lemari es, mikroskop, cawan petri, pipet satu ml, heater-magnetic stirrer, pembakar bunsen dan autoclave. Alat untuk pembuatan koumiss yaitu botol steril, pengaduk kayu, termometer, gelas liter, gelas ukur, panci double plate dan kompor gas; sedangkan untuk pengujian daya hambat antimikroba koumiss dengan
S. Typhimurium ATCC 14028 dan M. tuberculosis H37RV menggunakan alat pipet volumetrik, pipet man, tabung ulir kecil, tabung reaksi kecil, cawan Petri, jarum Ose, vortex-mixer, tabung berdiameter lima mm (corke borer), glass beed, nevlometer dan jangka sorong.
Prosedur Penelitian
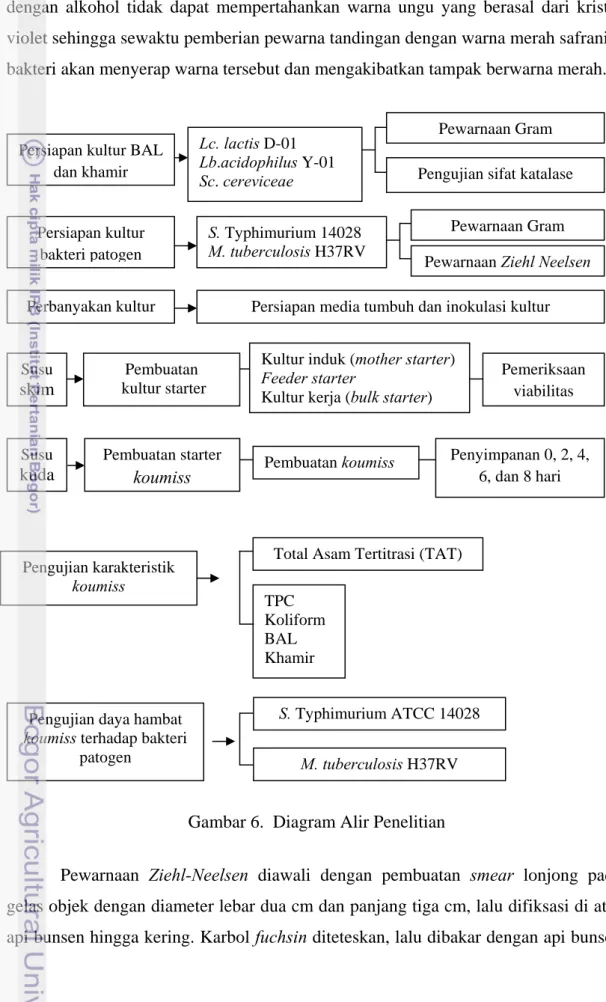
Penelitian terdiri atas beberapa tahap meliputi perbanyakan kultur, pembuatan starter induk serta persiapan dan perbanyakan kultur uji bakteri patogen. Tahap selanjutnya adalah pengujian kualitas mikrobiologi susu kuda, pembuatan koumiss dan pengujian aktivitas daya hambat antimikroba koumiss pada bakteri S. Typhimurium ATCC 14028 dan M. tuberculosis H37RV. Diagram alir penelitian disajikan pada Gambar 6.
Persiapan Kultur Bakteri
Kultur bakteri koleksi yang digunakan adalah Lc. lactis D-01, Lb. acidophilus Y-01, dan Sc. cereviceae, serta bakteri patogen S. Typhimurium ATCC 14028 dan M. tuberculosis H37RV. Pemeriksaan morfologi dan sifat katalase untuk mengetahui karakteristik kultur bakteri termasuk ke dalam persiapan kultur bakteri. Pengujian morfologi starter dengan bantuan pewarnaan Gram untuk bakteri asam laktat Lc. lactis D-01, Lb. acidophilus Y-01, khamir Sc. cereviceae dan bakteri patogen S. Typhimurium ATCC 14028 dan pewarnaan Ziehl-Neelsen untuk M. tuberculosis H37RV. Pengujian pewarnaan Gram mengacu pada Fitria (2009) meliputi tahapan sebagai berikut: kultur bakteri dioleskan pada gelas obyek dengan jarum Ose, kemudian kultur ditetesi kristal violet dan dibiarkan selama satu menit. Preparat kemudian dibilas dengan akuades dan dikeringudarakan. Preparat yang sudah kering ditetesi larutan lugol iodin dan didiamkan selama satu menit, kemudian dibilas kembali dengan akuades. Preparat kemudian dikeringudarakan, selanjutnya ditetesi dengan alkohol 95% sebagai bahan pemucat selama sekitar lima detik. Preparat dibilas kembali dengan akuades dan dikeringudarakan. Pewarnaan terakhir menggunakan safranin selama 30 detik dan dibilas kembali dengan akuades, lalu preparat dikeringudarakan. Bakteri yang telah diwarnai diperiksa di bawah mikroskop pada perbesaran 10 x 100.
Bakteri dikelompokkan menjadi bakteri Gram positif, bila dapat mempertahankan zat warna ungu kristal dan tampak berwarna ungu tua. Kelompok
bakteri Gram negatif akan terlihat berwarna merah, karena pada saat pencucian dengan alkohol tidak dapat mempertahankan warna ungu yang berasal dari kristal violet sehingga sewaktu pemberian pewarna tandingan dengan warna merah safranin, bakteri akan menyerap warna tersebut dan mengakibatkan tampak berwarna merah.
Pewarnaan Ziehl-Neelsen diawali dengan pembuatan smear lonjong pada gelas objek dengan diameter lebar dua cm dan panjang tiga cm, lalu difiksasi di atas api bunsen hingga kering. Karbol fuchsin diteteskan, lalu dibakar dengan api bunsen
Persiapan kultur BAL dan khamir Perbanyakan kultur Pembuatan kultur starter Lc. lactis D-01 Lb.acidophilus Y-01 Sc. cereviceae Pewarnaan Gram Pengujian sifat katalase
Persiapan media tumbuh dan inokulasi kultur Kultur induk (mother starter)
Feeder starter
Kultur kerja (bulk starter)
Pemeriksaan viabilitas Pembuatan starter koumiss Susu skim Susu
kuda Pembuatan koumiss
Penyimpanan 0, 2, 4, 6, dan 8 hari
Pengujian karakteristik koumiss
Total Asam Tertitrasi (TAT) TPC
Koliform BAL Khamir
Pengujian daya hambat koumiss terhadap bakteri
patogen
S. Typhimurium ATCC 14028 M. tuberculosis H37RV
Gambar 6. Diagram Alir Penelitian Persiapan kultur
bakteri patogen
S. Typhimurium 14028 M. tuberculosis H37RV
Pewarnaan Gram Pewarnaan Ziehl Neelsen
dan didiamkan selama lima menit. Setelah itu dibilas dengan air, selanjutnya ditetesi decolorizer berupa asam alkohol dan didiamkan selama 10-15 detik, kemudian dibilas kembali. Larutan ketiga berupa methylen blue diteteskan dan didiamkan selama 10-20 detik lalu dibilas dengan air mengalir dan didiamkan hingga preparat kering. Identifikasi menggunakan mikroskop pada perbesaran 10 x100 (WHO, 1998).
Pengujian sifat katalase dilakukan dengan pengambilan satu Ose bakteri, kemudian dioleskan pada gelas objek, selanjutnya ditetesi dengan satu tetes H2O2.
Apabila dihasilkan gelembung-gelembung gas O2, maka bakteri yang diperiksa
diklasifikasikan ke dalam kelompok bakteri katalase positif, sebaliknya apabila tidak ditemukan gelembung gas, maka bakteri tersebut diklasifikasikan ke dalam kelompok bakteri katalase negatif (Pelczar dan Chan, 2007).
Perbanyakan Kultur
Persiapan Media Tumbuh. Media tumbuh untuk masing-masing mikroflora penyusun starter koumiss disiapkan sebelum melakukan perbanyakan kultur. Media tumbuh untuk Lc. lactis ssp. lactis, Lb. acidophilus berupa de Man’s Rogosa Sharpe Broth (MRSB) disiapkan, pada suhu inkubasi 37 o
C. Media tumbuh untuk Sc. cereviceae berupa Nutrien Broth pada suhu inkubasi 25 o
C.
Inokulasi Kultur. Perbanyakan kultur dilakukan dengan cara penyegaran kultur bakteri sebanyak 5% di dalam media yang sesuai dan diinkubasi pada suhu optimal yang sesuai untuk masing-masing pertumbuhan mikroflora.
Pembuatan Starter dan Pemeriksaan Viabilitas
Persiapan Media Tumbuh. Media tumbuh adalah susu skim yang telah disterilisasi pada suhu 115 oC selama tiga menit. Susu didistribusikan dalam tabung reaksi ukuran 10 ml untuk penumbuhan starter induk.
Penyegaran Kultur Starter. Sebesar 5% kultur perbanyakan diinokulasi ke dalam susu steril yang telah dipanaskan pada suhu 115 oC selama tiga menit, lalu diinkubasi pada suhu 37 oC untuk Lc. lactis D-01 dan Lb. acidophilus Y-01 dan pada suhu 25 oC untuk Sc. cereviceae sampai terjadi koagulasi. Kultur tersebut adalah kultur induk (mother starter). Tahapan selanjutnya yaitu membuat feeder starter dengan cara menambahkan 5% kultur induk ke media tumbuh baru dan diinkubasikan pada suhu
37 oC. Bulk starter dibuat melalui penambahan 5% feeder starter ke dalam media tumbuh baru dan diinkubasikan pada suhu 37 oC.
Pemeriksaan Viabilitas Kultur Starter Koumiss. Pemeriksaan viabilitas kultur starter ini bertujuan untuk mengetahui jumlah koloni dalam starter kerja yang ditentukan dengan memupukkan dan menumbuhkan kultur starter koumiss pada media yang sesuai, untuk bakteri asam laktat (Lc. lactis D-01 dan Lb. acidophilus Y-01) pada media MRSA dan khamir (Sc. cereviceae) pada media PDA.
Pembuatan Starter Koumiss. Bahan baku pembuatan media koumiss yaitu susu segar yang dipanaskan pada suhu 65 oC selama 30 menit, lalu didinginkan hingga suhu 28 oC. Koumiss dibuat dengan cara membagi tiga bagian yang sama, yaitu satu bagian susu dinokulasi dengan Lc. lactis D-01, satu bagian susu diinokulasi dengan Lb. acidophilus Y-01 lalu diinkubasi pada suhu 37 o
C selama tujuh jam dan satu bagian susu diinokulasi dengan Sc. cereviceae pada suhu 25 oC selama lima jam (Gambar 7).
Gambar 7. Diagram Alir Pembuatan Starter Koumiss Tambahkan satu bagian susu kuda yang telah dipasteurisasi 65 oC
selama 30 menit dan telah didinginkan hingga suhu 28 oC Dipanaskan 65oC, 30 menit
Inkubasi 25 oC, 5 jam
Inkubasi 28 oC, 24 jam Æ Starter koumiss terbentuk Dicampur
Inkubasi 37 oC, tujuh jam
Satu bagian inokulasi Sc. cereviceae Satu bagian inokulasi
Lb. acidophilus Satu bagian, inokulasi
Lc. Lc. lactis ssp. lactis
Dinginkan suhu 28oC Susu sapi skim
Pembuatan starter koumiss diawali dengan pencampuran keseluruhan kultur, baik Lc. lactis D-01, Lb. acidophilus Y-01 maupun Sc. cereviceae sebanyak 3%-5% (v/v) ke dalam susu kuda yang telah dipanaskan 65 oC selama 30 menit, lalu didinginkan hingga suhu 28 oC. Hasil campuran susu dan kultur starter diinkubasi pada suhu 28 oC selama 24 jam sehingga terbentuk starter yang diinginkan (modifikasi Rahman et al., 1992).
Pembuatan Koumiss
Koumiss dibuat dari susu kuda yang dipanaskan pada suhu 65 o
C selama 30 menit dan setelah suhu mencapai 28 oC inokulasi dengan 30% starter. Setelah itu diinkubasi pada suhu 28 oC selama 24 jam (modifikasi Rahman et al., 1992). Diagram pembuatan koumiss disajikan pada Gambar 8.
Dinginkan hingga 5 oC dan disimpan
Pematangan 20 oC selama dua jam Dikemas dalam botol Dinginkan hingga 20oC Inkubasi 28 oC selama 24 jam
Dicampur dan diaduk
Gambar 8. Diagram Alir Pembuatan Koumiss Inokulasi dengan 30 % starter
Dinginkan suhu 28 oC Dipanaskan 70 oC, 30 menit
Pengujian Karakteristik Mikrobiologis
Metode yang digunakan dalam penghitungan TPC, koliform, bakteri asam laktat dan khamir yang terdapat dalam susu kuda adalah metode agar tuang (Fardiaz, 1992). Sebanyak satu ml susu kuda contoh dipipet ke dalam tabung reaksi berisi sembilan ml larutan pengencer BPW steril yang selanjutnya merupakan faktor pengenceran 10-1. Campuran dihomogenkan, kemudian diambil satu ml larutan dan dimasukkan ke dalam tabung reaksi berisi sembilan ml larutan pengencer NaCl fisiologis steril sebagai pengenceran 10-2. Pengenceran 10-3, 10-4, dan seterusnya diperoleh dengan cara yang sama.
Setiap pengenceran yang dikehendaki untuk dipupukkan, dipipet secara aseptik sebanyak satu ml. Hasil pengenceran dimasukkan ke dalam cawan petri, yang kemudian dituangi dengan 15-20 ml media steril dan dihomogenkan dengan cara cawan digerakkan membentuk angka delapan. Khusus untuk koliform media dituang sebanyak 15 ml, dihomogenkan, lalu dibiarkan membeku. Setelah itu dibuat over lay dengan cara 5 ml media dituang kembali secara merata ke seluruh permukaan.
Penghitungan jumlah mikroorganisme dilakukan dalam media Plate Count Agar (PCA) dengan pengenceran 10-4
, 10-5 dan 10-6, sedangkan penghitungan bakteri asam laktat menggunakan media de Man Rogosa Sharpe Agar (MRSA) pada pengenceran 10-4, 10-5 dan 10-6.
Penghitungan koliform dilakukan dalam media Violet Red Bile Agar (VRBA) dengan pengenceran 10-1, 10-2 dan 10-3 dan penghitungan khamir dilakukan dalam media Potato Dextrose Agar (PDA) dengan pengenceran 10-4, 10-5 dan 10-6. Penghitungan dilakukan secara duplo. Cawan petri diinkubasi dengan keadaan terbalik dalam inkubator bersuhu 37 oC selama 24 jam. Koloni mikroba yang terbentuk dihitung berdasarkan Standard Plate Count (SPC) dengan rumus sebagai berikut:
1 0,1 2
Keterangan :
N = Jumlah koloni yang berbeda dalam kisaran hitung (25-250 koloni) n1 = Jumlah cawan pertama yang koloninya dapat dihitung
n2 = Jumlah cawan pertama yang koloninya dapat dihitung
Setelah dilakukan tahapan persiapan kultur dan telah didapat jumlah total mikroba, maka selanjutnya dihitung pengenceran yang diperlukan saat mengerjakan uji difusi agar sumur.
Pengukuran Nilai pH (AOAC, 2005). Nilai pH diukur dengan alat pH meter (Schott instrumen lab 850) yang telah dikalibrasi dengan larutan buffer pada pH 7 dan 4. Sampel susu fermentasi dimasukkan ke dalam gelas ukur, kemudian elektroda dari pH meter dimasukkan ke dalam gelas ukur yang telah diisi dengan susu fermentasi, nilai pH tertera pada layar pH meter.
Total Asam Tertitrasi (TAT) (Nielsen 2003). Sejumlah volume tertentu sampel susu fermentasi ditambah tiga tetes Phenopthalein (PP) sebagai indikator, kemudian campuran tersebut dititrasi dengan larutan NaOH 0,1 N hingga terbentuk warna merah muda pertama yang tidak hilang. Nilai derajat keasaman dapat dihitung melalui konversi nilai keasaman menjadi persentase asam laktat sebagai berikut:
persen asam laktat . 100%
Keterangan:
N= normalitas titran (NaOH) V1= Volume titran (ml) V2= Volume sampel (ml)
Eq. Wt = Berat ekuivalen asam (asam laktat = 90,08)
Pengujian Aktivitas Daya Hambat Antimikroba Koumiss terhadap Salmonella Typhimurium
Pengujian aktivitas daya hambat antimikroba koumiss terhadap bakteri Salmonella Typhimurium dilakukan dengan metode difusi agar sumur (modifikasi Wiryawan et al., 2009). Perlakuan yang dilakukan berupa susu kuda pasteurisasi, filtrat dan koumiss. Filtrat merupakan hasil sentrifugasi koumiss 6.000 rpm selama 20 menit. Filtrat koumiss digunakan sebagai perlakuan pembanding dan susu kuda pasteurisasi sebagai kontrol.
Persiapan Bakteri S. Typhimurium ATCC 14028. Bakteri patogen yang digunakan adalah bakteri yang berumur 24 jam. Bakteri patogen dengan populasi awal minimal 108 cfu/ml (standar Mc Farland no. 0,5) untuk metode spread plate,
sedangkan untuk metode pour plate perlu diencerkan dalam media NaCl fisiologis hingga populasi 106 cfu/ml.
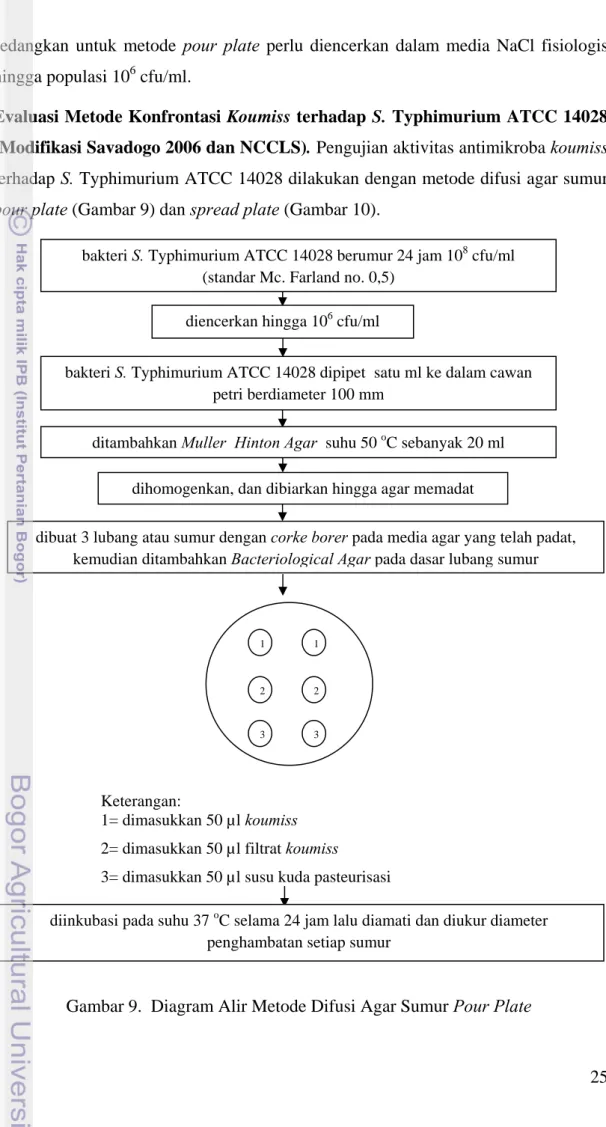
Evaluasi Metode Konfrontasi Koumiss terhadap S. Typhimurium ATCC 14028 (Modifikasi Savadogo 2006 dan NCCLS). Pengujian aktivitas antimikroba koumiss terhadap S. Typhimurium ATCC 14028 dilakukan dengan metode difusi agar sumur pour plate (Gambar 9) dan spread plate (Gambar 10).
Keterangan:
1= dimasukkan 50 µl koumiss 2= dimasukkan 50 µl filtrat koumiss
3= dimasukkan 50 µl susu kuda pasteurisasi diencerkan hingga 106 cfu/ml
bakteri S. Typhimurium ATCC 14028 dipipet satu ml ke dalam cawan petri berdiameter 100 mm
dihomogenkan, dan dibiarkan hingga agar memadat ditambahkan Muller Hinton Agar suhu 50 oC sebanyak 20 ml
dibuat 3 lubang atau sumur dengan corke borer pada media agar yang telah padat, kemudian ditambahkan Bacteriological Agar pada dasar lubang sumur
1
diinkubasi pada suhu 37 oC selama 24 jam lalu diamati dan diukur diameter penghambatan setiap sumur
bakteri S. Typhimurium ATCC 14028 berumur 24 jam 108 cfu/ml (standar Mc. Farland no. 0,5)
1
2 2
3 3
Metode pour plate dilakukan dengan cara sebanyak satu ml kultur bakteri S. Typhimurium ATCC 14028 yang telah diencerkan dengan populasi 106 cfu/ml, dipipet ke dalam cawan petri, lalu ditambahkan media Muller Hinton Agar (MHA) pada suhu 50 oC sebanyak 20 ml/cawan dengan diameter 100 mm, kemudian dihomogenkan dengan cara digerakkan membentuk angka delapan. Media MHA berisi bakteri indikator dibiarkan memadat.
Metode spread plate dilakukan dengan menggores bakteri standar 0,5 Mc. Farland tanpa perlu diencerkan secara merata, setelah media MHA dituang ke dalam cawan dan memadat. Setelah itu dibuat sumur difusi berdiameter lima mm dengan alat pelubang atau cork borer, lalu bagian bawah sumur dilapisi dengan media Bacteriological Agar untuk menghindari koumiss merembes di dasar sumur.
Keterangan:
1= dimasukkan 50 µl koumiss 2= dimasukkan 50 µl filtrat koumiss
3= dimasukkan 50 µl susu kuda pasteurisasi MHA dibiarkan hingga padat
bakteri S. Typhimurium ATCC 14028 berumur 24 jam 108 cfu/ml (standar Mc. Farland no. 0,5) dituang di atas MHA, kemudian dihomogenkan dibuat 3 lubang atau sumur dengan corke borer pada media agar yang telah padat,
kemudian ditambahkan Bacteriological Agar pada dasar lubang sumur
1
diinkubasi pada suhu 37 oC selama 24 jam lalu diamati dan diukur diameter penghambatan setiap sumur
Muller Hinton Agar suhu 50 o
C sebanyak 20 ml dituang ke dalam cawan berdiameter 100 mm
1
2 2
Sebanyak 50 μl koumiss dipipet ke dalam sumur, lalu cawan beserta isi diletakkan dalam refrigerator suhu empat derajat celcius selama 30 menit untuk memberi kesempatan koumiss berdifusi ke dalam agar. Cawan selanjutnya diinkubasi pada suhu 37 oC selama 24 jam. Diameter penghambatan berupa zona bening di sekeliling sumur diukur dengan jangka sorong pada empat tempat yang berbeda, lalu hasil pengukuran dirata-ratakan.
Penetapan Konsentrasi Koumiss untuk Penghambatan M. tuberculosis H37RV Penetapan konsentrasi ini dilakukan untuk mengetahui persentase koumiss yang tepat untuk ditambahkan ke dalam media Lowenstein Jensen dan dapat menghambat pertumbuhan M. tuberculosis H37RV. Pembuatan Media Lowenstein Jensen dilakukan dengan terlebih dahulu homogenisasi telur, penimbangan media Lowenstein Jensen dan pembuatan media untuk pengujian penghambatan (Sjahrurachman, 2008). Penanaman bakteri Mycobacterium tuberculosis H37RV dilakukan setelah media penghambatan disiapkan. M. tuberculosis H37RV yang telah ditanam, diinkubasi selama delapan minggu dengan pengamatan dilakukan pada minggu keempat, keenam dan kedelapan.
Homogenisasi Telur. Telur bebek segar dibersihkan dengan cara digosok dengan sikat dan sabun serta dicuci dengan air mengalir. Setelah itu telur dikeringkan dan direndam dalam etanol 70% selama 15 menit. Telur dipecahkan dengan terlebih dahulu membakar cangkang lalu ditampung di dalam gelas beker. Homogenisasi telur dengan blender selama dua menit (jangan sampai terbentuk gelembung). Larutan telur disaring dengan corong steril yang telah dilapisi dengan kasa steril. Larutan telur diukur sehingga didapatkan satu l larutan.
Persiapan media Lowenstein Jensen. Media LJ (garam-garam, L-Asparagine) dilarutkan dalam 600 ml. Gliserol sebanyak 12 ml dan 20 ml larutan malachite green 2% ditambahkan ke dalam larutan. Larutan dihomogenisasi hingga tercampur sempurna kemudian disterilisasi menggunakan autoclave pada suhu 121 oC selama 15 menit. Media yang telah steril didinginkan sampai suhu 50 oC dan ditambahkan telur homogen sebanyak satu l yang telah dipersiapkan secara steril dan perlahan-lahan (pembentukan gelembung dihindari). Media yang telah siap dituang ke dalam tabung ulir sebanyak 6-8 ml dan dimasukkan oven pada suhu 85 oC selama 45 menit pada posisi miring 30o.
Media Lowenstein Jensen Resistensi. Pengujian aktivitas daya hambat dengan cara menambahkan koumiss dengan persentase tertentu ke dalam media LJ. Persentase yang diuji sebesar 5%;7%;10%;12%;14% dan 20%. Setelah itu baru dilakukan inokulasi bakteri Mycobacterium tuberculosis H37RV.
Inokulasi Bakteri Mycobacterium tuberculosis H37RV. Inokulasi diawali dengan persiapan suspensi bakteri Mycobacterium tuberculosis H37RV dengan konsentrasi standar 0,5 Mc. Farland lalu diencerkan hingga 103 cfu/ml. Pengenceran dilakukan dengan menambahkan 1% bakteri (v/v) ke dalam lima ml NaCl fisiologis. Sebanyak 100 µl suspensi bakteri diinokulasi ke dalam media resistensi yang telah disiapkan dengan menggunakan pipet man secara duplo. Setelah itu suspensi diratakan pada seluruh permukaan media resistensi. Inkubasi tabung-tabung media dengan posisi horizontal dengan sudut kemiringan 30o ke dalam inkubator suhu 37 oC selama satu malam dengan tutup longgar. Setelah inkubasi, tutup tabung dieratkan dan tabung ditegakkan menjadi posisi vertikal. Pembacaan pertumbuhan koloni dilakukan pada hari ke 28 dan 42.
Pengujian Penghambatan M. tuberculosis H37RV
Pengujian untuk bakteri M. tuberculosis H37RV dilakukan dengan membuat media penghambatan yaitu menambahkan koumiss yang telah mengalami perlakuan penyimpanan dengan persentase sesuai hasil penetapan ke dalam media Lowenstein Jensen. Penanaman dan pengujian penghambatan dilakukan sesuai dengan metode di atas.
Pembacaan Uji Penghambatan M. tuberculosis H37RV
Hasil resistensi dibaca pertama kali pada hari ke-28. Jika pembacaan pada hari ke-28 tersebut adalah resisten, maka tidak perlu diadakan pembacaan ulang, sehingga produk dinyatakan resisten terhadap Mycobacterium tuberculosis. Jika hasil pembacaan pada hari ke-28 adalah sensitif maka perlu dilakukan pembacaan ulang pada hari ke-42 untuk meyakinkan hasil pembacaan pada hari ke-28.
Rancangan
Analisis Data
Analisis data yang digunakan dalam penelitian ini adalah analisis deskriptif dengan perlakuan pemberian antimikroba pada taraf kontrol (susu kuda pasteurisasi),
pemberian filtrat koumiss dan pemberian koumiss serta perlakuan penyimpanan koumiss hari ke-0, 2, 4, 6 dan 8 untuk pengujian terhadap S. Typhimurium ATCC 14028. Perlakuan untuk Pengujian M. tuberculosis H37RV yaitu perlakuan penyimpanan koumiss hari ke-0, 2, 4, 6 dan 8. Analisis data untuk M. tuberculosis H37RV menggunakan rancangan non-parametrik uji Cohran. Model statistik yang digunakan sebagai berikut:
M. tuberculosis H37RV Uji Cohran (Daniel, 1990)
1 ∑ – 1
∑
Keterangan:
Q = Statistik Cohran C = Jumlah ulangan N = Jumlah total perlakuan R = Jumlah total ulangan
Jika hasil zona penghambatan bakteri M. tuberculosis H37RV menunjukkan perbedaan diantara taraf perlakuan yang diberikan, maka analisis akan dilanjutkan dengan uji banding nilai tengah Cohran. Pengolahan data dibantu dengan software statistik program MedCalc 11.5.0.0.
Peubah yang Diamati
Peubah yang diamati dalam penelitian ini adalah karakteristik mikrobiologis susu kuda dan koumiss berupa jumlah TPC, koliform, bakteri asam laktat dan khamir serta aktivitas daya hambat antimikroba terhadap S. Typhimurium ATCC 14028 dan pengujian penghambatan koumiss terhadap M. tuberculosis H37RV. Aktivitas daya hambat antimikroba dihitung berdasarkan diameter zona bening di sekeliling sumur (mm), sedangkan pengujian penghambatan terhadap Mycobacterium tuberculosis H37RV dilihat berdasarkan jumlah koloni yang masih tumbuh. Penilaian dengan skor yaitu 0 (tidak tumbuh) dan 1 (tumbuh).