DISUSUN OLEH TUTI SUPRIANTI, S.Si RENCANA PELAKSANAAN PEMBELAJARAN MATAPELAJARAN IKATAN KIMIA KELAS X KIMIA FARMASI KESTABILAN UNSUR DAN IKATAN ION
Bebas
34
0
0
Teks penuh
(2)
(3)
(4)
(5)
(6)
(7)
(8)
(9)
(10)
(11)
(13)
(14)
(15)
(16)
(17)
(18)
(19)
(20)
(23)
(24)
(25)
(26)
(27)
(28)
(29)
(30)
(31)
(32)
(33)
(34)
Gambar

Dokumen terkait
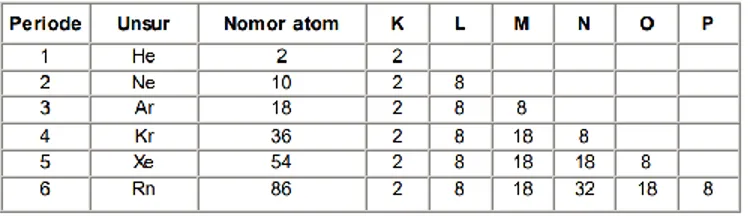
Atom-atom cenderung memiliki konfigurasi elektron pada kulit terluarnya seperti konfigurasi elektron gas mulia terdekat dengan atom-atom tersebut (elektron valensi 8). Unsur
Sifat fisik senyawa kovalen yaitu, senyawa kovalen memiliki titik didih yang rendah dimana senyawa kovalen mampu mendidih di bawah 200° C, mudah menguap
- Mengamati konfigurasi elektron yang telah ditulis, membandingkan elektron valensi gas mulia dan elektron valensi unsur golongan lain, untuk menemukan keistimewaan apa yang
Apakah unsur-unsur dalam satu golongan memiliki jumlah elektron valensi yang sama? Lantas bagaimana kira-kira jarak dari inti atom sampai elektron di kulit