PENENTUAN POTENSI INDUKSI APOPTOSIS TILIROSIDA DARI
EKSTRAK DAUN JATI BELANDA (
Guazuma ulmifolia
Lamk.)
TERHADAP SEL T47D DENGAN METODE
FLOW CYTOMETRY
NASKAH PUBLIKASI
Oleh:
MARHAMAH NUR AZIZAH
K 100110006
FAKULTAS FARMASI
UNIVERSITAS MUHAMMADIYAH SURAKARTA
SURAKARTA
1 PENENTUAN POTENSI INDUKSI APOPTOSIS TILIROSIDA DARI EKSTRAK
DAUN JATI BELANDA (Guazuma ulmifolia Lamk.) TERHADAP SEL T47D DENGAN METODE FLOW CYTOMETRY
DETERMINATION OF POTENCY APOPTOSIS INDUCTION OF TILIROSIDE FROM PIGEON WOOD LEAVES (Guazuma ulmifolia Lamk.)
ON T47D CELL USING FLOW CYTOMETRY METHOD
Muhammad Da’i*, Ika Trisharyanti D.K*, Marhamah Nur Azizah*
Fakultas Farmasi Universitas Muhammadiyah Surakarta Jl. Ahmad Yani Tromol Pos I, Pabelan Kartasura Surakarta 57102
ABSTRAK
Jati belanda (Guazuma ulmifolia Lamk.) mempunyai aktivitas sitotoksik. Penelitian ini bertujuan untuk mengetahui persentase induksi apoptosis tilirosida dari daun jati belanda terhadap sel T47D. Induksi apoptosis dilakukan dengan metode flow cytometry dengan alat FACSCaliburTM menggunakan reagen Annexin V dan zat pewarna PI (Propidium Iodida). Konsentrasi induksi apoptosis yang digunakan berdasarkan pada uji MTT assay (IC50) tilirosida pada sel T47D, yaitu sebesar 60 µg/mL. Konsentrasi yang
dibutuhkan yakni 1 IC50, ½ IC50, dan ¼ IC50. Hasil percobaan menunjukkan bahwa induksi apoptosis awal
tilirosida tertinggi yaitu 11,01 % pada konsentrasi ¼ IC50, dan apoptosis akhir tertinggi yaitu 4,93 % pada
konsentrasi ½ IC50. Jika persentase tersebut dibandingkan dengan kontrol,persentase induksi apoptosis
tilirosida lebih kecil. Jadi tilirosida tidak mampu menginduksi apoptosis sel kanker payudara T47D.
Kata kunci : Tilirosida, Guazuma ulmifolia Lamk., apoptosis, flow cytometry, sel T47D:
ABSTRACT
Pigeon wood (Guazuma ulmifolia Lamk.) has cytotoxic activity. This research was purposed to know persentage of apoptosis induction of tiliroside from pigeon wood on T47D. Apoptosis induction used flow cytometry with instrument FACSCaliburTM use reagent Annexin-V and dye PI (Propidium Iodide). Concentrations of apoptosis induction based on cytotoxic value (IC50) of tiliroside on T47D cells, the value is
60 mg/mL. Concentration required were 1 IC50, ½ IC50, and ¼ IC50. The results indicated that the highest
percentage of early apoptosis was 11.01% at concentration of ¼ IC50 and late apoptosis was 4,93% at
concentration of ½ IC50.The percentage of apoptosis induction by tiliroside was smaller than the percentage
of control. In conclusion, tiliroside did not induce apoptosis on breast cancer cells (T47D).
Key word : Tiliroside,Guazuma ulmifolia Lamk., apoptosis induction, flow cytometry, T47D cell.
PENDAHULUAN
Kanker payudara merupakan penyebab kematian kedua pada wanita akibat dari
kanker setelah kanker serviks (Rasjidi, 2009). Di Indonesia dan negara lain peningkatan
jumlah penderita kanker payudara dari tahun 1980 sampai 2010 mengalami peningkatan
sebesar 3,1% (Forouzanfar, 2011). Menurut American Cancer Society, ada sekitar 465.000
wanita didunia meninggal tiap tahunnya karena kanker payudara (Rasjidi, 2009) dan satu
dari sebelas wanita mengalami kanker payudara (Price & Wilson, 1995).
Faktor risiko penyebab kanker payudara di negara maju seperti Jepang dan
Amerika adalah faktor reproduktif yang dipengaruhi oleh kadar estrogen endogen, hormon
2 antropometri, faktor genetik dan keluarga (Saika & Sobue, 2009). Cara pengobatan kanker
menurut Tagliaferri (2007), yaitu pembedahan, radiasi, kemoterapi, modulasi hormon,
pengobatan alternatif, meningkatkan sistem imun tubuh. Namun, ada efek samping dari
pengobatan modern seperti mual, muntah, rambut rontok, inflamasi, abnormalitas genetik.
Untuk mengurangi efek tersebut perlu adanya kombinasi dengan pengobatan alternatif,
cara yang bisa dilakukan seperti menggunakan akupuntur dan obat herbal. Pengobatan
herbal menjadi pilihan terapeutik karena aman dan banyak instansi fitomedis yang telah
membuktikan keefektifannya secara klinis (Heinrich, 2009).
Untuk menangani penyakit kanker payudara pada wanita harus diketahui sifat dari
sel kanker, karena setiap individu memiliki gen yang berbeda (Soemitro, 2012). Salah satu
karakteristik sel kanker yaitu tidak sensitif terhadap induksi apoptosis, penyebabnya adalah
mutasi p53. Apoptosis berfungsi untuk penghambatan sel kanker sehingga meningkatkan
sensitivitas dari sel kanker untuk memacu induksi apoptosis menjadi target dalam
penemuan antikanker baru (Brown & Attardi, 2005).
Menurut Food and Agriculture Organization of the United Nations (FAO), ada
940 spesies tanaman di Indonesia yang telah digunakan sebagai tanaman obat, salah
satunya adalah tanaman jati belanda (Guazuma ulmifolia Lamk.). Menurut BPOM (2008),
tilirosida adalah isolat atau senyawa murni yang dapat diperoleh dari jati belanda, selain itu
senyawa ini merupakan senyawa identitas jati belanda. Senyawa identitas bermanfaat
untuk pengembangan obat baru, sehingga dapat bermanfaat untuk kehidupan dimasa yang
akan datang. Tilirosida merupakan flavonoid polifenol yang mempunyai aktivitas
antikanker (Tsimplouli et al., 2011) dan antioksidan (Tomczyk et al., 2008). Antioksidan
dari flavonoid dan polifenol berperan dalam melindungi sel dari dampak oksidatif.
Biasanya aktivitas antioksidan berperan pada antikanker termasuk pro-apoptosis,
kerusakan DNA, antiangiogenik dan efek imunostimulator (Leong et al., 2001).
Senyawa ini telah diteliti aktivitas antikankernya terhadap sel CCRF-CEM,
NAMALWA (leukemia) (Dimas et al., 2000), Ehrlich (Esteves-Souza et al., 2002), HepG2
(hepatoma), Colon 205 (kolon), Jurkat (limfositik) (Rao et al., 2007), MCF-7 (Tomczyk et
al., 2008), dan L292 (Matsuda et al., 2002). Nilai IC50 dari beberapa sel menunjukkan
bahwa tilirosida terbukti aktif menghambat sel dibuktikan dengan nilai IC50 < 20 µg/mL
atau < 33,7 µM (Matsuda et al., 2002; Dimas et al.,2000; Tomczyk et al., 2008; Rao et al.,
2007; Saifudin, 2014). Tilirosida mampu menginduksi apoptosis pada sel MCF-7
3 meningkatkan aktivitas sitotoksik dan mampu menginduksi apoptosis pada sel SF268
(Tsimplouli et al., 2012).
Penelitian-penelitian di atas menunjukan bahwa tilirosida mempunyai aktivitas
antikanker pada beberapa sel kanker. Masih sedikitnya pengetahuan aktivitas induksi apoptosis
pada sel kanker payudara T47D menjadi hal yang menarik untuk diteliti. Metode kuantitatif
dengan metode flow cytometry memiliki banyak kelebihan dibandingkan metode yang lain
seperti pengecatan DNA, degradasi PARP dengan western blot, dan assay of cleavage of
caspase. Penelitian ini dilakukan sebagai salah satu upaya untuk meningkatkan
pengetahuan tentang khasiat dan manfaat, dan sebagai dasar utama pembuatan bahan obat
dari senyawa tilirosida yang berguna di masa mendatang.
METODOLOGI PENELITIAN Alat dan Bahan
Alat. Alat yang digunakan yaitu botol duran, tabung eppendorf (Iwaki), TCD (Tissue
Culture Dish) (Iwaki), mikropipet (Nichipet Ex), LAF (Laminar Air Flow) (Labconco),
inkubator (Napco), cyrotube (Falcon), tabung konikel steril (BDsciences), sentrifus
(Centrifuge 5415 D), vorteks (Thermolyne), flowcytometer (FACSCalibur™), counter,
mikroskop cahaya (Olympus), hemositometer, dan kamera digital (Canon).
Bahan. Bahan yang digunakan yaitu tilirosida dari ekstrak daun jati belanda yang
didapatkan dari Universitas Muhammadiyah Surakarta, sel T47D diperoleh dari
Laboratorium Parasitologi FK UGM, media kultur RPMI (Roswell Park Memorial
Institute) 1640, FBS (Fetal Bovine Serum) 10%, antibiotik penisilin-streptomisin 2%,
fungizon 0,5%, aquadest, PBS (Phosphate Buffered Saline), tripsin-EDTA 0,25%, Annexin
V-PI (Propidium Iodida) (BDBiosciences), blue tips (Thermo), yellow tips (Thermo), dan
white tips (Thermo).
Jalannya Penelitian
Penumbuhan sel. Media kultur disiapkan dalam konikel, lalu dimasukkan ke culture dish
dan diberi penanda. Ampul yang berisi sel diambil dari tangki nitrogen cair. Suspensi sel
pada ampul dicairkan pada suhu kamar, lalu suspensi tersebut diambil 1000 µL dan
dipindahkan ke media kultur yang telah disiapkan. Konikel yang telah ditutup, disentrifus 5
menit. Setelah itu konikel dibawa ke LAF dan disemprot alkohol 70%. Tutup dibuka lalu
supernatan pada media tersebut dibuang. Konikel ditambahkan media kultur sebanyak 4
mL. Kemudian konikel diresuspensi hingga homogen dengan mikropipet. Suspensi sel
4 media kultur. Kondisi sel diamati dengan menggunakan mikroskop lalu disimpan dalam
inkubator CO2.
Pemanenan sel. Sel yang telah diinkubasi, diambil dan diamati kondisi sel dengan
mikroskop. Pemanenan sel dikerjakan ketika sel telah mengalami kondisi 80% konfluen.
Pemanenan dilakukan dengan cara membuang media dengan mikropipet. Sel dicuci dua
kali dengan PBS, volume yang dibutuhkan setengah dari volume media awal.
Tripsin-EDTA dimasukkan secara merata dengan tujuan untuk melepaskan sel dari matrik,
kemudian diinkubasi selama 3 menit. Setelah itu dish ditambahkan media kultur 5 mL
untuk menginaktifkan tripsin dan resuspensi sel dengan mikropipet. Keadaan sel diamati
dengan mikroskop untuk melihat sel terlepas satu-satu. Jika masih menggerombol lakukan
resuspensi kembali. Sel yang telah terlepas satu-satu dipindahkan ke dalam konikel steril
baru.
Perhitungan sel. Hasil panen sel diresuspensi dan diambil 10 µL lalu diletakkan diatas
hemositometer. Perhitungan sel dilihat dengan mikroskop cahaya dan dihitung dengan
counter.
Perlakuan Sel. Sel T47D yang telah dihitung jumlah selnya, dibuat pengenceran dengan
media kultur sesuai kebutuhan (jumlah sel yang diperlukan untuk 6 well plate sebanyak
5x105 sel/1000 µL). Sel dipindahkan sebanyak 2000 µL ke dalam masing-masing sumuran.
Distribusi sel diamati dengan mikroskop serta didokumentasi dengan kamera. Sumuran
yang berisi sel diinkubasi pada suhu 370C selama 24 jam. Sampel dibuat seri konsentrasi
untuk perlakuan ketika sel normal. Jika sel belum normal maka media diganti dan sel
diinkubasi kembali. Seri konsentrasi sampel terdiri dari 3 konsentrasi yaitu 1 IC50, ½ IC50
dan ¼ IC50. Kontrol diperlukan untuk membandingkan percobaan dengan tilirosida dengan
kontrol negatif yang berisi sel dan media dan kontrol positif yang berisi sel dan
doksorubisin.
Setelah 24 jam plate yang berisi sel diambil dari inkubator. Media sel dibuang dengan
mikropipet perlahan-lahan. Sel yang ada di sumuran dicuci dengan 1000 µL PBS lalu
dibuang dan dimasukkan 2000 µL dari seri konsentrasi sampel, media RPMI untuk kontrol
negatif dan doksorubisin untuk kontrol positif ke masing-masing sumuran dan dilakukan
inkubasi pada 370C selama ±24 jam.
Pembuatan reagen flow cytometry. Reagen flow cytometry untuk analisis apoptosis yang
digunakan 1 sampel dilakukan dengan mengambil buffer sebanyak 100 µL, propidium
iodida (PI) sebanyak 2 μL dan Annexin-V sebanyak 2 µL lalu dicampur. Satu well plate (6
5 dibungkus dengan aluminium foil, karena reagen tidak tahan terhadap cahaya. Pembuatan
reagen ini dilakukan dengan sarung tangan karena senyawa karsinogen.
Persiapan sampel. Satu konikel disiapkan untuk satu jenis perlakuan serta diberi penanda
pada masing-masing konikel. Media diambil dari sumuran dengan mikropipet 1 mL dan
dipindahkan ke konikel. Masing-masing sumuran dimasukkan 1000 µL PBS untuk
mencuci sel dan membersihkan serum yang berasal dari media, karena serum tersebut
dapat menghambat kerja tripsin. Kemudian PBS diambil dengan mikropipet lalu
dipindahkan kedalam konikel. Pada masing-masing sumuran ditambahkan 200 µL
tripsin-EDTA 0,25% agar sel terlepas satu per satu lalu diinkubasi pada 37ºC selama 5 menit.
Masing-masing sumuran dimasukkan 1000 µL media kultur (RPMI) dengan mikropipet
lalu diresuspensi. Sel diamati dengan mikroskop hingga terlihat sel terlepas satu per satu.
Media kultur yang berada disumuran dipindahkan kedalam konikel lalu konikel disentrifus
pada 600 rpm selama 5 menit. Media dibuang dengan cara dituang lalu dicuci
masing-masing pellet dengan 500 µL PBS dingin dengan cara diresuspensi agar pellet yang
mengendap dibawah menjadi larut dalam PBS. Pellet tersebut dipindahkan ke dalam
eppendorf dan disentrifus pada 2000 rpm selama 3 menit dan sel siap untuk diuji dengan
flow cytometer.
Media pada tabung eppendorf dibuang, lalu dimasukkan 100 µL reagen Annexin V-PI ke
dalam tabung eppendorf dan buffer sebanyak 350 µL. Agar bercampur maka divorteks,
kemudian diinkubasi pada suhu ruang dan tempat gelap selama 10 menit. Suspensi sel
tersebut dipindahkan ke flowcyto-tube. Suspensi sel siap untuk diinjek pada alat flow
cytometry.
Analisis data. Analisis data dilakukan dengan program cell quest untuk melihat persentase
sel hidup, apoptosis awal, apoptosis akhir dan nekrosis. Dari hasil percobaan dibandingkan
antara sel T47D yang diinduksi dengan tilirosida dengan kontrol positif (doksorubisin) dan
kontrol negatif (sel). Hasil persentase induksi apoptosis dilanjutkan dengan menghitung
rata-rata .
HASIL DAN PEMBAHASAN
MTT assay dilakukan untuk mengetahui kemampuan tilirosida dalam
menghambat pertumbuhan sel T47D. Tilirosida memiliki kemampuan sitotoksik terhadap
6 bahwa tilirosida mampu menghambat pertumbuhan sel sebanyak 50% pada konsentrasi 60
µg/mL. Pengamatan induksi apoptosis dilakukan untuk mengetahui penyebab kematian sel
baik apoptosis maupun nekrosis. Metode flow cytometry mampu membedakan sel hidup,
apoptosis awal, apoptosis akhir dan nekrosis, karena reagen Annexin V dan PI bekerja
secara selektif mengikat sel yang utuh maupun tidak utuh (fragmentasi). Hasil uji induksi
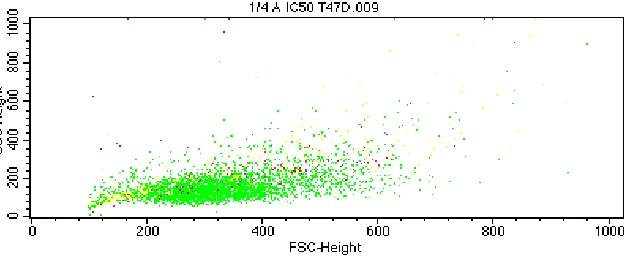
apoptosis dengan flow cytometry diperoleh hasil pada Gambar 1 dan Gambar 2. Percobaan
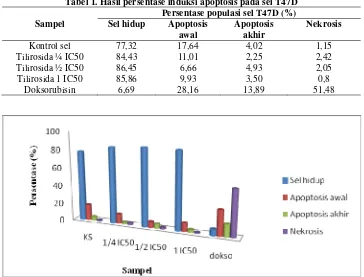
dilakukan duplo ditunjukkan pada Tabel 1, Gambar 3.
Gambar 1. Hasil persebaran sel setelah induksi dengan tilirosida ¼ IC50.
R2 R3
R4
R1
Gambar 2. Hasil analisis dengan cell quest pada konsentrasi ¼ IC50
Keterangan: (R1) sel hidup, (R2) apoptosis awal, (R3) apoptosis akhir, dan (R4) nekrosis.
Data persebaran sel (Gambar 1) menghubungkan diameter sel pada sumbu X atau
bagian FSC (forward-angle light scatter) dan konformasi struktur sel pada sumbu Y atau
bagan SSC (side-single light scatter). Persebaran sel apoptosis pada FSC akan menurun
dan pada SSC akan menaik, sedangkan persebaran sel nekrosis pada FSC akan menaik dan
SSC akan menurun.
Dari data persebaran sel tersebut agar memudahkan analisis, maka warna-warna
yang terbentuk dipisahkan dengan metode cell quest (Gambar 2). Data diperoleh 4 macam
warna, yakni hijau menunjukkan sel hidup, kuning menunjukkan apoptosis awal, merah
muda menunjukkan apoptosis akhir, dan merah menunjukkan nekrosis. Warna tersebut
1,50% 2,38%
7 bisa terbentuk disebabkan oleh sel yang memancarkan epi-fluoresensi oleh ikatan Annexin
V atau PI lalu ditangkap oleh sinar UV. Panjang gelombang warna hijau pada 488 nm –
525 nm, absorbansi maksimal berada pada 490 nm. Pada apoptosis awal akan
berfluoresensi kuning dengan intensitas yang lemah pada panjang gelombang 536 nm –
617 nm. Sel yang mengalami nekrosis atau apoptosis akhir akan berfluoresensi merah pada
panjang gelombang 650 nm – 700 nm (Rahman, 2014).
Tabel 1. Hasil persentase induksi apoptosis pada sel T47D
Sampel
Persentase populasi sel T47D (%) Sel hidup Apoptosis
awal
Apoptosis akhir
Nekrosis
Kontrol sel 77,32 17,64 4,02 1,15 Tilirosida ¼ IC50 84,43 11,01 2,25 2,42 Tilirosida ½ IC50 86,45 6,66 4,93 2,05 Tilirosida 1 IC50 85,86 9,93 3,50 0,8
Doksorubisin 6,69 28,16 13,89 51,48
Gambar 3. Grafik apoptosis awal, apoptosis akhir dan nekrosis pada perlakuan tilirosida.
Pada apoptosis awal, sel T47D mengalami ekspresi fosfatidilserin dalam membran
sel yang menyebabkan fosfatidilserin keluar dari membran sel sehingga menyebabkan
reagen Annexin V mampu mengidentifikasi adanya peristiwa tersebut. Apoptosis akhir
ditandai dengan fragmentasi DNA yang menyebabkan Annexin V dan PI mampu
mengidentifikasi peristiwa tersebut.
Persentase sel hidup (Gambar 1) pada perlakuan tilirosida lebih besar
dibandingkan dengan dibandingkan kontrol sel dan kontrol doksorubisin. Hal tersebut
disebabkan oleh sedikitnya sel yang mengalami kematian akibat apoptosis dan nekrosis.
Sel hidup seharusnya dipertahankan pada 90%, namun persentase sel hidup kontrol pada
8 sel banyak yang mengalami kematian akibat apoptosis dan nekrosis. Apoptosis dan
nekrosis akan meningkat seiring menurunnya persentase sel hidup.
Persentase apoptosis awal (Gambar 1) pada kontrol sel T47D lebih besar
dibandingkan dengan perlakuan tilirosida. Hal tersebut terjadi disebabkan karena sel T47D
mengalami silencing p53 mutan melalui nuclear blebbing dan pembelahan PARP-1.
PARP-1 terlibat dalam proses transformasi tumor dan pemulihan DNA yang rusak pada sel
normal maupun abnormal (Lim et al., 2009). Silencing p53 akan menyebabkan sel mampu
melakukan apoptosis yang besar serta menunjukkan bahwa sel T47D telah metastasis.
Persentase apoptosis akhir (Gambar 1) perlakuan tilirosida tertinggi sebesar 4,93 % pada
konsentrasi ½ IC50. Apoptosis akhir menandakan bahwa sel telah mengalami fragmentasi
DNA dan mengalami proses fagositosis, sel yang terfragmentasi akan dihilangkan oleh sel
darah putih sehingga tidak menimbulkan inflamasi. Namun hasil tersebut tidak selaras
dengan persentase apoptosis awal yang rendah. Persentase induksi apoptosis yang baik
adalah persentase apoptosis awal dan apoptosis lebih besar dibandingkan dengan kontrol
sel serta persentase nekrosisnya lebih rendah.
Persentase sel nekrosis (Gambar 1) perlakuan tilirosida mengalami penurunan
dengan semakin menurunnya konsentrasi tilirosida yang diberikan. Penurunan sel nekrosis
menunjukkan bahwa tilirosida tidak mempunyai kemampuan sitotoksik. Persentase
perlakuan tilirosida dibandingkan dengan kontrol doksorubisin (Gambar 1) menunjukkan
bahwa tilirosida tidak mampu menyamai persentase kematian sel akibat apoptosis, karena
sel T47D sensitif terhadap doksorubisin.
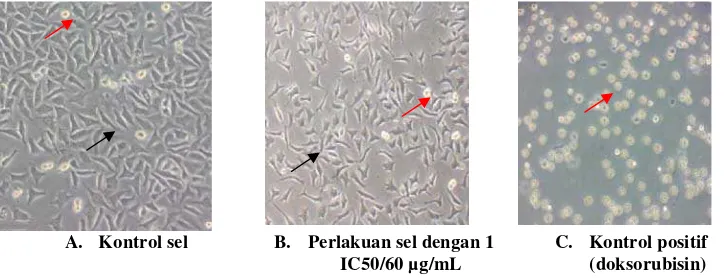
Pengamatan morfologi pada sel T47D yang hidup dan mati ditemukan adanya
perbedaan (Gambar 2). Sel hidup memiliki bentuk sel yang tidak beraturan sedangkan sel
yang mati ditandai dengan bulatan yang berwarna kuning menyala. Sel mati tersebut
berwarna kuning menyala dan berbentuk bulat karena membran sel sudah rusak sehingga
cairan sitoplasma menghilang sehingga tidak mampu meneruskan cahaya dari mikroskop.
Pada sel hidup, membran sel masih utuh dan mengandung sitoplasma sehingga cahaya dari
mikroskop mampu diteruskan ke sel. Perbedaan mencolok terlihat pada hasil uji perlakuan
dengan tilirosida dan doksorubisin. Pada kontrol positif, sel menunjukkan sensitivitas yang
tinggi terhadap doksorubisin dibuktikan banyaknya sel yang mati, sedangkan pada
9
A. Kontrol sel B. Perlakuan sel dengan 1 IC50/60 µg/mL
C. Kontrol positif (doksorubisin) Gambar 2. Hasil percobaan kontrol sel, perlakuan dengan tilirosida dan doksorubisin.
Keterangan : Panah hitam ( ) sel hidup dan panah merah ( ) sel mati
Aktivitas biologi molekuler sel T47D menunjukkan bahwa tilirosida tidak mampu
menginduksi apoptosis. Persentase apoptosis dari kontrol sel lebih tinggi dibandingkan
dengan perlakuan tilirosida belum mampu menyamai induksi apoptosis dari doksorubisin.
Kemungkinan hal tersebut terjadi karena karakteristik sel T47D yaitu mutasi p53 yang
stabil sehingga fungsi normal p53 untuk menginduksi apoptosis tidak bisa terjadi (Lim et
al., 2009).
Jika dilihat dari struktur tilirosida, grup coumaryl yang berada didekat glikosida
mempengaruhi kemampuan sitotoksik, yakni akan menurunkan kemampuan penghambatan
sel dan induksi apoptosis. Kaempferol glycosides yang aktif yaitu platanosida yang
memiliki 2 gugus coumaryl yang berikatan dengan gugus glikosida (Dimas et al., 2000)
dan trans-asetilasi tilirosida (Tsimplouli et al., 2012). Hal tersebut berkaitan dengan
kepolaran senyawa tersebut, tilirosida menjadi lebih polar daripada platanosida. Semakin
polar suatu senyawa maka kemampuan sitotoksik semakin rendah (Setyowati et al., 2007).
KESIMPULAN
Berdasarkan uraian pembahasan, peneliti menyimpulkan bahwa tilirosida dari
daun jati belanda tidak mampu menginduksi apoptosis pada sel T47D.
SARAN
Berdasarkan kesimpulan, peneliti menyarankan adanya modifikasi struktur
tilirosida pada gugus coumaryl dan dilakukan uji aktivitas antikanker, induksi apoptosis
10 UCAPAN TERIMA KASIH
Bapak Muhammad Da’i, M.Si., Apt. selaku dosen pembimbing utama dan Bu Ika
Trisharyanti D. K., M.Farm., Apt selaku pembimbing pendamping, yang telah memberikan
pengarahan, bimbingan, nasihat, masukan, dan ilmu yang bermanfaat selama penelitian
dan penyusunan skripsi.
DAFTAR ACUAN
Brown, J.M., & Attardi, L.D., 2005, The Role of Apoptosis in Cancer Development and Treatment Response, Nat Rev Cancer, 5, 231-237.
Badan POM RI, 2008, Farmakope Herbal, 36-39, Jakarta, Badan POM Republik Indonesia.
Dimas, K., Demetzoz, C., Mitaku, S., Marselos, T. T., & Kokkinopoulos, D., 2000, Cytotoxic Activity of Kaempferol Glycosides Against Human Leukemic Cell Line In Vitro, Pharmacological Research, 41 (1), 85-88.
Esteves-Souza, A., Sarmento da Silva, T.M., Alves, F.C.C, De Carvalho, M.G., Braz-Filho, R., Echevarria, A., 2002 Cytotoxic activities against Ehrlich carcinoma and human K562 leukaemia of alkaloids and flavonoid from two Solanum species, J Braz Chem Soc, 13, 838–842.
Dhewanti, F.C., 2015, Aktivitas Sitotoksik Isolat Ekstrak Metanol Daun Jati Belanda (Guazuma ulmifolia Lamk.) Terhadap Sel MCF-7 dan Sel T47D, Skripsi, Surakarta, UMS.
FAO (Food and Agriculture Organization of The United Nations), (tanpa tahun), Country Report on The State of Plant Genetic Resources For Food and Agriculture: Indonesia, Report, The State of World’s Plant Genetic Resources for Food and Agriculture, 1-39.
Forouzanfar, M.H., Foreman, K.J., Delossantos, A.M., Lozano, R., Lopez, A.D., Murray, C.J., et al., 2011, Breast and Cervical Cancer in 187 Countries Between 1980 and 2000: A Systematic Analysis, Lancet, 378, 1461-1465.
Heinrich, M., Syarief, W.R., & Hadinata, A. H., 2009, Farmakognosi dan Fitoterapi, Jakarta, EGC.
Leong, A.C.N., Kinjo, Y., Tako, M., Iwasaki, H., Oku, H., & Tamaki, H., 2001, Flavonoid Glycosides in the Shoot System of Okinawa Taumu (Colocasia esculenta S.), Food Chemistry, 119 (2), 630-635.
11 Matsuda, H., 2002, Hepatoprotective Principles from The Flowers of Tilia argentea
(Linden): Structure Requirements of Tiliroside and Mechanisms of Action.
Bioorganic & Medicinal Chemistry, 10 (3), 707-712.
Price, S.A. & Wilson, L.M.,1995, Patofisiologi: Konsep Klinis Proses–Proses Penyakit, Edisi 4, 1142, Jakarta, EGC.
Rao, Y.K., Geethangili, Fang, S.H, Tzeng, Y.M., 2007, Antioxidant and cytotoxic activities of naturally occurring phenolic and related compounds: A comparative study, Food Chem Toxicol, 45, 1770–1776.
Rasjidi, I., 2009, Deteksi Dini dan Pencegahan Kanker pada Wanita, Jakarta, CV Sagung Seto.
Saifudin, A., 2014, Senyawa Alam Metabolit Sekunder: Teori, Konsep, dan teknik Pemurnian, 71-72, Yogyakarta, Deepublish.
Saika, K. & Sobue, T., 2009, Epidemiology of Breast Cancer in Japan and The US,
Journal of the Japan Medical Association, 52 (1), 39-44.
Setyowati, E.P., Jenie, U.A., Sudarsono, Kardono, B., Rahmat, R., & Meiyanto, E., 2007, Isolasi senyawa sitotoksik spons Kaliapsis, Majalah Farmasi Indonesia, 18 (4), 183-189.
Soemitro, M.P., 2012, Blak-blakan Kanker Payudara (Informasi Lengkap dan Akurat), Jakarta, Qanita.
Tagliaferri, M., Tripathy, D., & Cohen, I., 2007, Kanker Payudara: Cara Penyembuhan Alternatif, Jakarta, PT Indeks.
Tomczyk, M., Drozdowska, D., Bielawska, A., Bielawska, K., & Gudej, J., 2008, Human DNA topoisomerase inhibitors from Potentilla argentea and their cytotoxic effect against MCF-7, Pharmazie, 63, 389-393.